Efecto del tamaño corporal y distancia evolutiva en las interacciones agonísticas de colibríes (Trochilidae)
Ubaldo Márquez-Luna a, *, Carlos Lara b, Pablo Corcuera c y Pedro Luis Valverde c
a Doctorado en Ciencias Biológicas y de la Salud, Universidad Autónoma Metropolitana-Iztapalapa, Av. San Rafael Atlixco Núm. 186, Col. Vicentina, Delegación Iztapalapa, 09340 Ciudad de México, México
b Centro de Investigación en Ciencia Biológicas, Universidad Autónoma de Tlaxcala, Km 10.5 Autopista Tlaxcala-San Martín Texmelucan, 90120 San Felipe Ixtacuixtla, Tlaxcala, México
c Departamento de Biología, Universidad Autónoma Metropolitana, Av. San Rafael Atlixco Núm. 186, Col. Vicentina, Delegación Iztapalapa, 09340 Ciudad de México, México
*Autor para correspondencia: marquezubaldo@gmail.com (U. Márquez-Luna)
Resumen
Es frecuente que los colibríes de mayor tamaño dominen a especies más pequeñas en contiendas por recursos. Recientemente se ha postulado que en las aves, esta ventaja declina conforme aumenta la distancia evolutiva entre 2 especies interactuantes. En el presente estudio usamos a los colibríes como modelo para evaluar: 1) la frecuencia de encuentros agonísticos ganados por especies de mayor y menor tamaño corporal, 2) si el tamaño corporal respecto al del competidor y el clado de pertenencia de los colibríes tienen un efecto sobre la frecuencia de encuentros ganados, y 3) si existen diferencias entre la distancia genética de los colibríes que ganaron enfrentamientos contra contendientes más pequeños. Nuestro estudio incluyó interacciones de 74 especies de colibríes distribuidas en 7 países de América. Encontramos que las especies de mayor tamaño dominaron el 74% de los encuentros. Los colibríes del clado Esmeralda dominaron el 45% de las contiendas analizadas y todos los clados de colibríes ganaron más contiendas cuando enfrentaron a un contendiente más pequeño. Finalmente, no se encontraron diferencias significativas entre la distancia genética de los colibríes que ganaron contiendas contra competidores más pequeños. Los resultados resaltan la importancia de incorporar perspectivas evolutivas en el estudio de comunidades.
Palabras clave:
Dominancia; Jerarquía; Competencia; Clados de colibríes; América
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Effect of body size and evolutionary distance in the agonistic interactions of hummingbirds (Trochilidae)
Abstract
Larger hummingbirds often dominate smaller species in contest for resources. It has recently been postulated that in birds, this advantage declines as the evolutionary distance between two interacting species increases. In the present study we used hummingbirds as a model to evaluate: 1) the frequency of agonistic interactions won by larger and smaller hummingbirds, 2) if the body size relative to the competitor and the clade belonging to the hummingbirds have an effect on the frequency of won encounters, and 3) if there are differences between the genetic distance of hummingbirds that won encounters against smaller contenders. Our study included interactions of 74 species of hummingbirds distributed in seven countries of America. We found that the largest species dominated 74% of the encounters. Hummingbirds of the Emerald clade dominated 45% of the total contests analyzed, and all clades of hummingbirds won more encounters when they faced a smaller contender. Finally, no significant differences were found between the genetic distances of the hummingbirds that won contests against smaller competitors. The results highlight the importance of incorporating evolutionary perspectives in the study of communities.
Keywords:
Dominance; Hierarchy; Competition; Clades of hummingbirds; America
El desarrollo y mejoramiento de hipótesis filogenéticas robustas ha permitido que las relaciones evolutivas se incorporen al estudio de la ecología de comunidades (Johnson y Stinchcombe, 2007; Webb et al., 2002). En este sentido, McGuire et al. (2014) desarrollaron una hipótesis filogenética basada en datos de 284 de las 338 especies de colibríes. Dicha hipótesis ubica el origen de los colibríes en Eurasia (≈ 40 millones de años) y que su llegada al continente americano ocurrió a través de Norteamérica, región de la cual se dispersaron hacía el sur. Posteriormente, en Sudamérica el grupo se diversificó tras los cambios geográficos que ocurrieron en la región (e.g., el surgimiento de la Cordillera de los Andes). Siete de los nueve clados de colibríes se diversificaron en Sudamérica (i.e., Ermitaños, Topacios, Mangos, Brillantes, Coquetas, Patagona y Esmeraldas), mientras que el ancestro común de las Abejas y las Gemas de Montaña recolonizó Norteamérica (≈ 12 millones de años) donde posteriormente ambos clados se diversificarían. Esta hipótesis sugiere que los 9 clados aparecieron diferencialmente en el tiempo (i.e., Ermitaños y Topacios ≈ 22 millones de años, Mangos ≈ 18 millones de años, Brillantes y Coquetas ≈ 15 millones de años, Patagona gigas ≈ 14 millones de años, Esmeraldas ≈ 12 millones de años, Gemas de montaña ≈ 10 millones de años y Abejas ≈ 5 millones de años) (McGuire et al., 2014). Pese a estas diferencias, las comunidades de colibríes usualmente están integradas por especies que tienen cierto grado de parentesco o incluso pertenecen al mismo clado. Este patrón da como resultado que las especies que integran a cada comunidad tiendan a ser ecológicamente parecidas y que compartan características morfológicas tales como, tamaño corporal o el largo del pico. Esta similitud intensifica la competencia inter e intraespecífica por el acceso a los recursos florales (Freshwater et al., 2014).
Se ha encontrado que las especies de colibríes de mayor tamaño corporal tienden a dominar a las especies más pequeñas, limitándoles el acceso a los mejores recursos (Dearborn, 1998). Dicho patrón también ocurre a nivel intraespecífico (Carpenter et al., 1993). Sin embargo, existen reportes en donde las especies pequeñas de colibríes pueden ganar contiendas agresivas contra especies más grandes (Justino et al., 2012). En este sentido, Martin y Ghalambor (2014) postulan que una especie de ave de menor talla tiene más probabilidades de ganar un encuentro agresivo contra otra especie de mayor tamaño cuando la distancia evolutiva aumenta entre ellas. Esta hipótesis fue puesta a prueba utilizando como modelo las interacciones agonísticas originadas por el acceso a recursos en 3 grupos de aves: buitres, colibríes y pájaros hormigueros. Los autores sugieren que a lo largo del tiempo evolutivo, las especies pequeñas pueden acumular características que les permitan superar las desventajas competitivas asociadas a un menor tamaño corporal, por ejemplo, un incremento en la aceleración y maniobrabilidad que les permite ser más eficientes energéticamente al defender sus territorios de forrajeo en comparación a especies más grandes, mientras que las especies de mayor tamaño pudieron desarrollar otras características que comprometen su habilidad de competir agresivamente, por ejemplo la especialización hacía recursos particulares (e.g., los colibríes ermitaños del género Phaethornis y las plantas que visitan del género Heliconia). Es decir, las ventajas de un mayor tamaño corporal declinan conforme aumenta la distancia evolutiva entre las 2 especies participantes en un encuentro agonístico. Sin embargo, en el caso de los colibríes la diferencia entre el peso corporal del colibrí ganador y perdedor puede ser muy pequeña para determinar claramente a la especie con mayor o menor masa corporal de la interacción. Esto es particularmente importante en aquellas especies que realizan movimientos migratorios latitudinales, ya que su masa corporal puede cambiar significativamente en un solo día (Carpenter et al., 1983). Lo anterior sugiere que otros factores como la historia filogenética y de diversificación del grupo, o las características conductuales asociadas a la forma de explotar los recursos de las especies contendientes, pueden estar involucrados en determinar el resultado final de una interacción agonística.
El presente estudio fue diseñado para evaluar el efecto del tamaño corporal y la distancia genética entre colibríes en el resultado de las contiendas agonísticas generadas por el acceso a los recursos. Para lograr esto evaluamos: 1) la frecuencia con la que especies de colibríes de menor tamaño ganan encuentros agonísticos contra especies más grandes, 2) si la frecuencia de encuentros ganados y perdidos es influenciada por el tamaño corporal y el clado de pertenencia de los colibríes contendientes y 3) si la distancia genética entre contendientes es significativamente diferente entre las contiendas ganadas por colibríes más grandes y pequeños que su competidor y si debido a la historia de diversificación de los clados de colibríes en América, este patrón cambia en Norte, Centro y Sudamérica. Para explorar esta hipótesis, se generó una base de datos derivada de una compilación bibliográfica exhaustiva.
Materiales y métodos
En cada caso de estudio, se determinó si la especie ganadora de cada interacción agonística fue de mayor o menor masa corporal (g) que su competidor. Para lo anterior, se consideró que el peso corporal promedio y los errores estándar que reportaron los autores de cada artículo no se empalmaran. Esto permitió asegurar que la asimetría entre ambas especies fuera la suficiente para poder considerar a una especie más grande que otra (tabla 1). En caso de que el artículo no mencionara la masa corporal de las especies interactuantes, se utilizaron los rangos de peso propuestos por Schuchmann (1999). En estos casos se consideró una diferencia de al menos un gramo entre el peso máximo registrado para ambas especies como diferencia suficiente.
Para los análisis, a cada especie se le asignó el clado de pertenencia de acuerdo a McGuire et al. (2014). En la búsqueda se encontraron interacciones que involucraron a especies pertenecientes a los 9 clados de colibríes: Ermitaños, Topacios, Mangos, Brillantes, Coquetas, Esmeraldas, Gemas de Montaña, Abejas y al compuesto por Patagona gigas; este último conformado únicamente por la especie de colibrí de mayor tamaño corporal (i.e., colibrí gigante; 20-22 cm y 18.5-20.2 g; Schuchmann, 1999). La distancia genética entre cada par de colibríes contendientes se calculó utilizando secuencias genéticas mitocondriales del gen NADH deshidrogenasa subunidad 2, (sensu Martin y Ghalambor, 2014) disponibles en Genbank (tabla 1). Las secuencias fueron alineadas mediante el algoritmo de alineamiento ClustalW (Thompson et al., 1994) y posteriormente se calculó la distancia genética entre cada par de especies mediante el modelo de Tamura-Nei (Tamura y Nei, 1993), el cual corrige las sustituciones múltiples en un sitio considerando las diferencias en la tasa de sustitución nucleotídica entre secuencias de DNA. Estas fueron obtenidas en MEGA versión 7.0 (Kumar et al., 2016).
Evaluamos las diferencias entre la frecuencia de encuentros agonísticos ganados y perdidos por colibríes a través de 2 modelos lineales generalizados (GLM) con distribución Poisson y función de enlace log (Nelder y Wedderburn, 1972). Para el primer modelo utilizamos como variable de respuesta la frecuencia de encuentros ganados por los colibríes y como variables predictoras se incluyeron la identidad del clado del colibrí ganador con
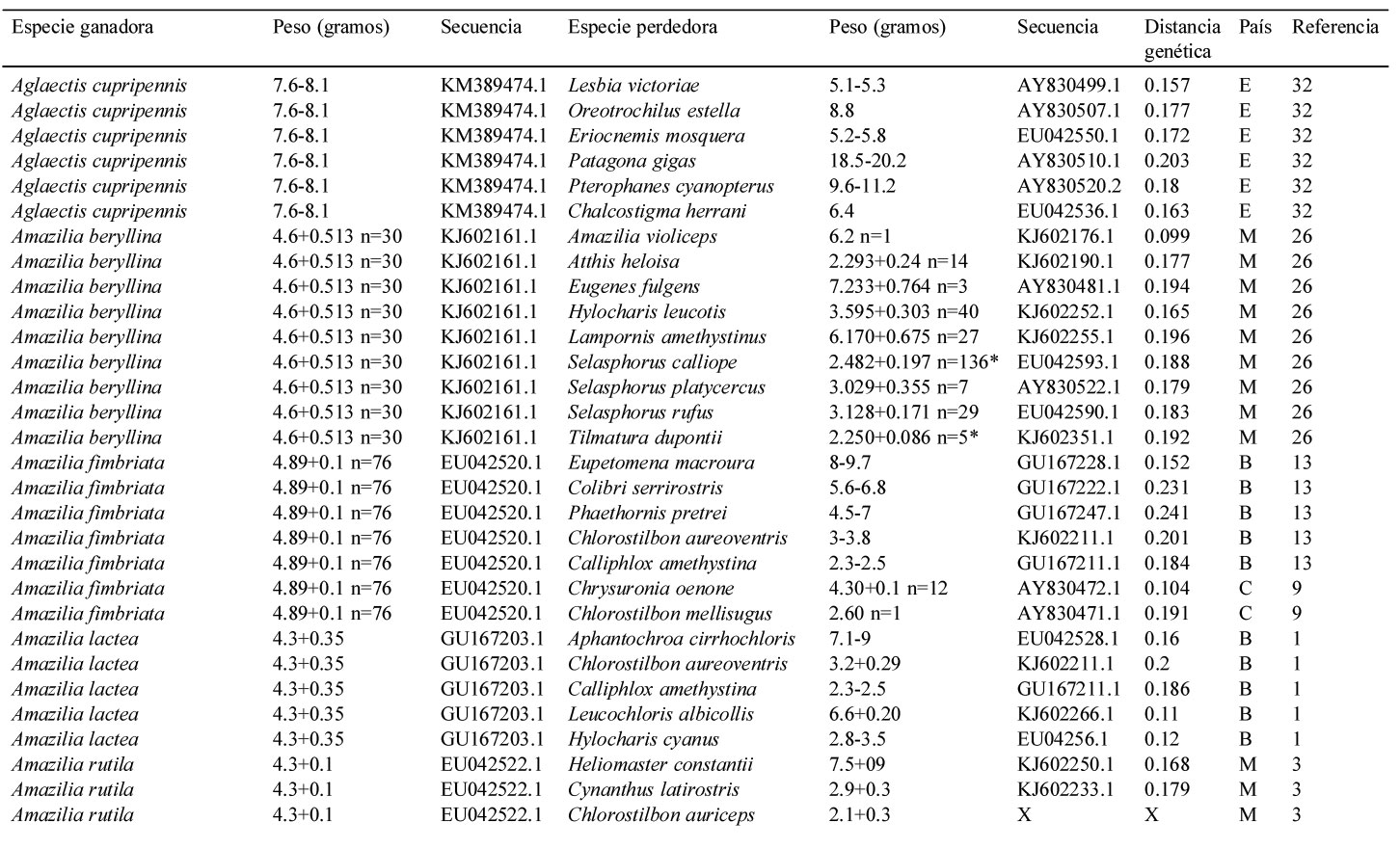
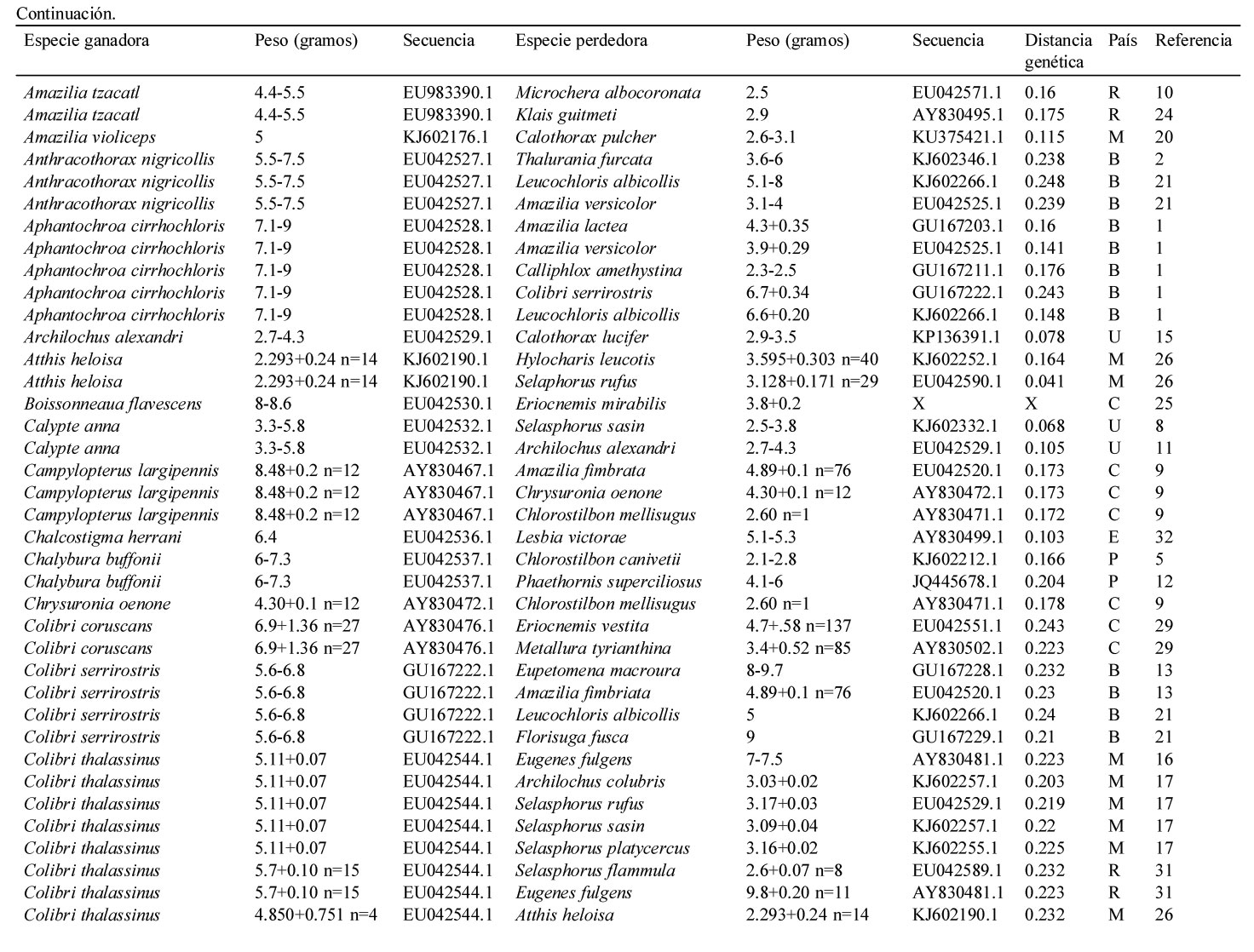
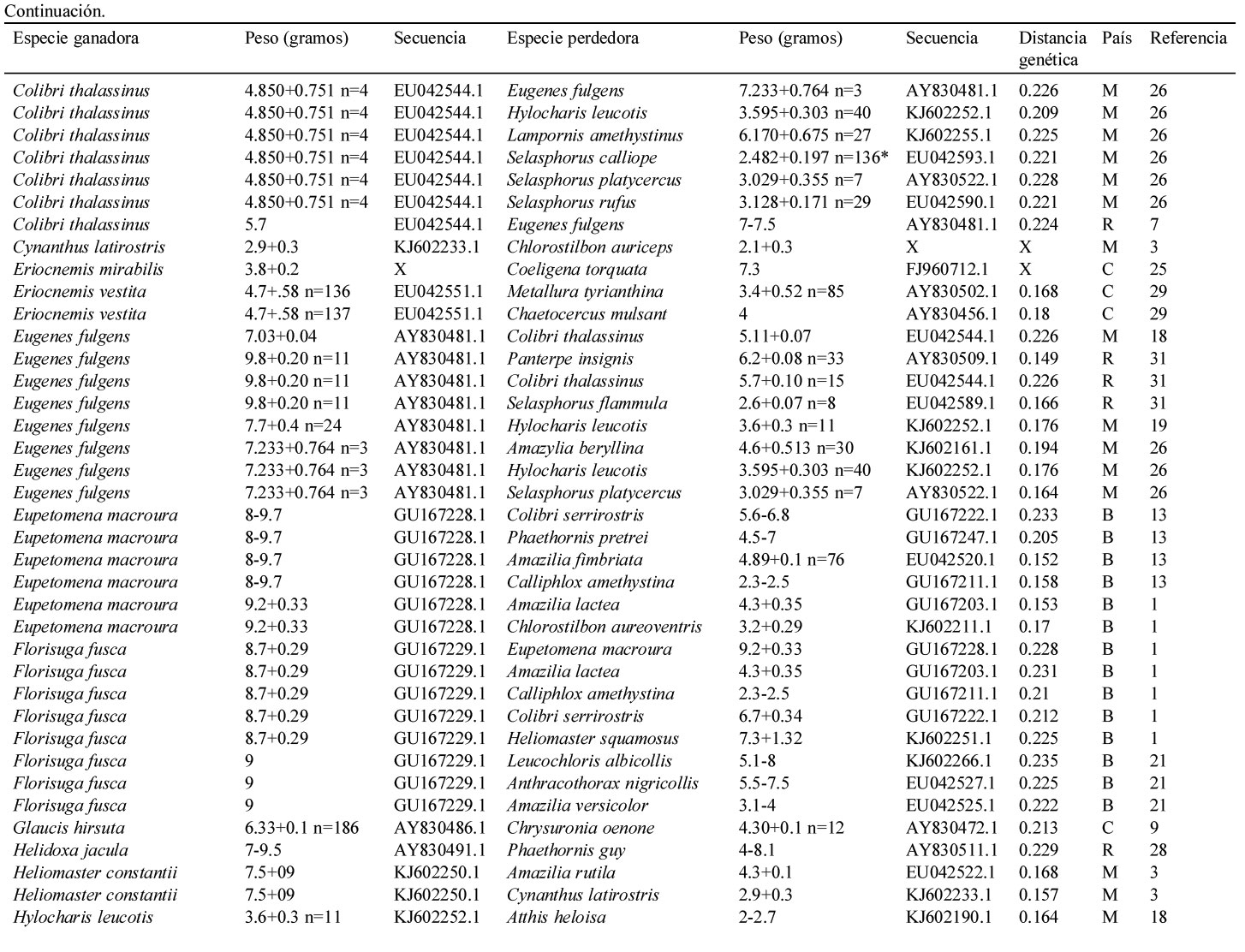
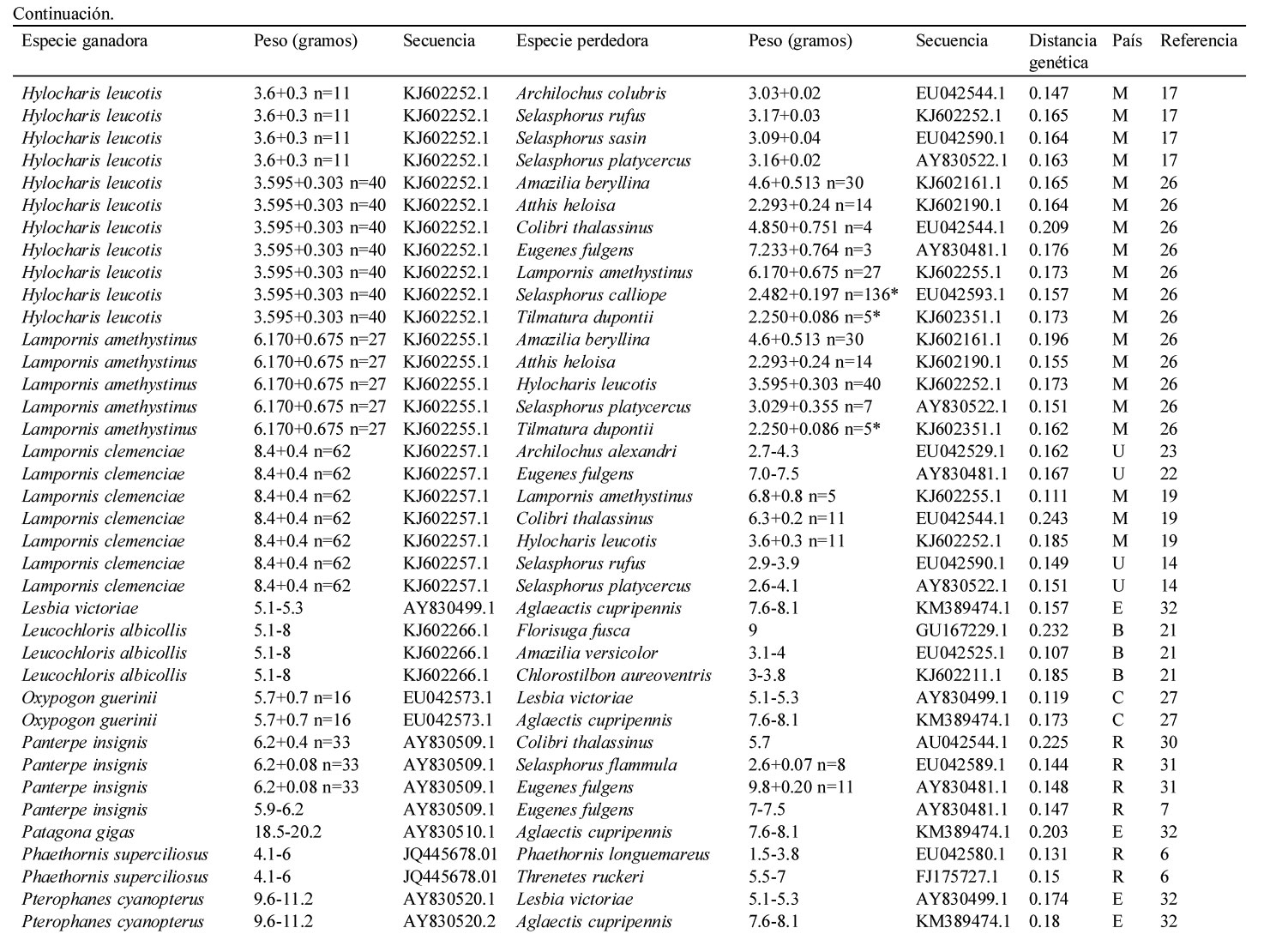
Resumen de la información contenida en este estudio. Se indica el país (i.e., Estados Unidos = U, México = M, Panamá = P, Costa Rica = R, Colombia = C, Ecuador = E y Brasil = B), la especie del colibrí ganador y perdedor de cada contienda, la distancia genética entre contendientes, la secuencia del gen mitocondrial NADH deshidrogenasa subunidad 2 de Genbank y el peso promedio en caso de haberlo indicado el autor, el rango de peso de acuerdo a Schuchmann (1999) o Contreras-Martínez (2014) para aquellos pesos marcados con *. El número está asociado a las siguientes referencias: 1) Antunes, 2003; 2) Araujo-Silva y Bessa, 2010; 3) Arizmendi y Ornelas, 1990; 4) Ayala, 1986; 5) Boyden, 1978; 6) Chaves, 1997; 7) Colwell, 1973; 8) Copenhaver y Ewald, 1980; 9) Cotton, 1998; 10) Dearbon, 1998; 11) Ewald y Bransfield, 1987; 12) Fraga, 1989; 13) Justino et al., 2012; 14) Kuban et al., 1983; 15) Kuban y Neill, 1980; 16) Lara, 2006; 17) Lara et al., 2009; 18) Lara et al., 2011; 19) Lyon, 1976; 20) Ornelas et al., 2002; 21) Persegona et al., 2009; 22) Pimm et al., 1985; 23) Powers y Mckee, 1994; 24) Primack y Howe, 1975; 25) Ramírez-Burbano et al., 2007; 26) Rodríguez-Flores y Arizmendi, 2016; 27) Salamanca-Reyes, 2011; 28) Taylor, 2005; 29) Toloza-Moreno et al., 2014; 30) Wolf, 1969; 31) Wolf et al., 1976; 32) Woods y Ramsay, 2001.
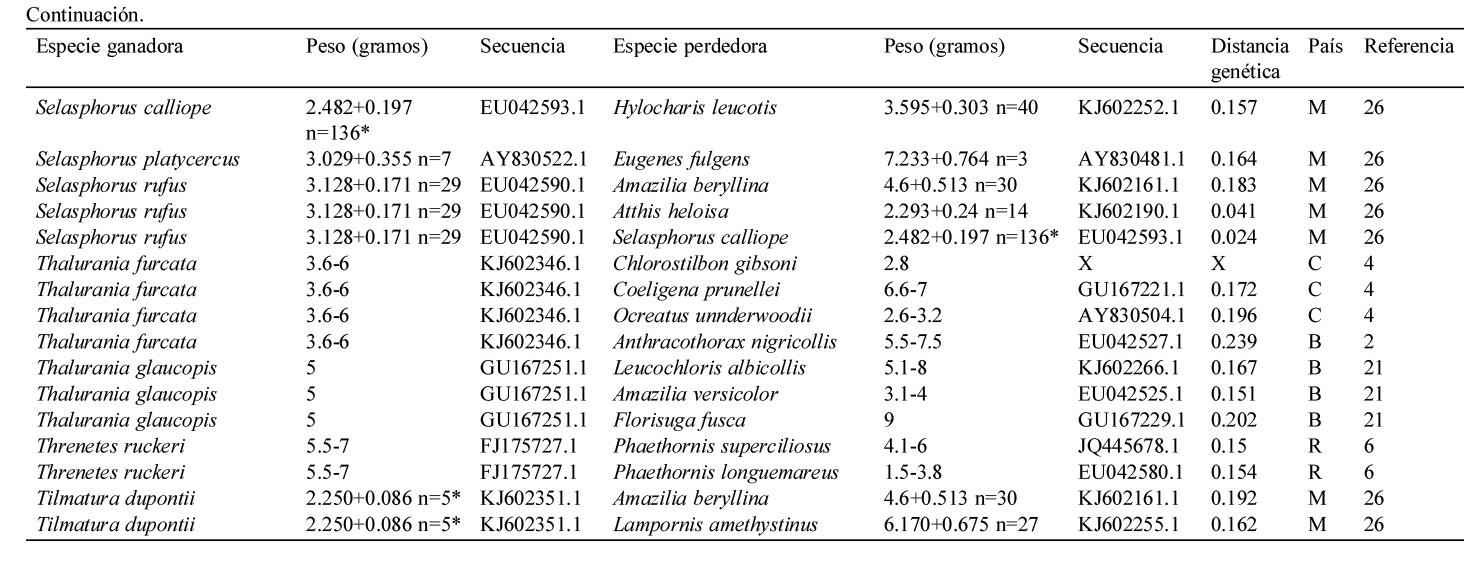 9 niveles (i.e., Ermitaños, Topacios, Mangos, Brillantes, Coquetas, Esmeraldas, Gemas de Montaña, Abejas, y Patagona) y el tamaño corporal del colibrí ganador respecto al de su competidor con 2 niveles (i.e., grande y pequeño). En el segundo modelo incluimos como variable de respuesta la frecuencia de encuentros perdidos por los colibríes y como variables predictoras la identidad del clado del colibrí perdedor con 9 niveles y el tamaño corporal del perdedor respecto al de su competidor con 2 niveles. Finalmente, utilizamos pruebas de Kruskal-Wallis para evaluar si existieron diferencias significativas entre la distancia genética de los colibríes que ganaron enfrentamientos contra contendientes más grandes en cada una de las regiones de América (i.e., Norteamérica, Centroamérica y Sudamérica). Los análisis estadísticos se realizaron en el software R (R Core Team, 2013) y las gráficas se realizaron mediante el paquete ggplot2 (Wickham, 2009).
9 niveles (i.e., Ermitaños, Topacios, Mangos, Brillantes, Coquetas, Esmeraldas, Gemas de Montaña, Abejas, y Patagona) y el tamaño corporal del colibrí ganador respecto al de su competidor con 2 niveles (i.e., grande y pequeño). En el segundo modelo incluimos como variable de respuesta la frecuencia de encuentros perdidos por los colibríes y como variables predictoras la identidad del clado del colibrí perdedor con 9 niveles y el tamaño corporal del perdedor respecto al de su competidor con 2 niveles. Finalmente, utilizamos pruebas de Kruskal-Wallis para evaluar si existieron diferencias significativas entre la distancia genética de los colibríes que ganaron enfrentamientos contra contendientes más grandes en cada una de las regiones de América (i.e., Norteamérica, Centroamérica y Sudamérica). Los análisis estadísticos se realizaron en el software R (R Core Team, 2013) y las gráficas se realizaron mediante el paquete ggplot2 (Wickham, 2009).Resultados
La identidad de los clados tuvo un efecto significativo en la frecuencia de contiendas agonísticas ganadas (x2 = 176.96, g.l. = 8, p < 0.001) y perdidas (x2 = 145.59, g.l. = 8, p < 0.001). Los clados de aquellas especies que dominaron la mayor cantidad de encuentros agonísticos fueron: Esmeraldas, Gemas de Montaña y los Mangos. Los colibríes Esmeraldas dominaron el 45% (n = 72 contiendas), las Gemas de Montaña dominaron el 16% (n = 26 contiendas) y los Mangos el 15% (n = 24 contiendas) de los casos de estudio incluidos en este estudio. El tamaño corporal de los contendientes tuvo un efecto significativo en el resultado de los enfrentamientos (x2 = 39.69, gr.l. = 1, p < 0.001), ya que las especies de todos los clados ganaron más encuentros agonísticos cuando fueron la especie más grande de la contienda (fig. 1a) y perdieron mayor cantidad de encuentros al ser el contendiente más pequeño (fig. 1b).
Para el análisis de las diferencias entre la distancia genética de colibríes de especies grandes y pequeñas que ganaron enfrentamientos agonísticos solo se incluyeron 155 de los 160 casos de estudio. Esto se debió a la falta de secuencias del gen mitocondrial NADH deshidrogenasa subunidad 2 para las siguientes especies: Eriocnemis mirabilis, Chlorostilbon gibsoni y C. auriceps. En estos 155 casos, no se encontraron diferencias significativas entre la distancia genética de los contendientes que participaron en los encuentros ganados por colibríes de especies más grandes y pequeñas (H = 0.204, p = 0.651; fig. 2). Al analizar los casos de estudio por región geográfica tampoco se encontraron diferencias significativas entre la distancia genética de los colibríes que ganaron contiendas contra competidores de especies de tamaños distintos (Norteamérica, H = 0.432, p = 0.510; Centroamérica, H = 0.482, p = 0.487 y Sudamérica, H = 0.141, p = 0.706; fig. 2).
Discusión
El hecho de que los colibríes de especies pequeñas ganen encuentros contra colibríes de especies más grandes podría deberse a factores asociados al contexto en el cual ocurre la contienda. Por ejemplo, el colibrí pechizafiro (Amazilia lactea) pesa 4.3 g en promedio, mientras que el colibrí sombrío (Aphantochroa cirrochloris) alcanza los 7 g. Cuando estas 2 especies compiten por el acceso a las flores de Eucalyptus spp., A. lactea tiende a ganar
Debe considerarse además que no todas las especies de colibríes establecen territorios de forrajeo o participan en contiendas agonísticas. Lo anterior ha sido descrito con base en los roles primarios que pueden ocupar los colibríes dentro de una comunidad. Al respecto, Feinsinger y Colwell (1978) postulan que los colibríes pueden desempeñar diferentes roles dentro de una comunidad para obtener acceso a los recursos disponibles en el ambiente, clasificándolos de acuerdo a sus características morfológicas (tamaño corporal, longitud del pico y patas) como ruteros (i.e., colibríes que establecen una ruta de forrajeo haciendo visitas secuenciales a diferentes puntos de alimentación) de baja calidad y ladrones (< 4 g y pico corto), generalistas y territoriales (4-5 g y pico de corto a medio) y ruteros de alta calidad y merodeadores (> 5 g y pico de medio a largo). No obstante, es importante enfatizar que una especie puede cambiar el rol que tiene
La variedad y plasticidad de los roles que pueden desempeñar las especies de colibríes dentro de una comunidad pueden ser el reflejo de procesos evolutivos, no solo de los colibríes, sino de las plantas que visitan. En conjunto, tales procesos podrían promover una disminución en la competencia interespecífica y aumentar el éxito reproductivo de las plantas (Brown et al., 1981). Un ejemplo de lo anterior son las características morfológicas de las corolas de algunas especies de plantas, las cuales solo pueden ser explotadas por especies de colibríes con cierta longitud y curvatura en el pico (Stiles, 1975; Vizentin-Bugoni et al., 2014).
corporal.
Finalmente, los colibríes Esmeralda fueron el clado que perdió la mayor cantidad de encuentros (44 casos de estudio) cuando se enfrentaron a especies de colibríes de mayor tamaño corporal (fig. 1b). Este patrón podría ser explicado por la presencia de los colibríes del género Chlorostilbon (2.1 – 3.8 g) en este clado, ya que suelen ser relegados del acceso a los mejores recursos por colibríes de otras especies e incluso por abejas (e.g., Xylocopa spp.; Arizmendi y Ornelas, 1990).
de contiendas agonísticas por el acceso a los recursos.
En conclusión, nuestro estudio indica que las especies de colibríes con mayor tamaño corporal generalmente dominan a las especies más pequeñas. Este patrón se mantiene a lo largo de la distribución del grupo y parece ser más evidente en clados como el Esmeraldas. Por otro lado, contrario a lo postulado por Martin y Ghalambor (2014), la distancia genética entre contendientes no resultó significativamente distinta entre colibríes que ganaron enfrentamientos contra competidores de menor masa corporal. Sin embargo, se debe tomar en cuenta que el presente estudio consideró cualitativamente a cada contienda (especie ganadora y especie perdedora) y que, dada la naturaleza de los datos, no se consideró la fuerza de cada interacción (es decir, cuantitativamente). Además de lo anterior, no se tomó en cuenta el contexto ecológico en el cual se desarrollan las contiendas, por lo cual se debe profundizar en el papel que juega la distancia evolutiva, en conjunto con la variabilidad en la disponibilidad y abundancia de los recursos, la calidad energética de los mismos y los cambios en la estructura de las comunidades debidos a la llegada y partida de especies migratorias en localidades particulares.
Agradecimientos
Referencias
Antunes, A. Z. (2003). Partilha de néctar de Eucalyptus spp., territorialidade e hierarquia de dominância em beija-flores (Aves: Trochilidae) no sudeste do Brasil. Ararajuba, 11, 39–44.
Araujo-Silva, L. E. y Bessa, E. (2010). Territorial behaviour and dominance hierarchy of Anthracothorax nigricollis Vieillot 1817 (Aves: Trochilidae) on food resources. Revista Brasileira de Ornitologia, 18, 89–96.
Arizmendi, M. C. y Ornelas, J. F. (1990). Hummingbirds and their floral resources in a tropical dry forest in Mexico. Biotropica, 2, 172–180.
Ayala, R. A. V. (1986). Aspectos de la relación entre Thalurania furcata colombica (Aves Trochilidae) y las flores en que liba, en un bosque subandino. Caldasia, 14, 549–562.
Boyden, T. C. (1978). Territorial defense against hummingbirds and insects by tropical hummingbirds. The Cooper Ornithological Society, 2, 216–221.
Brown, J. H., Kodric-Brown, A., Whitham, T. GR. y Bond, H. W. (1981). Competition between hummingbirds and insects for the nectar of two species of shrubs. The Southwestern Naturalist, 2, 133–145.
Camfield, A. F. (2006). Resource value affects territorial defense by Broad-tailed and Rufous hummingbirds. Journal of Field Ornithology, 77, 120–125.
Carpenter, F. L., Hixon, M. A., Russell, R. W., Paton, D. C. y Temeles, E. J. (1993). Interference asymmetries among age-sex classes of Rufous hummingbirds during migratory stopovers. Behavioral Ecology and Sociobiology, 33, 297–304.
Carpenter, F. L., Paton, D. C. y Hixon, M. A. (1983). Weight gain and adjustment of feeding territory size in migrant hummingbirds. Proceedings of the National Academy of Sciences of the United States of America, 80, 7259–7263.
Chaves, C. J. (1997). Coexistencia de varias especies de colibríes ermitaños en un parche de Heliconia danielsianna. En F. Bolaños, J. Lobo y D. Briceño (Eds.), Curso de Biología de Campo (pp. 92–97). San José: Facultad de Ciencias, Escuela de Biología, Universidad de Costa Rica.
Colwell, R. K. (1973). Competition and coexistence in a simple tropical community. The American Naturalist, 958, 737–760.
Contreras-Martínez, S. (2014). Dinámica espacio-temporal de colibríes (Trochilidae), en bosques de pino-encino post-incendio en la Reserva de la Biosfera Sierra de Manantlán, Jalisco, México (Tesis). Guadalajara, Jalisco: Centro Universitario de la Costa del Sur, Universidad de Guadalajara.
Copenhaver, C. y Ewald, P. W. (1980). Cost of territory establishment in hummingbirds. Oecologia, 46, 155–160.
Cotton, P. A. (1998). Temporal partitioning of a floral resource by territorial hummingbirds. Ibis, 140, 647–653.
Cotton, P. A. (2007). Seasonal resource tracking by Amazonian hummingbirds. Ibis, 149, 135–142.
Dearborn, D. C. (1998). Interspecific territoriality by a Rufous-tailed hummingbird (Amazilia tzacatl): effects of intruder size and resource value. Biotropica, 30, 306–313.
Ewald, P. W. y Bransfield, R. J. (1987). Territory quality and territorial behavior in two sympatric species of hummingbirds. Behavioral Ecology and Sociobiology, 20, 285–293.
Feinsinger, P. y Colwell, R. K. (1978). Community organization among Neotropical nectar-feeding birds. Amercian Zoologist, 18, 779–795.
Fraga, R. M. (1989). Interactions between nectarivorous birds and the flowers of Aphelandra sinclairiana in Panama. Journal of Tropical Ecology, 5, 19–26.
Freshwater, C., Ghalambor, C. K. y Martin, P. R. (2014). Repeated patterns of trait divergence between closely related dominant and subordinate bird species. Ecology, 95, 2334–2345.
Johnson, M. T. y Stinchcombe, J. R. (2007). An emerging synthesis between community ecology and evolutionary biology. Trends in Ecology and Evolution, 22, 250–257.
Justino, D. G. R., Maruyama, P. K. y Oliveira, P. E. (2012). Floral resource availability and hummingbird territorial behaviour on a Neotropical savanna shrub. Journal of Ornithology, 153, 189–197.
Kuban, J. F., Lawley, J. y Neill, R. L. (1983). The partitioning of flowering century plants by Black-chinned and Lucifer hummingbirds. The Southwestern Naturalist, 28, 143–148.
Kuban, J. F. y Neill, R. L. (1980). Feeding ecology of hummingbirds in the highlands of the Chisos Mountains, Texas. Condor, 82, 180–185.
Kumar, S., Stecher, GR. y Tamura, K. (2016). MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution, 33, 1870–1874.
Lara, C. (2006). Temporal dynamics of flower use by hummingbirds in a highland temperate forest in Mexico. Ecoscience, 13, 23–29.
Lara, C., Lumbreras, K. y González, M. (2009). Niche partitioning among hummingbirds foraging on Penstemon roseus (Plantaginaceae) in central Mexico. Ornitologia Neotropical, 20, 73–83.
Lara, C., Martínez-García, V., Ortiz-Pulido, R., Bravo-Cadena, J., Loranca, S. y Córdoba-Aguilar, A. (2011). Temporal-spatial segregation among hummingbirds foraging on honeydew in a temperate forest in Mexico. Current Zoology, 57, 56–62.
Licona-Vera, Y. y Ornelas, J. F. (2017). The conquering of North America: dated phylogenetic and biogeographic inference of migratory behavior in bee hummingbirds. BMC Evolutionary Biology, 17, 126.
Lyon, D. L. (1976). A montane hummingbird territorial system in Oaxaca, Mexico. The Wilson Bulletin, 88, 280–299.
Martin, P. R. y Ghalambor, C. K. (2014). When David beats Goliath: the adventage of large size in interspecific aggressive contests declines over evolutionary time. Plos One, 9, e108741.
McGuire, J. A., Witt, C. C., Remsen, J. V., Corl, A., Rabosky, D. L., Altshuler, D. L. et al. (2014). Molecular phylogenetics and the diversification of hummingbirds. Current Biology, 24, 910–916.
McGuire, J. A., Witt, C. C., Remsen, J. V., Dudley, R. y Altshuler, D. L. (2009). A higher-level taxonomy for hummingbirds. Journal of Ornithology, 150, 155–165.
Nelder, J. A. y Wedderburn, R. W. M. (1972). Generalized linear models. Journal of the Royal Statistical Society, 135, 370–384.
Ornelas, J. F. (1995). Radiation in the genus Amazilia: a comparative approach to understanding the diversification of hummingbirds (Tesis doctoral). University of Arizona, Arizona, EUA.
Ornelas, J. F., Ordano, M., Hernández, A., López, J. C., Mendoza, L. y Perroni, Y. (2002). Nectar oasis produced by Agave marmorata Roezl. (Agavaceae) lead to spatial and temporal segregation among nectarivores in the Tehuacán Valley, México. Journal of Arid Environments, 52, 37–51.
Persegona, J. E., Corrêa, L. y Roper, J. J. (2009). Interações estacionais entre beija-flores (Trochilidae) em uma região de ecótone no município de Piraquara, Paraná. Estudos de Biologia, 31, 49–58.
Pimm, S. L., Rosenzweig, M. L. y Mitchell, W. (1985). Competition and food selection: field test of a theory. Ecology, 66, 798–807.
Powers, D. R. y McKee, T. (1994). The effect of food availability on time and energy expenditures of territorial and non-territorial hummingbirds. Condor, 96, 1064–1075.
Primack, R. B. y Howe, H. F. (1975). Interference competition between a hummingbird (Amazilia tzacatl) and skipper butterflies (Hesperiidae). Biotropica, 7, 55–58.
R Core Team. (2013). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna. Disponible en: http://www.r-project.org/
Ramírez-Burbano, M., Sandoval-Sierra, J. y Gómez-Bernal, L. (2007). Uso de recursos florales por el Zamarrito multicolor Eriocnemis mirabilis (Trochilidae) en el Parque Nacional Natural Munchique, Colombia. Ornitología Colombiana, 5, 64–77.
Rodríguez-Flores, C. I. y Arizmendi-Arriaga, M. C. (2016). The dynamics of hummingbird dominance and foraging strategies during the Winter season in a highland community in Western Mexico. Journal of Zoology, 4, 262–274.
Salamanca-Reyes, J. R. (2011). Ecología del barbudito de páramo (Oxypogon guerinii, Trochilidae) en el páramo de Siscunsí, Boyacá, Colombia. Ornitología Colombiana, 11, 58–75.
Schuchmann, K. L. (1999). Family Trochilidae (Hummingbirds). En J. del Hoyo, A. Elliott, y J. Sargatal (Eds.), Handbook of birds of the World, Volumen 5: Barn–owls to hummingbirds. (pp. 468–535). Barcelona: Lynx Edicions.
Stiles, F. G. R. (1975). Ecology, flowering phenology, and hummingbird pollination of some Costa Rican Heliconia species. Ecology, 56, 285–301.
Tamura, K. y Nei, M. (1993). Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees. Molecular Biology and Evolution, 10, 512–526.
Taylor, J. (2005). Do sympatric heliconias attract the same species of hummingbird? Observations on the pollination ecology of Heliconia beckneri and H. tortuosa at Cloudbridge Nature Reserve. Brenesia, 15, 151–180.
Thompson, J. D., Higgins, D. G. R. y Gibson, T. (1994). CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Research, 22, 4673–4680.
Toloza-Moreno, D. L., León-Camargo, D. A. y Rosero-Lasprilla, L. (2014). El ciclo anual de una comunidad de colibríes (Trochilidae) en bosques altoandinos intactos y paramizados en la Cordillera Oriental de Colombia. Ornitología Colombiana, 14, 28–47.
Vizentin-Bugoni, J., Maruyama, P. K. y Sazima, M. (2014). Processes entangling interactions in communities: forbidden links are more important than abundance in a hummingbird-plant network. Proceedings of the Royal Society of London B: Biological Sciences, 281, 1–8.
Webb, C. O., Ackerly, D. D., McPeek, M. A. y Donoghue, M. J. (2002). Phylogenies and community ecology. Annual Review of Ecology and Systematics, 33, 475–505.
Wickham, H. (2009). ggplot2: elegant graphics for data analysis. Springer, Nueva York, EUA.
Wolf, L. L. (1969). Female territoriality in a tropical hummingbird. The Auk, 86, 490–504.
Wolf, L. L., Stiles, F. G. R. y Hainsworth, F. R. (1976). Ecological organization of a tropical, highland hummingbird community. Journal of Animal Ecology, 45, 349–379.
Woods, S. y Ramsay, P. M. (2001). Variability in nectar supply: implications for high-altitude hummingbirds. En P. M. Ramsay (Ed.), The ecology of volcán Chiles: high-altitude ecosystems on the Ecuador-Colombia border (pp. 209–217). Londres: Pebble & Shell, Plymouth.