Descripción de la larva de tercer estadio y pupa de Pelidnota lugubris (Coleoptera: Scarabaeidae: Rutelinae)
Gabriel Antonio Lugo-García a, Víctor Alfonso Cuate-Mozo a, *, Agustín Aragón-García b y Juan Fernando Sánchez-Portillo a
a Colegio de Ciencias Agropecuarias, Facultad de Agricultura del Valle del Fuerte, Universidad Autónoma de Sinaloa, Calle 16 y Av. Japaraqui, 81110 Juan José Ríos, Ahome, Sinaloa, México
b Centro de Agroecología, Instituto de Ciencias, Benemérita Universidad Autónoma de Puebla, EcoCampus Valsequillo, Edificio VAL 1, Km 1.7 carretera San Baltazar Tetela, 72570 San Pedro Zacachimalpa, Puebla, México
*Autor para correspondencia: pneuma@hotmail.com (V.A. Cuate-Mozo)
Resumen
Se describe la larva de tercer estadio y pupa de Pelidnota lugubris LeConte (Coleoptera: Scarabaeidae: Rutelinae: Rutelini) con base en especímenes recolectados en suelos de bosque tropical caducifolio de la localidad de Ocolome, municipio del Fuerte, Sinaloa, México. Se incluyen ilustraciones de estructuras de diagnóstico y una clave para las larvas conocidas del tercer estadio de las especies del género Pelidnota.
Palabras clave: Saprófago; Morfología; Taxonomía; Gallina ciega
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Description of the third instar larva and pupa of Pelidnota lugubris (Coleoptera: Scarabaeidae: Rutelinae)
Abstract
The third instar larva and pupa of Pelidnota lugubris LeConte (Coleoptera: Scarabaeidae: Rutelinae: Rutelini) are described based on specimens collected in deciduous tropical forest soils in Ocolome, municipality of El Fuerte, Sinaloa, Mexico. Illustrations of diagnostic structures and a key to the known third-stage larvae of Pelidnota species are included.
Keywords: Saprophagous; Morphology; Taxonomy; White grubs
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
El género Pelidnota MacLeay (Scarabaeidae: Rutelinae: Rutelini) es endémico de América, se encuentra representado por 194 especies. En México se tienen registradas 14 especies (P. aurescens, P. centroamericana, P. frommeri, P. guatemalensis, P. jalapensis, P. lucae, P. lugubris, P. notata, P. perplexa, P. punctata, P. strigose, P. teocuitlamayatli, P. velutipes y P. virescens). En la región noreste del país solo se encuentra registradas las especies P. lugubris, P. virescens y P. lucae (Morón et al., 1997). Los escarabajos de este género en estado adulto presentan la región dorsal usualmente glabra, la sutura frontoclipeal incompleta en la porción central, con el borde externo de las mandíbulas redondeado o con un dentículo preapical, sinuado o escotado, con un dentículo preapical notable. Los élitros tiene los calla apicales redondeados y sus bordes presentan sedas escasas, con diferentes coloraciones, desde el negro intenso y brillante hasta combinaciones contrastantes o iridiscentes, incluyendo especies completamente blancas. Se conocen comúnmente como “escarabajos joyas”, polinizan diferentes angiospermas y consumen follaje de diferentes plantas (Soula, 2011). Sus estados inmaduros se desarrollan en diferentes sustratos, entre ellos el suelo y troncos en proceso de descomposición (Neita et al., 2006). Se alimentan sobre todo de madera podrida, de tal forma que reintegran los nutrientes al suelo (Morón y Deloya, 1991, 2002).
Respecto a la historia natural de algunas especies, Hayes (1925) reportó a los adultos de Pelidnota punctata alimentándose de las hojas de Vitis vinifera L. (Vitaceae). En Colombia, Neita et al. (2006) recolectaron larvas de P. chiriquina Bates en troncos podridos de Brosimum utile (Kunt) (Moraceae).
Sobre el conocimiento de los estados inmaduros de las especies reportadas en el continente americano se tienen descritas las larvas del tercer estadio de P. virescens, P. fulva, P. punctata y P. lugubris (presente en este trabajo). El género Pelidnota es parafilético, no hay caracteres del adulto que lo definan adecuadamente, pero las larvas contribuyen mucho a resolver estas relaciones. En este trabajo presentamos la descripción de la larva del tercer estadio y pupa de P. lugubris, como una contribución al conocimiento morfológico y taxonómico, comparándola con las especies descritas del mismo género.
Material y métodos
Se recolectaron 27 larvas de P. lugubris en noviembre del 2017 en la localidad de Ocolome (26°26’54” N, 108°34’25” O; 138 m de altitud), perteneciente al municipio del Fuerte, Sinaloa, México, en bosque tropical caducifolio. Las larvas fueron recolectadas manualmente de muestras de suelos de 30 × 30 × 30 cm de acuerdo con la metodología de Lavelle et al. (1981) y se depositaron en recipientes de plástico de un litro con suelo como sustrato. Finalmente, fueron trasportadas al laboratorio de la Colección Entomología del Valle del Fuerte, Universidad Autónoma de Sinaloa (CEVF-UAS). Un 30% de la muestra se fijó en solución Pampel (9 larvas) y 4 días después se pasaron a solución acuosa de etanol al 70% para su conservación. El 70% de las larvas de esa muestra (18 larvas) se mantuvieron vivas, para verificar su identidad, en recipientes de polietileno con sustrato del sitio de colecta que previamente se esterilizó de acuerdo con la metodología propuesta por Aragón y Morón (2004). Los recipientes se colocaron en una cámara de cría a temperatura de 26 ± 2 °C y humedad relativa de 70 ± 10%. Las observaciones e ilustraciones se hicieron con un estereomicroscopio Carl Zeiss y una cámara lucida. Los caracteres y la terminología utilizada en las descripciones fueron tomadas de Böving (1936). Los ejemplares estudiados se depositaron en la colección de la Facultad de Agricultura del Valle del Fuerte.
Descripción
Pelidnota lugubris (LeConte)
Larva de tercer estadio
(figs. 1-14)
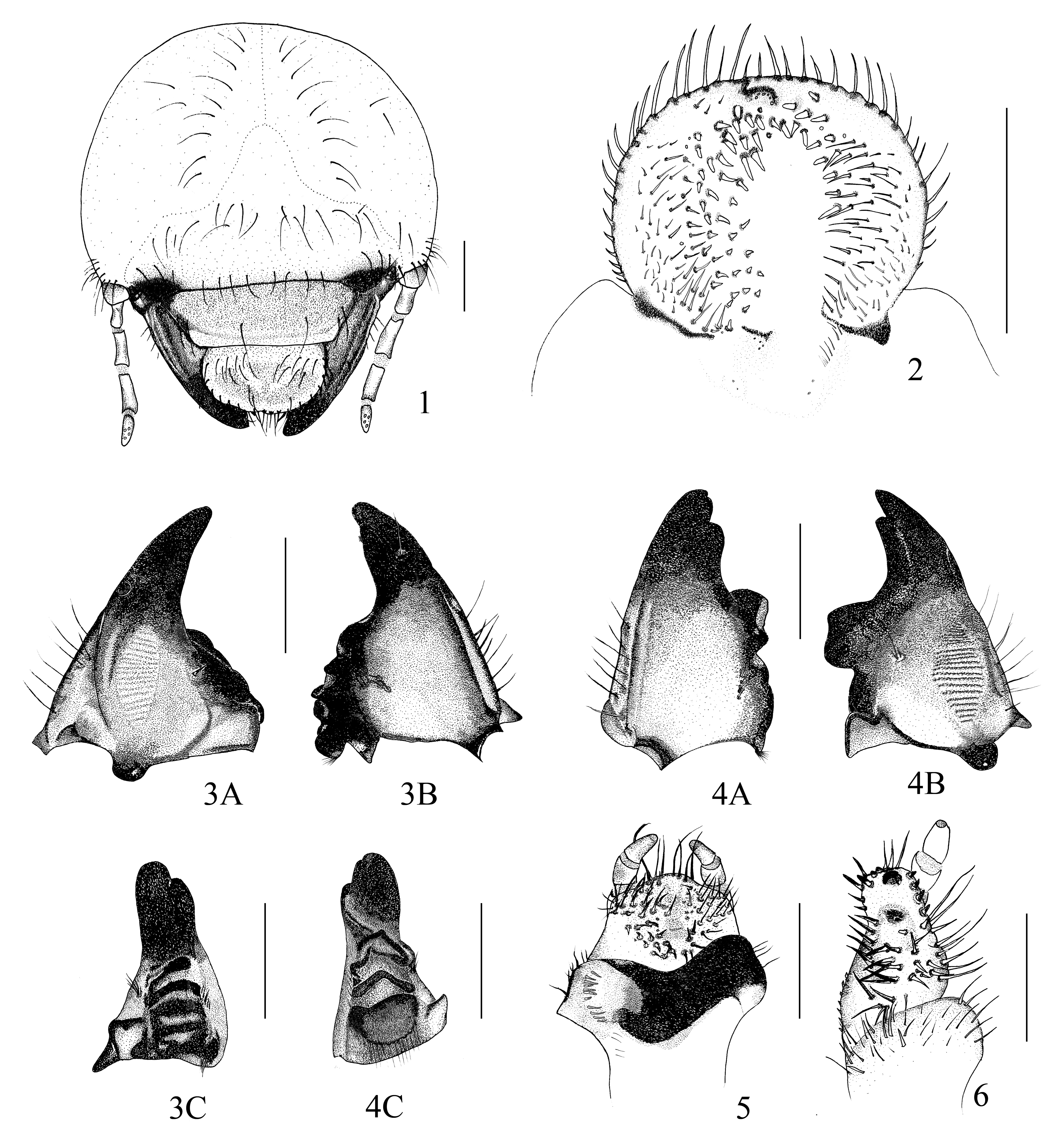
Cabeza (fig. 1): hipognata. Ancho de cápsula cefálica: 5.51-5.60 mm. Superficie del cranium pardo amarillenta, sedas predominantemente de color castaño. Con una fila de 9 sedas cercana de la sutura epicraneal. Frente con 3 sedas frontales exteriores, 9 posteriores a cada lado, 8 anteriores frontales, 2 en ángulo anterior, 4 en base antenal a cada lado. Stemmata ausente. Clípeo trapezoidal con 2 sedas anterocentrales, 2 laterales a cada lado. Labro simétrico, con márgenes redondeados, con 9 sedas en parte posterior y 6 sedas postlaterales a cada lado; margen anterior del labro con 2 sedas. Epifaringe (fig. 2) de 1.70 mm de ancho y 1.11 mm de longitud, con zigum y 6 sencilias delante al zigum; 15 helis que se encuentran en 3 filas de forma irregular, epizigum, acroparia, plegmatium y proplegmatia ausentes. Dexiophoba y laephoba definidos. Dexiotorma casi recta ligeramente recurvado, con el extremo medio adelgazado. Laeotorma corta y ancha. Pterotorma estrecha, sin cono sensorial. Crepis no definido y estrecho. Acanthoparia con 12-14 sedas gruesas y agudas. Chaetoparia derecha con 65 sedas gruesas y 6 sedas delgadas. Chaetoparia izquierda con 55 sedas gruesas y 28 sedas delgadas. Mandíbula derecha 1.81 mm de ancho, 2.72 mm de longitud, con lámina cortante distal separadas por dientecillo incisivo proximal (S1 + S2 fusionados), separados de S3 por muesca. Superficie ventral (fig. 3A) con un área estriduladora y 15 estrías; proceso ventral bien desarrollado. Vista dorsal (fig. 3B). Scrobe con 7 sedas, región dorsal molar con 8 sedas y brustia con 6 sedas. Calx largo y prominente. Área molar con 2 lóbulos M1-2 (fig. 3C). Mandíbula izquierda de 1.61 mm ancho, 2.62 mm longitud. Superficie Ventral (fig. 4A) con área estridulatoria presente y 19 estrías, proceso ventral largo y redondeado, brustia con 14 sedas, lóbulo molar bien desarrollado (fig. 4C). Vista dorsal (fig. 4B) área sensorial con 2 dientes apicales separados por muesca, scrobis con 7 sedas, acia bien desarrollada, superficie dorso molar con 5 sedas. Esclereoma hipofaríngeo (fig. 5) asimétrico, con 4 sedas en lado derecho y 17 sedas largas y delgadas en lado izquierdo. Labio con 27 sedas largas y delgadas, y 15 sedas gruesas y cortas. Maxila (fig. 6). Galea con uncus apical, 4 unci y dos filas con 4 helis; lacinia con uncus apical. Palpo maxilar con 4 segmentos, segmentos 1 y 2 desiguales en longitud, segmento 4 más largo que el 3. Área estriduladora con 9 dientes pequeños y agudos (fig. 7). Antena formada por 4 segmentos, con 8 áreas sensoriales; 4 dorsal (fig. 8A) y 4 ventral (fig. 8B).
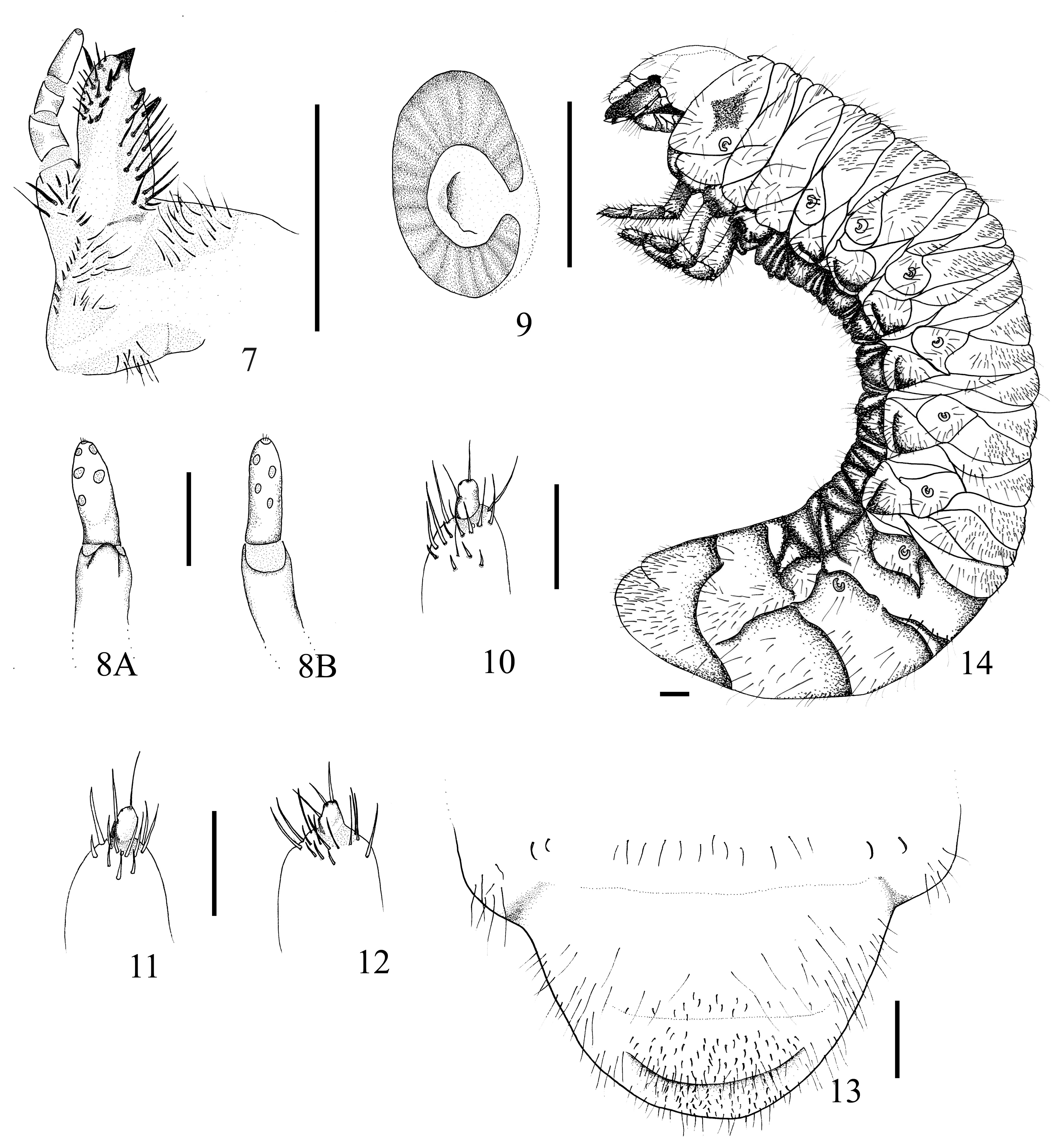
Tórax. Estigma respiratorio de 0.81 mm de ancho y 0.41 mm de longitud, placa respiratoria parda amarilla, lóbulos uniformemente recurvado en forma de “C” (fig. 9), la distancia entre los lóbulos de la placa respiratoria es menor al diámetro de la bulla redondeada; con 23-26 poros microscópicos en una línea transversal de la placa respiratoria, con forma y tamaño irregular. Pronoto con escleroma lateral alargado a cada lado, amarillo débilmente marcado, con 64-72 sedas; pro-prescuto con 5-7 sedas; proscuto con 6-9 sedas; meso-prescuto con 14 sedas; mesoscuto con 14-17 sedas; mesoscutelo con 9-11 sedas; meta-prescuto con 16 sedas; metascuto con 15 sedas; metascutelo con 13 sedas. Patas con 4 artejos. Pro- meso- meta-pretarsus (figs. 10-12) bien desarrollado con el ápice afilado con 1 seda prebasal interna y 1 lateral externa.
Abdomen. Placas respiratorias de todos los segmentos pardo amarillentas, regularmente recurvadas en forma de “C”; placa del segmento I-II con 0.61 mm longitud y 0.31 mm de ancho; placas del segmento III-VII de 0.60 mm longitud y 0.40 mm ancho; placas del segmento VIII con 0.61 mm longitud y 0.31 mm ancho. Dorso. Segmento abdominal I; prescuto con 22 sedas largas y delgadas; subscuto con 4 sedas largas y delgadas; scuto con 12 sedas largas y 28 sedas espiniformes; scutelo con 5 sedas largas y 37 sedas espiniformes; postscutelo con 2 sedas delgadas y con 10 sedas largas en el área espiracular. Segmento abdominal II, prescuto con 11 sedas largas y 21 sedas espiniformes; subscuto con 6 sedas largas; scuto con 15 sedas largas y 52 sedas espiniformes; scutelo con 5 sedas largas y 43 sedas espiniformes; postscutelo con 2 sedas largas, en el área espiracular con 11 sedas largas y delgadas. Segmento abdominal III, prescuto con 3 sedas largas y 28 sedas espiniformes; subscuto con 3 sedas largas y delgadas; scuto con 14 sedas delgadas y 67 sedas espiniformes; scutelo con 7 sedas largas y 48 sedas espiniformes; postscutelo con 2 sedas largas; área espiracular con 10 sedas largas. Segmento abdominal IV, prescuto con 3 sedas largas y 34 sedas espiniformes; subscuto con 6 sedas largas; scuto con 15 sedas largas y 63 sedas espiniformes; scutelo con 6 sedas largas y 44 sedas espiniformes; postscutelo con 2 sedas largas; área espiracular con 8 sedas largas. Segmento abdominal V, prescuto con 2 sedas largas y 41 sedas espiniformes; subscuto con 6 sedas largas; scuto con 10 sedas largas y 56 sedas espiniformes; scutelo con 5 sedas largas y 31 sedas espiniformes; postscutelo con 2 sedas largas; área espiracular con 11 sedas largas. Segmento abdominal VI, prescuto con 4 sedas largas y 65 sedas espiniformes; subscuto con 3 sedas largas; scuto con 17 sedas largas y 62 sedas espiniformes; scutelo con 6 sedas largas y 36 sedas espiniformes; postscutelo con 2 sedas largas; área espiracular con 11 sedas largas. Segmento abdominal VII, prescuto con 3 sedas largas y 17 sedas espiniformes; scuto con 17 sedas largas y 5 sedas espiniformes; postscutelo con 2 sedas largas; área espiracular con 8 sedas largas. Segmento abdominal VIII, con 14 sedas largas y sedas espiniformes ausentes; postscutelo con 2 sedas largas; área espiracular con 6 sedas largas. Segmento abdominal IX, con fila anterior de 9 sedas largas y una fila posterior de 17 sedas largas, sedas espiniformes ausentes. Segmento abdominal X, con combinación de 10 sedas largas y cortas. Venter, segmentos abdominales del I-VII con 12 sedas largas distribuidas transversalmente. Segmento abdominal VIII con 14 sedas largas. Segmento abdominal IX con 18 sedas largas. Raster: palidia ausente, teges formado por combinación de 19-22 sedas cortas y medianas. Barbula moderadamente densa, con sedas largas. Dorsal; labio anal superior con 26 sedas delgadas y largas y 54 sedas espiniformes. Labio anal inferior dividido por línea sagital, con 47 sedas espiniformes y 46 sedas largas y delgadas. Abertura anal transversal (fig. 13). Longitud aproximada de larva 3.39-4.6 cm (fig. 14).
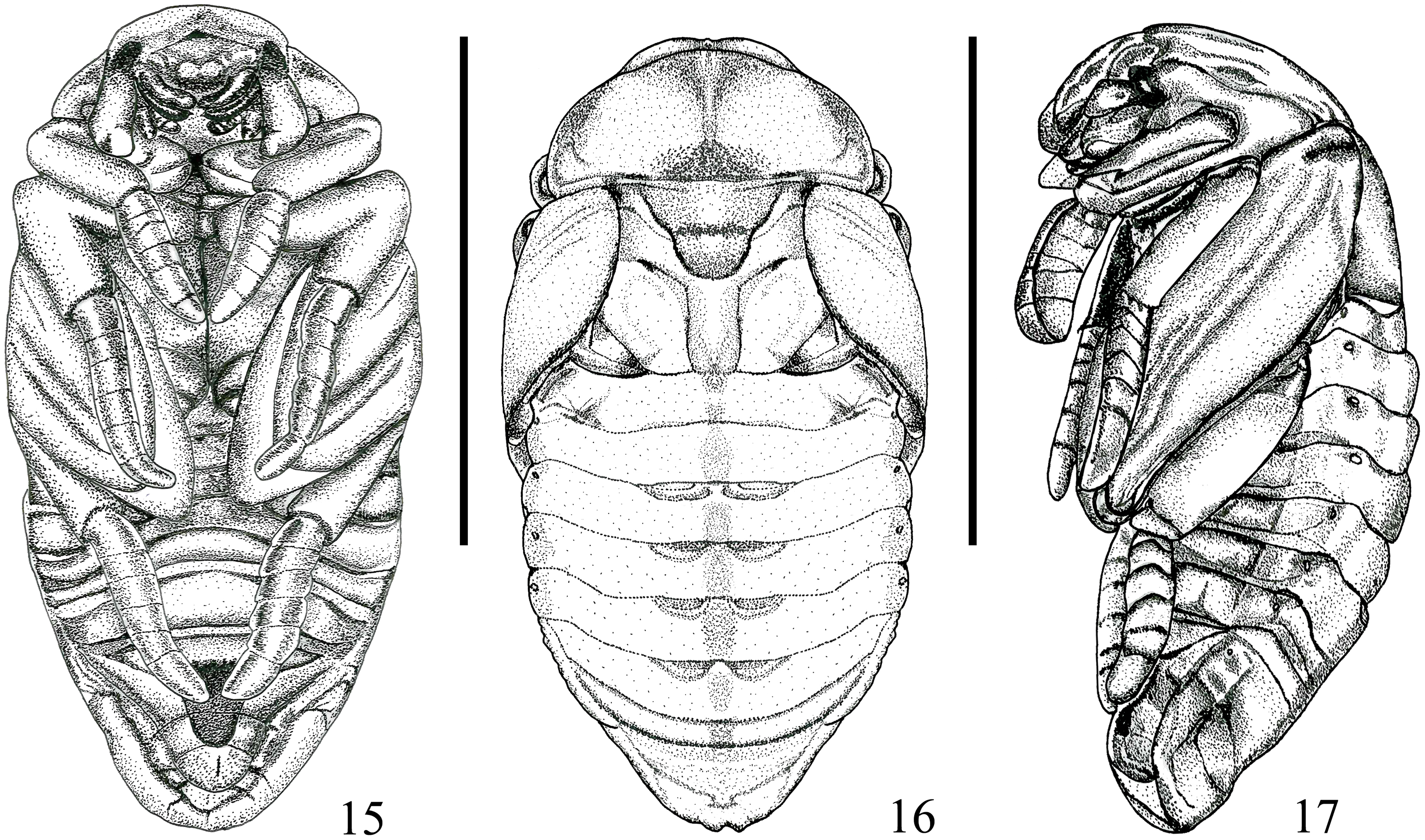
Pupa (figs. 15-17). Longitud corporal 15.3 mm, ancho 7.3 mm. Cuerpo de forma alargado ovalado. Color blanco amarillento. Vestidura finamente aterciopelada. Superficie de cabeza glabra, fuertemente inclinada hacia abajo. Frente con depresiones irregulares, clípeo convexo; piezas bucales claramente diferenciadas; ojos compuestos ligeramente visibles; tecae antenal claramente visibles y engrosados. Pronoto convexo. Meso y metanoto bien diferenciado. Pteroteca cerca del cuerpo, ventralmente curvado, extendiéndose hacia el segundo segmento abdominal. Protibias de igual tamaño respecto a los tarsos. Mesotibias ligeramente más cortas que mesotarsos. Metatibias ligeramente más largas que metatarsos. Abdomen. I segmento delgado en comparación que los segmentos II-V los cuales son claramente más anchos, con órganos dioneiformes bien definidos entre segmentos III-VII. Espiráculo I elongado con peritrema fino y cubierto ligeramente por teca alar. Espiráculos II-IV con peritrema fino no prominente, espiráculos de segmentos V-VII cerrados. Espiráculo VIII se proyecta con sentido mesial. Noveno segmento abdominal triangular, lateralmente extendido hacia lado ventral, sin urogomphi. Último esternito abdominal con ámpula genital ligeramente pronunciada en el macho.
Resumen taxonómico
Material examinado: 9 larvas del tercer estadio recolectadas en noviembre del 2017 en suelos de bosque tropical caducifolio de Ocolome (26°26’54” N, 108°34’25” O; 138 m de altitud), municipio del Fuerte, Sinaloa, México. Col. V. A. Cuate M. y G. A. Lugo-García.
Biología: en el noreste de Sinaloa, Aragón et al. (2010) recolectaron 48 adultos los cuales se encontraban alimentando de las hojas de Parkisonia aculeata (Fabaceae) y Baccharis salicifolia (Asteraceae). En julio del 2009 y agosto del 2014 se recolectaron 28 ejemplares que fueron atraídas por la trampa de luz negra en la localidad de Santa Ana, Bamicori y sierra de Balacachi, El Fuerte (Lugo et al., 2014). Esta especie presenta una distribución muy restringida en bosques tropicales caducifolios localizados entre el sur de Sonora y el norte de Sinaloa, y depende estrechamente de la vegetación local de esa región, que está siendo perturbada por la agricultura local. En agosto del 2017, se encontraron 19 adultos de P. lugubris sobre las hojas de mauto (Lysiloma divaricatum (Jacq.) J.F.Macbr.) (Com. Pers.) en Ocolome, El Fuerte. Su hallazgo es muy importante en una localidad donde predominan los terrenos agrícolas, pues indica que la especie puede tolerar un alto grado de reducción del hábitat mientras se conserven tocones de mauto y palo brea (Parkinsonia praecox Ruiz y Pav.) para el desarrollo de las larvas y al menos algunos árboles saludables de las mismas especies para que obtengan su alimento los adultos.
Comentarios taxonómicos
Las larvas de P. virescens, P. punctata y P. lugubris son similares, pero difieren en el número de sedas en el cranium; P. punctata cuenta con un número menor de sedas (11), P. virescens es la única especie que presenta sedas espiniformes gruesas en la acroparia (6-7), así como un menor número de filas irregulares de helis (2). Pelidnota punctata y P. lugubris no muestran acroparia, pero P. lugubris se diferencia de las demás especies por mayor número de sedas espiniformes cortas recurvadas presentes en la acanthoparia (12-14).
Clave para separar las larvas de tercer estadio de Pelidnota modificada de Rodrigues et al. (2012).
1. Cranium con 9-10 sedas dorsoepicraneales y 8 sedas anterofrontales; epifaringe con helis cortos dispuestos en 2 filas irregulares transversales; acroparia con 6-7 sedas espiniformes gruesas. Sur y noreste de México…………………………P. virescens Burmeister
1′. Cranium con 5-7 sedas dorsoepicraneales y 3-4 sedas anterofrontal; epifaringe con más de 2 filas de helis de diferentes longitudes; acroparia con menos de 6 sedas o sin sedas espiniformes gruesas………………………… 2
2. Cranium con 4 sedas antero frontales y 6 sedas dorsoepicraneales, acroparia con 4 sedas espiniformes gruesas; epifaringe con 3 filas de helis dispuestas irregularmente; acanthoparia con 10-12 sedas espiniformes cortas recurvadas; Brasil, Bolivia, Paraguay y Argentina………………………… P. fulva Blanchard
2′. Acroparia sin sedas espiniformes gruesas………………………… 3
3. Epifaringe con 3-4 filas de helis dispuesta en forma irregular; acanthoparia con 9 sedas espiniformes cortas recurvadas; cranium con 3-4 sedas anterofrontales y 5-7 sedas dorsoepicraniales. Este de USA………………………… P. punctata (L.)
3′. Epifaringe con 15 heli dispuestos en 3 filas de forma irregular; acanthoparia 12-14 sedas espiniformes cortas recurvadas; cranium con 8 sedas anterofrontales y una fila de 9 sedas dorsoepicraniales. Noreste de México………………………… P. lugubris (LeConte)
Referencias
Aragón A., Lugo-García, G. A., Reyes-Olivas, A., Casillas-Álvarez, P., Villegas-Cota, J. R. y Morón, M. Á. (2010). Huéspedes vegetales de adultos de Coleoptera Scarabaeoidea en el Valle del Carrizo, Sinaloa, México. Southwestern Entomologist, 35, 99–108. https://doi.org/10.3958/059.035.0111
Aragón, G. A. y Morón, M. A. (2004). Un método de cría para gallinas ciegas rizófagas del género Phyllophaga (Coleoptera: Melolonthidae En M. N. Bautista, M. H. Bravo y P. C. Chavarín (Eds.), Cría de insectos plaga y organismos benéficos (pp. 109–118). Texcoco, Estado de México: Colegio de Posgraduados, Montecillos/ Conabio. https://doi.org/10.24850/j-tyca-2019-03-07
Böving, A. (1936). Description of the larvae of Plectis aliena Chapin and explanation of new terms applied to the epipharynx and raster. Proceedings of the Entomological Society of Washington, 38, 169–185.
Hayes, W. P. (1925). A comparative study of the life cycle of certain phytophagous scarabaeid beetles. Kansas, Agricultural Experiment Station Technical Bulletin, 16, 1–146.
Lavelle, P., Maury, M. E. y Serrano, V. (1981). Estudio comparativo de la fauna del suelo en la región de Laguna Verde, Veracruz. Época de lluvias. En P. Reyes-Castillo (Ed.), Estudios ecológicos en el trópico mexicano (pp. 75–105). Ciudad de México: Instituto de Ecología A.C. https://doi.org/10.4000/books.cemca.1292
Lugo-García G. A., Morón, M. Á., Aragón-Sánchez, M., Reyes-Olivas, Á., Sánchez-Soto, B. H. y Sauceda-Acosta, C. P. (2014). Especies de gallina ciega (Coleóptera: Scarabaeoidea) asociadas al cultivo de ajonjolí en Sinaloa, México. En A. Aragón G. y J. F. Pérez-Domínguez (Eds.), Diversidad e importancia agrícola de coleópteros edafícolas (pp. 65–76). México D.F.: Benemérita Universidad Autónoma de Puebla/ Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias. https://doi.org/10.24850/j-tyca-2017-05-11
Morón, M. A. y Deloya, C. (1991). Los coleópteros Lamellicornios de la Reserva de la Biosfera “La Michilia”, Durango, México. Folia Entomologica Mexicana, 81, 209–283. https://doi.org/10.21829/abm22.1993.668
Morón, M. A. y Deloya, C. (2002). Observaciones sobre el ciclo de vida de Pelidnota (Pelidnota) virescens Burmeister, 1844 (Coleoptera: Melolonthidae, Rutelinae). Acta Zoológica Mexicana (n.s.), 85, 109–118. https://doi.org/10.21829/abm22.1993.668
Morón, M. A., Ratcliffe, B. C. y Deloya, C. (1997). Atlas de los escarabajos de México, Coleoptera Lamellicornia Vol. I. Familia Melolonthidae. Ciudad de México: Conabio/ Sociedad Mexicana de Entomología. https://doi.org/10.2307/3495775
Neita, J. C., Orozco, J. y Ratcliffe, B. (2006). Escarabajos (Scarabaeidae: Pleurosticti) de la selva baja del Bosque Pluvial Tropical “BP-T”, Chocó, Colombia. Acta Zoológica Mexicana (n.s.), 22, 1–32.
Rodrigues, S. R., Morón, M. A. y Nogueira, G. A. L. (2012). Description of the third instar of Pelidnota fulva Blanchard, 1850 (Coleoptera: Scarabaeidae: Rutelinae). The Coleopterists Bulletin, 66, 266–270. https://doi.org/10.1649/072.066.0314
Soula, M. (2011). Les coléoptères du Nouveau Monde. Geniatini 1. Révision du genre Bolax (Coleoptera: Scarabaeidae: Rutelini: Geniatini). Besoiro, Supplément, 5, 1–85.



