Lluvia polínica en la selva baja caducifolia del cerro El Picante, San José Tilapa, Puebla, valle de Tehuacán-Cuicatlán
Mauricio León-Carreño a, *, Elia Ramírez-Arriaga a, Angélica Martínez-Bernal b, Enrique Martínez-Hernández a, María del Rocío Zárate-Hernández b, Beatriz Vasquez-Velasco b y Alfonso Valiente-Banuet c
a Departamento de Paleontología, Instituto de Geología, Universidad Nacional Autónoma de México, Circuito de la Investigación Científica s/n , Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
b Departamento de Biología, División de Ciencias Biológicas y de la Salud, Universidad Autónoma Metropolitana, Unidad Iztapalapa, Av. San Rafael Atlixco Núm. 186, Col. Vicentina, Iztapalapa, 09340 Ciudad de México, México
c Departamento de Ecología de la Biodiversidad, Instituto de Ecología, Universidad Nacional Autónoma de México, Circuito Exterior s/n anexo Jardín Botánico exterior, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
*Autor para correspondencia: maury19942@hotmail.com (M. León-Carreño).
Resumen
En este estudio se analiza por primera vez la lluvia de polen en la selva baja caducifolia del cerro El Picante en San José Tilapa (Puebla), ubicado dentro del biodiverso valle de Tehuacán-Cuicatlán. En 3 transectos de 100 m cada uno, se recolectaron bromelias cada 10 m, obteniéndose un total de 32 muestras, de las cuales se recuperaron los palinomorfos y se procesaron por medio de la técnica de acetólisis. Un total de 11,520 polen-esporas pertenecientes a 156 grupos taxonómicos fueron registrados. Los análisis permitieron reconocer taxones regionales, locales y extra locales identificados como señales polínicas. La señal regional estuvo caracterizada por elementos templados, principalmente del bosque mesófilo. La señal local destacó en riqueza e incluyó Asteraceae, Bursera morelensis, B. aptera, Euphorbiaceae, Ceiba aesculifolia y C. parvifolia de la selva baja caducifolia del cerro El Picante; mientras que la señal extra local estuvo representada por Sapindaceae, Caryophyllaceae, Meliaceae y Ephedra spp., que son elementos tanto de selva baja caducifolia como de matorral xerófilo. La comparación de los conjuntos palinológicos con la estructura de la selva baja caducifolia indicaron que Acaciella sp., Asteraceae, Bursera aptera, B. morelensis, Ceiba aesculifolia, C. parvifolia y Mimosa spp. son indicadores polínicos de este tipo de vegetación.
Palabras clave: Palinología; Polen; Esporas; Vegetación semiárida; Bosque tropical caducifolio; Reserva de la biosfera; Actuopalinología
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Tropical deciduous forest pollen rain from El Picante hill, San José Tilapa, Puebla, Tehuacán-Cuicatlán Valley
Abstract
In this study, we analized for the first time the tropical deciduous forest pollen rain at San José Tilapa, Puebla, located within the biodiverse Tehuacán-Cuicatlán Valley. In 3 transects, 100 m each, bromeliads were collected every 10 m, for a total of 32 samples, from which palynomorphs were recovered and processed by mean of the acetolysis technique. A total of 11,520 pollen-spores belonging to 156 taxa were recorded. The analysis allowed us to recognize regional, local and extra local taxa identified as pollinic signals. The regional signal was characterized by temperate elements mainly from the cloud forest. The local signal had a high species richness and included Asteraceae, Bursera morelensis, B. aptera, Euphorbiaceae, Ceiba aesculifolia and C. parvifolia from the tropical deciduous forest of El Picante hill; while the extra local signal was represented by Sapindaceae, Caryophyllaceae, Meliaceae and Ephedra spp. which are elements of both tropical deciduous forest and xerophytic shrubland. The comparison between palynological assemblages with the structure of the tropical deciduous forest indicated that Acaciella sp., Asteraceae, Bursera aptera, B. morelensis, Ceiba aesculifolia, C. parvifolia and Mimosa spp. are pollinic indicators of this type of vegetation.
Keywords: Palynology; Pollen; Spores; Semiarid vegetation; Tropical deciduous forest; Biosphere reserve, Actuopalynology
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
La lluvia de polen hace referencia a un periodo de acumulación temporal de palinomorfos en una región en particular y es una herramienta útil para conocer la representatividad de la composición florística de un tipo de vegetación en el espectro polínico como respuesta a la dispersión, depositación y transporte de polen-esporas (Collao-Alvarado et al., 2015; Ruiz-Zapata y García-Anton, 1987). Estudios actuales han documentado que el espectro polínico de la lluvia de polen está constituido por todos los granos de polen producidos y dispersados por las especies de una comunidad (autóctonos) en proporciones que pueden ser similares o diferentes a la composición florística de la vegetación original, así como polen acarreado de lugares aledaños (alóctonos) variando la relación polen-vegetación en espacio y tiempo (Chang-Martínez y Domínguez-Vázquez, 2013; Tejero-Diez et al., 1988).
Entre los factores ecológicos de mayor interés en los estudios de lluvia polínica se encuentra la dispersión; en el caso de las plantas con dispersión anemófila, producen grandes cantidades de granos de polen por lo que llegan a estar mejor representados en las asociaciones palinológicas que el polen de las plantas con dispersión zoófila (Osorio-Pascual y Quiroz-García, 2009). Además, existen otras variables que pueden modificar las frecuencias de cada taxón en la lluvia polínica como son el medio de deposición, la resistencia de la pared del polen (exina) a la degradación, el tamaño y las características particulares del sitio de muestreo y finalmente las características climáticas y ecológicas que controlan la floración (Escarraga-Paredes et al., 2014; Islebe et al., 2001; Lozano-García, 1984). Chang-Martínez y Domínguez-Vázquez (2013) proponen que debe existir una relación entre la lluvia de polen y las especies productoras de polen. Además, en otras investigaciones de tipo paleopalinológico y paleoecológico (Palacios-Chávez, 1977), se pretende entender cómo la vegetación actual se expresa en la lluvia de polen moderna de un área de estudio y emplear dichos resultados para interpretar los conjuntos paleopalinológicos e inferir la vegetación pasada en respuesta a las variaciones climáticas principalmente durante el Cenozoico (Escarraga-Paredes et al., 2014; Ramírez-Arriaga et al., 2014, 2017; Rosales-Torres et al., 2017; Webb, 1987).
En México, existen pocos trabajos de lluvia de polen relacionados con la extensión territorial y la diversidad de tipos de vegetación. De manera particular, hay estudios que incluyen en su análisis a la selva baja caducifolia (SBC) (Miranda y Hernández, 1963) o al bosque tropical caducifolio (BTC) (Rzedowski, 1978) y se han reportado en Sonora y Chihuahua. Ortega-Rosas et al. (2008) trabajaron en bosques templados, además de matorral y BTC; en esta última comunidad, los elementos importantes fueron Amaranthaceae, Asteraceae y Bursera laxiflora; en el norte de Nayarit y sur de Sinaloa, Jacobs (1982) estudió 5 tipos de vegetación (manglar, bosque espinoso, BTC, bosque subcaducifolio y bosque de pino) y reportó bajos porcentajes de Ceiba acuminata, Bombax palmeri, Bursera sp., Ipomoea arborescens, entre otros; en Chamela, Jalisco, Palacios-Chávez (1985) citó como importantes a Croton, Jatropha, Bursera y Amphipterygium en el BTC; en Michoacán, Chang-Martínez y Domínguez-Vázquez (2013) realizaron sus investigaciones en bosque de pino-encino, bosque mesófilo y SBC, en el diagrama polínico destacan Bombacaceae, Mimosoideae, Tiliaceae y Urticaceae; y por último, en 3 sitios con vegetación secundaria del BTC contiguos a la ciudad de Oaxaca, Osorio-Pascual y Quiroz-García (2009) destacan Amaranthaceae, Asteraceae y Bursera entre el polen recuperado. Sin embargo, faltan estudios en diversas regiones del país que generen información sobre la relación de la estructura y composición de la vegetación con la lluvia de polen actual. En ese sentido, una zona de gran interés es la región del valle de Tehuacán-Cuicatlán (VTC) ubicada en el suroeste de Puebla y el noroeste de Oaxaca la cual está incluida en la región xerofítica mexicana (Rzedowski, 1978). Este valle presenta entre 10 y 11.4% de la flora nacional y debido a sus características tanto bióticas como abióticas es reconocida como la zona árida y semiárida de Norteamérica con mayor riqueza biológica y con 13.9% de endemismo de su flora actual destacando las familias Cactaceae, Asteraceae, Fabaceae, Burseraceae, Bromeliaceae, Agavaceae y Poaceae, entre otras (Dávila et al., 2002; Valiente-Banuet et al., 2000, 2009). Con relación a su diversidad ecosistémica, Valiente-Banuet et al. (2000) reconocen al menos 29 asociaciones vegetales diferentes. Entre los tipos de vegetación de clima árido-seco más importantes por su extensión territorial en el VTC, así como su alta diversidad florística (Semarnat, 2013) predomina la selva baja caducifolia, la cual es el objeto de estudio del presente trabajo.
La SBC es una comunidad vegetal que se caracteriza por tener 2 condiciones contrastantes relacionadas con la estacionalidad, presentando 2 épocas bien marcadas: la de lluvia, en donde luce una fisionomía de exuberante verdor y muchas de las especies inician los procesos de floración y la época seca, en donde las plantas pierden su follaje y los procesos de fructificación son notorios (Rzedowski, 1978; Trejo-Vázquez, 1999). La SBC se presenta entre un rango de altitud de 0 a 1,900 m snm (Rzedowski, 1978). Florísticamente presenta una alta diversidad de especies, las familias Fabaceae y Burseraceae están bien representadas (Becerra, 2005). Estructuralmente, está conformada por 3 estratos: a) el arbóreo se caracteriza por árboles con alturas de 5 a 12 m con copas extendidas y generalmente con troncos verdes, amarillentos, glaucos y rojos que en su mayoría presentan cortezas brillantes y exfoliantes; b) el estrato arbustivo es en general muy denso y muchas especies presentan espinas, como algunas leguminosas (Acacia, Mimosa, entre otras) y c) el estrato herbáceo poco desarrollado en comparación con los mencionados anteriormente. La SBC también se puede enriquecer con especies tanto trepadoras como epífitas (principalmente bromeliáceas del género Tillandsia), así como de la presencia de cactáceas columnares y candelabriformes (Rzedowski, 1978; Trejo-Vázquez, 1999; Valiente-Banuet et al., 2009).
En el VTC se han reportado lluvias polínicas fósiles (Ramírez-Arriaga et al., 2014, 2017; Rosales-Torres et al., 2017), sin embargo, faltan estudios de lluvia de polen actual en las diferentes comunidades vegetales. Por lo anterior, el objetivo de este estudio es analizar la lluvia de polen de la SBC en el cerro El Picante de San José Tilapa, municipio de Coxcátlan, Puebla, ubicado en el VTC, para conocer y analizar la diversidad de los conjuntos de polen-esporas; diferenciar los taxones de la vegetación local, extra local y regional más representativos, los cuales son referidos como señales polínicas (Janssen, 1966); así como, comparar los resultados de los conjuntos palinológicos con la estructura y composición de la SBC realizado en los mismos transectos (Vasquez-Velasco, 2018) con la finalidad de establecer similitudes o diferencias y así, reconocer los indicadores polínicos de este tipo de vegetación.
Materiales y métodos
El estudio se realizó al sureste del VTC en el cerro El Picante (18°10’48”- 18°11’01” N, 97°04’52”- 97°04’39” O) entre 1,020 y 1,100 m snm, ubicado a 3 km al noroeste del camino de terracería a San Antonio Barranca Vigas, localidad de San José Tilapa, municipio de Coxcatlán, Puebla (fig. 1). De acuerdo con el sistema de clasificación de Köppen modificado por García (2004), el tipo de clima dominante es el seco o árido cálido con lluvias en verano [BS0(h´)w] marcado por la estacionalidad, las temperaturas anuales medias varían de 14 a 28 °C y la precipitación media anual varía de los 300 a los 1,100 mm en la época húmeda (INEGI, 2009; Olalde-Estrada et al., 2015). La comunidad vegetal dominante en la zona de estudio es la selva baja caducifolia, en cuya composición florística de acuerdo a Vasquez-Velasco (2018) en el estrato arbóreo destacan Acacia cochliacantha, Bursera aptera, B. morelensis, Bursera submoniliformis, Ceiba aesculifolia, Cyrtocarpa procera, Euphorbia schlechtendalii, Fouquieria formosa, Parkinsonia praecox, Plumeria rubra, Prosopis laevigata, Senna wislizeni y Ziziphus pedunculata, mientras que el estrato arbustivo está conformado principalmente por Acaciella angustissima, Acanthaceae, Aeschynomene sp., Asteraceae, Cordia curassavica, Croton sp., Lippia graveolens, Mimosa polyantha y Randia nelsonii. Finalmente, entre las rosetófilas y cactáceas se encuentran bien representados los géneros Agave sp., Hechtia sp., Opuntia sp., y las cactáceas columnares como Escontria chiotilla y Pachycereus weberi, entre otros.
Para el estudio de lluvia de polen en la SBC del cerro El Picante se establecieron 3 transectos, lo más recto posible de 100 m. En los transectos se recolectaron cada 10 m muestras de bromelias (de 3 a 4 plantas completas), principalmente de Tillandsia recurvata. En el primero de ellos, ubicado en la cima del cerro (transecto 1 con rango altitudinal de 1,086 a 1,088 m) se recolectaron 10 muestras y en los 2 transectos de las laderas sureste y noroeste del cerro se colectaron 11 muestras en cada uno de ellos ya que se consideró el punto cero: transecto 2 (1,059 a 1,077 m) y 3 (1,052 a 1,075 m). Un total de 32 muestras fueron colocadas de manera individual en bolsas de papel con sus respectivos datos de número y georreferenciación (fig. 2, tabla 1). Posteriormente, las muestras fueron trasladadas, registradas y procesadas por métodos convencionales (Montúfar, 1985; Palacios-Chávez, 1977) y empleando la técnica de acetólisis de Erdtman (1960), modificada por Martínez-Hernández (1970) en el laboratorio de palinología: Paleopalinología y Actuopalinología del Departamento de Paleontología en el Instituto de Geología, Universidad Nacional Autónoma de México. Por cada muestra se elaboraron 10 laminillas permanentes en gelatina glicerinada como medio de montaje. Las laminillas obtenidas se depositaron en la palinoteca del IG, con los números H-2133 a H-2164. Los análisis palinológicos se basaron en el conteo de 360 palinomorfos por muestra, y la determinación de los granos de polen se llevó a cabo con apoyo de la colección de referencia de la flora palinológica del área de estudio y literatura palinológica especializada (Demske et al., 2013; Gosling et al., 2013; Martínez-Hernández et al., 1993; Palacios-Chávez et al., 1991; Roubik y Moreno, 1991). Los conteos totales se incluyeron en una hoja de cálculo donde se obtuvo el porcentaje de cada taxón y los diagramas polínicos fueron elaborados en el programa Tilia versión 2.0.41 (Grimm, 1990). En el análisis de los resultados se destacan de manera puntual los porcentajes promedio (≥ 1%) de los taxones con base en diversos trabajos de lluvia de polen fósil (Ramírez-Arriaga et al., 2014, 2017; Rosales-Torres, 2016).
En relación con los parámetros estadísticos analizados, se consideraron: la riqueza (S), los índices de diversidad de Shannon-Wiener (H´), la equidad de Pielou (J´) y la similitud de Sørensen (Is), con el objetivo de comparar los resultados como se ha realizado con lluvias de polen fósil (Ramírez-Arriaga et al., 2014, 2017; Rosales-Torres et al., 2017). Se determinó la riqueza de taxones (S) como el número total de tipos polínicos registrados en cada muestra y/o transecto. Para evaluar la diversidad, se utilizó el índice de Shannon-Wiener (Shannon, 1948). Con base en los valores de diversidad se calcularon los valores de equidad utilizando el índice de equidad de Pielou (Pielou, 1977). La estimación de la riqueza, diversidad y equidad se calculó empleando el paquete estadístico MVSP 3.22 (Kovach, 2003). Para determinar la existencia de diferencias significativas entre los parámetros de los 3 transectos, se utilizó un análisis de varianza (Anova), y cuando los datos no cumplieron con los supuestos de normalidad y homocedasticidad, se usó el análisis de Kruskal Wallis; en ambos casos se usó el paquete NCSS 12 (NCSS 12 Statistical Software, 2018).
Para establecer la similitud en la composición de los taxones determinados entre los diferentes transectos se aplicó el índice cualitativo de Sørensen (1948):
Is = 2c / (a + b),
donde Is es el índice de Sørensen, a es el número de taxones encontrados en uno de los transectos a comparar, b es el número encontrado en el otro transecto comparado y c son los grupos taxonómicos comunes entre los transectos comparados. Por otra parte, se obtuvieron los grupos exclusivos y compartidos de cada transecto, para posteriormente ejemplificar los resultados en un diagrama de Venn (Bardou et al., 2014).
Se realizó un análisis CONISS, el cual es un análisis de conglomerados estratigráficamente restringido que sigue un método multivariado (incrementación constreñida de la suma de cuadrados) para la definición cuantitativa de zonas polínicas (Grimm, 1997). Para ello, con el programa Tilia 2.0.41 (Grimm, 1990), se realizó una matriz incluyendo el número total de granos de polen-esporas contabilizados excluyendo los indeterminados (Rosales-Torres, 2016), obteniendo un dendrograma como resultado.
Para determinar la existencia de grupos afines en cada uno de los transectos se realizó un análisis de correspondencia utilizando como variables discriminatorias las abundancias de cada uno de los taxones de cada transecto, empleando la chi cuadrada como medida de distancia y un método de normalización principal, obteniendo como resultado un diagrama de dispersión biespacial (biplot) de los taxones, permitiendo agruparlos por tipos de vegetación consultando diversos trabajos de vegetación (Campos-Villanueva y Villaseñor, 1995; López-Pérez et al., 2011; Rzedowski, 1978; Steinmann, 2009; Valiente-Banuet et al., 2009; Vasquez-Velasco, 2018; Villanueva-Almanza y Fonseca, 2011) y además interpretar su relación con los transectos (Jacinto-Pimienta et al., 2016). Este análisis se realizó con el paquete estadístico IBM SPSS Statistics 24.0 (IBM Corp., 2016).
Considerando los datos de presencia-ausencia de lluvia de polen y de vegetación basados en el método de cuadrantes centrados en un punto (Vasquez-Velasco, 2018), se calcularon 3 índices de Davis: el índice de asociación (A); el índice de sobrerrepresentación (O); así como el índice de subrepresentación (U), los cuales indican si se registraron de manera simultánea el polen y su planta asociada en el mismo transecto de la SBC (Davis, 1984; Hjelle, 1997; Islebe y Hooghiemstra, 1995) y se calcularon de la siguiente manera:
A = B0 / P0 + P1 + B0
O = P0 / P0 + B0
U = P1 / P1 + B0
donde B0 es el número de transectos donde están presentes tanto el tipo polínico como el grupo vegetal asociado; P0 representa el número de transectos donde se registra el polen, pero la planta que lo produce no está presente en la vegetación, y P1 es el número de transectos donde el tipo de polen está ausente, pero el taxón vegetal está presente en la vegetación. Según Fjordheim et al. (2018), los valores de los índices de cada taxón se agruparon en las siguientes categorias: 1) tipo fuertemente asociado “TFA” cuando A > 0.65; 2) tipo asociado “TA”, cuando A varía entre 0.65 y 0.5; 3) tipo débilmente asociado “TDA”, donde A < 0.5 y además O y U son positivos; 4) tipo sobrerrepresentado “TOR”, cuando A < 0.5 y U = 0; 5) tipo subrepresentado “TUR”, con A < 0.5 y O = 0, y 6) tipo no asociado “TNA”, en donde A = 0, además O y U son positivos.
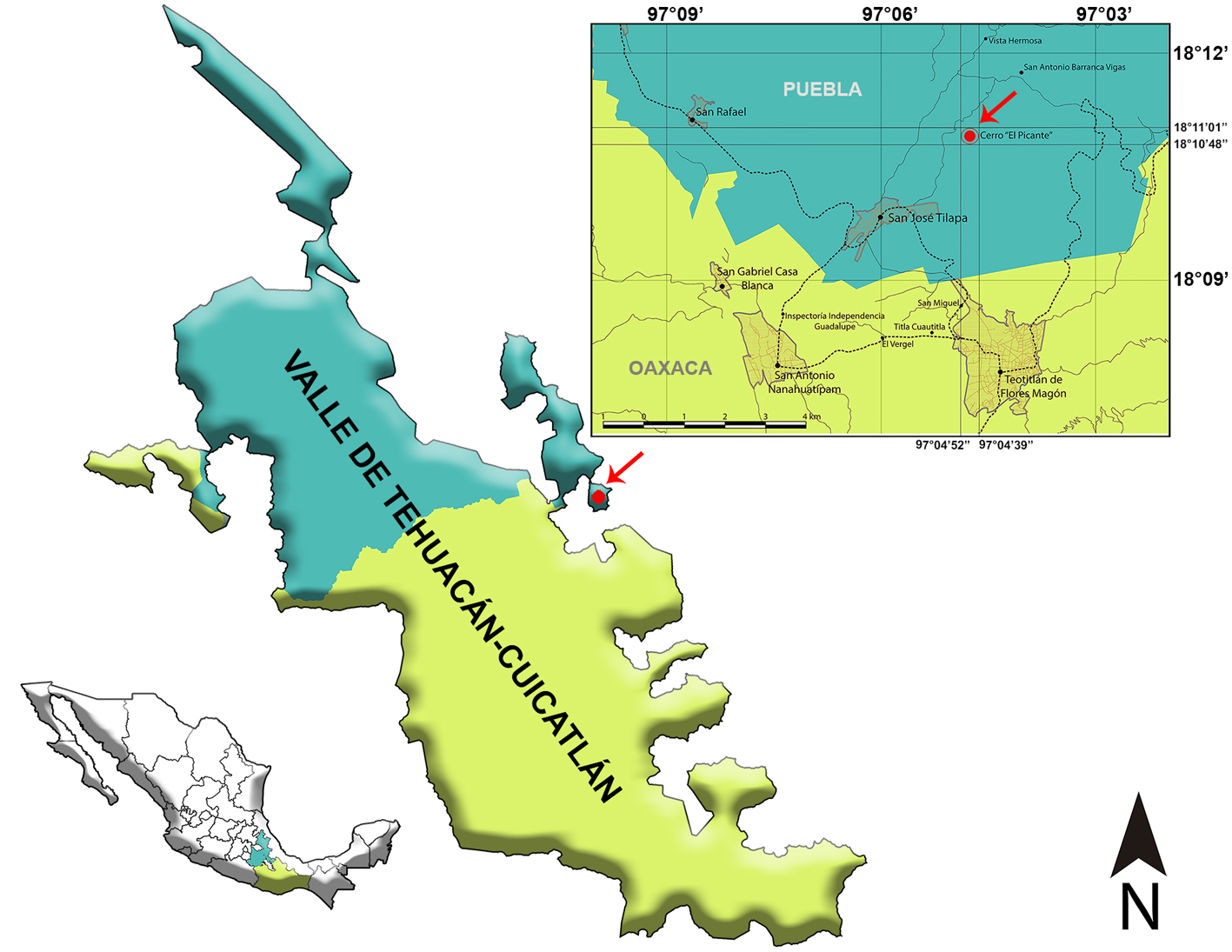
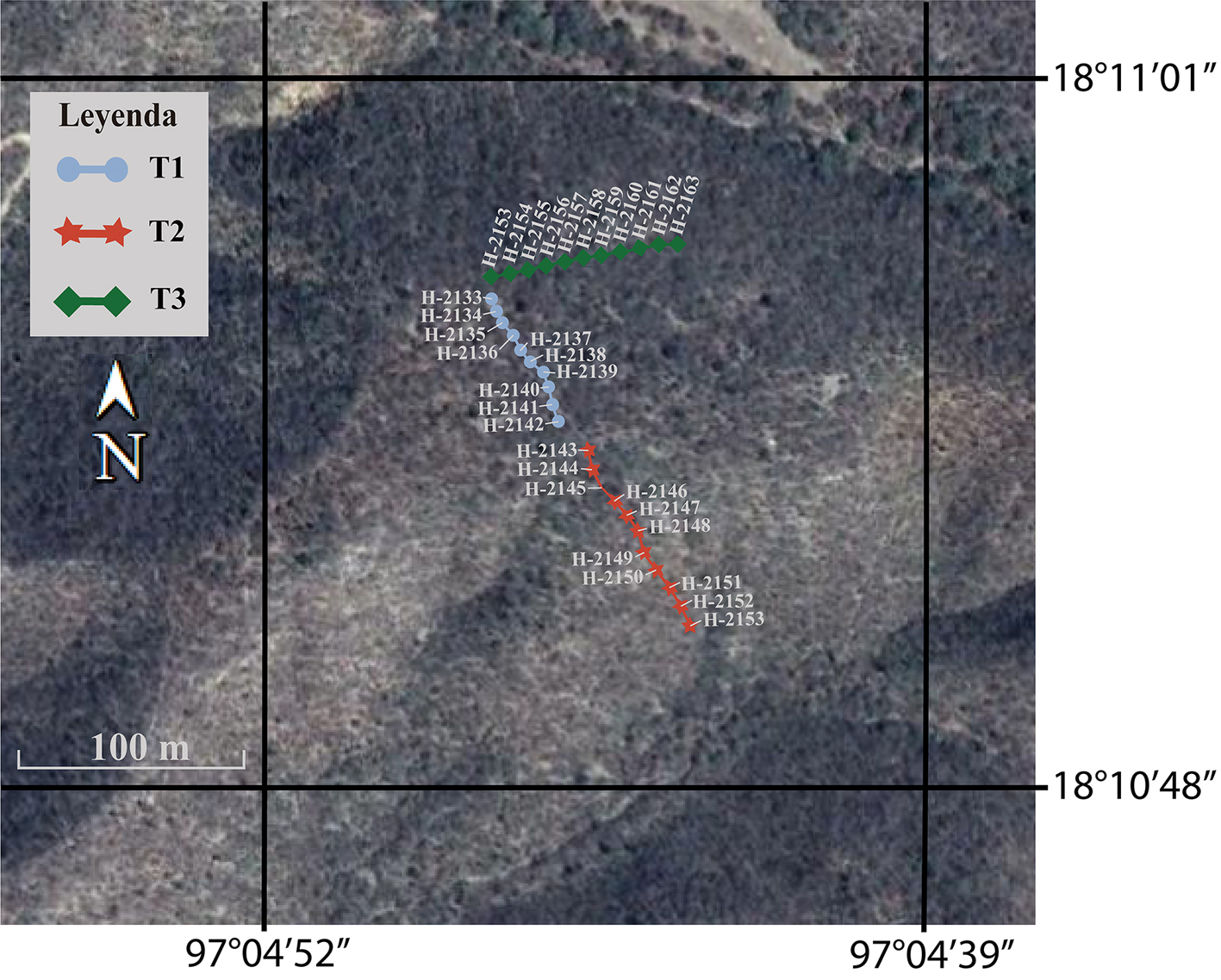
Tabla 1
Listado palinoflorístico y conteos registrados en la lluvia de polen de la selva baja caducifolia en el cerro El Picante, San José Tilapa, Puebla, valle de Tehuacán-Cuicatlán.
|
Tabla 1 Continuación. |
||||||||||||||||||||||||||||||||
|
Transecto 1 |
Transecto 2 |
Transecto 3 |
||||||||||||||||||||||||||||||
|
Taxón |
H-2133 |
H-2134 |
H-2135 |
H-2136 |
H-2137 |
H-2138 |
H-2139 |
H-2140 |
H-2141 |
H-2142 |
H-2143 |
H-2144 |
H-2145 |
H-2146 |
H-2147 |
H-2148 |
H-2149 |
H-2150 |
H-2151 |
H-2152 |
H-2153 |
H-2154 |
H-2155 |
H-2156 |
H-2157 |
H-2158 |
H-2159 |
H-2160 |
H-2161 |
H-2162 |
H-2163 |
H-2164 |
|
Altitud (m snm) |
1086 |
1086 |
1086 |
1087 |
1087 |
1087 |
1088 |
1088 |
1088 |
1087 |
1077 |
1075 |
1072 |
1071 |
1070 |
1069 |
1065 |
1064 |
1061 |
1060 |
1059 |
1075 |
1073 |
1071 |
1069 |
1066 |
1063 |
1060 |
1058 |
1056 |
1053 |
1052 |
|
|
Transecto 1 |
Transecto 2 |
Transecto 3 |
|||||||||||||||||||||||||||||
|
Taxón |
H-2133 |
H-2134 |
H-2135 |
H-2136 |
H-2137 |
H-2138 |
H-2139 |
H-2140 |
H-2141 |
H-2142 |
H-2143 |
H-2144 |
H-2145 |
H-2146 |
H-2147 |
H-2148 |
H-2149 |
H-2150 |
H-2151 |
H-2152 |
H-2153 |
H-2154 |
H-2155 |
H-2156 |
H-2157 |
H-2158 |
H-2159 |
H-2160 |
H-2161 |
H-2162 |
H-2163 |
H-2164 |
|
Altitud (m snm) |
1086 |
1086 |
1086 |
1087 |
1087 |
1087 |
1088 |
1088 |
1088 |
1087 |
1077 |
1075 |
1072 |
1071 |
1070 |
1069 |
1065 |
1064 |
1061 |
1060 |
1059 |
1075 |
1073 |
1071 |
1069 |
1066 |
1063 |
1060 |
1058 |
1056 |
1053 |
1052 |
|
Angiospermas |
||||||||||||||||||||||||||||||||
|
Magnoliopsida (67) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Acacia spp. (Aca) |
1 |
0 |
0 |
1 |
4 |
1 |
1 |
1 |
0 |
6 |
2 |
4 |
3 |
0 |
3 |
1 |
0 |
0 |
2 |
1 |
1 |
1 |
5 |
2 |
2 |
3 |
3 |
0 |
1 |
0 |
2 |
1 |
|
Acaciella sp. (Aci) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
4 |
5 |
5 |
4 |
6 |
5 |
5 |
3 |
2 |
4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Acanthaceae (Acaae) |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Alfaroa-Engelhardtia-Oreomunnea (AEO) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
0 |
1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Alnus sp. tetraporado (Aln4) |
25 |
12 |
22 |
25 |
16 |
22 |
17 |
14 |
24 |
10 |
26 |
17 |
18 |
19 |
14 |
25 |
19 |
23 |
17 |
24 |
18 |
25 |
21 |
23 |
21 |
12 |
16 |
13 |
18 |
28 |
24 |
25 |
|
Alnus sp. pentaporado (Aln5) |
50 |
69 |
58 |
48 |
59 |
34 |
50 |
47 |
64 |
45 |
66 |
51 |
67 |
68 |
73 |
74 |
68 |
67 |
62 |
50 |
53 |
55 |
45 |
45 |
59 |
46 |
52 |
46 |
55 |
64 |
65 |
47 |
|
Alnus sp. hexaporado (Aln6) |
0 |
1 |
1 |
0 |
0 |
0 |
2 |
0 |
1 |
2 |
0 |
0 |
1 |
0 |
2 |
4 |
0 |
0 |
2 |
1 |
0 |
2 |
2 |
1 |
1 |
3 |
1 |
1 |
3 |
3 |
2 |
1 |
|
Amaranthaceae-Chenopodiaceae (AmCae) |
12 |
20 |
6 |
15 |
8 |
3 |
9 |
23 |
14 |
8 |
8 |
16 |
11 |
6 |
12 |
14 |
23 |
10 |
9 |
18 |
9 |
9 |
9 |
19 |
6 |
10 |
8 |
5 |
6 |
4 |
10 |
27 |
|
Anacardiaceae (Anaae) |
6 |
3 |
1 |
6 |
5 |
14 |
5 |
1 |
1 |
1 |
2 |
3 |
2 |
1 |
4 |
6 |
1 |
2 |
4 |
1 |
5 |
3 |
3 |
1 |
5 |
2 |
4 |
0 |
6 |
3 |
4 |
2 |
|
Annonaceae (Annae) |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
2 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Asteraceae (Astae) |
51 |
13 |
23 |
28 |
19 |
23 |
17 |
21 |
24 |
73 |
17 |
22 |
19 |
39 |
18 |
16 |
25 |
29 |
16 |
34 |
24 |
21 |
31 |
32 |
34 |
38 |
30 |
26 |
39 |
40 |
23 |
36 |
|
Betulaceae (Betae) |
4 |
1 |
3 |
6 |
2 |
3 |
2 |
1 |
0 |
0 |
0 |
1 |
1 |
1 |
0 |
1 |
1 |
0 |
1 |
0 |
1 |
3 |
2 |
3 |
5 |
3 |
4 |
1 |
3 |
6 |
1 |
4 |
|
Bursera aptera (Bura) |
4 |
3 |
2 |
11 |
5 |
4 |
4 |
3 |
6 |
3 |
5 |
3 |
3 |
5 |
0 |
3 |
4 |
2 |
4 |
0 |
5 |
30 |
18 |
16 |
14 |
23 |
24 |
23 |
8 |
7 |
5 |
6 |
|
Bursera morelensis (Burm) |
9 |
11 |
25 |
34 |
15 |
48 |
27 |
17 |
24 |
33 |
52 |
27 |
44 |
19 |
65 |
44 |
42 |
53 |
54 |
39 |
29 |
12 |
4 |
1 |
3 |
5 |
6 |
3 |
5 |
4 |
1 |
0 |
|
Bursera submoniliformis (Burs) |
1 |
0 |
2 |
5 |
0 |
1 |
3 |
0 |
0 |
2 |
4 |
5 |
4 |
2 |
3 |
1 |
0 |
0 |
2 |
1 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
0 |
1 |
2 |
0 |
|
Cactaceae (Cacae) |
0 |
0 |
3 |
0 |
0 |
0 |
3 |
1 |
0 |
0 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
2 |
0 |
0 |
1 |
1 |
0 |
1 |
0 |
0 |
1 |
1 |
|
Cannabaceae (Canae) |
6 |
1 |
0 |
4 |
2 |
3 |
0 |
1 |
3 |
2 |
6 |
5 |
3 |
1 |
2 |
8 |
11 |
5 |
5 |
7 |
2 |
2 |
4 |
4 |
5 |
3 |
1 |
2 |
2 |
1 |
3 |
0 |
|
Capparis sp. (Cap) |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Carpinus sp. (Car) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
|
Carya sp. (Cay) |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Caryophyllaceae (Carae) |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Ceiba aesculifolia (Ceia) |
12 |
15 |
7 |
9 |
6 |
14 |
6 |
4 |
2 |
4 |
1 |
2 |
2 |
0 |
3 |
0 |
1 |
1 |
0 |
1 |
8 |
0 |
2 |
2 |
2 |
6 |
3 |
1 |
4 |
0 |
8 |
13 |
|
Ceiba parvifolia (Ceip) |
7 |
4 |
7 |
14 |
16 |
22 |
20 |
6 |
1 |
7 |
0 |
1 |
3 |
4 |
3 |
1 |
4 |
5 |
2 |
3 |
1 |
3 |
9 |
3 |
1 |
0 |
0 |
1 |
2 |
1 |
0 |
7 |
|
Ceiba sp. (Cei) |
0 |
0 |
4 |
2 |
8 |
7 |
0 |
0 |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Cleome sp. (Cle) |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Cordia sp. (Cor) |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
|
Croton spp. (Cro) |
0 |
2 |
0 |
1 |
0 |
0 |
0 |
2 |
3 |
0 |
2 |
1 |
0 |
1 |
0 |
2 |
0 |
1 |
0 |
0 |
0 |
2 |
0 |
3 |
2 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Cupania sp. (Cup) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Cyrtocarpa procera (Cyrp) |
0 |
2 |
0 |
0 |
0 |
3 |
2 |
1 |
0 |
0 |
5 |
11 |
3 |
5 |
0 |
0 |
0 |
2 |
3 |
1 |
3 |
3 |
0 |
1 |
1 |
1 |
0 |
1 |
0 |
0 |
0 |
0 |
|
Dalea sp. (Dal) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
4 |
1 |
2 |
0 |
2 |
2 |
1 |
1 |
0 |
0 |
1 |
|
Euphorbiaceae (Eupae) |
4 |
5 |
3 |
10 |
11 |
8 |
8 |
3 |
15 |
7 |
1 |
10 |
9 |
5 |
6 |
0 |
7 |
4 |
8 |
4 |
4 |
8 |
6 |
6 |
8 |
4 |
10 |
3 |
7 |
3 |
6 |
5 |
|
Fabaceae (Fabae) |
1 |
2 |
2 |
4 |
1 |
5 |
4 |
6 |
5 |
7 |
3 |
4 |
6 |
4 |
5 |
3 |
7 |
4 |
8 |
6 |
9 |
8 |
6 |
7 |
7 |
5 |
7 |
7 |
4 |
4 |
4 |
4 |
|
Fouquieria formosa (Fouf) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
6 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
0 |
0 |
1 |
1 |
1 |
0 |
0 |
1 |
0 |
0 |
2 |
0 |
3 |
0 |
|
Fraxinus sp. (Fra) |
9 |
3 |
3 |
5 |
6 |
3 |
6 |
14 |
1 |
1 |
10 |
13 |
0 |
6 |
7 |
3 |
1 |
2 |
3 |
6 |
1 |
4 |
1 |
5 |
2 |
2 |
2 |
1 |
8 |
4 |
1 |
2 |
|
Gomphrena sp. (Gom) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
0 |
0 |
1 |
|
Hedyosmum sp. (Hed) |
24 |
3 |
6 |
15 |
12 |
11 |
12 |
9 |
8 |
6 |
9 |
11 |
9 |
11 |
8 |
6 |
9 |
6 |
6 |
3 |
3 |
6 |
4 |
4 |
1 |
1 |
8 |
2 |
8 |
4 |
6 |
4 |
|
Heliocarpus spp. (Hel) |
3 |
0 |
2 |
0 |
2 |
0 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
3 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
|
Ilex sp. (Ile) |
0 |
4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
|
Juglans sp. (Jug) |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
1 |
0 |
1 |
1 |
0 |
0 |
0 |
1 |
0 |
0 |
|
Lamiaceae (Lamae) |
0 |
0 |
1 |
0 |
1 |
0 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
0 |
2 |
0 |
1 |
0 |
1 |
1 |
1 |
0 |
1 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
1 |
1 |
|
Lauraceae (Lauae) |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Liquidambar sp. (Liq) |
0 |
1 |
1 |
4 |
2 |
1 |
2 |
5 |
1 |
0 |
2 |
1 |
0 |
1 |
4 |
2 |
1 |
0 |
0 |
3 |
6 |
4 |
3 |
2 |
0 |
0 |
0 |
1 |
7 |
0 |
1 |
1 |
|
Malpighiaceae (Malpae) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
|
Malvaceae (Malvae) |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Meliaceae (Melae) |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
|
Mimosa spp. (Mim) |
0 |
1 |
1 |
0 |
0 |
0 |
2 |
0 |
1 |
4 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
2 |
12 |
20 |
9 |
6 |
5 |
2 |
0 |
4 |
4 |
7 |
|
Moraceae (Morae) |
2 |
8 |
7 |
4 |
6 |
3 |
4 |
3 |
2 |
4 |
0 |
0 |
5 |
1 |
0 |
0 |
0 |
1 |
4 |
3 |
3 |
6 |
13 |
6 |
3 |
13 |
18 |
10 |
12 |
20 |
8 |
8 |
|
Myrtaceae (Myrae) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
1 |
0 |
0 |
0 |
|
Onagraceae (Onaae) |
1 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
|
Opuntia sp. (Opu) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Parkinsonia praecox (Parp) |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
5 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
1 |
0 |
3 |
20 |
6 |
2 |
3 |
1 |
1 |
0 |
0 |
0 |
0 |
|
Phithecellobium sp. (Phi) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Polygonum sp. (Pol) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
|
Quercus spp. (Que) |
38 |
70 |
50 |
29 |
43 |
40 |
36 |
48 |
60 |
29 |
47 |
53 |
64 |
50 |
49 |
46 |
54 |
60 |
57 |
43 |
51 |
43 |
49 |
39 |
47 |
69 |
58 |
75 |
49 |
61 |
70 |
51 |
|
Rhamnaceae (Rhaae) |
0 |
0 |
0 |
1 |
2 |
4 |
0 |
0 |
0 |
4 |
1 |
1 |
1 |
1 |
2 |
0 |
0 |
0 |
2 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Rosaceae (Rosae) |
0 |
0 |
2 |
0 |
0 |
0 |
1 |
1 |
0 |
1 |
0 |
3 |
1 |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
2 |
2 |
1 |
1 |
3 |
0 |
4 |
1 |
1 |
6 |
1 |
0 |
|
Rubiaceae (Rubae) |
0 |
0 |
0 |
0 |
2 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
0 |
0 |
0 |
1 |
1 |
0 |
0 |
6 |
2 |
0 |
2 |
2 |
2 |
|
Rumex sp. (Rum) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Rutaceae (Rutae) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Salix spp. (Sal) |
0 |
2 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
|
Sapindaceae (Sapiae) |
2 |
8 |
4 |
2 |
5 |
2 |
2 |
4 |
1 |
4 |
3 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
0 |
5 |
3 |
3 |
0 |
1 |
4 |
2 |
|
Sapotaceae (Sapoae) |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
0 |
|
Senna spp. (Sen) |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
4 |
2 |
2 |
1 |
2 |
2 |
0 |
1 |
|
Sterculiaceae (Steae) |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Tiliaceae (Tilae) |
1 |
0 |
0 |
1 |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
0 |
|
Urticaceae (Urtae) |
1 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
3 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
7 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
0 |
0 |
|
Verbenaceae (Verae) |
0 |
0 |
2 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
2 |
1 |
1 |
4 |
1 |
0 |
3 |
1 |
1 |
3 |
1 |
|
Liliopsida (9) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Agavaceae (Agaae) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
|
Araceae (Araae) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Arecaceae (Areae) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Cyperaceae (Cypae) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Liliaceae (Lilae) |
2 |
1 |
0 |
0 |
0 |
1 |
0 |
1 |
3 |
1 |
1 |
0 |
0 |
2 |
1 |
1 |
1 |
0 |
1 |
0 |
2 |
3 |
1 |
0 |
1 |
0 |
0 |
2 |
1 |
1 |
3 |
0 |
|
Poaceae (Poaae) |
10 |
6 |
8 |
15 |
9 |
15 |
15 |
10 |
14 |
13 |
10 |
6 |
14 |
16 |
11 |
15 |
11 |
10 |
6 |
12 |
14 |
18 |
23 |
27 |
48 |
26 |
32 |
63 |
30 |
23 |
17 |
19 |
|
Smilacaceae (Smiae) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Sparganiaceae (Spaae) |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
5 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Tillandsia spp. (Til) |
0 |
0 |
0 |
2 |
0 |
2 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
2 |
1 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
2 |
10 |
|
Gimnospermas (4) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Abies sp. (Abi) |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
1 |
|
Cupressus-Juniperus-Taxodium (CJT) |
21 |
5 |
9 |
11 |
14 |
7 |
19 |
25 |
6 |
9 |
7 |
10 |
13 |
17 |
11 |
11 |
8 |
11 |
6 |
18 |
13 |
15 |
13 |
8 |
3 |
16 |
8 |
3 |
18 |
14 |
12 |
14 |
|
Ephedra spp. (Eph) |
0 |
0 |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
|
Pinus spp. (Pin) |
26 |
66 |
62 |
23 |
47 |
29 |
43 |
44 |
41 |
34 |
34 |
40 |
22 |
40 |
19 |
44 |
34 |
40 |
54 |
38 |
39 |
33 |
23 |
43 |
33 |
21 |
16 |
33 |
33 |
17 |
37 |
25 |
|
Pteridofitas |
||||||||||||||||||||||||||||||||
|
Monoletes (3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Elaphoglossum sp. (Ela) |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
|
Polypodium spp. (Poly) |
2 |
0 |
1 |
3 |
4 |
3 |
4 |
0 |
4 |
1 |
3 |
4 |
1 |
1 |
1 |
2 |
2 |
2 |
1 |
2 |
4 |
0 |
0 |
0 |
1 |
2 |
3 |
1 |
3 |
1 |
3 |
5 |
|
Thelypteridaceae (Theae) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Triletes (3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cyatheaceae (Cyaae) |
0 |
1 |
0 |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
|
Selaginella sp. (Sel) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
0 |
0 |
2 |
0 |
1 |
4 |
1 |
0 |
1 |
1 |
0 |
|
Selaginella sp. (tétrada) (Selt) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
11 |
0 |
0 |
1 |
1 |
0 |
0 |
1 |
0 |
1 |
1 |
4 |
|
Indeterminados |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tetrabrevicolpado tectado perforado (Ttp) |
12 |
7 |
11 |
10 |
8 |
7 |
13 |
5 |
12 |
7 |
13 |
15 |
11 |
18 |
17 |
13 |
12 |
8 |
6 |
12 |
8 |
5 |
12 |
8 |
6 |
9 |
7 |
4 |
9 |
8 |
5 |
8 |
|
Magnoliopsida (50 tipos) |
5 |
5 |
13 |
6 |
8 |
11 |
13 |
11 |
12 |
12 |
8 |
9 |
8 |
7 |
5 |
5 |
5 |
6 |
5 |
6 |
8 |
8 |
6 |
5 |
6 |
5 |
7 |
5 |
1 |
8 |
3 |
5 |
|
Liliopsida (6 tipos) |
1 |
0 |
0 |
0 |
0 |
1 |
2 |
1 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
2 |
0 |
0 |
0 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
0 |
3 |
1 |
2 |
1 |
0 |
|
Monoletes (9 tipos) |
0 |
0 |
1 |
1 |
2 |
0 |
2 |
1 |
2 |
2 |
1 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
2 |
1 |
1 |
1 |
2 |
3 |
2 |
0 |
5 |
5 |
1 |
|
Triletes (4 tipos) |
3 |
1 |
1 |
1 |
2 |
1 |
0 |
1 |
0 |
2 |
0 |
1 |
0 |
2 |
1 |
0 |
1 |
0 |
1 |
1 |
1 |
1 |
2 |
2 |
3 |
0 |
0 |
0 |
2 |
1 |
0 |
1 |
|
Total |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
360 |
Resultados
Un total de 11,520 granos de polen-esporas fueron contados de las 32 muestras de lluvia de polen analizadas de los 3 transectos de la selva baja caducifolia.
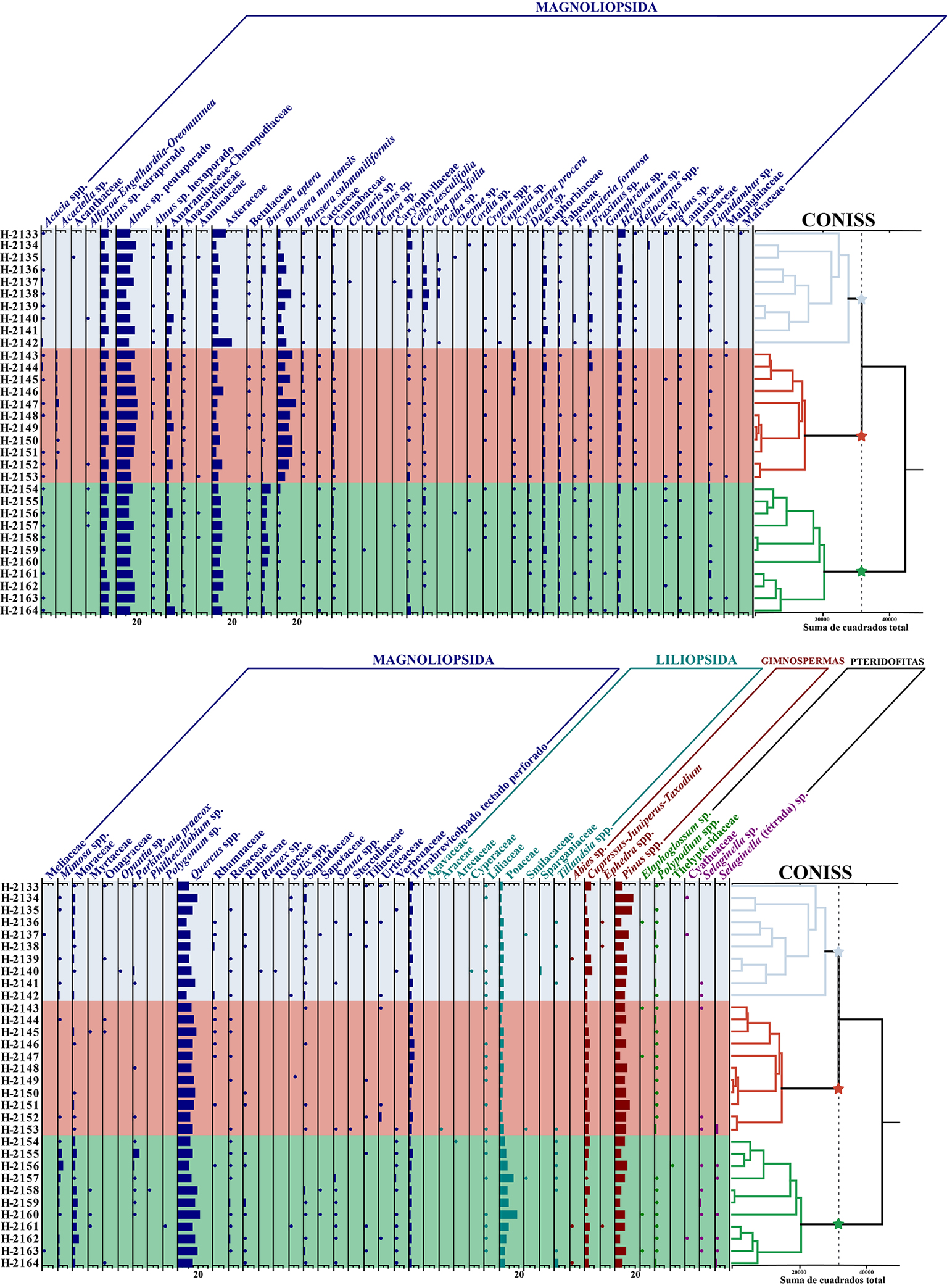
En el espectro polínico general de la lluvia de polen de la selva baja caducifolia del cerro El Picante se registró un total de 156 tipos polínicos, de los cuales 86 se determinaron a nivel de especie (n = 8), género (n = 39) y familia (n = 39) (tabla 1): 76 angiospermas (67 Magnoliopsida; 9 Liliopsida), 4 gimnospermas y 6 pteridofitas (figs. 3-5). Los tipos más representativos fueron elementos regionales templados que crecen en las serranías que bordean al VTC como Alnus sp. pentaporado (15.6%), Quercus spp. (14.1%) y Pinus spp. (9.8%), además de taxones locales presentes en o cerca de los puntos de muestreo dentro de la SBC, como Asteraceae (7.8%), Bursera morelensis (6.6%), B. aptera (2.2%), Euphorbiaceae (1.7%), Ceiba parvifolia (1.2%) y C. aesculifolia (1.2%). Otros elementos extralocales/regionales como Alnus sp. tetraporado, Poaceae, Cupressus–Juniperus–Taxodium, Amaranthaceae-Chenopodiaceae, elemento indeterminado (tetrabrevicolpado tectado perforado), Hedyosmum sp., Moraceae, Fabaceae y Fraxinus sp., mostraron porcentajes promedio de entre 1 y 10%, mientras que el resto estuvo por debajo del 1% (fig. 6). A continuación, se describen los conjuntos polínicos recuperados de cada transecto.
Primer transecto. En las 10 muestras del transecto 1 (H-2133 a H-2142) se obtuvo un total de 115 taxones, 74 de ellos fueron determinados (tabla 1); la riqueza dentro de las muestras varió de 38 a 48, el índice de diversidad se registró entre 2.653 y 3.121, mientras que el valor de equidad varió entre 0.729 y 0.835 (fig. 7). Los taxones más abundantes fueron: Alnus sp. pentaporado (9.4-19.2%; x = 14.6%), Quercus spp. (8.1-19.4%; x = 12.3%) y Pinus spp. (6.4-18.3%; x = 11.5%). Otros taxones comunes, fueron: Asteraceae (3.6-20.3%; x = 8.1%), Bursera morelensis (2.5-13.3%; x = 6.8%), Alnus sp. tetraporado (2.8-6.9%; x = 5.2%), Cupressus–Juniperus–Taxodium (1.4-6.9%; x = 3.5%), Amaranthaceae-Chenopodiaceae (0.8-6.4%; x = 3.3%), Poaceae (1.7-4.2; x = 3.2%), Hedyosmum sp. (0.8-6.7%; x = 2.9%), Ceiba parvifolia (0.3-6.1%; x = 2.9%), elemento indeterminado (tetrabrevicolpado tectado perforado) (1.4-3.6%; x = 2.6%), C. aesculifolia (0.6-4.2; x = 2.2%), Euphorbiaceae (0.8-4.2%; x = 2.1%), Fraxinus sp. (0.3-3.9%; x = 1.4%), Bursera aptera (0.6-3.1%; x = 1.3%), Anacardiaceae (0.3-3.9%; x = 1.2%), Moraceae (0.6-2.2%; x = 1.2%) y Fabaceae (0.3-1.9%; x = 1%). El resto, como Sapindaceae, Ceiba sp., Betulaceae, Cannabaceae, Polypodium spp., Liquidambar sp., Acacia spp., B. submoniliformis, Rhamnaceae, Heliocarpus spp., Mimosa spp., Liliaceae, Croton spp., Cyrtocarpa procera, Alnus sp. hexaporado, Cactaceae, Fouquieria formosa, Parkinsonia praecox, Salix spp., Sparganiaceae, Rosaceae, Urticaceae, Tillandsia spp., Ilex sp., Lamiaceae, Tiliaceae, Cupania sp., Dalea sp., Rubiaceae, Verbenaceae, Cyatheaceae, Cordia sp., Lauraceae, Onagraceae, Rumex sp., Senna spp., Ephedra spp., Selaginella sp., Acanthaceae, Alfaroa–Engelhardtia–Oreomunnea, Annonaceae, Cuadrella sp., Carya sp., Caryophyllaceae, Cleome sp., Juglans sp., Malpighiaceae, Malvaceae, Meliaceae, Opuntia sp., Rutaceae, Sapotaceae, Sterculiaceae, Cyperaceae, Abies sp. y Elaphoglossum sp., presentaron porcentajes promedios menores a 1% (fig. 6).
Segundo transecto. Se reconocieron 88 taxones en total en las 11 muestras analizadas (H-2143 a H-2153), 58 de ellos determinados (tabla 1). La riqueza varió de 31 a 52, el índice de diversidad varió de 2.566 a 3.071, mientras que el valor de equidad de 0.736 a 0.797 (fig. 7). Los grupos más representativos de este transecto, con los porcentajes promedio mayores a 10% fueron: Alnus sp. pentaporado (13.9-20.6%; x = 17.7%), Quercus spp. (11.9-17.8%; x = 14.5%), B. morelensis (5.3-18.1%; x = 11.8%) y Pinus spp. (5.3-15.0%; x = 10.2%). Por otra parte, los grupos frecuentes registrados con porcentajes promedio menores a 10% pero mayores a 1% fueron: Asteraceae (4.4-10.8%; x = 6.5%), Alnus sp. tetraporado (3.9-7.2%; x = 5.6%), Amaranthaceae-Chenopodiaceae (1.7-6.4%; x = 3.4%), elemento indeterminado (tetrabrevicolpado tectado perforado) (1.7-5.0%; x = 3.4%), Cupressus–Juniperus–Taxodium (1.7-5.0%; x = 3.2%), Poaceae (1.7-4.4%; x = 3.2%), Hedyosmum sp. (0.8-3.1%; x = 2%), Fabaceae (0.8-2.5%; x = 1.5%), Euphorbiaceae (0.3-2.8%; x = 1.5%), Cannabaceae (0.3-3.1%; x = 1.4%), Fraxinus sp. (0.3-3.6%; x = 1.3%) y Acaciella sp. (0.8-1.7%; x = 1.1%). Los otros taxones con proporciones promedio menores a 1% fueron: Bursera aptera, Cyrtocarpa procera, Anacardiaceae, Ceiba parvifolia, B. submoniliformis, Polypodium spp., Liquidambar sp., C. aesculifolia, Acacia spp., Moraceae, Selaginella sp. (tétrada), Alnus sp. hexaporado, Urticaceae, Heliocarpus spp., Lamiaceae, Liliaceae, Rhamnaceae, Rosaceae, Betulaceae, Croton spp., Sapindaceae, Cactaceae, Fouquieria formosa, Malpighiaceae, Selaginella sp., Dalea sp., Juglans sp., Mimosa spp., Myrtaceae, Onagraceae, Parkinsonia praecox, Rubiaceae, Tiliaceae, Smilacaceae, Elaphoglossum sp., Alfaroa–Engelhardtia–Oreomunnea, Annonaceae, Cordia sp., Senna spp., Sterculiaceae, Verbenaceae, Araceae y Tillandsia spp. (fig. 6).
Tercer transecto. Se analizaron 11 muestras (H-2154 a H-2164), con un total de 117 tipos polínicos, de los cuales 71 fueron determinados (tabla 1), registrándose entre 41 y 50 taxones; en tanto que, el índice de diversidad calculado varió de 2.704 a 3.100 y la equidad entre 0.702 y 0.807 (fig. 7). Los taxones más abundantes que alcanzaron valores promedio mayores a 10% fueron Quercus spp. (10.8-20.8%; x = 15.4%) y Alnus sp. pentaporado (12.5-18.1%; x = 14.6%), seguidos de elementos frecuentes como: Asteraceae (5.8-11.1%; x = 8.8%), Poaceae (4.7-17.5%; x = 8.2%), Pinus spp. (4.4-11.9%; x = 7.9%), Alnus sp. tetraporado (3.3-7.8%; x = 5.7%), Bursera aptera (1.4-8.3%; x = 4.4%), Cupressus–Juniperus–Taxodium (0.8-5.0%; x = 3.1%), Moraceae (0.8-5.6%; x = 3%), Amaranthaceae-Chenopodiaceae (1.1-7.5%; x = 2.9%), elemento indeterminado (tetrabrevicolpado tectado perforado) (1.1-3.3%; x = 2%), Mimosa spp. (0.6-5.6%; x = 1.8%), Euphorbiaceae (0.8-2.8%; x = 1.7%), Fabaceae (1.1-2.2%; x = 1.6%), Hedyosmum sp. (0.3-2.2%; x = 1.2%), B. morelensis (0.3-3.3%; x = 1.1%) y Ceiba aesculifolia (0.3-3.6%; x = 1%). Los taxones menos abundantes (valores promedio menores a 1%) fueron: Parkinsonia praecox, Betulaceae, Anacardiaceae, Fraxinus sp., Cannabaceae, C. parvifolia, Acacia spp., Alnus sp. hexaporado., Rosaceae, Liquidambar sp., Polypodium spp., Sapindaceae, Verbenaceae, Tillandsia spp., Rubiaceae, Dalea sp., Senna spp., Liliaceae, Selaginella spp., Croton spp., Fouquieria formosa, Cactaceae, Cyrtocarpa procera, B. submoniliformis, Juglans sp., Heliocarpus spp., Lamiaceae, Alfaroa–Engelhardtia–Oreomunnea, Annonaceae, Gomphrena sp., Myrtaceae, Tiliaceae, Arecaceae, Cordia sp., Onagraceae, Sapotaceae, Urticaceae, Abies sp., Elaphoglossum sp., Carpinus sp., Caryophyllaceae, Cleome sp., Ilex sp., Malpighiaceae, Meliaceae, Phithecellobium sp., Polygonum sp., Rhamnaceae, Salix spp., Agavaceae, Smilacaceae, Ephedra spp., Thelypteridaceae y Cyatheaceae (fig. 6).
En general, en la selva baja caducifolia se obtuvo una riqueza alta (S = 156) y de acuerdo con los promedios de cada transecto, se observó que el tercer transecto fue el que presentó la mayor riqueza polínica (x = 45.64), seguido del primero (x = 42.20), en tanto que el segundo fue el que presentó menor riqueza (x = 38.64). Asimismo, comparando los promedios de los 3 transectos, se confirmó que la riqueza sí varió significativamente entre ellos (p = 0.003) (fig. 7). Por otra parte, los valores máximo y mínimo de H´ fueron 2.566 y 3.121 respectivamente, además, comparando los promedios del transecto 1 (x = 2.964), 2 (x = 2.787) y 3 (x = 2.956), se observó el mismo patrón (Anova, p = 008; fig. 7). En cuanto a la equidad, el valor mínimo obtenido fue de J´= 0.702, lo que nos indica que, en general, los valores de este índice resultaron ser altos concluyendo que los taxones registrados en los 3 transectos tendieron a la homogeneidad. De igual manera, comparando los promedios de los valores del índice de equidad de Pielou (x = 0.792, 0.764, 0.774), se observó que hubo pequeñas variaciones pero no existieron diferencias significativas (p = 0.131) (fig. 7).
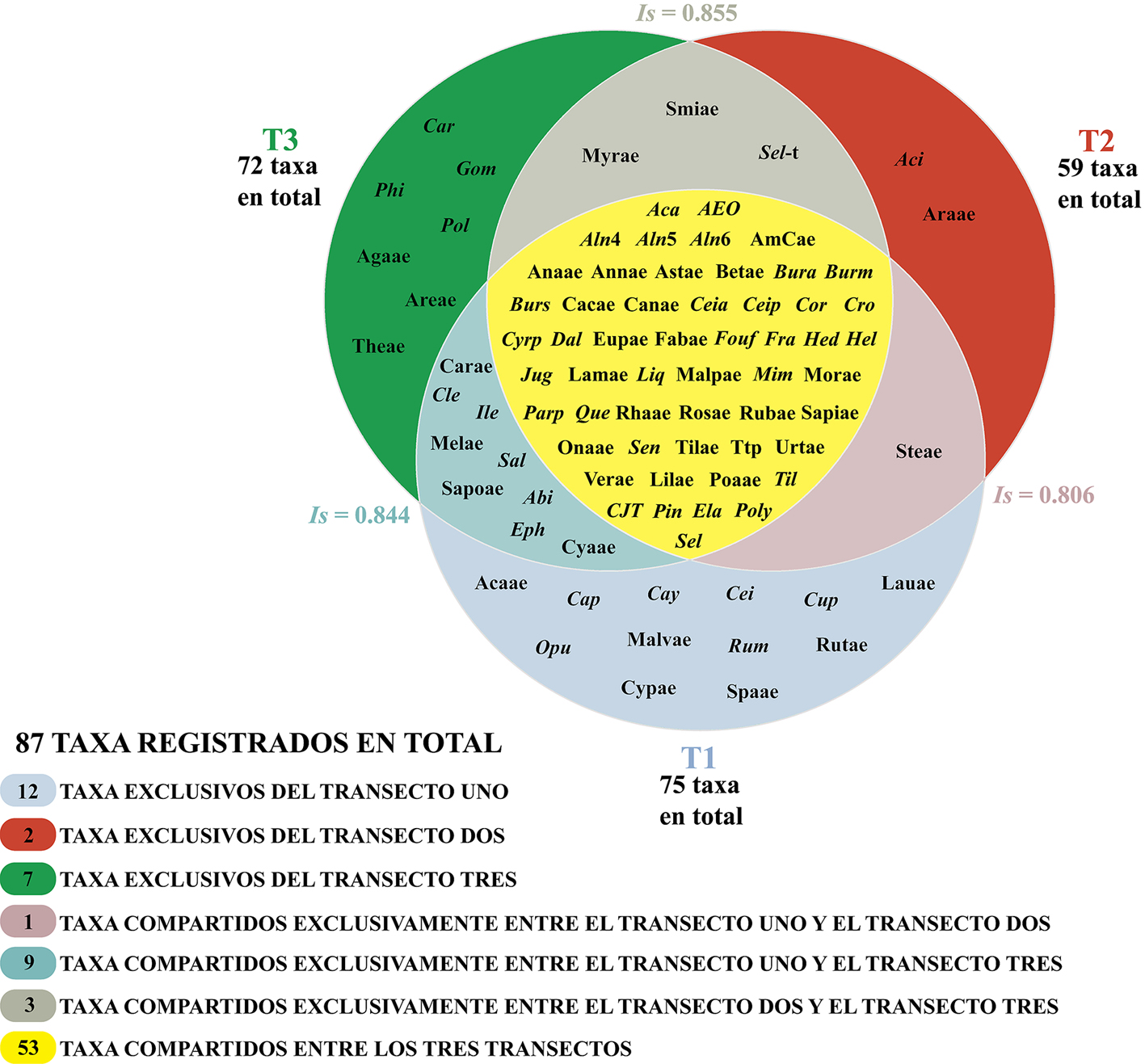
De los 156 tipos polínicos registrados, solamente se consideraron para el análisis de índice de similitud los 86 taxones determinados y el tipo polínico indeterminado (tetrabrevicolpado tectado perforado), debido a que estos taxones estuvieron bien representados en todos los transectos. El primer transecto presentó un total de 75 taxones, de los cuales 12 son exclusivos de éste; el segundo, 59 con 2 exclusivos y el tercero presentó 7 exclusivos de 72. Por último, se obtuvieron 53 grupos taxonómicos que se compartieron entre los 3 transectos (fig. 8).
Asimismo, de acuerdo con el índice de Sørensen, se encontró una semejanza de 81% en la composición del primer y segundo transecto, con un total de 54 taxones compartidos de los 80 registrados entre los 2 transectos. Entre el transecto 1 y 3 se encontró que la composición de los elementos fue 84% similar, compartiendo 62 los 85 taxones. En cuanto a la similitud de la composición entre el transecto 2 y 3, se encontró que fue del 85%, con 56 taxones compartidos (fig. 8).
En el análisis de agrupamiento (CONISS) se observaron 3 grupos en la línea de corte (fig. 6) —“A”, “B” y “C”, los cuales hacen referencia a los transectos 1, 2 y 3, respectivamente.
El grupo “A” se caracterizó por Ceiba parvifolia, C. aesculifolia, Sapindaceae y Salix spp., que si bien no son los grupos más abundantes, presentaron un mejor nivel de abundancia en comparación con los otros 2 transectos, además de que Ceiba sp. solamente estuvo presente en este transecto. El grupo “B” se caracterizó por presentar mayores abundancias por Bursera morelensis, un elemento indeterminado (tetrabrevicolpado tectado perforado), Cannabaceae, Acaciella sp. y Cyrtocarpa procera, siendo Acaciella sp. de gran importancia, debido a que resultó exclusivo de éste y estuvo presente en la gran mayoría de las muestras (10 de 11). Con respecto al tercer transecto, se registró el mayor número de elementos característicos en casi todas las muestras tal como Poaceae, Bursera aptera, Moraceae, Mimosa spp., Rosaceae, Verbenaceae, Tillandsia spp., Rubiaceae, Dalea sp., Senna spp. y Selaginella sp. (fig. 6).



Adicionalmente, tomando en cuenta el número de taxones por tipo de vegetación, existió una mayor riqueza de elementos de selva baja caducifolia que de elementos de vegetación templada; sin embargo, estos elementos templados tuvieron mayor abundancia (fig. 6).
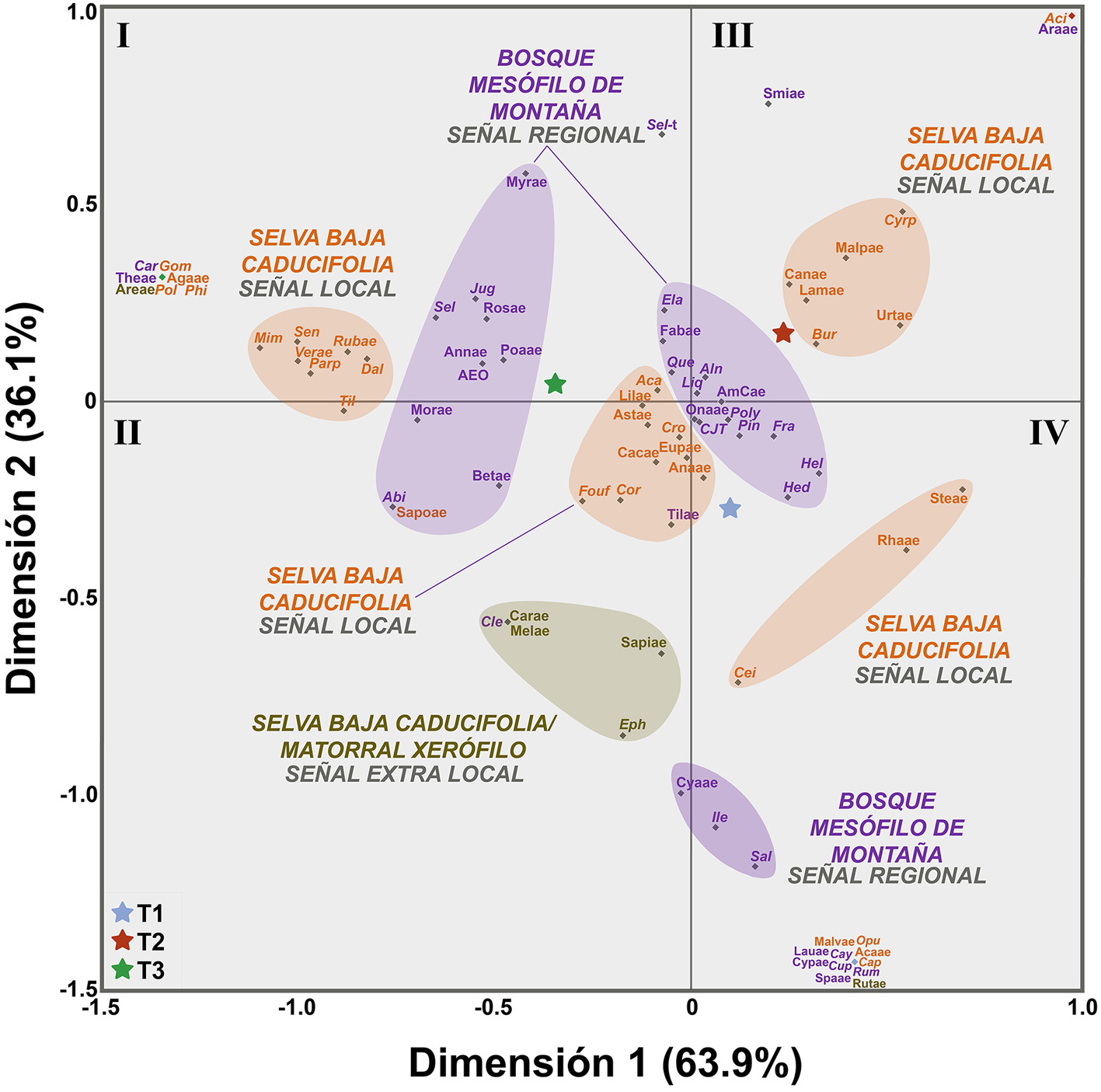
El análisis de correspondencia permitió la formación de 8 asociaciones (fig. 9). Además, los transectos están representados por una estrella cuya cercanía a las agrupaciones representa su estrecha relación. Se puede observar que en las 2 agrupaciones centrales: Anacardiaceae, Cordia sp., Croton spp., Cupressus–Juniperus–Taxodium, Euphorbiaceae, Fraxinus spp., Hedyosmum sp., Heliocarpus spp. Onagraceae, Pinus spp., Polypodium spp. y Tiliaceae, se presentaron abundancias ligeramente mayores en el primer transecto (T1), por lo que estos taxones se encuentran más cercanos a la posición del mismo (estrella azul), mientras que Acacia spp., Asteraceae, Elaphoglossum sp., Fabaceae, Fouquieria formosa, Liliaceae y Quercus spp., tuvieron una abundancia ligeramente mayor en el transecto 3 (T3, estrella verde); mientras que Alnus spp., Amaranthaceae-Chenopodiaceae y Liquidambar sp. en el segundo transecto (T2, estrella roja). Es importante resaltar que la mayoría de estos elementos se encuentran cercanos a la intersección de los ejes X y Y, lo que significa que son menos discriminatorios (tabla 1; fig. 6).

Entre los cuadrantes II y IV se identificaron además 3 agrupaciones, la primera de ellas quedó conformada por Caryophyllaceae, Cleome sp., Ephedra spp., Meliaceae y Sapindaceae. La segunda estuvo integrada por Ceiba spp. (C. aesculifolia, C. parvifolia y C. sp.), Rhamnaceae y Sterculiaceae. Finalmente, la tercera estuvo constituida por Cyatheaceae, Ilex sp. y Salix spp. Por otra parte, de acuerdo con el análisis de correspondencia, en el cuadrante III se observa el agrupamiento de Bursera spp. (incluyendo B. morelensis, B. aptera y B. submoniliformis), Cannabaceae, Cyrtocarpa procera, Lamiaceae, Malpighiaceae y Urticaceae) el cual estuvo mejor asociado con el transecto 2 (figs. 6, 9).
Por último, entre los cuadrantes I y II se distinguieron 2 agrupaciones fuertemente relacionadas con el tercer transecto (T3), la primera integrada por Dalea sp. Mimosa spp., Parkinsonia praecox, Rubiaceae, Senna spp., Tillandsia spp. y Verbenaceae, y la segunda formada por Abies sp., Alfaroa-Engelhardtia-Oreomunnea, Annonaceae, Betulaceae, Juglans sp., Moraceae, Myrtaceae, Poaceae, Rosaceae, Sapotaceae y Selaginella sp.
De acuerdo con los valores obtenidos de los índices de Davis, el polen proveniente de Acaciella sp., Asteraceae, Bursera aptera, B. morelensis, Ceiba aesculifolia, C. parvifolia, Gomphrena sp., Mimosa spp., Rhamnaceae, Tillandsia spp., y Verbenaceae resultó estar fuertemente asociado (A = 1, O = 0 y U = 0), así como Parkinsonia praecox, Senna spp. (ambos con A = 0.75, O = 0.25 y U = 0.33), Cyrtocarpa procera y Fouquieria formosa (ambos con A = 0.67, O = 0.33 y U = 0), todos ellos de la vegetación local. Por otra parte, solamente Agavaceae y Cordia sp. resultaron estar subrepresentados, mientras que Opuntia sp. obtuvo un valor no asociado (tabla 3). Además, la mayoría de los elementos regionales estuvieron sobrerepresentados (tabla 3).
Discusión
Con base en el análisis de correspondencia, se identificaron 3 señales polínicas (Janssen, 1966; Nichols, 1987): la regional derivada de fuentes externas del área de concentración dada principalmente por elementos templados de los bosques mesófilo de montaña y de encino; la señal extra local representada por polen derivado de sitios aledaños, es decir, elementos de la SBC y matorral de las zonas bajas y de los alrededores del cerro, y la señal local referente al polen proveniente de las plantas que crecen en la zona de muestreo del cerro El Picante.
La señal regional estuvo integrada por Abies sp., Alfaroa–Engelhardtia–Oreomunnea, Alnus spp., Amaranthaceae-Chenopodiaceae, Araceae, Betulaceae, Carpinus sp., Carya sp., Cupania sp., Cupressus–Juniperus–Taxodium, Cyatheaceae, Cyperaceae, Elaphoglossum sp., Fabaceae, Fraxinus sp., Hedyosmum sp., Heliocarpus spp., Ilex sp., Juglans sp., Lauraceae, Liquidambar sp., Moraceae, Myrtaceae, Onagraceae, Pinus spp., Poaceae, Polypodium spp., Quercus spp., Rosaceae, Salix spp., Sparganiaceae y Thelypteridaceae, elementos reportados en el bosque mesófilo de montaña (Campos-Villanueva y Villaseñor, 1995; López-Pérez et al., 2011; Rzedowski, 1978; Rzedowski y Palacios-Chávez, 1977). Sin embargo, el alto porcentaje de Quercus spp., también podría indicar la presencia de un bosque de encino, ambos tipos de vegetación ubicados en la sierra contigua como se muestra en el mapa de vegetación del área de estudio (fig. 10).
La señal local representa la selva baja caducifolia, conformada por Acacia spp., Acaciella sp., Acanthaceae, Agavaceae, Anacardiaceae, Arecaceae, Asteraceae, Bursera spp. (B. morelensis, B. aptera y B. submoniliformis), Cactaceae, Ceiba spp. (C. aesculifolia, C. parvifolia y C. sp.), Cannabaceae, Cecropia sp., Cordia sp., Croton spp., Cuadrella sp., Cyrtocarpa procera, Dalea sp., Euphorbiaceae, Fouquieria formosa, Gomphrena sp., Lamiaceae, Liliaceae, Malpighiaceae, Malvaceae, Mimosa spp., Opuntia sp., Parkinsonia praecox, Phithecellobium sp., Polygonum sp., Rhamnaceae, Rubiaceae, Senna spp., Sterculiaceae, Tiliaceae, Tillandsia spp., Urticaceae y Verbenaceae debido a que se han registrado en esta comunidad vegetal (Steinmann, 2009; Valiente-Banuet et al., 2009; Vasquez-Velasco, 2018).
Es importante destacar que Ephedra spp., Rutaceae, Sapindaceae, Meliaceae y Caryophyllaceae se han documentado en el matorral xerófilo y en la selva baja caducifolia (Abundiz-Bonilla et al., 2004; Calónico-Soto, 2011; Germán-Ramírez, 2005; Ramírez-Bravo y Hernández-Santin, 2016; Rojas et al., 2013; Valiente-Banuet et al., 2009). Un caso particular es el de Ephedra ya que E. compacta es la única especie reportada para el valle de Tehuacán-Cuicatlán (Villanueva-Almanza y Fonseca, 2011; Valiente-Banuet et al., 2009) y en la lluvia polínica de este estudio se encontraron 2 tipos polínicos de Ephedra, uno correspondiente a E. compacta (fig. 5: 21) y otro muy similar a E. antisyphilitica (fig. 5: 20) por su morfología polínica (Bolinder et al., 2016), el cual solo está reportado para Chihuahua, Coahuila, Durango, Nuevo León, San Luis Potosí, Tamaulipas y Zacatecas (Villanueva-Almanza y Fonseca, 2011). Es importante señalar que el matorral xerófilo crece en contacto con la selva baja caducifolia (INEGI, 2009; Meave et al., 2012) (fig. 10).
El análisis de la lluvia de polen del presente estudio mostró una gran riqueza de tipos polínicos, donde los elementos anemófilos fueron muy abundantes en los 3 transectos analizados. Estos tipos pertenecen a la vegetación templada ubicada en las serranías, a altitudes mucho más elevadas, lo cual estaría evidenciando una señal regional, que de acuerdo con el análisis de correspondencia (fig. 9), fueron producidos principalmente por elementos de bosque mesófilo de montaña, el cual se encuentra distribuido en altitudes superiores a 800 m en el sistema montañoso del norte de Oaxaca (Conabio, 2010; Rzedowski y Palacios-Chávez, 1977) (fig. 10). Al respecto, los taxoneas regionales más abundantes fueron Alnus spp., Quercus spp. y Pinus spp. (fig. 6), coincidiendo con el estudio de lluvia de polen del bosque mesófilo de montaña realizado por Tejero-Diez et al. (1988), los cuales reportan dichos elementos con porcentaje de 6 a 39%, indicando además que la comunidad se desarrolla a una altitud aproximada de 2,300 m. La mayor abundancia de estos grupos se puede explicar por su mecanismo de polinización anemófila, que se caracteriza por la gran cantidad de granos de polen que producen, ya que liberan más de 1 millón por planta (Piotrowska, 2008; Tormo et al., 1996) y por el desplazamiento de enormes distancias gracias a su morfología polínica. En el caso de los granos bisacados del género Pinus y polen de Quercus, se dispersan hasta 1,000 km, mientras que Alnus alcanza los 588 km (Potter y Rowley, 1960).
Por otra parte, los elementos locales mejor representados en el espectro polínico de este estudio fueron: Asteraceae, Bursera morelensis, B. aptera, Euphorbiaceae, Ceiba parvifolia y C. aesculifolia, mientras que el resto de los taxones de la selva baja caducifolia mostraron estar subrepresentados en el espectro polínico (fig. 6). Esto se debe a que la mayoría de las plantas de este tipo de vegetación son de polinización entomófila y en consecuencia su producción de polen es baja y presentan mecanismos especializados para su adhesión a los polinizadores (Rzedowski et al., 2014).
En otros estudios, la mayoría de taxones locales de este tipo de vegetación presentan porcentajes muy bajos, algunos llegan a 25%, mientras que los regionales no exceden 40% (Ortega-Rosas et al., 2008; Osorio-Pascual y Quiroz-García, 2009; Palacios-Chávez, 1985), por lo que no existe en realidad un determinado tipo polínico excesivamente dominante (Palacios-Chávez, 1985), contrario a las lluvias polínicas realizadas en comunidades templadas, donde los tipos polínicos dominantes tienen porcentajes mayores al 50% (Lozano-García et al., 2014; Ohngemach, 1977; Ortega-Rosas et al., 2008; Palacios-Chávez, 1977; Tejero-Diez et al., 1988; Velázquez-Silva, 2008). Este patrón de sobrerrepresentación de elementos regionales y subrepresentación de elementos locales también se ha reportado en los registros paleopalinológicos en el VTC (Ramírez-Arriaga et al., 2014, 2017; Rosales-Torres et al., 2017).
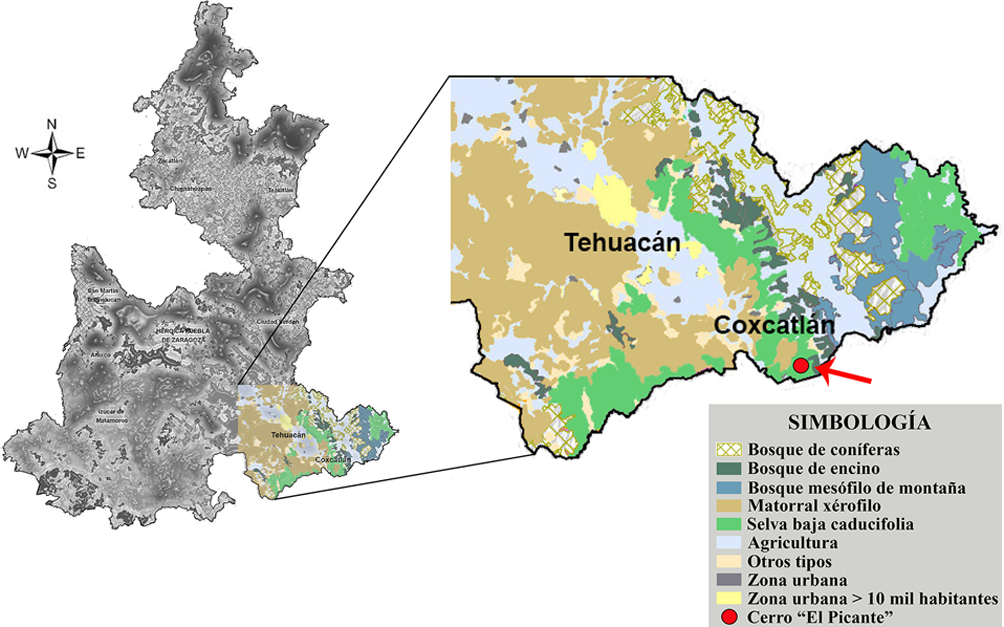
Comparación de señales polínicas con la composición y estructura de la selva baja caducifolia.
a) Análisis del espectro palinológico y la vegetación. La comparación entre los porcentajes de los taxones locales mejor representados en el espectro polínico con los porcentajes obtenidos del índice de valor de importancia (IVI) se llevó a cabo considerando los resultados del estudio sobre composición y estructura de la selva baja caducifolia realizado por Vasquez-Velasco (2018) en la misma zona de estudio y en los transectos aquí analizados. En el primer transecto, Asteraceae, Bursera morelensis, Ceiba parvifolia, C. aesculifolia, Euphorbiaceae y B. aptera fueron los elementos mejor representados. Sin embargo, solamente C. parvifolia y C. aesculifolia fueron los que caracterizaron este transecto por presentar los valores más altos de abundancia en comparación con los otros transectos (fig. 6; tabla 1). Igualmente, el valor del IVI de Ceiba aesculifolia (46.2%) en el primer transecto, destacó sobre los valores de los otros 2 (tabla 2) (Vasquez-Velasco, 2018). En el segundo transecto, 4 taxones estuvieron bien representados: Bursera morelensis, Asteraceae, Euphorbiaceae y Acaciella sp.; los porcentajes de abundancia de B. morelensis y Acaciella sp. fueron mayores en este transecto que en los otros 2, además, Acaciella sp., solamente estuvo registrado en este transecto en la mayoría de las muestras (fig. 6). De igual manera, en la vegetación, los valores del IVI de B. morelensis (36.8%) y Acaciella angustissima (41.5%) fueron reportados más altos que en los otros transectos (Vasquez-Velasco, 2018). En el tercer transecto, Asteraceae, Bursera aptera, Mimosa spp., Euphorbiaceae, B. morelensis y Ceiba aesculifolia fueron los taxones locales más representativos, siendo Asteraceae, B. aptera y Mimosa spp., los elementos con abundancias más altas en este transecto (fig. 6). Vasquez-Velasco (2018), de igual manera, reportó que B. aptera (30.8%) y tipo Asteraceae (42.2%) presentaron los valores de IVI más altos en este transecto, con respecto al primero y el segundo, mientras que Mimosa polyantha, está reportado como un taxón arbustivo de gran importancia en el tercer transecto, sin embargo, su IVI es mayor en el segundo.
Tabla 2
Plantas representativas de cada transecto, se muestran los porcentajes promedio del espectro polínico (≥ 1%) y los porcentajes del índice de valor de importancia (IVI) de la estructura de la vegetación (modificado de Vasquez-Velasco, 2018). En negritas se destacan los taxones con los mayores valores comparando los 3 transectos.
|
|
Lluvia de polen % espectro polínico (presente trabajo) |
Vegetación % IVI (Vasquez-Velasco, 2018) |
|
Transecto 1 |
Asteraceae (8.1%) |
Lippia graveolens (54.7%) |
|
Bursera morelensis (6.8%) |
Ceiba aesculifolia (46.2%) |
|
|
Ceiba parvifolia (2.9%) |
Mimosa polyantha (25.6%) |
|
|
Ceiba aesculifolia (2.2%) |
Parkinsonia praecox (15.9%) |
|
|
Euphorbiaceae (2.1%) |
Bursera aptera (14.7%) |
|
|
Bursera aptera (1.3%) |
Randia nelsonii (14.0%) |
|
|
Transecto 2 |
Bursera morelensis (11.8%) |
Acaciella angustissima (41.51%) |
|
Asteraceae (6.5%) |
Bursera morelensis (36.8%) |
|
|
Euphorbiaceae (1.5%) |
Mimosa polyantha (34.1%) |
|
|
Acaciella sp. (1.1%) |
Ceiba aesculifolia (24.2%) |
|
|
Transecto 3 |
Asteraceae (8.8%) |
Tipo Asteraceae (42.2%) |
|
Bursera aptera (4.4%) |
Ceiba aesculifolia (32.9%) |
|
|
Mimosa spp. (1.8%) |
Bursera aptera (30.8%) |
|
|
Euphorbiaceae (1.7%) |
Lippia graveolens (26.1%) |
|
|
Bursera morelensis (1.1%) |
Mimosa polyantha (23.3%) |
|
|
Ceiba aesculifolia (1%) |
Fouquieria formosa (18.9%) |
De las evidencias anteriores, comparando los porcen-tajes locales de la lluvia de polen con los del IVI de la vegetación (Vasquez-Velasco, 2018), se observó que Ceiba parvifolia y C. aesculifolia del primer transecto; Bursera morelensis y Acaciella sp. del segundo, y B. aptera y Asteraceae del tercero, presentaron los valores más altos tanto de vegetación como de polen en los respectivos transectos, en cuanto a abundancia se refiere (tabla 2).
b) Relación lluvia de polen-vegetación considerando los índices de Davis. La mayoría de los taxones regionales templados con síndrome de polinización anemófila estuvieron sobrerrepresentados en la lluvia de polen de la selva baja caducifolia. Por otro lado, también hubo taxones locales sobrerrepresentados, como Acacia spp., Bursera submoniliformis, Cactaceae, entre otros, registrados en los 3 transectos (fig. 6), los cuales resultaron escasos en los muestreos de vegetación realizados en los mismos transectos por Vasquez-Velasco (2018). En el caso de Acacia spp., se registraron 2 tipos polínicos, uno de ellos correspondiente a A. cochliacantha (fig. 3: 1), siendo la única especie del género reportada en el cerro El Picante (Vasquez-Velasco, 2018). Por el contrario, solamente Agave sp. estuvo subrepresentado debido a que en toda la lluvia de polen se encontró un solo grano de polen de este género, mientras que Vasquez-Velasco (2008) reporta hasta 12 individuos en los 3 transectos. Por su parte, Opuntia sp. resultó no estar asociada con la vegetación, lo cual podría deberse principalmente a 3 razones: 1) su mecanismo de polinización especializado, 2) su morfología polínica y 3) sus escasas abundancias en la vegetación local (Valiente-Banuet, 2002; Vasquez-Velasco, 2018). Además, los índices indicaron que 44 taxones de la selva baja caducifolia (tabla 3) presentan algún tipo de asociación entre la lluvia polínica y la vegetación, siendo Acaciella sp., Asteraceae, B. aptera, B. morelensis, Ceiba aesculifolia. C. parvifolia, Cyrtocarpa procera, Fouquieria formosa, Gomphrena sp., Mimosa spp., Parkinsonia praecox, Rhamnaceae, Verbenaceae y Tillandsia spp. los elementos fuertemente asociados con “TFA” (tabla 3), lo que indica que el espectro polínico local de la lluvia de polen está relacionado fielmente con la vegetación local. Cabe señalar que Vasquez-Velasco (2018) reporta la existencia de otros taxones como Plumeria rubra, Prosopis laevigata, Randia nelsonii, Aeschynomene sp. y Solanum tridynamum, los cuales no se presentaron en la lluvia polínica de este estudio.
Tabla 3
Valores de los índices de asociación de Davis (A, O, U) de los taxones registrados en la lluvia de polen, basados en datos de presencia/ausencia, tanto de lluvia de polen como de la vegetación (Vasquez-Velasco, 2018). Los índices de asociación se clasificaron con base en Fjordheimen et al. (2018): TFA = tipos fuertemente asociados, TA = tipos asociados, TDA = tipos débilmente asociados, TOR = tipos sobrerepresentados, TUR = tipos subrepresentados y TNA = tipos no asociados. Taxones sombreados en gris claro: presentes en la selva baja caducifolia; sombreados en gris oscuro: elementos fuertemente asociados con la selva baja caducifolia.
|
Taxones |
A |
O |
U |
Tipo |
|
Taxones |
A |
O |
U |
Tipo |
|
Acacia spp. |
0.33 |
0.67 |
0.00 |
TOR |
|
Acaciella sp. |
1.00 |
0.00 |
0.00 |
TFA |
|
Acanthaceae |
0.00 |
1.00 |
– |
TOR |
|
Alfaroa-Engelhardtia-Oreomunnea |
0.00 |
1.00 |
– |
TOR |
|
Alnus sp. tetraporado |
0.00 |
1.00 |
– |
TOR |
|
Alnus sp. pentaporado |
0.00 |
1.00 |
– |
TOR |
|
Alnus sp. hexaporado |
0.00 |
1.00 |
– |
TOR |
|
Amaranthaceae-Chenopodiaceae |
0.00 |
1.00 |
– |
TOR |
|
Anacardiaceae |
0.00 |
1.00 |
– |
TOR |
|
Annonaceae |
0.00 |
1.00 |
– |
TOR |
|
Asteraceae |
1.00 |
0.00 |
0.00 |
TFA |
|
Betulaceae |
0.00 |
1.00 |
– |
TOR |
|
Bursera aptera |
1.00 |
0.00 |
0.00 |
TFA |
|
Bursera morelensis |
1.00 |
0.00 |
0.00 |
TFA |
|
Bursera submoniliformis |
0.00 |
1.00 |
– |
TOR |
|
Cactaceae |
0.00 |
1.00 |
– |
TOR |
|
Cannabaceae |
0.00 |
1.00 |
– |
TOR |
|
Capparis sp. |
0.00 |
1.00 |
– |
TOR |
|
Carpinus sp. |
0.00 |
1.00 |
– |
TOR |
|
Carya sp. |
0.00 |
1.00 |
– |
TOR |
|
Caryophyllaceae |
0.00 |
1.00 |
– |
TOR |
|
Ceiba aesculifolia |
1.00 |
0.00 |
0.00 |
TFA |
|
Ceiba parvifolia |
1.00 |
0.00 |
0.00 |
TFA |
|
Cleome sp. |
0.00 |
1.00 |
– |
TOR |
|
Cordia sp. |
0.33 |
0.00 |
0.67 |
TUR |
|
Croton spp. |
0.00 |
1.00 |
– |
TOR |
|
Cupania sp. |
0.33 |
0.67 |
0.00 |
TOR |
|
Cyrtocarpa procera |
0.67 |
0.33 |
0.00 |
TFA |
|
Dalea sp. |
0.00 |
1.00 |
– |
TOR |
|
Euphorbiaceae |
0.33 |
0.67 |
0.00 |
TOR |
|
Fabaceae |
0.00 |
1.00 |
– |
TOR |
|
Fouquieria formosa |
0.67 |
0.33 |
0.00 |
TFA |
|
Fraxinus sp. |
0.00 |
1.00 |
– |
TOR |
|
Gomphrena sp. |
1.00 |
0.00 |
0.00 |
TFA |
|
Hedyosmum sp. |
0.00 |
1.00 |
– |
TOR |
|
Heliocarpus spp. |
0.00 |
1.00 |
– |
TOR |
|
Ilex sp. |
0.00 |
1.00 |
– |
TOR |
|
Juglans sp. |
0.00 |
1.00 |
– |
TOR |
|
Lamiaceae |
0.00 |
1.00 |
– |
TOR |
|
Lauraceae |
0.00 |
1.00 |
– |
TOR |
|
Liquidambar sp. |
0.00 |
1.00 |
– |
TOR |
|
Malpighiaceae |
0.00 |
1.00 |
– |
TOR |
|
Malvaceae |
0.00 |
1.00 |
– |
TOR |
|
Meliaceae |
0.00 |
1.00 |
– |
TOR |
|
Mimosa spp. |
1.00 |
0.00 |
0.00 |
TFA |
|
Moraceae |
0.00 |
1.00 |
– |
TOR |
|
Myrtaceae |
0.00 |
1.00 |
– |
TOR |
|
Onagraceae |
0.00 |
1.00 |
– |
TOR |
|
Opuntia sp. |
0.00 |
1.00 |
1.00 |
TNA |
|
Parkinsonia praecox |
0.75 |
0.25 |
0.00 |
TFA |
|
Phithecellobium sp. |
0.00 |
1.00 |
– |
TOR |
|
Polygonum sp. |
0.00 |
1.00 |
– |
TOR |
|
Quercus spp. |
0.00 |
1.00 |
– |
TOR |
|
Rhamnaceae |
1.00 |
0.00 |
0.00 |
TFA |
|
Rosaceae |
0.00 |
1.00 |
– |
TOR |
|
Rubiaceae |
0.00 |
1.00 |
– |
TOR |
|
Rumex sp. |
0.00 |
1.00 |
– |
TOR |
|
Rutaceae |
0.00 |
1.00 |
– |
TOR |
|
Salix spp. |
0.00 |
1.00 |
– |
TOR |
|
Sapindaceae |
0.00 |
1.00 |
– |
TOR |
|
Sapotaceae |
0.00 |
1.00 |
– |
TOR |
|
Senna spp. |
0.75 |
0.25 |
0.00 |
TFA |
|
Sterculiaceae |
0.00 |
1.00 |
– |
TOR |
|
Tiliaceae |
0.00 |
1.00 |
– |
TOR |
|
Urticaceae |
0.00 |
1.00 |
– |
TOR |
|
Verbenaceae |
1.00 |
0.00 |
0.00 |
TFA |
|
Agavaceae |
0.50 |
0.00 |
0.50 |
TUR |
|
Araceae |
0.00 |
1.00 |
– |
TOR |
|
Arecaceae |
0.00 |
1.00 |
– |
TOR |
|
Cyperaceae |
0.00 |
1.00 |
– |
TOR |
|
Liliaceae |
0.00 |
1.00 |
– |
TOR |
|
Poaceae |
0.00 |
1.00 |
– |
TOR |
|
Smilacaceae |
0.00 |
1.00 |
– |
TOR |
|
Sparganiaceae |
0.00 |
1.00 |
– |
TOR |
|
Tillandsia spp. |
1.00 |
0.00 |
0.00 |
TFA |
|
Abies |
0.00 |
1.00 |
– |
TOR |
|
Cupressus-Juniperus-Taxodium |
0.00 |
1.00 |
– |
TOR |
|
Ephedra spp. |
0.00 |
1.00 |
– |
TOR |
|
Pinus spp. |
0.00 |
1.00 |
– |
TOR |
|
Elaphoglossum sp. |
0.00 |
1.00 |
– |
TOR |
|
Polypodium spp. |
0.00 |
1.00 |
– |
TOR |
|
Thelypteridaceae |
0.00 |
1.00 |
– |
TOR |
|
Cyatheaceae |
0.00 |
1.00 |
– |
TOR |
|
Selaginella sp. |
0.00 |
1.00 |
– |
TOR |
|
Selaginella sp. (tétrada) |
0.00 |
1.00 |
– |
TOR |
Por último, analizando en conjunto los porcentajes de polen-vegetación, basados en abundancia (tabla 2) y los valores de asociación del índice de Davis, apoyados en datos de presencia/ausencia (tabla 3), se proponen como indicadores polínicos de la selva baja caducifolia del cerro El Picante a Acaciella sp., Asteraceae, Bursera aptera, B. morelensis, Ceiba aesculifolia, C. parvifolia, Mimosa spp. y Tillandsia spp.
En síntesis, la presente investigación se incorpora como el primer registro de lluvia de polen actual en la selva baja caducifolia en la región del VTC, concluyendo que el espectro polínico en cada transecto estuvo dominado principalmente por el depósito de elementos anemófilos regionales como Alnus spp., Quercus spp. y Pinus spp.; sin embargo, también estuvieron bien representados, en menores proporciones, elementos entomófilos locales como Asteraceae, Bursera morelensis, B. aptera, Euphorbiaceae, Ceiba parvifolia y C. aesculifolia, mientras que la mayoría de los taxones locales presentaron abundancias bajas, al igual que elementos extralocales como Ephedra spp., Meliaceae, Sapindaceae y Caryophyllaceae. Es importante destacar que se registró mayor riqueza palinoflorística procedente de la selva baja, la cual contrastó con un menor número de especies provenientes de comunidades vegetales templadas.
Agradecimientos
Al proyecto “Diversidad palinoflorística y reconstrucción de la vegetación en el Paleógeno y Neógeno de Oaxaca, México” de la Universidad Nacional Autónoma de México, PAPIIT IN-108517, por el apoyo para el desarrollo de la presente investigación, así como por las becas otorgadas. De igual manera, agradecemos a la Universidad Autónoma Metropolitana-Iztapalapa, a la Reserva de la Biosfera del Valle de Tehuacán-Cuicatlán, así como a la comunidad y autoridades correspondientes de San José Tilapa, VTC, Puebla, por el apoyo brindado en el trabajo de campo. Por las valiosas sugerencias que enriquecieron el presente manuscrito, los autores agradecen a los dos revisores anónimos así como al editor Dr. Fernándo Álvarez de la Revista Mexicana de Biodiversidad.
Referencias
Abundiz-Bonilla, L. A. M., Barajas-Morales, J. y Tenorio-Lezama, P. (2004). Anatomía de maderas de México: Árboles y arbustos del matorral xerófilo de Tehuacán, Puebla. Ciudad de México: Universidad Nacional Autónoma de México.
Bardou, P., Mariette, J., Escudié, F., Djemiel. C. y Klopp, C. (2014). jvenn: an interactive Venn diagram viewer. BMC Bioinformatics, 15, 293. https://doi.org/10.1186/1471-2105-15-293
Becerra, J. X. (2005). Timing the origin and expansion of the Mexican tropical dry forest. Proceedings of the National Academy of Sciences, 102, 10919–10923. https://doi.org/10.1073/pnas.0409127102
Bolinder, K., Ivarsoon, L. N., Humphreys, A. M., Ickert-Bond, S. M., Han, F., Hoorn, C. et al. (2016). Pollen morphology of Ephedra (Gnetales) and its evolutionary implications. Grana, 55, 24–51. https://doi.org/10.1080/00173134.2015.1066424
Calónico-Soto, J. (2011). Flora del valle de Tehuacán-Cuicatlán. Fascículo 86, Sapindaceae. Ciudad de México: Instituto de Biología. Universidad Nacional Autónoma de México.
Campos-Villanueva, A. y Villaseñor, J. L. (1995). Estudio florístico de la porción central del Municipio de San Jerónimo Coatlán, Distrito de Miahuatlán (Oaxaca). Boletín de la Sociedad Botánica de México, 56, 95–120. https://doi.org/10.17129/botsci.1468
Chang-Martínez, L. y Domínguez-Vázquez, G. (2013). Distribución espacial del polen en un gradiente altitudinal en Michoacán, México. Revista Mexicana de Biodiversidad, 84, 876–883. https://doi.org/10.7550/rmb.32417
Collao-Alvarado, K., Maldonado, A., González, L., Sandoval, A., de Porras, M. E., Zamora, A. et al. (2015). Estudio de la relación polen-vegetación actual en el Norte de Chile, en el transecto Pozo Almonte-Salar de Huasco (20°15´S/69°06´W). Gayana Botanica, 72, 125–136. https://doi.org/10.4067/s0717-66432015000100015
Conabio (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad). (2010). El bosque mesófilo de montaña en méxico: amenazas y oportunidades para su conservación y manejo sostenible. Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Dávila, P., Arizmendi, M. C., Valiente-Banuet, A., Villaseñor, J. L., Casas, A. y Lira, R. (2002). Biological diversity in the Tehuacán-Cuicatlán Valley, Mexico. Biodiversity and Conservation, 11, 421–442. https://doi.org/10.1023/A:1014888822920
Davis, O. K. (1984). Frequencies reflect vegetation patterns in a Great Basin (U.S.A.) mountain range. Review of Paleobotany and Palynology, 40, 295–315. https://doi.org/10.1016/0034-6667(84)90013-7
Demske, D., Tarasov, P. E., Nakagawa, T. y Suigetsu 2006 Project Members. (2013). Atlas of pollen, spores and further non-pollen palynomorphs recorded in the glacial-interglacial late Quaternary sediments of Lake Suigetsu, central Japan. Quaternary International, 290–291, 164–238. https://doi.org/10.1016/j.quaint.2012.02.002
Erdtman, G. (1960). The acetolysis method, a revised description. Svensk Botanisk Tidskrift, 54, 561–564.
Escarraga-Paredes, D. S., Torrescano-Valle, N. e Islebe, G. A. (2014). Análisis de la relación vegetación-lluvia de polen actual de las comunidades vegetales en el noroeste de la península de Yucatán, México. Polibotánica, 38, 27–52.
Fjordheim, K., Moen, A., Hjelle, K. L., Bjune, A. E. y Birks, H. H. (2018). Modern pollen-vegetation relationships in traditionally mown and unmanaged boreal rich-fen communities in central Norway. Review of Paleobotany and Palynology, 251, 14–27. https://doi.org/10.1016/j.revpalbo.2018.01.001
García, E. (2004). Modificaciones al sistema climático de Köppen para adaptarlo a las condiciones de la República Mexicana. Ciudad de México: Instituto de Geografía, Universidad Nacional Autónoma de México.
Germán-Ramírez, M. T. (2005). Flora del valle de Tehuacán-Cuicatlán. Fascículo 42, Meliaceae. Ciudad de México: Instituto de Biología. Universidad Nacional Autónoma de México.
Gosling, W. D., Miller, C. S. y Livingstone, D. A. (2013). Atlas of the tropical West African pollen flora. Review of Paleobotany and Palynology, 199, 1–135. https://doi.org/10.1016/j.revpalbo.2013.01.003
Grimm, E. C. (1990). TILIA and TILIA GRAPH: PC spreadsheet and graphics software for pollen data. INQUA Working Group on Data-Handling Methods, Newsletter, 4, 5–1 7. Recuperado el 15 febrero, 2019 de: http://www.chrono.qub.ac.uk/inqua/news4/nl4-ecg2.html
Grimm, E. C. (1997). CONISS: a FORTRAN 77 program from stratigraphically constrained cluster analysis by the method of incremental sum of squares. Computers & Geosciences, 13, 13–35. https://doi.org/10.1016/0098-3004(87)90022-7
Guevara-Romero, M. L. (2011). Tipos de vegetación de Puebla. En Comisiòn Nacional para el Conocimiento y Uso de la Biodiversidad (Conabio). La biodiversidad en Puebla: estudio de estado. Puebla: Comisiòn Nacional para el Conocimiento y Uso de la Biodiversidad/ Gobierno del Estado de Puebla/ Benemérita Universidad Autónoma de Puebla.
Hjelle, K. L. (1997). Relationships between pollen and plants in human-influenced vegetation types using presence-absence data in western Norway. Review of Paleobotany and Palynology, 99, 1–16. https://doi.org/10.1016/s0034-6667(97)00041-9
IBM Corp. (2016). IBM SPSS Statistics for Windows, Version 24.0. Armonk, New York: IBM Corp.
INEGI (Instituto Nacional de Estadística y Geografía). (2009). Prontuario de información geográfica municipal de los Estados Unidos Mexicanos, Coxcatlán, Puebla. Ciudad de México: Clave geoestadística 21035. Instituto Nacional de Estadística y Geografía. Recuperado el 15 febrero, 2019 de: http://www3.inegi.org.mx/contenidos/app/mexicocifras/datos_geograficos/21/21035.pdf
Islebe, G. A. y Hooghiemstra, H. (1995). Recent pollen spectra of highland Guatemala. Journal of Biogeography, 22, 1091–1099. https://doi.org/10.2307/2845838
Islebe, G. A., Villanueva-Gutiérrez, R. y Sánchez, O. (2001). Relación lluvia de polen-vegetación en selvas de Quintana Roo. Boletín de la Sociedad Botánica Mexicana, 69, 31–38. https://doi.org/10.17129/botsci.1645
Jacinto-Pimienta, S. Y., Mendoza-Hernández, J. H. R., Zaldivar-Cruz, J. M., Sol-Sánchez, A., Vargas-Villamil, L. M. y Reyes-Sánchez, C. A. (2016). El uso de componentes principales en la clasificación melisopalinológica de la miel de Apis mellifera L. Revista Mexicana de Ciencias Agrícolas, 14, 2831–2840. https://doi.org/10.29312/remexca.v0i14.454
Jacobs, B. F. (1982). Modern pollen spectra from surface soil samples, Northern Nayarit, Southern Sinaloa, Mexico. Journal of the Arizona-Nevada Academy of Science, 17, 1–14.
Janssen, C. R. (1966). Recent pollen spectra from the deciduous and coniferous-deciduous forests of northeastern Minnesota: a study in pollen dispersal. Ecology, 47, 804–825. https://doi.org/10.2307/1934267
Kovach, W. L. (2003). MVSP – A MultiVariate Statistical Package for Windows, ver. 3.22. Pentraeth, Reino Unido: Kovach Computing Services.
López-Pérez, Y., Tejero-Díez, D., Torres-Díaz, A. N. y Luna-Vega, I. (2011). Flora del bosque mesófilo de montaña y vegetación adyacente en Avándaro, Valle de Bravo, Estado de México, México. Boletín de la Sociedad Botánica de México, 88, 35–53. https://doi.org/10.17129/botsci.304
Lozano-García, S. (1984). Interpretaciones sobre la lluvia de polen en la Región de San Luis Potosí, México. Boletín de la Sociedad Botánica de México, 46, 53–74. https://doi.org/10.17129/botsci.1319
Lozano-García, S., Correa-Metrio, A. y Luna, L. (2014). Análisis de la lluvia de polen moderna de la cuenca de México: una herramienta para la interpretación del registro fósil. Boletín de la Sociedad Geológica Mexicana, 66, 1–10. https://doi.org/10.18268/bsgm2014v66n1a1
Martínez-Hernández, E. (1970). Estudio palinológico de las especies dominantes de la vegetación de los alrededores de la Laguna Madre, Tamaulipas, México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Martínez-Hernández, E., Cuadriello-Aguilar, J. I., Téllez-Valdez, O., Ramírez-Arriaga, E., Sosa-Nájera, M. S., Melchor-Sánchez, J. E. M. et al. (1993). Atlas de las plantas y el polen utilizado por cinco especies principales de abejas productoras de miel en la región del Tecana, Chiapas, México. Ciudad de México: Instituto de Geología, Universidad Nacional Autónoma de México.
Meave, J. A., Romero-Romero, M. A., Salas-Morales, S. H., Pérez-García, E. A. y Gallardo-Cruz, J. A. (2012). Diversidad, amenazas y oportunidades para la conservación del bosque tropical caducifolio en el estado de Oaxaca, México. Ecosistemas, 21, 85–100.
Miranda, F. y Hernández, X. E. (1963). Los tipos de vegetación de México y su clasificación. Boletín de la Sociedad Botánica de México, 28, 29–178. https://doi.org/10.17129/botsci.1084
Montúfar, L. A. (1985). Lluvia de polen actual en bromelias, musgo y suelo superficial en los alrededores de Santa María Ocozocoautla; Chiapas. En A. Montúfar (coordinadora), Estudios palinológicos y paleoetnobotánicos (pp. 85–100). Ciudad de México: Instituto Nacional de Antropología e Historia.
NCSS 12 Statistical Software. (2018). NCSS, LLC. Kaysville, Utah, USA.
Nichols, D. J. (1987). Palynology of the Vermillion Creek Coal Bed and associated strata. En H. W. Roehler y P. L. Martin (Eds.), Geological investigations of the Vermillion Creek coal bed in the Eocene Niland Tongue of the Wasatch Formation, Sweetwater Country Wyoming (pp 47–73). Washington: U.S. Geological Survey Professional Paper.
Ohngemach, D. (1977). Pollen sequence of the Tlaloqua Crater (La Malinche Volcano, Tlaxcala, Mexico). Boletín de la Sociedad Botánica de México, 36, 33–44. https://doi.org/10.17129/botsci.1158
Olalde-Estrada, I., Cano-Santana, Z., Castellanos-Vargas, I. I. y Balboa-Aguilar, C. C. (2015). Variación espacio-temporal en la densidad y diversidad de abejas en sitios de bosque tropical caducifolio sujetos a disturbio en el Ejido San José Tilapa, Pue. Entomología Mexicana, 2, 533–539.
Ortega-Rosas, C. I., Peñalba, M. C. y Guiot, J. (2008). Holocene altitudinal shifts in vegetation belts and environmental changes in the Sierra Madre Occidental, Northwestern Mexico, based on modern and fossil pollen data. Review of Palaeobotany and Palynology, 151, 1–20. https://doi.org/10.1016/j.revpalbo.2008.01.008
Osorio-Pascual, A. y Quiroz-García, D. L. (2009). Lluvia de polen de la ciudad de Oaxaca, México. Polibotánica, 28, 161–190.
Palacios-Chávez, R. (1977). Lluvia de polen moderno en diferentes hábitats del Valle de México. Boletín de la Sociedad Botánica de México, 36, 45–70. https://doi.org/10.17129/botsci.1159
Palacios-Chávez, R. (1985). Lluvia de polen moderno en el bosque tropical caducifolio de la Estación de Biología de Chamela, Jal. (México). Anales de la Escuela Nacional de Ciencias Biológicas, 29, 43–55.
Palacios-Chávez, R., Ludlow-Wiechers, B. y Villanueva, R. (1991). Flora palinológica de la Reserva de la Biosfera de Sian Ka’an, Quintanta Roo, México. Chetumal, Quintana Roo: Centro de Investigaciones de Quintana Roo.
Pielou, E. C. (1977). Mathematical ecology. New York: Wiley.
Piotrowska, K. (2008). Ecological features of flowers and the amount of pollen released in Corylus avellana (L.) and Alnus glutinosa (L.) Gaertn. Acta Agrobotanica, 61, 33–39. https://doi.org/10.5586/aa.2008.004
Potter, L. D. y Rowley, J. (1960). Pollen rain and vegetation, San Augustin Plains, New Mexico. Botanical Gazette, 122, 1–25. https://doi.org/10.1086/336081
Ramírez-Arriaga, E., Prámparo, M. B., Nieto-Samaniego, A. F., Martínez-Hernández, E., Valiente-Banuet, A., Macías-Romo, C. et al. (2014). Palynological evidence for Middle Miocene vegetation in the Tehuacán Formation of Puebla, Mexico. Palynology, 38, 1–27. https://doi.org/10.1080/01916122.2013.802750
Ramírez-Arriaga, E., Prámparo, M. B., Nieto-Samaniego, A. F. y Valiente-Banuet, A. (2017). Eocene Mequitongo Formation palinoflora from the intertropical Tehuacán-Cuicatlán Valley, Mexico. Review of Paleobotany and Paynology, 246, 14–31. https://doi.org/10.1016/j.revpalbo.2017.06.001
Ramírez-Bravo, O. E. y Hernández-Santin, L. (2016). Plant diversity along a disturbance gradient in a semi-arid ecosystem in Central Mexico. Acta Botanica Mexicana, 117, 11–25. https://doi.org/10.21829/abm117.2016.1164
Rojas, S., Castillejos-Cruz, C. y Solano, E. (2013). Florística y relaciones fitogeográficas del matorral xerófilo en el Valle de Tecozautla, Hidalgo, México. Botanical Sciences, 91, 273–294. https://doi.org/10.17129/botsci.8
Rosales-Torres, S. (2016). Reconstrucción paleoflorística a partir de los conjuntos palinológicos recuperados de los lacustres Villa Alegría y cerro Prieto en el Valle de Tehuacán-Cuicatlán, Puebla y Oaxaca (Tesis de maestría). Universidad Autónoma Metropolitana. Ciudad de México.
Rosales-Torres, S., Ramírez-Arriaga, E., Martínez-Bernal, A., Zárate-Hernández, M. R., Valiente-Banuet, A. y Márquez-García, A. Z. (2017). Palinoflora del Plioceno-Pleistoceno recuperada de los travertinos Villa Alegría y cerro Prieto en el valle de Tehuacán-Cuicatlán, México. Revista Mexicana de Ciencias Geológicas, 34, 114–137. https://doi.org/10.22201/cgeo.20072902e.2017.2.461
Roubik, D. W. y Moreno, J. E. (1991). Pollen and spores of Barro Colorado Island (Monographs in Systematic Botany). Saint Louis, Missouri: Missouri Botanical Garden.
Ruiz-Zapata, M. B. y García-Anton, M. (1987). La palinología y su aplicación al estudio de la reconstrucción de la vegetación durante el cuaternario (1): consideraciones generales. Henares: Revista de Geología, 1, 77–84.
Rzedowski, J. (1978). Vegetación de México. Ciudad de México: Limusa.
Rzedowski, J. y Palacios-Chávez, R. (1977). El bosque de Engelhardtia (Oreomunnea) mexicana en la región de La Chinantla (Oaxaca, México). Una reliquia del cenozoico. Boletín de la Sociedad Botánica de México, 36, 93–127. https://doi.org/10.17129/botsci.1161
Rzedowski, J., Zamudio, S., Calderón-de Rzedowski, G. y Paizanni, A. (2014). El bosque tropical caducifolio en la cuenca lacustre de Pátzcuaro (Michoacán, México). En Flora del Bajío y de regiones adyacentes (Fascículo complementario XXIX). Pátzcuaro, Michoacán: Instituto de Ecología, Centro Regional del Bajío.
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2013). Programa de manejo Reserva de la Biosfera Tehuacán-Cuicatlán. Ciudad de México: Comisión Nacional De Áreas Naturales Protegidas.
Shannon, C. E. (1948). A mathematical theory of communication. Bell System Technical Journal, 27, 379–423.
Sørensen, T. (1948). A method of establishing groups of equal amplitude in plant sociology based on similarity of species and its application to analyses of the vegetation on Danish commons. Biologiske Skrifter, 5, 1–34.
Steinmann, V. W. (2009). Flora del valle de Tehuacán-Cuicatlán. Fascículo 68, Urticaceae. Ciudad de México: Instituto de Biología, Universidad Nacional Autónoma de México.
Tejero-Diez, D., Reyes-Salas, M. y Martínez-Hernández, E. (1988). Lluvia de polen moderno en un gradiente altitudinal con vegetación templada en el Municipio de Ocuilan, Edo. Méx. Palynologica et Paleobotanica, 1, 61–80.
Tormo, M. R., Muñoz, R. A., Silva, P. I. y Gallardo, L. F. (1996). Pollen production in anemophilous tres. Grana, 35, 38–46. https://doi.org/10.5586/aa.2008.005
Trejo-Vázquez, I. (1999). El clima de la selva baja caducifolia en México. Investigaciones Geográficas, 39, 40–52. https://doi.org/10.4067/s0716-078×2002000100009
Valiente-Banuet, A. (2002). Vulnerabilidad de los sistemas de polinización de cactáceas columnares de México. Revista Chilena de Historia Natural, 75, 99–104.
Valiente-Banuet, A., Casas, A., Alcántara, A., Dávila, P., Flores-Hernández, N., Arizmendi, M. C. et al. (2000). La vegetación del valle de Tehuacán-Cuicatlán. Boletín de la Sociedad Botánica de México, 67, 24–74. https://doi.org/10.17129/botsci.1625
Valiente-Banuet, A., Solís, L., Dávila, P., Arizmendi, M. C., Silva, P. C., Ortega-Ramírez, J. et al. (2009). Guía de la vegetación del valle de Tehuacán-Cuicatlán. México: Universidad Nacional Autónoma de México, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Instituto Nacional de Antropología e Historia, Universidad Autónoma de Tamaulipas, Fundación para la Reserva de la Biosfera Cuicatlán.
Vasquez-Velasco, B. (2018). Estructura y composición florística de la selva baja caducifolia en San José Tilapa, Puebla (Tesina). Universidad Autónoma Metropolitana. Ciudad de México.
Velázquez-Silva, A. L. (2008). Lluvia de polen en un gradiente altitudinal en la ladera NW del Volcán La Malinche, Tlaxcala, México (Tesis de Maestría). Instituto Politécnico Nacional. Ciudad de México.
Villanueva-Almanza, L. y Fonseca, R. M. (2011). Revisión taxonómica y distribución geográfica de Ephedra (Ephedraceae) en México. Acta Botanica Mexicana, 96, 79–116. https://doi.org/10.21829/abm96.2011.261
Webb, T. III (1987). The appearance and disappearance of major vegetational assemblages: long term vegetational dynamics in eastern North America. Vegetatio, 69, 177–188. https://doi.org/10.1007/978-94-009-4061-1_18



