Dieta de la nutria neotropical (Lontra longicaudis annectens) en Pueblo Nuevo, Durango, México
Francisco Cruz-García⁎ ✉ , Armando Jesús Contreras-Balderas, Juan Antonio García Salas, Juan Pablo Gallo-Reynoso
Resumen
El objetivo del presente trabajo fue determinar la dieta de la nutria neotropical en la parte alta del río San Diego. Esta especie es un depredador considerado como indicador de la calidad de los ecosistemas acuáticos, además de estar catalogada como amenazada en México, por lo que es indispensable realizar estudios para conocer su biología y ecología. El monitoreo se realizó durante 2 años (2012-2013), se muestrearon 8 km sobre el río, los cuales se dividieron en 3 segmentos de igual tamaño, se recolectaron 266 heces y se identificaron los distintos ítems alimenticios encontrados en las mismas. La dieta se separó en 7 categorías, siendo los invertebrados y los peces los de mayor porcentaje de aparición (39.45 y 34.86%, respectivamente) y en menor presencia plantas, anfibios, mamíferos, reptiles y un 4.95% corresponde a elementos no identificados. Se encontraron elementos de todas las categorías en el periodo de primavera. Gila conspersa, Corydalus texanus y Abedus sp. se observaron con mayor frecuencia en la dieta. No existieron diferencias significativas en la dieta entre estaciones del año ni entre los segmentos del río muestreados, solo entre temporada de secas y lluvias para el año 2012.
Palabras clave
Diet of the neotropical otter (Lontra longicaudis annectens) in Pueblo Nuevo, Durango, Mexico
The aim of this study was to determine the diet of the neotropical otter in the upper San Diego River. Neotropical otters are predator considered as an indicator of the quality of the aquatic ecosystems, the species is listed as threatened in Mexico; therefore it is essential to conduct studies to understand their biology and ecology. The monitoring was carried out for 2 consecutive years (2012-2013), a longitudinal section of the river of 8 km was surveyed, it was divided into 3 equal sections. A total of 266 scats were collected, food items found in them were identified. Diet was conformed by 7 categories of prey, invertebrates and fish representing the highest percentage (39.45% and 34.86%, respectively), with a smaller presence plants, amphibians, mammals, birds, reptiles and 4.95% of unidentified items. Items in all categories were found in spring. Gila conspersa, Corydalus texanus and Abedus sp., were the most often species found in the diet. There were no significant differences in diet between seasons, or segments of the river (only between dry and rainy season for the year 2012).
© 2017 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Keywords:
Diversity index; Relative frequency; Proportion of appearance; Rarefaction
Introducción
La nutria neotropical Lontra longicaudis annectens es un depredador generalista ubicado en el nivel trófico más elevado. Su amplia distribución geográfica abarca desde el norte de México hasta la zona central de Argentina, a lo largo de la cual ocupa diversos hábitats acuáticos ( Gallo, 1989; Spínola y Vaughan, 1995 ). La nutria vive en áreas con ciertos requisitos del paisaje: una amplia vegetación ribereña, suficiente alimento y buena cobertura de vegetación para facilitar su escape ( Botello, 2004; Colares y Waldemarin, 2000; Gori, Carpaneto y Ottino, 2003 ), ya que en los márgenes del cauce es donde realizan actividades como descanso, marcaje de territorio, acicalamiento y cría de cachorros ( Chanin, 1985; Kruuk, 1995).
Su alimentación se basa en peces, pero ocasionalmente comen crustáceos, moluscos, anfibios, reptiles, insectos, aves e incluso pequeños mamíferos. En general, son animales oportunistas y su dieta varía de acuerdo a la región geográfica donde se encuentren ( Chanin, 1985).
Algunos autores exponen que las nutrias son los principales depredadores capaces de mantener un equilibrio en la estructura de la comunidad y la densidad de sus presas en los ecosistemas acuáticos ( Anoop y Hussein, 2005 ). Los estudios sobre la dieta son importantes en la ecología de los vertebrados, en particular de mamíferos carnívoros ( Gittleman, 1989; Monroy-Vilchis, Gómez, Janczur y Urios, 2009 ). En los carnívoros, el alimento puede condicionar la organización social, el uso de hábitat y las tasas de reproducción ( Braña, Naves y Palomero, 1987 ). La dieta en los carnívoros es un aspecto biológico ampliamente estudiado, cuyo objetivo tradicional ha sido entender las interacciones que tienen con su medio y en particular con las especies presa ( Casariego-Madorell, List y Ceballos, 2006; Guerrero, Badii, Zalapa y Flores, 2002; Monroy-Vilchis et al., 2009; Servín y Huxley, 1991 ).
Actualmente en México, la nutria se encuentra como «amenazada» de acuerdo a la NOM-059-SEMARNAT-2010 ( Semarnat, 2010 ). Además, se encuentra en el apéndice i de CITES (CITES, 2016 ) y en la lista roja de especies amenazadas la podemos encontrar en la categoría de casi amenazada ( Rheingantz y Trinca, 2015 ). En Durango, existen pocos estudios documentados sobre la presencia de la nutria y más escasos aun sobre la dieta de esta especie, por lo que el objetivo del presente trabajo fue identificar los grupos taxonómicos que componen la dieta de la nutria en la parte alta del río San Diego en Pueblo Nuevo, Durango, información que coadyuvará a la conservación de esta especie.
Materiales y métodos
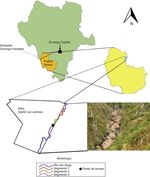
El estudio se llevó a cabo en el ejido Adolfo Ruiz Cortínez (sic), municipio de Pueblo Nuevo, Durango, México, el cual se ubica en: 23°44’08” N, 105°17’52” O (fig. 1 ), en la región suroeste del estado de Durango, en las estribaciones de la Sierra Madre Occidental, en la subprovincia Cañones Duranguenses, a 20 km al sureste de la ciudad de El Salto, Pueblo Nuevo, Durango ( AFAE, 2007 ). El área se encuentra en la región hidrológica 11 (Presidio-San Pedro) y comprende a las cuencas B (río Acaponeta) que incluye la subcuenca d (Q. San Vicente) ( Inegi, 2016 ). Específicamente el estudio se realizó en la parte que comprende el río San Diego, en la quebrada de Galindo. En esta área el río se encuentra encañonado, solo se tienen partes abiertas al principio y al final del tramo muestreado. En las partes altas, la vegetación está compuesta por bosque de Pinus y Quercus principalmente, y en la parte baja a las orillas del río se observa vegetación ribereña conformada por los géneros: Salix, Populos, Bursera, Lysiloma y Pithecellobium , entre otros. Según la clasificación climática de Köppen adaptada para México por García (1981) , los climas presentes en el predio son: C(W2)-templado subhúmedo y C(E)(W2)-semifrío subhúmedo.
Figura 1
Ubicación de la zona de estudio.
Se muestrearon 8 km del río divididos en 3 segmentos de 2.6 km aproximadamente, considerando diferencias fisiográficas: profundidad del río, ancho del cauce, tipo de flujo, encañonado o abierto y presencia de chorros de agua caliente. Se realizaron recorridos por la ribera del río en cada estación del año (de 2012 a 2013). Los recorridos se efectuaron caminando por la orilla del río. Las heces encontradas durante el recorrido se colocaron en bolsas de papel, rotuladas con la fecha y la posición geográfica ( Monroy-Vilchis y Mundo, 2009 ). La identificación de las heces se realizó considerando: forma de la excreta y olor de la misma (siempre presentan un olor almizclado; Macías-Sánchez, 2003 ). Se procesaron en el Laboratorio de Ornitología de la Universidad Autónoma de Nuevo León, donde se lavaron en agua corriente y posteriormente fueron secadas a temperatura ambiente. Los componentes fueron separados con ayuda de pinzas y agujas de disección ( Macías-Sánchez y Aranda, 1999 ). Para la determinación específica de los restos óseos de mamíferos (mandíbulas, dientes y extremidades) se hizo una comparación con ejemplares de laboratorio y la guía de pelos de guardia de Monroy-Vilchis y Rubio-Rodríguez (2003) . En el caso de los peces y anfibios, mediante la comparación de ejemplares colectados en campo usando la identificación de vértebras, espinas, escamas, cráneos, dientes faríngeos y otolitos. Para insectos, se utilizaron guías taxonómicas de identificación ( Fierros-López, 2003 ); en cuanto a la vegetación ingerida, el reconocimiento se realizó mediante la comparación con ejemplares del laboratorio de botánica y con ayuda de especialistas del Instituto Tecnológico de El Salto, Pueblo Nuevo, Durango. El material fue identificado hasta el nivel taxonómico posible ( Monroy-Vilchis y Mundo, 2009).
Para determinar las especies más importantes en la dieta se utilizaron 2 índices ( Helder y de Andrade, 1997): 1) la frecuencia de aparición de cada especie presa en las muestras; FA = fi/N*100 donde: fi es el número de heces en los que aparece la especie i y N es el número total de heces; 2) la proporción de aparición de cada especie presa en las muestras; PA = fi/F*100 donde: fi es el número de heces en las que aparece la especie i y F el número total de apariciones de todas las especies en todas las heces, que se obtienen sumando las fi.
Se obtuvieron los índices de diversidad de Shannon (1948) por segmento del río muestreado para las 4 estaciones del año (primavera, verano, otoño e invierno) y para las temporadas de secas y de lluvias.
donde: k es el número de categorías, pi es la proporción de las observaciones encontradas en la categoría i. Denota n para ser tamaño de la muestra y fi para ser el número de observaciones en la categoría i. Entonces pi = fi/n.
Posteriormente se realizó la comparación entre los índices de diversidad, para las temporadas secas y lluvias. Se aplicó una prueba «T» de student para ver si existía diferencia significativa. Las estaciones del año se compararon mediante un análisis de varianza completamente al azar de un factor ( Zar, 1999 ), y para conocer si existían diferencias entre los 3 segmentos del río, se realizaron curvas de rarefacción, las cuales nos permiten hacer comparaciones de riqueza de especies o diversidad de Shannon en este caso entre comunidades, cuando el tamaño de las muestras no es igual ( Moreno, 2001).
Resultados
Se recolectaron 116 y 150 heces durante el 2012 y 2013 respectivamente, de las cuales se identificaron 7 grupos alimenticios: los invertebrados (insectos, arácnidos, diplópodos y gastrópodos) fueron los de mayor porcentaje de aparición total para los 2 años de muestreo, con un 39.45%, seguido de peces (34.86%), plantas (8.26%), anfibios (8.07%), mamíferos (2.20%), aves (1.83%) y reptiles (0.37%), el 4.95% restante fueron grupos no identificados.
El segmento 2 presentó un mayor número de ítems alimenticios por grupo para los 2 años de muestreo, seguido del segmento 3, destacando los invertebrados y peces con mayor porcentaje de frecuencia en ambos segmentos, y aunque en el segmento 1 los valores de frecuencia fueron más bajos que para los otros 2, igualmente destacan estos 2 grupos alimenticios como los más frecuentes ( fig. 2).
Figura 2
Total de ítems por segmento incluyendo los 2 años de muestreo. Seg 1 (aguas arriba), seg 2 (intermedio), seg 3 (aguas abajo).
La única estación del año en la que se encontraron ítems de todos los grupos alimenticios fue en la primavera. Peces, invertebrados, anfibios y plantas estuvieron presentes en todas las estaciones del año, los demás solo se observaron en una ó 2 estaciones, como las aves y reptiles que únicamente se encontraron para el periodo de primavera ( fig. 3).
Figura 3
Total ítems por grupos alimenticios incluyendo los 2 años de muestreo.
El pez Gila conspersa presentó los valores más altos de frecuencia de aparición y de porcentaje de aparición para ambos años (FA 1 = 56.03; PA1 = 25.69 y FA2 = 83.33; PA2 = 30.12), seguido de los insectos Corydalus texanus (FA1 = 27.59; PA1 = 12.65 y FA2 = 61.33; PA2 = 22.17) y Abedus sp. (FA1 = 18.97; PA1 = 8.70 y FA2 = 53.33; PA2 = 19.28). Estas mismas especies fueron las más consumidas por la nutria en general para todo el periodo de muestreo (F = 190, F = 124 y F = 102, respectivamente). Por otra parte, las especies menos consumidas fueron ítems del grupo de las plantas las cuales no pudieron ser identificadas ( tabla 1).
Tabla 1
Contenido de muestras fecales de la nutria, frecuencia (F), frecuencia de aparición (FA) y porcentaje de aparición (PA) en los dos años de muestreo.
| Morfo | Nombre del ítem | F 2012 (n = 116) | FA1 | PA1 | F 2013 (n = 150) | FA2 | PA2 |
| 1 | Peces | ||||||
| Gila conspersa | 65 | 56.03 | 25.69 | 125 | 83.33 | 30.12 | |
| 2 | Insectos | ||||||
| Corydalus texanus | 32 | 27.59 | 12.65 | 92 | 61.33 | 22.17 | |
| 3 | Ladona sp. | 22 | 18.97 | 8.70 | 61 | 40.67 | 14.70 |
| 4 | Abedus sp. | 22 | 18.97 | 8.70 | 80 | 53.33 | 19.28 |
| 5 | Lethocerus sp. | 17 | 14.66 | 6.72 | 12 | 8.00 | 2.89 |
| 6 | Ambrysus sp. | 4 | 3.45 | 1.58 | 1 | 0.67 | 0.24 |
| 7 | Orden: Orthoptera | 5 | 4.31 | 1.98 | 2 | 1.33 | 0.48 |
| 8 | Orden: Coleoptera | 3 | 2.59 | 1.19 | 0 | 0 | 0 |
| 9 | Orden: Coleoptera | 11 | 9.48 | 4.35 | 0 | 0 | 0 |
| 10 | Arácnidos | ||||||
| Mastigoproctus giganteus | 4 | 3.45 | 1.58 | 0 | 0 | 0 | |
| Diplópodos | |||||||
| 11 | Clase: Diplopoda | 5 | 4.31 | 1.98 | 0 | 0 | 0 |
| Gastrópodos | |||||||
| 12 | Clase: Gastropoda
Plantas |
9 | 7.76 | 3.56 | 1 | 0.67 | 0.24 |
| 13 | Juniperus sp. | 15 | 12.93 | 5.93 | 2 | 1.33 | 0.48 |
| 14 | Planta 1 (no identificada) | 1 | 0.86 | 0.40 | 0 | 0 | 0 |
| 15 | Arbutus sp. | 8 | 6.90 | 3.16 | 0 | 0 | 0 |
| 16 | Planta 2 (no identificada) | 3 | 2.59 | 1.19 | 2 | 1.33 | 0.48 |
| 17 | Planta 3 (no identificada) | 5 | 4.31 | 1.98 | 5 | 3.33 | 1.20 |
| 18 | Planta 4 (no identificada) | 3 | 2.59 | 1.19 | 0 | 0 | 0 |
| 19 | Planta 5 (no identificada) | 1 | 0.86 | 0.40 | 0 | 0 | 0 |
| 20 | Mamíferos | ||||||
| Orden: Rodentia | 6 | 5.17 | 2.37 | 0 | 0 | 0 | |
| 21 | Aves | ||||||
| Clase: Aves | 1 | 0.86 | 0.40 | 2 | 1.33 | 0.48 | |
| 22 | Reptiles | ||||||
| Thamnophis validus | 0 | 0.00 | 0.00 | 2 | 1.33 | 0.48 | |
| 23 | Anfibios | ||||||
| Hyla arenicolor | 11 | 9.48 | 4.35 | 28 | 18.67 | 6.75 |
La diversidad de Shannon del total de los ítems alimenticios presentó diferencias significativas (t = 2.09; p = 0.03) entre la temporada de secas (H¿ = 2.5) y de lluvias (H¿ = 2.3) para el año 2012, mientras que para el año 2013 no hubo diferencias significativas (t = 1.31; p = 0.19) entre estas 2 temporadas (H’ secas = 1.7; H¿lluvias = 1.6). Considerando todo el periodo de muestreo, los resultados mostraron diferencias altamente significativas (t = 9.86; p = 4.87E-21) entre el 2012 y 2013 (H¿ 2012 = 2.5; H¿2013 = 1.7). El índice de diversidad Shannon fue más alto para las 4 estaciones del año en el 2012, que para las mismas estaciones en el 2013; igualmente para los segmentos por año, fueron más bajos los valores para el 2013 que para el 2012 ( tabla 2).
Tabla 2
Índice de diversidad de Shannon por segmento del río, temporadas y estaciones del año.
| Año | Temporada | Estación | Segmento | ||||||
| Secas | Lluvias | Primavera | Verano | Otoño | Invierno | 1 | 2 | 3 | |
| 2012 | 2.55 | 2.3 | 2.36 | 2.24 | 2.25 | 2.4 | 2.17 | 2.59 | 2.52 |
| 2013 | 1.78 | 1.68 | 1.78 | 1.59 | 1.6 | 1.67 | 1.67 | 1.73 | 1.81 |
Comparando las 4 estaciones del año, no se encontraron diferencias significativas en los valores de diversidad de la dieta para el periodo de muestreo ( fig. 4 ). En las curvas de rarefacción de la diversidad de Shannon ( fig. 5 ) se observa que los intervalos de confianza para los 3 segmentos se interponen entre sí, lo que indica que no existen diferencias significativas entre ninguno de estos.
Figura 4
Comparación de los índices de diversidad en la dieta entre las 4 estaciones climáticas para todo el periodo de muestreo.
Figura 5
Curvas de rarefacción de la diversidad de Shannon de los 3 segmentos a lo largo de los 2 años de muestreo.
Discusión
Lontra longicaudis annectens es un depredador tope en las redes tróficas acuáticas y es reconocida como una especie ictiófaga ( Espitia, Causil, Arcila, Barbosa y Mona, 2006; González, Utrera y Castillo, 2004 ). No obstante, también consume otros organismos asociados a los cuerpo de agua, como insectos, reptiles y cangrejos ( Arcila, 2003 ), lo que concuerda con los resultados de este estudio, ya que a pesar de consumir mayormente peces, insectos y otros invertebrados, la nutria ocasionalmente se alimentó de anfibios, plantas, mamíferos, aves y reptiles. Gallo (1989) registró estos mismos grupos taxonómicos en la dieta de la nutria excepto por las plantas. El grupo de los crustáceos no fue observado, aunque sí ha sido reportado como parte primordial de la dieta para otras regiones del país ( Gallo, 1989; Macías-Sánchez y Aranda, 1999; Spínola y Vaughan, 1995 ), posiblemente porque las condiciones ambientales y geográficas de la región no favorecen el desarrollo de estos organismos, como por ejemplo, las especies del género Macrobrachium características de áreas tropicales, subtropicales y templadas, con temperatura anual mínima de 16 °C y máxima de 32 °C, encontrándose desde el nivel del mar hasta los 1,500 m snm. ( Vega-Villasante, Martínez-López, Espinosa-Chaurand, Cortés-Lara y Nolasco-Soria, 2011 ); que comparado con el área muestreada, esta se encuentra por arriba de los 1,500 m snm, con climas templado subhúmedo y semifrío subhúmedo con temperaturas menores a los 5 °C. Kasper, Feldens, Salvi y Zanardi-Grillo (2004) y Gallo (1989) mencionan que los peces son la principal fuente de alimentación de la nutria para Brasil y el norte de México, respectivamente, lo que concuerda con los resultados obtenidos de este trabajo. El pez Gila conspersa fue la especie más consumida, aunque por grupo de alimentación, los invertebrados fueron los de mayor frecuencia. El último autor menciona que los reptiles y los anfibios, en especial las ranas ( Rana sp., Hyla sp., Smilisca baudini , etc.), son comúnmente consumidas por las nutrias; a pesar de que las tortugas y las serpientes son abundantes en su hábitat, pocas veces son consumidas. Resultados similares fueron encontrados en este trabajo, donde Hyla arenicolor fue consumida en la mayoría de los meses, excepto en septiembre y diciembre. No se encontraron restos de tortugas, solo se observaron de la culebra (Thamnophis validus) en 2 heces durante la primavera del 2013. Macías-Sánchez (1998) menciona a Basiliscus vittatus (F = 88; n = 474) como la única especie de reptil observada en su estudio.
Los mamíferos han sido registrados en una baja incidencia en la dieta de la nutria neotropical ( Rangel y Gallo, 2013; Restrepo y Botero-Botero, 2012 ), coincidiendo con lo encontrado en este trabajo, ya que solo se observó la presencia de este grupo en 6 heces en el 2012. Franco y Soto-Gamboa (2011) encontraron restos de mamíferos en una hez para L. provocax en Chile. Greer (1955) obtuvo un 6.1% de restos de mamíferos en un total de 1,374 heces para L. canadensis en Montana, EE. UU. El grupo de las aves, al igual que el de mamíferos y reptiles fue poco representativo (1.83%), con solo una presencia para el 2012 y 3 para el 2013; porcentajes similares reportados en Oaxaca con un 1.77% en 161 heces ( Duque-Dávila, Martínez, Botello y Sánchez, 2013 ), un 3.2% en un río de Jalisco ( Díaz-Gallardo, Íñiguez-Dávalos y Santana, 2007 ) y un 1.4% en Veracruz ( Macías-Sánchez y Aranda, 1999 ; aunque el estudio de Gallo-Reynoso, Ramos-Rosas y Rangel-Aguilar (2008) en el río Yaqui denota una especialización en la depredación local de aves, debida a su abundancia; estos autores mencionan que las aves encontradas eran especies asociadas al ambiente acuático y ribereño.
Las semillas o restos de plantas son poco observadas en la mayoría de los trabajos sobre dieta en la nutria neotropical. En esta investigación, los resultados muestran 7 tipos de material vegetal en 45 heces, 42 para el 2012 y solo 3 para el 2013; no se observaron restos de hojas o tallos, todos fueron semillas. Algunos restos se identificaron hasta género como el caso de Juniperus y Arbutus. Gallo-Reynoso y Casariego (2005) señalan que las nutrias pueden ser consideradas excelentes dispersores de semillas por efecto del consumo de frutos; Díaz-Gallardo et al. (2007) también mencionan que encontraron semillas (1%) en las heces colectadas en el río Ayuquila, Jalisco; Briones-Salas, Peralta-Pérez y Arellanes (2013) reportan 1.06% de plantas para la costa de Oaxaca, mientras que Monroy-Vilchis y Mundo (2009) encuentran un porcentaje de aparición del 1.7% en la cuenca del río Balsas en el Estado de México; como se puede ver, la incidencia de este grupo es poco significativa en la dieta de la nutria.
Los invertebrados que formaron parte de la dieta de la nutria fueron insectos, arácnidos, diplópodos y gasterópodos, de los cuales, Corydalus texanus (etapa larvaria), Abedus sp. y Lethocerus sp. (hemípteros), Ladona sp. (odonato) fueron consumidos con mayor frecuencia en los 2 años de muestreo. Gallo (1989) hace una división en los insectos, mencionando libélulas con un 2.6%, Lethocerus sp. con un 8% y a otros insectos del orden Hemiptera con un 11%. En este estudio igualmente se encontraron taxones del orden Hemiptera, tal es el caso de los géneros: Abedus, Ambrysus y Lethocerus. Mientras que el género Corydalus, es reportado por Briones-Salas et al. (2013) con un porcentaje de aparición de 0.022 para el río Zimatán en Oaxaca; Restrepo y Botero-Botero (2012) también registran este género con un 15% en el Alto Cauca, Colombia, y Mayor-Victoria y Botero-Botero (2010) con un 9% en el río Roble en Colombia. Gallo (1989) menciona que los moluscos de agua dulce como almejas y caracoles se han reportado como parte de la dieta de otras especies de nutria, pero su frecuencia es baja pudiendo ser comidos accidentalmente o apareciendo solamente como parte de la dieta de la presa. En este estudio, los restos de caracoles se encontraron en 10 heces, 9 en el 2012 y una en el 2013. Se observaron restos de Mastigoproctus giganteus (Arachnida) en 4 heces recolectadas en el 2012. Charre-Medellín, López-González, Lozano y Guzmán (2011) mencionan la presencia de un arácnido en heces recolectadas en la cuenca del río Mezquital-San Pedro. Por otra parte, Gallo-Reynoso et al. (2008) observaron restos del arácnido Philodromus en heces recolectadas en el río Yaqui, en Sonora. Morales, Lizana y Acera (2004) reportan arácnidos con un porcentaje de aparición del 1.08% en la dieta de Lutra lutra en el río Francia en Salamanca, España; así como material perteneciente a la clase Diplopoda (mil pies) con 0.43% de aparición. En este trabajo se registró la presencia de este grupo en 5 heces en el año 2012.
Monroy-Vilchis y Mundo (2009) no encontraron diferencias significativas entre temporada de secas y de lluvias en la dieta de la nutria; mientras que Macías-Sánchez (1998) observó que para la temporada de secas los crustáceos presentaron mayor porcentaje de aparición, seguido de los peces, y para la época de lluvias, este grupo fue el más consumido, obteniendo un valor de amplitud del nicho trófico mayor en temporada de secas (0.72) que de lluvias (0.46). A pesar de que la amplitud de nicho trófico no se calculó en este trabajo, sí se encontraron diferencias significativas en los valores de diversidad de Shannon entre la temporada de secas y de lluvias para el año 2012; no así para estas mismas temporadas en el 2013, siendo la temporada de secas la que presentó un valor mayor en este índice para ambos años. Otros autores no encontraron diferencias significativas en el consumo de las presas entre temporadas ( Casariego-Madorell, List y Ceballos, 2008 ).
En cuanto a investigaciones realizadas sobre la dieta de la nutria neotropical analizada para las 4 estaciones climáticas, no existen estudios documentados que hagan referencia a esta división. Sin embargo, Toca (2000) comparó la dieta de Lutra lutra entre las estaciones del año y encontró diferencias significativas entre primavera y verano, primavera y otoño, verano e invierno y otoño e invierno.
Entre los 3 segmentos del río, no hay diferencias significativas en la dieta, aunque el segmento 1 tuvo un menor solapamiento. Morales, Díez y Lizana (2010) no encontraron diferencias en la dieta de la nutria entre las localidades de muestreo debido al cambio continuo de las condiciones del río y a la disponibilidad de presas entre las zonas bajas y altas; las dietas se solapan más en localidades más próximas. Comparando estos datos con lo obtenido en este estudio, hay coincidencias en un mayor traslape en los intervalos de confianza entre los segmentos próximos (2 y 3) aguas abajo. Además, se ha indicado que el mayor número de especies presentes en las partes bajas de los ríos es resultado de la presencia de ambientes más estables, con menores fluctuaciones ambientales, en comparación con las partes más altas, donde existe mayor variabilidad ambiental ( Rodríguez-Pérez y Contreras, 2012 ).
En este trabajo, todos los valores de diversidad en la dieta fueron más altos en el 2012 que en el 2013, lo que podría explicarse por el efecto del estrés ambiental hacia los grupos presa primordiales de la nutria (peces e insectos acuáticos), que podrían estarse desplazando aguas abajo, por búsqueda de alimento o por su baja reproducción, orillando a la nutria a consumir otras especies. En esta región en particular, el año 2012 fue un año seco, con una precipitación de 798 mm, además de que venía arrastrando un déficit de lluvias desde el año 2011 con una precipitación de 573 mm, en comparación con el año 2013 cuya precipitación fue de 975 mm el cual fue mucho más húmedo.
Durante el periodo de sequía ocurre una contracción del medio acuático, por lo que se restringe enormemente el aporte de alimento alóctono para los peces, el cual se origina en los ecosistemas terrestres circundantes y termina siendo aportado al medio acuático disminuyendo la productividad acuática por el de cremento de la carga de nutrientes del río ( Galvis et al., 2006 ). La mayoría de las poblaciones de peces no pueden sobrevivir, o sufren importantes pérdidas durante las sequías prolongadas ( Merron, Brutonand y la Hausse-de Lalouviere, 1993 ). Cuando una población de plantas o de animales es interferida en alguna de sus funciones vitales por alteraciones significativas de los pulsos, tarde o temprano será desplazada o eliminada del sistema. Esta alteración estructural ocurre en la naturaleza en forma temporal como consecuencia de sequías o inundaciones extraordinarias. De hecho, muchos organismos de vida larga (árboles y peces) atraviesan periodos adversos en los cuales no se reproducen o no crecen por estas alteraciones ( Neiff, 1999 ). Además, los insectos de la familia Belostomatidae que fueron consumidos con mayor frecuencia por la nutria, a pesar de ser eminentemente acuáticos, suelen abandonar temporalmente su medio natural, debido a su gran capacidad para el vuelo ( Schnack, 1976). Según De Carlo (1938) , esto generalmente ocurre cuando se extinguen los cuerpos de agua que habitan, fenómeno que obedece a factores climáticos. La temporada climática es un parámetro abiótico con gran influencia en los cambios de las comunidades macrobentónicas ( Robinson y Minshall, 1986 ). En los arroyos tropicales, la precipitación desempeña esta importante función en los cambios en la estructura de la comunidad bentónica.
Debido a lo anterior, se plantea que las nutrias no se movieron de lugar o incrementaron el tamaño de su territorio, sino que buscaron una mayor diversidad de especies presa (plantas, anfibios, aves, reptiles y mamíferos) para compensar la falta de dieta primordial (peces e insectos acuáticos).
Agradecimientos
A los pobladores del ejido Adolfo Ruiz Cortínez (sic) por permitirnos realizar este estudio en su comunidad; al Conacyt por el apoyo con la beca doctoral del primer autor; al personal del Laboratorio de Entomología, Ictiología y Ornitología de la Facultad de Ciencias Biológicas de la Universidad Autónoma de Nuevo León, que ayudaron a la realización de este trabajo.
Referencias
AFAE, 2007
AFAE (Asesoría Forestal y Ambiental Especializada) (2007). Programa de manejo forestal (2007-2016). Ejido Adolfo Ruiz Cortines, Pueblo Nuevo, Dgo.: AFAE.
Anoop y Hussain, 2005
K.R. Anoop
S.A. Hussain
Food and feeding habits of smooth-coated otters (Lutra perspicillata) and their significance to the fish population of Kerala, India
Journal of Zoology
266
2005
15-23
Arcila, 2003
Arcila, D. A. (2003). Distribución, uso de microhábitat y dieta de la nutria neotropical Lontra longicaudis (Olfers 1818) en el cañón del río Alicante, Antioquia, Colombia (Tesis ). Medellín, Colombia: Universidad de Antioquia.
Botello, 2004
Botello, J. (2004). Evaluación del estado de la nutria de río Lontra longicaudis (Olfers 1818) en el río Cauca, zona de influencia del municipio de Cali-Departamento del Valle del Cauca . Bogotá: CVC. Fundación Natura.
Braña et al., 1987
Braña, F., Naves, J. y Palomero, G. (1987). Hábitos alimenticios y configuración de la dieta del oso pardo en la cordillera cantábrica. Coloquio Internacional sobre el oso pardo , 14-15 de noviembre de 1987, Seix (Arilge), Francia.
Briones-Salas et al., 2013
M. Briones-Salas
M.A. Peralta-Pérez
E. Arellanes
Análisis temporal de los hábitos alimentarios de la nutria neotropical (Lontra longicaudis) en el río Zimatán en la costa de Oaxaca México
Therya
4
2013
311-26
Casariego-Madorell et al., 2006
A.A. Casariego-Madorell
R. List
G. Ceballos
Aspectos básicos sobre la ecología de la nutria de río (Lontra longicaudis annectens) para la costa de Oaxaca
Revista Mexicana de Mastozoología
10
2006
71-4
Casariego-Madorell et al., 2008
M.A. Casariego-Madorell
R. List
G. Ceballos
Tamaño poblacional y alimentación de la nutria de río (Lontra longicaudis annectens) en la costa de Oaxaca México
Acta Zoológica Mexicana
24
2008
179-200
Chanin, 1985
P. Chanin
The natural history of otters
1985
Charre-Medellín et al., 2011
J.F. Charre-Medellín
C. López-González
A. Lozano
A.F. Guzmán
Estado actual del conocimiento sobre la nutria neotropical (Lontra longicaudis annectens) en el estado de Durango México
Revista Mexicana de Biodiversidad
82
2011
1343-7
CITES, 2016
CITES (2016). Apéndices I, II y III. Convención sobre el comercio internacional de especies amenazadas de fauna y flora silvestres. UNEP. Centro Mundial de Monitoreo de la Conservación, Ginebra, Suiza.
Colares y Waldemarin, 2000
E.P. Colares
H.F. Waldemarin
Feeding of the neotropical river otter Lontra longicaudis in the coastal region of rio Grande do Sul State, southern Brazil UICN otter specialist group bull
Wageningen
17
2000
6-13
De Carlo, 1938
J.A. De Carlo
Los belostómidos americanos (Hemiptera)
Revista del Museo Argentino de Ciencias Naturales
39
1938
189-260
Díaz-Gallardo et al., 2007
Díaz-Gallardo, N., Íñiguez-Dávalos, L. I. y Santana, E. (2007). Ecología y conservación de la nutria (Lontra longicaudis) en la Cuenca Baja del Río Ayuquila, Jalisco. En G. Sánchez-Rojas y A. Rojas-Martínez (Eds.), Tópicos en sistemática, biogeografía, ecología y conservación de mamíferos (pp. 165-182). Pachuca: Universidad Autónoma del Estado de Hidalgo, Instituto de Ciencias Básicas e Ingeniería.
Duque-Dávila et al., 2013
D.L. Duque-Dávila
E. Martínez
F.J. Botello
V. Sánchez
Distribución, abundancia y hábitos alimentarios de la nutria ( Lontra longicaudis annectens Major 1897) en el río Grande, Reserva de la Biosfera Tehuacán-Cuicatlán Oaxaca, México
Therya
4
2013
281-96
Espitia et al., 2006
L.F. Espitia
Y. Causil
D. Arcila
J. Barbosa
Y. Mona
Hábitos alimenticios de la nutria neotropical Lontra longicaudis (Olfers, 1818) e interacción con la actividad pesquera en el bajo Sinú, Córdoba, Colombia
Segundo Congreso Colombiano de Zoología. Libro de resúmenes
Editorial Panamericana Formas e Impresos
Santa Marta
2006
Fierros-López, 2003
H.E. Fierros-López
Guía para las familias comunes de Coleoptera de México
2003
Franco y Soto-Gamboa, 2011
Franco, M. y Soto-Gamboa, M. (2011). Prey selection and trophic position of southern river otter (Lontra provocax). En The wetlands of the “Carlos Adwandter Nature Sanctuary”, Southern Chile. Proceedings of X International Otter Colloquium, IUCN Otter Spec. Group Bull A (pp. 86-96). Volumen 28.
Gallo, 1989
Gallo, J.P. (1989). Distribución y estado actual de la nutria o perro de agua (Lutra Longicaudis annectes Major, 1897) en la Sierra Madre del Sur, México (Tesis de maestría). México. D.F.: Facultad de Ciencias, UNAM.
Gallo-Reynoso y Casariego, 2005
Gallo-Reynoso, J.P. y Casariego, M.A. (2005). Nutria de río, perro de agua. Los mamíferos silvestres de México. En G. Ceballos y G. Oliva (Eds.), Nutria de río, perro de agua (pp. 374-376). Ciudad de México: Comisión Nacional para el Conocimiento y uso de la Biodiversidad Fondo de Cultura Económica México.
Gallo-Reynoso et al., 2008
J.P. Gallo-Reynoso
N.N. Ramos-Rosas
O. Rangel-Aguilar
Depredación de aves acuáticas por la nutria neotropical (Lontra longicaudis annectens) , en el río Yaqui, Sonora, México
Revista Mexicana de Biodiversidad
79
2008
275-9
Galvis et al., 2006
G. Galvis
J.I. Mojica
S.R. Duque
C. Castellanos
P. Sánchez-Duarte
M. Arce
Peces del medio Amazonas región Leticia. Series de Guías Tropicales de Campo n. o 5. Conservación Internacional
2006
García, 1981
E. García
Modificaciones al sistema de clasificación climática de Kóppen
1981
Gittleman, 1989
J.L. Gittleman
Carnivore behavior, ecology and evolution
1989
González et al., 2004
González, I., Utrera, A. y Castillo, O. (2004). Dieta de la nutria Lontra longicaudis en el río Ospino, Edo. Portuguesa, Venezuela. VI Congreso Internacional de Manejo de Fauna Silvestre en la Amazonia y Latinoamérica , Libro de resúmenes. 5-10 de septiembre. Iquitos, Perú.
Gori et al., 2003
M. Gori
G. Carpaneto
P. Ottino
Spatial distribution and diet of the neotropical otter Lontra longicaudis in the Ibera lake (Northern Argentina)
Acta Theriológica
48
2003
495-504
Greer, 1955
K.R. Greer
Yearly food habits of the river otter in the Thompson lakes region Northwestern Montana, as indicated by scat analyses
American Midland Naturalist
54
1955
299-313
Guerrero et al., 2002
S. Guerrero
M.H. Badii
S.S. Zalapa
A.E. Flores
Dieta y nicho de alimentación del coyote, zorra gris, mapache y jaguarundi en un bosque tropical caducifolio de la costa del sur del estado de Jalisco. México
Acta Zoológica Mexicana
86
2002
119-37
Helder y de Andrade, 1997
J. Helder
K. de Andrade
Food and feeding habits of neotropical river otter Lontra longicaudis (Carnivora Mustelidae)
Mammalogy
61
1997
193-203
Inegi, 2016
Inegi (Instituto Nacional de Estadística, Geografía e Informática). (2016). Simulador de flujos de agua de cuencas hidrográficas. (SIATL). Versión: 3.1. Instituto Nacional de Estadística y Geografía. México. Recuperado el25 de mayo del 2016, de: h t t p & # 5 8 ; & # 4 7 ; & # 4 7 ; a n t a res.inegi.org.mx/analisis/red_hidro/SIATL/.
Kasper et al., 2004
C.B. Kasper
M.J. Feldens
J. Salvi
C. Zanardi-Grillo
Estudio preliminar sobre a ecología de Lontra longicaudis (Olfers) (Carnivora, Mustelidae) no Vale do Taquari Sul do Brasil
Revista Brasileira de Zoologia
21
2004
65-72
Kruuk, 1995
H. Kruuk
Wild otters: predation and populations
1995
Macías-Sánchez, 1998
Macías-Sánchez, S. (1998). Análisis de los hábitos alimentarios de la nutria neotropical Lontra longicaudis (Olfers, 1818) en un sector del río Los Pescados, municipio de Jalcomulco, Veracruz (Tesis doctoral). Xalapa: Facultad de Biología, Universidad Veracruzana.
Macías-Sánchez, 2003
Macías-Sánchez, S. (2003). Evaluación del hábitat de la nutria neotropical (Lontra longicaudis Olfers, 1818) en dos ríos de la zona centro del estado de Veracruz, México (Tesis de maestría ). Xalapa: Instituto de Ecología, A.C.
Macías-Sánchez y Aranda, 1999
S. Macías-Sánchez
M. Aranda
Análisis de la alimentación de la nutria Lontra longicaudis (Mammalia: Carnivora) en un sector del río Los Pescados, Veracruz México
Acta Zoológica Mexicana
76
1999
49-57
Mayor-Victoria y Botero-Botero, 2010
R. Mayor-Victoria
A. Botero-Botero
Dieta de la nutria neotropical Lontra longicaudis (Carnivora, Mustelidae) en el río Roble, Alto Cauca Colombia
Acta Biológica Colombiana
15
2010
237-44
Merron et al., 1993
G. Merron
M. Brutonand
P. la Hausse-de Lalouviere
Changes in fish communities of the Phongolo floodplain Zululand (S. Africa) before, during and after a severe drought
Regulated Rivers
8
1993
335-44
Monroy-Vilchis et al., 2009
O. Monroy-Vilchis
Y. Gómez
M. Janczur
V. Urios
Food niche of Puma concolor in central Mexico
Wild life Biology
15
2009
97-105
Monroy-Vilchis y Mundo, 2009
O. Monroy-Vilchis
V. Mundo
Nicho trófico de la nutria neotropical (Lontra longicaudis) en un ambiente modificado, Temascaltepec, México
Revista Mexicana de Biodiversidad
80
2009
801-6
Monroy-Vilchis y Rubio-Rodríguez, 2003
O. Monroy-Vilchis
R. Rubio-Rodríguez
Guía de mamíferos terrestres del Estado de México a través del pelo de guardia
2003
Morales et al., 2010
J. Morales
D. Díez
M. Lizana
Análisis de la alimentación y distribución del visón americano “Neovison vison” y de la nutria “Lutra lutra” en la población simpátrica del río Moros (Sistema Central, Segovia)
Galemys
22
2010
63-89
Morales et al., 2004
J.J. Morales
M. Lizana
F. Acera
Ecología trófica de la nutria paleártica Lutra lutra en el río Francia (cuenca del Tajo, Salamanca)
Galemys
16
2004
57-77
Moreno, 2001
Moreno, C. (2001). Métodos para medir la biodiversidad . MyT-Manuales y Tesis SEA. Vol. 1. Zaragoza: Edición CYTED, ORCYT/UNESCO y SEA.
Neiff, 1999
Neiff, J. J. (1999). El régimen de pulsos y grandes humedales de Sudamérica. En A. I. Malvárez y P. Kandaus (Eds.), Tópicos sobre humedales subtropicales y templados de Sudamérica . Montevideo: Ed. Universidad de Buenos Aires/UNESCO.
Rangel y Gallo, 2013
O. Rangel-Aguilar
J.P. Gallo-Reynoso
Hábitos alimentarios de la nutria neotropical (Lontra longicaudis annectens) en el río Bavispe-Yaqui, Sonora México
Therya
4
2013
297-309
Restrepo y Botero-Botero, 2012
C. Restrepo
A. Botero-Botero
Ecología trófica de nutria neotropical Lontra longicaudis (Carnivora, Muestelidae) en el río de La Vieja, Alto Cauca Colombia. Boletín científico
Museo de Historia Natural
16
2012
207-14
Rheingantz y Trinca, 2015
Rheingantz, M. L. y Trinca, C. S. (2015). Lontra longicaudis . The IUCN Red List of Threatened Species 2015: e.T12304A21937379. Recuperado el 22 de febrero del 2016 de: h t t p & # 58;//dx.doi.org/10.2305/IUCN.UK.;1; 2015-2.RLTS.T12304A21937379.en.
Robinson y Minshall, 1986
C.T. Robinson
G.W. Minshall
Effects of disturbance frequency on stream benthic community structure in relation to canopy cover and season
Journal of the North American Benthological Society
5
1986
237-48
Rodríguez-Pérez y Contreras, 2012
B.J. Rodríguez-Pérez
E.T. Contreras-Macbeath
Evaluación de la diversidad ictiofaunística del río Estelí Nicaragua
Revista Científica FAREM-Estelí
1
2012
1-24
Schnack, 1976
J.A. Schnack
Los Belostomatidae de la República Argentina (Hemiptera)
Fauna de agua dulce de la República Argentina
FECIC
Buenos Aires
1976
1-66
Semarnat, 2010
Semarnat (Secretaría del Medio Ambiente y Recursos Naturales) (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental – Especies nativas de México de flora y fauna silvestres – Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio – Lista de especies en riesgo. Diario Oficial de la Federación. 30 de diciembre de 2010, Segunda Sección, México.
Servín y Huxley, 1991
J. Servín
C. Huxley
La dieta del coyote en un bosque de encino-pino de la sierra Madre occidental de Durango, México
Acta Zoológica Mexicana
44
1991
1-6
Shannon, 1948
C.E. Shannon
A mathematical theory of communication
Bell System Technical Journal
27
1948
379-656
Spínola y Vaughan, 1995
R.M. Spínola
C. Vaughan
Dieta de la nutria neotropical (Lutra longicaudis) en la estación biológica La Selva, Costa Rica
Vida Silvestre Neotropical
4
1995
125-32
Toca, 2000
Toca, M.P. (2000). Variaciones estacionales en la dieta de la nutria (Lutra lutra) en la cuenca del río Esva (Asturias ). Seminario de Investigación dentro del Programa de Doctorado Organismos y Sistemas Forestales y Acuáticos de La Universidad de Oviedo. Asturias, España.
Vega-Villasante et al., 2011
F. Vega-Villasante
E.A. Martínez-López
L.D. Espinosa-Chaurand
M.C. Cortés-Lara
H. Nolasco-Soria
Crecimiento y supervivencia del langostino Macrobrachium tenellum en cultivos experimentales de verano y otoño en la costa tropical del Pacífico mexicano
Tropical and Subtropical Agroecosystems
14
2011
581-8
Zar, 1999
J.H. Zar
Biostatistical analysis
4th. ed
1999
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.
*
Autor para correspondencia.
Copyright © 2017 Universidad Nacional Autónoma de México, Instituto de Biología.