José G. Palacios-Vargas, Ricardo Iglesias y Jair Páez *
Universidad Nacional Autónoma de México, Facultad de Ciencias, Departamento de Ecología y Recursos Naturales, Laboratorio de Ecología y Sistemática de Microartrópodos, Circuito Exterior s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
*Autor para correspondencia: jd.pl@ciencias.unam.mx (J. Páez)
Recibido: 19 marzo 2021; aceptado: 14 julio 2021
http://zoobank.org/urn:lsid:zoobank.org:pub:77561233-D3FC-4FF3-84BE-C08F060FCB8B
Resumen
Por medio de la fumigación de 2 especies arbóreas con piretrinas naturales en la selva tropical húmeda de Los Tuxtlas, Veracruz, se obtuvieron 6 especies del género Scapheremaeus, una de ellas es una especie nueva para la ciencia con caracteres especializados a la vida arbórea que se describe aquí. Con los caracteres diferenciales de la especie nueva (menos de 300 μ, notogáster piriforme muy ancho; prodorso con carinas lamelares bien desarrolladas, sin translamela; con 7 pares de sedas notogástricas claviformes, fórmula genito-anal 4-1-1-2; patas muy cortas y tridáctilas), se modifica la diagnosis genérica y se discuten las adaptaciones morfológicas para la vida arborícola. Adicionalmente, se incluye una clave para las especies de México y Centroamérica y se proporcionan registros nuevos para la localidad.
Palabras clave: Quetotaxia; Canopia; Selva; Fumigación; Fenología
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Mites of the genus Scapheremaeus (Oribatei: Cymbaeremaeidae) in Los Tuxtlas, Veracruz, with description of a new species modified for arboreal life
Abstract
Throughout the fumigation with natural pyrethrin of 2 tree species in the humid tropical rain forest of Los Tuxtlas, Veracruz, 6 species of the genus Scapheremaeus were obtained, one of them is a new species for science, with characters very highly specialized to tree life which is described here. With the differential characters of the new species (less than 300 μ, very wide pyriform notogaster; prodorso with well developed lamellar carinae, without translamella; with 7 pairs of claviform notogastric setae, genito-anal formula 4-1-1-2; very short and tridactyl legs), the generic diagnosis is modified and the morphological adaptations for tree life are discussed. In addition, a key for Mexican and Central American species is provided and some new records for the locality are given.
Keywords: Chaetotaxy; Canopy; Jungle; Fogging; Phenology
Keywords: Diversity; Crops; Pastures; Arbuscular mycorrhizae
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
La selva tropical húmeda de Los Tuxtlas, Veracruz cuenta con una gran diversidad de especies arbóreas que en conjunto forman un abundante dosel perennifolio tales como: Ficus yoponensis Desv. (Moraceae), F. tecolutensis (Liebm.) Miq. (Moraceae), Ceiba pentandra (L.) Gaertn. (Malvaceae), Astrocaryum mexicanum Liebm. ex Mart (Arecaceae), Chamaedorea tepejilote Liebm. (Arecaceae) y Guarea glabra Kunth (Meliaceae) (Vázquez et al., 2010). Allí se pueden identificar 3 diferentes tipos de estratos: un nivel arbóreo con más de 30 m de altura, otro nivel que va de 15 a 22 m de altura y un último de 6 a 15 m. El dosel tiene diversas funciones importantes en las selvas y bosques, además de ser el hábitat de numerosos animales cuya interacción impulsa el desarrollo en la dinámica de comunidades. El estudio de los microartrópodos que componen el dosel de las selvas ha sido un ambiente poco trabajado en México y solo de manera sistemática en Chamela, Jalisco (Palacios-Vargas et al., 1999). Un proyecto reciente del autor principal de este artículo dio origen a recientes publicaciones (Palacios-Vargas, 2017; Palacios-Vargas y Mejía, 2017), utilizando la fumigación con piretrinas fotodegradables para la colecta de los microartrópodos que viven en el dosel de la selva de Los Tuxtlas, Veracruz. La composición poblacional de mayor abundancia que se ha registrado dentro de los microartrópodos son los ácaros y los colémbolos (Palacios-Vargas y Mejía, 2017; Villagómez et al., 2017). En México, la diversidad de ácaros oribátidos se encuentra representada por 105 familias, 251 géneros y 443 especies (Palacios-Vargas e Iglesias, 2004). Dentro de los ácaros oribátidos y de acuerdo con Subías (2004), se encuentra la familia Cymbaeremaeidae Sellnick, 1928, la que agrupa a los géneros Bulleremaeus Hammer, 1966; Cymbaeremaeus Berlese, 1896; Glanderemaeus Balogh y Csiszár, 1963; Scapheremaeus Berlese, 1910; Seteremaeus Hammer, 1971; Spineremaeus Colloff, 2011 y el recientemente descrito Sculpteremaeus (Behan-Pelletier y Ermilov, 2020).
Scapheremaeus tiene 117 especies y puede conside-rarse hiperdiverso, según los estándares de los oribátidos (Colloff, 2010; Subías, 2004), con distribución cosmopolita y una notoria afinidad por los biotopos epífitos como musgos o líquenes (Ríos y Palacios-Vargas, 1998), por lo general, en el dosel de las selvas y bosques, pero también en otros ambientes muy diversos. De este género se han citado en el mundo 29 taxones procedentes de musgos, ya sea sobre rocas, en el suelo o epífitos (4 en Polytrichum sp.), 13 de suelo, 10 de hojarasca, 8 de canopia, 7 de líquenes y 2 de corales muertos, además de otros ambientes como bromeliáceas epífitas.
Sus representantes son muy pequeños, alrededor de 500 μ; tienen el cuerpo muy esclerosado y cubierto con un cerotegumento muy denso que forma una microescultura muy variada. En el prodorso no existen lamelas verdaderas, solo cóstulas con diverso tipo de desarrollo. Carecen de tutorio, y en la mayoría faltan las sedas exobotridiales e interlamelares. En el notogáster con frecuencia se pueden distinguir 3 regiones: dorsocentral, circumdorsal y circumnotogastral. En la parte anterior del notogáster se encuentra una región abombada, menos esclerosada, llamada lentículo, de valor taxonómico (Pérez-Íñigo, 1993).
Los antecedentes del estudio de los Scapheremaeus en México son numerosos. Norton y Palacios-Vargas (1987) citaron al género del volcán Popocatépetl, Estado de México, donde notaron su preferencia por vivir en líquenes; posteriormente, Ríos y Villavicencio (1994) encontraron la misma especie, aún inédita, asociada a musgos en un bosque de los Dinamos de la Alcaldía Magdalena Contreras, Ciudad de México. Finalmente, Ríos (1996) la describió como S. palaciosi Ríos (1996); además, este autor, en su tesis de licenciatura, hace la descripción preliminar de varias especies que luego describe formalmente. Palacios-Vargas et al. (1999) en su estudio de la fenología de los artrópodos del dosel de la selva seca de Chamela citan la presencia del género, representado por varias especies nuevas que habían sido descritas recientemente (Ríos y Palacios-Vargas, 1998). Palacios-Vargas y Ríos (1998) describieron S. flamiferus designando como localidad tipo a León, Nicaragua, donde el primer autor la había colectado en Tillandsia sp. sobre el jícaro sabanero (Crescentia alata) previamente, pero dan nuevos registros de Guerrero, Quintana Roo y Veracruz. S. tonatiuh Palacios-Vargas, Ríos y Vázquez (1998) fue descrita del dosel de la selva de Chamela Jalisco, pero registrada también de ambientes arbóreos de Quintana Roo y Chiapas (Palacios-Vargas et al., 1998). El material de este género obtenido por Sánchez et al. (1998) del dosel de Astrocaryum mexicanum, ya había sido incluido en el trabajo de Ríos y Palacios Vargas (1998) y fue base de la descripción de varias especies. En trabajos más recientes, solo se citó la presencia del género en Querétaro y en Baja California (Cutz-Pool et al., 2008; Villarreal-Rosas et al., 2014, respectivamente), este último de suelos crustosos de un desierto, pero en ninguno de estos casos se determinó el material a nivel específico.
Los registros más recientes corresponden al proyecto del estudio de los microartrópodos de Los Tuxtlas, Veracruz. Palacios-Vargas (2017) mencionó cómo tuvo que adecuar la metodología para colectar microartrópodos del dosel en la selva tropical húmeda de Los Tuxtlas. Villagómez et al. (2017) ofrecieron numerosos registros de los ácaros oribátidos de los estratos edáficos y arbóreos de esta selva y citaron varios ejemplares de Scapheremaeus. Palacios-Vargas y Páez (2018) describieron S. dirzoius de la canopia y Hernández et al. (2018) proporcionaron los primeros informes sobre la morfología tan peculiar de la especie nueva que aquí se describe. Finalmente, Villagómez et al. (2019) en su trabajo sobre el efecto de la identidad del árbol y las variables edáficas, estudian la estructura de las comunidades edáficas de los oribátidos citando nuevamente a dicho género de la Estación de Biología de Los Tuxtlas.
Para Los Tuxtlas solo se tienen registros de 5 taxones (Ríos, 1997); 2 de ellos, S. tonatiuh y S. banzsi, han sido citadas por Villagómez et al. (2017), aunque 3 se han descrito con ejemplares de esta zona. En México el género Scapheremaeus está representado por 20 especies, distribuidas en 11 estados (fig. 1).
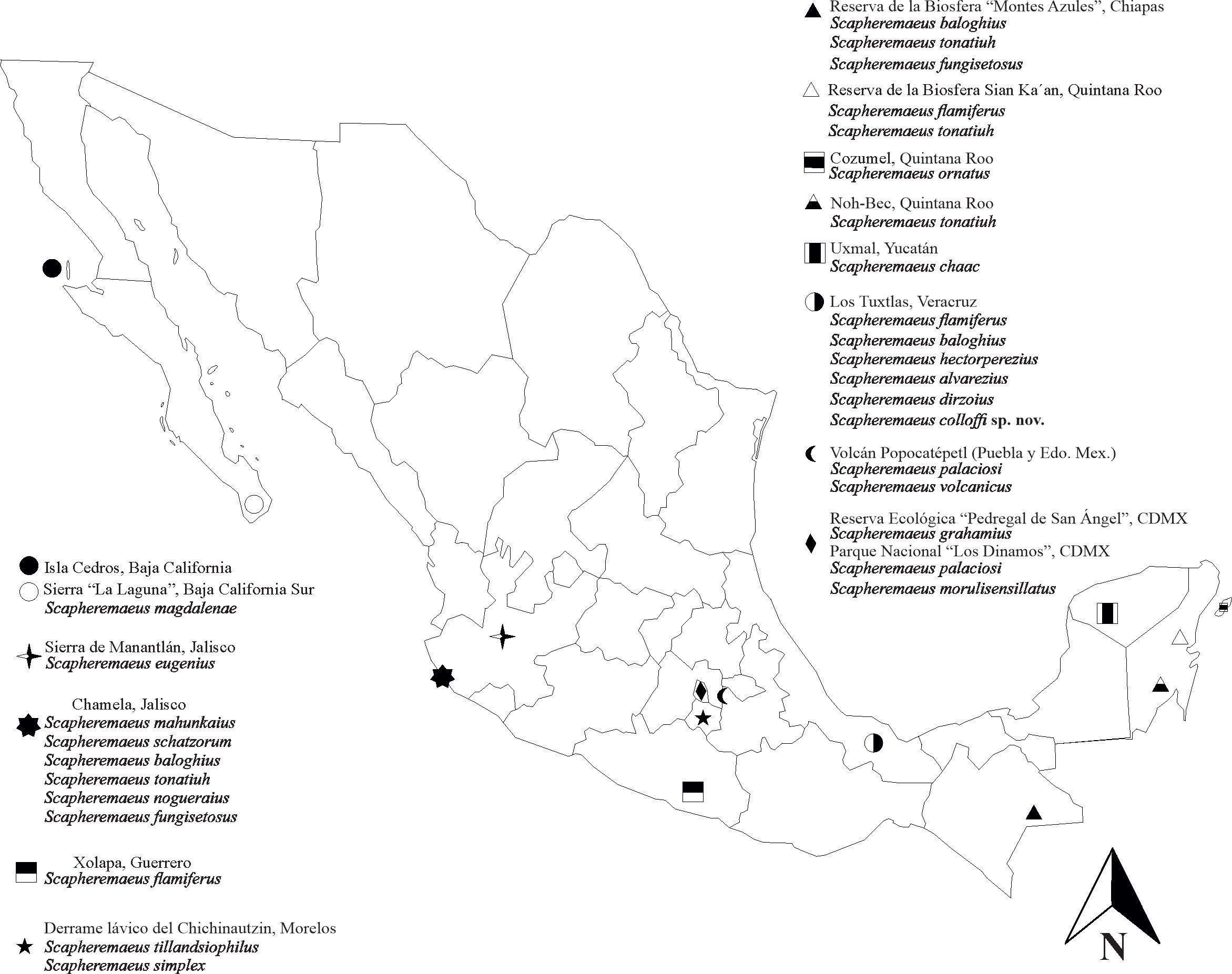
Materiales y métodos
Para la recolecta de microartrópodos se eligieron 5 ejemplares de cada una de 2 especies arbóreas, A. mexicanum (fig. 2) y G. glabra (fig. 3) mismos que fueron fumigados en cada estación del año (marzo, mayo, octubre y diciembre de 2016); utilizando nebulizaciones con piretrinas naturales fotodegradables modificando la metodología empleada por Palacios-Vargas y Gómez-Anaya (1993). Se colocó debajo de cada árbol una lona de plástico de 2 × 2 m (figs. 4, 5) para poder interceptar la mayor cantidad de artrópodos del dosel de los árboles fumigados y conservarlos en alcohol al 70% (Palacios-Vargas, 2017). El montaje de los oribátidos en preparaciones semipermanentes fue realizado bajo el microscopio de disección con ayuda de pequeñas palitas para manipularlos. Algunos ejemplares fueron montados en posición ventral y otros dorsalmente. Cada preparación se cubrió con un cubreobjetos y se mantuvo en el horno de secado, aproximadamente una semana a una temperatura de 45 ºC. Para el estudio de los caracteres específicos como la quetotaxia de las patas y las partes bucales, como los quelíceros y los pedipalpos, fue necesario realizar microdisecciones (Palacios-Vargas y Mejía, 2007), así como el uso de claves (Balogh y Balogh, 1988, 1990; Ríos, 1997). Se hizo el estudio de la morfología con un microscopio de contraste de fases Carl Zeiss y los dibujos can ayuda de una cámara lúcida. Todas las mediciones fueron realizadas en micrómetros (μm); el rango está señalado en paréntesis. Los dibujos fueron editados con el programa CorelDraw 2020.

La longitud del cuerpo se midió desde la punta del rostro hasta el margen posterior de la placa notogastral dorsal. La anchura se midió en vista dorsal en el punto de la parte más ancha del notogáster, generalmente entre las patas II y III. Se proporcionan la longitud y la anchura promedios de 10 ejemplares de la serie tipo. Las longitudes de los artejos de la pata, incluidas las partes insertadas en el siguiente segmento proximal, se indican en secuencia desde el fémur hasta el tarso y son el promedio de 4 ejemplares disectados. Se excluyen las longitudes del trocánter. Las fórmulas de las patas incluyen el número de solenidios entre paréntesis. El fámulus está incluido en la fórmula de la quetotaxia tarsal. Todas las descripciones se refieren a especímenes adultos. Todo el material tipo se deposita en la Colección del Laboratorio de Ecología y Sistemática de Microartrópodos del Departamento de Ecología y Recursos Naturales de la Facultad de Ciencias, UNAM.
Descripción
Scapheremaeus Berlese, 1910
Diagnosis (modificada de Colloff, 2009). Ácaros oribátidos del grupo Brachypilina, familia Cymbaeremaeidae con notogáster fuertemente ornamentado, con un lentículo anterior y una escisión con tubérculos, formando un área central notogástrica completa o incompleta, a veces reducida. Sensilo típicamente muy oscuro, globoso, apicalmente en forma de clava, liso o barbulado, a menudo moruliforme o con forma de líquen. Placas genitales y anales ampliamente separadas. Sin tutorio con muesca, pero puede haber una carina lateral. Seda lamelar setiforme, ligeramente baciliforme o fuertemente pigmentada con o sin forma de clava, debido al cerotegumento; generalmente asociada a una cóstula similar a una verdadera lamela. Seda interlamelar setiforme, o como una peca, representada solo por el alveolo o ausente. Botridio bien desarrollado, no oculto por el notogáster en vista dorsal. Con o sin seda exobotridial. Sutura dorsosejugal contínua, convexa; notogáster con escisión completa o incompleta, separando una placa centro-dorsal circum-notogástrica, a veces reducida, visible solo por la diferencia entre la micro-escultura lateral y la central. Generalmente con 3 pares de lirifisuras concentradas en la parte posterior, en el borde circum-notogástrico; parte central del notogáster con micro-escultura con tubérculos y/o crestas o alveolos, con origen parcialmente del cerotegumento. Típicamente con 10, 14 o 15 pares de sedas notogástricas, raramente 7, 8, 9, 12 o 13 pares. Con o sin procesos humerales extendiéndose ventralmente. Fórmula epimeral 3-1-2-2 o rara vez 3-1-3-3 (3-1-1-2, 2-1-1-2). Unión del epímero IV y placa ventral sin enantiófisis; margen posterior de la región ventral en forma de U, nunca de V; placas genitales y anales separadas por una distancia similar al largo de la apertura genital; con 2, 4, 6 o 7 pares de sedas genitales; un par de sedas agenitales; 1 o 2 pares de sedas anales situados en el margen medio de las placas a cierta distancia del borde; con 3 o 2 pares de sedas adanales. Con un esclerito preanal triangular. Patas monodáctilas o tridáctilas.
Especie tipo: S. patella (Berlese, 1886).
Los caracteres diferenciales de la especie nueva son muy novedosos, lo que ha permitido actualizar la diagnosis. Placas anales con un solo par de sedas, algo que nunca se había reportado. Además, la reducción de las sedas del notogáster, con ausencia total de la hilera h correlacionado con la reducción de sedas adanales, que nunca se había observado.
Scapheremaeus colloffi sp. nov. (figs. 6-30)
http://zoobank.org/urn:lsid:zoobank.org:act:FB6EBB15-C6B5-4B32-8059-2E5656381A9A
Diagnosis diferencial. Especie diminuta, menos de 300μ, notogáster piriforme, ancho. Prodorso con carinas lamelares bien desarrolladas, sin translamela. Siete pares de sedas notogástricas claviformes. Área central del notogáster muy ancha. Fórmula epimeral 3-1-2-1. Cuatro pares de sedas genitales, un par de sedas anales y solo 2 pares de sedas adanales. Patas cortas, tridáctilas, tarsos con muchas sedas capitadas. Dimensiones: longitud total (n = 10): 278 (270-284); anchura: 208 (185-234); grosor 99.
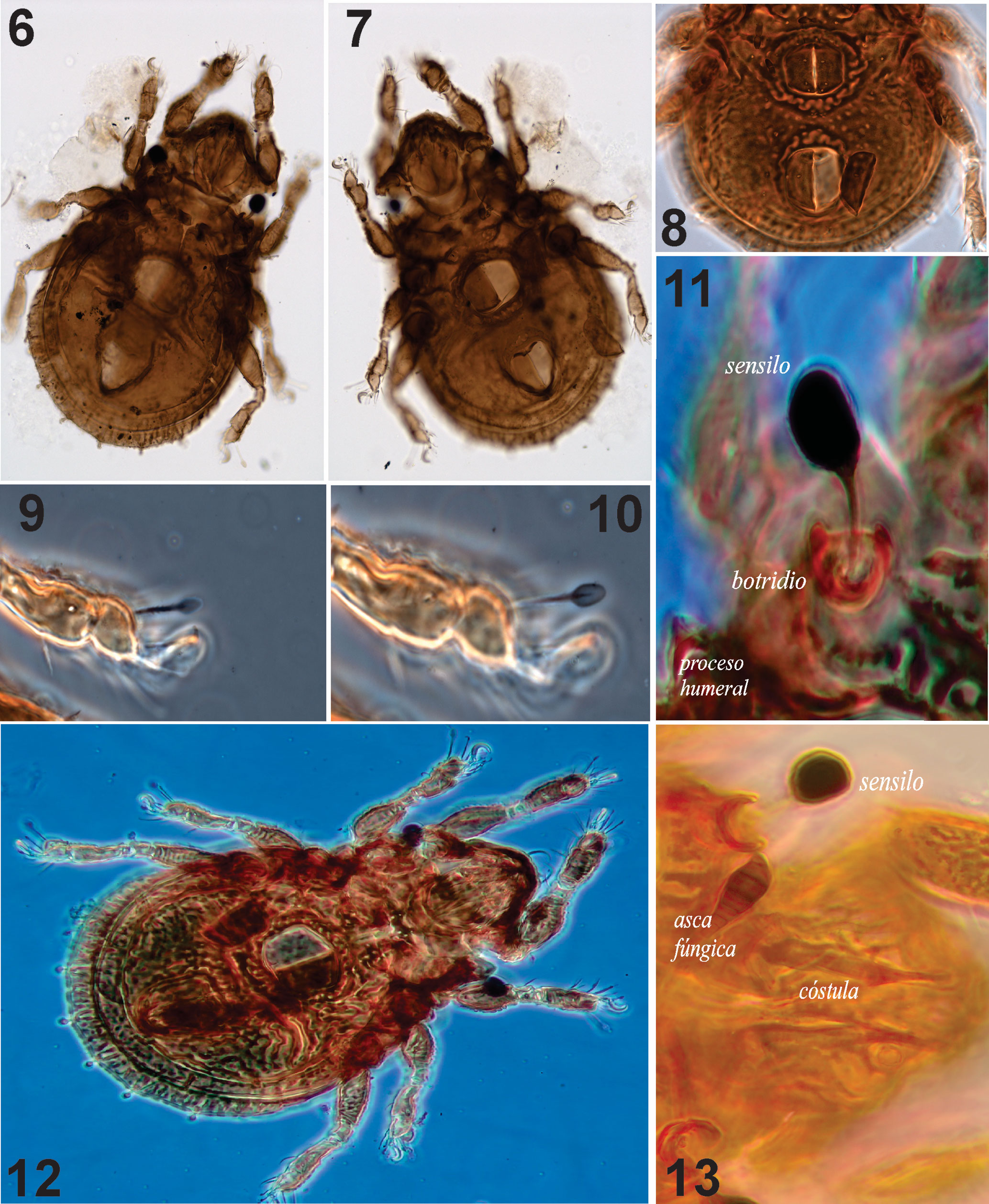
Integumento. Cerotegumento denso e irregularmente distribuido. Todas las superficies del cuerpo con ornamentación en microesculturas, excepto la parte central del notogáster. Las patas con cerotegumento denso que dificulta ver las sedas (figs. 18-20). Prodorsum: tuberculado con un patrón irregular y con las cóstulas bien desarrolladas terminando en largas cúspides lamelares; sin translamela (figs. 13, 22). Rostro redondeado, seda rostral (ro) ligeramente barbulada (n = 10): 19 (15-25); seda lamelar (le) (n = 4) 2.5 (2-3) claviforme en el ápice de la lamela (fig. 22). Cóstulas (25) bien desarrolladas, más o menos paralelas, extendiéndose posteriormente hasta cerca de los botridios. Sin seda interlamelar (in). Sensilo (ss) en forma de clava, muy obscuro, con pocas barbulaciones, longitud total 33 (29-40) incluyendo el pedicelo (figs. 6, 11, 13, 22, 26). Quelíceros con la seda dorsal cha y la lateral chb ligeramente barbuladas (fig. 24). Mentón con fina granulación, sedas h, m y a lisas (8, 11, 7) y rutelo bien desarrollado (fig. 23). Fórmula de sedas del pedipalpo: 1-1-3-9(1). Notogáster (n = 10): longitud total 278 (270-284), longitud del notogáster 229 (209-249), anchura del notogáster 208 (185-234), muy aplanado, cuya proporción longitud/anchura del notogáster = 1.3. Con una escisión completa, separando un área dorso-central (figs. 14, 22) y con una pequeña espina en la región humeral (figs. 11, 22). Longitud del área central (n = 10): 180 (162-197) anchura 158 (128-185). Proporción longitud/anchura área central 1.1. Con lentículo (20 × 15) flanqueado por protuberancias circulares (fig. 14), foveolas irregulares y algunos tubérculos esféricos. Siete pares de sedas notogástricas cortas (6.6), c2, la y lm cortas y acuminadas (fig. 22), sedas lp y las de la serie p claviformes (figs. 15, 16, 22). Sedas notogástricas clavadas (cuando conservan el cerotegumento), emergiendo de pequeños tubérculos, con alveolos bien definidos, en particular los posteriores (hilera p). Las sedas presentes son c2, la, lm, lp, p1, p2 y p3; solo lp en la región dorso-central (fig. 22). Región posterior casi circular, con ligera indentación entre las sedas p (figs. 14, 16, 22) Lirifisuras im, ih, ips e ip con una disposición radial en la región laterodorsal. Seda lp muy cerca del borde de la división dorso-central, abertura de la glándula (gla), cerca de la seda lp del lado anterior externo (fig. 15).
Región ventral (figs. 7, 8, 12, 25). Fórmula de sedas epimerales 3-1-2-1; 4 sedas genitales equidistantes, abertura genital rodeada de ornamentación en forma de festones (figs. 8, 25); un par de sedas agenitales, un par de anales y 2 pares de adanales, ornamentación de la abertura de las placas anales solo en la parte anterior (fig. 21). Microescultura ventral formada por foveolas. Lirifisuras iad en posición paraanal. Vista lateral (figs. 17, 26): grosor del cuerpo 90 μ. Microescultura prodorsal compuesta por tubérculos redondos, ovalados y alargados, dispuestos en patrones lineales (fig. 26). Microescultura del notogáster, dividida en la parte media por 4 crestas transversales. Cúspides de las cóstulas sobresaliendo de la superficie del prodorso; cúspide seda lamelar libre, minúscula y claviforme. Pedotecto I auriculado, cubriendo parte del acetábulo I; pedoctecto II en medio, entre los acetábulos II y III, con ápice ventral, el III entre las patas III y IV muy esclerosado, en forma de v.
Patas (figs. 27-30). Fórmula quetotáxica: pata I: 0-4-2(1)-4(2)-14 (2); pata II: 0-4-2(1)-3(1)-15(1); pata III: 1-2-1(1)-3(1)-12; pata IV: 0-2-1(1)-3(1)-12. Todas las patas con ornamentación cuticular. Fémures I-IV con microescultura tuberculada en la superficie antiaxial; algunas crestas paralelas y áreas circulares porosas presentes en superficies paraxiales. Tarsos de todas las patas con sedas capitadas; tarso III con seda más capitada que las demás. Tibia I con una gran seda dorsal capitada. Tarso IV con una seda muy capitada y genua con una seda dorsal corta capitada. Longitud de artejos de las patas (fémur – tarso): pata I: 71-12-34-21; pata II: 59-10-26-17; pata III: 48-12-30-16; pata IV: 57-10-37-16. Uñas heterotridáctilas. Longitud total de las patas (de fémur a tarso): 138, 111, 106, 121.
El tamaño total del cuerpo varía entre 270-284 μ de longitud. La apariencia de las sedas de la serie p y eventualmente otras del notogáster pueda variar dependiendo de la conservación del cerotegumento después del aclarado en ácido láctico.
Resumen taxonómico
Material tipo: holotipo hembra (272 × 239) y 41 paratipos hembras montados en preparaciones semipermanentes en líquido de Hoyer. El holotipo y paratipos se conservan en la colección del Laboratorio de Ecología y Sistemática de Microartrópodos de la Facultad de Ciencias, UNAM.
Localidad tipo: México: Veracruz: Estación de Biología Tropical de Los Tuxtlas, 37 de Guarea glabra y 7 de Astrocaryum mexicanum, 8-oct-2016, J. G. Palacios-Vargas col. Por fumigación.
Registros adicionales: exlíquenes, México, Veracruz: Estación de Biología Tropical de Los Tuxtlas, exlíquenes, 11-sept-1983. J. G. Palacios col.
Etimología: esta especie se dedica al Dr. Matthew J. Colloff por su importante contribución a la morfología y taxonomía de este género.
Discusión
Scapheremaeus colloffi sp. nov. pertenece al grupo de especies plicadas (Colloff, 2009) puesto que tiene una escisión circumdorsal completa con microescultura en la placa circumnotogástrica contrastando con la microescultura de la placa dorsal central (lobulada); también pertenece al grupo “carinatus” ya que además de la escisión dorsal completa, el prodorso tiene carinas bien desarrolladas. La especie nueva se puede distinguir de otros miembros del género por la combinación de los siguientes caracteres: microescultura del notogáster muy irregular, la escisión con tubérculos esféricos, completamente diferente de las otras especies conocidas; solo 7 pares de sedas notogástricas y únicamente 1 par de sedas anales (todas las especies tienen 2 pares), además de tener solo 2 pares de sedas adanales (la mayoría tiene 3 pares). El habitus es similar a S. palaciosi Ríos,1996, la que es más grande (452 × 255) con notogáster elíptico y menos ancho, con más ornamentación cuticular; el notogáser con 8 pare de sedas baciliformes; 6 pares de sedas genitales, 2 pares de sedas anales y 3 adanales. También la fórmula epimeral es diferente (3-1-2-2 contra 3-1-2-1 en S. colloffi sp. nov).
Tomando en cuenta la anchura del área dorso-central, la especie nueva tiene una proporción entre la longitud y la anchura igual a 1.1. Por este carácter se asemeja a S. chaac Ríos y Palacios-Vargas, 1998. En ambas, la anchura es muy grande, casi tanto como su longitud; sin embargo, en S. colloffi sp. nov. es piriforme y en S. chaac es elipsoidal; además, en S. chaac el área central tiene 2 pares de sedas: lm y lp, y un total de 10 pares de sedas notogástricas; mientras en la especie nueva, dicha área solo tiene 1 par sedas (lp) en el área central y un total de 7 pares sedas notogástricas.
Colloff (2009) considera que la serie h de sedas notogástricas son altamente conservadas y que son aquellas de la serie p las que pueden estar significativamente reducidas o completamente ausentes, acompañada de la pérdida de las sedas anales. S. palaciosi Ríos, 1996 tiene 8 pares de sedas notogástricas (p2 y p3 faltan) y posee una fórmula anogenital completa 6-1-2-3, completamente diferente de la especie nueva en la que han desaparecido todas las de la hilera p.
Clave para identificar las especies de Scapheremaeus de México y Centroamérica.
1A. Notogáster sin área central; sensilo ensanchado, con forma de líquen……………………………..Scapheremaeus morenoi (Balogh y Mahunka, 1974) (Cuba: Prov. Oriente).
1B. Notogáster con área central bien definida; sensilo de diversas formas………………………………………………………………2
2A. Notogáster casi circular con solo 7 pares de sedas, fórmula genito-anal 4-1-1-2………………..Scapheremaeus colloffi sp. nov. (Mex: Veracruz: Los Tuxtlas).
2B. Notogáster por lo general alargado; con 8 o más pares de sedas, fórmula genito-anal diferente………………………….3
3A. Con 8 pares de sedas notogástricas, fórmula genito-anal 6-1-2-3…………………………………..Scapheremaeus palaciosi Ríos, 1996 (Mex: CDMX: Contreras; Edo. de Mex.: volcán Popocatépetl).
3B. Notogáster con 9 o más pares de sedas………………………………………………………………………………………………………….4
4A. Notogáster con 9 pares de sedas, fórmula genito-anal 6-1-2-2………………………………………..Scapheremaeus dirzoius Palacios-Vargas y Páez, 2018 (Mex: Veracruz: Los Tuxtlas).
4B. Notogáster con 10 o más pares de sedas fórmula genito-anal diferente…………………………………………………………….5
5A. Notogáster con 14 pares de sedas……………………………………………………………………………..Scapheremaeus baloghius Ríos y Palacios-Vargas, 1998 (Mex: Jalisco: Chamela; Chiapas: Chajul; Veracruz: Los Tuxtlas).
5B. Notogáster con 10 pares de sedas…………………………………………………………………………………………………………………6
6A. Con fórmula epimeral 3-1-3-3………………………………………………………………………………..Scapheremaeus schatzorum Ríos y Palacios-Vargas, 1998 (Mex: Jalisco, Chamela).
6B. Con fórmula epimeral 3-1-2-2………………………………………………………………………………………………………………………7
7A. Notogáster con una división transversal que separa el lentículo; largo total del cuerpo más de 2 veces su anchura………………………………..Scapheremaeus alvarezius Ríos y Palacios-Vargas, 1998 (Mex: Veracruz: Los Tuxtlas).
7B. Notogáster sin dicha división, largo total del cuerpo menos de 2 veces su anchura……………………………………………8
8A. Área central del notogáster con una cresta longitudinal…………………………………………………………………………………..9
8B. Área central del notogáster sin dicha cresta longitudinal……………………………………………………………………………….11
9A. Sedas del notogáster baciliformes con alveolos normales………………………………………………………………………………10
9B. Sedas del notogáster en forma de flama con alveolos relativamente grandes, sensilo en forma de liquen………..Scapheremaeus flamiferus Palacios-Vargas y Ríos, 1998 (Nica: León; Mex: Q. Roo, Guerrero, Veracruz).
10A. Sensilo negro, barbulado y alargado con una cresta incompleta entre el lentículo y el área central……….Scapheremaeus grahamius Ríos y Palacios-Vargas, 1998 (Mex: CDMX: Reserva Pedregal de San Ángel).
10B. Sensilo moruliforme y elíptico, con una cresta lateral y posterior al lentículo que rebordea al área central………………………..Scapheremaeus tillandsiophilus Ríos y Palacios-Vargas, 1998 (Mex: Morelos: Chichinautzin).
11A. Área central del notogáster con 2 crestas laterales que unen las sedas lm y lp; sedas rostrales diminutas (3 μm)…………………………..Scapheremaeus eugenius Ríos y Palacios-Vargas, 1998 (Mex: Jalisco: sierra de Manantlán).
11B. Sin dichas crestas, sedas rostrales normales (10 μm o más)…………………………………………………………………………12
12A. Notogáster con crestas entre el lentículo y el área central……………………………………………………………………………16
12B. Notogáster sin crestas entre el lentículo y el área central…………………………………………………………………………….13
13A. Área central del notogáster casi circular, prodorso con lamelas muy largas, habitante de la superficie de rocas……………………………………………………………..Scapheremaeus chaac Ríos y Palacios-Vargas, 1998 (Mex: Yucatán).
13B. Área central del notogáster elíptica, prodorso sin lamelas……………………………………………………………………………14
14A. Todas las sedas del notogáster y las adanales ad1 y ad2 fungiformes……………………..Scapheremaeus fungisetosus Ríos y Palacios-Vargas, 1998 (Mex: Jalisco: Chamela).
14B. Área central del notogáster con o sin cresta longitudinal, sedas distintas………………………………………………………15
15A. Sin procesos humerales. Sedas lamelares setiformes, sensilo en forma de liquen, con una pequeña muesca cerca de la seda c2……………………………..Scapheremaeus mahunkaius Ríos y Palacios-Vargas, 1998 (Mex: Jalisco, Chamela).
15B. Con procesos humerales. Sedas lamelares baciliformes, sensilo negro; sin muesca cerca de la seda c2………………………………………….Scapheremaeus simplex Ríos y Palacios-Vargas, 1998 (Mex: Morelos: Chichinautzin).
16A. Cuerpo muy aplanado (longitud del cuerpo/grosor = 3.4) sedas lamelares y notogastrales diminutas (4μm)…………………………………………Scapheremaeus nogueraius Ríos y Palacios-Vargas, 1998 (Mex: Jalisco: Chamela).
16B. Cuerpo normal no aplanado (longitud/grosor = 1.6 – 2.3) sedas lamelares medianas o largas………………………….17
17A. Sensilo en forma de liquen, notogáster ancho (ratio longitud/anchura = 1.5)………………Scapheremaeus volcanicus Ríos y Palacios-Vargas, 1998 (Mex: Edo. de Mex.: volcán Popocatépetl).
17B. Sensilo de forma distinta, notogáster no tan ancho……………………………………………………………………………………..18
18A. Sensilo con apariencia de mórula, cuerpo relativamente alargado (longitud/anchura = 1.8)………….Scapheremaeus morulisensillatus Ríos y Palacios-Vargas, 1998 (Mex: CDMX: Contreras)
18B. Sensilo sin forma de mórula……………………………………………………………………………………………………………………..19
19A. Sedas notogástricas baciliformes, largas (15 μm); margen posterior del notogáster con bordes irregulares…………………………………………………………………………………………………………………Scapheremaeus magdalenae Ríos y Palacios-Vargas, 1998 (Mex: Baja California: isla de Cedros, Baja California Sur: sierra La Laguna).
19B. Sedas del cuerpo diferentes, cortas; margen posterior del notogáster redondeado…………………………………………..20
20A. Prodorso con cúspides lamelares cortas, translamela incompleta; con denso cerotegumento, notogáster con 2 áreas centrales circulares, sedas posteriores fungiformes………………………………………………………………Scapheremaeus tonatiuh (MEX: Jalisco: Chamela, Q. Roo: Sian Ka’an; Chiapas: Chajul).
20B. Prodorso sin cúspides lamelares y sin translamela; poco cerotegumento, notogáster con una sola área central, con sedas diminutas ligeramente clavadas con un gran alveolo…………………………………………Scapheremaeus hectorperezius Ríos y Palacios-Vargas, 1998 (MEX: Veracruz, Los Tuxtlas).
Fenología. Durante el año de 2016 se realizaron 4 expediciones, una en cada estación del año (marzo, mayo, octubre y diciembre) para fumigar 5 ejemplares de cada especie: A. mexicanun y G. glabra. Es interesante que tan solo en esta localidad se obtuvieron 6 especies, de las que S. colloffi sp. nov. fue la más abundante en total de muestras con 4 ejemplares en marzo, 1 en mayo y 36 en octubre; pero ninguno en diciembre. La mayor cantidad de ejemplares fueron colectados en A. mexicanum (34, de los cuales, 30 fueron en un solo árbol); unos pocos en G. glabra (7, de los cuales 6 fueron de un solo árbol, tabla 1). Scapheremaeus dirzoius se encontró solo en octubre con 8 ejemplares, 2 de ellos de G. glabra y 6 de A. mexicanum; de S. tonatiuh solo se encontraron 14 ejemplares, 2 en marzo y 12 en octubre. En la tabla 1 se muestran los ejemplares encontrados en cada mes muestreado y el árbol en el que fueron encontrados.
Estos resultados pueden ser atribuidos a la superficie más rugosa de las hojas de A. mexicanum, pero también a la gran cantidad de líquenes que tienen y de las que pueden alimentarse y bajo las que estos ácaros pueden desarrollarse. Martínez (2016) señaló que existen 11 especies de líquenes que viven sobre esta palma, mientras que para G. glabra solo 2.
Previamente, se describió Scapheremaeus alvarezius Ríos y Palacios Vargas, 1998 para la selva de Los Tuxtlas, con ejemplares colectados el 20 de octubre de 1996, en hojarasca de Nectandra ambigens y de F. yoponensis sobre el dosel de A. mexicanum. S. hectorperezius fue colectada de líquenes el 11 de octubre de 1983 de la misma estación de Los Tuxtlas, pero se describió hasta 1998; mientras que S. tonatiuh, está más ampliamente distribuida; se describió con material de la selva tropical seca de Chamela, Jalisco, por medio de fumigaciones el 24 de febrero de1993 y el 15 de mayo de 1993, en febrero de 1994 y mayo de 1995. También se recolectó de Quintana Roo, de la selva de Sian Ka’an en suelo de epífitas bromeliáceas el 16 de mayo de 1995. En Chiapas se conoce de Montes Azules, donde se colectó el 25 de agosto de 1994 en la canopia, también por medio de fumigaciones. Recientemente, se registró de muestras de suelo junto a G. glabra en mayo de 2016 (Villagómez, et al., 2019). Este es el primer registro que se tiene de la canopia de Los Tuxtlas, de donde también se recolectó por medio de fumigaciones, tanto en A. mexicanum como en G. glabra. Al parecer, en la selva tropical húmeda de los Tuxtlas se encuentra preferentemente en octubre. Es interesante que las localidades donde se han citado más especies en México son la selva tropical seca de Chamela, Jalisco y la selva tropical húmeda de Los Tuxtlas, Veracruz; cada una con 6 especies; sin embargo, solo comparten una especie (S. baloghius). Cabe señalar que en estas 2 localidades es donde más se ha trabajado con proyectos anuales y en las otras solo se han realizado colectas esporádicas.
Scapheremaeus colloffi sp. nov. es la mejor representada y la que tiene los caracteres más adecuados para vivir sobre los árboles de A. mexicanum, como se puede concluir con los siguientes análisis.
Aoki (1964) es el primero en analizar la forma del notogáster de distintas especies de Scapheremaeus (entre otras características). Hizo una tabla comparativa y llega a la conclusión de que S. sinuosus y S. reticulatus son las más alargadas, ya que la proporción entre la longitud del notogáster y su anchura es de 1.48 y 1.45, respectivamente, y que S. conniger, S. patella, S. clavifer, S. trirugis, S. guerini y S. pisancensis son los más redondeados (según su tabla van de 1.21 a 1.28). Walter y Behan-Pelletier (1999) consideraron a Scapheremaeus spp. ser habitantes de filoplanos especializados y que el tamaño pequeño y el aplanamiento dorsoventral de la mayoría de las especies probablemente representan adaptaciones a la vida arbórea.
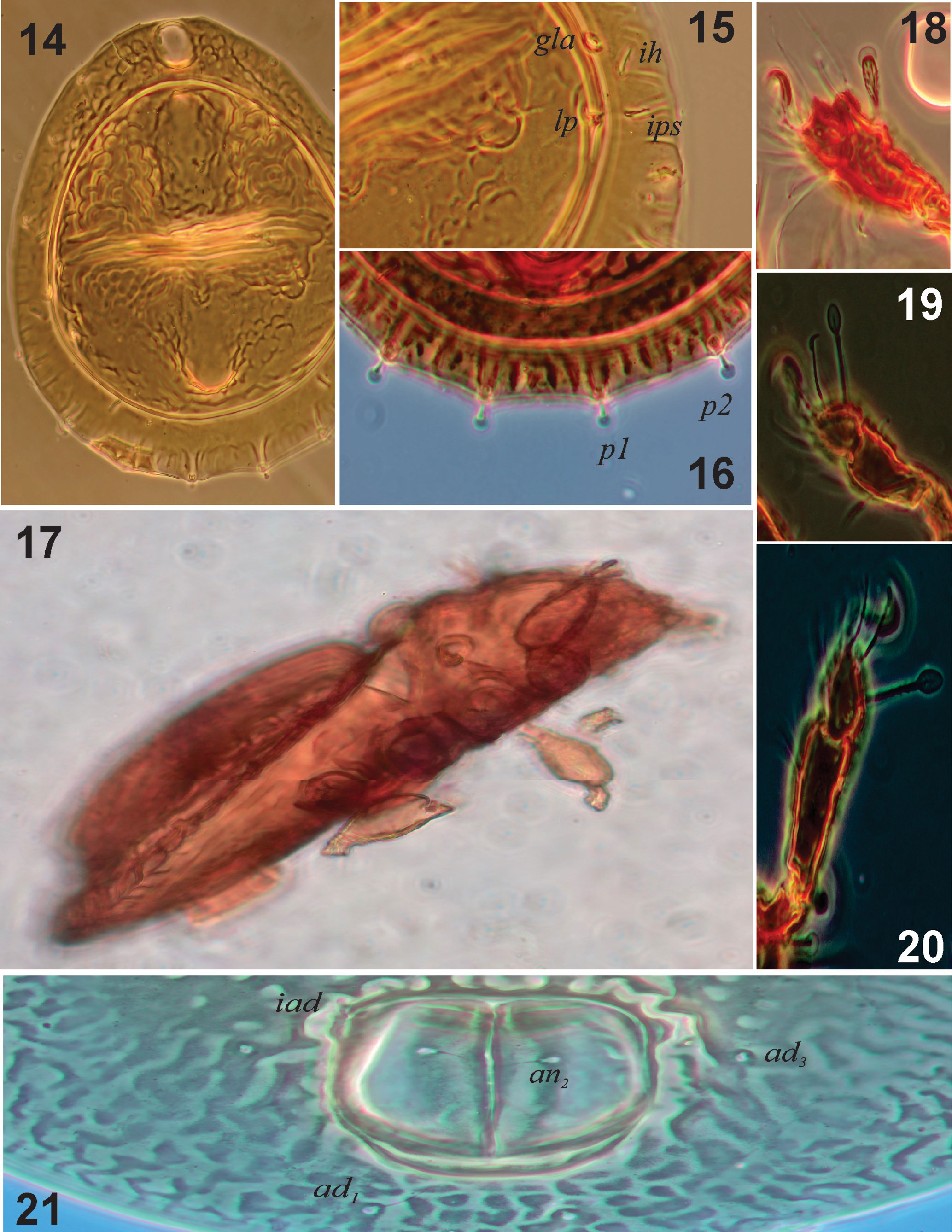
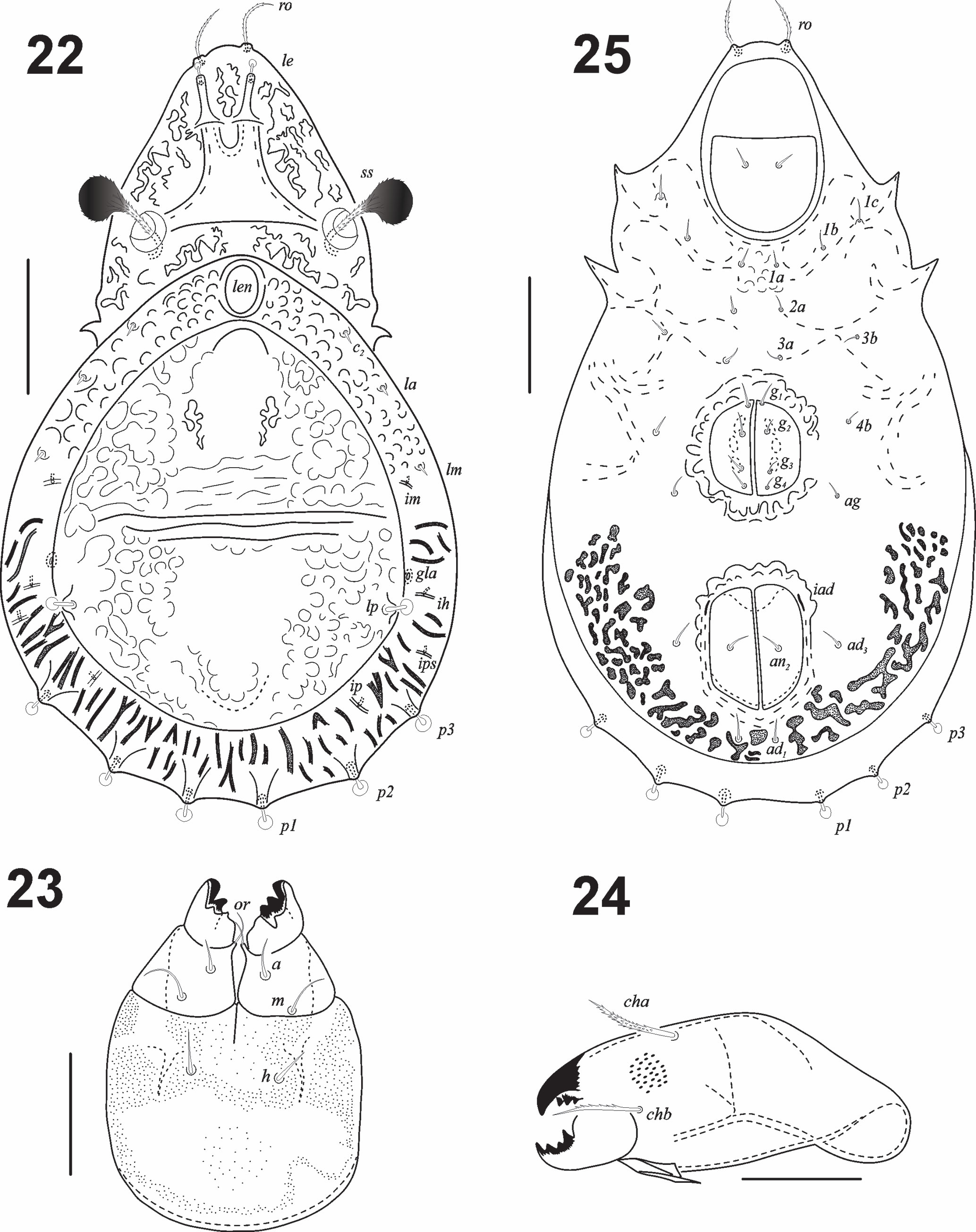
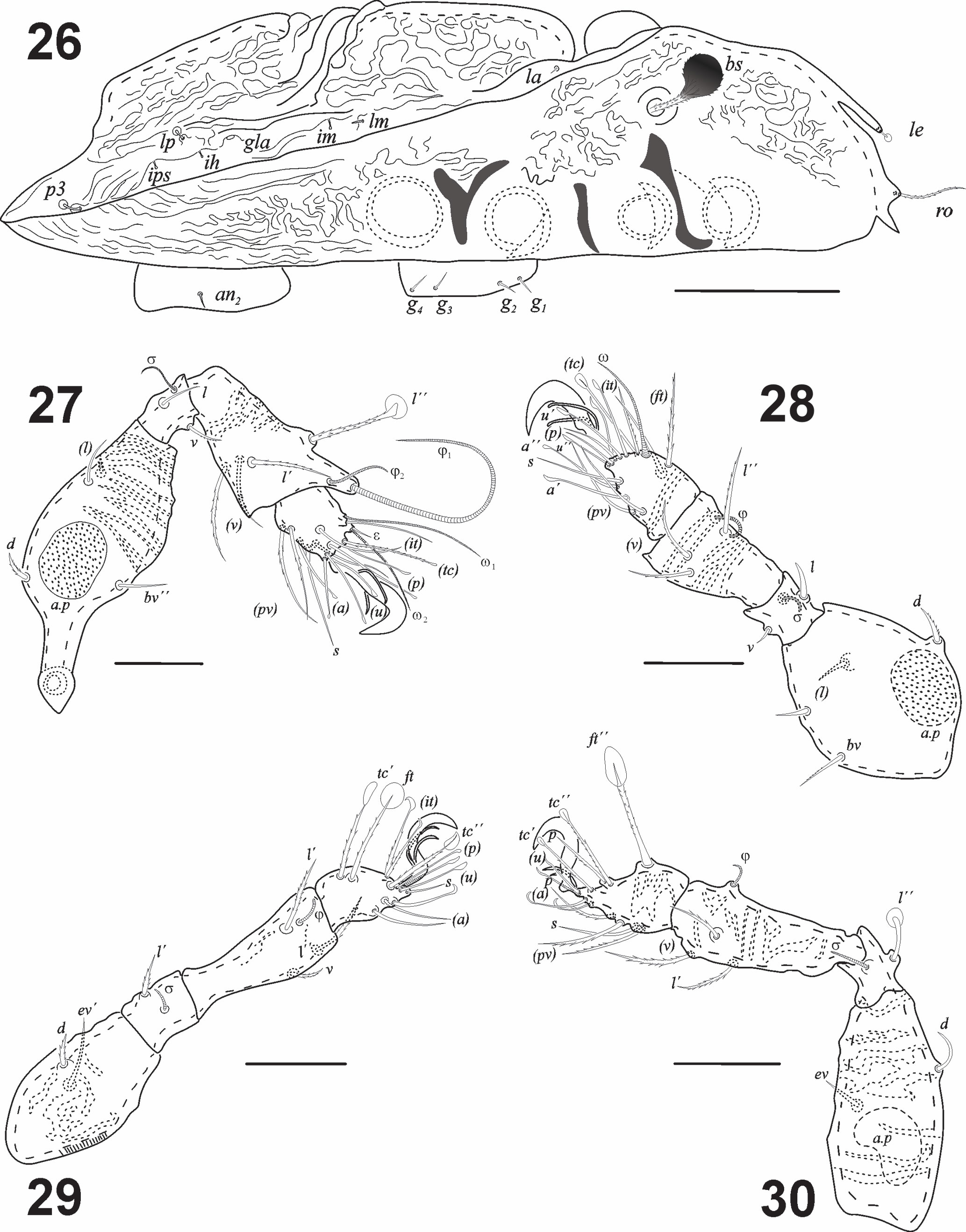
Tabla 1
Resultados de las fumigaciones. Fenología de las especies de Scapheremaeus de la selva de Los Tuxtlas, Veracruz.
|
Marzo |
Mayo |
Octubre |
||||
|
A. mexicanum |
G. glabra |
A. mexicanum |
G. glabra |
A. mexicanum |
G. glabra |
|
|
S. colloffi sp. nov. |
4 |
0 |
1 |
0 |
34 |
7 |
|
S. dirzoius |
0 |
0 |
0 |
0 |
6 |
2 |
|
S. alvarezius |
0 |
0 |
0 |
0 |
0 |
1 |
|
S. hectorperezius |
0 |
0 |
0 |
0 |
1 |
8 |
|
S. cf. palaciosi |
0 |
0 |
0 |
0 |
0 |
2 |
|
S. tonatiuh |
0 |
2 |
0 |
0 |
5 |
7 |
Tabla 2
Lista de especies de Scapheremaeus y las proporciones entre longitud total y la anchura, longitud del notogáster y la anchura del área central y la longitud del notogáster y su grosor máximo (s. d. = sin datos).
|
Longitud total/anchura total |
Longitud del notogáster/anchura del área central |
Longitud del notogáster/grosor |
Biotopo |
|
|
S. chaac |
1.5 |
1.1 |
1.9 |
Rupícola |
|
S. colloffi sp. nov. |
1.3 |
1.1 |
3.4 |
Arbóreo (A. mexicanum) |
|
S. dirzoius |
1.8 |
1.7 |
s. d. |
Arbóreo |
|
S. eugenius |
1.8 |
1.5 |
s. d. |
Musgo |
|
S. flamiferus |
1.8 |
1.5 |
1.8 |
Tillandsia (Bromeliaceae) |
|
S. grahamius |
1.9 |
1.4 |
s. d. |
Musgos rupícolas |
|
S. magdalenae |
1.8 |
1.8 |
s. d. |
Musgos epífitos |
|
S. mahunkaius |
1.8 |
1.5 |
2.3 |
Canopia |
|
S. morulisensillatus |
1.8 |
1.5 |
1.7 |
Musgos rupícolas |
|
S. nogueraius |
1.9 |
1.3 |
3.4 |
Canopia |
|
S. simplex |
1.8 |
1.8 |
s. d. |
Tillandsia |
|
S. tillandsiophilus |
1.8 |
1.6 |
1.6 |
Tillandsia |
|
S. tonatiuh |
1.6 |
2.0 |
s. d. |
Arbóreo |
|
S. volcanicus |
1.7 |
1.5 |
1.7 |
Musgos epífitos |
|
S. rodickae |
2.2 |
2.3 |
2.2 |
Musgos |
|
S. pauliani |
1.7 |
1.3 |
1.6 |
Helichrysum (Asteraceae) |
Si se analizan las especies que hay en México, tomando en cuenta la proporción de la longitud del notogáster con su grosor (tabla 2), se nota que la más aplanada son S. colloffi sp. nov. y S. nogueraius, ambas 3.4, lo que indica que son las especies mejor adaptadas para vivir en la corteza de los árboles. Por el contario, S. tillandsiophilus (1.6), S. morulisensillatus (1.7), y S. volcanicus (1.7) y S. flamiferus (1.8), son las especies más gruesas y viven en otros ambientes, como epífitas y musgos.
Con relación a la talla de estos ácaros y tomando en cuenta la propuesta de Travé (1963), la reformulamos de la siguiente manera. Aquellos ácaros que miden menos de 300 μm son considerados diminutos, de 300 a 450 pequeños, entre 450 y 600 medianos y más de 600 son grandes. Como puede verse en la tabla 3, la única diminuta es S. colloffi, sp. nov. (277 en promedio); S. pauliani (353) y pulleni (430) son pequeñas; S. cheloniella es mediana (529) y S. angusi (623) y S. argentinensis (660) son grandes.
Scapheremaeus colloffi es la especie con el notogáster más circular (tabla 2), ya que la longitud total/ anchura total = 1.3; longitud del notogáster/ anchura del área central = 1.1) y también es la especie con el cuerpo más aplanado (longitud notogáster/ grosor = 3.4); otra muy aplanada es S. nogueraius (misma proporción de la longitud/grosor); sin embargo, su cuerpo no es más alargado (longitud/anchura = 1.9). El caso más extremo de alargamiento es S. rodickae (2.2), de EUA y colectada en musgos. Las especies mexicanas más aplanadas son S. colloffi sp. nov. y S. nogueraius; ambas viven en la canopia y fueron obtenidas por medio de fumigaciones, la primera de la selva tropical húmeda de Los Tuxtlas (Veracruz) y la segunda de la selva tropical seca de Chamela (Jalisco). Las que tienen el notogáster más circular y aplanado son S. chaac y S. colloffi (tabla2); sin embargo, la primera es saxícola y la segunda arborícola.
Otro carácter relevante es la longitud de las patas; al comparar la longitud de cada artejo (de fémur a tarso) y total de cada pata (tabla 3) de las 6 especies con que contamos con los datos completos, se nota que las más largas son de S. argentinensis (en rocas de Cordón del Plata (casi a 6,000 m snm), Vallecitos, Provincia de Mendoza, Argentina ya que la longitud total de I a IV es: 302, 263, 242, 281, y la que la tiene más cortas es S. colloffi sp. nov., que vive en árboles de Los Tuxtlas, México (180 m snm), cuyas patas de I a IV miden: 138, 112, 106, 120. De acuerdo con Travé (1963), los oribátidos más adaptados a la vida arborícola tienen patas más cortas que aquellas que viven en otros ambientes. Por lo que consideramos que S. colloffi sp. nov., por su tamaño diminuto, forma del cuerpo, aplanado y circular, y sus patas cortas, es la que presentan más modificaciones para para la vida en la corteza de los árboles.
Si se compara la longitud total de las patas I, II, III y IV (tabla 3), se nota una tendencia a que la primera sea más grande que la II y la II que la III; pero la pata IV es más larga que la III; pero no más que la primera. Esto es algo común en la mayoría de los ácaros oribátidos. Sin embargo, si se consideran las proporciones entre longitud total del cuerpo y la longitud de cada una de las patas, las de S. pauliani parecen ser las más cortas y es una especie de tamaño pequeño, S. angusi es la que tiene las patas más largas, siendo una especie de talla grande. Esto tendría que ser verificado, ya que, en todos los casos, las medidas de los artejos de las patas provienen de un solo ejemplar. Si solo se toma en cuenta la longitud de las patas, sin considerar el cuerpo, S. colloffi sp. nov. es la que tiene las patas más cortas y S. argentinensis las más largas.
Tabla 3
Longitud total del cuerpo, anchura y proporción; longitud de cada artejo (de fémur a tarso) y total de cada pata.
|
Tamaño |
Patas I |
Patas II |
|||||||||||
|
Long total |
Anch total |
Ratio |
F |
G |
T |
Tr |
Total |
F |
G |
T |
Tr |
Total |
|
|
S. angusi |
623 |
368 |
1.7 |
110 |
38 |
70 |
32 |
250 |
116 |
44 |
90 |
40 |
290 |
|
S. argentinensis |
660 |
190 |
3.5 |
136 |
45 |
76 |
45 |
302 |
121 |
44 |
60 |
38 |
263 |
|
S. cheloniella |
529 |
280 |
1.9 |
100 |
32 |
67 |
32 |
232 |
91 |
33 |
58 |
30 |
212 |
|
S. colloffi sp.nov. |
277 |
208 |
1.3 |
71 |
21 |
34 |
21 |
138 |
59 |
10 |
26 |
17 |
112 |
|
S. pauliani |
353 |
206 |
1.7 |
97 |
39 |
33 |
39 |
198 |
75 |
29 |
45 |
33 |
182 |
|
S. pulleni |
430 |
242 |
1.8 |
86 |
26 |
58 |
26 |
198 |
83 |
22 |
51 |
22 |
178 |
|
Tamaño |
Patas III |
Patas IV |
|||||||||||
|
Long total |
Anch total |
Ratio |
F |
G |
T |
Tr |
Total |
F |
G |
T |
Tr |
Total |
|
|
S. angusi |
623 |
368 |
1.7 |
86 |
30 |
76 |
38 |
230 |
80 |
36 |
82 |
46 |
244 |
|
S. argentinensis |
660 |
190 |
3.5 |
96 |
33 |
68 |
45 |
242 |
95 |
45 |
81 |
60 |
281 |
|
S. cheloniella |
529 |
280 |
1.9 |
70 |
32 |
57 |
34 |
193 |
77 |
32 |
68 |
36 |
213 |
|
S. colloffi sp.nov. |
277 |
208 |
1.3 |
48 |
12 |
30 |
16 |
106 |
57 |
10 |
37 |
16 |
120 |
|
S. pauliani |
353 |
206 |
1.7 |
54 |
19 |
58 |
29 |
160 |
58 |
21 |
54 |
39 |
172 |
|
S. pulleni |
430 |
242 |
1.8 |
70 |
19 |
55 |
24 |
168 |
68 |
23 |
51 |
31 |
173 |
De acuerdo con Walter y Behan-Pelletier (1999), los Scapheremaeus son habitantes de estructuras vegetales especializadas y su tamaño pequeño y el aplanamiento dorsoventral de la mayoría de las especies, probablemente representan adaptaciones a la vida arbórea. Esto lo hemos comprobado en S. colloffi, sp. nov. (tablas 3 y 4), que es la especie más diminuta, con las patas más cortas y el cuerpo más aplanado que se conoce en México.
Según Colloff (2010), hay evidencias de que Scapheremaeus ha sufrido múltiples radiaciones adaptativas, como denota su distribución mundial y la presencia de grupos de especies que tienen la mayor cantidad de microhábitats que cualquier otro género de oribátidos, con una fuerte tendencia a la vida sobre las plantas. Al parecer, estos rasgos han promovido altas tasas de especiación, una gran radiación adaptativa y su enorme diversificación ecológica.
Estos resultados pueden ser atribuidos a que A. mexicanum tienen una amplia cobertura de sus hojas y una textura rugosa que permite puedan permanecer ahí, además en esta palma se encuentran 11 especies de líquenes, lo que otorga a estos ácaros distintas fuentes de alimento para su desarrollo (Martínez, 2016).
Al parecer, en la selva tropical húmeda de los Tuxtlas, se encuentra preferentemente en octubre. Es interesante que las localidades donde se han citado más especies en México son la selva tropical seca de Chamela, Jalisco y la selva tropical húmeda de Los Tuxtlas, Veracruz; cada una con 6 especies; sin embargo, solo comparten una especie (S. baloghius). Cabe señalar que en estas 2 localidades es donde más se ha trabajado con proyectos anuales y en las otras solo se han realizado recolectas esporádicas. S. colloffi sp. nov. es la mejor representada en la palma A. mexicanum.
Agradecimientos
Este trabajo forma parte del proyecto “Ecología de Microartrópodos de la selva de Los Tuxtlas, Veracruz” que tuvo el apoyo del programa PAPIIT (UNAM) IN214816, a cargo del primer autor. Se agradece a la jefa de la estación de Biología Tropical de Los Tuxtlas, Rosamond Coates y a Martha Madora su ayuda logística; a Ignacio Castellanos (UAEH) por el préstamo de su nebulizadora y a los estudiantes que participaron en las fumigaciones: Adrián Gómez, Fernando Villagómez, Jesús Cruz, y Ariel Quintero, así como a Santiago Sinaca. Ana Isabel Bieler (Laboratorio de Microcine) tomó las fotos 5 a 9 del hábitus y detalles de la morfología bajo el microscopio de contraste de fases. Los autores agradecen a Heinrich Schatz la revisión del manuscrito y sus sugerencias, así como a los revisores anónimos.
Referencias
Aoki, J. (1964). Some oribatid mites (Acarina) from Laysan Island. Pacific Insects, 6, 649– 664.
Balogh, J. y Balogh, P. (1988). Oribatid mites of the Neotropical Region I. Soil mites of the World 2. Akademiai Kiado, Budapest.
Balogh, J. y Balogh, P. (1990). Oribatid mites of the Neotropical Region II. Soil mites of the World 3. Akademiai Kiadó, Budapest.
Colloff, M. J. (2009). Comparative morphology and species-groups of the oribatid mite genus Scapheremaeus (Acari: Oribatida: Cymbaeremaeidae), with new species from South Australia. Zootaxa, 2213, 1– 46. https://doi.org/10.11646/zootaxa.2213.1.1
Colloff, M. J. (2010). The hyperdiverse oribatid mite genus Scapheremaeus (Acari: Oribatida: Cymbaeremaeidae) in Australia, with descriptions of new species and consideration of biogeographical affinities. Zootaxa, 2475, 1–8. https://doi.org/10.11646/zootaxa.2475.1.1
Cutz-Pool, L. Q., Bernal-Rojas, A., Palacios-Vargas, J. G. e Iglesias-Mendoza, R. (2008). Diversidad de artrópodos en un bosque mesófilo del Puerto San Agustín, Querétaro, México. X Simposio de Zoología. México.
Hernández, C., Iglesias, R. y Palacios-Vargas, J. G. (2018). Estudio de los ácaros Scapheremaeus Berlese 1910 (Oribatei: Cymbaeremaeidae) de los Tuxtlas, Veracruz. Entomología Mexicana, 5, 53–57.
Martínez, C. P. (2016). Análisis de la estructura de las comunidades de los líquenes folícolas en la Estación de Biología Tropical Los Tuxtlas, Veracruz, México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. México D.F.
Norton, R. A. y Palacios-Vargas, J. G. (1987). A new arboreal Scheloribatidae, with ecological notes on epiphytic oribatid mites of Popocatépetl, México. Acarologia, 28, 75–89.
Palacios-Vargas, J. G. (2017). ¿Cómo colectar microartrópodos del dosel? El caso de los colémbolos y ácaros de la selva de los Tuxtlas, Veracruz. Memorias del XIX simposio de Zoología. CUCBA, U. de G.
Palacios-Vargas, J. G., Castaño-Meneses, G. y Pescador, A. (1999). Phenology of canopy arthropods of a tropical deciduous forest in Western Mexico. Pan Pacific Entomologist, 75, 200−211.
PalaciosVargas, J. G. y GómezAnaya, J. A. (1993). Los Collembola (Hexapoda: Apterygota) de Chamela, Jalisco, México (Distribución Ecológica y claves). Folia Entomológica Mexicana, 89, 1−34.
Palacios-Vargas, J. G. e Iglesias, R. (2004). Oribatei (Acari). En J. Llorente Bousquets, J.J Morrone, O. Yáñez- Ordóñez y I. Vargas Fernández. (Eds). Biodiversidad, taxonomía y biogeografía de artrópodos de México: hacia una síntesis de su conocimiento, Vol. IV. (pp. 431−468). Facultad de Ciencias, UNAM, México D.F.
Palacios-Vargas, J. G. y Mejía, B. (2007). Técnicas de colecta, montaje y preservación de microartrópodos edáficos. México D.F.: Las Prensas de Ciencias.
Palacios-Vargas, J. G. y Mejía, B. (2017). Artrópodos de la canopia en la selva tropical húmeda de Los Tuxtlas, Veracruz con énfasis en Collembola. Entomología Mexicana, 4, 90−95.
Palacios-Vargas, J. G y Páez, J. (2018). A new Mexican Scapheremaeus (Acari: Oribatida: Cymbaeremaeidae) from the tropical rain forest of Los Tuxtlas, Veracruz. Dugesiana, 25, 129−136.
Palacios-Vargas, J. G. y Ríos, G. (1998). A new Scapheremaeus (Oribatei: Cymbaeremaeidae) from Central America. Revista Nicaragüense de Entomología, 44, 29−35.
Palacios-Vargas, J. G., Ríos, G. y Vázquez, M. (1998). A new Mexican Scapheremaeus (Oribatei: Cymbaeremaeidae) from tropical forest. Acarología, 39, 95−100.
Pérez-Íñigo, C. (1993). Fauna Ibérica, Vol. 3. Acari, Oribatei, Poronota. Madrid: Museo Nacional de Ciencias Naturales.
Ríos, G. (1996). A peculiar new Scapheremaeus species from Mexico (Acari: Oribatida). Folia Entomologica Hungarica, 57, 237–241.
Ríos, G. y Palacios-Vargas, J. G. (1998). Especies nuevas de Scapheremaeus (Acari: Oribatei: Cymbaeremaeidae) de México. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, serie Zoología, 69, 181−215.
Ríos, G. y Villavicencio, R. (1994). Microartrópodos asociados a musgos en Contreras, México D.F. Resúmenes del III Simposio de Zoología y II Congreso Latinoamericano de Teriología del 20 al 24 de junio, La Habana, Cuba.
Ríos, S. G. (1997). Taxonomìa de los Scapheremaeus (Oribatei: Cymbaeremaeidae) de la Región Neotropical (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. México D.F.
Sánchez, M. A. V., Ríos, G. A. S., García, S, J. A., Palacios-Vargas, J. G., Álvarez, J. S., Gómez, R. V. et al. (1998). Microartrópodos del dosel de Astrocarium mexicanum, y estimaciones preliminares de la descomposición de hojarasca de 4 especies arbóreas, en una selva tropical. XXXIII Congreso Nacional de Entomología, del 24 al 27 de marzo, Acapulco, Guerrero, México.
Subías, L. S. (2004). Listado sistemático, sinonímico y biogeográfico de los ácaros oribátidos (Acariformes: Oribatida) del (1758-2002). Graellsia, 60 (Número extraordinario), 3–305.
Travé, J. (1963) Écologie et biologie des Oribates (Acariens) saxicoles et arbicoles. Vie et Milieu, Supplement, 14, 1–267.
Vázquez, T. M., Armenta, S., Campos, J. y Carvajal, C. (2010). Árboles de la región de Los Tuxtlas. Xalapa: Comisión Organizadora del Estado de Veracruz. Library Congress.
Villagómez, F., Iglesias, R. y Palacios-Vargas, J. G. (2017). Los ácaros oribátidos (Acari: Oribatei) de los estratos edáficos y arbóreos de la selva alta perennifolia de los Tuxtlas, Veracruz. Entomología Mexicana, 4, 28–34.
Villagómez, F., Palacios-Vargas, J. G., G. Castaño Meneses, G. y Castellanos Vargas, I. (2019). Effect of tree identity, temporal variation and edaphic parameters on the structure of the edaphic community of oribatid mites in an evergreen tropical forest of Mexico. Applied Ecology and Environmental Research, 17, 14621–14639.
Villarreal-Rosas, J., Palacios-Vargas, J. G. y Maya, Y. (2014). Microarthropod communities related with biological soil crusts in a desert scrub in northwestern Mexico. Revista Mexicana de Biodiversidad, 85, 513–522. https://doi.org/10.7550/rmb.38104
Walter, D. E. y Behan-Pelletier, V. (1999). Mites in forest canopies: filling the size distribution shortfall? Annual Review of Entomology, 44, 1–19. https://doi.org/10.1146/annurev.ento.44.1.1




