Jiichiro Yoshimoto a, *, Mercedes Barrios b, José Luis Salinas-Gutiérrezc y Andrew D. Warren d
a Universidad del Valle de Guatemala, Laboratorio de Entomología Sistemática, Apartado postal 82, 01901 Ciudad de Guatemala, Guatemala
b Universidad de San Carlos de Guatemala, Centro de Estudios Conservacionistas, Avenida La Reforma 0-53, Zona 10, 01010 Ciudad de Guatemala, Guatemala
c Universidad Nacional Autónoma de México, Facultad de Ciencias, Departamento de Biología Evolutiva, Museo de Zoología, Circuito Exterior s/n, Ciudad Universitaria Coyoacán, 04510 Ciudad de México, México
d University of Florida, Florida Museum of Natural History, McGuire Center for Lepidoptera and Biodiversity, 3215 Hull Rd., UF Cultural Plaza, Gainesville, Florida 32611-2710, EUA
*Autor para correspondencia: jyoshimoto@uvg.edu.gt (J. Yoshimoto)
Recibido: 7 abril 2020; aceptado: 10 agosto 2020
Resumen
En un bosque secundario mixto de la Ciudad de Guatemala se realizó trabajo de campo (recolectas, fotografías y observaciones) de mariposas diurnas, entre noviembre de 2014 a octubre de 2019. Se registraron 109 especies de 77 géneros, 17 subfamilias y 6 familias del orden Lepidoptera. La riqueza y composición de especies difieren considerablemente entre los meses, sin presentar patrones estacionales evidentes entre la estación seca y la lluviosa. Los resultados sugieren que este bosque pequeño y aislado tiene una riqueza alta de lepidópteros y que este tipo de hábitat es de gran importancia para mantener la diversidad de insectos en las zonas urbanas que están sujetas al constante deterioro ambiental. Este es el primer estudio que comprende varios años de muestreo de lepidópteros en la Ciudad de Guatemala y sirve de línea base para estudios de conservación de la biodiversidad en la zona metropolitana.
Palabras clave: Diversidad; Estacionalidad; Fluctuación; Hesperiidae; Inventario; Neotropical
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Fauna and phenology of butterflies (Lepidoptera: Papilionoidea) of a secondary forest in the urban area of Guatemala
Abstract
In a secondary mixed forest in Guatemala City, field surveys (collecting, photographing, and observations) of butterflies were conducted from November 2014 to October 2019, which yielded 109 species in 77 genera from 17 subfamilies of 6 families of the order Lepidoptera. Species richness and composition varied highly among months, showing no marked seasonal patterns between the dry and rainy seasons. The results suggest that a small and isolated woodland can harbor a rich lepidopteran fauna, and that this type of habitat is of great importance for the maintenance of insect diversity in urban areas subject to constant environmental degradation. This is the first study on Lepidoptera conducted across multiple years in Guatemala City, and serves as a baseline for biodiversity conservation studies in the metropolitan area.
Keywords: Diversity; Seasonality; Fluctuation; Hesperiidae; Inventory; Neotropical
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Guatemala cuenta con gran riqueza de especies de flora y fauna, no obstante, en la actualidad los ecosistemas del país están amenazados por varios impactos ambientales, como la deforestación y la contaminación (Cano, 2006). Ambas amenazas son particularmente importantes en las áreas urbanas, donde hay más actividades humanas y un crecimiento considerable de la población. Para fundamentar las estrategias de conservación de los espacios naturales remanentes, es necesario obtener la información básica de flora y fauna mediante la elaboración de inventarios biológicos y el monitoreo de la biodiversidad (Kremen et al., 1993).
Durante 2006 y 2007 se realizaron estudios de diversidad biológica en el Departamento de Guatemala, en los que se registran diversas especies de plantas y animales (Ixcot et al., 2007). Sin embargo, ante el acelerado deterioro ambiental en la última década, es necesario actualizar la información de la flora y fauna para comprender el estado actual de la biodiversidad del área. Las mariposas diurnas, Lepidoptera, son uno de los grupos taxonómicos importantes para este tipo de investigaciones porque se utilizan como bioindicadores y se investigan en relación a la urbanización o perturbación en varias partes del mundo (Balam-Ballote y León-Cortés, 2010; Bergerot et al., 2010; Brown y Freitas, 2002; Kitahara y Sei, 2001; Kremen, 1992; Ramírez-Restrepo y MacGregor-Fors, 2017; Sánchez-Jasso et al., 2019).
En cuanto a las mariposas diurnas de Guatemala, hasta la fecha se han registrado aproximadamente 400 especies de la familia Hesperiidae (Austin et al., 1998; Barrios et al., 2006) y alrededor de 700 especies de las demás familias de la superfamilia Papilionoidea (Salinas-Gutiérrez, 2013; Salinas-Gutiérrez et al., 2009, 2012). A pesar de lo anterior, aun se conoce poco acerca de la fauna de mariposas del país en comparación con otros países neotropicales. Por ejemplo, en México existen listas exhaustivas de especies a nivel de país y algunos estados (Luis-Martínez et al., 2004, 2011, 2016; Llorente-Bousquets et al., 2014; Maza et al., 1989, 1991); mientras que Guatemala tiene pocos estudios intensivos y listas publicadas de Lepidoptera.
Austin et al. (1996) registraron más de 500 especies de Papilionoidea en una selva lluviosa tropical del norte de Guatemala. Nuestras investigaciones revelan que los bosques estacionalmente secos del país también tienen diversidad alta de mariposas (Yoshimoto et al., 2018, 2019). Por otro lado, es necesario hacer notar que aun existen importantes vacíos de conocimiento sobre los lepidópteros diurnos en otras regiones del país, asociadas a diferentes tipos de vegetación. El presente estudio aporta una lista de especies de Papilionoidea (incluye la familia Hesperiidae; van Nieukerken et al., 2011) con base en muestreos realizados de 2014 a 2019 en un bosque secundario mixto de la Ciudad de Guatemala, que contribuye al inventario de mariposas diurnas de la zona urbana del país. Además, se implementó un monitoreo mensual por 1 año para interpretar patrones fenológicos.
Materiales y métodos
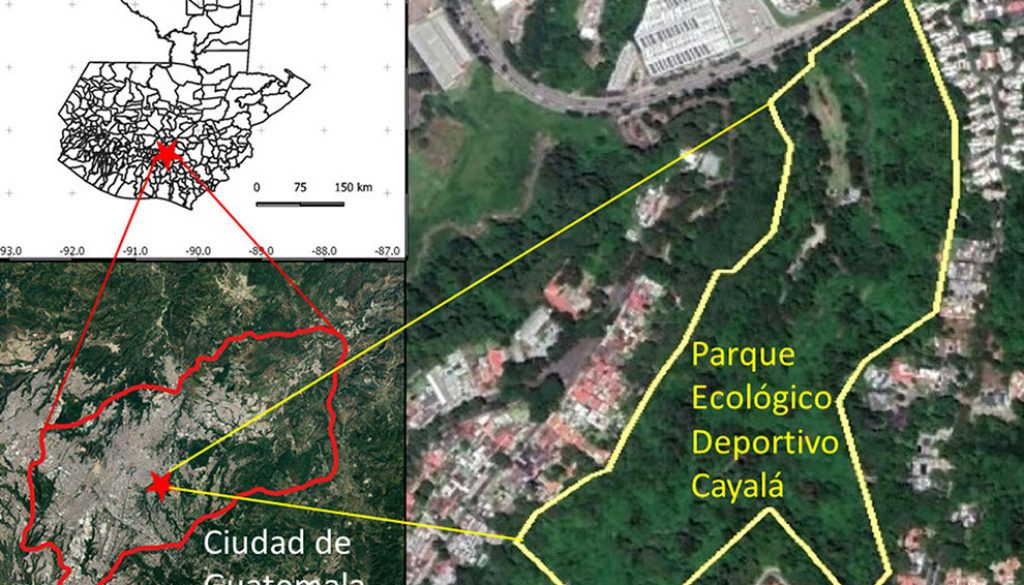
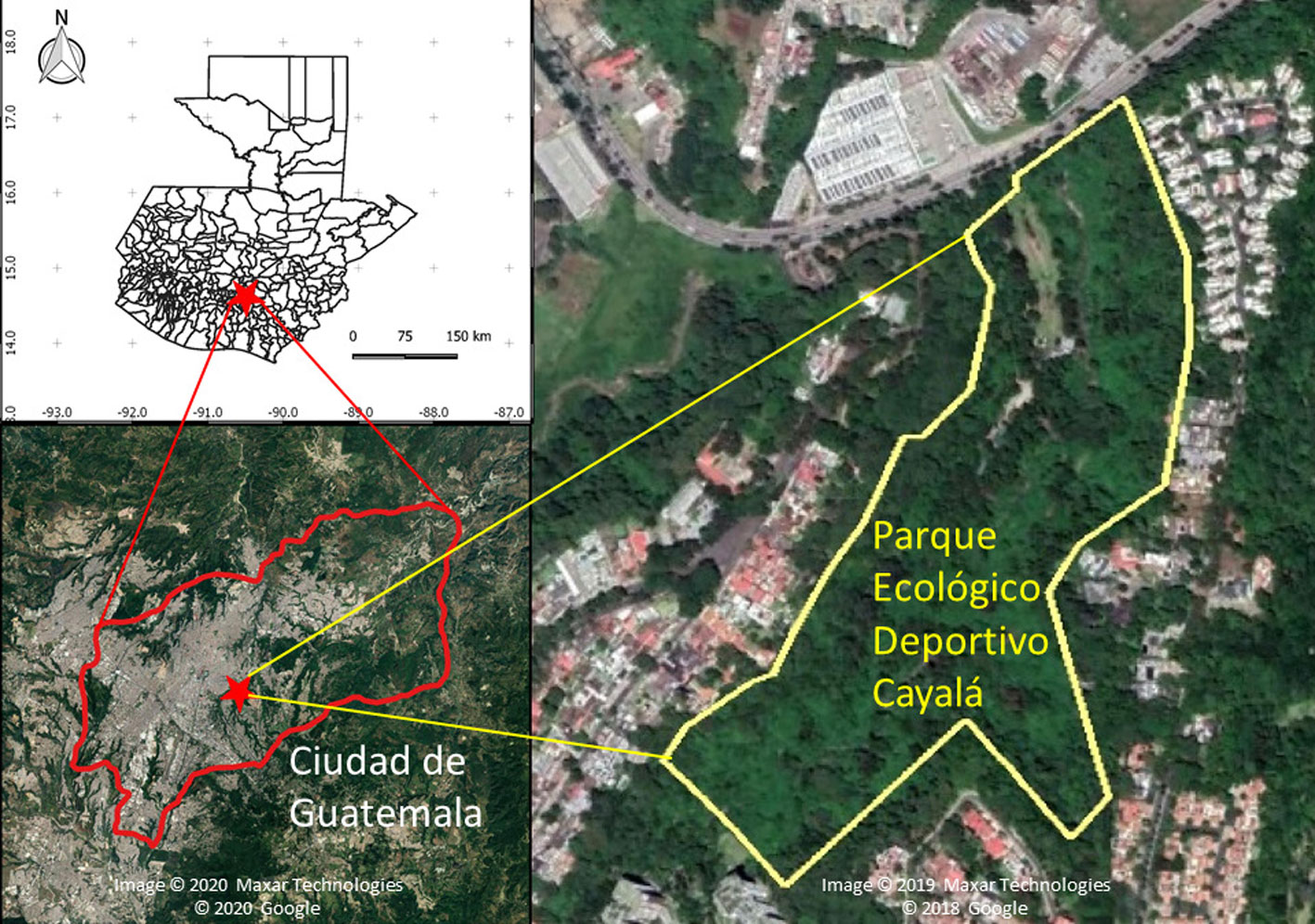
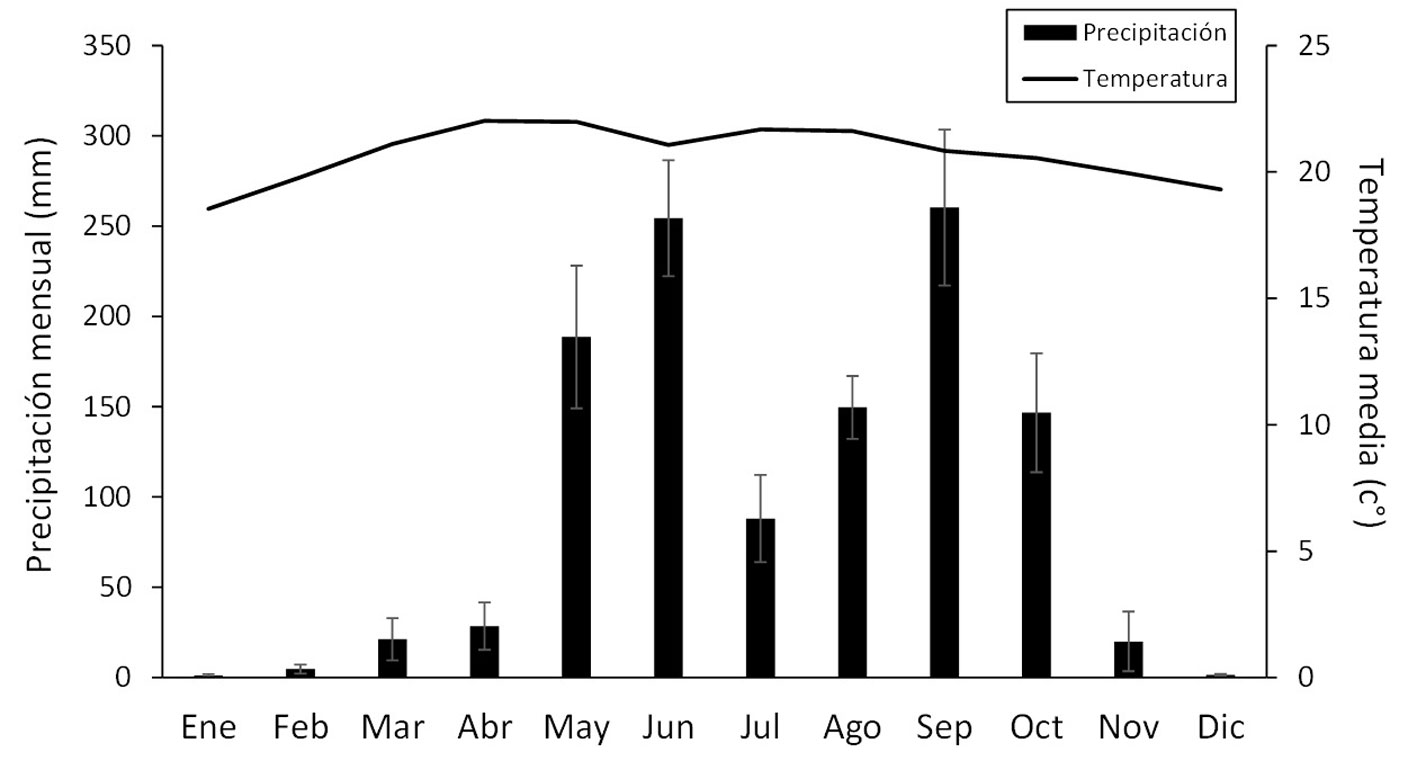
Este estudio se realizó en el Parque Ecológico Deportivo Cayalá (14°37’01” N, 90°29’34” O; 1,450 m snm, ~10 ha), zona 16, Ciudad de Guatemala (fig. 1). En la Ciudad de Guatemala, la estación lluviosa normalmente es de mayo a octubre y la estación seca inicia en noviembre y permanece hasta finales de abril (fig. 2). El parque colinda con una barranca donde se encuentran áreas boscosas; en la actualidad casi todos estos bosques conforman islas por la deforestación y urbanización. La vegetación de la zona donde se ubica el parque corresponde al bosque húmedo subtropical (Cruz, 1982); los árboles dominantes son pinos (Pinus), encinos y robles (Quercus), lo que corresponde al bosque mixto (FAO, 2010). Si bien en el parque hay áreas abiertas y perturbadas, aun se mantiene un bosque secundario mixto con varios árboles latifoliados, pinos, arbustos como el chichicaste (Urera sp.: Urticaceae) y plantas introducidas como Eucalyptus globulus, Liquidambar styraciflua y Magnolia champaca (J. Yoshimoto, observación personal). Cabe mencionar que el parque tiene una riqueza alta de otros grupos taxonómicos; por ejemplo, se registran 117 especies de aves, según la lista elaborada en diciembre de 2019 (FUNDAECO, datos no publicados).
Se realizó un muestreo cualitativo con base en la recolecta de mariposas con red entomológica y registros fotográficos desde noviembre de 2014 hasta octubre de 2019 (34 días en total). Para detectar patrones de fenología, se llevó a cabo un monitoreo semicuantitativo por el mismo observador una vez al mes, de abril de 2016 a marzo de 2017 (12 días en total; 5 de estas fechas coinciden con las fechas en las que se hizo el muestreo cualitativo). Para el monitoreo mensual, se estableció un transecto a lo largo de senderos de 1.4 km y a través de un puente colgante, donde se observaron mariposas diurnas volando o posándose dentro o por la orilla de los senderos de las 09:30 a las 12:30 hrs. A inicios de 2017, el puente y una parte de los senderos se cerraron por la construcción de una residencia, lo que obligó a cambiar parcialmente la ruta del monitoreo durante los 3 meses subsecuentes, de enero a marzo; se desviaron las partes cerradas unos 160 m, pasando por otro sendero y un puente nuevo. La identificación fue visual en el campo, empero, en los casos de determinación difícil a simple vista, los individuos se recolectaron o se fotografiaron para su posterior determinación en el laboratorio. En los casos donde no hay recolecta ni fotografía de los individuos de determinación difícil, se registraron los datos hasta género (apéndice). Con el fin de obtener información de la fenología de abundancia, se realizaron conteos preliminares para las especies y géneros que se pudieron identificar en el campo, con el mismo método y criterio que los del estudio anterior (Yoshimoto et al., 2019); se contabilizaron los individuos para cada especie o género durante cada muestreo, considerando que un taxón es relativamente abundante cuando se registran más de 9 individuos observados, lo que es un criterio arbitrario. Los datos, producto de los muestreos cualitativos y semicuantitativos se utilizaron para crear la lista de especies. Los ejemplares recolectados se montaron como especímenes voucher y se identificaron hasta especie o subespecie, según Warren et al. (2017). Los ejemplares que no se identificaron hasta género no se registraron; solo se incluyen 3 individuos recolectados de Hesperiidae (Hesperiidae sp. 1, Hesperiinae sp. 1 y Hesperiinae sp. 2; apéndice), pues se confirmó que son diferentes especies a las otras determinadas de dicha familia con base en la revisión de los genitales. Todos los especímenes montados se depositaron en la Colección de Artrópodos del Laboratorio de Entomología Sistemática de la Universidad del Valle de Guatemala.
La riqueza de especies fue definida como el número total de especies registradas; además, se estimó con base en el índice de Chao II, que puede ser aplicado a los datos de incidencia con replicación (Chao et al., 2005; Gotelli y Colwell, 2011). Se realizó la misma estimación de riqueza de especies con los datos de la estación seca, 19 días entre noviembre y abril, y de la estación lluviosa, 22 días entre mayo y octubre, para determinar la presencia de algún patrón estacional. A través de los datos del monitoreo mensual semicuantitativo, se utilizaron la riqueza mensual de especies, la riqueza total de especies de la estación seca (abril 2016 y de noviembre 2016 a marzo 2017) y de la estación lluviosa (mayo-octubre 2016) y el promedio de riqueza de especies de cada estación. Se usaron los mismos datos para un análisis multivariado, NMDS (por sus siglas en inglés), para ello se utilizó la matriz de similitud con el índice de Sørensen, con el objeto de interpretar las variaciones en la composición de especies entre los meses. Los taxones no identificados hasta especie fueron incluidos en el género correspondiente (código de paréntesis en el apéndice); solamente los datos de Eurema sp., Urbanus spp. y Bolla sp. se excluyeron de todos los análisis, pues es probable que esos individuos fueran de una de las especies ya determinadas de cada género. Todos estos análisis se realizaron con el programa R 3.5.3, con el paquete Vegan (Oksanen et al., 2019; R Development Core Team, 2019).
Resultados
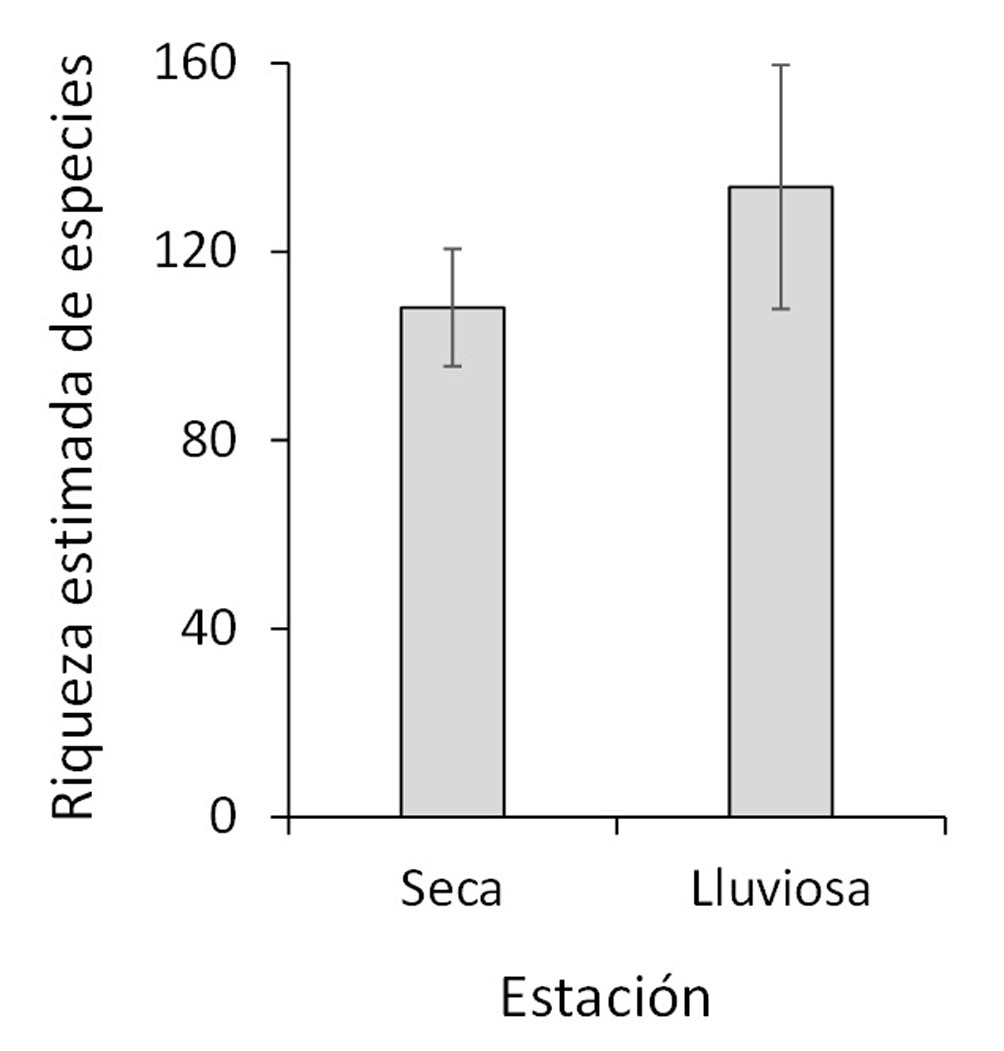
Durante el periodo de trabajo de campo de 2014 a 2019, se registraron 109 especies (incluyendo 4 taxones no identificados y 56 subespecies) de 77 géneros, 17 subfamilias y 6 familias del orden Lepidoptera (apéndice). La familia que tuvo la mayor riqueza de especies fue Hesperiidae (49 especies), seguida por Nymphalidae, Pieridae, Lycaenidae, Riodinidae y Papilionidae (40, 8, 7, 4 y 1 especies, respectivamente). El número estimado de especies (promedio ± error estándar) con base en el índice de Chao II es 142.93 ± 14.11, el cual indica un muestreo de 76.3% de las especies que habitan en el parque Cayalá. Se registraron 81 especies en la estación seca y 75 especies en la estación lluviosa; la estimación de riqueza de especies no evidenció diferencias significativas entre ambas estaciones, con base a la variación de los valores estimados (fig. 3).
En el monitoreo mensual semicuantitativo, la riqueza de especies suma 68 en la estación seca y 64 en la estación lluviosa; su valor promedio con error estándar de la estación seca es 27.33 ± 2.88 y el de la estación lluviosa es 24.33 ± 2.80. La riqueza de especies fluctuó considerablemente a mediados y a fines de la estación lluviosa (julio-octubre) y al principio de la estación seca (noviembre-enero); incrementó altamente en julio, luego disminuyó al mínimo en septiembre, posteriormente aumentó de nuevo y alcanzó al pico en diciembre (tabla 1). En enero redujo de nuevo y en febrero y marzo fluctuó en menor grado, casi al mismo nivel que entre abril y junio del año anterior.
Hay una gran diferencia en los patrones mensuales de riqueza de especies entre las 6 familias (tabla 1). Hesperiidae y Nymphalidae tuvieron la mayor riqueza de especies entre octubre y diciembre, si bien Hesperiidae tuvo riqueza alta también en junio y julio, en cambio, Nymphalidae en mayo y enero. Pieridae fluctuó en mayor grado (1-5 especies) entre abril y septiembre alcanzando el máximo en julio. Lycaenidae tuvo una riqueza más alta en la estación seca (abril, enero y febrero). En cuanto a Papilionidae y Riodinidae, se registró una especie o no se observó ninguna mensualmente.
Tabla 1
Riqueza de especies para 6 familias de mariposas diurnas observadas en el monitoreo mensual realizado de abril de 2016 a marzo de 2017 en el Parque Ecológico Deportivo Cayalá, Guatemala.
|
Familia |
Abr |
May |
Jun |
Jul |
Ago |
Sep |
Oct |
Nov |
Dic |
Ene |
Feb |
Mar |
|
Papilionidae |
1 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Pieridae |
2 |
1 |
2 |
5 |
3 |
1 |
2 |
3 |
4 |
4 |
3 |
2 |
|
Lycaenidae |
3 |
0 |
1 |
2 |
1 |
1 |
0 |
0 |
2 |
3 |
4 |
2 |
|
Riodinidae |
1 |
1 |
1 |
1 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
|
Nymphalidae |
9 |
12 |
8 |
9 |
10 |
8 |
13 |
18 |
20 |
13 |
6 |
10 |
|
Hesperiidae |
6 |
10 |
12 |
14 |
5 |
4 |
17 |
12 |
13 |
5 |
9 |
9 |
|
Total |
22 |
24 |
24 |
31 |
19 |
15 |
33 |
33 |
39 |
25 |
22 |
23 |
Se muestra una variación mensual alta e irregular en la composición de especies, según el análisis de NMDS (estrés = 0.179; fig. 4). En el diagrama de ordenación, la composición de especies cambió considerablemente cada mes y no están separados claramente los datos de los meses de la estación seca y de la estación lluviosa.
Durante el periodo de los 5 años, se observaron 47 especies en ambas estaciones, 34 especies únicamente en la estación seca y 28 en la estación lluviosa (apéndice). La especie más dominante fue Heliconius charithonia (Nymphalidae), que se observa durante todo el año, con la abundancia más alta (≥ 10 individuos) en 5 meses de la estación seca y en octubre. Las especies que ocupan el segundo lugar en la dominancia (observadas en 11 meses) fueron Greta morgane (Nymphalidae) y Hermeuptychia hermes (el nombre de la especie podría cambiar, porque hermes aplica a las especies de América del Sur, según Cong y Grishin, 2014), seguidas por Eurema salome (Pieridae), Dircenna klugii y Tegosa guatemalena (Nymphalidae), que se observaron en 10 meses. A nivel de género, Heliconius, Anthanassa (Nymphalidae) y Remella (Hesperiidae) fueron los más dominantes registradas durante todo el año, seguidos por Phoebis (Pieridae), Greta y Hermeuptychia que aparecieron durante 11 meses.

Discusión
Se registraron 109 especies de mariposas diurnas en el parque Cayalá en los últimos 5 años y la riqueza de especies estimada con base en el índice de Chao II es 142.93. Estos resultados indican que este bosque, aunque es pequeño y aislado, tiene una riqueza alta de la superfamilia Papilionoidea, lo cual a la vez subraya la importancia de los remanentes de vegetación natural y áreas verdes para mantener la diversidad de insectos en la zona urbana propensa a sufrir de constante deterioro ambiental. Estos datos, en conjunto con la lista de aves (117 especies: FUNDAECO, datos no publicados) mencionada en la sección de sitio de estudio, son evidencias importantes de la riqueza de fauna que aun se observa en el parque Cayalá y sirven de base para el desarrollo y ejecución de planes y estrategias de conservación de la biodiversidad en la zona metropolitana. El presente estudio es el primero que comprende varios años de muestreo de los lepidópteros en la Ciudad de Guatemala.
El parque presenta una diversidad alta de mariposas a pesar de ubicarse en la zona urbana donde el bosque está aislado, mientras que numerosos estudios previos detectaron un impacto negativo de urbanización sobre la diversidad de lepidópteros (Ramírez-Restrepo y MacGregor-Fors, 2017). Se sugiere una posibilidad de que otros remanentes de bosques y áreas verdes tanto como los valles y barrancas alrededor del parque funcionen como un corredor de hábitats (Dennis et al., 2013; Haddad, 1999), con lo cual muchas especies de mariposas observadas en el parque podrían mantener sus poblaciones mediante la dispersión entre hábitats. Otra posibilidad es que estas especies pudieran sostener sus poblaciones dentro del parque sin conexión alta con otros hábitats de los alrededores. Estos resultados subrayan la necesidad e importancia de investigación de diversidad de mariposas del parque en relación con los elementos de paisaje (e.g., conectividad y fragmentación de hábitats) y con los caracteres de historia de vida de las especies (capacidad de vuelo y dispersión, voltinismo, hábito de alimentación).
La riqueza y composición de especies de mariposas cambiaron alta e irregularmente entre los meses y no se detectaron patrones marcados entre la estación seca y lluviosa (tabla 1, figs. 3, 4). Estos resultados contrastan con los de mariposas del bosque seco, donde se observaron muchas más especies en la época lluviosa que en la época seca (Yoshimoto et al., 2019). Aunque es difícil discutir los patrones estacionales irregulares del parque, el aumento de riqueza de especies al principio de la época seca (tabla 1) podría estar relacionado con la fenología de las plantas, porque en esta temporada aparecen flores de varias hierbas y arbustos como los chichicastes (Urera sp.: Urticaceae) y las familias Asteraceae y Acanthaceae (J. Yoshimoto, obs. pers.; M. R. Álvarez, com. pers.). Es por ello que se considera necesario el monitoreo cuantitativo mensual relacionado a factores bióticos y abióticos, especialmente a la fenología florística, para dilucidar la fenología de mariposas del parque Cayalá.
La falta de información de fenología previa a este estudio impide la discusión de las diferencias en la fluctuación entre las familias (tabla 1), pero es muy probable que las 6 especies observadas casi todo el año (Heliconius charithonia, Greta morgane, Hermeuptychia hermes, Dircenna klugii, Tegosa guatemalena y Eurema salome) sean multivoltinas; es decir, que se reproduzcan varias veces al año. También cabe mencionar que algunas de estas especies dominantes aumentaron su abundancia (≥ 10 individuos) en ciertos meses.
Orthos lycortas (Hesperiidae: Hesperiinae) no se reportó con anterioridad para Guatemala; sin embargo, hay un registro fotográfico de esta especie en el suroeste del país, en la Reserva Natural Los Tarrales, a 70 km del parque Cayalá (ver la página web Butterflies of America; Warren et al., 2017); por lo tanto, nuestro dato no es un registro nuevo para el país, pero sí podría corresponder a los primeros especímenes recolectados en el país.
Es importante resaltar el registro de Lasaia sessilis (Riodinidae: Riodininae) en el bosque de pino-encino del parque, porque este género tiende a encontrarse más comúnmente en las tierras bajas y cálidas con otros tipos de vegetación. En México esta especie es más abundante entre 0-1,500 m snm (Arellano-Covarrubias et al., 2019) y se registró principalmente en el bosque tropical subcaducifolio, bosque tropical perennifolio y bosque mesófilo de montaña; un solo ejemplar se recolectó en la vegetación similar al bosque de pino-encino de alrededor de 800 m snm (A. Arellano-Covarrubias, com. pers.). Se subraya que esta especie se recolectó en el parque solamente en el 2019 y que no se había observado en los años anteriores, incluyendo el periodo del monitoreo mensual. Es necesario obtener suficientes datos en varios sitios de Guatemala para determinar si la distribución de L. sessilis está cambiando recientemente o no.
Agradecimientos
Se reconoce a Cesar Barrios, Patricia Lux, Gabriel Valle y los colegas del Parque Ecológico Deportivo Cayalá por su gran apoyo logístico para la investigación entomológica en este sitio. A la Fundación para el Ecodesarrollo y la Conservación (FUNDAECO) por brindarnos la información geográfica y los datos de avifauna del parque. A Arturo Arellano Covarrubias por la información valiosa de Riodinidae y a María Renée Álvarez por la identificación de plantas recolectadas en el parque y por la información florística de la Ciudad de Guatemala. Al Instituto Nacional de Sismología, Vulcanología, Meteorología e Hidrología (INSIVUMEH) por prestarnos los datos climáticos de la Ciudad de Guatemala. A Keith R. Willmott y los dos revisores anónimos por sus revisiones del manuscrito y sus comentarios valiosos.
Apéndice. Lista de especies de mariposas diurnas con registros de noviembre de 2014 a octubre de 2019 en el Parque Ecológico Deportivo Cayalá, Guatemala. Las especies en negritas y con el superíndice F son registros físicos y tienen fotografías, respectivamente. Los taxones con código en paréntesis no se lograron identificar hasta especie en el monitoreo mensual (estos datos se excluyeron del conteo de especies y del cálculo del índice de Chao II). Las determinaciones se llevaron a cabo según Warren et al. (2017). Los meses en negritas indican los casos donde se observaron más de 9 individuos en el monitoreo.
|
Familia |
Meses de observación |
|
|
Subfamilia |
||
|
Especie y subespecie |
||
|
Papilionidae |
||
|
Papilioninae |
||
|
1 |
Heraclides erostratus erostratus (Westwood, 1847) |
Abr, Sep |
|
Pieridae |
||
|
Coliadinae |
||
|
2 |
Eurema daira eugenia (Wallengren, 1860) |
Ene |
|
3 |
Eurema mexicana mexicana (Boisduval, 1836) |
Feb, Mar, Ago, Dic |
|
4 |
Eurema salome jamapa (Reakirt, 1866) F |
Ene, Feb, Mar, Abr, Jun, Jul, Ago, Oct, Nov, Dic |
|
(2-4) |
Eurema sp.* |
Abr |
|
5 |
Phoebis philea philea (Linnaeus, 1763) F |
Mar |
|
(5) |
Phoebis spp. |
Ene, Feb, Abr, May, Jun, Jul, Sep, Oct, Nov, Dic |
|
6 |
Pyrisitia nise nelphe (R. Felder, 1869) |
Ene, Jul |
|
(6) |
Pyrisitia sp. |
Ago |
|
7 |
Zerene cesonia cesonia (Stoll, 1790) F |
Jul |
|
Pierinae |
||
|
8 |
Ascia monuste monuste (Linnaeus, 1764) |
Mar |
|
9 |
Leptophobia aripa elodia (Boisduval, 1836) |
Mar, Jul, Nov, Dic |
|
Lycaenidae |
||
|
Theclinae |
||
|
10 |
Arawacus sito (Boisduval, 1836) |
Sep, Oct |
|
11 |
Ostrinotes keila (Hewitson, 1869) F |
Ene, Abr, Jul, Ago, Dic |
|
Polyommatinae |
||
|
12 |
Celastrina echo gozora (Boisduval, 1870) |
Feb |
|
(12) |
Celastrina sp. |
Abr |
|
13 |
Cupido comyntas texana (F. Chermock, 1945) F |
Jul |
|
14 |
Leptotes cassius cassidula (Boisduval, 1870) |
Feb, Dic |
|
15 |
Leptotes marina (Reakirt, 1868) F |
Ene, Feb, Mar, Abr, Jun |
|
16 |
Zizula cyna (W. H. Edwards, 1881) |
Ene, Feb, Mar, Dic |
|
Riodinidae |
||
|
Riodininae |
||
|
17 |
Calephelis spp. F |
May, Jun, Jul, Oct |
|
18 |
Calociasma laius (Godman & Salvin, 1886) |
May |
|
19 |
Emesis tenedia C. Felder & R. Felder, 1861 F |
Dic |
|
(19) |
Emesis sp. |
Abr |
|
20 |
Lasaia sessilis Schaus, 1890 |
Ago |
|
Apéndice. Continúa |
||
|
Nymphalidae |
||
|
Libytheinae |
||
|
21 |
Libytheana carinenta mexicana Michener, 1943 |
Nov |
|
Danainae |
||
|
22 |
Danaus plexippus plexippus (Linnaeus, 1758) |
Feb, Mar, Jul, Dic |
|
(22) |
Danaus sp. |
Ene |
|
23 |
Lycorea halia atergatis E. Doubleday [1847] F |
May, Jul |
|
24 |
Dircenna klugii klugii (Geyer, 1837) F |
Ene, Abr, May, Jun, Jul, Ago, Sep, Oct, Nov, Dic |
|
25 |
Greta annette annette (Guérin-Méneville, [1844]) F |
Mar, Dic |
|
26 |
Greta morgane oto (Hewitson, [1855]) F |
Ene, Feb, Mar, May, Jun, Jul, Ago, Sep, Oct, Nov, Dic |
|
27 |
Mechanitis lysimnia utemaia Reakirt, 1866 F |
Ene, Jul, Ago, Nov, Dic |
|
28 |
Mechanitis polymnia lycidice H.W. Bates, 1864 |
Mar |
|
(27, 28) |
Mechanitis spp. |
Jun, Jul |
|
29 |
Pteronymia simplex fenochioi Lamas, 1978 F |
Dic |
|
Heliconiinae |
||
|
30 |
Actinote anteas ssp. n. |
Feb, Mar |
|
31 |
Altinote ozomene nox (H. Bates, 1864) F |
Ene, Oct, Dic |
|
32 |
Dione moneta poeyii A. Butler, 1873 F |
Feb, Mar, May, Oct, Nov |
|
33 |
Dryas iulia moderata (N. Riley, 1926) F |
Ene, Abr, Nov, Dic |
|
34 |
Euptoieta hegesia meridiania Stichel, 1938 |
Mar |
|
35 |
Heliconius charithonia vazquezae W. Comstock & F. Brown, 1950 F |
Ene, Feb, Mar, Abr, May, Jun, Jul, Ago, Sep, Oct, Nov, Dic |
|
36 |
Heliconius hortense (Guérin-Méneville, [1844]) F |
May, Oct, Nov |
|
Limenitidinae |
||
|
37 |
Adelpha paroeca paroeca (H. Bates, 1864) F |
Nov |
|
Biblidinae |
||
|
38 |
Diaethria anna salvadorensis (Franz & Schröder, 1954) F |
Mar, Ago Sep, Oct, Nov |
|
39 |
Diaethria astala astala (Guérin-Méneville, [1844]) F |
Ene, Mar, Abr, May, Jul, Sep, Oct, Nov, Dic |
|
40 |
Diaethria pandama (E. Doubleday, [1848]) F |
Mar, May, Oct, Dic |
|
41 |
Epiphile adrasta adrasta Hewitson, 1861 F |
May, Sep, Oct, Nov, Dic |
|
Cyrestinae |
||
|
42 |
Marpesia petreus ssp. n. |
Oct |
|
Nymphalinae |
||
|
43 |
Anartia fatima fatima (Fabricius, 1793) |
Mar, Abr, Jun, Jul, Sep, Oct, Nov, Dic |
|
44 |
Anthanassa atronia (H. Bates, 1866) |
Mar |
|
45 |
Anthanassa drusilla lelex (H. Bates, 1864) F |
Mar, Sep |
|
46 |
Anthanassa otanes otanes (Hewitson, 1864) F |
Ene, Ago, Nov |
|
47 |
Anthanassa ptolyca ptolyca (H. Bates, 1864) F |
Feb, Mar, Ago, Sep, Oct, Dic |
|
48 |
Anthanassa texana texana (W. H. Edwards, 1863) |
Mar |
|
(44-48) |
Anthanassa spp. F |
Ene, Feb, Mar, Abr, May, Jun, Jul, Ago, Oct, Nov, Dic |
|
49 |
Chlosyne lacinia lacinia (Geyer, 1837) |
Oct |
|
Apéndice. Continúa |
||
|
(49) |
Chlosyne sp. |
Ene |
|
50 |
Hypanartia lethe lethe (Fabricius, 1793) F |
Ene, Mar, Oct, Nov, Dic |
|
51 |
Siproeta epaphus epaphus (Latreille, [1813]) F |
Ene, Jun, Ago, Sep, Oct, Nov, Dic |
|
52 |
Siproeta stelenes biplagiata (Fruhstorfer, 1907) F |
Abr, Dic |
|
53 |
Smyrna blomfildia datis Fruhstorfer, 1908 F |
Ago |
|
54 |
Tegosa guatemalena (H. Bates, 1864) F |
Ene, Feb, Mar, Abr, May, Jul, Ago, Oct, Nov, Dic |
|
Satyrinae |
||
|
55 |
Cissia pseudoconfusa Singer, DeVries & P. Ehrlich, 1983 |
Mar |
|
56 |
Cyllopsis hedemanni hedemanni R. Felder, 1869 |
Mar, Ago, Oct |
|
57 |
Cyllopsis pephredo (Godman, 1901) |
Sep |
|
58 |
Hermeuptychia hermes (Fabricius, 1775) F, ** |
Ene, Mar, Abr, May, Jun, Jul, Ago, Sep, Oct, Nov, Dic |
|
59 |
Oxeoschistus tauropolis tauropolis (Westwood, [1850]) |
Mar, Oct, Nov, Dic |
|
60 |
Manataria maculata maculata (Hopffer, 1874) |
May |
|
Hesperiidae |
||
|
61 |
Hesperiidae sp.1*** |
May |
|
Eudaminae |
||
|
62 |
Astraptes anaphus annetta Evans, 1952 F |
Feb, Mar, Abr, Jun, Jul, Sep, Oct, Nov, Dic |
|
63 |
Astraptes fulgerator azul (Reakirt, [1867]) |
Nov |
|
64 |
Autochton bipunctatus (Gmelin, [1790]) F |
Mar, Abr, Oct, Dic |
|
(64) |
Autochton sp. F |
Feb, Mar, May, Jun, Oct, Nov |
|
65 |
Cabares potrillo potrillo (Lucas, 1857) |
May, Jun, Jul, Oct |
|
66 |
Epargyreus exadeus cruza Evans, 1952 |
Ago |
|
(66) |
Epargyreus sp. F |
Mar |
|
67 |
Spathilepia clonius (Cramer, 1775) |
Jun |
|
68 |
Urbanus alva Evans, 1952 F |
Nov |
|
69 |
Urbanus esmeraldus (A. Butler, 1877) |
Nov |
|
70 |
Urbanus procne (Plötz, 1881) |
Ene |
|
71 |
Urbanus proteus proteus (Linnaeus, 1758) |
Jul, Dic |
|
72 |
Urbanus teleus (Hübner, 1821) F |
Jul |
|
73 |
Urbanus viterboana (Ehrmann, 1907) |
Jun, Jul, Oct, Nov, Dic |
|
(68-73) |
Urbanus spp. F, * |
Oct, Nov |
|
Pyrginae |
||
|
74 |
Antigonus corrosus Mabille, 1878 F |
Abr, Jun |
|
(74) |
Antigonus sp. |
Jul |
|
75 |
Bolla brennus brennus (Godman & Salvin, 1896) |
Mar |
|
76 |
Bolla eusebius (Plötz, 1884) |
May, Jul, Oct |
|
77 |
Bolla subapicatus (Schaus, 1902) |
Jul, Oct |
|
(75-77) |
Bolla sp. F, * |
Jul |
|
78 |
Carrhenes callipetes Godman & Salvin, 1895 |
Ene, Mar, Sep, Oct, Nov, Dic |
|
(78) |
Carrhenes sp. |
Feb, Mar |
|
79 |
Celaenorrhinus stola Evans, 1952 F |
Ene, Feb, Sep, Nov, Dic |
|
Apéndice. Continúa |
||
|
80 |
Gorgythion vox Evans, 1953 F |
Ene, Feb, Jul, Oct, Dic |
|
81 |
Heliopetes alana (Reakirt, 1868) F |
Feb, Mar, Jul, Nov |
|
82 |
Nisoniades ephora (Herrich-Schäffer, 1870) |
Ene, Oct, Dic |
|
83 |
Noctuana lactifera bipuncta (Plötz, 1884) |
Feb |
|
84 |
Noctuana stator (Godman & Salvin, 1899) |
Mar, May |
|
85 |
Pyrgus oileus (Linnaeus, 1767) |
Mar, Abr, Dic |
|
(85) |
Pyrgus sp. |
Feb, Mar, May Jun, Jul, Ago, Oct |
|
86 |
Quadrus lugubris lugubris (R. Felder, 1869) F |
Ene, Jul |
|
87 |
Staphylus ascalaphus (Staudinger, 1876) |
Feb, May, Jun, Jul, Oct |
|
88 |
Staphylus vincula (Plötz, 1886) |
May |
|
89 |
Staphylus vulgata (Möschler, 1879) |
Feb |
|
(87-89) |
Staphylus sp. |
May |
|
90 |
Xenophanes tryxus (Stoll, 1780) |
Mar |
|
91 |
Zera tetrastigma tetrastigma (Sepp, [1847]) |
Sep |
|
Hesperiinae |
||
|
92 |
Conga chydaea (A. Butler, 1877) |
Jul, Oct |
|
93 |
Cymaenes tripunctus theogenis (Capronnier, 1874) |
Jul, Oct |
|
94 |
Cynea cynea (Hewitson, 1876) |
Ago |
|
95 |
Lerema lumina (Herrich-Schäffer, 1869) |
Feb, Mar, Dic |
|
96 |
Orthos lycortas (Godman, 1900) |
Ene, Mar |
|
97 |
Papias dictys Godman, 1900 |
Jun, Sep |
|
98 |
Papias subcostulata (Herrich-Schäffer, 1870) |
Ago, Oct, Nov |
|
99 |
Poanes inimica (A. Butler & H. Druce, 1872) |
Mar |
|
100 |
Poanes melane poa (Evans, 1955) |
May |
|
101 |
Pompeius pompeius (Latreille, [1824]) |
Mar, Jun |
|
102 |
Remella duena (Evans, 1955) |
Mar, Oct |
|
103 |
Remella vopiscus (Herrich-Schäffer, 1869) F |
Sep, Nov |
|
(102, 103) |
Remella spp. F |
Ene, Feb, Mar, Abr, May, Jun, Jul, Ago, Sep, Oct, Dic |
|
104 |
Saturnus reticulata obscurus (E. Bell, 1941) |
Feb, Mar |
|
105 |
Synapte salenus salenus (Mabille, 1883) |
Abr, May |
|
106 |
Vettius fantasos (Cramer, 1780) F |
Nov |
|
107 |
Vettius onaca Evans, 1955 F |
May, Jun, Ago, Oct, Nov, Dic |
|
108 |
Hesperiinae sp.1*** |
Oct |
|
109 |
Hesperiinae sp.2*** |
Dic |
* Excluidos de todos los análisis (Chao II, NMDS y fenología), pues es probable que fueran de una de las especies ya determinadas de cada género en el monitoreo mensual.
** El nombre de la especie podría cambiar, porque “hermes” debería aplicarse a las especies de América del Sur (Cong y Grishin, 2014). Y sería posible que los individuos muestreados en el parque Cayalá incluyeran múltiples especies.
*** No se han podido identificar hasta especie, pero se confirmó que son diferentes a las otras especies determinadas de Hesperiidae basado en la revisión de los genitales.
Referencias
Arellano-Covarrubias, A., Trujano-Ortega, M., Luis-Martínez, A., Luna-Reyes, M. y Llorente-Bousquets, J. (2019). Geographical distribution of Lasaia Bates, 1868 (Lepidoptera: Riodinidae) across the biogeographical provinces of Mexico. Zootaxa, 4656, 243–273. https://doi.org/10.11646/zootaxa.4656.2.3
Austin, G. T., Haddad, N. M., Méndez, C., Sisk, T. D., Murphy, D. D., Launer, A. E. et al. (1996). Annotated checklist of the butterflies of the Tikal National Park area of Guatemala. Tropical Lepidoptera, 7, 21–37.
Austin, G. T., Méndez, C. y Launer, A. E. (1998). A preliminary checklist of Guatemala butterflies: Hesperiidae (Lepidoptera: Hesperioidea). Tropical Lepidoptera, 9 (Suppl. 2), 8–19.
Balam-Ballote, Y. y León-Cortés, J. L. (2010). Forest management and biodiversity: a study of an indicator insect group in Southern Mexico. Interciencia, 35, 526–533.
Barrios, M. V., Méndez, C. A. y Austin, G. T. (2006). Las Hesperiidae (Lepidoptera: Hesperioidea) de Guatemala. En E. B. Cano (Ed.), Biodiversidad de Guatemala. Vol. I (pp. 431–439). Guatemala: Universidad del Valle de Guatemala.
Bergerot, B., Fontaine, B., Julliard, R. y Baguette, M. (2010). Landscape variables impact the structure and composition of butterfly assemblages along an urbanization gradient. Landscape Ecology, 26, 83–94. https://doi.org/10.1007/s10980-010-9537-3
Brown, K. S. y Freitas, A. V. L. (2002). Butterfly communities of urban forest fragments in Campinas, São Paulo, Brazil: structure, instability, environmental correlates, and conservation. Journal of Insect Conservation, 6, 217–231. https://doi.org/10.1023/A:1024462523826
Cano, E. B. (2006). Biodiversidad de Guatemala. Vol. I. Guatemala: Universidad del Valle de Guatemala.
Chao, A., Chazdon, R. L., Colwell, R. K. y Shen, T. J. (2005). A new statistical approach for assessing similarity of species composition with incidence and abundance data. Ecology Letters, 8, 148–159. https://doi.org/10.1111/j.1461-0248.2004.00707.x
Cong, Q. y Grishin, N. V. (2014). A new Hermeuptychia (Lepidoptera, Nymphalidae, Satyrinae) is sympatric and synchronic with H. sosybius in southeast US coastal plains, while another new Hermeuptychia species -not hermes– inhabits south Texas and northeast Mexico. Zookeys, 379, 43–91. https://doi.org/10.3897/zookeys.379.6394
Cruz, J. R. (1982). Clasificación de zonas de vida de Guatemala a nivel de reconocimiento. Guatemala: Ministerio de Agricultura, Ganadería y Alimentación/ Sector Público Agropecuario y de Alimentación/ Instituto Nacional Forestal/ Unidad de Evaluación y Promoción/, Dirección General de Servicios Agrícolas.
Dennis, R. L. H., Dapporto, L., Dover, J. W. y Shreeve, T. G. (2013). Corridors and barriers in biodiversity conservation: a novel resource-based habitat perspective for butterflies. Biodiversity and Conservation, 22, 2709–2734. https://doi.org/10.1007/s10531-013-0540-2
FAO (Organización de las Naciones Unidas de la Alimentación y la Agricultura). (2010). Evaluación de los recursos forestales mundiales: Informe Nacional Guatemala. FRA2010/084, Roma.
Gotelli, N. J. y Colwell, R. K. (2011). Estimating species richness. En A. E. Magurran y B. J. McGill (Eds.), Biological diversity: frontiers in measurement and assessment (pp. 39–54). Oxford, RU: Oxford University Press.
Haddad, N. M. (1999). Corridor and distance effects on interpatch movements: a landscape experiment with butterflies. Ecological Applications, 9, 612–622. https://doi.org/10.1890/1051-0761(1999)009[0612:CADEOI]2.0.CO;2
Ixcot, L. C., Acevedo, M. E., Barrios, M. V., Cano, E. B., Castillo, N. A., Enríquez, H. et al. (2007). Diversidad biológica en el departamento de Guatemala. Informe final Proyecto FODECYT 29-2006. Guatemala: Consejo Nacional de Ciencia y Tecnología/ Secretaría Nacional de Ciencia y Tecnología/ Fondo Nacional de Ciencia y Tecnología/ Universidad de San Carlos de Guatemala/ Facultad de Ciencias Químicas y Farmacia, Centro de Estudios Conservacionistas.
Kitahara M. y Sei, K. (2001). A comparison of the diversity and structure of butterfly communities in semi-natural and human-modified grassland habitats at the foot of Mt. Fuji, central Japan. Biodiversity and Conservation, 10, 331–351. https://doi.org/10.1023/A:1016666813655
Kremen, C. (1992). Assessing the indicator properties of species assemblages for natural areas monitoring. Ecological applications, 2, 203–217. https://doi.org/10.2307/1941776
Kremen, C., Colwell, R. K., Erwin, T. L., Murphy, D. D., Noss, R. F. y Sanjayan, M. A. (1993). Terrestrial arthropod assemblages: their use in conservation planning. Conservation Biology, 7, 796–808.
Llorente-Bousquets, J., Vargas-Fernández, I., Luis-Martínez, A., Trujano-Ortega, M., Hernández-Mejía, B. C. y Warren, A. D. (2014). Biodiversidad de Lepidoptera en México. Revista Mexicana de Biodiversidad, 85 (Supl.), 353–371. https://doi.org/10.7550/rmb.31830
Luis-Martínez, A., Hernández-Mejía, B., Trujano-Ortega, M., Warren, A., Salinas-Gutiérrez, J. L., Ávalos-Hernández, O. et al. (2016). Avances faunísticos en los Papilionoidea sensu lato (Insecta: Lepidoptera) de Oaxaca, México. Southwestern Entomologist, 41, 171–224.
Luis-Martínez, M. A., Llorente-Bousquets, J., Warren, A. D. y Vargas-Fernández, I. (2004). Lepidópteros: Papilionoideos y Hesperioideos. En A. J. García-Mendoza, M. J. Ordóñez y M. Briones-Salas (Eds.), Biodiversidad de Oaxaca (pp. 335–355). México D.F.: Instituto de Biología, UNAM/ Fondo Oaxaqueño para la Conservación de la Naturaleza/ WWF.
Luis-Martínez, M. A., Salinas-Gutiérrez, J. L. y Llorente-Bousquets, J. (2011). Papilionoidea y Hesperioidea (Lepidoptera: Rhopalocera). En F. Álvarez (Ed.), Chiapas: estudios sobre su diversidad biológica (pp. 363–391). México D.F.: Instituto de Biología, UNAM.
Maza, J., White-López, A. y Maza, R. G. (1991). La fauna de mariposas de México. Parte II. Hesperioidea (Lepidoptera: Rhopalocera). Revista de la Sociedad Mexicana de Lepidopterología, 14, 3–44.
Maza., R. G., Maza, J. y White-López, A. (1989). La fauna de mariposas de México. Parte I. Papilionoidea (Lepidoptera: Rhopalocera). Revista de la Sociedad Mexicana de Lepidopterología, 12, 39–98.
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinnet D. et al. (2019). Vegan: Community Ecology Package. Version 2.5-4. R Foundation for Statistical Computing, Vienna, Austria.
R Development Core Team. (2019). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria.
Ramírez-Restrepo, L. y MacGregor-Fors, I. (2017). Butterflies in the city: a review of urban diurnal Lepidoptera. Urban Ecosystems, 20, 171–182. https://doi.org/10.1007/s11252-
016-0579-4
Salinas-Gutiérrez, J. L. (2013). Registros nuevos y aclaratorios de ninfálidos (Papilionoidea: Nymphalidae) para Guatemala. Acta Zoológica Mexicana, 29, 431–436.
Salinas-Gutiérrez, J. L., Llorente-Bousquets, J., Méndez, C., Barrios, M. y Pozo, C. (2012). Introducción a los Papilionoidea (Papilionidae, Pieridae, Lycaenidae, Riodinidae y Nymphalidae) de Guatemala. En E. B. Cano y J. C. Schuster (Eds.), Biodiversidad de Guatemala. Vol. II (pp. 155–173). Guatemala: Universidad del Valle de Guatemala.
Salinas-Gutiérrez, J. L., Méndez, C., Barrios, M., Pozo, C. y Llorente-Bousquets, J. (2009). Hacia una síntesis de los Papilionoidea (Insecta: Lepidoptera) de Guatemala con una breve reseña histórica. Caldasia, 31, 407–440.
Sánchez-Jasso, J. M., Estrada-Álvarez, J. C., Medina, J. P. y Estrada-Álvarez, B. Y. (2019). Diversidad de mariposas diurnas (Lepidoptera: Papilionoidea y Hesperioidea) en el paisaje urbano del municipio de Metepec, Estado de México, México. Revista Mexicana de Biodiversidad, 90, 1–12. https://doi.org/10.22201/ib.20078706e.2019.90.2659
van Nieukerken, E. J., Kaila, L., Kitching, I. J., Kristensen, N. P., Lees, D. C., Minet, J., Mitter, C. et al. (2011). Order Lepidoptera Linnaeus, 1758. En Z. Q. Zhang (Ed.), Animal biodiversity: an outline of higher-level classification and survey of taxonomic richness. Zootaxa, 3148, 212–221. https://doi.org/10.11646/zootaxa.3148.1.41
Warren, A. D., Davis, K. J., Stangeland, E. M., Pelham, J. P. y Grishin, N. V. (2017). Illustrated lists of American butterflies (North and South America). Recuperado el 21 noviembre 2017, de: http://www.butterfliesofamerica.com/
Yoshimoto, J., Salinas-Gutiérrez, J. L. y Barrios, M. (2018). Annotated list of butterflies (Lepidoptera: Papilionoidea) of a Guatemalan dry forest, with two first records for Guatemala. Tropical Lepidoptera Research, 28, 1–8. https://doi.org/10.5281/zenodo.1248159
Yoshimoto, J., Salinas-Gutiérrez, J. L. y Barrios, M. (2019). Butterfly fauna and phenology in a dry forest of the Motagua Valley, Guatemala. Journal of the Lepidopterists’ Society, 73, 191–202. https://doi.org/10.18473/lepi.73i3.a8