Los microcosmos de Prosopis laevigata albergan una alta diversidad florística en el valle de Zapotitlán, Puebla
Luis Alberto Bernal-Ramírez a, b, José Alejandro Zavala-Hurtado b, *, Monserrat Jiménez a, b, Zenón Cano-Santana c y Juan Fornoni d
a Doctorado en Ciencias Biológicas y de la Salud, Universidad Autónoma Metropolitana-Iztapalapa, Apartado postal 55535, 09340 Ciudad de México, México
b Departamento de Biología, Universidad Autónoma Metropolitana-Iztapalapa, Apartado postal 55535, 09340 Ciudad de México, México
c Laboratorio de Interacciones y Procesos Ecológicos, Departamento de Ecología y Recursos Naturales, Facultad de Ciencias, Universidad Nacional Autónoma de México, Circuito Exterior s/n, Ciudad Universitaria, 04510 Ciudad de México, México
d Laboratorio de Interacción Planta-Animal, Departamento de Ecología Evolutiva, Instituto de Ecología, Universidad Nacional Autónoma de México, Apartado postal 70-275, 04510 Ciudad de México, México
*Autor para correspondencia: jazh@xanum.uam.mx (J.A. Zavala-Hurtado)
Resumen
En ambientes xéricos, la presencia de árboles o arbustos, generalmente leguminosas, promueve la existencia de parches con mayores concentraciones de recursos, como los nutrientes liberados por la descomposición de la hojarasca, y un microambiente particular que favorece el incremento de la diversidad vegetal. Este trabajo contribuye tanto al reconocimiento de la flora de los microcosmos del mezquite Prosopis laevigata, como a la relación existente entre la riqueza, diversidad y abundancia de estas plantas, con la estructura arbórea del valle de Tehuacán-Cuicatlán. Se marcaron 70 árboles, se calculó el área de sus copas y se realizó un reconocimiento taxonómico de la flora presente bajo éstas durante las temporadas de lluvias y secas. Se encontraron 76 y 62 especies en lluvias y secas, respectivamente. En ambas estaciones, Asteraceae, Cactaceae y Leguminosae registraron la mayor riqueza específica. Mientras que el número de individuos difirió entre estaciones. La cobertura y altura de los mezquites tienen influencia directa sobre la riqueza y diversidad de especies protegidas, lo que concuerda con la idea generalizada de que la disminución de la incidencia solar es un factor importante en el proceso de facilitación. Estos resultados refuerzan la hipótesis de que las leguminosas son plantas facilitadoras, con un papel crucial en la conservación de los recursos vegetales.
Palabras clave:
Facilitación; Riqueza de especies; Nodriza; Arquitectura arbórea; Estacionalidad
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Microcosmos of Prosopis laevigata harbor a high floristic diversity in the Zapotitlan Valley, Puebla
Abstract
The presence of trees or shrubs, usually legumes, in xeric environments, promotes the existence of patches with higher concentrations of resources, such as nutrients released from litter decomposition, and favorable microenvironments that support higher plant diversity. This work contributes to the recognition of microcosmos flora of Prosopis laevigata. Also, species diversity/richness-tree structure relationships in Tehuacán-Cuicatlán Valley are reported. Seventy trees were labeled, and their canopies’ areas were measured. Finally, we made a taxonomic recognition of vegetation under the canopies in the rainy and dry seasons. We found 76 and 62 plant species in rainy and dry seasons respectively. Asteraceae, Cactaceae, and Leguminosae were the families with more plant species at both seasons. Nevertheless, the number of individuals differs among seasons. Canopy cover and height of trees had a direct influence on richness of protected species and diversity. This is consistent with the general hypothesis that shadow is an important factor for the establishment of species under canopies in the facilitation process. Our results support the widespread hypothesis that show the legumes as nurse plants; as well as their crucial and potential role for plant resources conservation in arid and semiarid environments.
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Facilitation; Species richness; Nurse plant; Tree architecture; Seasonality
Introducción
Las regiones áridas y semiáridas se distinguen por distribuirse en zonas con baja disponibilidad de agua, oscilaciones térmicas diurnas elevadas y generalmente, presencia de suelos salinos (González-Medrano, 2003; Granados et al., 2012; Rzedowski, 1978). La combinación de estas variables ambientales, la marcada estacionalidad y los factores topográficos locales pueden favorecer la heterogeneidad ambiental. Asimismo, al interior de estas regiones áridas, la variación espacio-temporal de las condiciones abióticas influye en la distribución y abundancia de las plantas, ya que repercuten en el establecimiento, desarrollo, supervivencia y reproducción de los individuos (Rivas-Arancibia et al., 2006; Ruiz et al., 2008). Una consecuencia del dinamismo y heterogeneidad espacio-temporal es la existencia de parches con vegetación que se alternan con áreas semidesnudas lo que conforma un paisaje tipo mosaico (Montaña, 1992). Estos parches se producen en pendientes suaves, como resultado de la redistribución del agua de lluvia a través del flujo de escorrentía que transporta materia orgánica, sedimentos y nutrimentos disueltos (Montaña, 1992; Tongway et al., 2004). Los individuos de especies leñosas que se establecen en ciertos micro-hábitats favorecen la heterogeneidad, pues generan condiciones microambientales con mayores concentraciones de recursos, por lo que se les conoce como plantas nodrizas. Este tipo de plantas modifican los regímenes de radiación, humedad y temperatura, así como las características edáficas, en gran medida por la deposición de hojarasca y la sombra de su copa (Camargo-Ricalde et al., 2010; García-Sánchez et al., 2012; Perroni-Ventura et al., 2006; Valiente-Banuet y Verdú, 2007). Dentro de las grandes regiones áridas, estos sitios representan islas de recursos (Perroni-Ventura, 2007), donde las plantas nodrizas facilitan el establecimiento de otros organismos (i.e., especies protegidas) bajo su dosel.
En general, las islas de recursos están conformadas por especies de leguminosas que incrementan la fertilidad del suelo y la humedad, mientras que disminuyen la radiación solar y la temperatura (Camargo-Ricalde et al., 2010; Frías-Hernández et al., 1999; García-Sánchez et al., 2012; Moro et al., 1997; Perroni-Ventura et al., 2006; Ruiz et al., 2008). Lo anterior, genera un microambiente que promueve el establecimiento de individuos de otras especies a través de procesos estabilizadores de facilitación y complementariedad (Allan et al., 2013; Brooker et al., 2008; Cavieres y Badano, 2009; Valiente-Banuet y Verdú, 2007). Por lo tanto, el microambiente formado por la isla de recursos y la subsecuente dinámica de las comunidades de especies protegidas puede verse como un ecosistema natural con dimensiones espaciales pequeñas, es decir, un “microcosmos” (Srivastava et al., 2004). Se conoce que en los ambientes xéricos, la presencia de estos microcosmos naturales (i.e., parches, islas de recursos o plantas nodrizas) favorecen el incremento de la diversidad vegetal (García-Sánchez et al., 2012; Perroni-Ventura et al., 2006; Pugnaire et al., 1996; Tewksbury y Lloyd, 2001), tanto en especies anuales como perennes. Además, representan elementos centrales para la conservación de la biodiversidad. Sin embargo, son escasos los estudios sobre la dinámica de comunidades vegetales establecidas bajo la copa de plantas nodrizas que comprendan una cabal relación taxonómica de las especies que las componen.
Este estudio pretende contribuir al reconocimiento e identidad de la flora existente al interior de los microcosmos formados por el mezquite Prosopis laevigata (Humb. et Bonpl. ex Willd.) M.C. Johnst., en el Valle de Zapotitlán, Puebla. Además, se analiza la relación de la riqueza y la diversidad de especies vegetales protegidas con las particularidades de la arquitectura arbórea (v.gr., cobertura, altura, ramificación) y su variación entre estaciones climáticas (lluvias y secas).
Materiales y métodos
El valle de Zapotitlán se localiza entre los 18°11’-18°25’ N, 97°39’-97°22’ O; a 1,450 m snm, dentro del área de conservación del Jardín Botánico “Helia Bravo Hollis”, en la Reserva de la Biosfera Tehuacán-Cuicatlán (RBTC), Puebla. El clima es cálido y semiárido con lluvias en verano (García, 2004), la estación seca se extiende de octubre a mayo; mientras que de junio a septiembre llueve, presentándose una canícula a mitad del período. La precipitación promedio anual es de 380 – 400 mm y la temperatura media anual varía de 18 a 22 °C (Zavala-Hurtado et al., 1996). Según Rzedowski (1978), la vegetación está comprendida en un matorral xerófilo. En el estrato arbóreo destacan Parkinsonia praecox y Prosopis laevigata, presentándose en menor medida, diversas especies de los géneros Acacia, Bursera y Mimosa; además de las cactáceas columnares Lemaireocereus hollianus, Myrtillocactus geometrizans y Neobuxbaumia tetetzo. El estrato inferior está muy diversificado, se encuentran especies arbustivas como: Castela tortuosa, Cordia curassavica, Dalea carthagenensis, Echinopterys eglandulosa, Ruellia hirsutoglandulosa y Viguiera dentata. También existe una gran variedad de suculentas de los géneros Agave, Ferocactus, Mammillaria y Opuntia. Finalmente, en el estrato más bajo abundan Aegopogon cenchroides, Evolvulus alsinoides, Portulaca pilosa, Sanvitalia fruticosa y Sporobolus pyramidatus.
El mezquite, Prosopis laevigata, crece como arbusto o árbol de 3 a 9 m de altura con hojas compuestas y ramas con espinas pareadas. Presenta flores amarillentas en racimos que producen de 1 a 6 legumbres cada uno (Grether et al., 2006). Se distribuye en zonas áridas y semiáridas del centro de México. Bajo su dosel, la fertilidad del suelo (determinada por la disponibilidad de nutrimentos y la presencia de hongos micorrizógenos arbusculares) y la humedad muestran valores más altos en comparación con las áreas abiertas, mientras que la incidencia de radiación solar directa y la temperatura son más bajas (García-Sánchez et al., 2012; Muro-Pérez et al., 2014; Perroni-Ventura et al., 2006; Ruiz et al., 2008). Estas condiciones microambientales facilitan el establecimiento de distintas especies de plantas y animales. Así, al conjunto formado por este hábitat y las poblaciones de organismos que allí coexisten se le reconoce en el presente estudio como microcosmos.
Caracterización de los microcosmos. Se georreferenciaron y etiquetaron 70 mezquites de entre 1.0 y 4.0 m de altura (3.5 – 32 m2 de cobertura), durante junio de 2016. La arquitectura arbórea fue caracterizada considerando: i) cobertura, calculada como el área comprendida dentro de una elipse en relación con el diámetro mayor y diámetro menor de la copa; ii) altura máxima; iii) altura a la primera rama desde el suelo y iv) número de ramificaciones del tallo desde la base.
Para conocer la composición, diversidad y abundancia de la vegetación se realizó un reconocimiento florístico bajo la cobertura de los 70 mezquites. Durante las estaciones seca (febrero) y de lluvias (septiembre), se registró la identidad y el número de individuos de todas las plantas presentes bajo la cobertura de cada uno de los árboles. La determinación taxonómica de las especies se hizo directamente en el campo, con apoyo de guías de campo y listados florísticos de la RBTC (Dávila et al., 1993; Weller, 2010a, b). La nomenclatura de las especies reportadas, así como sus respectivos autores fueron cotejados en las bases de datos del Real Jardín Botánico de Kew (The Plant List, 2013) y del Jardín Botánico de Missouri (Tropicos.org, 2018).
A partir del reconocimiento florístico realizado en campo, se estimó la riqueza como el número de especies de plantas encontradas para cada estación en los 70 microcosmos; la abundancia de especies se determinó como el número de individuos de cada especie presentes en los mismos. La riqueza de Chao 1 y la diversidad Shannon-Wiener (usando logaritmos naturales), fueron calculadas mediante el programa PAST 3.11 (Hammer et al., 2001). Las curvas de rarefacción del número de especies acumuladas en función del número de individuos acumulados registrados para cada estación, se estimaron utilizando el programa EstimateS (Colwell, 2013).
Arquitectura arbórea y sus relaciones con la riqueza, diversidad y abundancia. Para evaluar las diferencias en la riqueza, diversidad y abundancia de especies entre estaciones se utilizó un análisis de varianza univariado (Andeva). Las relaciones entre los rasgos de la arquitectura, el número de individuos, la riqueza y diversidad de especies se analizaron a través de una matriz de correlación de Pearson. En caso necesario, se realizaron transformaciones logarítmicas (log10 [x + 1]) para ajustar los valores de los datos a una distribución normal (Zar, 1999).
Para analizar la relación entre las especies protegidas y el área de cobertura de los árboles, se empleó la función potencial de Arrhenius (1921) en su forma lineal (Dengler, 2009): log10 S = log10 c + z log10 A; donde S es el número de especies protegidas, A es el área de la cobertura, c es el intercepto y z es la pendiente, que representa la tasa de acumulación de riqueza florística de los microcosmos (Fattorini et al., 2017; López-Gómez y Cano-Santana, 2010). Se usó el mismo tipo de modelo lineal para analizar la relación entre la abundancia y diversidad de especies y el área de la cobertura de los mezquites.
Todos los análisis estadísticos fueron elaborados para cada estación (secas y lluvias) con el paquete estadístico JMP software® (SAS Institute, 2010), con un nivel de significancia de 0.05.
Resultados
Los atributos comunitarios de riqueza de especies (F1.138 = 8.98, R2 = 0.061, p = 0.003), riqueza de Chao 1 (F1.138 = 4.3, R2 = 0.030, p = 0.040) y el número total de individuos (F1.138 = 30.18, R2 = 0.179, p < 0.001) mostraron diferencias significativas entre estaciones, siendo mayores durante la estación de lluvias (fig. 1). En la estación seca, se registraron 3,267 individuos, mientras que en lluvias se encontraron 7,338 en los 70 microcosmos. Asimismo, la riqueza de especies en la estación seca fue de 62 especies, mientras que en lluvias se registraron 76. El número de individuos registrados se relacionó con la riqueza de especies y la curva de rarefacción obtenida en la estación seca fue más corta que la de lluvias (fig. 2).
A nivel florístico, las 62 especies registradas en la estación seca se agrupan en 54 géneros y 26 familias, mientras que de las 76 especies encontradas en lluvias se agruparon en 67 géneros y 29 familias. En la tabla 1 se detallan las abundancias absolutas a nivel de familia. Entre los géneros mejor representados en ambas estaciones destacan Agave, con 4 especies, seguido de Mammillaria, con 3. Los demás géneros están representados por 1 o 2 especies. Durante la estación seca, 92% de las especies registradas son perennes. La especie Mammillaria carnea tuvo la mayor abundancia relativa (0.394) con 1,288 individuos y fue la más común con 2 o más individuos en 68 microcosmos registrados. En contraste, en la estación de lluvias, el porcentaje total de especies perennes se redujo 88% y Flaveria ramosissima fue la especie más abundante con 3,073 individuos, que representó 42% del total. Además, se observó un endemismo elevado con 42.1% (32 especies) cuya distribución geográfica se encuentra limitada solo en México y 21% (16 especies exclusivas) de la RBTC (apéndice).
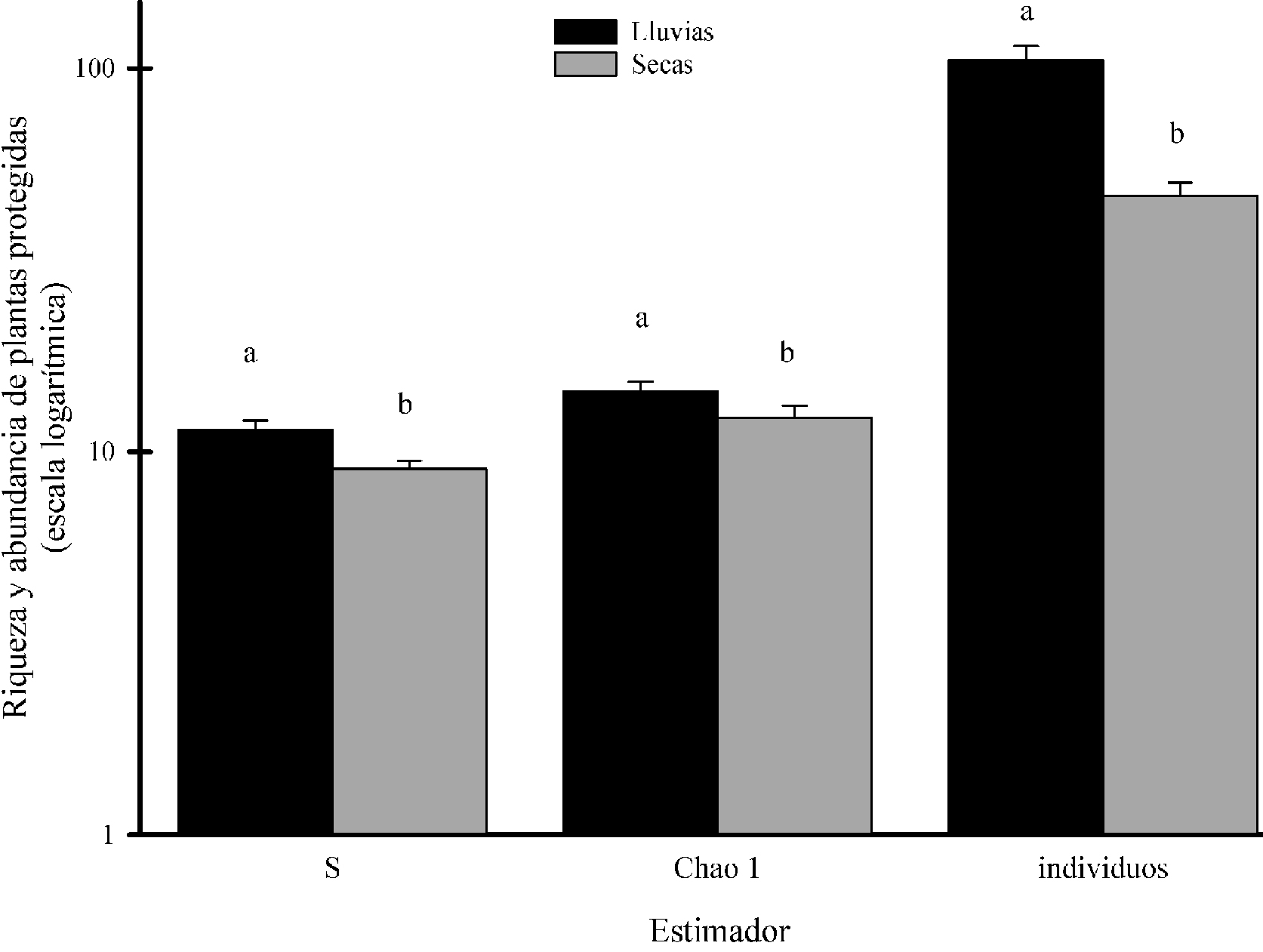
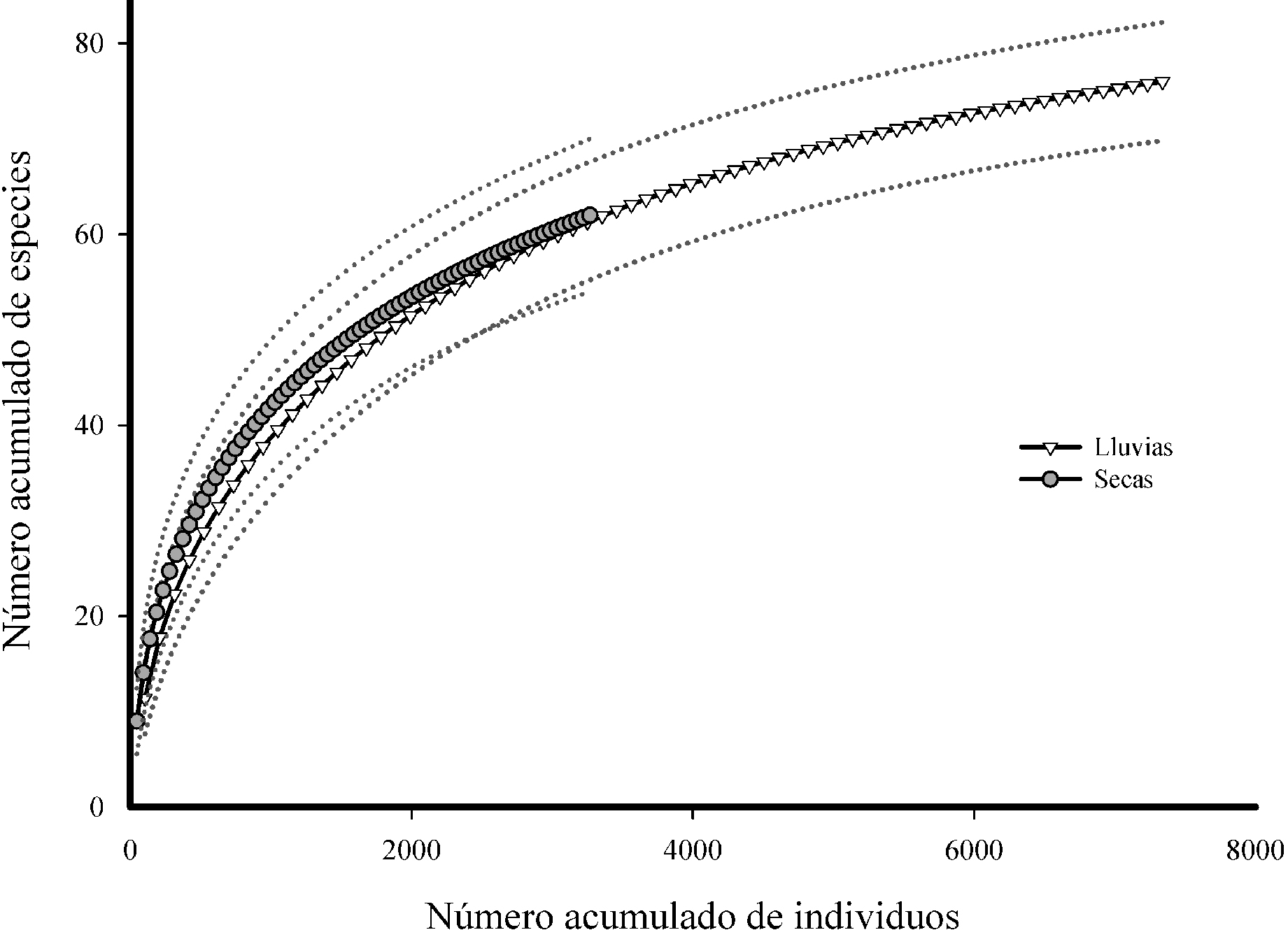
Tabla 1
Número de géneros, especies e individuos por familia de plantas registradas en los microcosmos bajo la copa de Prosopis laevigata en Zapotitlán Salinas, Puebla.
|
Tabla 1 Continuación. |
||||||
|
Familia |
Núm. géneros |
Núm. especies |
Núm. individuos |
|||
|
Secas |
Lluvias |
Secas |
Lluvias |
Secas |
Lluvias |
|
|
Familia |
Núm. géneros |
Núm. especies |
Núm. individuos |
|||
|
Secas |
Lluvias |
Secas |
Lluvias |
Secas |
Lluvias |
|
|
Acanthaceae |
2 |
2 |
2 |
2 |
44 |
43 |
|
Amaranthaceae |
2 |
3 |
2 |
3 |
237 |
303 |
|
Anacampserotaceae |
1 |
1 |
1 |
1 |
21 |
29 |
|
Asparagaceae |
1 |
1 |
4 |
4 |
115 |
140 |
|
Asteraceae |
6 |
8 |
7 |
9 |
219 |
3,380 |
|
Boraginaceae |
2 |
2 |
2 |
2 |
10 |
18 |
|
Bromeliaceae |
1 |
1 |
1 |
1 |
9 |
15 |
|
Burseraceae |
0 |
1 |
0 |
1 |
0 |
1 |
|
Cactaceae |
9 |
10 |
13 |
14 |
1,831 |
2,207 |
|
Cannabaceae |
1 |
1 |
1 |
1 |
9 |
8 |
|
Convolvulaceae |
2 |
3 |
1 |
3 |
14 |
17 |
|
Crassulaceae |
1 |
1 |
2 |
1 |
11 |
7 |
|
Cucurbitaceae |
1 |
1 |
1 |
1 |
3 |
3 |
|
Euphorbiaceae |
1 |
2 |
1 |
3 |
1 |
123 |
|
Leguminosae |
7 |
7 |
7 |
7 |
61 |
122 |
|
Loasaceae |
1 |
1 |
1 |
1 |
1 |
7 |
|
Malpighiaceae |
1 |
1 |
1 |
1 |
7 |
28 |
|
Malvaceae |
2 |
3 |
2 |
3 |
19 |
29 |
|
Nyctaginaceae |
2 |
2 |
2 |
2 |
23 |
19 |
|
Orobanchaceae |
0 |
1 |
0 |
1 |
0 |
1 |
|
Poaceae |
3 |
4 |
3 |
4 |
511 |
580 |
|
Polemoniaceae |
1 |
1 |
1 |
1 |
2 |
15 |
|
Portulacaceae |
1 |
1 |
1 |
1 |
21 |
56 |
|
Sapindaceae |
1 |
1 |
1 |
1 |
3 |
5 |
|
Simaroubaceae |
1 |
1 |
1 |
1 |
81 |
140 |
|
Solanaceae |
1 |
3 |
1 |
3 |
2 |
18 |
|
Talinaceae |
1 |
1 |
1 |
1 |
4 |
5 |
|
Verbenaceae |
2 |
2 |
2 |
2 |
8 |
15 |
|
Vitaceae |
0 |
1 |
0 |
1 |
0 |
4 |
|
Total |
54 |
67 |
62 |
76 |
3,267 |
7,338 |
En los rasgos de la arquitectura arbórea se encontraron correlaciones positivas y significativas entre la cobertura y la altura (r = 0.648, p < 0.001); así como cada una de éstas con la altura a la primera rama (r = 0.273, p = 0.0223 y r = 0.393, p < 0.001, respectivamente). También hubo una correlación significativa entre la ramificación del tallo y la altura a la primera rama (r = 0.242, p = 0.044). En todos los casos, g.l. = 68.
La riqueza de especies y el número de individuos mostraron una correlación positiva con la cobertura y la altura de los árboles en ambas estaciones. Por otro lado, sólo durante la estación seca se correlacionaron la riqueza de Chao 1 con la cobertura y la altura de los árboles, y la diversidad de Shannon-Wiener con la altura (tabla 2). Ninguna de las demás correlaciones fue significativa.
Tabla 2
Parámetros estadísticos de la matriz de correlación entre los rasgos de la arquitectura arbórea con la riqueza, diversidad (H’) y abundancia de especies protegidas de los 70 microcosmos formados por individuos de Prosopis laevigata para las dos estaciones climáticas muestreadas (secas y lluvias). g.l. = 68.
|
X1 |
X2 |
r |
p |
||
|
Secas |
Lluvias |
Secas |
Lluvias |
||
|
Cobertura |
Número de individuos |
0.383 |
0.346 |
0.001 |
0.003 |
|
Cobertura |
Riqueza de especies (S) |
0.342 |
0.317 |
0.004 |
0.008 |
|
Cobertura |
Chao 1 |
0.269 |
0.222 |
0.024 |
0.064ns |
|
Altura |
Número de individuos |
0.379 |
0.347 |
0.001 |
0.003 |
|
Altura |
Riqueza de especies (S) |
0.390 |
0.364 |
0.001 |
0.002 |
|
Altura |
Índice de diversidad (H´) |
0.252 |
0.222 |
0.036 |
0.064ns |
|
Altura |
Chao 1 |
0.365 |
0.333 |
0.002 |
0.005 |
ns = no significativo
Los resultados revelaron correlaciones significativas entre el área de la cobertura y la riqueza de especies (tabla 3, fig. 3). También se encontró el mismo patrón entre la cobertura y la abundancia para ambas estaciones, mientras que la diversidad de Shannon-Wiener no mostró correlación en ninguna estación (tabla 3).
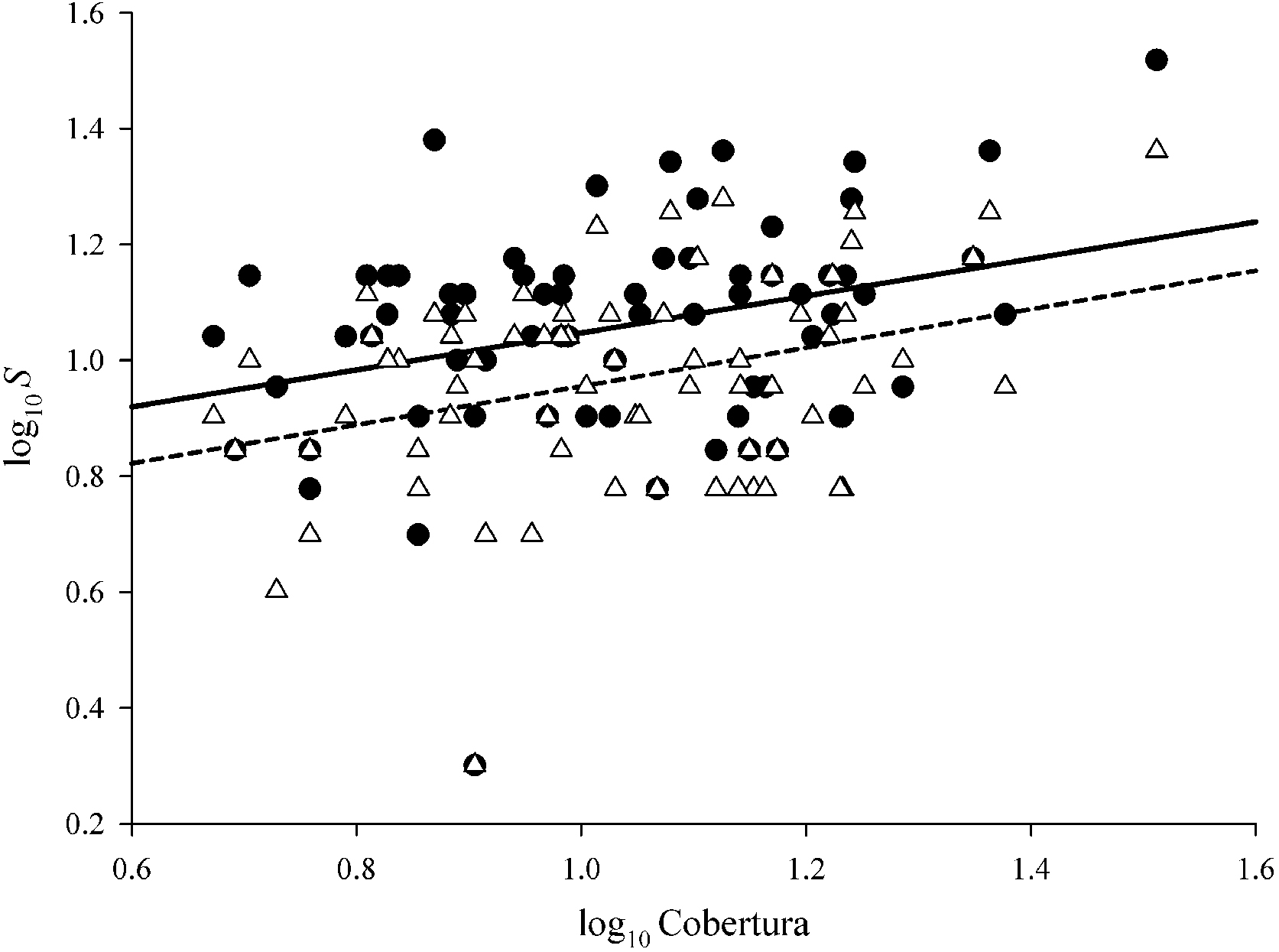
Tabla 3
Valores de las regresiones que explican el efecto del área de la cobertura (COB, en m2) de Prosopis laevigata sobre los atributos de las comunidades de plantas (Ab = abundancia; H´ = índice de diversidad Shannon-Wiener; S = riqueza de especies) que crecen bajo su copa. N = 70.
|
Atributo |
Modelo |
R2 |
P |
|||
|
Secas |
Lluvias |
Secas |
Lluvias |
Secas |
Lluvias |
|
|
log10 Ab |
= 0.915 + 0.650 log10 COB |
= 1.189 + 0.689 log10 COB |
0.146 |
0.119 |
0.001 |
0.003 |
|
H´ |
= 0.895 + 0.597 log10 COB |
= 0.882 + 0.643 log10 COB |
0.051 |
0.049 |
0.059ns |
0.063ns |
|
log10 S |
= 0.622 + 0.332 log10 COB |
= 0.728 + 0.319 log10 COB |
0.116 |
0.101 |
0.004 |
0.008 |
ns = no significativo
Discusión
Existen diferencias en la composición y abundancia de plantas protegidas entre las estaciones de secas y lluvias. Tal como era de esperarse, la estación seca mostró la menor abundancia, pero una mayor proporción de especies perennes. En contraste, en la estación lluviosa aumentó la riqueza de especies (10 perennes y 4 anuales) y la abundancia (principalmente de plantas anuales). Estos resultados son congruentes, ya que el establecimiento y desarrollo de las plantas anuales está influenciado por la gran variación estacional de precipitación, temperatura y sustrato (Bazzaz y Morse, 1991; Rivas-Arancibia, 2006). Sin embargo, estos mismos factores influyen en la germinación de especies perennes, por lo que, el aumento en la riqueza y diversidad durante la estación lluviosa está dado, al menos en parte, por la aparición de flora estacional (i.e., de especies anuales) y su interacción con las plantas perennes.
Durante la estación de lluvias se observa un aumento en la abundancia, diversidad y riqueza de especies protegidas, pero no se incrementa significativamente el número de familias (tabla 1). Este aumento se da principalmente dentro de las mismas familias presentes también en la estación seca (i.e., Asteraceae y Cactaceae). Asteraceae, Cactaceae, Leguminosae y Poaceae, fueron las cuatro familias con mayor cantidad de especies registradas y, en general, están cuantitativamente bien representadas dentro de las floras xéricas de México (Rzedowski, 1978). Probablemente, esto se debe a que los integrantes de estos taxa presentan múltiples formas de vida que les permiten utilizar de manera diferenciada los recursos (Zavala-Hurtado et al., 1996) y afrontar las fuertes restricciones que el ambiente impone (v.gr. aridez, salinidad edáfica, oscilaciones térmicas día-noche), por lo que muchas veces juegan un papel dominante en este tipo de vegetación (Rzedowski, 1978). Esta riqueza de especies y variedad de formas de vida puede explicarse porque los taxa de estas familias aparecieron y evolucionaron desde la era Cenozoica en lo que hoy es el valle de Tehuacán-Cuicatlán. Así, estudios sobre los registros palinológicos de las formaciones Mequitongo (hace 52-50 Ma; Ramírez-Arriaga et al., 2017) y Tehuacán (hace 25-15 Ma; Ramírez-Arriaga et al., 2014) documentaron el incremento en la diversidad florística del valle a lo largo del tiempo. Además, en este escenario evolutivo, los procesos de facilitación bajo la copa de plantas nodrizas habrían jugado un papel importante en la diversificación de la flora.
Los resultados de este estudio proveen información valiosa sobre la identidad taxonómica de las plantas que coexisten en los microcosmos formados por el mezquite Prosopis laevigata (ver apéndice). Las 76 especies vegetales encontradas en los microcosmos formados por árboles de mezquite, durante la estación de lluvias, representan 69% de la flora estimada dentro del área de conservación e influencia (ca. 500 ha) del Jardín Botánico “Helia Bravo Hollis”, en el valle de Zapotitlán (Zavala-Hurtado et al., datos sin publicar) y alrededor de 3% de las registradas en el valle de Tehuacán-Cuicatlán (Dávila et al., 2002). Asimismo, las 62 especies registradas en la estación seca representan también porcentajes relativamente altos de la flora del jardín botánico y del valle de Tehuacán-Cuicatlán (56.4 y 2.4%, respectivamente). En cuanto a los endemismos, 16 de las especies observadas solo se encuentran en el valle de Tehuacán-Cuicatlán, representando 4.4% de las angiospermas endémicas dentro de la RBTC (Dávila et al., 2002).
Tabla 4
Valores de riqueza de especies de plantas protegidas (S) bajo diferentes leguminosas nodrizas en diversas regiones áridas y semiáridas de México, España, Argentina y Bolivia.
|
Sitio |
Nodriza |
S |
Referencia |
|
Puebla, México |
Prosopis laevigata |
62-76 |
Este trabajo |
|
Almería, España |
Retama sphaerocarpa |
62 |
Pugnaire et al. (1996) |
|
La Prepuna, Argentina-Bolivia |
Caesalpinia trichocarpa, Prosopis ferox y Parkinsonia praecox |
49 |
López y Ortuño (2008) |
|
Puebla, México |
Parkinsonia praecox Prosopis laevigata |
43 44 |
Perroni-Ventura et al. (2006) |
|
Hidalgo, México |
Mimosa biuncifera Prosopis laevigata |
37 38 |
García-Sánchez et al. (2012) |
|
El Monte, Argentina |
Prosopis flexuosa |
34 |
Rossi y Villagra (2003) |
|
Guanajuato, México |
Prosopis laevigata |
30 |
Cruz-Rodríguez et al. (1997) |
|
Mecapaca, Bolivia |
Prosopis flexuosa |
21 |
Larrea-Alcázar et al. (2005) |
Aunque se reconoce ampliamente que la presencia de plantas nodrizas incrementa la diversidad vegetal (v.gr., García-Sánchez et al., 2012; López y Ortuño, 2008; Perroni-Ventura et al., 2006; Pugnaire et al., 1996; Valiente-Banuet, Bolongaro-Crevenna et al., 1991; Tewksbury y Lloyd, 2001), no existe un estudio previo que precise detalladamente la identidad taxonómica de las plantas establecidas bajo el dosel de las nodrizas. En general, los reportes publicados consideran conjuntamente a las especies que crecen directamente bajo las copas y las próximas a éstas. En consecuencia, tanto los 62 registros florísticos encontrados en secas como los 76 en lluvias, son mayores a los reportados por otros autores para otras leguminosas nodrizas (intervalo: 21-62 especies; tabla 4). Además, particularmente para la flora bajo la copa de P. laevigata, el número de registros florísticos hallados aquí supera a los 44 encontrados previamente en el valle de Zapotitlán, Puebla, al final de la estación lluviosa por Perroni-Ventura et al. (2006), así como los 39 taxones reportados en el valle del Mezquital, Hidalgo, durante la estación seca por García-Sánchez et al. (2012) y los 30 observados en El Cortijo, Guanajuato por Cruz-Rodríguez et al. (1997). Los datos obtenidos incrementan el registro de, al menos, 48 especies que no habían sido mencionadas previamente bajo la copa de los mezquites (apéndice). Sin embargo, al acotar la comparación solo al valle de Zapotitlán, de los 39 registros determinados a nivel de especie por Perroni-Ventura et al. (2006), únicamente 22 de éstos coinciden con los obtenidos en el presente trabajo, por lo que habría al menos 17 especies más habitando bajo la copa de mezquites en esta misma zona.
En la temporada de lluvias, 18.4% de las especies y 30% de los individuos pertenecen a la familia Cactaceae; mientras que en secas, son 19.4 y 56%, respectivamente. Estos datos concuerdan con la evidencia que establece a este taxón de plantas suculentas como el de mayor cantidad de especies que prosperan bajo protección de nodrizas en ecosistemas áridos (Flores y Jurado, 2003); además de que existen múltiples registros de la relación nodriza-cactáceas (v.gr., Larrea-Alcázar y Soriano, 2006; Mandujano et al., 2002; Muro-Pérez et al., 2012, 2014; Valiente-Banuet, Bolongaro-Crevenna et al., 1991; Valiente-Banuet, Vite et al., 1991). En este trabajo, Mammillaria carnea fue la especie más común, al estar presente en 97% de los microcosmos durante ambas estaciones. Según Mandujano et al. (2002), esto podría deberse a que esta especie requiere plantas nodriza para establecerse o bien, tiende a ocupar de manera selectiva parches de vegetación para asociarse con nodrizas (Rodríguez y Ezcurra, 2000). Sin embargo, este patrón parece diferir entre distintas regiones y aún entre poblaciones de la misma zona. En el valle de Zapotitlán, Puebla, los resultados reportados en este trabajo y los mencionados por Mandujano et al. (2002) muestran que P. laevigata es una de las nodrizas con mayor número de especies e individuos de cactáceas asociadas, particularmente M. carnea. En contraste, dentro de la misma zona, Rodríguez y Ezcurra (2000) reportan que las plantas de M. carnea no se distribuyen homogéneamente bajo las copas de diferentes especies de nodrizas, pues prefieren a Castela tortuosa sobre P. laevigata como nodriza. Martínez-Ramos (2016), por su parte, encontró que la condición en la que se encuentra M. carnea tiene efectos sobre su biología reproductiva, ya que los individuos sujetos a alta exposición lumínica y con tallas mayores son los que contribuyen considerablemente a la producción de estructuras reproductivas. En contraste, Golubov et al. (2010) no hallaron evidencias claras de la necesidad de una asociación de esta cactácea con nodrizas en la zona de Valerio Trujano, Oaxaca.
Existe la idea generalizada de que la sombra es un factor importante en el proceso de facilitación (Camargo-Ricalde et al., 2010; Flores y Jurado, 2003; García-Sánchez et al., 2012; Moro et al., 1997; Navarro-Cano et al., 2016; Perroni-Ventura et al., 2006; Valiente-Banuet y Verdú, 2007), pues ésta incrementa la supervivencia de las plántulas (Valiente-Banuet y Ezcurra, 1991), mientras que perecen al encontrarse expuestas aun cuando se les provea agua (Nobel, 1988). Esto explicaría, al menos parcialmente, porqué la mayoría de las plantas en zonas áridas no se distribuyen azarosamente a nivel espacial, sino que se concentran en islas de recursos, lo que concuerda con la alta diversidad florística que se encontró bajo el dosel de los mezquites en este trabajo. Además, es posible que las plantas cercanas a la periferia de las nodrizas sean influenciadas por las coberturas circundantes, aunque no se encuentren debajo del dosel, siempre y cuando exista una distancia pequeña entre la nodriza y las plantas adyacentes (Mandujano et al., 2002). En este sentido, Aguiar y Sala (1999) proponen que los espacios alrededor y debajo de leñosas pueden ser progresivamente colonizados por plantas asociadas hasta formar un parche de vegetación. De acuerdo con esta hipótesis, se encontró dentro de la flora bajo el dosel de P. laevigata a individuos de su misma especie y de otras especies de nodrizas (v.gr., Castela tortuosa, Mimosa luisana y Parkinsonia praecox), de modo que existiría un potencial para el desarrollo de parches de vegetación más amplios, pues una combinación de distintas especies de nodrizas incrementaría aún más la diversidad de plantas (García-Sánchez et al., 2012).
Por otra parte, se demostró que la talla de los mezquites, en términos de cobertura y altura, tiene influencia directa en la riqueza y diversidad de especies protegidas. Esto es consistente con las evidencias de la existencia de una relación entre el tamaño de un hábitat y la riqueza y diversidad de especies que éste alberga (Fattorini et al., 2017; López-Gómez y Cano-Santana, 2010; Matthews et al., 2014), lo que se atribuye al hecho de que al incrementar el tamaño de un hábitat, la heterogeneidad de éste aumenta en su interior, dando como resultado el incremento de distintos tipos de subparches (Begon et al., 2006). Sin embargo, en muchas de las relaciones especies-área, factores como: la heterogeneidad del hábitat, la dispersión, los efectos aleatorios y la distancia entre parches, pueden tener un papel importante en la influencia de los patrones de diversidad (Crist y Veech, 2006), por lo que es necesario continuar con estudios en donde se consideren estas variables para el análisis de la estructura comunitaria de la flora dentro de los microcosmos.
En conclusión, este trabajo contribuyó con el registro de 48 especies vegetales que no habían sido reportadas anteriormente bajo la cobertura de P. laevigata en el valle de Zapotitlán, Puebla. Además, se observó que la diversidad de las comunidades de plantas en los microcosmos fue mayor durante la temporada de lluvias con respecto a la de secas. Asimismo, se provee evidencias de una influencia positiva del tamaño de esta planta nodriza sobre la riqueza, diversidad y abundancia de plantas protegidas en un ecosistema semiárido. Se requieren nuevos estudios para analizar en detalle la dinámica y estructura de la vegetación de estos microcosmos en función de características físicas, como la incidencia de radiación solar y la distancia entre parches y el microambiente. Los resultados obtenidos refuerzan la hipótesis que postula a las leguminosas como importantes plantas facilitadoras, las cuales contribuyen sustancialmente en la conservación de los recursos vegetales en las zonas áridas y semiáridas.
Agradecimientos
A Pedro Miranda-Pacheco, Esperanza Córdova-Acosta y Arizbe Ponce-Bautista por su importante ayuda en el trabajo de campo. Los resultados de este trabajo forman parte de la tesis del primer autor dentro del Doctorado en Ciencias Biológicas y de la Salud de la UAM y se agradece al Conacyt por la beca otorgada (264372). Este trabajo fue financiado gracias al apoyo del Conacyt a través del proyecto “Un enfoque de metacomunidades y ecología de las invasiones para el análisis de la dinámica de comunidades en un ecosistema semiárido intertropical en México” (179296), a cargo de J.A. Zavala-Hurtado.
Apéndice. Lista florística de las especies protegidas bajo el dosel de Prosopis laevigata en el Jardín Botánico “Helia Bravo Hollis”, Zapotitlán Salinas, Puebla. Distribución: EM = endémica de México; EV = endémica del valle de Tehuacán-Cuicatlán. Ciclo o historia de vida: A = anual, B = bianual y P = perenne. Hábito: A = árbol; Ar = arbusto; C = cespitoso; E = enredadera; H = hierba; R = rastrero y S = suculento. Se señalan las abundancias de las especies para cada estación, los valores representan el número de individuos. Los valores entre paréntesis señalan la abundancia relativa (%).
|
Apéndice Continuación. |
|||||
|
Especies protegidas |
Distribución |
Ciclo |
Hábito |
Abundancia |
|
|
Secas |
Lluvias |
||||
|
Especies protegidas |
Distribución |
Ciclo |
Hábito |
Abundancia |
|
|
Secas |
Lluvias |
||||
|
Acanthaceae |
|||||
|
Justicia ramosa (Oerst.) V. A. W. Graham |
P |
H |
37 (1.13) |
37 (0.49) |
|
|
Ruellia hirsutoglandulosa (Oerst.) Hemsl. |
EM |
P |
Ar |
7 (0.21) |
7 (0.1) |
|
Amaranthaceae |
|||||
|
cf. Guilleminea densa (Willd. ex Schult.) Moq.* |
P |
R |
235 (7.19) |
290 (3.95) |
|
|
Gomphrena cf. serrata L. |
A |
H |
– |
8 (0.11) |
|
|
Iresine aff. calea (Ibantz) Standl.* |
P |
Ar |
2 (0.06) |
5 (0.07) |
|
|
Anacampserotaceae |
|||||
|
Talinopsis frutescens A. Gray* |
P |
Ar |
21 (0.64) |
29 (0.39) |
|
|
Asparagaceae |
|||||
|
Agave kerchovei Lem.* |
EM |
P |
S |
3 (0.09) |
5 (0.07) |
|
Agave macroacantha Zucc.* |
EV |
P |
S |
2 (0.06) |
13 (0.17) |
|
Agave marmorata Roezl* |
EM |
P |
S |
107 (3.27) |
117 (1.59) |
|
Agave peacockii Croucher* |
EV |
P |
S |
3 (0.09) |
5 (0.07) |
|
Asteraceae |
|||||
|
Flaveria ramosissima Klatt* |
EV |
A |
H |
– |
3073 (41.87) |
|
Gymnolaena oaxacana (Greenm.) Rydb.* |
EV |
P |
Ar |
1 (0.03) |
1 (0.01) |
|
Jefea aff. pringlei (Greenm.) Strother* |
EV |
P |
Ar |
5 (0.15) |
11 (0.15) |
|
Parthenium hysterophorus L.* |
P |
H |
1 (0.03) |
3 (0.04) |
|
|
Sanvitalia fruticosa Hemsl. |
EV |
P |
H |
94 (2.87) |
125 (1.70) |
|
Trixis pringlei B. L. Rob. et Greenm.* |
EM |
P |
Ar |
3 (0.09) |
2 (0.03) |
|
Verbesina aff. neotenoriensis B. L. Turner* |
EV |
P |
Ar |
– |
3 (0.04) |
|
Viguiera dentata (Cav.) Spreng. |
P |
Ar |
107 (3.27) |
134 (1.82) |
|
|
Viguiera aff. pinnatilobata (Sch. Bip.) S. F. Blake |
EV |
P |
Ar |
8 (0.24) |
28 (0.38) |
|
Boraginaceae |
|||||
|
Cordia curassavica (Jacq.) Roem. et Schult.* |
P |
Ar |
4 (0.12) |
8 (0.11) |
|
|
Heliotropium angiospermum Murray* |
A |
H |
6 (0.18) |
10 (0.14) |
|
|
Hechtia aff. podantha Mez |
P |
S |
9 (0.27) |
15 (0.20) |
|
|
Burseraceae |
|||||
|
Bursera cf. schlechtendalii Engl.* |
P |
Ar |
– |
1 (0.01) |
|
|
Cactaceae |
|||||
|
Coryphantha pallida Britton et Rose |
EM |
P |
S |
132 (4.04) |
147 (2) |
|
Cylindropuntia tunicata (Lehm.) F. M. Knuth |
P |
S |
2 (0.06) |
12 (0.16) |
|
|
Echinocactus platyacanthus Link et Otto |
EM |
P |
S |
1 (0.03) |
1 (0.01) |
|
Ferocactus flavovirens (Scheidw.) Britton et Rose* |
EV |
P |
S |
4 (0.12) |
5 (0.07) |
|
Ferocactus recurvus (Mill.) Borg |
EM |
P |
S |
62 (1.89) |
62 (1.06) |
|
Lemaireocereus hollianus (F. A. C. Weber) Britton et Rose |
EV |
P |
S |
– |
1 (0.01) |
|
Mammillaria carnea Zucc. ex Pfeiff. |
EM |
P |
S |
1288 (39.42) |
1587 (21.62) |
|
Mammillaria haageana Pfeiff. |
EM |
P |
S |
158 (4.84) |
189 (2.57) |
|
Mammillaria sphacelata Mart. |
EV |
P |
S |
10 (0.31) |
17 (0.23) |
|
Myrtillocactus geometrizans (Mart. ex Pfeiff.) Console |
EM |
P |
S |
73 (2.23) |
81 (1.10) |
|
Neobuxbaumia tetetzo (F. A. C. Weber ex K. Schum.) Backeb. |
EV |
P |
S |
63 (1.92) |
63 (0.86) |
|
Opuntia aff. pilifera F. A. C. Weber* |
EM |
P |
S |
12 (0.37) |
21 (0.29) |
|
Opuntia pubescens H. L. Wendl. ex Pfeiff.* |
P |
S |
25 (0.76) |
3 (0.04) |
|
|
Peniocereus viperinus (F. A. C. Weber) Buxb. |
EV |
P |
S |
1 (0.03) |
2 (0.03) |
|
Cannabaceae |
|||||
|
Celtis pallida Torr.* |
P |
A |
9 (0.27) |
8 (0.11) |
|
|
Crassulaceae |
|||||
|
Thompsonella minutiflora (Rose) Britton et Rose* |
EM |
P |
S |
14 (0.43) |
7 (0.09) |
|
Convolvulaceae |
|||||
|
Evolvulus alsinoides (L.) L.* |
P |
Ar |
8 (0.24) |
8 (0.11) |
|
|
Ipomoea arborescens (Humb. et Bonpl. ex Willd.) G. Don* |
P |
A |
– |
1 (0.01) |
|
|
Jacquemontia aff. smithii B. L. Rob. et Greenm.* |
P |
E |
3 (0.09) |
8 (0.11) |
|
|
Cucurbitaceae |
|||||
|
cf. Doyerea emetocathartica Grosourdy ex Bello* |
P |
E |
3 (0.09) |
3 (0.04) |
|
|
Euphorbiaceae |
|||||
|
Acalypha monostachya Cav.* |
P |
H |
1 (0.03) |
5 (0.07) |
|
|
Euphorbia aff. cumbrae Boiss.* |
A |
H |
– |
117 (1.59) |
|
|
Euphorbia sp. |
P |
H |
– |
1 (0.01) |
|
|
Leguminosae |
|||||
|
Acacia constricta A. Gray* |
P |
Ar |
3 (0.09) |
1 (0.01) |
|
|
Caesalpinia melanadenia (Rose) Standl.* |
EV |
P |
Ar |
5 (0.15) |
5 (0.07) |
|
Dalea carthagenensis (Jacq.) J. F. Macbr.* |
P |
Ar |
11 (0.33) |
19 (0.26) |
|
|
Mimosa luisana Brandegee |
EV |
P |
Ar |
1 (0.03) |
4 (0.05) |
|
Parkinsonia praecox (Ruiz et Pav.) Hawkins |
P |
A |
35 (1.07) |
25 (0.34) |
|
|
Prosopis laevigata (Willd.) M. C. Johnst. |
P |
A |
4 (0.12) |
52 (0.71) |
|
|
cf. Zapoteca formosa (Kunth) H. M. Hern.* |
P |
Ar |
2 (0.06) |
16 (0.22) |
|
|
Loasaceae |
|||||
|
Mentzelia hispida Willd. |
EM |
P |
E |
1 (0.03) |
7 (0.09) |
|
Malpighiaceae |
P |
||||
|
Echinopterys eglandulosa (A. Juss.) Small* |
EM |
P |
Ar |
7 (0.21) |
28 (0.38) |
|
Malvaceae |
|||||
|
Herissantia crispa (L.) Brizicky* |
P |
H |
18 (0.55) |
26 (0.35) |
|
|
Hibiscus phoeniceus Jacq.* |
P |
Ar |
1 (0.03) |
2 (0.03) |
|
|
Sida cf. cordifolia L.* |
A |
H |
– |
1 (0.01) |
|
|
Nyctaginaceae |
|||||
|
Allionia choisyi Standl.* |
P |
R |
21 (0.64) |
18 (0.24) |
|
|
Mirabilis viscosa Cav.* |
P |
Ar |
2 (0.06) |
1 (0.01) |
|
|
Orobanchaceae |
|||||
|
Orobanche ludoviciana Nutt.* |
P |
S |
– |
1 (0.01) |
|
|
Poaceae |
|||||
|
Aegopogon cenchroides Humb. et Bonpl. ex Willd.* |
A |
C |
25 (0.77) |
35 (0.48) |
|
|
Heteropogon contortus (L.) P. Beauv. ex Roem. et Schult.* |
P |
C |
– |
14 (0.19) |
|
|
cf. Muhlenbergia versicolor Swallen* |
P |
C |
83 (2.54) |
68 (0.92) |
|
|
Sporobolus aff. pyramidatus (Lam.) C. L. Hitchc. |
A |
C |
403 (12.34) |
463 (6.31) |
|
|
Polemoniaceae |
|||||
|
Loeselia coerulea (Cav.) G. Don |
EM |
B |
H |
2 (0.06) |
15 (0.20) |
|
Portulacaceae |
|||||
|
Portulaca pilosa L.* |
P |
H |
21 (0.64) |
56 (0.76) |
|
|
Sapindaceae |
|||||
|
Cardiospermum halicacabum L.* |
P |
E |
3 (0.09) |
5 (0.07) |
|
|
Simaroubaceae |
|||||
|
Castela tortuosa Liebm. |
P |
Ar |
81 (2.48) |
140 (1.91) |
|
|
Solanaceae |
|||||
|
Grabowskia geniculata (Fernald) C. L. Hitchc.* |
EV |
P |
Ar |
2 (0.06) |
5 (0.07) |
|
Lycium cf. nodosum Miers* |
P |
Ar |
– |
9 (0.12) |
|
|
Solanum tridynamum Dunal* |
EM |
P |
Ar |
– |
4 (0.05) |
|
Talinaceae |
|||||
|
Talinum paniculatum (Jacq.) Gaertn.* |
A |
H |
4 (0.12) |
5 (0.07) |
|
|
Verbenaceae |
|||||
|
Lantana camara L. |
P |
Ar |
5 (0.15) |
8 (0.11) |
|
|
Lippia graveolens Kunth |
P |
Ar |
3 (0.09) |
7 (0.09) |
|
|
Vitaceae |
|||||
|
Cissus sp. |
P |
E |
– |
4 (0.05) |
|
|
Total |
3267 |
7338 |
*Especies sin registro previo bajo mezquites.
Referencias
Aguiar, M. R. y Sala, O. E. (1999). Patch structure, dynamics and implications for the functioning of arid ecosystems. Trends in Ecology and Evolution, 14, 273–277.
Allan, E., Jenkins, T., Fergus, A. J. F., Roscher, C., Fischer, M., Petermann, J. et al. (2013). Experimental plant communities develop phylogenetically overdispersed abundance distributions during assembly. Ecology, 94, 465–477.
Arrhenius, O. (1921) Species and area. Journal of Ecology, 9, 95–99.
Bazzaz, F. A. y Morse, S. R. (1991). Annual plants: potential responses to multiple stresses. En H. A. Moorey, W. E. Winner y E. J. Pell (Eds.), Response of plants to multiple stresses (pp. 283–305). San Diego, California: Academic Press Inc.
Begon, M., Townsend C. R. y Harper J. L. (2006). Ecology. From individuals to ecosystems. Malden, Massachusetts: Blackwell Publishing.
Brooker, R. W., Maestre, F. T., Callaway, R. M., Lortie, C. L., Cavieres, L. A., Kunstler, G. et al. (2008). Facilitation in plant communities: the past, the present, and the future. Journal of Ecology, 96, 18–34.
Camargo-Ricalde, S. L., Reyes-Jaramillo, I. y Montaño, N. M. (2010). Forestry insularity effect of four Mimosa L. species (Leguminosae-Mimosoideae) on soil nutrients of a Mexican semiarid ecosystem. Agroforestry Systems, 80, 385–397.
Cavieres, L. A. y Badano, E. I. (2009). Do facilitative interactions increase species richness at the community level? Journal of Ecology, 97, 1181–1191.
Colwell, R. K. (2013). EstimateS: Statistical estimation of species richness and shared species from samples. Versión 9. Recuperado el 07 enero, 2018, de: http://viceroy.colorado.edu/estimates/
Crist, T. O. y Veech J. A. (2006). Additive partitioning of rarefaction curves and species-area relationships: unifying α-, β- and γ-diversity with simple size and habitat area. Ecology Letters, 9, 923–932.
Cruz-Rodríguez, J. A., García-Moya, E., Frías-Hernández, J. T., Montesinos-Silva, G. y Flores-Flores, J. L. (1997). Influencia de los mezquites en la composición y cobertura de la vegetación herbácea de un agostadero semiárido del norte de Guanajuato. Boletín de la Sociedad Botánica de México, 61, 21–30.
Dávila, P., Arizmendi M. C., Valiente-Banuet, A., Villaseñor, J. L., Casas, A. y Lira, R. (2002). Biological diversity in the Tehuacán-Cuicatlán Valley, Mexico. Biodiversity and Conservation, 11, 421–442.
Dávila, P., Villaseñor, J. L., Medina-Lemos, R. y Téllez-Valdés, O. (1993). Flora del valle Tehuacán-Cuicatlán. México D.F.: Instituto de Biología, UNAM.
Dengler, J. (2009). Which function describes the species-area relationship best? A review and empirical evaluation. Journal of Biogeography, 36, 728–744.
Fattorini, S., Borges, P. A. V., Dapporto, L. y Strona, G. (2017). What can the parameters of the species-area relationship (SAR) tell us? Insights from Mediterranean islands. Journal of Biogeography, 44, 1018–1028.
Flores, J. y Jurado, E. (2003). Are nurse-protégé interactions more common among plants from arid environments? Journal of Vegetation Science, 14, 911–916.
Frías-Hernández, J. T., Aguilar-Ledezma, A. L., Olalde-Portugal, V., Balderas-López, J. A., Gutiérrez-Juárez, G., Alvarado-Gil, J. J. et al. (1999). Soil characteristics in semiarid highlands of Central Mexico as affected by mesquite trees (Prosopis laevigata). Arid Soil Research and Rehabilitation, 13, 305–312.
García, E. (2004). Modificaciones al sistema climático de Köppen. México D.F.: Instituto de Geografía, UNAM.
García-Sánchez, R., Camargo-Ricalde, S. L., García-Moya, E., Luna-Cavazos, M., Romero-Manzanares, A. y Montaño, N. M. (2012). Prosopis laevigata and Mimosa biuncifera (Leguminosae), jointly influence plant an soil fertility of a Mexican semiarid ecosystem. Revista de Biología Tropical, 60, 87–103.
Golubov, J., Martínez-Valenzuela, P. A., Durán, C. E. J. y Martínez, C. Y. (2010). Distribución espacial y nodricismo en Mammillaria carnea en el municipio de Valerio Trujano, Cuicatlán, Oaxaca. Cactáceas y Suculentas Mexicanas, 55, 56–64.
González-Medrano, F. (2003). Las comunidades vegetales de México. México D.F.: INE-Semarnat.
Granados, S. D., Hernández, G. M. y López, R. G. (2012). Ecología de los desiertos del mundo. Chapingo, Estado de México: Universidad Autónoma Chapingo.
Grether, R., Martínez-Bernal, A., Luckow, M. y Zárate, S. (2006). Mimosaceae R. Br. Tribu Mimoseae Bronn. Flora del valle de Tehuacán. Fascículo 44. México D.F.: Instituto de Biología, UNAM.
Hammer, Ø., Harper, D. A. T. y Ryan, P. D. (2001). Past: paleontological statistics software package for education and data analysis. Paleontologia Electronica, 4, 1–9.
Larrea-Alcázar, D. M., López, R. P. y Barrientos, D. (2005). The nurse-plant effect of Prosopis flexuosa D. C. (Leg-Mim) in a dry valley of the Bolivian Andes. Ecotropicos, 18, 89–95.
Larrea-Alcázar, D. M. y Soriano, P. J. (2006). Spatial associations, size-distance relationships and population structure of two dominant life forms in a semiarid enclave of the Venezuelan Andes. Plant Ecology, 186, 137–149.
López, R. P. y Ortuño, T. (2008). La influencia de los arbustos sobre la diversidad y abundancia de las herbáceas de la Prepuna a diferentes escalas espaciales. Ecología Austral, 18, 119–131.
López-Gómez, V. y Cano-Santana, Z. (2010). Best host-plant attribute for species-area relationship, and effects of shade, conspecific distance and plant phenophase in an arthropod community within the grass Muhlenbergia robusta. Entomological Science, 13, 174–182.
Mandujano, M. C., Flores-Martínez, A., Golubov, J. y Ezcurra, E. (2002). Spatial distribution of three globose cacti in relation to different nurse-plant canopies and bare areas. The Southwestern Naturalist, 47, 162–168.
Martínez-Ramos, M. (2016). Implicaciones de la asociación de nodricismo sobre la biología reproductiva y establecimiento de nuevos individuos de Mammillaria carnea (Tesis de maestría). México D.F.: Universidad Autónoma Metropolitana-Iztapalapa.
Matthews, T. J., Steinbauer, M. J., Tzirkalli, E., Triantis, K. A. y Whittaker, R. J. (2014). Thresholds and the species-area relationship: a synthetic analysis of habitat island datasets. Journal of Biogeography, 41, 1018–1028.
Montaña, C. (1992). The colonization of bare areas in two-phase mosaics of an arid ecosystem. Journal of Ecology, 80, 315–327.
Moro, M. J., Pugnaire, F. I., Haase, P. y Puigdefábegas, J. (1997). Effect of the canopy of Retama sphaerocarpa on its understory in a semiarid environment. Functional Ecology, 11, 425–431.
Muro-Pérez, G., Jurado, E., Flores, J. y Sánchez-Salas, J. (2014). Effect of seed burial in different soils on the germination of three specially protected cactus species. The Southwestern Naturalist, 59, 344–348.
Muro-Pérez, G., Jurado, E., Flores, J., Sánchez-Salas, J., García-Pérez, J. y Estrada, E. (2012). Positive effects of native shrubs on three specially protected cacti species in Durango, México. Plant Species Biology, 27, 53–58.
Navarro-Cano, J. A., Goberna, M., Valiente-Banuet, A. y Verdú, M. (2016). Same nurse but different time: temporal divergence in the facilitation of plant lineages with contrasted functional syndromes. Functional Ecology, 30, 1854–1861.
Nobel, P. S. (1988). Environmental biology of agaves and cacti. Cambridge: Cambridge University Press.
Perroni-Ventura, Y. (2007). Islas de fertilidad en un ecosistema semiárido: nutrimentos en el suelo y su relación con la diversidad vegetal (Tesis doctoral). Xalapa: Instituto de Ecología, A.C..
Perroni-Ventura, Y., Montaña, C. y García-Oliva, F. (2006). Relationship between soil nutrient availability and plant species richness in a tropical semi-arid environment. Journal of Vegetation Science, 17, 719–728.
Pugnaire, F. I., Haase, P., Puigdefábegas, J., Cueto, M., Clark, S. C. e Incoll, L. D. (1996). Facilitation and succession under the canopy of a leguminous shrub, Retama sphaerocarpa, in a semi-arid environment in south-east Spain. Oikos, 76, 455–464.
Ramírez-Arriaga, E., Prámparo, M. B., Nieto-Samaniego, A. F., Martínez-Hernández, E., Valiente-Banuet, A., Macías-Romo, C. et al. (2014). Palynological evidence for Middle Miocene vegetation in the Tehuacán Formation of Puebla, Mexico. Palinology, 38, 1–27.
Ramírez-Arriaga, E., Prámparo, M. B., Nieto-Samaniego, A. F. y Valiente-Banuet, A. (2017). Eocene Mequitongo Formation palynoflora from the intertropical Tehuacán–Cuicatlán Valley, Mexico. Review of Palaeobotany and Palynology, 246, 14–31.
Rivas-Arancibia, S. P. (2006). Dinámica de comunidades de plantas anuales en una zona semiárida del trópico mexicano. Factores que moldean la estructura de estas comunidades (Tesis doctoral). México D.F.: Facultad de Ciencias, UNAM.
Rivas-Arancibia, S. P., Montaña, C., Velasco, J. X. y Zavala-Hurtado, J. A. (2006). Germination responses of annual plants to substrate type, rainfall, and temperature in a semi-arid inter-tropical region in Mexico. Journal of Arid Environments, 67, 416–427.
Rodríguez, O. C. E. y Ezcurra, E. (2000). Distribución espacial en el hábitat de Mammillaria pectinifera y M. carnea en el valle de Zapotitlán Salinas, Puebla, México. Cactáceas y Suculentas Mexicanas, 45, 4–14.
Rossi, B. E. y Villagra, P. E. (2003). Effects of Prosopis flexuosa on soil properties and the spatial pattern of understory species in arid Argentina. Journal of Vegetation Science, 14, 543–550.
Ruiz, T. G., Zaragoza, S. R. y Cerrato, R. F. (2008). Fertility islands around Prosopis laevigata and Pachycereus hollianus in the drylands of Zapotitlán Salinas, México. Journal of Arid Environments, 72, 1202–1212.
Rzedowski, J. (1978). Vegetación de México. México D.F.: Limusa.
SAS Institute (Statistical Analysis System Institute). (2010). JMP® Version 9.0.1. SAS Institute Inc. USA
Srivastava, D. S., Kolasa, J., Bengtsson, J., Gonzalez, A., Lawler, S. P., Miller, et al. (2004). Are natural microcosm useful model systems for ecology? Trends in Ecology and Evolution, 19, 379–384.
Tewksbury, J. J. y Lloyd, J. D. (2001). Positive interactions under nurse-plants: spatial scale, stress gradients and benefactor size. Oecologia, 127, 425–434.
The Plant List. (2013). Versión 1.1. Disponible en: http://www.theplantlist.org/
Tongway, D. J., Cortina, J. y Maestre, F. T. (2004). Heterogeneidad espacial y gestión de medios semiáridos. Ecosistemas, 13, 2–15.
Tropicos.org. (2018). Missouri Botanical Garden. Disponible en: http://www.tropicos.org
Valiente-Banuet, A., Bolongaro-Crevenna, A., Briones, O., Ezcurra, E., Rosas, M., Nuñez, H., et al. (1991). Spatial relationships between cacti and nurse shrubs in a semi-arid environment in central Mexico. Journal of Vegetation Science, 2, 15–20.
Valiente-Banuet, A. y Ezcurra, E. (1991). Shade as a cause of the association between the cactus Neobuxbaumia tetetzo and the nurse plant Mimosa luisiana in the Tehuacán Valley, México. Journal of Ecology, 79, 961–971.
Valiente-Banuet, A. y Verdú, M. (2007). Facilitation can increase the phylogenetic diversity of plant communities. Ecology Letters, 10, 1029–1036.
Valiente-Banuet, A., Vite, F. y Zavala-Hurtado, J. A. (1991). Interaction between the cactus Neobuxbaumia tetetzo and the nurse shrub Mimosa luisana. Journal of Vegetation Science, 2, 11–14.
Weller, S. (2010a). Plantas de la Reserva de la Biosfera Tehuacán-Cuicatlán, Vol. I. Especies de Puebla. México D.F.: Peace Corps México-USAID.
Weller, S. (2010b). Plantas de la Reserva de la Biosfera Tehuacán-Cuicatlán, Vol. II. Oaxaca y otras especies de Puebla. México D.F.: Peace Corps México-USAID.
Zar, J. H. (1999). Biostatistical analysis. Upper Saddle River, Nueva Jersey: Prentice Hall.
Zavala-Hurtado, J. A., Valverde, P. L., Díaz-Solís, A., Vite, F. y Portilla, E. (1996). Vegetation-environment relationships based on a life forms classification in a semiarid region of Tropical Mexico. Revista de Biología Tropical, 44, 561–570.



