Diversidad de moluscos y crustáceos acuáticos en tres zonas en la cuenca del río Usumacinta, México
Cinthia Trinidad-Ocaña a, Juan Juárez-Flores a, Alberto J. Sánchez b y Everardo Barba-Macías a, *
a Departamento de Ciencias de la Sustentabilidad, Grupo Académico Manejo Sustentable de Cuencas y Zonas Costeras, El Colegio de la Frontera Sur, Unidad Villahermosa, Carretera a Reforma Km 15.5 s/n, Ra. Guineo 2da. Sección, 86280 Villahermosa, Tabasco, México
b División Académica de Ciencias Biológicas, Universidad Juárez Autónoma de Tabasco, Km 0.5 Carretera Villahermosa-Cárdenas, 86039 Villahermosa, Tabasco, México
* Autor para correspondencia: ebarba@ecosur.mx (E. Barba-Macías)
Resumen
Los moluscos y crustáceos son importantes en la transferencia energética a niveles tróficos superiores, además de que indican la condición de los ecosistemas acuáticos. La diversidad de ambos grupos se determinó mediante muestreos diurnos en ambientes lóticos y lénticos en 3 zonas de la cuenca del río Usumacinta: planicie delta 1 y 2 (PD) y montaña fluvial (MF), abarcando los periodos hidrológicos de mínima inundación (mín-I), transición y máxima inundación (máx-I). Se registraron 236,250 organismos pertenecientes a 35 y 13 especies de moluscos y crustáceos, con 99% y 1% de la abundancia total, respectivamente. El 85% de abundancia de moluscos correspondió a Melanoides tuberculata y Tarebia granifera (especies invasoras), y el 67% de los crustáceos a Macrobrachium sp. y Penaeus duorarum. La diversidad máxima de moluscos por zona fue en PD2 (H’ = 2.4); por ambiente en lóticos (H’ = 2.9) y por temporada en mín-1 (H’ = 2.2). Con respecto a los crustáceos, la diversidad fue máxima en la zona PD1 (H’ = 2.2), en lóticos (H’ = 2.0) y en máx-1 (H’ = 2.1). La diversidad varió por la mayor heterogeneidad de los hábitats y la influencia marina.
Palabras clave:
Especies invasivas no nativas; Humedales; Macroinvertebrados; Sureste de México
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Diversity of aquatic mollusks and crustaceans in three zones in the Río Usumacinta basin, Mexico
Abstract
Mollusks and crustaceans are important in making energy available to upper trophic levels, besides, they are indicators of aquatic ecosystems condition. Diversity and abundance were determined by diurnal samples in lotic and lentic systems in 3 zones: delta 1 and 2 floodplain (PD) and fluvial highlands (MF) of the Usumacinta river basin during hydrological periods of minimum flooding, transition and maximum flooding. A total of 236,250 organisms was collected, which belong to 35 and 13 species of mollusks and crustaceans, with 99% and 1% of the total abundance, respectively. The 85% of the abundance of mollusks was represented by Melanoides tuberculata and Tarebia granifera (invasive species), whereas the 67% of the crustaceans was represented by Macrobrachium sp. and Penaeus duorarum. The highest diversity for mollusks was in zone PD2 (H’ = 2.4); in lotic (H’ = 2.9) and mín-1 season (H’ = 2.2). Regarding the crustaceans, the highest diversity was in PD1 (H’ = 2.2), in lotic (H’ = 65 2.0) and in máx-1 season (H’ = 2.1). The diversity varied due to habitat heterogeneity and marine influence recorded.
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Invasive non-native species; Wetlands; Macroinvertebrates; Southern Mexico
Introducción
Entre los macroinvertebrados acuáticos, los moluscos y crustáceos destacan debido a su abundancia, además de constituir eslabones intermedios entre los productores primarios y los consumidores, donde su papel como transformadores e integradores de la materia orgánica es relevante en los flujos de energía de los sistemas fluviales (Barba et al., 2000). Los moluscos, grupo de origen marino, presentan una amplia distribución y están asociados con diferentes tipos de hábitat como fondos suaves, troncos hundidos y vegetación acuática (Naranjo-García y Olivera-Carrasco, 2014). Por otro lado, algunas especies de bivalvos son capturadas para consumo humano en la cuenca baja del río Usumacinta (Reserva de la Biosfera Pantanos de Centla), estas especies son Potamilus alatus (Say, 1817), Cyrtonaias tampicoensis (Lea, I., 1839), Pyganodon grandis (Say, 1829), Rangia cuneata (G. B. Sowerby I, 1832), y Pomacea flagellata (Say, 1829). Esta última especie es utilizada en sistemas de cultivo intensivo como fuente alimenticia (Rangel-Ruiz, 2000). Además, especies como P. flagellata, Neritina usnea (Say, 1822), N. virginea (Linnaeus, 1758), Biomphalaria obstructa (havanensis) (Morelet, 1849) y Rangia cuneata son utilizadas como indicadoras de ambientes moderadamente o no contaminados (Naranjo-García y Meza-Meneses, 2000). Por otro lado, las especies invasoras Melanoides tuberculata (Müller, 1774), Tarebia granifera (Lamarck, 1816) y Corbicula fluminea (Müller, 1774) han sido registradas frecuentemente en esta cuenca con altas abundancias y probablemente generan desequilibrio en la biodiversidad de los ambientes acuáticos que colonizan (Albarrán-Melzer et al., 2009; Barba y Trinidad-Ocaña, 2017; Cruz-Ascencio et al., 2003; Naranjo-García y Meza-Meneses, 2000; Sánchez et al., 2012).
En México el 89% de las especies de crustáceos registradas es marino, el 10% es dulceacuícola y el 1% terrestre (Álvarez et al., 1996). Estos invertebrados presentan adaptaciones entre las que destacan la respiración aérea (Díaz y Rodríguez, 1977), la capacidad de osmorregulación (Mantel y Farmer, 1983) y su capacidad locomotora que han facilitado la invasión a ambientes estuarinos, dulceacuícolas y terrestres (Wrange et al., 2014). Los crustáceos habitan en una variedad de sustratos como fondos lodosos, troncos hundidos, vegetación acuática sumergida, flotante y emergente, estos organismos desempeñan un papel importante en la transferencia energética hacia niveles tróficos superiores (Barba et al., 2000). Algunas especies se emplean como indicadores de la calidad del agua (Álvarez et al., 1996; Cumberlidge et al., 2009; Schertzinger et al., 2018) tales como: Macrobrachium spp. (Camacho-Sánchez, 2007), Hyalella azteca (Keithly et al., 2004), Mysidopsis bahia (Raz-Guzman, 2000). Además, dentro de este grupo, los camarones peneidos, los carideos y las jaibas se destacan por su relevancia en la pesca comercial y contribuyen con el 1.4% de la producción nacional (Conapesca, 2013).
La alta productividad biológica de algunas cuencas se ha explicado por la vinculación entre los ambientes acuáticos y la fuerte presión de la selección natural que producen interacciones únicas entre vertebrados, invertebrados y la flora (Gibbs, 1993; Russell et al., 2002), lo cual se relaciona con el balance en la combinación del flujo de energía y la entrada del agua que influye en la diversidad (Rodríguez et al., 2005). La cuenca del río Usumacinta es considerada un ecosistema esencial para el país por su alta disponibilidad de agua (22,185 m3/hab/año), su diversidad biológica, su importancia ecológica y por las menores presiones hídricas (Conagua, 2011; March y Castro, 2010; Sánchez et al., 2015). No obstante, el aumento de las actividades antropogénicas causa una mayor presión al sistema debido a la modificación del uso del suelo (Kolb y Galicia, 2012), con la consecuente disminución de la vegetación riparia y el aumento de la descarga de aguas residuales sin tratamiento que afectan la calidad del agua (Laino-Guanes et al., 2016). Por lo que, los registros de especies no nativas invasoras son cada vez más frecuentes en la cuenca del río Usumacinta (Barba et al., 2014; Cruz-Ascencio et al., 2003; Rangel-Ruiz et al., 2011).
A pesar de la relevancia de los macroinvertebrados acuáticos (moluscos y crustáceos) en cuanto a su abundancia, los registros sobre su diversidad son aún limitados en comparación con el número de registros de otros grupos faunísticos como peracáridos y copépodos, así como la cobertura espacial en la cuenca (Albarrán-Melze et al., 2009; Barba et al., 2010; Montalvo et al., 2010; Sánchez et al., 2012; Velasco et al., 2005). Por lo anterior, este estudio tiene como objetivo describir la diversidad de moluscos y crustáceos en 3 zonas de la cuenca del río Usumacinta, en ambientes lóticos y lénticos, donde se plantea como hipótesis de trabajo que la diversidad responda directamente tanto a la influencia marina y dulceacuícola en las zonas bajas inundables, así como con la heterogeneidad ambiental de los ecosistemas acuáticos.
Materiales y métodos
Con fines del trabajo, la cuenca se dividió en 3 zonas: 1) planicie delta 1 (PD1), con influencia marina estacional que incluyó 6 sitios (0 m snm) en localidades de los Pantanos de Centla (RBPC), Tabasco y del río Palizada, Campeche; 2) planicie delta 2 (PD2) (7 m snm), limnética todo el año representada por 4 sitios localizados en los ríos Usumacinta, Chacamax y San Pedro, en la región de Balancan-Tenosique y Emiliano Zapata y 3) montaña fluvial (MF) (148 m snm) en 7 sitios localizados en las planicies de los ríos Lacantún, Tzendales y Usumacinta (tabla 1).
Tabla 1
Localidades de muestreos en 3 zonas de la cuenca del río Usumacinta. México.
|
Zona de estudios |
Estado |
Sistema |
|
Localidades |
Coordenadas |
|
|
Latitud |
Longitud |
|||||
|
Planicie delta 1 |
Tabasco |
Léntico |
1 |
Laguna San Pedrito |
18.349778 |
-92.567594 |
|
Planicie delta 1 |
Tabasco |
Léntico |
2 |
Laguna La Puerta |
18.344864 |
-92.612083 |
|
Planicie delta 1 |
Tabasco |
Léntico |
3 |
Laguna San Isidro |
18.405278 |
-92.467167 |
|
Planicie delta 1 |
Tabasco |
Lótico |
4 |
Canal Salsipuedes |
18.36889 |
-92.47652 |
|
Planicie delta 1 |
Tabasco |
Lótico |
5 |
Canal Tembladeras |
18.606878 |
-92.458222 |
|
Planicie delta 1 |
Tabasco |
Lótico |
6 |
Canal San Pedrito |
18.371278 |
-92.609417 |
|
Planicie delta 1 |
Campeche |
Lótico |
7 |
Río Palizada |
18.096408 |
-92.0835 |
|
Planicie delta 2 |
Tabasco |
Léntico |
8 |
Laguna Canitzán |
17.612469 |
-91.398008 |
|
Planicie delta 2 |
Tabasco |
Léntico |
9 |
Laguna Nueva Esperanza |
17.752428 |
-91.799006 |
|
Planicie delta 2 |
Tabasco |
Lótico |
10 |
Playón río San Pedro |
17.744742 |
-91.398644 |
|
Planicie delta 2 |
Tabasco |
Lótico |
11 |
Río Chacamax |
17.711561 |
-91.740883 |
|
Montaña fluvial |
Chiapas |
Lótico |
12 |
Arroyo Agua Azul |
16.820094 |
-90.909753 |
|
Montaña fluvial |
Chiapas |
Lótico |
13 |
Arroyo Guatemala |
16.828683 |
-90.925467 |
|
Montaña fluvial |
Chiapas |
Lótico |
14 |
Playón La Técnica |
16.824453 |
-90.905535 |
|
Montaña fluvial |
Chiapas |
Lótico |
15 |
Playón Macachí |
16.825244 |
-90.9248 |
|
Montaña fluvial |
Chiapas |
Lótico |
16 |
Río Tzendales |
16.28136 |
-90.906225 |
|
Montaña fluvial |
Chiapas |
Lótico |
17 |
Playón Lacantún |
16.26439 |
-90.861856 |
|
Montaña fluvial |
Chiapas |
Lótico |
18 |
Arroyo El Remolino |
16.264394 |
-90.868603 |
Los muestreos se realizaron en horas de iluminación y con un enfoque multihábitat, en 3 campañas de campo cubriendo las temporadas del periodo hidrológico del año 2015: mín-I: mínima inundación (febrero-abril), transición (junio-julio) y máx-I: máxima inundación (agosto-septiembre), en 18 sitios pertenecientes a 13 ambientes lóticos y 5 ambientes lénticos ubicados a lo largo del río en las 3 zonas: PD1, PD2 y MF.
En cada localidad se registraron las condiciones del hábitat de manera visual y cualitativa mediante la ficha técnica de caracterización física y de calidad de agua siguiendo los criterios empleados por Barbour et al. (1999) para las variables de corriente y tipo de sustrato. Con respecto al tipo de vegetación, ésta fue valorada de acuerdo con su forma de vida, siguiendo los criterios de Barba et al. (2013) (tabla 2).
Los moluscos y los crustáceos se recolectaron con diversas artes de colecta con diferente selectividad. Para la epifauna se emplearon redes de cuchara con luz de malla de 500 micras (un área de captura de 0.87 m2), red de arrastre tipo Renfro con luz de malla de 1 mm (50 m2) y una red chinchorro con luz de malla de 1 cm (62 m2); mientras que, para la infauna se utilizó un nucleador (0.0033 m2) y una draga Petite Ponar (0.025 m2). Todos los muestreos por arte de colecta, por localidad (18) y por temporadas (3) se realizaron por triplicado, con un total de 1,210 muestras. Los organismos se rotularon, envasaron y fijaron con alcohol etílico al 96% para su posterior análisis en laboratorio. La identificación se realizó hasta el nivel taxonómico más bajo posible, de acuerdo con los caracteres taxonómicos convencionales para moluscos mediante: Burch y Cruz-Reyes (1987), Thorp y Covich, (1991) y Hershler y Thompson (1992) y para crustáceos: Rathbun (1898, 1930), Holthuis (1949, 1950), Bousfield (1972), Chace (1972), Pennak (1978), Williams (1984) y Thorp y Covich (1991). Así como, con el apoyo de catálogos ilustrados de crustáceos, como el de Raz-Guzmán et al. (1992). Los organismos se encuentran depositados en la Colección de Macroinvertebrados, en el Laboratorio de Aprovechamiento de Recursos Acuáticos de El Colegio de la Frontera Sur (ECOSUR), Unidad Villahermosa.
Adicionalmente a la identificación de los organismos recolectados en este estudio, se realizó una búsqueda bibliográfica de los registros previos de moluscos y crustáceos en la zona de estudio y se realizó la recopilación de la información sobre la biodiversidad disponible para la cuenca Usumacinta de la red de datos del Sistema Nacional de Información de Biodiversidad (SNIB) de la Comisión Nacional para el Conocimiento y uso de la Biodiversidad (Conabio) (Álvarez-Noguera y Hernández-Álvarez, 2004; Avendaño-Gil, 2004; Elías-Gutiérrez, 2006; Quiroz-Vázquez, 2012; Rangel-Ruíz, 2000; Reguero-Reza et al., 2012; Vásquez-Yeomans, 2006).
Los organismos identificados fueron contabilizados y pesados en una balanza analítica con una precisión de 0.001 g. La densidad se calculó mediante el conteo de los individuos obtenidos (abundancia) en cada réplica, se calculó el promedio por sitio y posteriormente se transformaron con base en el área de cada colector para obtener org/m2.
Tabla 2
Condiciones del hábitat de cada localidad de muestreo en 3 zonas de la cuenca del río Usumacinta, México.
|
Zona |
Loc. |
Tipo de vegetación |
Corriente |
Sustrato |
|||||||
|
Emergente |
Flotante |
Enraizada sumergida |
Moderada a fuerte |
Lenta |
Arena |
Lodo |
Rocoso |
||||
|
Planicie delta 1 |
1 |
x |
x |
x |
|
x |
|
x |
|
||
|
2 |
x |
x |
|
|
x |
|
x |
|
|||
|
3 |
x |
x |
|
|
x |
|
x |
|
|||
|
4 |
|
x |
|
|
x |
|
x |
|
|||
|
5 |
|
|
|
|
x |
x |
|
|
|||
|
6 |
x |
x |
x |
x |
|
|
x |
|
|||
|
7 |
|
|
|
x |
|
x |
|
|
|||
|
Planicie delta 2 |
8 |
x |
|
|
|
x |
|
x |
|
||
|
9 |
x |
|
|
|
x |
|
x |
|
|||
|
10 |
|
|
|
x |
|
x |
|
|
|||
|
11 |
|
x |
|
|
x |
|
x |
|
|||
|
Montaña fluvial |
12 |
|
|
|
x |
|
|
|
x |
||
|
13 |
|
|
|
|
x |
|
x |
|
|||
|
14 |
|
|
|
x |
|
x |
|
x |
|||
|
15 |
x |
|
|
x |
|
x |
|
x |
|||
|
16 |
x |
|
|
x |
|
x |
|
x |
|||
|
17 |
x |
|
|
x |
|
x |
|
x |
|||
|
18 |
|
|
|
|
x |
x |
|
x |
Para cada grupo se calcularon independientemente el índice de Shannon-Wiener H’ = -Σ (Pi*Ln (Pi), el índice de equidad de Pielou J’ = H’/Ln(S) y el índice de dominancia (D) (Krebs, 1989; McCune y Grace, 2002; Ramírez, 1999;). Todos los índices fueron calculados para cada zona y temporada con el paquete estadístico PAST versión 2.17c (Hammer et al., 2001). Para agrupar las localidades con base en la presencia o ausencia de las especies determinadas por cada localidad se realizaron análisis de componentes principales (ACP). De igual forma para determinar las posibles agrupaciones se relacionó la presencia o ausencia de especies con las variables del hábitat: tipo de corriente (moderada a fuerte, lenta), vegetación acuática presente (emergente, flotante y enraizada sumergida) y tipo de sustrato (arena, lodo, rocoso).
Resultados
Los sitios de muestreo en PD1 presentaron vegetación acuática flotante, velocidad de corriente lenta y fondo lodoso. Mientras que en PD2 se registró vegetación de tipo ribereño matorral y pastizal, con corriente nula o moderada y sustrato del fondo de tipo lodoso. La zona MF se caracterizó por presentar corriente fuerte, sustrato rocoso y presencia de vegetación emergente (tabla 2).
Se recolectaron un total de 234,666 moluscos con un peso total de 32.93 kg correspondientes a 7 órdenes, 20 familias, 33 géneros y 35 especies. El 86% de la abundancia total correspondió a las especies de moluscos no nativos invasores Melanoides tuberculata y Tarebia granifera. Con respecto a los crustáceos se registraron 1,584 organismos con un peso total de 0.55 kg, pertenecientes a 3 órdenes, 10 familias, 10 géneros y 13 especies. Macrobrachium sp. (Spence Bate, 1868), y Penaeus duorarum (Burkenroad, 1939) especies nativas, representaron el 67% de la abundancia total (tabla 3).
Planicie delta 1. En esta zona se capturaron un total de 232, 543 moluscos (91% de la densidad total de moluscos) representados por 14 familias, 24 géneros y 29 especies; T. granifera y M. tuberculata fueron dominantes y obtuvieron una densidad del 67.36%. Mientras que de crustáceos se capturaron 1,487 organismos (88.5% de la densidad total de crustáceos), distribuidos en 9 familias, 9 géneros y 12 especies, donde Macrobrachium sp. y P. duorarum fueron dominantes, con una densidad 46% y 19% .
Planicie delta 2. En esta zona se recolectaron un total de 1,793 individuos que corresponde a 4.5% de la densidad total de moluscos pertenecientes a 11 familias, 17 géneros y 17 especies. Dos especies fueron dominantes M. tuberculata con 36% de la densidad total, y Cochliopina francesae (Goodrich y Van der Schalie, 1937) con 26.5% de la densidad. Con respecto a los crustáceos, se capturaron 94 individuos que representaron el 11% de la densidad total, pertenecientes a 3 familias, 3 géneros y 4 especies, los camarones carideos del género Macrobrachium sp. fueron dominantes.
Montaña fluvial. En esta zona se recolectaron un total de 498 ejemplares de moluscos (4.5% del total), distribuidos en 15 familias, 18 géneros y 20 especies, y 3 crustáceos (0.5 %) pertenecientes a una familia, un género y 2 especies. Las especies dominantes en esta zona fueron los moluscos T. granifera, Corbicula fluminea y los camarones juveniles de Macrobrachium sp. y M. acanthurus (Wiegmann, 1836) lo cual difiere parcialmente de las 2 zonas anteriores ubicadas en la planicie delta de la cuenca.
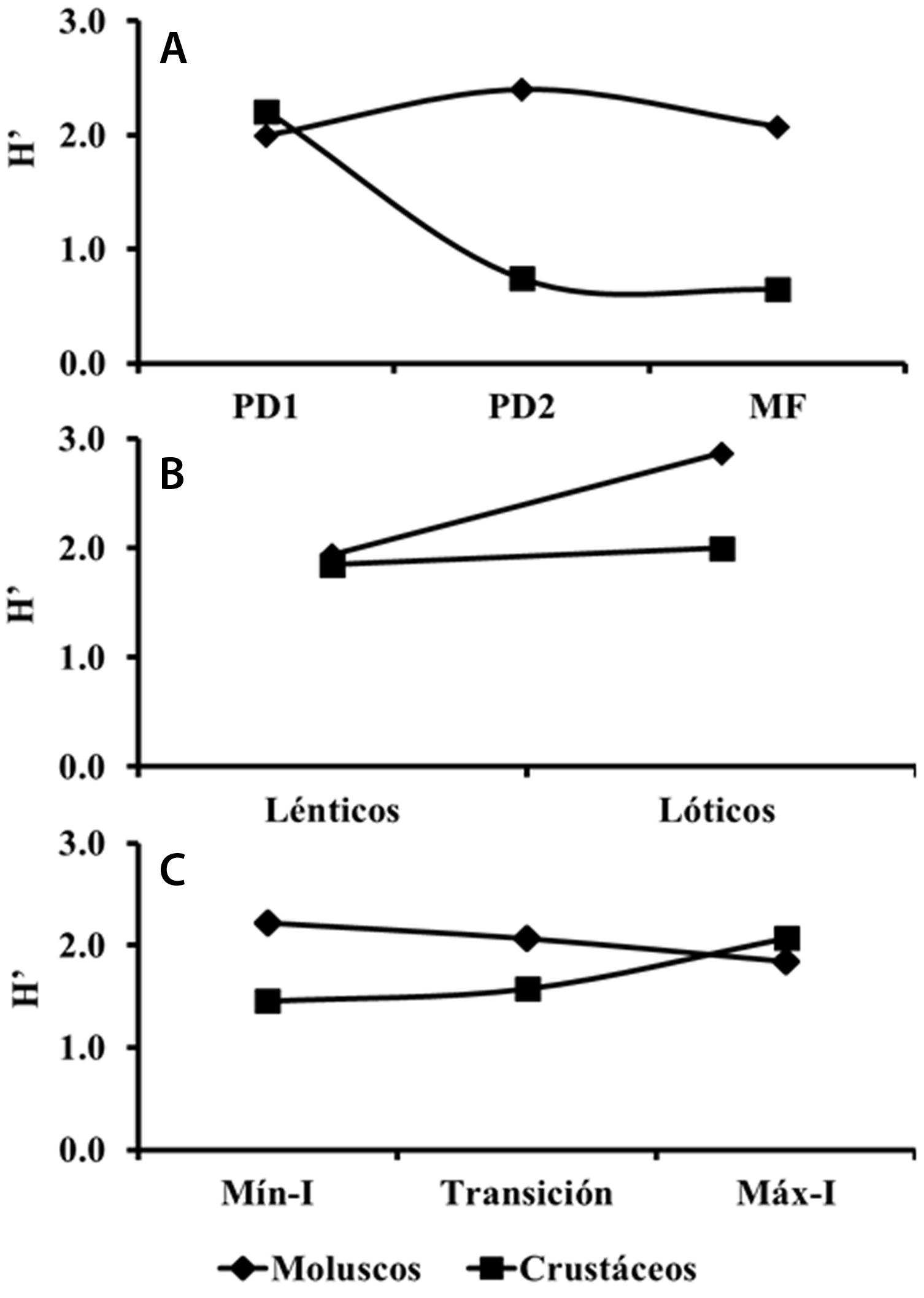
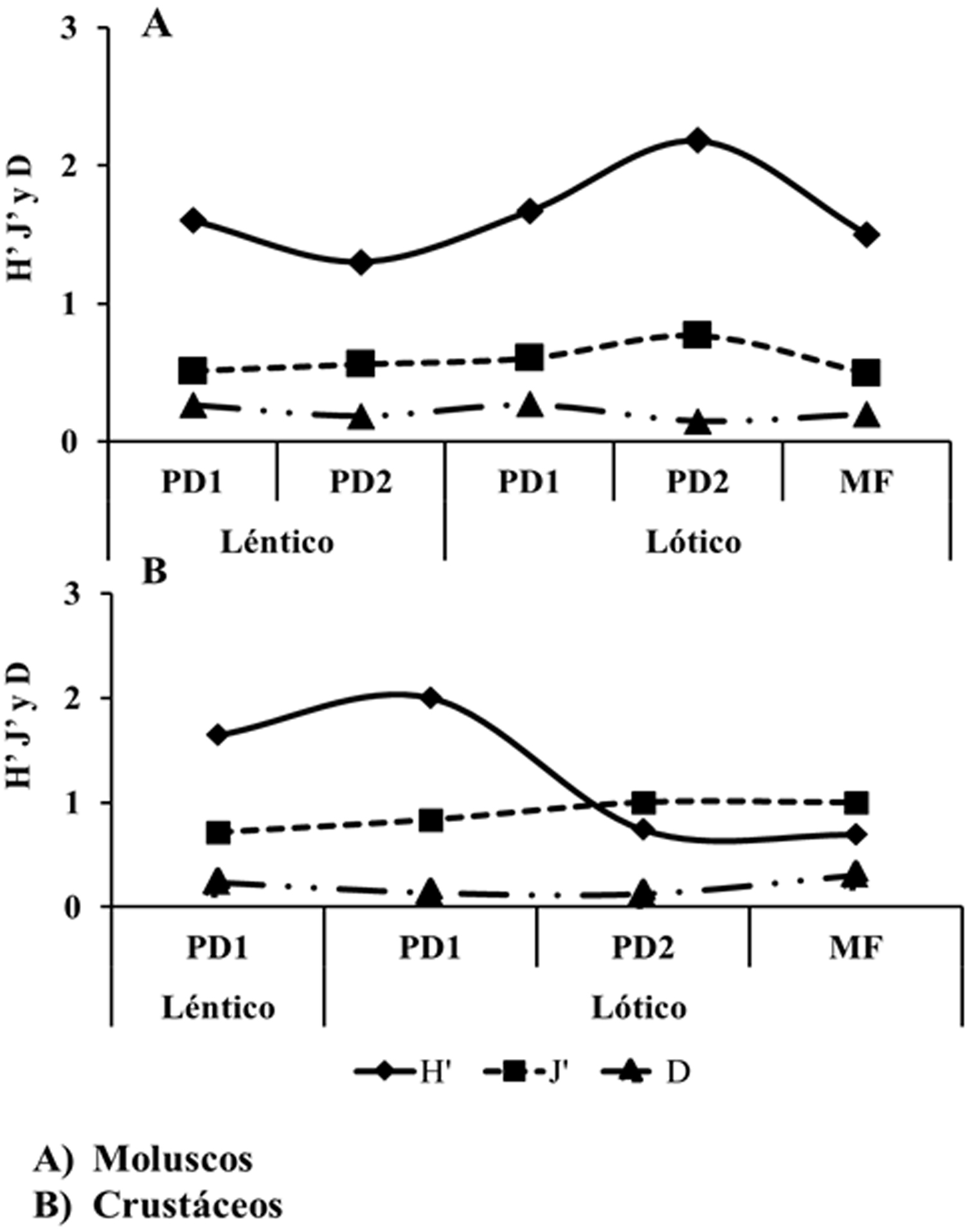
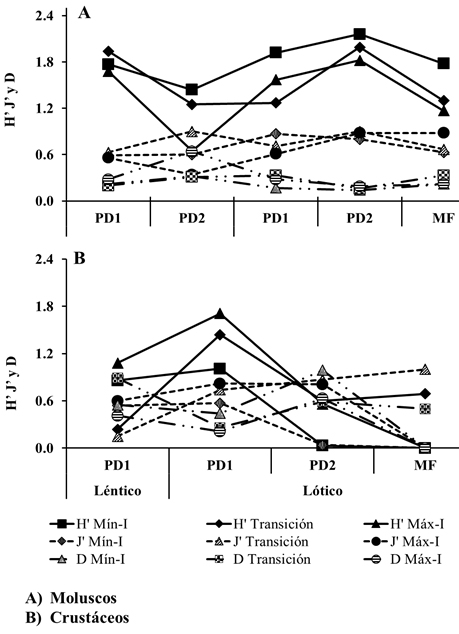
La diversidad máxima de moluscos por zona se encontró en PD2 (H´ = 2.4) y la diversidad mínima en PD1 (H´ = 2.0). Mientras que la diversidad máxima de crustáceos se registró en la zona de PD1 (H´ = 2.2) y la diversidad mínima en MF (H´ = 0.6) (figs. 1A, 2A, 3A). La diversidad de moluscos y crustáceos resultó ser mayor en ambientes lóticos (H´ = 2.9 y 2.0) y menor en los ambientes lénticos (H´ = 1.9 y 1.8) (figs. 1B, 2B, 3B). Temporalmente, los moluscos tuvieron la diversidad máxima en la mínima inundación (H´ = 2.2) y la mínima diversidad durante la máxima inundación (H´ = 1.8), mientras que los crustáceos se comportaron de manera inversa donde la diversidad máxima se obtuvo en la máxima inundación (H´ = 2.1) y en la inundación menor presentaron la menor diversidad (H´ = 1.5) (figs. 1C, 2B, 3B).
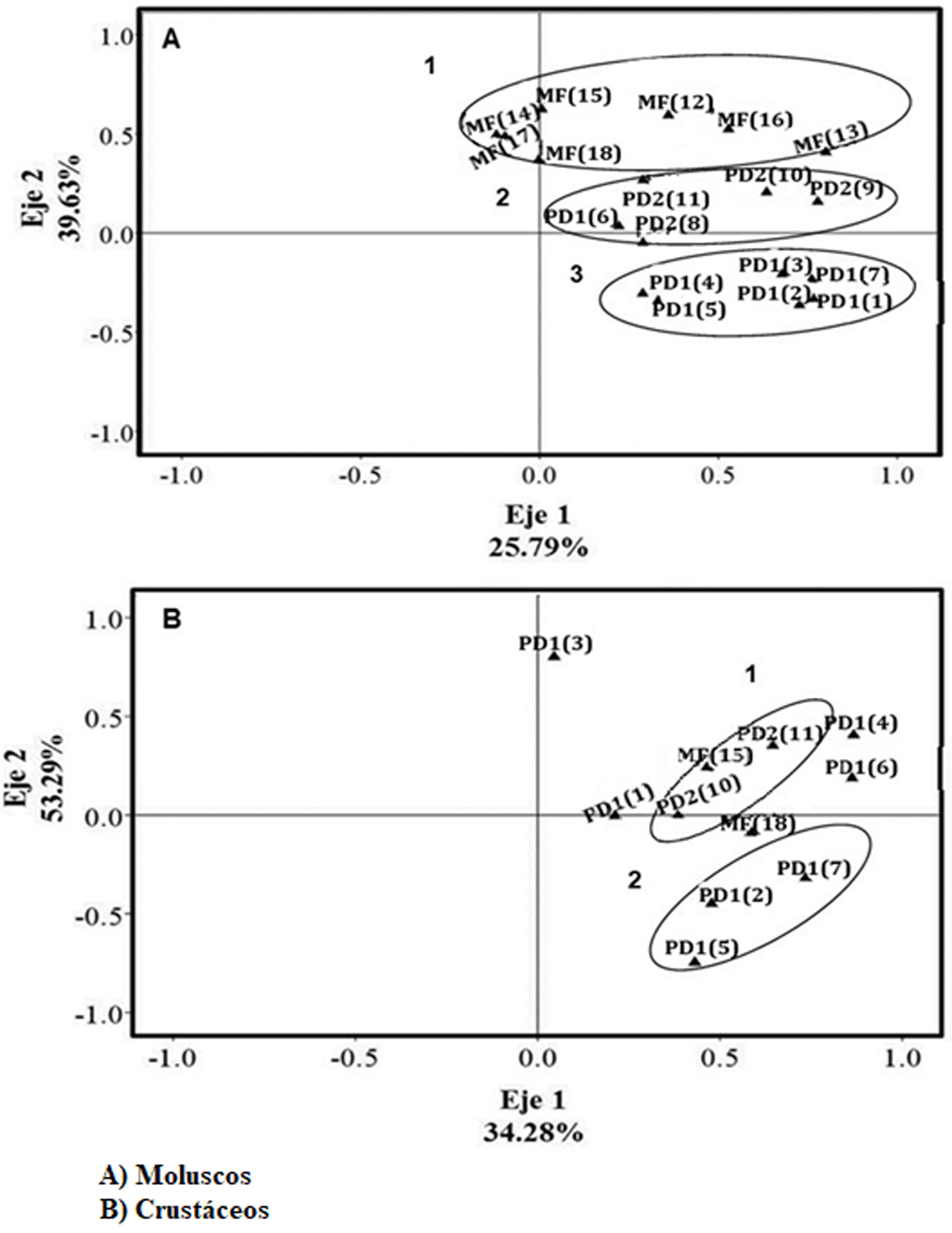
El ACP realizado para los moluscos explicó el 65.42% de la variación espacial en los 2 primeros componentes (fig. 4A). La ordenación determinó la formación de 3 grupos: 1) conformado por los gasterópodos Neocyclotus dysoni (Pfeiffer, 1851), Pachychilus indiorum (Morelet, 1849), P. schumoi (Pilsbry, 1931), y Pachychilus sp. (Lea, 1850) entre otras, ubicadas en la zona MF, 2) grupo constituido por las especies Drepanotrema lucidum (Pfeiffer, 1839), Cyrtonaias tampicoensis, Potamilus alatus distribuidas en las localidades de la zona PD2 y 3) grupo representado por Biomphalaria obstructa, Mytilopsis leucophaeta (Conrad, 1831) y Neritina usnea de la zona PD1 (fig. 4A). En el caso de los crustáceos la ordenación de las localidades en el ACP en sus 2 primeros componentes explicó 87.57% de la variación espacial total (fig. 4B). Dicho análisis ordenó a las localidades en 2 grupos: 1) constituido por las especies no identificadas del género Macrobrachium ubicadas en las zonas PD2 y MF y el 2) representado por las especies Penaeus aztecus (Ives, 1891), P. duorarum y Callinectes similis (Williams, 1966) de las localidades de la zona PD1 (fig. 4B).
Tabla 3
Matriz de abundancia de moluscos y crustáceos por sitio y zona en la cuenca del río Usumacinta. México.
|
Tabla 3 Continuación. |
|||||||||||||||||||||
|
Zona |
|
Planicie delta 1 |
Planicie delta 2 |
Montaña fluvial |
Abundancia total |
Peso total (kg) |
|||||||||||||||
|
Especie/Localidad |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
||
|
Zona |
|
Planicie delta 1 |
Planicie delta 2 |
Montaña fluvial |
Abundancia total |
Peso total (kg) |
|||||||||||||||
|
Especie/Localidad |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
||
|
Mollusca |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aroapyrgus sp. |
As |
22 |
|
149 |
|
|
|
|
|
131 |
55 |
|
11 |
34 |
|
1 |
15 |
|
1 |
419 |
0.01 |
|
Averellia coactiliata |
Ac |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
|
|
|
2 |
0 |
|
Biomphalaria obstructa |
Bo |
3 |
|
59 |
1 |
|
|
11 |
|
|
|
|
|
|
|
|
|
|
|
74 |
0 |
|
Bulimulus unicolor |
Bu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
4 |
0.01 |
|
Cochliopina francesae |
Cf |
529 |
46 |
16,223 |
|
|
8 |
3 |
|
400 |
98 |
|
28 |
45 |
|
2 |
27 |
|
|
17,409 |
0.43 |
|
Corbicula fluminea |
Cof |
|
|
717 |
|
|
|
|
|
|
9 |
9 |
6 |
10 |
18 |
136 |
2 |
1 |
|
908 |
0.95 |
|
Drepanotrema lucidum |
Dl |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
1 |
0 |
|
Eupera sp. |
Es |
14 |
|
938 |
|
13 |
|
7 |
|
12 |
33 |
|
|
1 |
|
2 |
|
|
|
1,020 |
0.19 |
|
Hebetancylus excentricus |
He |
44 |
2 |
37 |
|
|
|
1 |
|
2 |
22 |
|
11 |
18 |
|
|
|
|
|
137 |
0 |
|
Planorbella duryi |
Hd |
222 |
16 |
340 |
|
|
|
153 |
|
7 |
4 |
|
|
|
|
|
3 |
|
|
745 |
0.03 |
|
Hidrobido sp. |
Hs |
1,037 |
111 |
1,630 |
|
|
|
7 |
|
28 |
91 |
|
|
6 |
|
2 |
21 |
|
|
2,933 |
0.04 |
|
Lamellaxis micra |
Lm |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
5 |
0 |
|
Cyrtonaias tampicoensis |
Lat |
|
|
37 |
|
|
|
|
|
|
35 |
|
|
|
|
|
|
|
|
72 |
1.12 |
|
Lucidella lirata |
Ll |
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
6 |
0 |
|
Melanoides tuberculata |
Mt |
132 |
|
36,897 |
|
|
|
|
427 |
|
10 |
113 |
|
|
|
|
|
|
|
37,579 |
3.88 |
|
Mytilopsis leucophaeata |
Ml |
75 |
60 |
9 |
|
136 |
|
7 |
|
|
|
|
|
|
|
|
|
|
|
287 |
0.01 |
|
Neocyclotus dysoni |
Nd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
|
|
|
12 |
0.01 |
|
Neritina usnea |
Nr |
636 |
185 |
42 |
|
76 |
|
41 |
|
|
|
|
|
|
|
|
|
|
|
980 |
7.83 |
|
N. virginea |
Nv |
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
0 |
|
Helicina oweniana |
Oo |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
8 |
|
|
|
9 |
0 |
|
Pachychilus indiorum |
Pi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
0.01 |
|
P. schumoi |
Ps |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
8 |
0.01 |
|
Pachychilus sp. |
Pas |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
17 |
22 |
0.1 |
|
Physido sp. |
Phs |
34 |
1 |
178 |
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
219 |
0.21 |
|
Polymesoda arctata |
Pa |
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
0.17 |
|
Pomacea flagellata |
Pf |
57 |
10 |
176 |
2 |
1 |
|
1 |
16 |
25 |
44 |
2 |
5 |
4 |
|
|
2 |
|
|
345 |
3.45 |
|
Potamilus alatus |
Poa |
|
|
69 |
|
|
|
|
15 |
6 |
|
5 |
|
|
|
|
|
|
|
95 |
0.65 |
|
Pyganodon grandis |
Pg |
|
|
21 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21 |
0.38 |
|
Pyrgophorus coronatus |
Pc |
279 |
35 |
4,430 |
|
34 |
1 |
126 |
|
|
|
|
|
1 |
|
|
|
|
|
4,906 |
0.08 |
|
Rangia cuneata |
Rc |
11 |
|
|
|
23 |
|
|
|
|
|
|
|
|
1 |
7 |
|
|
|
42 |
0.26 |
|
Tortaxis sp. |
Ss |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
0 |
|
Stenophysa impluviata |
Si |
86 |
1 |
225 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
313 |
0.01 |
|
Succinea undulata |
Su |
|
|
|
|
|
|
|
|
3 |
8 |
|
1 |
|
|
|
|
|
|
12 |
0 |
|
Tarebia granifera |
Tg |
|
|
165,963 |
|
|
21 |
1 |
|
|
|
|
|
|
9 |
1 |
3 |
|
|
165,998 |
13.03 |
|
Unionido sp. |
Us |
5 |
|
57 |
|
|
1 |
|
|
|
7 |
|
|
|
|
|
|
|
|
70 |
0.06 |
|
Crustacea |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Armases cinereum |
Arc |
21 |
20 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
42 |
0 |
|
Callinectes similis |
Cs |
19 |
3 |
|
|
6 |
|
5 |
|
|
|
|
|
|
|
|
|
|
|
33 |
0.23 |
|
Discapseudes mexicanus |
Dm |
2 |
|
|
|
14 |
|
9 |
|
|
|
|
|
|
|
|
|
|
|
25 |
0 |
|
Penaeus aztecus |
Fa |
|
3 |
|
7 |
9 |
2 |
111 |
|
|
|
|
|
|
|
|
|
|
|
132 |
0.01 |
|
P. duorarum |
Fd |
34 |
14 |
20 |
105 |
10 |
2 |
296 |
|
|
|
|
|
|
|
|
|
|
|
481 |
0.05 |
|
Hyalella azteca |
Ha |
18 |
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
0 |
|
Macrobrachium acanthurus |
Ma |
6 |
|
2 |
45 |
|
|
32 |
|
|
|
|
|
|
|
1 |
|
|
|
86 |
0.03 |
|
M. carcinus |
Mc |
1 |
|
4 |
38 |
|
105 |
|
|
|
|
1 |
|
|
|
|
|
|
|
149 |
0.07 |
|
Macrobrachium sp. |
Ms |
106 |
1 |
|
87 |
11 |
226 |
63 |
|
|
75 |
10 |
|
|
|
1 |
|
|
1 |
581 |
0.11 |
|
Potamocarcinus hartmanni |
Ph |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
1 |
0.04 |
|
Potimirim mexicana |
Pm |
|
|
|
1 |
1 |
7 |
1 |
|
|
5 |
2 |
|
|
|
|
|
|
|
17 |
0.01 |
|
Procambarus sp. |
Prs |
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
0 |
|
Uhlorchestia uhleri |
Uu |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
0 |
En la figura 5 se encuentra el ACP donde se forman 5 grupos de especies y explica el 68.21% de la variación total en los 2 primeros componentes, siendo las variables de mayor peso: variables del hábitat (tipo de vegetación, textura del sustrato) y tipo de ambiente (léntico, lótico) en conjunto con la matriz de presencia/ausencia de especies (moluscos y crustáceos). El primer grupo conformado por los gasterópodos Pachychilus sp., P. schumoi, P. indiorum, Helicina oweniana (Pfeiffer, 1848), Tortaxis sp. (Baker, 1939), Bulimulus unicolor (Sowerby, 1849), Lamellaxis micra (d’Orbigny, 1835), Averellia coactiliata (Férussac, 1838), Succinea undulata (Morelet, 1849), Lucidella lirata (Pfeiffer, 1847), las cuales se asociaron con hábitats en sustratos arenosos y corriente fuerte presentes en ambientes lóticos y predominantemente en la zona MF. Un segundo grupo de especies, principalmente de moluscos gasterópodos Aroapyrgus sp. (H. B. Baker, 1931), Neocyclotus dysoni, Drepanotrema lucidum y el crustáceo P. aztecus, se encontraron asociados al hábitat de corriente moderada registrada principalmente en ambientes lénticos en la zona PD1. El tercer grupo constituido por los bivalvos Corbicula fluminea y Eupera sp. (Bourguignat, 1854) y el gasterópodo Hidrobido sp. (Stimpson, 1865), asociados con la vegetación emergente Hymenocallis littoralis (Jacq.) Salisbury y Sagittaria lancifolia L. en ambientes lóticos principalmente en la zona MF. Un cuarto grupo conformado de manera equitativa por especies de moluscos como P. flagellata, Pyganodon grandis, Physido sp. (Fitzinger, 1833), M. tuberculata, Pyrgophorus coronatus (Pfeiffer, 1840), Neritina usnea y N. virginea; y por los crustáceos Discapseudes mexicanus (Gutu, 2006), Armases cinereum (Bosc, 1802), Procambarus sp. (Ortmann, 1905) y Macrobrachium carcinus (Linnaeus, 1758), asociados a la vegetación flotante de las especies Eichhornia crassipes (Mart.) (Solms, 1883) y Salvinia auriculata (Aubl, 1775) preferentemente en la zona PD1. Por último, un quinto grupo representado por los crustáceos P. duorarum, Potimirim mexicana (de Saussure, 1857), Macrobrachium sp., M. acanthurus, Hyalella azteca (De Saussure, 1858), Callinectes similis, Potamocarcinus hartmanni (Pretzmann, 1975), Uhlorchestia ulheri (Shoemaker, 1930) y por los moluscos Polymesoda arctata (Deshayes, 1854), Planorbella duryi (Wetherby, 1879), C. tampicoensis, B. obstructa, Rangia cuneata, Stenophysa impluviata (Morelet, 1848), P. alatus, Hebetancylus excentricus (Morelet, 1851), C. francesae, T. granifera, asociados a sustratos suaves, principalmente lodo, a vegetación libre flotadora (Eichhornia crassipes y Salvinia auriculata), y a vegetación enraizada emergente de Nymphaea jamesoniana (Planch, 1852) en ambientes lénticos en la zona PD1 (fig. 5, tabla 2).
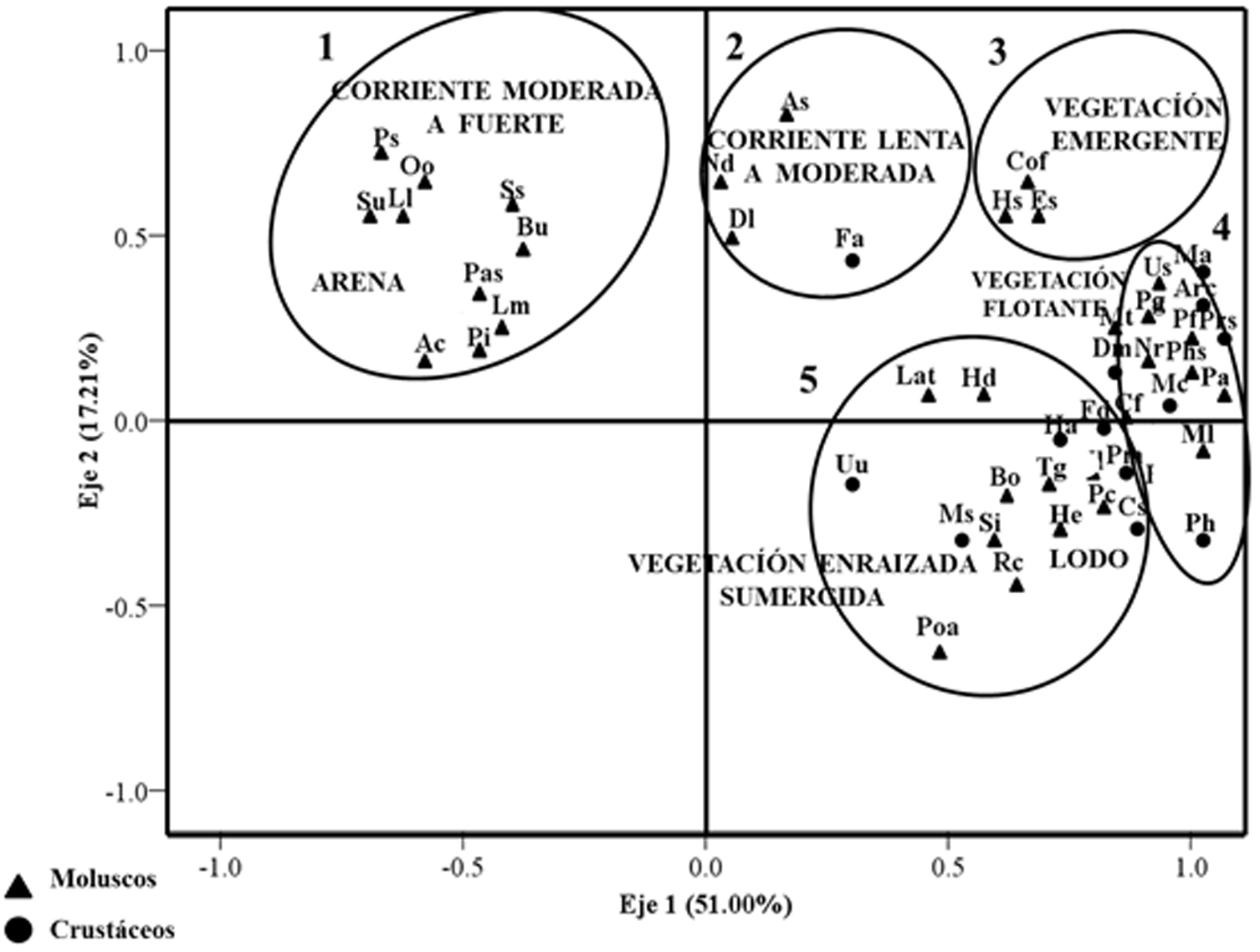
Discusión
La diversidad de moluscos registrada en el presente estudio representó el 53.8% (35 especies) del total de especies registradas para la cuenca Usumacinta (65) lo cual refleja una diversidad alta, un porcentaje importante de las especies reportadas pertenecen a especies semi-terrestres, todas limnéticas y previamente reportadas en pantanos de Centla (Albarrán-Melzer et al., 2009; Barba et al., 2014; Cruz-Ascencio et al., 2003; Rangel-Ruiz et al., 2011). Por el contrario, los crustáceos recolectados en este estudio representaron 24% (13 especies) del total registrado para crustáceos Malacostracos y Eumalacostracos (Peracaridos, Carideos, Peneidos y Brachiuros), mientras que en las bases de datos del SNIB (Conabio) se registran 54 especies para la cuenca Usumacinta, lo que representa una baja diversidad recolectada. Sin embargo, cabe señalar que en el caso de los registros de la Conabio se incluyen especies de cangrejos brachiuros (20 sp.), que en su mayoría son especies asociadas con manglares y especies semiterrrestres recolectadas de manera manual o con trampas. Otro caso es el de los camarones carideos (18 sp.), donde varias de esas especies tienen hábitat específicos en zonas estuarinas como pastos marinos y manglares. La ausencia de estos grupos de decápodos y hábitat en este estudio se explica por la restringida influencia marina temporal en la zona de estudio y porque los muestreos se restringieron a ambientes limnéticos, algunos de ellos con influencia marina temporal. Además de que no se realizaron muestreos en zonas de anegación temporal y durante horas de obscuridad de acuerdo a los hábitos de cada especie (Montalvo et al., 2010; Sánchez y Barba, 2005).
No obstante, cabe señalar que los resultados obtenidos en la zona de estudio reflejan que la mayor diversidad de crustáceos se registró en la PD1 para ambos tipos de ambientes (lóticos y lénticos). Sin embargo, la diversidad y la heterogeneidad de las condiciones del hábitat fueron cambiando entre las zonas. La zona PD1 presentó vegetación palustre, vegetación libre flotadora, vegetación sumergida, palmar y popal (Ocaña y Lot, 1996), corrientes de agua de lentas a moderadas y sustratos suaves constituidos por lodos y arenas, lo que constituyó la zona con mayor número de hábitats para la fauna (Barba y Sánchez, 2007). La zona PD2 estuvo representada por hábitats con sustratos arenosos y corriente fuerte presente en ambientes lóticos donde dominaron moluscos gasterópodos, y en la zona MF asociada con la vegetación emergente Hymenocallis littoralis y Sagittaria lancifolia y conformada por moluscos gasterópodos.
El análisis de ordenación de las zonas realizado con la presencia-ausencia de organismos (moluscos y crustáceos) reflejó agrupaciones claras que distinguen de manera precisa la separación de la PD1 para ambos grupos. En esta zona se registró la mayor variedad de hábitats y los máximos valores de abundancia para los moluscos y crustáceos (abundancia > 90%) en este estudio, principalmente en los ambientes lénticos. En estos ambientes se registró el mayor número de especies de moluscos (23 especies), en comparación con los ambientes lóticos (16 especies). Los crustáceos presentaron sus máximos valores de diversidad en esta zona, lo cual se relaciona con los servicios ambientales que proveen los hábitats con vegetación, así como la elevada complejidad estructural que ofrecen, por lo cual representan hábitats idóneos como áreas de refugio, alimentación y reproducción para los organismos (Barba y Sánchez, 2007; Cetra y Petrere, 2007; Genkai-Kato, 2007; Rozas y Minello, 2006; Sánchez et al., 2012).
Las especies B. obstructa, Neritina usnea, N. virginea, P. arctata, P. grandis, Tortaxis sp., S. impluviata y la mayoría de crustáceos presentaron una distribución restringida en la zona PD1, lo cual coincide con el área de distribución de estas especies con afinidad a condiciones estuarinas (Álvarez et al., 2005). En esta zona se evidenció una elevada presencia de materia orgánica que favoreció la presencia de especies detritívoras como C. francesae y de algunos crustáceos como Potimirim mexicana, Rhithropanopeus harrisii, H. azteca y algunas especies de Macrobrachium, las cuales están asociadas con las raíces de lirio acuático y ocasionalmente con sustratos de fondos lodosos u oquedades en los troncos hundidos (Álvarez et al., 2005; Barba y Sánchez, 2007; Montalvo et al., 2010).
En la zona Planicie delta 2 (PD2) las especies con una distribución restringida fueron D. lucidum, S. undulata y P. hartmanni. Los valores de densidad para esta zona fueron intermedios para ambos grupos y máximos de diversidad para los moluscos, mientras que para los crustáceos se registraron los valores mínimos de diversidad. En esta zona se evidenciaron los cambios en el uso de suelo debido principalmente a la agricultura y la ganadería (March y Castro, 2010), donde la vegetación predominante correspondió a pastizales y matorrales riparios consecuencia de las actividades antropogénicas que generan cambios en las márgenes de los ambientes acuáticos, estos cambios pueden generar una disminución de la riqueza y de la abundancia de las especies (Sánchez y Barba, 2005).
Con respecto a la zona MF se presentaron los valores mínimos de abundancia para ambos grupos y de diversidad para los moluscos. Las especies restringidas para esta zona fueron los gasterópodos B. unicolor, N. dysoni, O. oweniana, Pachychilus sp., P. indiorum y P. schumoi. De éstas, Pachychilus representa un recurso consumible en el sureste del país (Rangel-Ruiz y Gamboa-Aguilar, 2005). Estas zonas presentan un mejor estado de conservación, donde predomina la vegetación de la selva alta perenifolia (March y Castro, 2010), sin embargo se apreciaron zonas con cambio de uso de suelo, aunque en menor proporción que en la zona PD2.
El registro de los moluscos invasores M. tuberculata, T. granifera y C. fluminea, que dominaron la densidad total de los moluscos con el 85% y registraron la mayor representación en los ambientes lénticos, coincidió con lo mencionado por Albarrán-Melzer et al. (2009), Contreras-Arquieta et al. (1995) y Cruz-Ascencio et al. (2003) para el caso de los thiaridos. La zona PD1 presentó la mayor abundancia de M. tuberculata y T. granifera, lo cual está de acuerdo con otros trabajos que evidenciaron su preferencia por ambientes lénticos en la zona baja de la planicie de inundación (Albarrán-Melzer et al. 2009; Barba et al., 2014; Contreras-Arquieta et al. 1995; Cruz-Ascencio et al. 2003), mientras que C. fluminea estuvo mejor representada en la zona MF en ambientes lóticos, de velocidad rápida, aguas oxigenadas y sustratos arenosos, lo cual concuerda con otros trabajos en el sureste, como el estudio realizado en los ríos Tuxpan y Tecolutla por López-López et al. (2009).
Temporalmente tanto en los ambientes lénticos y lóticos, los moluscos estuvieron mejor representados en la época de mín-I, principalmente en la zona PD2, lo que probablemente se deba a la menor profundidad en dicha temporada, mayor temperatura del agua, mayor penetración luminosa que favorece la producción primaria, además de la presencia de vegetación acuática, la cual ofrece protección y un aumento en la variedad de hábitats que repercuten en una mayor diversidad de organismos (Barba y Sánchez, 2007; Cetra y Petrere, 2007; Genkai-Kato, 2007). Mientras que la distribución temporal de los crustáceos, tanto en los ambientes lénticos como en los lóticos, mostró su mayor diversidad registrada para la zona PD1, la cual ofrece una amplia variedad de hábitats dada por la presencia de vegetación acuática (flotante y sumergida) y ribereña (Barba y Sánchez, 2007).
Los resultados muestran a nivel cuenca que 4 especies de la malacofauna y carcinofauna fueron dominantes: los gastrópodos invasores Melanoides tuberculata y Tarebia granifera y los crustáceos Macrobrachium sp. y Penaeus duorarum. Sin embargo, la máxima diversidad de moluscos fue en PD2, y la de crustáceos en la zona PD1 y la mínima en la zona MF, esto concuerda con otros estudios donde en la zona con influencia estuarina convergen organismos con preferencias y tolerancias marinas, estuarinas y dulceacuícolas, lo cual incrementa la diversidad, espacial y temporalmente. La hipótesis se cumple al encontrarse los valores de máxima diversidad en las zonas de planicie tanto estuarina (PD1) como en la zona de planicie fluvial (PD2), donde además se registró la máxima heterogeneidad de hábitats.
Agradecimientos
Agradecemos a la Comisión Federal de Electricidad (CFE) por el financiamiento otorgado. Al Sistema Nacional de Información sobre Biodiversidad de la Comisión Nacional de la Biodiversidad (SNIB- Conabio) por facilitar las bases de datos de registros en colecciones y proyectos financiados (AA011, AS019, G034, HC001, HC024, M068, U046, Y015). Al personal de las reservas y áreas naturales protegidas por su apoyo, a las autoridades de las comunidades: de La Libertad, Calatraba, Frontera Corozal, Marqués de Comillas, Chis.; Palizada, Camp.; Canitzán, Estapilla y Salsipuedes, Tab.
Referencias
Albarrán-Melzer, N. C., Rangel-Ruiz, L. J. y Gamboa Aguilar, J. (2009). Distribución y abundancia de Melanoides tuberculata (Gastropoda: Thiaridae) en la Reserva de la Biosfera Pantanos de Centla, Tabasco, México. Acta Zoológica Mexicana, 25, 93–104.
Álvarez-Noguera, F. y Hernández-Álvarez. C. (2004). Computarización de la Colección Nacional de Crustáceos del Instituto de Biología, UNAM y elaboración de su catálogo. México D.F.: Universidad Nacional Autónoma de México, Instituto de Biología. Bases de datos SNIB-Conabio proyecto No. U046.
Álvarez, F., Villalobos, J. L. y Lira, E. (1996). Decapoda. II. Grupos de Arachnida y Crustacea. En J. Llorente-Bousquets, A. N. García-Aldrete y E. S. González (Eds.), Biodiversidad, taxonomía y biogeografía de artrópodos de México: hacia una síntesis de su conocimiento (pp. 103–132). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Bayer/ Facultad de Ciencias, Universidad Nacional Autónoma de México.
Álvarez, F., Villalobos-Hiriart, J. L. y Robles, R. (2005). Crustáceos. En J. Bueno, F. Álvarez y S. Santiago (Eds.). Biodiversidad del estado de Tabasco. México, D.F.: Instituto de Biología, Universidad Nacional Autónoma de México, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. (pp. 177–194).
Avendaño-Gil, M. J. (2004). Inventario de gasterópodos terrestres y dulceacuícolas del área focal de Ixcán, Chiapas. México D.F.: Instituto de Historia Natural y Ecología. Bases de datos SNIB-Conabio proyecto No. Y015.
Barba, E., Alva-Juárez, M. y Calva-Benítez, L. (2013). Guía ilustrada para la identificación de plantas acuáticas en humedales de Tabasco. Villahermosa: El Colegio de la Frontera Sur.
Barba, E., Juárez-Flores, J. y Estrada-Loreto, F. (2010). Distribución y abundancia de crustáceos en humedales de Tabasco, México. Revista Mexicana de Biodiversidad, 81, 153–163.
Barba, E., Magaña-Vázquez, M. y Juárez-Flores, J. (2014). Nuevos registros de los gasterópodos Melanoides tuberculata (Muller, 1974) y Tarebia granifera (Lamarck, 1822) en las cuencas Grijalva, Usumacinta y Tonalá, Pajonal-Machona, Tabasco. En M. A. Low Pfeng, P. A. Quijon y E. M. Peters-Recagno (Eds.), Especies invasoras acuáticas: casos de estudio en ecosistemas de México (pp. 359–379). México D.F.: Semarnat (Secretaría de Medio Ambiente y Recursos Naturales), INECC (Instituto Nacional de Ecología y Cambio Climático) y UPEI (University of Prince Edward Island).
Barba, E. y Sánchez, A. J. (2007). A new record of Hyalella azteca Saussure, 1858 (Amphipoda, Hyalellidae) from the Lerma-Chapala Basin, Mexican Pacific coast. Crustaceana, 80, 625–630.
Barba, E., Sánchez, A. J., Raz-Guzmán, A. y Gallegos, M. E. (2000). Dieta natural y tasa de forrajeo del carideo Hippolyte zostericola (Smith) sobre epífitas de Thalassia testudinum Banks et Solander ex König. Hidrobiológica, 10, 139–146.
Barba, E. y Trinidad-Ocaña, C. (2017). Nuevos registros de la almeja asiática invasora Corbicula fluminea (Bivalvia: Veneroida: Cyrenidae) en humedales de las cuencas Papaloapan, Grijalva y Usumacinta. Revista Mexicana de Biodiversidad, 88, 450–453.
Barbour, M. T., Gerritsen, J., Snyder, B. D. y Stribling, J. B. (1999). Rapid bioassessment protocols for use in streams and wadeable rivers: periphyton, benthic macroinvertebrates and fish, Second Edition. EPA 841-B-99-002. Washington, D.C.: U.S. Environmental Protection Agency; Office of Water.
Bousfield, E. L. (1972). Shallow water, Gammaridean Amphipoda of New England. Ithaca, New York: Cornell University Press.
Burch, J. B. y Cruz-Reyes. A. (1987). Clave genérica para la identificación de gastrópodos de agua dulce en México. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Camacho-Sánchez, M. I. (2007). Bioconcentración y toxicidad de metales en el langostino Macrobrachium rosenbergii (de Man) Revista de Toxicología, 24, 14–17
Cetra, M. y Petrere, J. R. M. (2007). Associations between fish assemblages and riparian vegetation in the Corumbataí River Basin (SP). Brazil Journal Biology, 67, 191–195.
Chace, F. J. (1972). The shrimps of the Smithsonian-Bredin Caribbean Expeditions with a summary of the West Indian shallow-water species (Crustacea: Decapoda: natantia). Smithsonian Contributions to Zoology, 98, 1–179.
Conapesca (Comisión Nacional de Acuacultura y Pesca). (2013). Anuario estadístico de acuacultura y pesca. México D.F.: Comisión Nacional de Acuacultura y Pesca.
Conagua (Comisión Nacional del Agua). (2011). Identificación de reservas potenciales de agua para el medio ambiente en México. México D.F.: Secretaría del Medio Ambiente y Recursos Naturales.
Contreras-Arquieta, A., Guajardo-Martínez, G. y Contreras-Balderas, S. (1995). Thiara (Melanoides) tuberculata (Müller, 1774) (Gastropoda: Thiaridae), su probable impacto ecológico en México. Publicaciones Biológicas de la Facultad de Ciencias Biológicas de la Universidad Autónoma de Nuevo León, 8, 17–24.
Cruz-Ascencio, M., Florido, R., Contreras-Arquieta, A. y Sánchez, A. J. (2003). Registro del caracol exótico Thiara (Melanoides) tuberculata (Müller, 1774) (Gastropoda: Thiaridae) en la Reserva de la Biosfera Pantanos de Centla. Universidad y Ciencia, 19, 101–103.
Cumberlidge N., Peter, K. L., Darren, C. J., Magalhães, C., Campos, M. R., Álvarez, F. et al. (2009). Freshwater crabs and the biodiversity crisis: importance, threats, status, and conservation challenges. Biological Conservation, 142, 1665–1673.
Díaz, H. y Rodríguez, G. (1977). The branchial chamber of some terrestrial and semiterrestrial crabs. Biological Bulletin, 153, 485–504.
Elías-Gutiérrez, M. (2006). Estudio comparativo del zooplancton en dos regiones de México. México D.F.: El Colegio de la Frontera Sur, Bases de datos SNIB-Conabio proyecto No. AS019.
Genkai-Kato, M. (2007). Macrophyte refuges, prey behaviour and trophic interactions: consequences for lake water clarity. Ecology Letters, 10, 105 –114.
Gibbs, J. P. (1993). Importance of small wetlands for the persistence of local populations of wetland associated animals. Wetlands, 13, 25–31.
Hammer, Ø., Harper, D. A. T. y Ryan, P. D. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 4, 1–9.
Hershler, R. y Thompson, F. G. (1992). A review of the aquatic gastropod subfamily Cochliopinae (Prosobranchia: Hydrobiidae). Malacological Review Supplement, 5, 1–140.
Holthuis, L. B. (1949). Note on the species of Palaemonetes (Crustacea Decapoda) found in the United States of America. Proceedings van de Koninklijke Nederlandsche Akademie van Wetenschappen, 52, 87–95.
Holthuis, L. B. (1950). Preliminary descriptions of twelve new species of Palaemonid prawns from American waters (Crustacea Decapoda). Proceedings Koninklijke Nederlandse Akademie van Wetenschappen, 53, 93–99.
Keithly J., Brooker, J., DeForest, D. K., Wu, B. K. y Brix, K.V. (2004). Acute and chronic toxicity of nickel to a cladoceran (Ceriodaphnia dubia) and an amphipod (Hyalella azteca). Environmental Toxicology and Chemistry, 23, 691–696.
Kolb, M. y Galicia, L. (2012). Challenging the linear forestation narrative in the Neo-tropic: regional patterns and processes of deforestation and regeneration in southern Mexico. The Geographical Journal, 178, 147–161.
Krebs, C. J. (1989). Ecological methodology. New York: Harper Collins Publishers.
Laino-Guanes, R., González-Espinosa, M., Ramírez-Marcial, N., Bello-Mendoza, R., Jiménez, F., Casanove, F. et al. (2016). Human pressure on water quality and water yield in the upper Grijalva river basin in the Mexico-Guatemala border. Ecohydrology & Hydrobiology, 16, 149 –159.
López-López, E., Sedeño-Díaz, J. E., Tapia-Vega, P. y Oliveros, E. (2009). Invasive mollusks Tarebia granifera Lamarck, 1822 and Corbicula fluminea Müller, 1774 in the Tuxpan and Tecolutla rivers, Mexico: spatial and seasonal distribution patterns. Aquatic Invasions, 4, 435–450.
Mantel, L. H. y Farmer, L. L. (1983). Osmotic and ionic regulation. En D. Bliss y L. Mantel (Eds.), The biology of Crustacea, Vol. 5. Internal anatomy and physiological regulation (pp. 53–161). New York: Academic Press.
March, M. I. y Castro, M. (2010). La cuenca del Río Usumacinta: perfil y perspectivas para su conservación y desarrollo sustentable. En H. Cotler-Ávalos (Eds.), Las cuencas hidrográficas de México. Diagnóstico y priorización (pp. 193–197). México D.F.: Secretaría de Medio Ambiente y Recursos Naturales/ Instituto Nacional de Ecología/ Fundación Gonzalo Río Arronte.
McCune, B. y Grace, J. B. (2002). Analysis of ecological communities. Gleneden Beach, Oregon: MjM Software Design.
Montalvo, H., Sánchez, A. J., Florido, R. y Macossay-Cortez, A. A. (2010). Lista de crustáceos distribuidos en troncos hundidos en el humedal tropical Pantanos de Centla, al sur del golfo de México. Revista Mexicana de Biodiversidad, 81, 121–131.
Naranjo-García, E. y Meza-Meneses, G. (2000). Moluscos. En G. De la Lanza, P. S. Hernández y P. J. Carbajal (Eds.), Organismos indicadores de la calidad del agua y de la contaminación (bioindicadores) (pp. 304–404). México D.F.: Comisión Nacional del Agua/ Instituto de Biología, Universidad Nacional Autónoma de México.
Naranjo-García, E. y Olivera-Carrasco, M. T. (2014). Moluscos dulceacuícolas introducidos e invasores. En R. Mendoza y P. Koleff (Eds.), Especies acuáticas invasoras en México (pp. 337–345). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Ocaña, D. y Lot, A. (1996). Estudio de la vegetación acuática vascular del sistema fluvio-lagunar-deltaico del río Palizada Campeche, México. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, serie Botánica, 67, 303–327.
Pennak, R. W. (1978). Freshwater invertebrates of the United States. New York: Wiley.
Quiroz-Vázquez, P. (2012). Base de datos de la colección de zooplancton de agua dulce de ECOSUR, Chetumal. El Colegio de la Frontera Sur. Bases de datos SNIB-Conabio proyecto No. HC001. Quintana Roo, México.
Ramírez, A. (1999). Ecología aplicada. Diseño y análisis estadístico. Bogotá: Fundación Universitaria Jorge Tadeo Lozano.
Rangel-Ruíz, L. J. (2000). Estudio taxonómico de moluscos terrestres y dulceacuícolas de la región maya de México I. Reserva de la Biosfera Pantanos de Centla. México, D.F.: Universidad Juárez Autónoma de Tabasco. Bases de datos SNIB-Conabio proyectos No. M068 y G034.
Rangel-Ruiz, L. J. y Gamboa-Aguilar, J. (2005). Moluscos gasterópodos. En. J. Bueno, F. Álvarez y S. Santiago (Eds.), Biodiversidad del estado de Tabasco (pp. 167–176). México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Rangel-Ruiz, L. J., Gamboa-Aguilar, J., García-Morales, M. y Ortiz-Lezama, O. M. (2011). Tarebia granifera (Lamarck, 1822) en la región hidrológica Grijalva-Usumacinta en Tabasco, México. Acta Zoológica Mexicana, 27, 103–114.
Rathbun, M. J. (1898). The Brachyura of the Biological Expedition to the Florida Keys and the Bahamas in 1893. Bulletin from the Laboratories of Natural History of the State University of Iowa, 4, 250–294.
Rathbun, M. J. (1930). The cancroid crabs of America of the families Euryalidae, Portunidae, Atelecyclidae, Cancridae, and Xanthidae. Bulletin of the United States National Museum, I–XVI, 1–609.
Raz-Guzmán, A. (2000). Crustáceos y poliquetos. En G. De la Lanza, P. S. Hernández y P. J. L. Carbajal. (Eds.), Organismos indicadores de la calidad del agua y de la contaminación (bioindicadores) (pp. 265–307). México D.F.: Plaza y Valdés.
Raz-Guzmán, A., Sánchez, A. J. y Soto, L. A. (1992). Catálogo ilustrado de cangrejos braquiuros y anomuros (Crustacea) de la Laguna de Alvarado, Veracruz, México. Cuaderno 14. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Reguero-Reza, M. M., Ortigosa-Gutiérrez, J. D., Lozada-Flores O. y Rodríguez-Sobreyra, R. (2012). Computarización sistemática de los bivalvos y gasterópodos de la sección húmeda de la Colección Malacológica Dr. Antonio García-Cubas. México D.F.: Universidad Nacional Autónoma de México. Instituto de Ciencias del Mar y Limnología. Bases de datos SNIB-Conabio. Proyecto No. HC024.
Rodríguez, J. P., Beard, T. D., Agard, J., Bennett, E., Cork, S., Cumming, G. et al. (2005). Interactions among ecosystem services. Ecosystems and human well-being: scenarios. Vol. II. En P. L. Carpenter, E. M. Pingali, S. R. Bennett y M. B. Zurek. (Eds.), Findings of the scenarios working group, Millennium Ecosystem Assessment (pp. 431–448). Washington D.C.: Island Press
Rozas, L. P. y Minello, T. J. (2006). Nekton use Vallisneria americana Michx. (wild celery) beds and adjacent habitats in coastal Louisiana. Estuaries and Coasts, 29, 297–310.
Russell, K. R., Guynn, D. C. y Hanlin, H. G. (2002). Importance of small isolated wetlands for herpetofaunal diversity in managed, young growth forests in the Coastal Plain of South Carolina. Forest Ecology and Management, 163, 43–59.
Sánchez, A. J. y Barba, E. (2005). Biodiversidad de Tabasco. En J. Bueno, F. Álvarez y S. Santiago (Eds.), Biodiversidad del estado de Tabasco (pp. 1–16). México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Sánchez, A. J., Florido, R., Salcedo, M. A., Ruiz-Carrera, V., Montalvo-Urgel, H. y Raz-Guzmán, A. (2012). Macrofaunistic diversity in Vallisneria americana Michx. in a tropical wetland, Southern Gulf of Mexico. En A. Mahamane (Eds.), Diversity of ecosystems (pp. 1-26). Zagreb, Croatia: InTech.
Sánchez, A. J., Salcedo, M. A., Florido, R., Mendoza, J. D, Ruiz-Carrera, V. y Álvarez-Pliego, N. (2015). Ciclos de inundación y conservación de servicios ambientales en la cuenca baja de los ríos Grijalva-Usumacinta. Contactos, 97, 5–14.
Schertzinger, G., Ruchter, N. y Sures, B. (2018). Metal accumulation in sediments and amphipods downstream of combined sewer overflows. Science of The Total Environment, 616–617, 1199–1207.
Thorp, J. H. y Covich, A. P. (1991). Ecology and classification of North American freshwater invertebrates. San Diego: Academic Press.
Vásquez-Yeomans, L. (2006). Actualización de bases de datos de invertebrados (Rotifera, Cladocera y Copepoda) y peces. México D.F.: El Colegio de la Frontera Sur. Bases de datos SNIB-Conabio proyecto No. AA011.
Velasco, C., Sánchez, A. J. y Florido, R. (2005). New locality record of Uhlorchestia uhleri (Peracarida: Amphipoda: Talitridae) in the coastal zone of the southern Gulf of Mexico. Crustaceana, 78, 499 –502.
Williams, A. B. (1984). Shrimps, lobsters, and crabs of the Atlantic coast of the Eastern United States, Maine to Florida. Washington D.C.: Smithsonian Institution Press.
Wrange, A., André, C., Lundh, T., Lind, U., Blomberg, A., Jonsson, P. y Havenhand, J. (2014). Importance of plasticity and local adaptation for coping with changing salinity in coastal areas: a test case with barnacles in the Baltic Sea. Evolutionary Biology, 14, 1–14.
