Morfoanatomía floral de Kallstroemia maxima (Zygophyllaceae)
Rosa María Fonseca a, *, Mercedes Eunice Castro-Laportte b y Estela Sandoval-Zapotitla c
a Facultad de Ciencias, Universidad Nacional Autónoma de México, Circuito Exterior s/n, Ciudad Universitaria, 04510 Ciudad de México, México
b Facultad de Agronomía, Universidad Central de Venezuela, Maracay 2101, Aragua, Venezuela
c Jardín Botánico, Instituto de Biología, Universidad Nacional Autónoma de México, Tercer Circuito Exterior s/n, Ciudad Universitaria, 04510 Ciudad de México, México
*Autor para correspondencia: tewamil@hotmail.com (R.M. Fonseca)
Resumen
El objetivo es contribuir al conocimiento de la anatomía floral de Kallstroemia maxima y compararlo con otros géneros relacionados dentro de la familia Zygophyllaceae. Se utilizaron botones florales de 3 plantas de K. maxima recolectados el día previo a la antesis; se procesaron preparaciones permanentes y se hicieron observaciones a partir de fotomicrografías de botones herborizados. Se proporcionan descripciones de algunas estructuras anatómicas no descritas con anterioridad, como son: nectarios opuestos a los sépalos, presencia de un haz vascular compartido por un pétalo y el estambre opuesto a éste, engrosamientos helicoidales en las células epidérmicas de los márgenes de los pétalos, células papilares en la superficie abaxial de los pétalos cerca de su base, número de haces vasculares que irrigan a cada carpelo y la existencia de una cavidad interna en la base del estilo. Los resultados permiten distinguir mejor a K. maxima de los géneros afines dentro de las Zygophyllaceae.
Palabras clave:
Flor; Androceo; Gineceo; Nectarios
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Floral morphoanatomy of Kallstroemia maxima (Zygophyllaceae)
Abstract
The objective is to contribute to the knowledge of the floral anatomy of Kallstroemia maxima and compare it with other related genera within the family Zygophyllaceae. Flower buds obtained from 3 plants of K. maxima were collected a day before to the anthesis. Permanent preparations were processed and observations of photomicrographs from herborizated buds were done. Anatomical descriptions of characters not previously reported are given such as: the nectaries opposed to the sepals, presence of a vascular bundle shared by a petal and the stamen opposite to it, helicoidal thickening of the epidermal cells on the petal margins, papillary cells near the base of the abaxial surface of petals, number of vascular bundles that irrigate each carpel and the existence of an internal cavity at the base of the style. The results allowed us to distinguish better Kallstroemia maxima from related genera in the Zygophyllaceae.
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Flower; Androecium; Gynoecium; Nectaries
Introducción
La familia Zygophyllaceae, considerada dentro del orden Zygophyllales (APG, 2016), está conformada por 22 géneros y aproximadamente 325 especies, con distribución tropical y subtropical asociada a zonas secas (Stevens, 2001). En México, se presentan 32 especies de 8 géneros (Fagonia L., Guaicum L., Kallstroemia Scop., Larrea Cav., Morkillia Rose et Painter, Porlieria Ruiz. et Pav., Sericodes A. Gray y Viscainoa Greene; Villaseñor, 2016). Las 18 especies de Kallstroemia se distribuyen desde el sur de EUA hasta Sudamérica e Indias Occidentales, 14 de las cuales están presentes en México (Turner, 2016).
Engler (1896) dividió a Zygophyllaceae en 4 subfamilias; recientemente, con base en estudios moleculares se propusieron 5 grupos considerados monofiléticos: Larreoideae, Morkilloideae, Seetzenioideae, Tribuloideae y Zygophylloideae (Sheahan, 2007; Sheahan y Chase 2000). A partir de un análisis filogenético con secuencias moleculares (rbcL y trnL-F), Sheahan y Chase (2000) ubicaron a Kallstroemia dentro de la subfamilia Tribuloideae y como hermano de Tribulus, Kelleronia y Tribulopis, con los cuales morfológicamente comparte la presencia de hojas opuestas y paripinnadas con 2-12 pares de foliolos; flores pentámeras con 10 estambres en 2 verticilos desiguales, ausencia de apéndices de los filamentos, frutos con 5 o 10 mericarpos indehiscentes, semillas sin endospermo y polen poliaperturado (Sheahan, 2007). Kallstroemia se diferencia de Kelleronia porque este último género está constituido por arbustos hasta de 1.5 m, mientras que Tribulus, Tribulopis y Kallstroemia son hierbas postradas o ascendentes, rara vez leñosas en su base. A su vez, Kallstroemia se distingue por presentar ovario con 10 lóbulos y fruto con 10 mericarpos, mientras que Tribulus y Tribulopis tienen ovario con 5 lóbulos y frutos con 5 mericarpos (Sheahan, 2007).
Porter (1969a) en su tratamiento de Zygophyllaceae, señaló que Kallstroemia, Kelleronia, Tribulopis y Tribulus son géneros afines que se distinguen porque los estambres de la serie externa están adnados en la base a los pétalos y por la presencia de tejido nectarífero entre los estambres y el perianto. El mismo autor indicó que “entre la base de cada filamento del verticilo interno y el sépalo opuesto a éste, hay un nectario pequeño, ovoide, bilobulado”.
La cercana relación entre Kallstroemia, Kelleronia, Tribulopis y Tribulus fueron evidenciadas por diferentes autores. Sheahan y Cutler (1993), a partir del análisis de la anatomía vegetativa de 37 especies, pertenecientes a 19 géneros, sugirieron que, a excepción de Tribulopis, estos géneros deberían ser separados de los géneros zygophylloides, por lo menos, a nivel de subfamilia. Sheahan y Chase (1996) señalaron que Kallstroemia comparte con Kelleronia y Tribulus, entre otros caracteres, la presencia de tricomas no ramificados, vaina en los haces vasculares de las hojas, ovario sésil, ausencia de apéndices estaminales, frutos con cocos separados en la madurez y semillas sin endospermo.
El estudio de la anatomía de las estructuras florales es importante en la sistemática de diversos grupos de angiospermas (Rudall y Goldblatt, 2000; Rudall et al., 2002). En las Zygophyllaceae se ha señalado la presencia, número, ubicación y forma de las glándulas nectaríferas como un carácter de utilidad para diferenciar taxones (Porter 1969a, 1971). Así, Chauhan (1975) consideró que la presencia de nectarios vascularizados en Balanites y no vascularizados en Tribulus contribuye a diferenciarlos.
El número de lóculos del ovario en la Zygophyllaceae también es un rasgo importante para caracterizar a los diferentes géneros, por ejemplo Sheahan y Chase (2000) mencionaron que Augea puede distinguirse de Zygophyllum por tener 10 lóculos; en la familia frecuentemente se presentan de 4 o 5 lóculos, aunque pueden tener desde 2 hasta 12 (Sheahan, 2007). Singh et al. (2002) también mencionan que la vascularización de los distintos verticilos florales es de interés para la sistemática de esta familia.
Con base en lo expuesto anteriormente, se planteó realizar el estudio de la anatomía floral de Kallstroemia maxima, (L.) Hook. et Arn., para contribuir a su caracterización.
Materiales y métodos
Se obtuvieron botones florales frescos y se recolectaron ramas con flores y frutos para elaborar ejemplares de herbario, a partir de 3 individuos de Kallstroemia maxima, en Yecapixtla, Morelos, México. Los ejemplares fueron herborizados, examinados, medidos y determinados a especie mediante el uso de la clave taxonómica de Porter (1969a). La descripción morfológica de la especie se realizó midiendo y examinando los ejemplares recolectados y fue completada con la descripción proporcionada por Porter (1969a, b). Los ejemplares de respaldo están depositados en el Herbario de la Facultad de Ciencias (FCME) y en el Herbario Nacional de México (MEXU). Los botones frescos fueron fijados en Navashin (Sandoval et al., 2005). Este material fue deshidratado en una serie de alcoholes graduales en base a alcohol ter-butílico (ATB), 35%, 50%, 60%, 70%, 85, 95%, 100% y 3 cambios en ATB absoluto, cada cambio con una duración de 24 horas. Se infiltró e incluyó en parafina de dureza media (punto de fusión 56-58 ºC). Se realizaron cortes en un micrótomo de rotación marca American Optical modelo 820, a un grosor de 12 µm para obtener secciones transversales y longitudinales. Las mismas fueron teñidas con safranina-verde rápido según Sandoval et al. (2005). Se hicieron preparaciones permanentes montadas en resina sintética. Las observaciones y fotomicrografías fueron realizadas en un fotomicroscopio Carl Zeiss-Axioskop, con cámara de video SONY SSC-DC544. Las imágenes se capturaron con el programa Debut y se editaron con el programa Paint Shop-Pro 8.
Para los estudios de microscopía electrónica de barrido se trabajaron 4 botones tomados de los ejemplares herborizados, en 2 de ellos se removieron los pétalos y los sépalos para permitir la vista de estambres y gineceo. Debido a que este material estaba deshidratado, solo se procedió a cubrirlo con oro previamente a su observación en un microscopio JEOL JSM 5310 LV.
Resultados
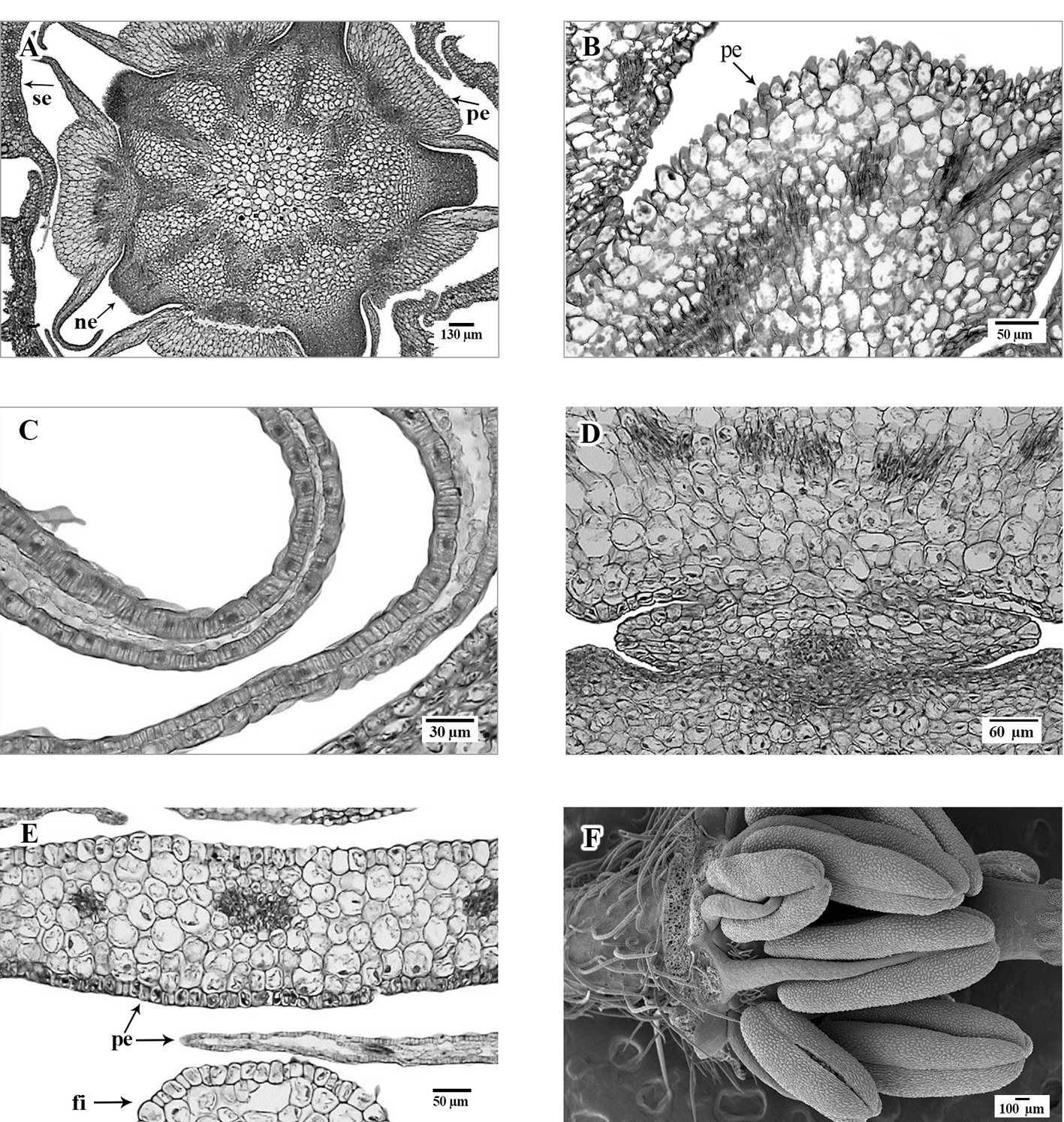
Flores solitarias (fig. 1A), pseudoaxilares, bisexuales, actinomorfas, pentámeras, con pedicelos fistulosos, en la antesis rectos, ca. 1.5 cm de largo, en fruto recurvados, de hasta 4 cm de largo, antrorso-pubescentes; sépalos 5, libres, con disposición quincuncial, lanceolados a estrechamente ovados y marcadamente cóncavos en la base (fig. 1B), de 2.5 a 6 mm de largo, con ápice acuminado, margen escarioso e involuto, adaxialmente glabros, excepto en el primer tercio y cerca del ápice donde presentan tricomas simples, abaxialmente hirsutos, márgenes con tricomas simples; nectarios 5, con forma de cojín, (fig. 1D), situados en la cavidad que forma cada uno de los sépalos en su base; pétalos 5, libres, convolutos, ampliamente obovados o semiorbiculares, de 4 a 9 mm de largo y hasta 7 mm de ancho, amarillos o anaranjados, laminares, con una cresta en la cara abaxial cerca de la base, misma que se pierde hacia la parte media del pétalo; estambres 10, hipóginos, en 2 verticilos, 5 opuestos a los sépalos y ligeramente más cortos que los 5 opuestos a los pétalos, estos últimos adnados a los pétalos en su base; filamentos de 2 a 3.5 mm de largo, anteras ditecas, oblongas, de 0.6 a 1 mm de largo, anaranjadas, con dehiscencia longitudinal, lateral; gineceo sincárpico con ovario súpero, sentado sobre una estructura ligeramente lobulada semiplana, similar a un disco (fig. 1D), ovario cortamente cilíndrico a globoso, con 10 lóbulos y 10 lóculos, con tricomas simples, placentación axial, estilo terminal simple, largamente cónico, ligeramente lobulado, persistente, estigma en forma de domo, con 10 lóbulos evidentes pero someros. Frutos esquizocarpos (fig. 1B), de 5 a 8 mm de diámetro, separándose en 10 mericarpos indehiscentes de 3.4 a 4.5 mm de alto, rara vez con escasos tricomas en la base, pico de 4 a 5 mm de largo, más o menos tan largo o ligeramente más largo que el cuerpo del fruto, glabro, sépalos persistentes, rodeando al fruto.

Florece a lo largo de todo el año, aunque en época seca es muy escasa y las flores se presentan bajo el follaje; es una hierba que crece a lo largo de los caminos, en cultivos y en sitios perturbados, tiene amplia distribución en regiones cálidas de América, desde el sur de Estados Unidos de América hasta el norte de Sudamérica y las Antillas.
El pedicelo consta de una epidermis uniestratificada con células más o menos cuadrangulares de paredes delgadas, presenta tricomas eglandulares, unicelulares, de base bulbosa; zona cortical constituida por células parenquimáticas isodiamétricas, de arreglo compacto; el pedicelo carece de médula y sólo en el extremo adyacente al receptáculo se presenta una médula constituida por células parenquimáticas con un arreglo laxo, algunas de estas células tienen drusas. Sistema vascular arreglado en forma de eustela, conformada por aproximadamente 10 haces vasculares colaterales cerrados.
Receptáculo con epidermis uniestratificada y presencia de tricomas eglandulares unicelulares, parénquima cortical con células isodiamétricas de paredes delgadas, las cuales son de mayor tamaño en la médula. Abundantes drusas en todo el parénquima. Sistema vascular similar al que se presenta en el pedicelo pero con el doble de haces vasculares (fig. 1C).

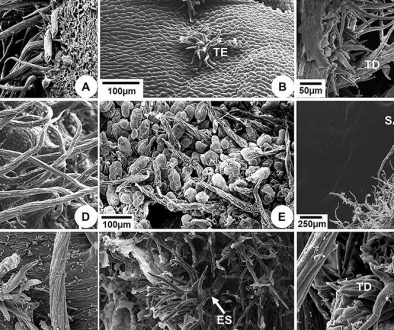
Sépalos con una clara disposición quincuncial, superficie abaxial irregular por la presencia de una roseta de varias células levantadas en la base de cada tricoma (fig. 2A), con epidermis adaxial uniestratificada, cutícula delgada; células de paredes delgadas, en la base de cada sépalo las células epidérmicas tienden a ser rectangulares, angostas y alargadas periclinalmente, mientras que hacia la parte media son isodiamétricas, y en algunos casos papilosas (fig. 2B); la epidermis abaxial es uniestratificada con cutícula delgada, formada por células isodiamétricas a cuadrangulares y alargadas en sentido anticlinal, de mayor tamaño que las de la epidermis adaxial, de paredes delgadas; presencia de estomas anomocíticos, con rebordes cuticulares externos conspicuos y células oclusivas con paredes periclinales engrosadas (fig. 2B); tricomas unicelulares y eglandulares de 2 tipos, el primero de 1.5 a 2 mm de largo, con paredes muy gruesas y lumen amplio, asociados con 9-16 células epidérmicas que forman una roseta de células epidérmicas levantadas, en la base de cada tricoma (fig. 2C, D); el segundo tipo mide hasta 0.5 mm de largo, con paredes delgadas, sin roseta de células en la base, y ubicados principalmente en el margen de los sépalos.
El mesofilo en los sépalos está conformado por parénquima homogéneo, con 5 a 6 estratos de células desde irregulares hasta isodiamétricas con pocos espacios intercelulares (fig. 2B). El número de estratos del parénquima disminuye desde el centro hacia los extremos laterales o márgenes del sépalo, donde se reduce hasta solo uno o ninguno en el margen. Sistema vascular en la base del sépalo conformado por 3 haces vasculares colaterales, los cuales se ramifican más arriba. Los haces principales se ubican hacia la parte central del sépalo y están rodeados por una vaina parenquimática (fig. 2B).
Nectarios con una epidermis uniestratificada, formada por células pequeñas cuadrangulares a isodiamétricas, con paredes delgadas. Parénquima secretor formado por células irregulares hasta isodiamétricas, elípticas o poligonales, con paredes ligeramente engrosadas, núcleo evidente y citoplasma denso, con espacios intercelulares grandes. Presencia de nectarostomas con probable actividad secretora en la parte inferior (fig. 2E, F).
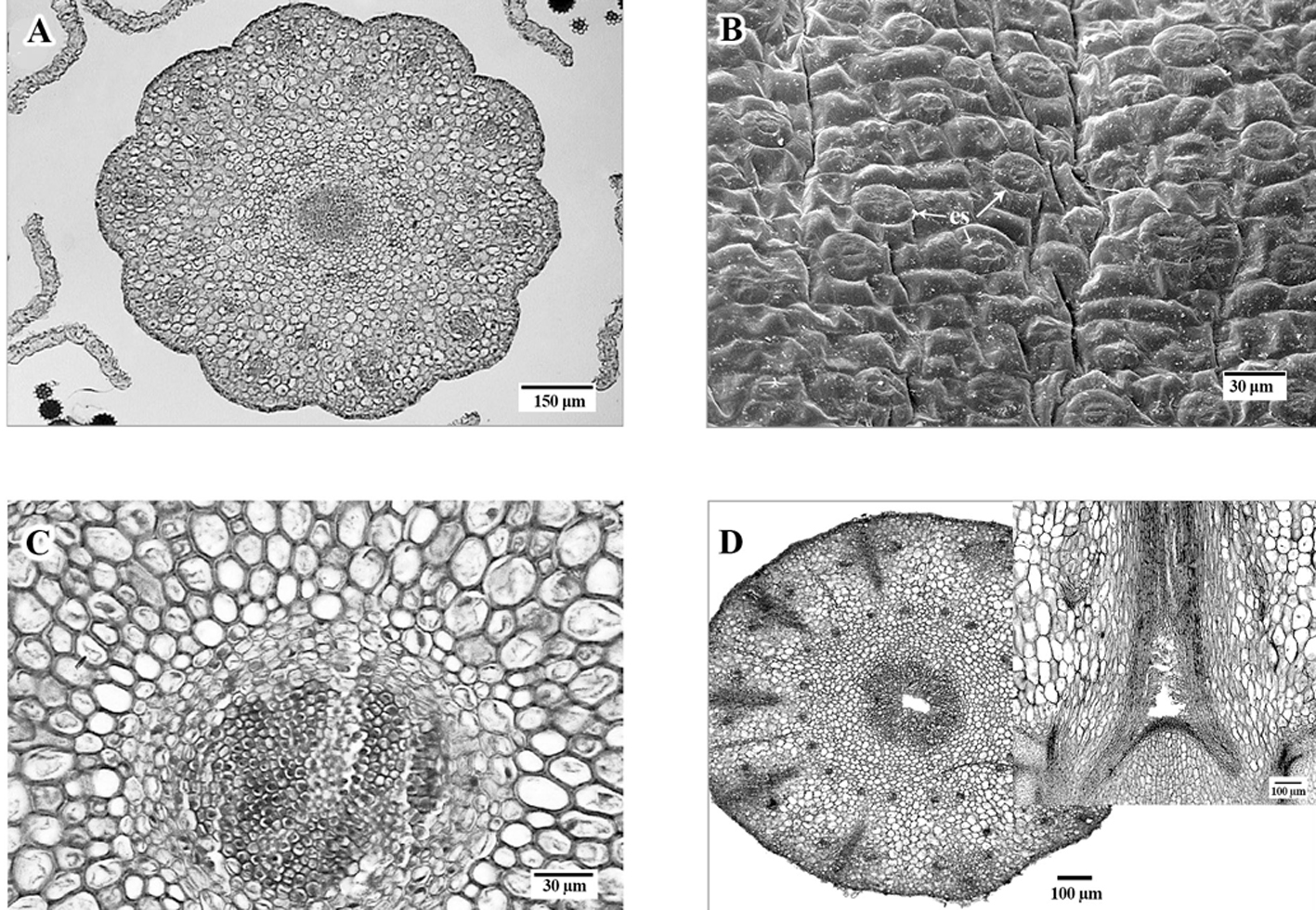
Pétalos con una cresta abaxial, central, en la base (fig. 3A), con cutícula delgada, epidermis abaxial con células isodiamétricas, de paredes delgadas y con papilas epidérmicas (fig. 3B); epidermis adaxial de células epidérmicas planas. Hacia los márgenes de los pétalos presentan células epidérmicas más pequeñas, alargadas periclinalmente, con estriaciones cuticulares evidentes y paredes laterales con engrosamientos helicoidales (fig. 3C). Hacia la mitad de su longitud, los pétalos ya no presentan la cresta abaxial y tienen una apariencia laminar, con epidermis uniestratificada, las células de la epidermis adaxial son más pequeñas que las de la epidermis abaxial (fig. 3D).
En la base del pétalo, el mesofilo está formado por células parenquimáticas de paredes delgadas, en un arreglo compacto, en la zona de la cresta está conformado por 7 a 8 estratos de células alargadas anticlinalmente, hacia los extremos laterales del pétalo las células parenquimáticas son irregulares, de paredes delgadas y dejan, entre sí, espacios intercelulares grandes; el número de estratos celulares del mesofilo disminuye hacia los extremos laterales, hasta desaparecer en el margen del pétalo (fig. 3C). El haz vascular en la base del pétalo es compartido con el estambre opuesto al mismo, apareciendo incluso como estructuras adnadas en la base (fig. 3D); más arriba en el pétalo se presentan haces vasculares colaterales, que van aumentando en número, desde 5 cerca de la base (fig. 3D, E) hasta 8 a 10 en la parte media del pétalo.

Androceo en 2 series (fig. 3F), con los filamentos de los estambres opuestos a los sépalos de forma orbicular y los 5 opuestos a los pétalos de forma ligeramente elíptica, cerca de su base, en vista transversal (fig. 4A); epidermis uniestratificada, con células oblongas, con el eje mayor dispuesto anticlinalmente, de paredes delgadas; parénquima constituido por células isodiamétricas, de paredes delgadas; un haz vascular anficribal hacia la parte central (fig. 4A). Anteras ditecas, tetrasporangiadas (fig. 4B) con dehiscencia longitudinal y lateral.
En sección transversal, la antera joven presenta epidermis con estriaciones cuticulares, papilas de diferentes tamaños y estomas, es uniestratificada formada por células pequeñas, alargadas periclinalmente, de paredes delgadas. Posteriormente se presenta el endotecio constituido por un estrato de células de paredes con engrosamientos secundarios transversales (fig. 4C), un estrato medio con células pequeñas, de paredes delgadas y el tapetum secretor uniestratificado.
A lo largo de la antera la epidermis es delgada y presenta estomas grandes, abiertos (fig. 4D); el tejido parenquimático en el conectivo está formado por células irregulares, de paredes engrosadas, en posición central se localiza un haz vascular (fig. 4E). En sección transversal, el estomio se presenta entre los 2 sacos polínicos, apreciándose una interrupción del endotecio (fig. 4F). En la antera madura y dehiscente, se aprecia la epidermis y el endotecio con engrosamientos marcados en sus paredes.
Gineceo con ovario orbicular en sección transversal, con 10 lóbulos (fig. 5A), epidermis externa uniestratificada, con cutícula delgada, sin estomas, escasos tricomas eglandulares, unicelulares, cerca de la base, células epidérmicas pequeñas, redondas a cuadrangulares y de paredes delgadas (fig. 5B). El tejido parenquimático de los carpelos está constituido por células isodiamétricas, de paredes delgadas y con un arreglo laxo hacia la parte externa de los mismos, mientras que en la región cercana al lóculo, las células son de menor tamaño y compactas (fig. 5C, D).

A nivel de la unión de los carpelos se observa una sutura delimitada por 1-2 estratos de células parenquimáticas, radialmente alargadas; y entre estos estratos se presentan abundantes drusas (fig. 5D, E). El sistema vascular en la base del ovario está formado por 10 haces que posteriormente se ramifican, de manera que, hacia la mitad de la longitud del ovario, se aprecian 5 haces asociados a cada lóculo. La epidermis interna de cada lóculo es uniestratificada, formada por células rectangulares de paredes delgadas. Óvulos 1 por lóculo, hemítropos, bitégmicos y crasinucelados. Tegumento externo, en la parte media, con 2 estratos de células de paredes delgadas y alargadas periclinalmente; el tegumento interno constituído por 2-3 estratos de células cuadrangulares (fig. 5F).
Estilo en sección transversal de forma orbicular, con 10 lobulaciones (fig. 6A). Con cutícula delgada, epidermis uniestratificada de células isodiamétricas a ligeramente cuadrangulares y paredes delgadas, estomas anomocíticos abundantes ubicados a nivel del resto de las células epidérmicas (fig. 6B). Por debajo de la epidermis, parénquima constituido por células irregulares a isodiamétricas, de paredes gruesas y arreglo compacto. En posición central el tejido de transmisión formado por células isodiamétricas, más pequeñas que las ubicadas en el resto del estilo, de paredes ligeramente engrosadas y contenido citoplasmático denso (fig. 6C).
El estilo en sección transversal es sólido, excepto en la base donde se observa una cavidad central que se reduce hacia su extremo superior, dicha cavidad se presenta antes, durante y después de la antesis y se ha observado que se amplía en los primeros estadios de desarrollo del fruto (fig. 6D).
Estigma con epidermis marcadamente papilosa (fig. 7A), células cónicas con ápice convexo, de paredes gruesas, núcleo evidente y citoplasma denso (fig. 7B-D). No se han observado evidencias de secreciones por lo que se sugiere que es de tipo seco.
Discusión
En las descripciones previas de Kallstroemia (Porter, 1969a; Sheahan y Cutler, 1993; Sheahan y Chase, 1996, 2000; Sheahan, 2007), no fueron descritos algunos aspectos tanto de su morfología como de su anatomía, en la presente revisión de Kallstroemia maxima se aportan nuevas evidencias de rasgos anatómicos que contribuyen a una descripción floral más completa o que reafirman y precisan algunas ya citadas con posible valor taxonómico.
Los tricomas unicelulares y simples son comunes en diversas estructuras de las Zygophyllaceae (Metcalfe y Chalk, 1950; Sheahan y Cutler, 1993; Sheahan y Chase, 1996). En K. maxima se presentan 2 tipos de tricomas, ambos unicelulares y eglandulares en la superficie abaxial de los sépalos. Los del primer tipo son menores a 0.5 mm de longitud y tienen una base poco desarrollada, mientras que los otros miden de 1.5 a 2 mm de largo y están rodeados por una roseta de células epidérmicas que se levantan formando una base cónica para cada tricoma. Este último tipo de tricoma es similar a los encontrados en las hojas de otras especies de Kallstroemia, en Kelleronia y Tribulus (Sheahan y Cutler, 1993; Sheahan y Chase, 1996) y en Tribulus terrestris (Semerdjieva, 2011). Sheahan y Cutler (1993) los describen como tricomas cutinizados alrededor de la zona de fijación. Cabe mencionar que los tricomas de este tipo, en las hojas de K. maxima son de hasta de 1 mm de largo, mientras que los tricomas de los sépalos miden hasta 2 mm o más de largo.
Sheahan y Cutler (1993) encontraron que las estructuras vegetativas de 37 especies de Zygophyllaceae tienen estomas de tipo anomocítico con reborde cuticular externo muy evidente y paredes periclinales engrosadas en las células oclusivas, en los sépalos de K. maxima se observan estomas con las mismas características. También se observó que los haces vasculares de los sépalos tienen una vaina parenquimática, típica de la anatomía Kranz, similar a la que se presenta en las hojas de Kelleronia y Tribulus (Sheahan y Chase, 1996).

La familia Zygophyllaceae ha recibido diversos tratamientos taxonómicos (Medina-Lemos, 2012; Porter, 1969a, b, 2009; Rzedowski y Rzedowski, 1994; Stafford, 2015; Standley y Steyermark, 1946), y no obstante que los nectarios o las glándulas extra estaminales pudieran tener valor taxonómico, en estos estudios no queda clara la información referente a ellos. Por ejemplo, Rzedowski y Rzedowski (1994) no las mencionan a nivel de familia, ni de género, ni en la descripción de la especie bajo estudio; Medina-Lemos (2012) tampoco las incluye en las descripciones, a pesar de estar representadas en la ilustración referente a K. maxima. Por otra parte, se ha señalado que en la familia se presentan nectarios anulares o como escamas adyacentes a la cara adaxial de los estambres. En el caso de K. maxima son evidentes 5 nectarios en forma de cojín, ubicados entre cada sépalo y la base del estambre opuesto a dicho sépalo. La presencia de nectarios bilobulados fue considerada por Porter (1969a), como una característica distintiva de algunos géneros de la subfamilia Tribuloideae; sin embargo, en K. maxima no son bilobulados, por lo que se requiere un estudio de los nectarios en otros géneros para determinar si la forma de los mismos puede ser de utilidad en la diferenciación de estos grupos. Los nectarios de K. maxima son del tipo estructurado, donde la secreción ocurre aparentemente a través de nectarostomas, que es considerada la forma más común de secreción de néctar en las angiospermas (Pacini y Nepi, 2007). En cuanto al origen de los nectarios, Porter (1971) indicó que en el caso de Tribulus, no está claro si los mismos representan estambres reducidos o son órganos surgidos de novo; para K. maxima es indispensable llevar a cabo estudios ontogenéticos que ayuden a dilucidar el origen de los nectarios.
En los pétalos de K. maxima, se aprecia que las células epidérmicas de los márgenes laterales, presentan en sus paredes engrosamientos secundarios. El patrón de engrosamiento en estas células es semejante al de las células que conforman el endotecio en las anteras de la mayoría de las angiospermas y de la misma K. maxima. Este tipo de engrosamiento podría estar relacionado con el cierre de los pétalos después de la antesis, ya que en K. maxima las flores abren en la mañana en la zona de Yecapixtla, Morelos, donde fueron recolectadas las muestras que se utilizaron en este estudio. Alrededor de las 11:00 h, el polen está disponible y el estigma receptivo, unas horas después los estambres, alrededor de las 17:00 h, o antes, se giran quedando cerca del estigma, posteriormente también los pétalos se pliegan de forma convoluta, manteniendo unidas a ambas estructuras, como fue reportado por Porter (1969a); este mecanismo es similar al que ocurre en las anteras, donde debido a los engrosamientos del endotecio y asociado a cambios de humedad, las paredes se giran hacia adentro, permitiendo la apertura de la antera y la liberación del polen (Keijzer et al., 1987; Wilson et al., 2011). No obstante, es necesario realizar estudios de los cambios anatómicos asociados a los procesos de polinización que permitan comprobar estas hipótesis. En la superficie abaxial, cerca de la base de los pétalos, a nivel de los nectarios, se presentan algunas papilas. Este carácter, aunado a la presencia de nectarios, podría indicar la relación con algún polinizador; sin embargo, en observaciones directas, en vivo, de flores en antesis, no se ha observado secreción de néctar.
Sheahan y Chase (1996) señalaron que los estambres de Kallstroemia, Kelleronia y Tribulus carecen de apéndices estaminales y los estambres se encuentran distribuidos en 2 verticilos diferentes, esto mismo se observó en la especie estudiada. En el receptáculo se observa que los 2 verticilos de estambres se forman en diferente posición, los opuestos a los sépalos que se diferencian primero y los opuestos a los pétalos que se desarrollan poco después, Porter (1969a) utilizó el término “externo” para designar este último verticilo; en este estudio se considera más apropiado designar a los estambres como “opuestos a los sépalos” y “opuestos a los pétalos”, observándose que éstos últimos, son de mayor tamaño que los opuestos a los sépalos.
Las anteras maduras en K. maxima presentan cutícula estriada y estomas hacia la zona del conectivo; Keijzer et al. (1987) han señalado que la presencia de estomas y estriaciones cuticulares a nivel de la antera pueden contribuir a aumentar la evaporación del agua y facilitar su dehiscencia. Aunque Porter (1969a) señaló que la dehiscencia de las anteras es introrsa, en el presente estudio se observó que la dehiscencia es longitudinal y lateral. En general, la morfología de la antera en la especie estudiada es similar a lo señalado por Cuevas et al. (2005) en las flores hermafroditas de K. grandiflora.
Varios autores señalan la presencia de un disco en el género Kallstroemia, algunos de ellos solo mencionan que los estambres se insertan en el disco, sin describirlo (Medina-Lemos, 2012; Porter, 1969a; Rzedowski y Rzedowski, 1994); Porter (1969b, 2009) menciona la presencia de un disco carnoso, anular, obscuramente 10-lobulado; Stafford (2015) lo describe como disco carnoso, inconspicuamente 10-lobado. En el presente estudio se observó por debajo del ovario una estructura semiplana, ligeramente lobulada, con textura y color similares a los del ovario, excepto que en fresco se ha visto que no presenta la misma pubescencia que el ovario y se aprecia más desarrollado cuando el fruto ya está madurando. Pudiera tratarse de un disco reducido; sin embargo, su similitud con la pared externa del ovario sugiere un origen común con éste, por lo que se propone se trata de un ginóforo lo cual contradice la postura de Sheahan y Chase (1996) de considerar el ovario sésil en Kallstroemia. No obstante, se requieren más estudios acerca del desarrollo de esta estructura para definir su origen.
Wight et al. (1834) mencionaron que el gineceo en Kallstroemia está conformado por 5 carpelos, mientras que Sheahan (2007) dijo que en este género se presentan 10 carpelos. En nuestras observaciones, en el gineceo se aprecian los 10 lóculos, con septos bien definidos, así como un estigma con 10 lóbulos, lo cual apoyaría el planteamiento de Sheahan (2007), de un ovario con 10 carpelos; esto mismo se ve sustentado porque desde la base del ovario se observan 10 haces vasculares, uno para cada carpelo. Dentro de la misma familia Zygophyllaceae, no obstante que Augea no está cercanamente relacionada con Kallstroemia (Sheahan y Chase, 2000), ambos géneros coinciden en tener ovario con 10 lóculos.
La presencia de cristales de oxalato de calcio tipo drusas fue señalada por Porter (1969a) solo a nivel del receptáculo; sin embargo, en K. maxima además del receptáculo, las drusas se presentan en la zona de unión de los carpelos, condición que no había sido señalada anteriormente en las Zygophyllaceae. Sin embargo, Sheahan y Cutler (1993) registraron la presencia de abundantes cristales en hojas y tallos de la mayoría de las 37 especies que analizaron, observaron que la forma más común fueron las drusas, aunque también señalan la presencia de cristales aciculares, romboidales y estilodios, todos ellos solitarios o agrupados. El estigma de K. maxima tiene 10 lóbulos, tal como fue descrito por Sheahan y Chase (1996), se encontraron papilas unicelulares pero no se encontraron indicios de secreciones estigmáticas por lo que, hasta el momento, se considera estigma seco.
La anatomía floral ha mostrado algunos caracteres de utilidad para la sistemática de Zygophyllaceae (Porter, 1971), y se espera que los detalles revelados en este estudio contribuyan al conocimiento de la especie, así como a hacer más claras las diferencias entre los géneros de la subfamilia Tribuloideae.
Este estudio contribuye a la descripción y caracterización morfoanatómica floral de Kallstroemia maxima. Los engrosamientos en la epidermis del margen de los pétalos, la presencia de papilas en su superficie abaxial, la posición y secuencia en el desarrollo de las dos series de estambres, el número de carpelos y haces vasculares que los irrigan, así como la presencia de drusas en la unión de los carpelos, la presencia de una cavidad en la base del estilo y el número de lóbulos del estigma, son caracteres descritos por primera vez y pueden ser de interés en la sistemática de las Zygophyllaceae.
Agradecimientos
A Silvia Espinosa Matías por su apoyo en la obtención de micrografías en el microscopio electrónico de barrido y a Priscila Aceves por su apoyo en el manejo de las imágenes.
Referencias
APG (Angiosperm Phylogeny Group). (2016). An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. Botanical Journal of the Linnean Society, 181, 1–20.
Cuevas, E., Márquez, J., Domínguez, C. y Molina-Freaner, F. (2005). Evidence of gynodioecy in Kallstroemia grandiflora (Zygophyllaceae): microsporogenesis in hermaphrodite and female plants and lack of reproductive compensation. International Journal of Plant Sciences, 166, 481–491.
Chauhan, A. (1975). Morphological studies in the order Geraniales (Tesis doctoral). Jiwaji University. Gwalior, India.
Engler, H. G. A. (1896). En H. G. A. Engler y K. A. E. Prantl (Eds.), Die Natürlichen Pflanzenfamilien nebst ihren Gattungen und wichtigeren Arten, insbesondere den Nutzflanzen, unter Mitwirkung zahlreicher hervorragender Fachgelehrten begründet. Recuperado el 25 de octubre de 2016 de: http://www.biodiversitylibrary.org/item/68285#page/92/mode/1up
Keijzer, C. J., Hoek, I. H. S. y Willems, M. T. M. (1987). The processes of anther dehiscence and pollen dispersal III. The dehydration of the filament tip and the anther in three monocotyledonous species. New Phytologist, 106, 281–287.
Medina-Lemos, R. (2012). Zygophyllaceae. En R. Medina- Lemos (Ed.), Flora del valle de Tehuacán-Cuicatlán, 108 (pp. 1–18). México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Metcalfe, C. R. y Chalk, L. (1950). Anatomy of dicotyledons. Oxford: Clarendon Press.
Pacini, E. y Nepi, M. (2007). Nectar production and presentation. En S. W. Nicolson, M. Nepi y E. Pacini (Eds.), Nectaries and nectar (pp.167–214). Dordrecht: Springer.
Porter, D. M. (1969a). The genus Kallstroemia (Zygophyllaceae). Contributions Gray Herbarium, 198, 41–153. Recuperada el 24 de octubre de 2016 de: http://www.botanicus.org/item/31753002286778.
Porter, D. M. (1969b). Zygophyllaceae. En R. E. Woodson, Jr., R.W. Schery y D. M. Porter (Eds.), Flora of Panama, Part VI. Annals of the Missouri Botanical Garden, 56, 1–7.
Porter, M. D. (1971). Notes on the floral glands in Tribulus (Zygophyllaceae). Annals of the Missouri Botanical Garden, 58, 1–5.
Porter, D. M. (2009). Zygophyllaceae. En W. D. Stevens, C. Ulloa, A. Pool y O. M. Montiel (Eds.), Flora de Nicaragua. Monographs in Systematic Botany from the Missouri Botanical Garden, 85, i–xlii. Recuperada el 19 de octubre de 2016 de: http://www.tropicos.org/name/40034413?projectid=7
Rudall, P., Bateman, R., Fay, M. y Eastman, A. (2002). Floral anatomy and systematics of Alliaceae with particular reference to Gilliesia, a presumed insect mimic with strongly zygomorphic flowers. American Journal of Botany, 89, 1867–1883.
Rudall, P. y Goldblatt, P. (2000). Floral anatomy and systematic position of Diplarrhena (Iridaceae): a new tribe Diplarrheneae. Annalici Botanica, 58, 59–66.
Rzedowski, J. y Rzedowski, G. C. (1994). Zygophyllaceae. En J. Rzedowski y G. C. de Rzedowski (Eds.). Flora del Bajío y regiones adyacentes, 30. Pátzcuaro, Michoacán: Instituto de Ecología, A.C.
Sandoval, E., Rojas, A., Guzmán, C., Carmona, L., Ponce, M., León, C. et al. (2005). Técnicas aplicadas al estudio de la anatomía vegetal. Cuadernos del Instituto de Biología 38. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Semerdjieva, I. (2011). Studies on leaf anatomy of Tribulus terrestris L. (Zygophyllaceae) in populations from the Thracian floristic region. Biotechnology and Biotechnological Equipment, 25, 2373–2378.
Sheahan, M. C. (2007). Zygophyllaceae. En K. Kubitzki (Eds.), The families and genera of vascular plants. Vol. 9 (pp. 488–500). Berlin, Heidelberg, New York: Springer.
Sheahan, M. C. y Cutler, D. F. (1993). Contribution of vegetative anatomy to the systematics of the Zygophyllaceae R. Br., Botanical Journal of the Linnean Society, 113, 227–262.
Sheahan, M. C. y Chase, M. W. (1996). A phylogenetic analysis of Zygophyllaceae R. Br. based on morphological, anatomical and rbcL DNA sequence data. Botanical Journal of the Linnean Society, 122, 279–300.
Sheahan, M. C. y Chase, M. W. (2000). Phylogenetic relationships within Zygophyllaceae based on DNA sequences of plastid regions, with special emphasis on Zygophylloideae. Systematic Botany, 25, 371–384.
Singh, B. P., Kaur, I. y Gauchan, D. P. (2002). Floral anatomy and systematic position of the genus Balanites. Acta Botanica Hungarica, 44, 137–143.
Stafford, M. J. (2015). Zygophyllaceae. En G. Davidse, M. Sousa-Sánchez, S. Knapp y F. Chiang (Eds.), Saururaceae a Zygophyllaceae. Flora Mesoamericana. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Standley, P. C. y Steyermark, J. A. (1946). Zygophyllaceae. En P. C. Standley y J. A. Steyermark (Eds.), Flora of Guatemala. Fieldiana, Botany, 24, 393–98.
Stevens, P. F. (2001). Angiosperm phylogeny website. Version 12, July 2012. Recuperado el 9 de enero de 2017 de: http://www.mobot.org/MOBOT/research/APweb/
Turner, B.L. (2016). Overview of Kallstroemia (Zygophyllaceae) in the USA and Mexico, and description of a new species: Kallstroemia porter. Phytologia, 98, 89–91.
Villaseñor, J. L. (2016). Checklist of the native vascular plants of Mexico. Revista Mexicana de Biodiversidad, 87, 559–902.
Wight, R., Arnott, W. y Arnott, G. (1834). Prodromus Florae Peninsulae Indiae Orientalis: containing abridged descriptions of the plants found in the peninsula of British India, arranged according to the natural system. London: Parbury, Allen. Recuperado el 19 de octubre de 2016 de: http://dx.doi.org/10.5962/bhl.title.252
Wilson, Z. A., Song. J., Taylor, B. y Yang. C. (2011). The final split: the regulation of anther dehiscence. Journal of Experimental Botany, 62, 1633–1649.