Nadinne I. Rodriguez-Pinto a, *, Darwin R. Díaz a, César E. Medina a, b,
David Villalobos-Chaves c, José A. Morales b, Edwin F. Bocardo b y Evaristo López a, b
a Universidad Nacional de San Agustín de Arequipa, Museo de Historia Natural, Colección Científica, Av. Alcides Carrión s/n, 04001 Arequipa, Perú
b Universidad Nacional de San Agustín de Arequipa, Facultad de Ciencias Biológicas, Departamento Académico de Biología, Sección de Zoología, Av. Alcides Carrión s/n, 04001 Arequipa, Perú
c University of Washington, Department of Biology, Box 351800, Seattle, WA 98195-1800, EUA
*Autor para correspondencia: nrodriguezp@unsa.edu.pe (N.I. Rodriguez-Pinto)
Recibido: 9 diciembre 2020; aceptado: 19 mayo 2021
Resumen
La telemetría, para el cálculo de ámbitos de hogar, proporciona una visión significativa del uso del espacio de las especies, como el entendimiento de patrones y componentes importantes del hábitat. El presente estudio determinó el tamaño del ámbito de hogar de Myotis atacamensis y Amorphochilus schnablii en los valles costeros de Arequipa para la generación de planes eficientes de manejo y conservación de estos murciélagos. Ambas especies están bajo alguna categoría de conservación (M. atacamensis, en peligro; A. schnablii, vulnerable), por la pérdida de extensión y calidad del hábitat en su área de distribución, además del limitado conocimiento de las mismas. En 2019 se instalaron transmisores de radio VHF Holohil LB-2X a 12 individuos, obteniendo las ubicaciones de los murciélagos mediante el método de “homing”. El tamaño del ámbito de hogar (AH) fue estimado con los métodos: polígono mínimo convexo y función de kernel bivariado. El tamaño de AH para M. atacamensis fue de 2.1 ± 1.6 ha sobre áreas de cultivo y para A. shnablii fue de 24.2 ± 27.1 ha sobre zonas áridas y cultivos. Los resultados sugieren que el uso de espacios de M. atacamensis y A. schnablii están orientados principalmente a la disponibilidad de alimento, registrándose mayor importancia de las áreas de cultivo en los ámbitos de hogar.
Palabras clave: Amenazados; Arequipa; Cultivos; Insectívoros; Telemetría VHF
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Home range size of bats Myotis atacamensis (Vespertilionidae) and Amorphochilus schnablii (Furipteridae) in the coastal valleys of southern Peru
Abstract
Telemetry for calculating home ranges provides meaningful insight into the space use of species, such as understanding important habitat components and patterns. The present study sought to determine the size of the home range of Myotis atacamensis and Amorphochilus schnablii in coastal valleys of Arequipa for the generation of efficient management and conservation plans. Both species are under some category of conservation (M. atacamensis, Endangered; A. schnablii, Vulnerable), due to loss of extension and quality of habitat in their distribution area, in addition to the limited knowledge of them. In 2019, Holohil LB-2X VHF radio transmitters were installed on 12 individuals, obtaining bat’s positions using the homing-in-the-animal method. The size of the home range (HR) was estimated with the methods: convex minimum polygon and bivariate kernel function. The HR size for M. atacamensis was 2.1 ± 1.6 ha on cultivated areas, and for A. shnablii it was 24.2 ± 27.1 ha on arid zones and cultivated areas. The results suggest that the use of spaces of M. atacamensis and A. schnablii are mainly oriented to the availability of food, registering greater importance of the cultivation areas in the home range.
Keywords: Threatened; Arequipa; Crops; Insectivorous; VHF telemetry
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
La telemetría VHF, aplicada en ecología, consiste básicamente en localizar un animal equipado con un radiotransmisor que produce una breve señal de radio intermitente que es detectada con un receptor de radio VHF conectado a una antena direccional; la cual nos permite contestar preguntas ecológicas y de manejo relacionadas al movimiento, comportamiento, uso de hábitat, sobrevivencia y productividad que son imposibles de contestar a través de otras técnicas, debido a que muchas especies de animales silvestres son difíciles de observar y de seguir en campo (Agnelli et al., 2004; Cooke et al., 2004; Garton et al., 2001).
La diversidad de murciélagos en Arequipa, Perú se estima en 18 especies, distribuidas principalmente entre los 500 a 1,600 m snm en los principales valles de la región (Málaga et al., 2020; Medina et al., 2018; Pari et al., 2015). De este grupo, los murciélagos Amorphochilus schnablii, Myotis atacamensis y Tomopeas ravus, se encuentran incluidos en las siguientes categorías de amenaza: en peligro (EN) y casi amenazada (NT) para los 2 primeros murciélagos de la legislación peruana, y como vulnerable (VU), en peligro (EN) y en peligro (EN), respectivamente, en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (Ministerio de Agricultura y Riego, 2014; Vargas-Rodríguez et al., 2016; Velazco, 2016; Velazco et al., 2015).
Amorphochilus schnablii y Myotis atacamensis son especies insectívoras simpátricas y endémicas del desierto costero del Pacífico con una distribución muy restringida. M. atacamensis es una especie que no cuenta con información poblacional disponible, y de la que se sospecha la reducción del tamaño de la población debido a la degradación y fragmentación del hábitat (Hutson et al., 2001; Vargas-Rodríguez et al., 2016). La historia natural de A. schnablii es prácticamente desconocida y la información existente se limita a descripciones, mediciones morfométricas, la adición de nuevos registros y comentarios sobre su distribución (Ibáñez, 1985; Tirira et al., 2012). A. schnablii es una de las 2 especies representativas de la familia Furipteridae y la pérdida de hábitat se expone como la potencial amenaza para su extinción (Galaz y Yáñez, 2006; García-Morales et al., 2013; Iriarte, 2008; Morgan y Czaplewski, 1999; Velazco et al., 2015).
La medida en que estos murciélagos usan ciertos lugares para posarse y alimentarse, o simplemente moverse a través de un lugar para acceder a sitios más favorables no ha sido estudiado, por lo que entender cómo usan diferentes áreas es esencial para definir medidas de mitigación y planes de manejo (Kirkpatrick et al., 2018).
La pregunta de investigación de este estudio es cuál es el área que necesita un murciélago para desempeñar sus funciones básicas. Se planteó como objetivo estimar el tamaño del ámbito de hogar de M. atacamensis y A. schnablii en los valles costeros de la región de Arequipa, considerando como hipótesis que las áreas de cultivo tendrían una mayor importancia en los patrones de actividad y forrajeo de las 2 especies en comparación de otras superficies.
Materiales y métodos
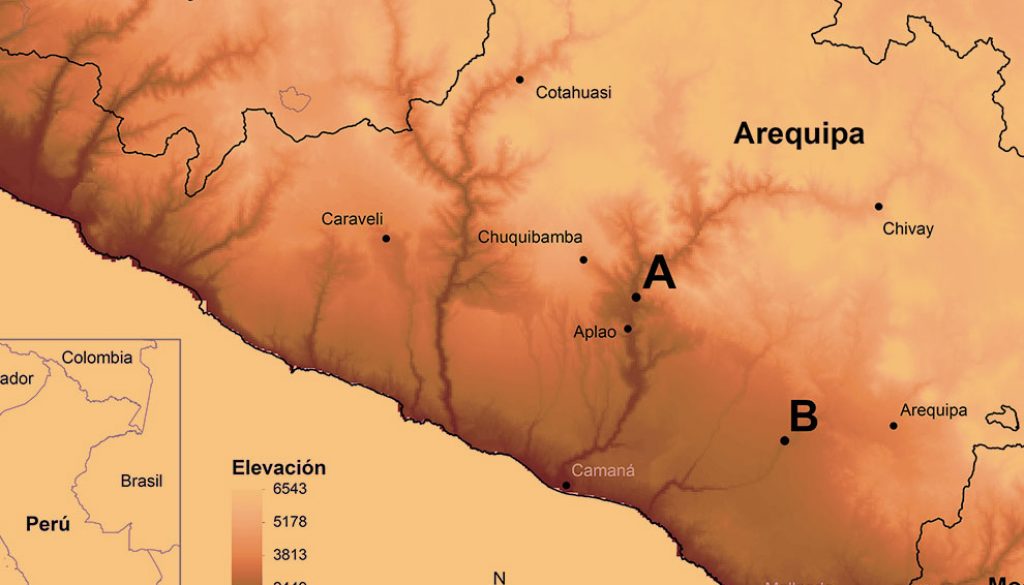
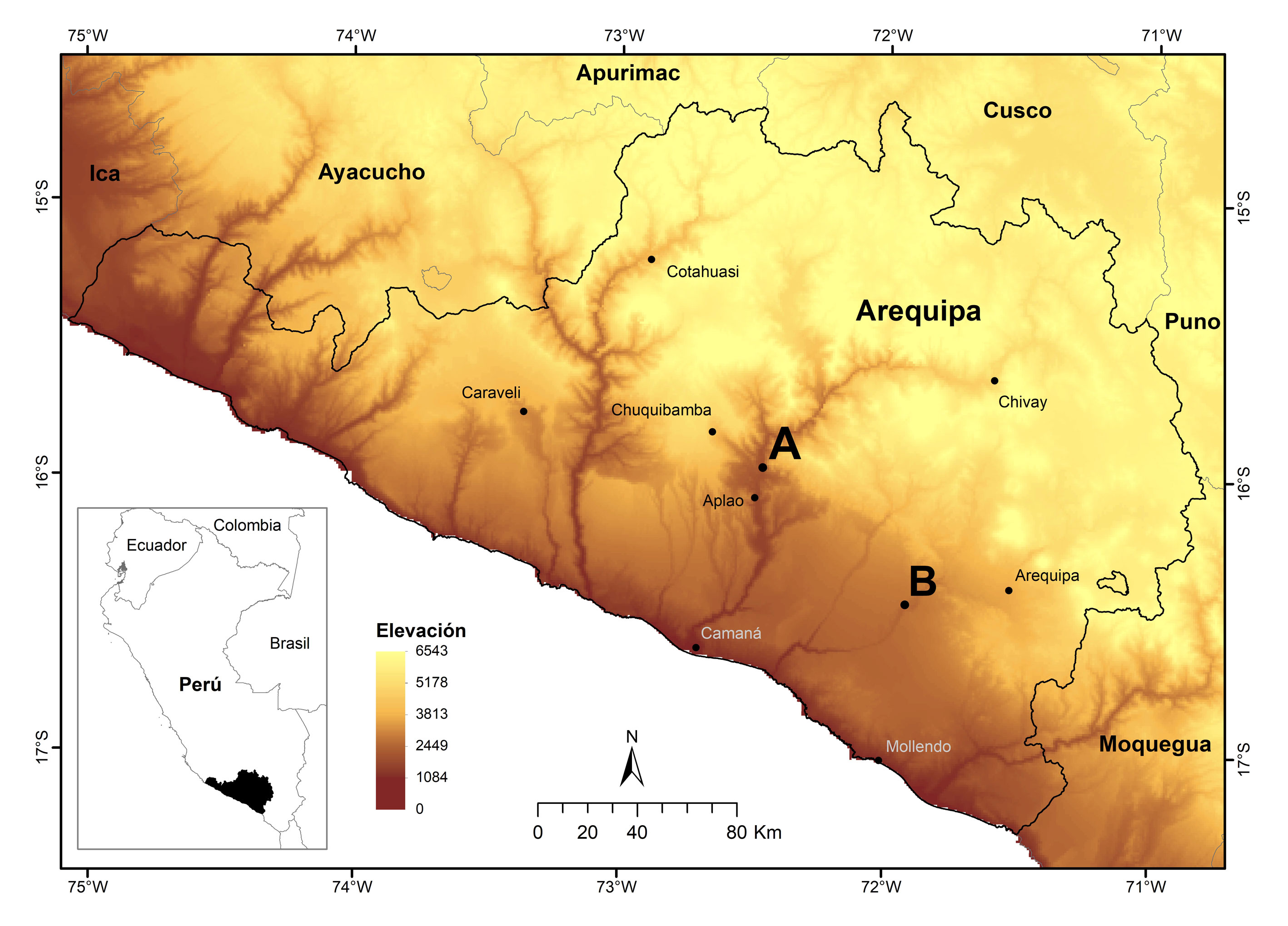
El estudio se realizó en las localidades de Huatiapa, ubicada a 11.5 km al norte de la capital del distrito de Aplao, durante enero, julio, octubre y noviembre de 2019 y Vítor, ubicada en los alrededores de la capital del distrito de Vítor, durante noviembre y diciembre de 2019. Ambas localidades pertenecen al departamento de Arequipa, suroeste del Perú (fig. 1) y tienen 3 tipos de cobertura vegetal (agricultura costera y andina, área urbana y desierto costero (fig. 2) (Ministerio del Ambiente, 2015).
La localidad de Huatiapa se caracteriza por formar parte de un valle largo y encajonado, ubicado en la llanura de la costa del océano Pacífico. El clima es caluroso por su estrechez y profundidad. La temperatura media anual es de 19.5ºC con lluvias esporádicas (INEI, 2017). La localidad de Vítor forma parte de un valle fluvial con planicie costera constituida por la cuenca continental de Moquegua y tiene un clima semicálido y algunas zonas se caracterizan por el alto porcentaje de horas de sol y el casi nulo registro de precipitaciones. Este valle tiene una temperatura media de 19 ºC; siendo la temperatura mínima extrema de 10 ºC y la máxima de 32 ºC (INEI, 2017). Los valles de Huatiapa y Vítor son considerados zonas agrícolas (alfalfa y maíz) y en segunda instancia, de ganadería y comercio (García y Llamoca, 2017; Kosaka et al., 2001).
Para capturar a los murciélagos se utilizaron redes de niebla de 6 × 2.5 m y de 12 × 2.5 m, ubicadas en refugios conocidos de M. atacamensis y A. schnablii. De cada captura, se registró el nombre de la especie, peso corporal, longitud de antebrazo, estado reproductivo y edad según el grado de osificación de las falanges del tercer metacarpiano (Brunet-Rossinni y Wilkinson, 2009).
Para la telemetría se utilizaron transmisores de radio VHF Holohil LB-2X (Holohil Systems, Carp, Ontario, Canadá) de 0.23 y 0.27 g de peso con baterías de una vida útil de 7 días como mínimo que fueron sujetados a la espalda de murciélagos adultos con ayuda de pegamento quirúrgico, siguiendo las recomendaciones de Kirkpatrick et al. (2018). El peso del transmisor representa el 6.7% ± 1.1% de los pesos corporales de los murciélagos (masa corporal media de los individuos marcados 3.9 g ± 0.5 SD). Este valor es inferior al umbral de masa de 10%, por encima del cual se considera que la masa del transmisor afecta seriamente el comportamiento de alimentación de un animal, considerando que los murciélagos pequeños pueden transportar cargas más pesadas en relación con su peso corporal que las especies más grandes (Brander y Cochran, 1969; Norberg y Rayner, 1987).
Los individuos fueron codificados mediante abreviación del nombre de la especie, sexo y los 3 primeros decimales de la frecuencia utilizada —p. ej., As_F464 corresponde a un individuo hembra de A. schnablii con una frecuencia de 164.464.
Los murciélagos fueron monitoreados desde el inicio de su actividad hasta las 00:00 h utilizando 3 receptores de transmisores para frecuencia de 164 MHz con sus respectivas antenas Yagi de 3 elementos con brújulas conectadas. Las posiciones de los murciélagos fueron obtenidas por el método de “homing”, una técnica mediante la cual se sigue al individuo hasta que la fuerza de la señal aumente y se observe al animal, o se circunda un área pequeña, asumiendo que el animal está dentro del área (Vincent et al., 2011; White y Garrot, 1990).
Se obtuvieron datos de posicionamiento durante un mínimo de 4 noches por individuo, tomándose datos de hora, punto geográfico (coordenada UTM), código del individuo, registro, azimuth y la fuerza de la señal cada 3 minutos cuando el animal estuvo quieto (perchado) y cada minuto cuando estuvo volando (De Solla et al., 1999). Los refugios diurnos fueron ubicados a la mañana siguiente y los lugares de descanso se confirmaron con recuentos de emergencia al atardecer, que consisten en observar a los murciélagos desde lejos mientras estos salen del refugio a forrajear. En los casos en que un murciélago no regresó a su refugio conocido, se realizaron más búsquedas durante el día para encontrar el nuevo sitio de descanso (Apoznański et al., 2018).
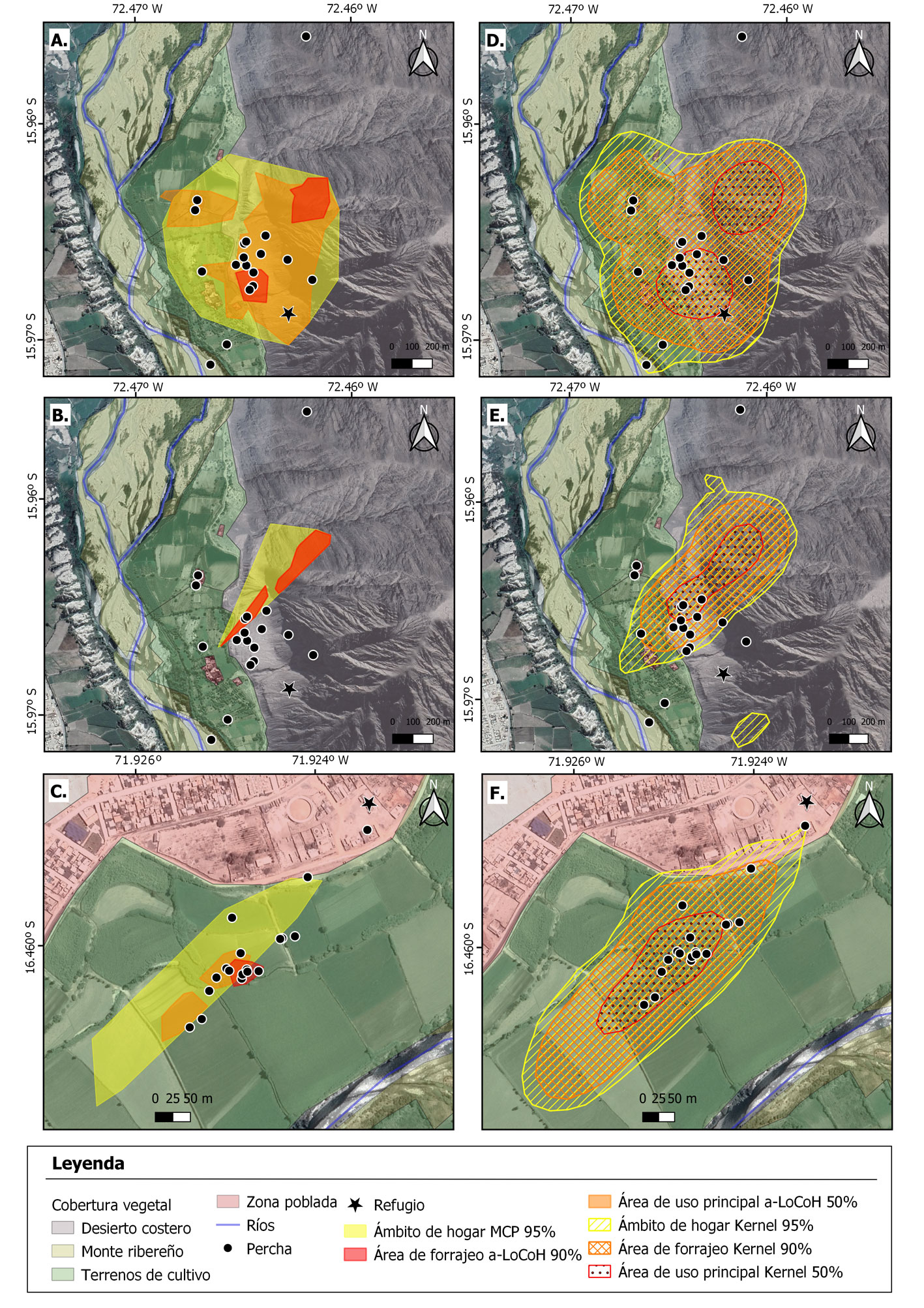
Los ámbitos de hogar (AH) fueron calculados con base en las coordenadas de ubicaciones de cada especie (Kniowski y Gehrt, 2014). Para estimar el tamaño del ámbito de hogar de los animales se utilizó el método de polígono mínimo convexo considerando 95% de coordenadas (MCP 95%) y la función de Kernel bivariado (FKB) (Harris et al., 1990; Mohr, 1947). Se consideraron isopletas al 90% para identificar las áreas de forrajeo (AF) e isopletas al 50% para las áreas de uso principal (AUP) utilizando los métodos no paramétricos de Kernel (a-LoCoH) y FKB (Getz, 2007). Para los cálculos de área de forrajeo y área de uso principal, no se incluyeron los refugios y las localizaciones dentro de las áreas atravesadas por los murciélagos mientras se desplazan entre las perchas diurnas y las áreas de forrajeo. Meyer et al. (2005), sostienen lo antes mencionado, ya que esto permite la comparación directa de los resultados obtenidos para diferentes individuos además de ser ampliamente empleado en estudios de radiotracking. Los tamaños de ámbito de hogar y su uso se obtuvieron utilizando el paquete adehabitatHR de R (Calenge, 2006). Se utilizaron imágenes satelitales recientes para la caracterización del ámbito de hogar sobre la cobertura vegetal, considerando 5 tipos de cobertura: desierto costero, zona poblada, terrenos de cultivo, monte ribereño y río. Dichas coberturas fueron transformadas al formato de shapefile para ser intersectadas con las áreas estimadas para cada especie y definir su porcentaje de importancia.
Adicionalmente, se estimó el desplazamiento realizado por cada individuo en función a la sumatoria de la distancia entre puntos consecutivos de registro, es decir, se sumó la distancia entre el primer y segundo punto de registro con la distancia del segundo al tercero, y así sucesivamente hasta el último punto de registro de la noche.
Resultados
Después de un total de 28 días de evaluación de campo se localizaron: 2 refugios de M. atacamensis; el primero, en una iglesia usada esporádicamente por los pobladores, con al menos 40 individuos (hembras principalmente) (16°27’28.31” S, 71°55’22.74” O) y el segundo, en una grieta inaccesible en las paredes escarpadas del cerro (16°27’9.61” S, 71°54’49.13” O) en la localidad de Vítor. Se observó a la especie compartir lugares de percha con algunos individuos de A. schnablii.
Para Amorphochilus schnablii, se localizó una grieta en las paredes escarpadas del cerro como refugio, inaccesible (15°58’97.54” S, 72°27’45.60” O) y un lugar de percha en una iglesia de poco uso en la localidad de Huatiapa (15°57’59.48” S, 72°27’52.44” O) con al menos 50 individuos (machos principalmente), compartiendo con algunos individuos de Histiotus montanus y M. atacamensis. También se localizaron individuos en casas abandonadas y hornos de ladrillo en desuso (lugar de percha de descanso).
De cada especie se capturó un total de 30 individuos para seleccionar 12 individuos (3 hembras y 3 machos por cada especie) para los trabajos de radio-telemetría. De los 12 individuos de estudio, se mantuvo contacto por radio con 7 individuos: 3 hembras (2 juveniles y 1 adulta) de M. atacamensis y 3 machos (2 juveniles y 1 adulto) y 1 hembra (juvenil) de A. shnablii, de los cuales se estimó el ámbito de hogar, áreas de forrajeo y áreas de uso principal.
Para M. atacamensis se obtuvieron 362 posiciones de telemetría, estimándose un ámbito de hogar de 2.1 ± 1.6 ha, un área de forrajeo de 1.0 ± 0.5 ha y un área principal de 0.5 ± 0.1 ha; 851 posiciones para A. schnablii, estimándose un ámbito de hogar de 24.2 ± 27.1 ha, un área de forrajeo de 12.7 ± 16.0 ha y un área principal de 3.0 ± 1.7 ha. Cabe resaltar que dichos valores presentaron fluctuaciones al ser analizados con el método FKB (tabla 1).
De manera general, el ámbito de hogar de M. atacamensis estuvo ubicado principalmente sobre terrenos de cultivo (71 – 75%), seguido de zonas pobladas (10 – 30%) y un porcentaje entre 3 y 10% de desierto costero, monte ribereño y río. Para A. shnablii, el ámbito hogareño estuvo localizado principalmente sobre desierto costero (80 – 88%), seguido de terrenos de cultivo (15 – 20%) y zonas pobladas (5 – 10%) (fig. 2).
Amorphochilus schnablii fue observado saliendo de su refugio a partir de las 18:40 h para forrajear, presentando actividad casi constante hasta las 22:00 h, con descansos de entre 5 y 90 min; estando perchados un periodo largo antes de volver al refugio.
Myotis atacamensis salía de su refugio entre las 17:45 y 18:00 h con dirección a los terrenos de cultivo, utilizando algunas casas cercanas y su propio refugio como lugares de percha, en donde permanecía periodos de 5 a 60 min. Los individuos de estudio presentaron un mismo patrón de actividad en los días de seguimiento hasta las 21:50 h en promedio.
Los desplazamientos por noche variaron entre los individuos de A. schnablii, y se observaron desplazamientos desde 0.84 hasta 21.1 km; mientras que para las hembras de M. atacamensis, se observaron desplazamientos de 0.75 a 17.9 km (tabla 1).
Tabla 1
Tamaño del ámbito de hogar (AH), área de forrajeo (AF) y área de uso principal (AUP) para Myotis atacamensis y Amorphochilus shnablii en las localidades de Huatiapa y Vítor, Arequipa (Perú). Individuos: siglas de la especie (As = A. shnablii, Ma = M. atacamensis), sexo (M = macho, F = hembra) y código asignado.
|
Myotis atacamensis |
Amorphochilus schnablii |
|||||||||
|
Sexo_Individuo |
Ma_F060 |
Ma_F164 |
Ma_F563 |
Media ± SD |
As_M164 |
As_M253 |
As_M261 |
As_F464 |
Media ± SD |
|
|
Posiciones de telemetría (n) |
23 |
297 |
42 |
120.7 ± 153.0 |
283 |
57 |
416 |
95 |
212.8 ± 167.7 |
|
|
Noches de seguimiento (n) |
4 |
5 |
4 |
4.3 ± 0.6 |
4 |
4 |
4 |
5 |
4.3 ± 0.5 |
|
|
Desplazamiento promedio recorrido por noche (d) |
0.75 |
7.38 |
2.68 |
4.4 ± 6.1 |
18.11 |
1.63 |
13.42 |
4.41 |
9.6 ± 7.8 |
|
|
Polígono Mínimo convexo (MCP) |
AH (ha) |
0.2 |
3.1 |
3 |
2.1 ± 1.6 |
63.8 |
2.3 |
16.2 |
14.3 |
24.2 ± 27.1 |
|
Métodos no paramétricos de Kernel (a-LoCoH) |
AF (ha) |
0.5 |
1.4 |
1 |
1.0 ± 0.5 |
36.4 |
1.9 |
8.4 |
4.1 |
12.7 ± 16.0 |
|
AUP (ha) |
0.5 |
0.5 |
0.4 |
0.5 ± 0.1 |
5.6 |
1.8 |
2.1 |
2.6 |
3.0 ± 1.7 |
|
|
Función de Kernel bivariado (FKB) |
AH (ha) |
1.6 |
8.5 |
133.9 |
48 ± 74.5 |
100.1 |
14.0 |
25.2 |
51.4 |
47.7 ± 38.3 |
|
AF (ha) |
1.1 |
6.5 |
26.7 |
11.4 ± 13.5 |
77.9 |
4.1 |
17.5 |
34.9 |
33.6 ± 32.1 |
|
|
AUP (ha) |
0.2 |
1.8 |
7.9 |
3.3 ± 4.1 |
20.7 |
0.8 |
5.3 |
10 |
9.2 ± 8.5 |
Discusión
Los estudios de ámbito de hogar se remontan a la década de 1960 basados en diferentes metodologías, lo cual ha generado que la comparación directa de las estimaciones del ámbito de hogar entre los estudios sea difícil debido a los diferentes métodos utilizados para recopilar los datos, la inconsistencia en la terminología y los diferentes métodos para calcular el tamaño del ámbito de hogar (Lacki et al., 2006). Por lo antes mencionado, el presente estudio utilizó métodos tradicionales y actuales para describir de forma más completa los ámbitos de hogar de M. atacamensis y A. schnablii.
El método FKB estimó un mayor tamaño de área de forrajeo y área de uso principal para ambas especies que el método a-LoCoH, debido a que el método FKB y el polígono mínimo convexo son muy sensibles a los puntos periféricos (Börger et al., 2006). Por consiguiente, se decidió utilizar, adicionalmente, el método de a-LoCoH porque producen ámbitos de hogar limitados, pues se demostró que tiene propiedades de convergencia superiores en comparación con los métodos FKB, además, nos permite construir distribuciones de utilización a partir de datos influenciados por geometrías idiosincrásicas como límites y agujeros geomorfológicos —p. ej., lagos o afloramientos rocosos— asociados con el espacio sobre el que se desplazan los ejemplares (Getz et al., 2007; Getz y Wilmers, 2004).
El tamaño de ámbito de hogar para Myotis atacamensis, obtenido según MCP 95% fue de 2.1 ± 1.6 ha y según el método FKB 95% fue de 48.0 ± 74.5 ha para este estudio. Si bien no existen estudios de uso de hábitat para M. atacamensis, se tiene información para otras especies del género Myotis con algunos estudios basados en cálculos con un pequeño número de individuos, como es el caso de Chung et al. (2013) que, utilizando 4 individuos de M. aurascens (2 machos y 2 hembras) sostienen que existe una estacionalidad en la ocupación de distintos ámbitos de hogar (Garner y Gadner, 1992; U.S. Fish and Wildlife Service, 2007).
Los ámbitos de hogar calculados utilizando los métodos MCP y FKB para M. atacamensis nos permitieron realizar una comparación de los tamaños de HR con otras especies del mismo género, debido a que son métodos tradicionales usados ampliamente. Rancourt et al. (2005) estimaron el ámbito de hogar (FKB 95%) de hembras de M. evotis entre 0.08 a 1.93 ha, mientras que Johnson y Gates (2008) calcularon entre 10.2 y 99.7 ha para hembras de M. leibii, ambos intervalos son inferiores a los obtenidos por el presente estudio (intervalo = 1.6 – 133.9 ha). Coleman et al. (2014) obtuvo un ámbito de hogar (FKB 95%) entre 33 y 102 ha para hembras de M. lucifugus, valor más amplio que los autores mencionados previamente; sin embargo, está por debajo del mayor intervalo registrado en nuestro estudio. El ámbito de hogar (FKB 95%) determinado para M. sodalis fue en promedio de 1137.13 ± 144.06 ha, valor que estaría por encima del ámbito de hogar calculado para M. atacamensis (48 ± 74.5 ha) (Womack et al., 2013). Utilizando el método de MCP 100%, Zeale et al. (2016) calcularon un ámbito de hogar entre 130.9 y 2,468.7 ha en diferentes sitios de muestreo para hembras de M. nattereri, mientras que en nuestro estudio se obtuvo un valor promedio por debajo de este (intervalo = 0.2 – 3.1 ha), pero con el análisis de MCP 95%.
El ámbito de hogar para M. atacamensis estuvo localizado principalmente sobre cobertura vegetal de terrenos de cultivo (siendo predominante los cultivos de alfalfa y maíz) con un porcentaje de 71 – 75%; esto debido aparentemente por una mayor disponibilidad de alimento proporcionado por las áreas agrícolas del valle, sabiendo que esta especie se alimenta principalmente de insectos (Kunz et al., 2011). Dichos cultivos estuvieron ubicados próximos al río Vítor, que estaría coincidiendo con Iriarte (2008), quien observó ejemplares alimentándose de insectos cerca de cuerpos de agua.
Cabe resaltar que la distribución altitudinal de M. atacamensis comprende desde el nivel del mar hasta los 2,436 m snm (Wilson, 2008). Si bien el presente estudio fue realizado a 1,194 m snm, es probable que futuras investigaciones de ámbito de hogar en otras elevaciones obtengan datos distintos a nuestros resultados.
Myotis atacamensis habita el desierto del Pacífico, en zonas áridas, valles costeros y zonas agrícolas, utilizando como refugios árboles huecos, cuevas y construcciones humanas como minas abandonadas, edificios, entre otros, lo cual estaría en concordancia con los refugios que se encontraron en el presente estudio (Mann, 1978; Iriarte, 2008). En la iglesia que usaron como refugio en la localidad de Vítor se observó una predominancia de hembras en comparación a machos (proporción de 30 a 2), situación documentada para otras especies de murciélagos, que pueden contar con refugios separados o como es el caso de Myotis capaccinii del que se han registrado grandes colonias de maternidad con la presencia de pocos machos adultos (Altringham, 1996; Papadatou et al., 2008). Dicho panorama aparentemente estaría sesgando los estudios de ámbito de hogar en el género Myotis, debido a que éstos se han centrado en estudios de hembras, como es el caso de Owen et al. (2003) y Womack et al. (2013), que utilizaron hembras preñadas y/o lactantes para estimar los ámbitos de hogar de M. septentrionalis y M. sodalis,
respectivamente.
El ámbito de hogar para Amorphochilus schnablii estuvo localizado sobre las coberturas de: desierto costero (84 a 88%), con la presencia de algunas construcciones humanas en desuso y terrenos de cultivo (15 a 20%), lo que concuerda con Sanborn (1941) e Ibáñez (1985), quienes observaron a la especie en valles cultivados próximos a construcciones humanas, así como en espacios intervenidos. Teniendo en cuenta que la mayor cantidad de localizaciones para A. schnablii se encuentran en ambientes con cierto grado de intervención, se sospecha que la especie podría tener cierta tolerancia o adaptabilidad a la intrusión humana presentando una estrategia de percha generalista, sin embargo, al vivir con los humanos, o cerca de ellos, los murciélagos son vulnerables a la depredación o perturbación humana, como lo ocurrido en el norte de Perú, donde se quemó un gran lugar de descanso (Guerra et al., 2020; Tirira y Carrera, 2011).
Amorphochilus schnablii se encuentra típicamente en elevaciones bajas a medias entre 5 m snm y 2,000 m snm donde el desarrollo y conversión de hábitat para la agricultura es prominente coincidiendo con lo reportado en el presente estudio que fue realizado a 726 m snm (Tirira et al., 2012; Velazco et al., 2015).
Comparando los tamaños de AH, AF y AUP entre los individuos de A.schnablii, se obtuvo un mayor tamaño para los machos As_M164 y As_M261 evaluados en enero y julio del 2019, respectivamente; mientras que para los individuos evaluados durante octubre y noviembre del 2019, se obtuvo un mayor tamaño de AH, AF y AUP para la hembra As_F464 en comparación al macho As_M253 (tabla 1). Por consiguiente, los murciélagos probablemente responden a señales ambientales como la temperatura, la lluvia y la abundancia de insectos (Guerra et al., 2020).
Canals y Cattan (2008) y Velazco et al. (2015) reportaron que la dieta de A. schnablii es a base de insectos —dípteros y lepidópteros nocturnos— que caza al vuelo. El área de forrajeo estimado en el presente estudio muestra que A. schnablii forrajea predominantemente sobre áreas desérticas, en las cuales se pudo observar la presencia de vías carrozables con alumbrado público. Cabe resaltar que para algunas noches de evaluación, ciertos individuos se quedaron forrajeando cerca a los postes de alumbrado público.
Amorphochilus schnablii se puede encontrar en colonias entre 5 y 300 individuos en refugios como fisuras de roqueríos naturales, cuevas, minas abandonadas y se le ha visto habitando casas y generalmente las colonias están formadas por individuos de ambos sexos (Aragón y Aguirre, 2014; Falcão et al., 2015; Fischer, 1978; Galaz y Yáñez, 2006; Ibáñez, 1985; Ortiz-De La Puente, 1951; Velazco et al., 2015). Para el presente trabajo se registró una colonia de 50 individuos aproximadamente, coincidiendo con Ibáñez (1985), que reportó colonias monoespecíficas de hasta 300 individuos de ambos sexos, aunque las colonias pueden incluir otras especies como Glossophaga soricina valens (Ortiz-De La Puente, 1951). La colonia registrada en el presente estudio estuvo constituida en su mayoría por individuos machos, dato coincidente con lo reportado por Guerra et al. (2020).
Las localidades de muestreo se ajustarían a la premisa de que los murciélagos seleccionan hábitats que satisfacen las necesidades de alimentación, descanso y recursos hídricos (Hayes y Adam, 1996; Hayes y Loeb, 2007; Krusik et al., 1996; Kunz, 1973). Por consiguiente, es acertado considerar a los valles costeros como fuentes importantes de biodiversidad.
Amorphochilus schnablii presentó un ámbito de hogar mayor a Myotis atacamensis, lo cual podría ser efecto de la disponibilidad de alimento y la cercanía del área de forrajeo al refugio. Teniendo en cuenta que Huatiapa es un valle estrecho que no presenta gran cantidad de cultivos, se sospecha que A. schnablii tendría que desplazarse una mayor distancia para obtener alimento; sin embargo, sería necesario incluir información de machos de M. atacamensis para hacer una comparación adecuada del tamaño de ámbito de hogar.
Cabe mencionar que aquí se presenta el primer estudio que describe el ámbito de hogar de M. atacamensis y A. schnablii, ya que, debido a su bajo peso corporal (en promedio: 2.95 g y 3.95 g respectivamente), no se han realizado estudios de radiotelemetría previamente, debido a que la premisa de que éstos se han centrado principalmente en los murciélagos de gran tamaño (Anthony y Sánchez, 2019; Pari et al., 2015). La gran variabilidad en el rango de área de forrajeo para A. schnablii podría estar relacionado con la edad, sexo y peso de cada individuo o por la disponibilidad de alimento, sin embargo se necesitan más estudios para establecer estas relaciones (Rydell, 1993). La teoría sugiere que las tasas de movimiento deberían disminuir cuando los animales viajan a través de áreas ricas en recursos, mientras que sitios con baja disponibilidad de forraje o alto riesgo de depredación, pueden estimular mayores tasas de movimiento (Avgar et al., 2011; Englund y Olsson, 1996; Frair et al., 2005; Gilliam y Fraser, 2001; Pyke et al., 1977).
El conocimiento de los movimientos espaciales de M. atacamensis y A. schnablii es importante ya que nos permite una mayor comprensión de las posibles respuestas al cambio de su ambiente y la composición de la población debido a que los patrones de movimiento resultan de las interacciones entre los animales y sus entornos (Johnson et al., 1992; Oleksy et al., 2019, Schick et al., 2008). Por consiguiente, considerando la categoría de amenaza de ambas especies, es necesario realizar más estudios de este tipo para una mejor comprensión de su ecología, lo que permitirá una mejor protección de hábitats claves y sitios de descanso a través de la generación de planes de manejo y conservación de M. atacamensis y A. schnablii en el Perú.
Agradecimientos
El presente proyecto fue subvencionado por la Universidad Nacional de San Agustín de Arequipa (Contrato de Subvención No TP-13-2019-UNSA) y con apoyo del Proyecto “Servicios ecosistémicos proporcionados por fauna silvestre en la Región de Arequipa: un enfoque desde los murciélagos y su función reguladora de insectos plaga” (Contrato de Financiamiento N° IBA-0014-2017-UNSA). Se agradece al Servicio Nacional Forestal y de Fauna Silvestre (SERFOR) por facilitarnos la autorización de investigación (RDG N° 370-2018-339 MINAGRI-SERFOR-DGGSPFFS). También agradecemos a Henry Condori, Carolina Herrera, Max Camilo y Diana Samanez, por su invaluable apoyo en los trabajos de campo; así como también a Emperatriz Delgado y a Judith Cáceres por su acogedora hospitalidad en sus predios.
Referencias
Agnelli, P., Martinoli, A., Patriarca, E., Russo, D., Scaravelli, D. y Genovesi, P. (2004). Guidelines for bat monitoring: methods for the study and conservation of bats in Italy. Quad. Cons. Natura 19bis. Min. Ambiente – ISPRA. Italia.
Altringham, J. D. (1996). Bats: biology and behavior. New York: Oxford University Press.
Anthony, C. R. y Sánchez, D. M. (2019). Resource selection and space use of Myotis evotis in a western juniper woodland in Oregon. Journal of Mammalogy, 100, 239–248. https://doi.org/10.1093/jmammal/gyy150
Apoznański, G., Sánchez-Navarro, S., Kokurewicz, T., Pettersson, S. y Rydel, J. (2018). Barbastelle bats in a wind farm: are they at risk? European Journal of Wildlife Research, 64, 43. https://doi.org/10.1007/s10344-018-1202-1
Aragón, A. y Aguirre, M. (2014). Distribución de murciélagos (Chiroptera) de la Región Tacna, Perú. Idesia (Chile), 3, 119–127. https://doi.org/10.4067/s0718-34292014000100015
Avgar, T., Kuefler, D. y Fryxell, J. M. (2011). Linking rates of diffusion and consumption in relation to resources. The American Naturalist, 178, 182–190. https://doi.org/10.1086/660825
Börger, L., Francon, N., De Michele, G., Gantz, A., Meschi, F., Manica, A. et al. (2006). Effects of sampling regime on the mean and variance of home range size estimates. Journal of Animal Ecology, 75, 1393–1405. https://doi.org/10.1111/j.1365-2656.2006.01164.x
Brander, R. B. y Cochran, W. (1969). Radio-location telemetry. En R. H. Giles (Ed.) Wildlife management techniques manual (pp. 95–103). Washington, D.C.: The Wildlife Society.
Brunet-Rossinni, A. K. y Wilkinson, G. S. (2009). Methods for age estimation and the study of senescence in bats. En T. H. Kunz and S. Parsons (Eds.) Ecological and behavioral methods for the study of bats. 2nd Edition (pp. 315–325). Baltimore: Johns Hopkins University Press.
Calenge, C. (2006). The package adehabitat for the R software: a tool for the analysis of space and habitat use by animals. Ecological Modelling, 197, 516–519. https://doi.org/10.1016/j.ecolmodel.2006.03.017
Canals, M. y Cattan, P. (2008). Radiografía de los murciélagos de Chile. Santiago, Chile: Editorial Universitaria.
Chung, C., Sung, K. y Sang, H. (2013). Diurnal roosts selection and home range size in the Myotis Aurascens (Chiroptera: Vespertilionidae) inhabiting a rural area. Journal of the Enviromental Sciences International, 22, 1227–1234. https://doi.org/10.5322/JESI.2013.22.9.1227
Coleman, L. S., Ford, W. M., Dobony, C. A. y Britzke, E. R. (2014). Comparison of radio-telemetric home-range analysis and acoustic detection for little brown bat habitat evaluation. Northeastern Naturalist, 21, 431–445. https://doi.org/10.1656/045.021.0309
Cooke, S. J., Hinch, S. G., Wikelski, M., Andrews, R. D., Kuchel, L. J., Wolcott, T. G. et al. (2004). Biotelemetry: a mechanistic approach to ecology. Trends in Ecology and Evolution, 19, 334–343. https://doi.org/10.1016/j.tree.2004.04.003
De Solla, S. R., Bonduriansky, R. y Brooks, R. J. (1999). Eliminating autocorrelation reduces biological relevance of home range estimates. Journal of Animal Ecology, 68, 221–234. https://doi.org/10.1046/j.1365-2656.1999.00279.x
Englund, G. y Olsson, T. (1996). Treatment effects in a stream fish enclosure experiment: influence of predation rate and prey movements. Oikos, 77, 519–528. https://doi.org/10.2307/3545941
Falcão, F., Ugarte-Núñez, J. A., Faria, D. y Caselli, C. B. (2015).Unravelling the calls of discrete hunters: acoustic structure of echolocation calls of furipterid bats (Chiroptera, Furipteridae). Bioacoustics, 24, 175–183. https://doi.org/10.1080/09524622.2015.1017840
Fischer, G. M. (1978). Los pequeños mamíferos de Chile. Santiago, Chile: Universidad de Concepción.
Frair, J. L., Merrill, E. H., Visscher, D. R., Fortin, D., Beyer, H. L. y Morales, J. M. (2005). Scales of movement by elk (Cervus elaphus) in response to heterogeneity in forage resources and predation risk. Landscape Ecology, 20, 273–287. https://doi.org/10.1007/s10980-005-2075-8
Galaz, J. L. y Yáñez, J. (2006). Los murciélagos de Chile: guía para su reconocimiento. Santiago, Chile: Ediciones del Centro de Ecología Aplicada.
García, J. y Llamoca, R. (2017). Análisis del potencial turístico del valle de Vítor y sus posibilidades para una ruta del pisco Arequipa (Tesis). Escuela profesional de Turismo y Hotelería. Facultad de Ciencias Histórico Sociales. Universidad Nacional de San Agustín. Arequipa, Perú.
García-Morales, R., Badano, E. I. y Moreno, C. E. (2013). Response of Neotropical bat assemblages to human land use. Conservation Biology, 27, 1096–1106. https://doi.org/10.1111/cobi.12099
Garner, J. D. y Gardner, J. E. (1992). Determination of summer distribution and habitat utilization of the Indiana bat (Myotis sodalis) in Illinois. Final report: Project E-3 Endangered Species Act Section 6 Report. Illinois Department of Conservation.
Garton, E. O., Wisdom, M. J., Leban, F. A. y Johnson, B. K. (2001). Experimental design for radiotelemetry studies. En J. J. Millspaugh y J. M. Marzluffe (Eds.), Radio tracking and animal populations (pp. 15–42). San Diego, California: Academic Press.
Getz, W. M., Fortmann-Roe, S., Cross, P. C., Lyons, A. J., Ryan, S. J. y Wilmers, C. C. (2007). LoCoH: Nonparameteric kernel methods for constructing home ranges and Utilization Distributions. Plos One, 2, e207. https://doi.org/10.1371/journal.pone.0000207
Getz, W. M. y Wilmers, C. C. (2004). A local nearest-neighbor convex-hull construction of home ranges and utilization distributions. Ecography, 27, 489–505. https://doi.org/10.1111/j.0906-7590.2004.03835.x
Gilliam, J. F. y Fraser, D. F. (2001). Movement in corridors: enhancement by predation threat, disturbance, and habitat structure. Ecology, 82, 258–273. https://doi.org/10.2307/2680101
Guerra, J., Ineson, K. M. y Swing, K. (2020) Range extension and natural history observations for the smoky bat (Amorphochilus schnablii). Mastozoología Neotropical, 27, 96–102. https://doi.org/10.31687/saremMN.20.27.1.0.02
Harris, S., Cresswell, W. J., Forde, P. G., Trewhella, W. J., Woollard, T. y Wray, S. (1990). Home-range analysis using radiotracking data: a review of problems and techniques particularly as applied to the study of mammals. Mammal Review, 20, 97–123. https://doi.org/10.1111/j.1365-2907.1990.tb00106.x
Hayes, J. P. y Adam, M. D. (1996). The influence of logging riparian areas on habitat utilization by bats in western Oregon. En R. M. R. Barclay y R. M. Brigham (Eds.), Bats and forest symposium (pp. 228–237). Victoria, British Columbia: British Columbia Ministry of Forests.
Hayes, J. P. y Loeb, S. C. (2007). The influences of forest management on bats in North America. En M. J. Lacki, J. P. Hayes y A. Kurta (Eds.), Bats in forests: conservation and management (pp. 207–235). Baltimore, Maryland: The Johns Hopkins University Press.
Hutson, A. M., Mickleburgh, S. P. y Racey, P. A. (2001). Microchiropteran bats: global status survey and conservation action plan. Gland, Switzerland and Cambridge, UK: IUCN/ SSC Chiroptera Specialist Group.
Ibáñez, C. (1985). Notes on Amorphochilus schnablii (Chiroptera, Furipteridae). Mammalia, 49, 584–587.
INEI (Instituto Nacional de Estadística e Informática). (2017). Oficina departamental de estadística e informática Arequipa (2017). Compendio estadístico Arequipa 2017.
Iriarte, A. (2008). Mamíferos de Chile. Barcelona: Lynx Edicions.
Johnson, A. R., Wiens, J. A., Milne, B. T. y Crist, T. O. (1992). Animal movements and population-dynamics in heterogeneous landscapes. Landscape Ecology, 7, 63–75. https://doi.org/10.1007/BF02573958
Johnson, J. B. y Gates, J. E. (2008). Spring migration and roost-selection of female Myotis leibii in Maryland. Northeastern Naturalist, 15, 453–460. https://doi.org/10.1656/1092-6194-15.3.453
Kirkpatrick, L., Graham, J., McGregor, S., Munro, L., Scoarize, M. y Park, K. (2018). Flexible foraging strategies in Pipistrellus pygmaeus in response to abundant but ephemeral prey. Plos One, 13, e0204511. https://doi.org/10.1371/journal.pone.0204511
Kniowski, A. y Gehrt, S. (2014). Home range and habitat selection of the Indiana bat in an agricultural landscape. The Journal of Wildlife Management, 78, 503–512. https://doi.org/10.1002/jwmg.677
Kosaka, R., Lizárraga, A., Arias, H., Ticona, J., Farfán, E. y Campano, J. (2001). Estudio geodinámico y evaluación de peligros del valle de Majes. Convenio Universidad Nacional de San Agustín (UNSA)- INDECI. Proyecto PER 98/018 PNUD – INDECI. Arequipa, Perú.
Krusik, R. A., Yamasaki, M., Neefus, C. D. y Pekins P. J. (1996). Bat habitat use in the White Mountain National Forest. Journal of Wildlife Management, 60, 625–631.
Kunz, T. H. (1973). Resource utilization: temporal and spatial components of bat activity in central Iowa. Journal of Mammalogy, 54, 14–32. https://doi.org/10.2307/1378869
Kunz, T. H., De Torrez, E. B., Bauer, D., Lobova, T. y Fleming, T. H. (2011). Ecosystem services provided by bats. Annals of the New York Academy of Sciences, 1223, 1–38. https://doi.org/10.1111/j.1749-6632.2011.06004.x
Lacki, M. J., Amelon, S. K. y Baker, M. D. (2006). Foraging ecology of bats in forests. En M. J. Lacki, J. P. Hayes y A. Kurta (Eds.), Bats in forests: conservation and management. Baltimore, Maryland: Johns Hopkins University Press.
Málaga, B. A., Díaz, D. R., Arias, S. y Medina, C. E. (2020). Una nueva especie de Lasiurus (Chiroptera: Vespertilionidae) del suroeste de Perú. Revista Mexicana de Biodiversidad, 91, e913096. http://dx.doi.org/10.22201/ib.20078706e.2020.91.3096
Mann, G. (1978). Los pequeños mamíferos de Chile. Gayana Concepción, 40, 1–342.
Medina, C. E., Díaz, D. R., Málaga-Téllez, B., Medina, Y. K. y López, E. (2018). Second record of Eumops chiribaya (Chiroptera: Molossidae) in Perú. Biodiversitas, 19, 1979–1984. https://doi.org/10.13057/biodiv/d190601
Meyer, C. F. J., Weinbeer, M. y Kalko, E. K. V. (2005). Home range size and spacing patterns of Macrophyllum macrophyllum (Phyllostomidae) foraging over water. Journal of Mammalogy, 86, 587–598. https://doi.org/10.1644/1545-1542(2005)86[587:HSASPO]2.0.CO;2
Ministerio de Agricultura y Riego. (2014). Decreto Supremo que aprueba la actualización de la lista de clasificación y categorización de las especies amenazadas de fauna silvestre legalmente protegidas: DECRETO SUPREMO Nº 004-2014-MINAGRI. El Peruano Normas legales, 520497–520504.
Ministerio del Ambiente. (2015). Mapa Nacional de cobertura vegetal – memoria descriptiva. Ministerio del Ambiente, Dirección General de Evaluación, Valoración y Financiamiento del Patrimonio Natural. Lima, Perú.
Mohr, C. O. (1947). Table of equivalent populations of North American small mammals. The American Midland Naturalist, 37, 223–249.
Morgan, G. S. y Czaplewski, N. J. (1999). First fossil record of Amorphochilus schnablii (Chiroptera: Furipteridae), from the late Quaternary of Peru. Acta Chiropterologica, 1, 75–79.
Norberg, U. M. y Rayner, J. M. V. (1987). Ecological morphology and flight in bats (Mammalia: Chiroptera): wing adaptations, flight performance, foraging strategy and echolocation. Philosophical Transactions of the Royal Society London, B. Biological Sciences, 316, 335–427. https://doi.org/10.1098/rstb.1987.0030
Oleksy, R. Z., Ayady, C. L., Tatayah, V., Jones, C., Howey, P. W., Froidevaux, J. S. P. et al. (2019). The movement ecology of the Mauritian flying fox (Pteropus niger): a long-term study using solar-powered GSM/GPS tags. Movement Ecology, 7, 12. https://doi.org/10.1186/s40462-019-0156-6
Ortiz-De La Puente, J. (1951). Estudio monográfico de los quirópteros de Lima y alrededores. Publicaciones del Museo de Historia Natural “Javier Prado.” U.N.M.S.M. Serie A, 7, 1–48.
Owen, S. F., Menzel, M. A., Ford, W. M., Chapman, B. R., Miller, K. V., Edwards, J. W. et al. (2003). Home-range size and habitat used by the Northern Myotis (Myotis septentrionalis). The American Midland Naturalist, 150, 352–359. https://doi.org/10.1674/0003-0031(2003)150[0352:HSAHUB]2.0.CO;2
Papadatou, E., Butlin, R. K. y Altringham, J. D. (2008). Seasonal roosting habits and population structure of the long-fingeredbat Myotis capaccinii in Greece. Journal of Mammalogy, 89, 503–512. https://doi.org/10.1644/07-MAMM-A-163R1.1
Pari, A., Pino, K. S., Medina, C. E., Zeballos, H. y López, E. (2015). Murciélagos de Arequipa, historia natural y conservación. Colección Científica, Museo de Historia Natural de la Universidad Nacional de San Agustín (MUSA). Impresiones Juve EIRL.
Pyke, G. H., Pulliam, H. R. y Charnov, E. L. (1977). Optimal foraging: a selective review of theory and tests. The Quarterly Review of Biology, 52, 137–154. https://doi.org/10.1086/409852
Rancourt, S. J., Rule, M. I. y O’Connell, M. A. (2005). Maternity roost site selection of long-eared Myotis, Myotis evotis. Journal of Mammalogy, 86, 77–84. https://doi.org/10.1644/11-MAMM-A-153.1
Rydell, J. (1993). Variation in foraging activity of an aerial insectivorous bat during reproduction. Journal of Mammalogy, 74, 503–509. https://doi.org/10.2307/1382411
Sanborn, C. C. (1941). Description and records of Neotropical bats. Field Museum of Natural History, Zoology Series, 27, 371–385.
Schick, R. S., Loarie, S. R., Colchero, F., Best, B. D., Boustany, A., Conde, D. A., et al. (2008). Understanding movement data and movement processes: current and emerging directions. Ecology Letters, 11, 1338–1350. https://doi.org/10.1111/j.1461-0248.2008.01249.x
Tirira, D. G., Burneo, S. F., Swing, K., Guerra, J. y Valle, T. D. (2012). Comentarios sobre la distribución de Amorphochilus schnablii Peters, 1877 (Chiroptera, Furipteridae) en Ecuador. En D. G. Tirira y S. F. Burneo (Eds.), Investigación y conservación sobre murciélagos en el Ecuador (pp. 209–216). Quito: Pontificia Universidad Católica del Ecuador/ Fundación Mamíferos y Conservación/ Asociación Ecuatoriana de Mastozoología. Publicación especial sobre los mamíferos del Ecuador 9.
Tirira, D. G. y Carrera, J. P. (2011). Murciélago ahumado (Amorphochilus schanblii). En D. G. Tirira (Ed.), Libro Rojo de los mamíferos del Ecuador, 2a edición (pp. 127–128). Quito: Fundación Mamíferos y Conservación/ Pontificia Universidad Católica del Ecuador/ Ministerio del Ambiente. Publicación especial sobre los mamíferos del Ecuador 8.
U. S. Fish, y Wildlife Service. (2007). Indiana bat (Myotis sodalis) draft recovery plan: first revision. U. S. Fish and Wildlife Service, Fort Snelling, MN.
Vargas-Rodríguez, R., Peñaranda, D., Ugarte-Núñez, J., Rodríguez-San Pedro, A., Ossa-Gomez, G. y Gatica-Castro, A. (2016). Myotis atacamensis. En IUCN 2019. The IUCN Red List of threatened Species. Version 2019.1. Recuperado el 14 octubre 2019, de www.iucnredlist.org
Velazco, P. (2016). Tomopeas ravus. En IUCN 2019. The IUCN Red List of threatened Species. Version 2020.1 Recuperado el 03 abril 2019, de www.iucnredlist.org
Velazco, P., Huamani, L. y Cadenillas, R. (2015). Amorphochilus schnablii. En IUCN 2019. The IUCN Red List of threatened Species. Version 2019.1 Recuperado el 14 octubre 2019, de www.iucnredlist.org
Vincent, S., Nemoz, M. y Aulagnier, S. (2011). Activity and foraging habitats of Miniopterus schreibersii (Chiroptera, miniopteridae) in southern France: implications for its conservation. Hystrix, the Italian Journal of Mammalogy, 22, 57–72. https://doi.org/10.4404/hystrix-22.1-4524
White, G. C. y Garrott, R. A. (1990). Analysis of wildlife radio tracking data. New York: Harcourt Brace Jovanovich.
Wilson, D. E. (2008). Genus Myotis. En A. L. Gardner (Ed.), Mammals of South America, Vol. 1. Marsupials, xenarthrans, shrews and bats (pp. 468–480). Chicago: The University of Chicago Press.
Womack, K. M., Amelon, S. K. y Thompson, F. R. (2013). Summer home range size of female Indiana bats (Myotis sodalis) in Missouri, USA. Acta Chiropterologica, 15, 423–429. https://doi.org/10.3161/150811013X679044
Zeale, M. R. K., Bennitt, E., Newson, S. E., Packman, C., Browne, W. J., Harris, S., et al. (2016). Mitigating the impact of bats in historic churches: The response of Natterer’s Bats Myotis nattereri to artificial roosts and deterrence. Plos One, 11, e0146782. https://doi.org/10.1371/journal.pone.0146782