La condición sexual en los musgos mexicanos
Ana Paola Peña-Retes y Claudio Delgadillo-Moya *
Departamento de Botánica, Instituto de Biología, Universidad Nacional Autónoma de México, Apartado postal 70-233, 04510 Ciudad de México, México
*Autor para correspondencia: moya@unam.mx (C. Delgadillo-Moya)
Resumen
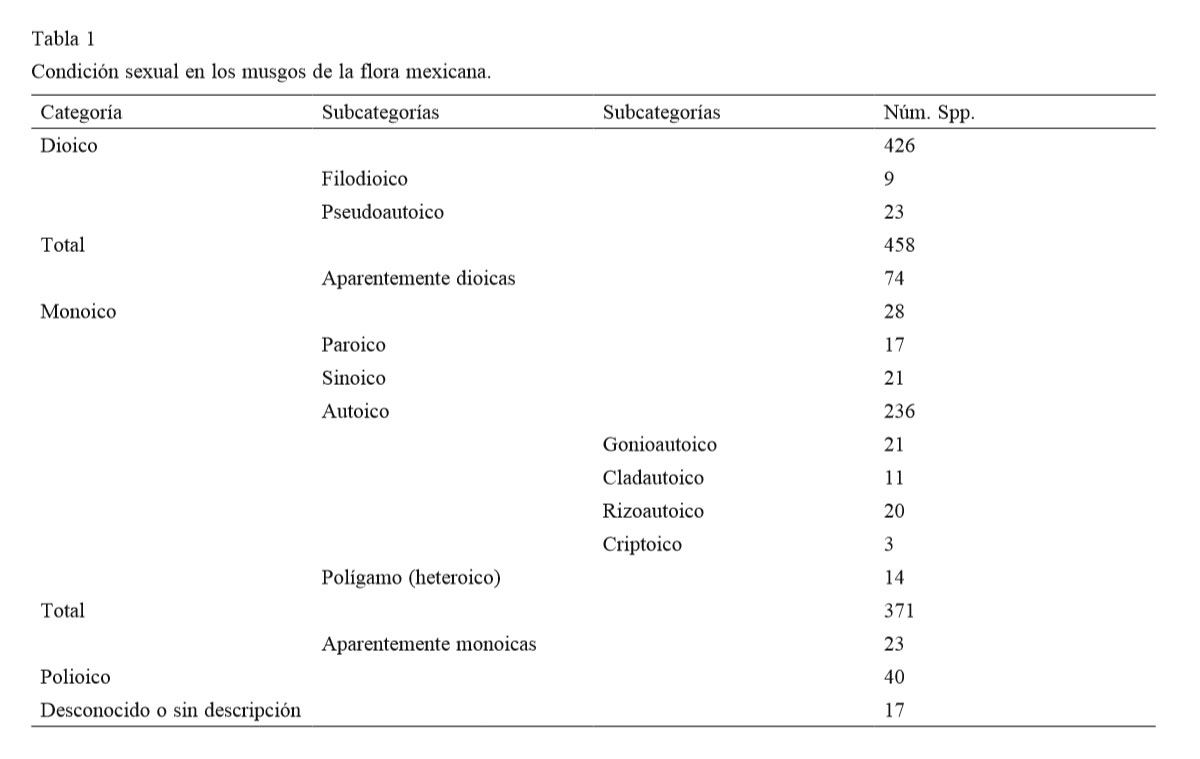
Para determinar la proporción de musgos dioicos o monoicos en la flora mexicana se preparó una base de datos de las 983 especies conocidas para México. Además se obtuvo información sobre formación de esporofitos y de propágulos para 829 especies. De este número, 458 (55%) especies son dioicas y 371 (45%) son monoicas. La condición sexual de las 154 especies remanentes es polioica, incierta o no existe información precisa. La tendencia a formar esporofitos es mayor en las especies monoicas, pero los musgos dioicos forman tanto esporofitos como propágulos en mayor proporción que los monoicos, pero la proporción de propágulos y esporofitos varía en las 13 familias más importantes de la flora mexicana. La expresión sexual en los musgos mexicanos sigue los patrones básicos de otras regiones en el mundo. Sin embargo, la investigación por familias puede ser ventajosa para determinar patrones particulares. En cada familia, se debe buscar la relación de la condición sexual con microhábitats, con la distribución geográfica local y con la producción de esporofitos y de propágulos.
Palabras clave:
Expresión sexual; Dioico; Monoico; Bryophyta; México
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Sexual condition in Mexican mosses
Abstract
The proportion of dioicous or monoicous mosses in the Mexican flora was determined with the aid of a database for 983 species reported from Mexico. Information was available for 829 species, 458 (55%) of which are dioicous and 371 (45%) are monoicous. The remaining 154 species are either polyoicous, or have uncertain or unknown sexuality. Sporophytes are more frequently found in monoicous taxa, but the dioicous species produce both sporophytes and propagulae more frequently than the monoicous species, but the proportion of asexual structures and sporophytes vary in 13 of the most important moss families in Mexico. Mexican mosses, in general, follow similar sexual expression patterns as those in other parts of the world. Research by family may be advantageous to identify specific patterns. The relationship between sexual condition and microhabitat, regional geographical distribution or sporophyte and propagule production should be investigated for each family.
Keywords:
Sexual expression; Dioicous; Monoicous; Bryophyta; Mexico
La condición sexual puede verse afectada por numerosos factores que incluyen los cambios climáticos cuya intensidad puede hacer que las plantas de un sexo desaparezcan; también la sensibilidad al estrés y el costo de la reproducción pueden influir en la condición sexual (Bisang et al., 2006; Glime, 2007; Ignatov et al., 2009). En sitios con sequía extrema los musgos monoicos son frecuentes por lo que podría pensarse que algunas estrategias y formas de vida están estrechamente ligadas a la condición sexual (During, 1979, Laenen et al., 2016). En algunos musgos hay mayor frecuencia del sexo femenino en hábitats sombreados y expuestos; las plantas masculinas solo son frecuentes en hábitats sombreados (Bowker et al., 2000).
Además de la influencia ambiental, la expresión sexual está regulada por factores intrínsecos. Los cromosomas sexuales X y Y y el nivel de ploidía pueden determinar el carácter masculino y femenino en muchas especies; los bivalentes dimórficos en Macromitrium y Schlotheimia intervienen en la determinación sexual produciendo machos enanos. Estos y otros componentes cromosómicos también han sido objeto de estudio (Anderson, 1980; Crawford et al., 2009; Doyle, 1970; Glime, 2007; Ramsey y Berrie, 1982; Vitt, 1968). Hormonas como las auxinas, giberelinas y citoquininas, pueden inhibir o inducir la formación de anteridios y arquegonios. La respuesta a la combinación de dichos factores es variable en cada especie (Glime, 2013).
Materiales y métodos
revisiones y monografías o descripciones originales de las especies. En casos excepcionales, la presencia de esporofitos y estructuras asexuales fue revisada en ejemplares de herbario.
Resultados
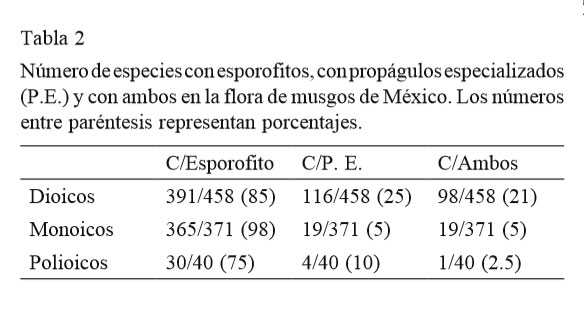
Tomando en cuenta las consideraciones de la introducción, además de identificar miembros de las 2 grandes condiciones sexuales, es importante saber la proporción de la flora que produce estructuras asexuales de reproducción y esporofitos (tabla 2). De manera general, los musgos mexicanos pueden producir tubérculos rizoidales, yemas (axilares, foliares) y ramas flagelíferas variables en forma, tamaño, color y posición sobre el gametofito. Son frecuentes y características en algunos taxa como, por ejemplo, las yemas claviformes de las Calymperaceae, las yemas unicelulares negras de Bryoerythrophyllum inaequalifolium o las ramas flagelíferas de Pseudocryphaea domingensis. Es deseable determinar si los musgos que producen yemas, forman esporofitos al mismo tiempo.
Los esporofitos son conocidos para la mayoría de las especies de musgos mexicanos, aunque por la naturaleza del estudio, aquí solo se registra su presencia. Entre las especies monoicas, los esporofitos no se conocen para
Discusión
En el conjunto de las 13 familias de musgos mexicanos más importantes, las especies dioicas son más numerosas que las monoicas, pero en las Bartramiaceae, Bryaceae y Pottiaceae, esa diferencia es notable (tabla 3). La disparidad en la proporción de especies dioicas con respecto a las monoicas podría deberse a mecanismos de selección ambiental que favorecen al dioicismo. Las Pottiaceae, por ejemplo, habitan en sitios donde la falta de agua no es obstáculo para el éxito reproductivo de las especies dioicas. A diferencia de ellas, las Fissidentaceae, que habitan en ambientes húmedos, son preferentemente monoicas. Esta observación, sin embargo, es contraria a la expresada por Wyatt (1982: 181, 183; véase también During, 1979; Laenen et al., 2016).
La investigación por familia podría aportar datos sobre las ventajas de su condición sexual en ambientes particulares. En las Orthotrichaceae, por ejemplo, la condición principalmente monoica parece tener ventajas sobre la condición dioica pues la fecundación cruzada es una dificultad inherente al ambiente de troncos y ramas donde habita la mayoría. Sin embargo, desconocemos si las especies mexicanas poseen mecanismos que previenen la autofecundación y son funcionalmente dioicas.
En México no se han examinado poblaciones de musgos monoicos para determinar la existencia de protandria o protoginia, pero en consideración al número de especies monoicas (371, tabla 1), podría pensarse que cualquiera de las 2 podría ser responsable de la formación de esporofitos por fertilización cruzada. Longton (1994) y Glime (2007) indican que el monoicismo aumenta la autofecundación. Esta última podría dar lugar a una adaptabilidad reducida por la retención de genes adversos por lo que ciertas especies poseen mecanismos que suprimen la autofecundación (Glime, 2007).
Según Crawford et al. (2009), no existe alguna asociación entre la condición sexual y la reproducción asexual. Sin embargo, también se ha sugerido que la ausencia de uno de los sexos promueve la formación de propágulos asexuales (Glime, 2007). Entre las 983 especies mexicanas, apenas el 13% producen propágulos asexuales especializados; 116 son dioicas y 19 son monoicas. En este caso, como se mostró anteriormente, en las Bryaceae, Calymperaceae y Pottiaceae son frecuentes las especies dioicas que producen propágulos especializados. La importancia de estas estructuras radica en que, por medio de ellas, las colonias de musgos logran mantener su presencia cuando no hay reproducción sexual. La ausencia de propágulos especializados en las especies mexicanas no representa un obstáculo serio para la permanencia de las colonias pues todos los musgos son capaces de reproducirse asexualmente a partir de cualquier fragmento de su gametofito (Best, 1901; Glime, 2007; Hartmann y Jenkins, 1984; Longton, 1994; Longton y Schuster, 1983; Wyatt, 1982, 1994). En contraste, en Alemania 86% de las especies que producen yemas son dioicas, mientras que en Japón son más del 20% y en América del Norte 76% (Glime, 2007).
La distribución geográfica de las especies depende de los tipos de reproducción en cada una. Las esporas son el mecanismo más efectivo para colonizar nuevos hábitats (Longton, 1994; Wyatt, 1994) de manera que el área de distribución de las especies que producen esporas es más amplia que la de especies que no producen esporofitos (Gemmell, 1950). Por ejemplo, las especies británicas que no producen esporofitos, muestran una distribución muy estrecha o altamente disyunta (Longton y Schuster, 1983). Por ello, desde un punto de vista teórico, se podría sugerir que la tendencia a la mayor producción de esporofitos en las especies monoicas podría estar ligada a una menor frecuencia de aparición de estructuras asexuales en las especies mexicanas (tabla 3) y a áreas de distribución más amplias. En general, en las 13 familias mejor representadas en la flora de musgos mexicanos, las especies monoicas confirman la tendencia a formar menos propágulos asexuales. Sin embargo, no se puede demostrar que sus áreas de distribución sean más amplias pues los datos geográficos son limitados para muchas especies. Además, existen consideraciones ecológicas e históricas que pueden influir sobre el tamaño del área ocupada por las especies de musgos. En las hepáticas, Laenen et al. (2015) no encontraron correlación entre la frecuencia de producción de propágulos vegetativos y la condición dioica o entre el tamaño del área de distribución y la condición sexual en las especies monoicas.
La presente contribución muestra que la condición sexual en los musgos mexicanos sigue los patrones que se han observado en otras regiones. Hay áreas de investigación potencial que no se han revisado para las especies tropicales y que sería deseable explorar para nuestra flora. La condición sexual está significativamente relacionada con los cromosomas sexuales, el nivel de ploidía y los cambios en las características de los cromosomas (Crawford et al., 2009; Jesson et al., 2011). Ciertas diferencias genéticas pueden dar lugar a diferencias en la expresión sexual. De la misma manera, la investigación sobre las condiciones ambientales que afectan de forma diferente a las plantas masculinas y a las femeninas o el desequilibrio en las proporciones de masculinas y femeninas (Bisang et al., 2006; Glime, 2007) son temas que se podrían revisar para entender la biología de las especies tropicales.
A Eberto Novelo, por la revisión y crítica a una versión preliminar del manuscrito.
Anderson, L. E. (1980). Cytology and reproductive biology of mosses. En R. J. Taylor y A. E. Leviton (Eds.), The mosses of North America (pp. 37–76). San Francisco: AAAS – Pacific Division.
Best, G. N. (1901). Vegetative reproduction of mosses. The Bryologist, 4, 1–3.
Bisang, I., Eehrlén, J. y Hedenäs, L. (2006). Reproductive effort and costs of reproduction do not explain female-biased sex ratios in the moss Pseudocalliergon trifarium (Amblystegiaceae). American Journal of Botany, 93, 1313–1319.
Bowker, M. A., Stark, L. R., McLetchie, D. N. y Mishler, B. D. (2000). Sex expression, skewed sex ratios, and microhabitat distribution in the dioecious desert moss Syntrichia caninervis (Pottiaceae). American Journal of Botany, 87, 517–526.
Crawford, M., Jesson, L. K. y Garnock-Jones, P. J. (2009). Correlated evolution of sexual system and life-history traits in mosses. Evolution, 63, 1129–1142.
Crum, H. (2001). Structural diversity of bryophytes. Ann Arbor, Michigan: University of Michigan Herbarium.
Churchill, S. P. (1987). Systematics and biogeography of Jaffueliobryum (Grimmiaceae). Memoirs of the New York Botanical Garden, 45, 691–708.
Deguchi, H. (1977). Small male branches of Ptychomitrium (Grimmiaceae) arised from the base of vaginula inside the perichaetial leaf circle. Miscelanea Bryologica et Lichenologica, 7, 177–179.
Deguchi, H. y Takeda, Y. (1986). Reproductive phenology of four species of Ptychomitrium. Proceedings of the Bryological Society of Japan, 4, 73–78.
Delgadillo-Moya, C. (2010). Latmoss 2010. Briología Mexicana. Recuperado el 15 de junio de 2016 de: www.ibiologia.unam.mx/briologia/www/index/
Doyle, W. T. (1970). The bryology of higher cryptogams. London: The Macmillan Co.
During, H. J. (1979). Life strategies of Bryophytes: a preliminary review. Lindbergia, 5, 2–18.
Fulford, M. y Sharp, A. J. (1990). The leafy Hepaticae of Mexico: one hundred and twenty-seven years after C. M. Gottsche. Memoirs of the New York Botanical Garden, 63, 1–86.
Gemmell, A. R. (1950). Studies the Bryophyta. I. The influence of sexual mechanism on varietal production and distribution of British musci. New Phytologist, 49, 64–71.
Glime, J. M. (2007). Bryophyte ecology. Volume 1. Physiological Ecology. Sexual Strategies. Michigan Technological University. Recuperado el 13 de junio, 2016 de: http://www.bryoecol.mtu.edu/.
Glime, J. M. (2013). Ecophysiology of development: gametogenesis. In Bryophyte Ecology. Michigan Technological University and the International Association of Bryologists. Recuperado el 24 de noviembre, 2016 de: http://www.bryoecol.mtu.edu/chapters/5-8Gametogenesis.pdf.
Hartmann, E. y Jenkins, G. I. (1984). Photomorphogenesis of mosses and liverworts. En A. F. Dyer y J. G. Duckett (Eds.), The experimental biology of Bryophytes (pp. 203–228). London: Academic Press.
Ignatov, M. S., Ignatova, E. A., Afonina, O. M. y Teleganova, V. V. (2009). Moss diversity in Russia: general overview and analysis of the distribution of dioicous species. En S. I. Golovatch, O. L. Makarova, A. B. Babenko y L. D. Penev (Eds.). Species and communities in extreme environments (pp. 303–318). Moscow: Pensoft Publishers & KMK Scientific Press.
Jesson, L. K., Cavanagh, A. P. y Perley, D. S. (2011). Polyploidy influences sexual system and mating patterns in the moss Atrichum undulatum sensu lato. Annals of Botany, 107, 135–143.
Laenen, B., Machac, A., Gradstein, S. R., Shaw, B., Patiño, J., Désamoré, A. et al. (2015). Geographical range in liverworts: does sex really matter? Journal of Biogeography, 43, 627–635.
Laenen, B., Machac, A., Gradstein, S. R., Shaw, B., Patiño, J., Désamoré, A. et al. (2016). Increased diversification rates follow shifts to bisexuality in liverworts. New Phytologist, 210, 1121–1129.
Longton, R. E. (1994). Reproductive biology in bryophytes. The challenge and opportunities. Journal of the Hattori Botanical Laboratory, 76, 159–172.
Longton, R. E. (1997). Reproductive biology and life-history strategies. Advances in Bryology, 6, 65–101.
Longton, R. E. (2006). Reproductive ecology of bryophytes: what does it tell us about the significance of sexual reproduction? Lindbergia, 31, 16–23.
Longton, R. E. y Schuster, R. M. (1983). Reproductive biology. En R. M. Schuster (Ed.), New manual of bryology. Journal of the Hattori Botanical Laboratory, 1, 386–462.
McDaniel, S. F. y Perroud, P. F. (2012). Invited perspective: bryophytes as models for understanding the evolution of sexual systems. The Bryologist, 115, 1–11.
Ramsay, H. P. y Berrie, G. K. (1982). Sex determination in bryophytes. Journal of the Hattori Botanical Laboratory, 52, 255–274.
Sharp, A. J., Crum, H. y Eckel, P. M. (1994). The moss flora of Mexico. Memoirs of the New York Botanical Garden, 69, 1–1113.
Vanderpoorten, A. y Goffinet, B. (2009). Introduction to bryophytes. Cambridge: Cambridge University Press.
Vitt, D. H. (1968). Sex determination in mosses. The Michigan Botanist, 7, 195–203.
Wyatt, R. (1982). Population ecology of bryophytes. Journal of the Hattori Botanical Laboratory, 52, 179–198.
Wyatt, R. (1994). Population genetics of bryophytes in relation to their reproductive biology. Journal of the Hattori Botanical Laboratory, 76, 147–157.
Wyatt, R. y Anderson, L. E. (1984). Breeding systems in bryophytes. En A. F. Dyer y J. G. Duckett (Eds.), The experimental biology of bryophytes (pp. 39–64). London: Academic Press.