Julián Yessid Arias-Pineda a, *, Emilio Realpe a y Camila González-Rosasb
a Universidad de los Andes, Departamento de Ciencias Biológicas, Laboratorio de Zoología y Ecología Acuática, Cra. 1 Núm. 18 A- 70. Edificio J- 206, Bogotá, Colombia
b Universidad de los Andes, Departamento de Ciencias Biológicas, Centro de Investigaciones en Microbiología y Parasitología Tropical, Cra. 1 Núm. 18 A- 70. Bloque A- Segundo piso, Bogotá, Colombia
*Autor para correspondencia: jy.arias10@uniandes.edu.co (J.Y. Arias-Pineda)
Recibido: 20 marzo 2020; aceptado: 14 septiembre 2020
Resumen
Los pseudotelfúsidos forman parte de la fauna de ecosistemas acuáticos de Centro y Sudamérica. Poseen un endemismo marcado, siendo relevante conocer su distribución y ecología. Neostregeria macropa es un cangrejo endémico de la sabana de Bogotá, vulnerable y en peligro de extinción. Es por ello que se estableció y evaluó la distribución potencial y aspectos ecológicos, mediante modelaje de nicho ecológico utilizando los datos de presencia de la especie, variables ambientales de Word-Clim y los programas MaxEnt, R y Arcmap 10.1. Para dilucidar algunos aspectos del nicho se caracterizó la estructura poblacional a lo largo del año. Se registran nuevas localidades de N. macropa predichas por el modelo, encontrando que la altitud, la precipitación en octubre, enero, febrero, marzo y junio, y temperatura media mínima anual, son las variables que explican el modelo. Los datos obtenidos revelan, además, que esta especie posee estabilidad poblacional, estacionalidad y se encuentra predominando en cuerpos lénticos con presencia de limos, rocas y coberturas vegetales, con una distribución no uniforme; muestra preferencia por niveles altos de oxígeno disuelto (6.9-7.5 mg/l) y temperatura entre los 12-14 °C. Este estudio muestra aspectos de la biología del cangrejo N. macropa que pueden ser útiles para su conservación.
Palabras clave: Cangrejos; Conservación; Modelo; Nicho; Andes
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Spatial distribution and ecological aspects of Neostrengeria macropa (Decapoda: Pseudothelphusidae) in the Bogotá Savanna, Colombia
Abstract
Pseudothelphusids are part of the aquatic ecosystems’ fauna in Central and South America. They have a marked endemism, making relevant to know their distribution and ecology. Neostregeria macropa is a crab endemic to the Bogotá Savanna, vulnerable and endangered. That is why the potential distribution and ecological aspects were established and evaluated, through ecological niche modeling using the species presence data, Word-Clim environmental variables, and the MaxEnt, R, and Arcmap 10.1 programs. To elucidate some aspects of the niche, the population structure throughout the year was characterized. New locations of N. macropa predicted by the model are recorded, finding that altitude, precipitation in October, January, February, March and June, and mean annual minimum temperature, are the variables that explain the model. The data obtained also reveal that this species has population stability, seasonality, with a predominance of crabs in lentic bodies of water with the presence of silt, rocks and plant cover, with a non-uniform distribution; preferring high dissolved oxygen levels (6.9-7.5 mg/l), and temperature between 12-14 °C. This work shows aspects of the biology of N. macropa crab that could be useful for its conservation.
Keywords: Crabs; Conservation; Model; Niche; Andes
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Pseudothelphusidae es una familia de cangrejos de montaña, con rangos de distribución altitudinal entre los 0 y los 3,000 m snm, habitantes comunes de Centro y Sudamérica incluyendo México, Cuba y las Antillas, además de los Andes, la Orinoquía y la Amazonía (Campos, 2005a, b, 2007; Cumberlidge et al., 2009; Magalhães, 2001, 2003; Magalhães et al., 2016; Rodríguez, 1982; Rodríguez y Díaz, 1981; Rodríguez y Herrera, 1994; Rodríguez y Magalhaes, 2005). Colombia por ser un país rico en fuentes de agua y por tener 3 cordilleras que favorecen la gran diversidad en la carcinofauna de agua dulce, es el primer país en el neotrópico seguido de México, con mayor diversidad de cangrejos de la familia Pseudothelphusidae; representados por 14 géneros y 85 especies, siendo 79 de éstas endémicas del país (Campos, 2005a, b, 2007, 2010a, b; Campos y Magalhães, 2014; Cumberlidge et al., 2009; Magalhães et al., 2016; Rodríguez, 1982).
Dentro de la familia Pseudothelphusidae, el género Neostrengeria Pretzmann, 1965 endémico de Colombia, comprende un grupo de especies que habitan en alta montaña, restringidos a la cordillera Oriental Colombiana, en las cuencas del Magdalena, Orinoco y Catatumbo (Campos, 1992, 1994; Campos y Rodríguez, 1985). Dentro del género existen especies importantes como N. macropa (Milne-Edwards, 1853), endémica de la sabana de Bogotá, habitante común de cuerpos de agua de montaña a altitudes entre 2,200 y 2,900 m, con temperaturas bajas y altas concentraciones de oxígeno disuelto (Campos, 2005a; Ortiz, 1981). Neostrengeria macropa reviste gran importancia ya que es una de las 2 especies de cangrejo que habita en ecosistemas de alta montaña junto con N. boyacencis, encontrándose hasta los 3,000 m. Neostrengeria macropa está distribuido sobre el altiplano cundiboyacense y la sabana de Bogotá, en cuerpos de aguas lénticas como quebradas, riachuelos, zanjas y lagunas, habitando junto con otra fauna emblemática de la región como el capitán de la sabana Eremophylus mutisi, la rana sabanera Dendrosophus labialis y la culebra sabanera Atractus crassicaudatus (Arias-Pineda, 2013; Arias-Pineda y Realpe, 2014; Arias-Pineda et al., 2014).
Los registros distribucionales de N. macropa indican que se encuentra en los municipios de Tabio, Sopó, Gachancipá, Zipaquirá, Guatavita, Cogua, Sesquilé, Suesca, Chocontá, Villapinzón y Tausa, todos estos ubicados en los altiplanos de Ubaté y Bogotá, irrigados por las cuencas de los ríos Checua, Bogotá y Ubaté (Campos, 1992, 1994; Campos y Rodríguez, 1985; Ortiz, 1981) (fig. 1). La especie está registrada en las listas rojas de especies en peligro de extinción, tanto nacionales propuestos por Amat et al. (2007) y Campos y Lasso (2015), quienes la ubican en categoría vulnerable, como internacionales de la UICN (UICN Red List, 2012), que la ubican en la categoría de preocupación menor. Unas de las razones por las cuales N. macropa es considerada como una especie vulnerable, es que ha sido sobrexplotada para la elaboración de bebidas afrodisiacas conocidas como “berraquillo” y por la destrucción de su hábitat natural, por desecación de los manantiales, urbanización y contaminación de los cuerpos de agua y ecosistemas donde habita (Amad et al., 2007; Arias-Pineda, 2013; Arias-Pineda y Realpe, 2014; Campos, 1992, 1994, 2005a, b; Campos y Lasso, 2015; Fundación Humedales, 2004; UICN Red List, 2012). La disminución de las poblaciones de N. macropa generarán un daño sobre los ecosistemas donde habitan, ya que ellos son un eslabón importante en el flujo energético de los mismos, siendo parte fundamental en los procesos de descomposición de materia orgánica y descompactación del suelo de las quebradas y sitios aledaños a las mismas, además de ser presas y depredadores de otra fauna circundante (Amat et al., 2007; Arias-Pineda, 2013; Arias-Pineda y Realpe, 2014; Arias-Pineda y Rodríguez, 2012; Arias-Pineda et al., 2014; Campos y Pedraza, 2007). Se sabe que algunos cangrejos de agua dulce son detritívoros, siendo parte fundamental en el ciclo de nutrientes de los ecosistemas de agua dulce tropical, participando activamente en las redes tróficas (Pereira, 2009).
Los modelos de nicho ecológico se han convertido en los últimos años en una herramienta muy utilizada para dar respuesta a interrogantes que se generan alrededor de la distribución de las especies (Avise, 2008; Avise et al., 1987; Brown y Lomolino, 1998; Guisan y Thuiller, 2005; Socorro, 2009; Vázquez-Domínguez, 2002). Para construir modelos de la distribución potencial de especies es necesario tener en cuenta los conceptos de nicho, hábitat y área de distribución (Anderson y Martínez-Meyer, 2004; Lanteri y Confalonieri, 2003). Esta metodología ha sido utilizada en diferentes campos biológicos tales como: conservación, ecología, epidemiología, evolución y distribución de especies invasoras o con importancia económica y médica (Peterson et al., 1999). Para el desarrollo de trabajos en este campo es necesario conocer bases de datos de presencia/ausencia, sin embargo, gran porcentaje de esta información suministrada por las colecciones biológicas, en donde los individuos se encuentran depositados, solo registra presencias y no ausencias (Socorro, 2009). Teniendo en cuenta lo anterior la finalidad de esta investigación es ampliar el conocimiento de la distribución y aspectos ecológicos del cangrejo sabanero Neostrengeria macropa como base para establecer planes de conservación en un futuro cercano.

Materiales y métodos
La sabana de Bogotá (departamentos de Cundinamarca y Boyacá) (fig. 1), con registros entre los 2,400 y 3,000 m, tiene un régimen bimodal que comprende 2 picos de sequías entre mayo-agosto, diciembre-enero, y picos de lluvias entre agosto-noviembre y febrero-abril (Arias-Pineda, 2013; Arias-Pineda y Realpe, 2014; Campos, 1994, 2005a; IGAC, 1992).
Se recopiló la información sobre los datos de presencia de N. macropa en la sabana de Bogotá depositados en colecciones biológicas y trabajos distribucionales. Las colecciones revisadas fueron Museo de la Salle, Colección de Artrópodos y otros Invertebrados (CAUD-216), Universidad Distrital Francisco José de Caldas, y el Museo de Historia Natural Universidad de los Andes, Colección de Invertebrados (ANDES-IN), ambas en Bogotá, Colombia. Los trabajos distribucionales publicados consultados fueron de Campos (1994, 2005a) y de Campos y Lasso (2015).
En cuanto a las capas ambientales, se incluyeron las variables bioclimáticas de Worldclim de las cuales se escogieron 8 que poseían el mayor valor de jacknife, obtenidas tanto en los análisis de MaxEnt (Phillips et al., 2006), como en los análisis de modelaje realizados con el software R (R core team, 2013). Una vez obtenidas las 8 variables que influencian la distribución de N. macropa en la sabana de Bogotá, se construyó el modelo de distribución potencial teniendo en cuenta tantos los datos de presencia y las 8 variables ambientales que fueron predictores del nicho (elevación, precipitaciones de octubre, precipitaciones de enero, temperatura media anual, precipitación de febrero, precipitación de marzo, temperatura del mes más frío y precipitaciones de junio). Se realizó la validación del modelo mediante las pruebas AUC y curvas ROC, que permiten evaluar qué tan eficiente fue el modelo para predecir la posible distribución de N. macropa en la sabana de Bogotá. Para que los análisis posmodelo fueran tconfiables se construyó una curva ROC manual mediante el programa R en el paquete Dismo (R core team, 2013). Una vez obtenidos la validación estadística y los mapas construidos con el programa Argmap (2010), se procedió a realizar la validación en campo del modelo.
Una vez obtenidos los mapas de distribución potencial, se realizaron muestreos en 20 puntos en la sabana y fuera de ella con el fin de poner a prueba la efectividad del modelo obtenido. Los puntos escogidos fueron los siguientes, debido a su fácil acceso y permisos obtenidos: municipio de Fúquene, laguna de Fúquene; municipio de Suesca inmediaciones al río Bogotá; municipio de Neusa, embalse del Neusa; municipio de Sesquile, embalse de Sesquile; municipio de Sibaté, veredas Neruda y San Miguel sobre el río Muña, Usme, embalse de La Regadera y río Curubital, Bogotá, localidad de Ciudad Bolívar, barrio Lucero Alto; municipio de La Calera, embalse de San Rafael, río Teusaca, Bogotá, Cerros Orientales; municipio de Facatativá, vereda El Vino y municipio Madrid. En cuanto a los puntos fuera de la sabana de Bogotá se muestrearon: el páramo de Sumapaz, laguna de Chisacá, Chipaque, vereda Potrero Grande, Albán, vereda Nazaret, Boyacá, municipio de Aquitania y laguna del Tota.
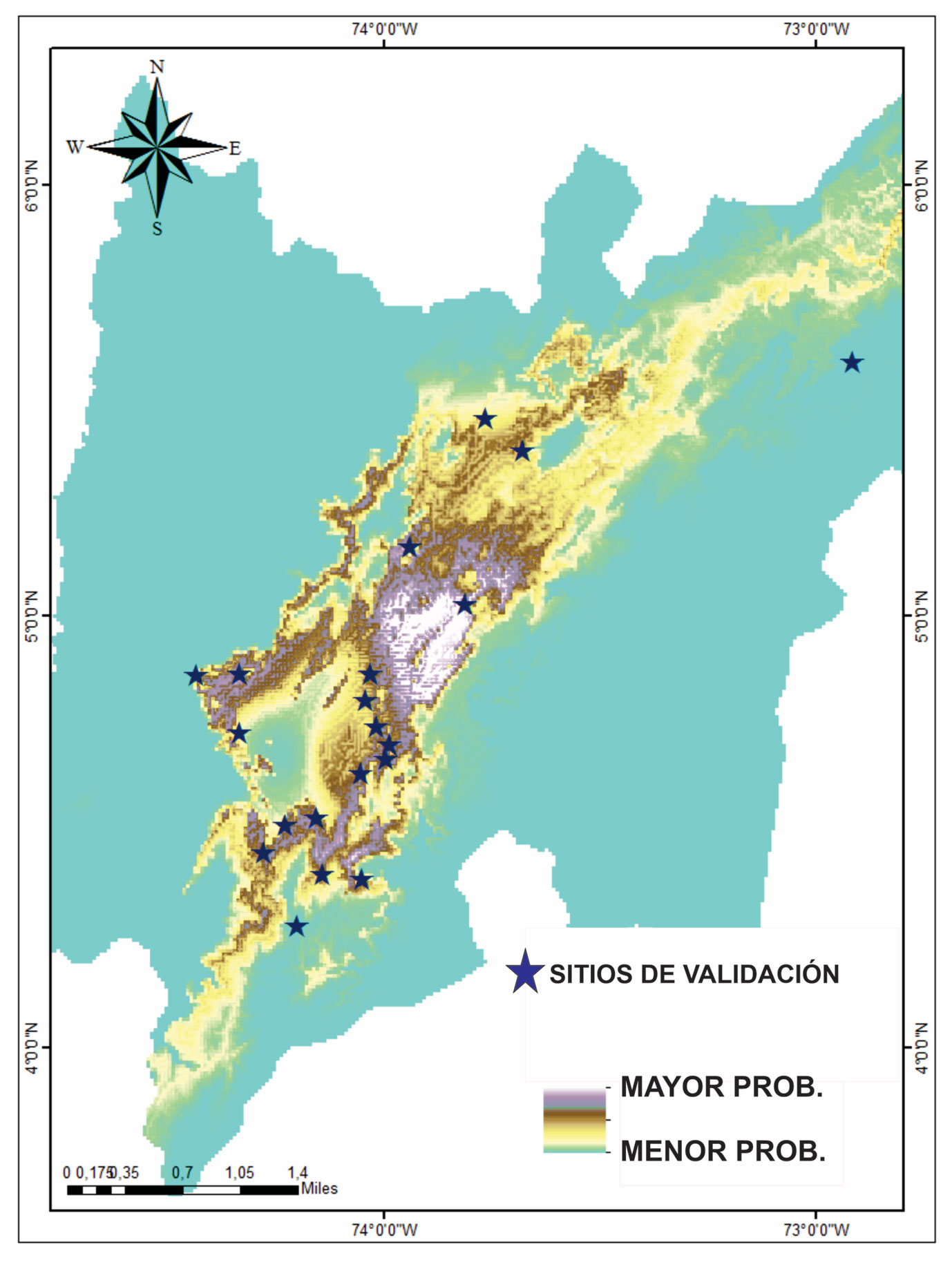
Una vez validado el modelo mediante los 20 puntos escogidos, se eligieron de los mismos 10 puntos por su fácil acceso, para realizar los análisis ecológicos posteriores que ayudaron a complementar los resultados del modelo evaluando en campo otras variables que pudieran explicar la distribución de la especie. Dichos sitios fueron: laguna de Fúquene, Suesca, inmediaciones al río Bogotá, laguna del Neusa, Sibaté, vereda Neruda y San Miguel, río Muña, Usme, embalse de La Regadera, río Curubital, La Calera, embalse de San Rafael, río Teusaca, Cerros Orientales, Facatativá y vereda El Vino (fig. 2).
Definidos los 10 puntos de muestreo en la sabana de Bogotá, se realizaron transectos de 150 m, en los que se colocó, cada 10, una trampa tipo tonel en cuyo interior se puso un cebo (hígado de pollo) y se sumergieron durante 2 horas, luego de lo cual eran revisadas para registrar la presencia o ausencia de los cangrejos (fig. 3A-H). Simultáneamente, se registraron las características fisicoquímicas del agua que podrían afectar la presencia o no de la especie, entre ellas se evaluaron: temperatura, conductividad, sólidos disueltos totales, salinidad, saturación de oxígeno y pH, con una sonda multiparámetro Orion Start de Thermos A221 pH portable, y la altitud y las coordenadas con un gps Caterpillar Cat B26. También se realizó una caracterización de los lechos de los cuerpos de agua según Gracia y Maza-Álvarez (1995) y se clasificaron en cantos rodados, rocas, gravas, limos y arcillas, además de observar la proporción de vegetación circundante, estimando el porcentaje en los transectos evaluados.
Los cangrejos muestreados fueron sexados y medidos, clasificando su estadio de desarrollo en adultos, juveniles y grávidas. Se realizaron histogramas de frecuencia para observar las proporciones entre machos, hembras y juveniles por meses a lo largo del año y encontrar sus porcentajes en cada uno de los sitios muestreados. Se realizó una prueba chi-cuadrada para observar las diferencias en la proporción de machos, hembras tanto adultas como grávidas, y juveniles entre sitios. Para evidenciar si existía una asociación entre los sitios y las características fisicoquímicas y estructurales de las quebradas se realizó un análisis de componentes principales (PCA), y una regresión múltiple para observar si existía una asociación entre los sitios y las características físicas y químicas de los cuerpos de agua que permitieran dar explicación a la abundancia, a la presencia o ausencia, o a la distribución espacial de estos cangrejos en dichos cuerpos de agua.
En cuanto a las diferencias entre abundancias y tamaño corporal, se hizo un análisis de varianza (Anova), y se realizaron pruebas de normalidad de Shapiro-Wilks, de homogeneidad de varianza de Levene, y arreglos de Bonferroni para normalizar los datos. Por último, se realizó una prueba de Tukey para conocer las diferencias entre los sitios y las variables de abundancia y tamaño corporal. Para conocer qué variables podrían estar explicando con mayor exactitud las variaciones en abundancia y tamaño entre los sitios se realizó una regresión múltiple, teniendo como variable dependiente la abundancia y el tamaño corporal, e independientes, las variables ambientales y estructurales.
Resultados
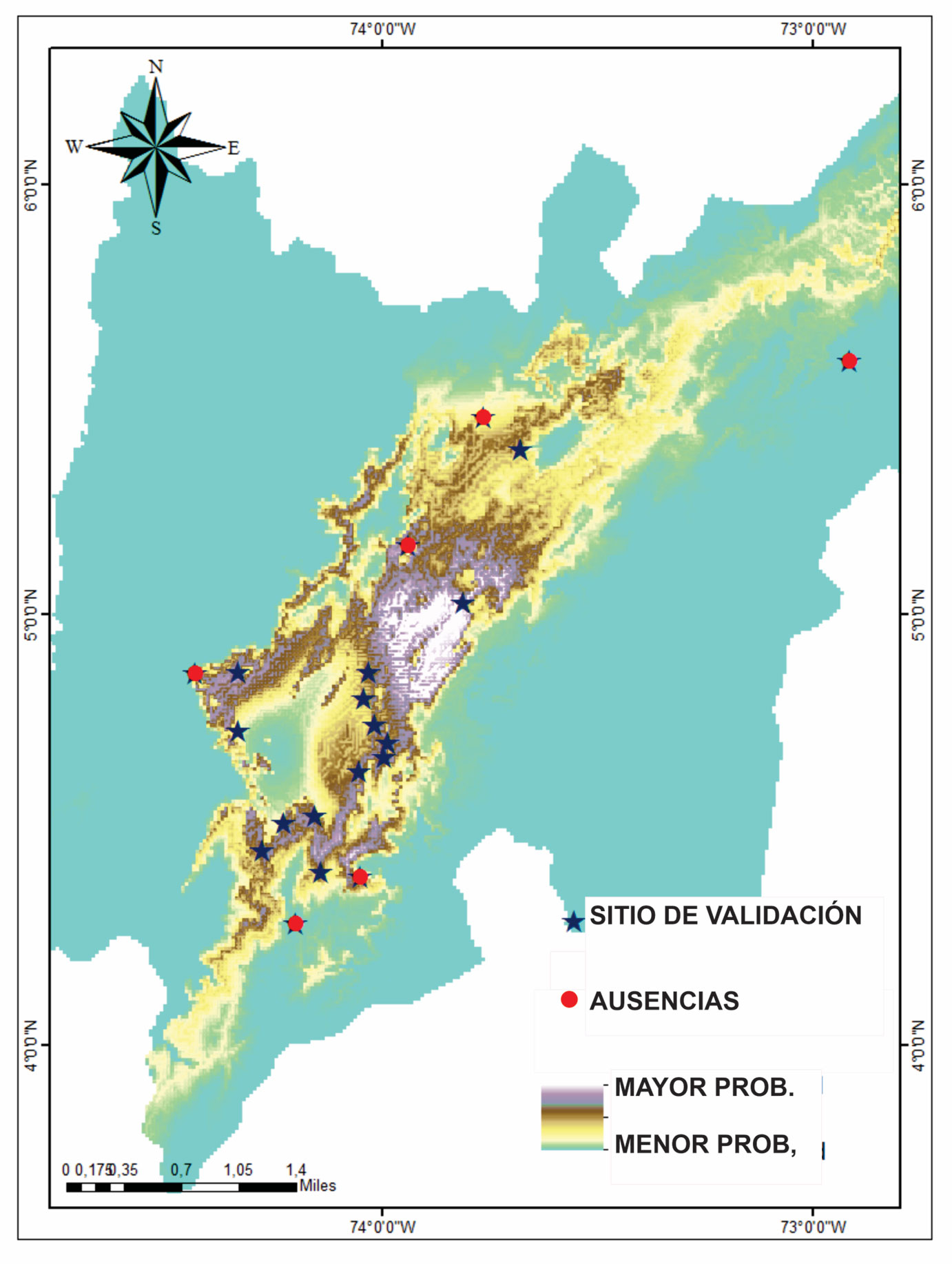
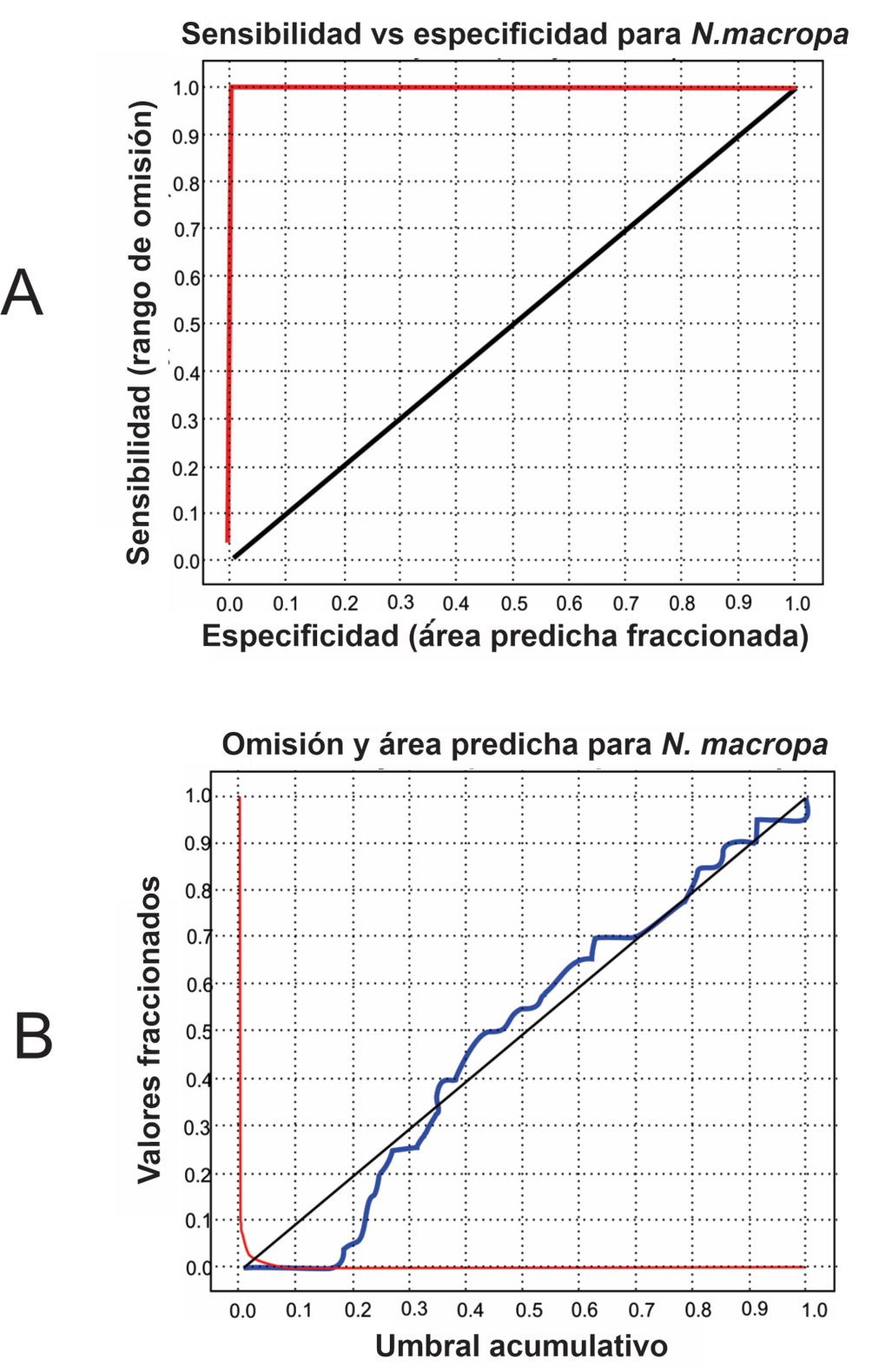
Se registró la presencia de cangrejos en 52 localidades dentro de la sabana de Bogotá (fig. 1). Al realizar la validación estadística del modelo se encontró que el poder predictivo del mismo fue alto (AUC = 0.999), teniendo en cuenta que se realizó una curva ROC parcial con 26 presencias y 1,000 pseudoausencias (fig. 4). Dentro de las variables seleccionadas y que contribuyeron de manera importante a la construcción del modelo fueron: elevación (47%), precipitaciones de octubre (21.3%), precipitaciones de enero (11.8%), temperatura media anual (6.5%), precipitación de febrero (5.4%), precipitación de marzo (4.2%), temperatura del mes más frío (3.5%) y precipitaciones de junio (0.4%).

Las predicciones que realizó el modelo de distribución potencial de la especie indican la presencia en sitios no evaluados en los trabajos distribucionales ni en las colecciones biológicas en donde estaba depositado N. macropa (figs. 2, 5). Para la validación en campo del modelo, se escogieron 20 puntos y se encontró que en 6 no estuvo presente N. macropa, 4 de los cuales indicaban ausencia y 2 indicaban presencia (fig. 5). Los sitios en los que el modelo indicaba ausencia y que se utilizaron por su fácil acceso fueron: la laguna del Tota, Chipaque, páramo de Sumapaz y Albán (tabla 1). En estos sitios se encontró la presencia de otras especies de cangrejos, exceptuando el páramo de Sumapaz donde no se encontró la presencia de los mismos. En cuanto a las especies de cangrejos encontradas en los sitios de ausencia predichas por el modelo encontramos a N. boyacencis, en la laguna del Tota, N. lindigiana en Chipaque y N. botti en Albán (tabla 1). Para el caso de los sitios donde el modelo de distribución potencial predecía la presencia de N. macropa y no se encontró, se encontraron indicios de contaminación o destrucción y desecación de los cuerpos de agua, específicamente en el embalse del Neusa y el río Muña en San Miguel. Para el caso de Fúquene, se encontró la presencia de la especie invasora P. clarkii (tabla 1).
En los restantes 14 puntos de validación, se confirmó la presencia de N. macropa, 7 de los cuales no se habían evaluado antes. Los sitios que predice el modelo se encuentran para los Cerros Orientales de la cuidad de Bogotá, al sur y occidente de la misma, entre estos sitios se encuentran: quebradas del norte de la sabana de Bogotá, calle 172 con 7, Lucero Alto, Usme, Sibaté, Facatativá, Madrid y Chía/Guaymaral.
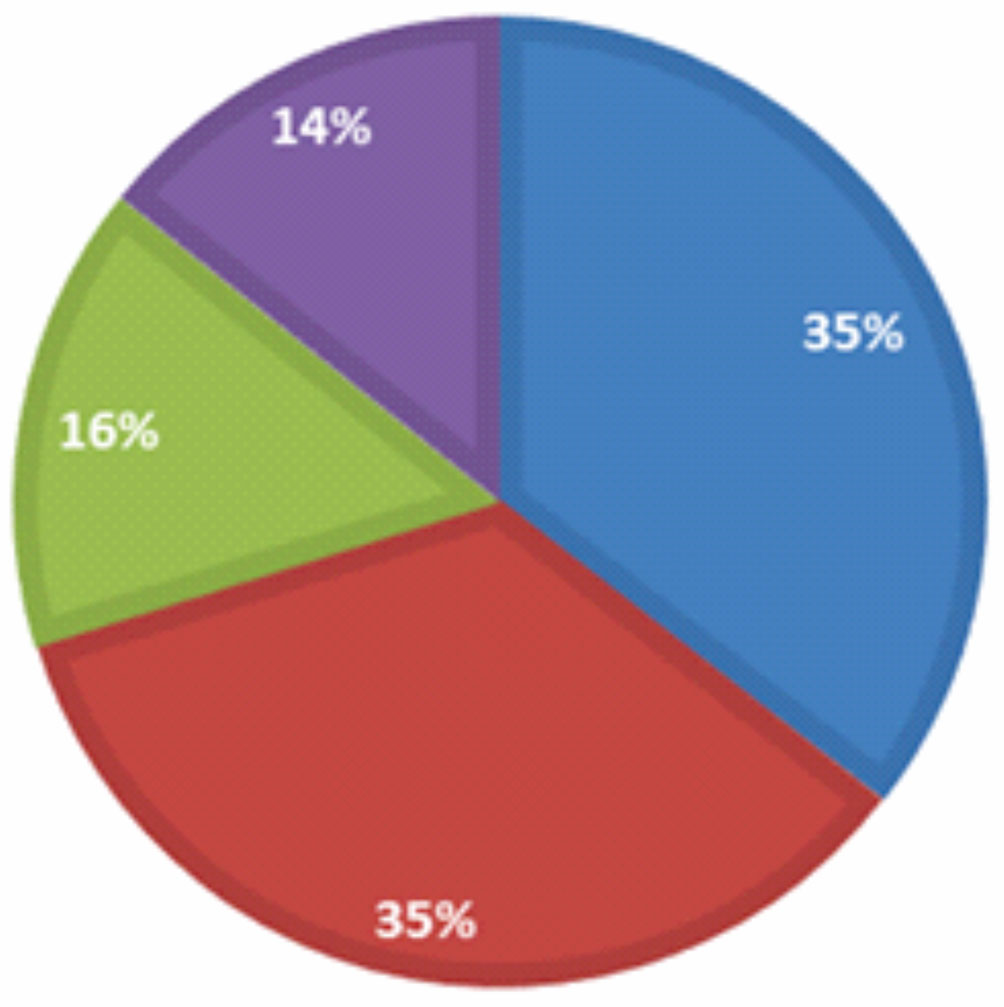
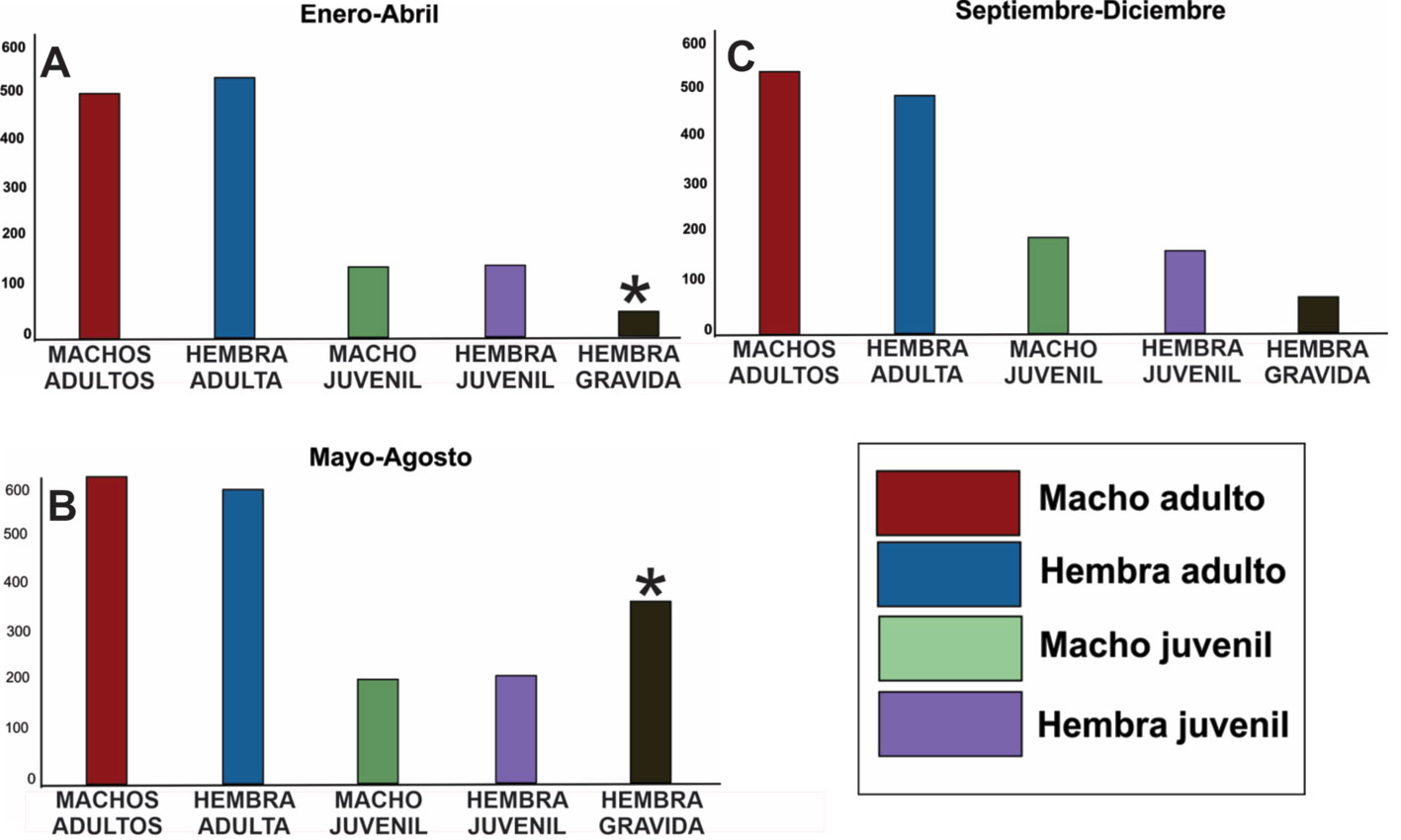
Los análisis ecológicos permitieron evaluar otras variables que explican la distribución, presencia y ausencia predichas por el modelo de nicho, pero que no son tan sensibles en la elaboración del modelo. Ésto debido a que el modelo posee varias limitantes, entre ellas las barreras geográficas o variables que son específicas y son muy limitadas para las herramientas computacionales. Durante esta etapa de la investigación, se muestrearon un total de 1,966 cangrejos de la especie N. macropa, 677 machos adultos (35%), 663 hembras adultas (35%), 299 machos juveniles (16%) y 265 hembras juveniles (14%). La distribución espacial de los individuos en los cuerpos de agua no fue uniforme, se observó una notable agregación en sitios con condiciones específicas como: presencia de limos, cantos rodados, vegetación sumergida y fuera del cuerpo de agua, además de altos niveles de oxígeno disuelto y temperaturas entre los 12 a 14 °C. Por otra parte, los análisis de abundancia por sitio indican que de los 10 sitios evaluados, 3 no registraron la presencia de N. macropa: Neusa, Fúquene y San Miguel, y río Muña.
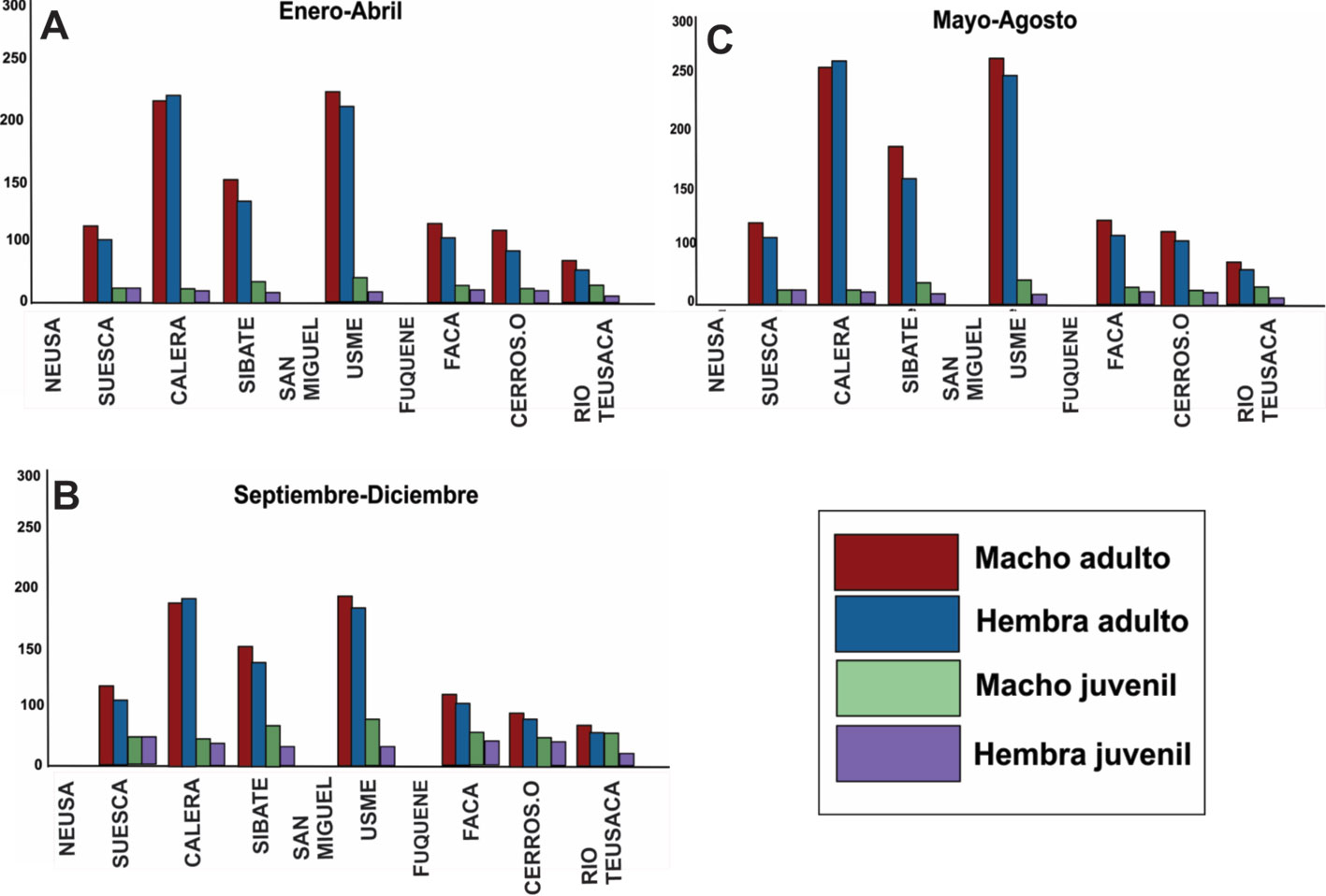
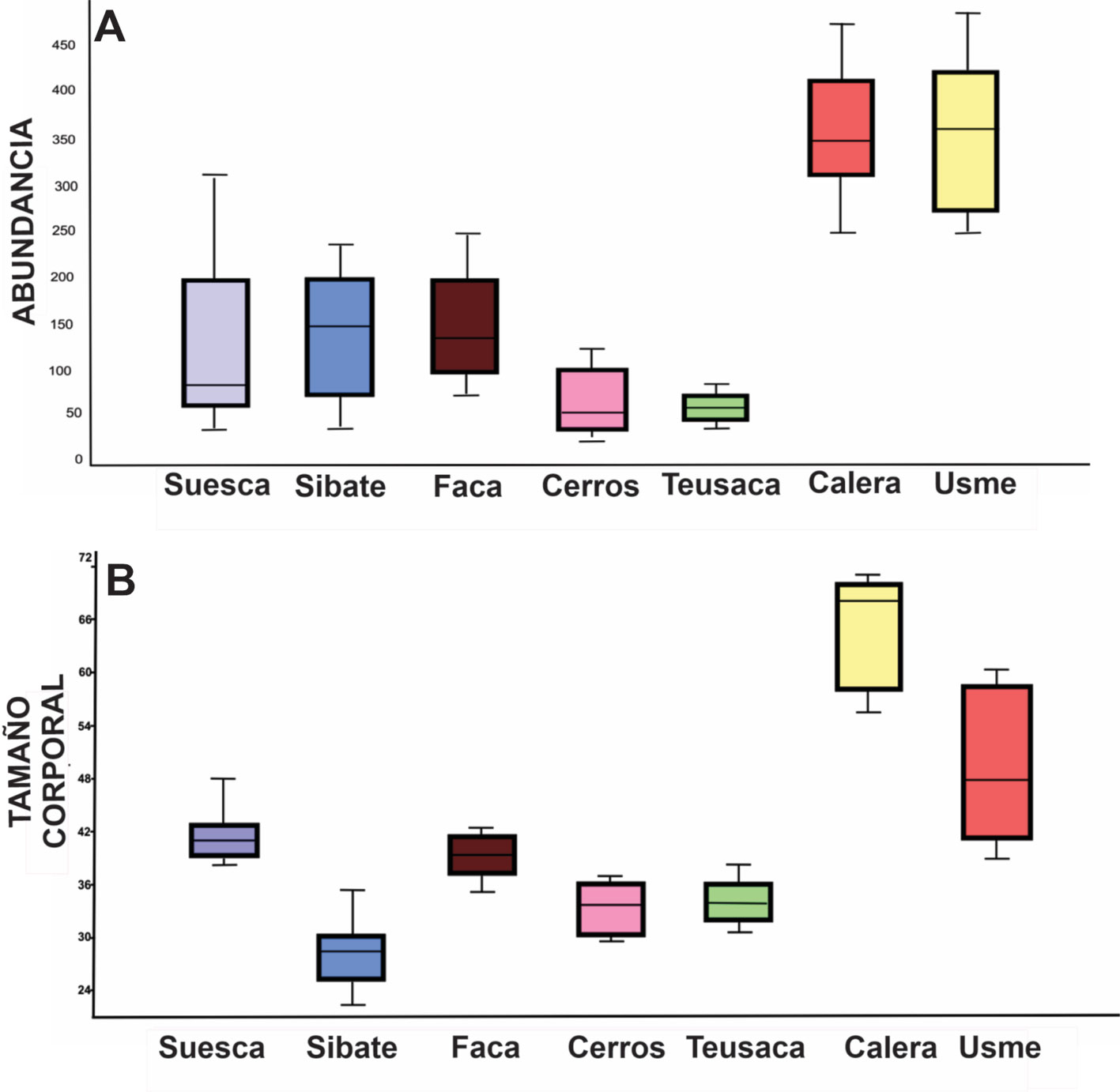
En cuanto a la abundancia total por mes, se encontró que no existe una diferencia significativa (X2, p = 0.175), entre la abundancia de machos y hembras adultos en su totalidad (fig. 6A-C), pero se observa una diferencia significativa en cuanto al número de juveniles obtenidos y en el número de hembras grávidas muestreadas entre mayo y agosto (X2, p = 0.0055; fig. 6C). Se encontró que la relación machos y hembras entre los sitios mantenía las proporciones igual a las que se observaron en el primer análisis (1:1) (fig. 6), sin embargo, en Usme y La Calera la abundancia de cangrejos fue mayor, y el sitio con menor abundancias de cangrejos fue el río Teusaca teniendo diferencias significativas (X2, p = 0.0048; fig. 7). El análisis exploratorio fue soportado mediante un Anova (W = 0.984, Levene = 4.709E -06, p < 0.005). Se encontró que sí existían diferencias significativas entre los sitios en cuanto a las abundancias de individuos, especialmente entre Usme, La Calera y el resto de sitios (prueba de Tukey; fig. 8A; tabla 2). También se registró que los tamaños corporales al igual que la abundancia son mucho mayores en La Calera y Usme respecto a los demás sitios, y el menor tamaño fue observado en Sibaté (p < 0.005), para ello se realizó una Anova (W = 0.97, Levene = 4.037E-20) (fig. 8B; tabla 3).
Se observó que la mayoría de cuerpos de agua presentan valores buenos en las características fisicoquímicas, teniendo algunas excepciones como el río Teusaca o Neusa en cuanto a la conductividad (48-60 µs/cm), pH (5.22-7.2) y variables asociadas (sólidos disueltos totales (0.68-40 ppm), salinidad (0.007-0.09 ups, temperatura (12-14ºC) y oxígeno disuelto (2.5-7.3 mg/l) (tabla 4). La caracterización física de los cuerpos de agua evidenció una asociación a lechos con gran cantidad de limos, cantos rodados y presencia de plantas sumergidas, al igual que coberturas vegetales (fig. 9); esto apoyado por el PCA (fig. 10) y la regresión lineal múltiple (tabla 5).
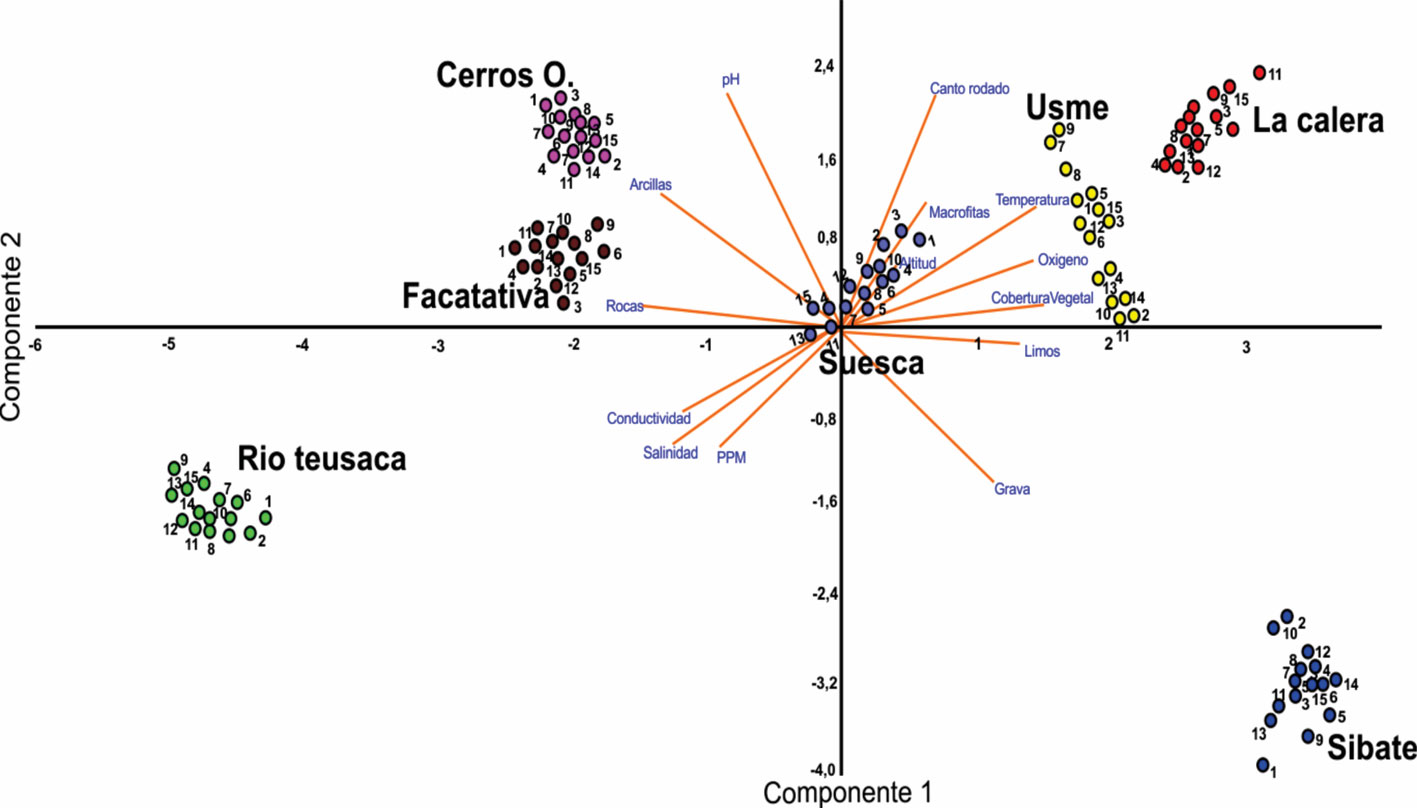
Finalmente, mediante PCA y la regresión lineal múltiple, se constató de modo general que existe una agrupación entre los cuerpos de agua lóticos (río Teusaca, Cerros Orientales, Facatativá, Sibaté y Suesca) y los cuerpos de agua lénticos (Usme y La Calera). Se obtuvo que las variables del PCA explican 2 componentes, el primero explica 59% y el segundo, 29% de la variación. En el PCA1, las variables cuyos autovectores se proyectan en el mismo son: cantos rodados, temperatura, altitud, presencia de plantas acuáticas, pH, arcillas, gravas, salinidad, conductividad y sólidos disueltos totales; mientras que el PCA2 considera el oxígeno disuelto, cobertura vegetal, limos y rocas (fig. 10). Se observa que las variables que se asocian y caracterizan a los cuerpos de agua lénticos son: temperatura, oxígeno disuelto, cantos rodados, la presencia de plantas acuáticas sumergidas y fuera de ellos y los limos. Algunas de estas características son compartidas por el cuerpo de agua evaluado en Suesca, por esta razón es que se acerca más a los cuerpos de agua lénticos, a pesar de ser un cuerpo de agua lótico. En cuanto a los cuerpos de agua lóticos, se observó una predominancia del sustrato rocoso y arcilloso. Dentro de estos cuerpos evaluados, el río Teusaca posee altos niveles de conductividad, mientras que en Sibaté, la estructura del lecho de la quebrada está caracterizada por lajas grandes y gravas pequeñas.
Tabla 1
Sitios muestreados indicando la presencia o ausencia de Neostrengeria macropa, o la presencia de otras especies.
|
Sitios muestreados |
Presencia o ausencia de N. macropa |
|
Aquitania, laguna del Total |
Ausencia, presencia de N. boyacensis |
|
Chipaque, vereda Potrero Grande |
Ausencia, presencia de N. lindigiana |
|
Albán, vereda Nazaret |
Ausencia, presencia de N. botti |
|
Páramo de Sumapaz, laguna de Chisaca |
Ausencia |
|
Tausa, embalse del Neusa |
Ausencia |
|
Villapinzón, vereda El Mirador |
Presencia |
|
Suesca, inmediaciones al río Bogotá |
Presencia |
|
Sesquile, embalse de Sesquile |
Presencia |
|
Laguna de Fúquene, embarcadero |
Ausencia, presencia de P. clarkii |
|
Chía, imediaciones al río Bogotá |
Presencia |
|
La Calera, embalse de La Regadera |
Presencia |
|
La Calera, río Teusaca |
Presencia |
|
Cerros orientales, calle 172 con 7 |
Presencia |
|
Bogotá, Lucero Alto, Ciudad Bolívar |
Presencia |
|
Bogotá, Guaymaral |
Presencia |
|
Bogotá, Usme, vereda Requilina y embalse de La Regadera |
Presencia |
|
Madrid, Bojaca, vereda Rincón Santo |
Presencia |
|
Facatativá, vereda El Vino |
Presencia |
|
Sibaté, vereda Neurda |
Presencia |
|
Sibaté, San Miguel, río Muña |
Ausencia |
Tabla 2
Abundancia por sitio de la especie N. macropa en los cuerpos muestreados en la sabana de Bogotá. El color amarillo de algunos valores, indica las diferencias existentes entre los sitios evaluados.
|
|
Suesca |
Sibaté |
Facatativá |
Cerros O |
Río Teusaca |
La Calera |
Usme |
|
Suesca |
|
0.9999 |
0.9953 |
0.04469 |
0.03269 |
0.0001202 |
0.0001202 |
|
Sibaté |
0.4264 |
|
0.9999 |
0.01893 |
0.01345 |
0.0001202 |
0.0001202 |
|
Facatativa |
0.9061 |
0.4797 |
|
0.006571 |
0.004547 |
0.0001202 |
0.0001202 |
|
Cerros_o |
4.317 |
4.743 |
5.223 |
|
1 |
0.0001202 |
0.0001202 |
|
río_Teusaca |
4.477 |
4.903 |
5.383 |
0.1599 |
|
0.0001202 |
0.0001202 |
|
La_Calera |
14.39 |
13.96 |
13.48 |
18.71 |
18.87 |
|
1 |
|
Usme |
14.6 |
14.18 |
13.7 |
18.92 |
19.08 |
0.2132 |
|
Tabla 3
Tamaño corporal promedio de los cangrejos por sitio en los cuerpos muestreados en la sabana de Bogotá. El color amarillo de algunos valores, indica las diferencias existentes entre los sitios evaluados.
|
|
Suesca |
Sibaté |
Facatativá |
Cerros O |
río Teusaca |
Usme |
La Calera |
|
Suesca |
|
0.0001202 |
0.5642 |
0.0001202 |
0.0002726 |
0.0001202 |
0.0002399 |
|
Sibate |
12.05 |
|
0.0001202 |
0.5397 |
0.004619 |
0.0001202 |
0.0001202 |
|
Facatativa |
2.518 |
9.535 |
|
0.000192 |
0.06022 |
0.0001202 |
0.0001202 |
|
Cerros O |
9.483 |
2.57 |
6.965 |
|
0.4314 |
0.0001202 |
0.0001202 |
|
Rio teusaca |
6.677 |
5.376 |
4.159 |
2.806 |
|
0.0001202 |
0.0001202 |
|
Usme |
19.1 |
31.15 |
21.62 |
28.58 |
25.78 |
|
0.0001202 |
|
La calera |
6.767 |
18.82 |
9.286 |
16.25 |
13.44 |
12.33 |
|
La regresión múltiple mostró que las variables que explican la abundancia de cangrejos son: temperatura, oxígeno disuelto, presencia de limos seguido por cantos rodados, presencia de plantas tanto al interior como al exterior del cuerpo de agua, y de manera general los cuerpos de agua lénticos (tabla 5). Se encontró que los cangrejos poseen una fuerte asociación por sitios con presencia de limos, rocas y coberturas vegetales (fig. 11).
Discusión
Los datos distribucionales actuales de la especie indican que N. macropa está presente en los municipios de Tabio, Sopó, Gachancipá, Zipaquirá, Guatavita, Cogua, Sesquilé, Suesca, Chocontá, Villapinzón y Tausa, todos ubicados en los altiplanos de Ubaté y Bogotá, irrigados por las cuencas de los ríos Checua, Bogotá y Ubaté (Campos, 1992, 1994; Campos y Rodríguez, 1985; Ortiz, 1981), pero también en otras localidades de la misma sabana de Bogotá en donde no se habían recolectado antes individuos de esta especie (Arias-Pineda, 2014; Arias-Pineda y Realpe, 2015)
En cuanto a las variables que predicen la distribución potencial del cangrejo sabanero, se observó que la altitud es una de las variables que más peso (47%) está contribuyendo al modelo. Esto concuerda con Campos (2010a), en donde la altitud y la orogenia, más las variables asociadas como: temperatura, tipos de vegetación y variables climáticas, juegan un papel preponderante en la distribución de los cangrejos de la familia Pseudothelphusidae. Además, se conoce que dentro de cierto intervalo, a medida que la altitud aumenta, la diversidad también lo hace, ésto se debe a que en las partes altas de los cuerpos de agua y en sus gradientes, la disposición de nutrientes, sustratos y variables ambientales son cada vez más cambiantes, lo que induce en los individuos una especialización para poder habitar en dichos sitios (Álvarez, 2009; Campos, 2010a; Hawkins, 2001; Morales-Castilla y García-Valdés, 2014; Peterson, 2011; Peterson et al., 1999; Stephens y Wiens, 2003; Wiens y Donoghue, 2004).
Para el caso de las precipitaciones, el modelo de nicho arrojó que precipitaciones de octubre (21.3%) y enero (11.8%), seguidos por febrero, marzo y junio, indican que las épocas de lluvias o sequías están marcando una pauta importante en la distribución de la especie. Según IDEAM (2017), en la sabana de Bogotá existe un régimen de lluvias bimodal caracterizado por 2 picos entre febrero-junio, septiembre-noviembre y una de sequías hacia diciembre-enero y junio-agosto, lo que concuerda con lo obtenido en el modelo de nicho (Bergkamp y Orlando, 1999; Lorente et al., 2004; Ramsar, 2000).
Tabla 4
Características fisicoquímicas de los diferentes cuerpos de agua muestrados y su localidad en varios puntos de la sabana de Bogotá.
|
Abundancia |
pH |
Oxígeno (ml/l) |
S. D T (ppm) |
Salinidad (PSU) |
Conductividad (μS/cm) |
Temperatura (C°) |
|
|
Neusa |
0 |
5.22 |
2.5 |
27.87 |
0.007 |
59.93 |
14.4 |
|
Suesca |
376 |
6.87 |
7.5 |
40.84 |
0.09 |
82.33 |
13.1 |
|
La calera |
429 |
7.02 |
7.17 |
40.7 |
0.007 |
48 |
13.5 |
|
San Miguel |
0 |
6.96 |
6.9 |
0.686 |
0.057 |
62.4 |
13.5 |
|
Sibate |
262 |
6.2 |
7.06 |
10.1 |
0.006 |
42.4 |
13.5 |
|
Usme |
434 |
6.62 |
7.5 |
40.7 |
0.09 |
48 |
13.1 |
|
Facatativa |
157 |
6.8 |
6.9 |
42.84 |
0.092 |
56 |
12 |
|
Cerros |
99 |
6.5 |
7.17 |
40.7 |
0.007 |
48 |
12.1 |
En cuanto a las temperaturas media y mínima anual, que son variables descriptoras de la distribución de la especie, según IDEAM (2017), la sabana de Bogotá presenta un clima frío y muy frío con temperaturas medias de 12 a 20 °C, y temperaturas mínimas entre 4 y 10 °C. Esto corrobora lo dicho por Hudson et al. (2016), quien observó que N. macropa tiene un rango de tolerancia alto al cambio de temperatura que va desde los 9 hasta los 24 °C. Sin embargo, la temperatura óptima fisiológica para esta especie oscila entre los 12 y 24 °C. Las temperaturas fuera de este intervalo generan, en esta especie, un estrés térmico llevando a la muerte del animal (Hudson et al., 2016). En ese orden de ideas, existen sitios en la sabana y meses específicos del año donde las temperaturas están por fuera de este intervalo, generando la no presencia de la especie. Esto podría explicar de manera clara porqué la temperatura media y mínima anual es clave en la explicación del modelo. Relacionada con la temperatura, está la altitud, que también contribuyó de manera importante en el modelo de distribución de la especie (Rodríguez, 2006). Como estas 2 variables están íntimamente relacionadas, se puede observar que la orogenia de la sabana de Bogotá moldea la distribución especie, estando limitada por montañas que pueden alcanzar los 3,500 m de altitud.
Tabla 5
Regresión múltiple entre las variables fisicoquímicas, bióticas y abióticas respecto a su influencia frente a la abundancia de los cangrejos encontrados.
|
Variable |
Coeficiente |
Error estándar |
T |
p |
R2 |
|
Intercepto |
-2864.5 |
570.66 |
-5.0196 |
0.0012 |
0 |
|
Oxígeno |
1.8431 |
0.47061 |
3.9164 |
0.0015 |
0.94027 |
|
Temperatura |
16.823 |
5.3524 |
3.143 |
0.0019 |
0.90176 |
|
Limo |
0.022261 |
0.13197 |
0.16868 |
0.0089 |
0.71421 |
|
Plantas |
-0.84939 |
0.31834 |
-2.6682 |
0.0022 |
0.83233 |
|
Léntico |
0.068273 |
0.13609 |
0.50167 |
0.007 |
0.53999 |
|
Lótico |
0.030546 |
0.016046 |
1.9037 |
0.00307 |
0.28528 |
p value: 0.008
Por último, en cuanto a los sitios predichos por el modelo que no se habían registrado previamente, se confirma la existencia de nuevas poblaciones de este cangrejo en la sabana de Bogotá (Arias-Pineda y Realpe, 2014; Arias-Pineda et al., 2016). Estos resultados pueden relacionarse con el hecho de que la sabana era una gran laguna, que con la fundación de la ciudad de Bogotá y municipios aledaños, fue fraccionada en pequeños cuerpos de agua (Calvachi, 2002). La fragmentación produjo la dispersión de las poblaciones de cangrejos como el capitán de la sabana E. mutisii, la guapucha G. bogotensis y la rana D. labialis.
En cuanto a las características fisicoquímicas de las quebradas, embalses y ríos muestreados, se observaron, en general, intervalos óptimos en cuanto a los niveles teóricos esperados para cuerpos de agua dulce (Agostinho et al., 2005; Chapman, 1996; Chapman y Kimstach, 1996; Margalef, 1983; Pinilla et al, 2010; Ramírez y Viña, 1998; tabla 5). Sin embargo, 3 de los 10 sitios muestreados presentan una variación considerable en los niveles de oxígeno disuelto, temperatura y conductividad, además de ser observables procesos de contaminación, desecación y destrucción de los cauces (tabla 5).
En 3 de los 10 sitios muestreados no se encontró a N. macropa. Estos sitios se caracterizaron por tener una probabilidad alta de presencia de la especie según el modelo de distribución potencial y por ser sitios históricos que registraron la presencia de la especie. Estos sitios son Neusa y Fúquene (Campos, 1994, 2005a), Sibaté, vereda San Miguel y río Muña (Arias-Pineda, 2013). En Neusa las posibles razones son la baja concentración de oxígeno disuelto, temperaturas promedio de 14.5 °C (tabla 5) y presencia de gran cantidad de plantas en la zona epineustónica.
En otros sitios en donde no se registró a N. macropa, se constató que fueron otros los causantes de la ausencia de la especie. En Fúquene, la presencia de la especie invasora Procambarus clarkii puede ser el factor que haya desplazado a N. macropa (Álvarez-León y Gutiérrez-Bonilla, 2007; Arias-Pineda y Rodríguez, 2012; Campos, 2005b; Coll-Morales, 1998; Flórez-Brand y Espinosa-Beltrán, 2011; Hudson et al., 2016; Valderrama y Garzón, 2004). En el río Muña y vereda San Miguel, las prácticas agrícolas asociadas a los cultivos de fresa han desplazado a los cangrejos hasta su desaparición local.
Para los restantes 7 sitios, se encontraron poblaciones estables al observarse que la relación de machos y hembras, tanto adultos como juveniles es 1 a 1 (Collares-Pereira et al., 2000; Diez et al., 2011; Garzón et al., 2005; Hernández et al., 2007; La Torre-Cuadros et al., 2007; Ramírez, 2008; Roa-Fuentes et al., 2013). Se observó una estacionalidad marcada en mayo-agosto (fig. 6C), encontrándose un notorio aumento en las hembras grávidas y juveniles. Esto es congruente, ya que se conoce que la especie se reproduce de junio a agosto y, además, está relacionada con los picos de sequías e inicio de lluvias en la sabana de Bogotá (Campos y Lasso, 2015; Ortiz, 1981; IDEAM, 2017).
En cuanto a la abundancia por cuerpo de agua, se observaron diferencias notorias y se tuvo un mayor número de cangrejos en embalses y lagunas, seguidos por ríos y quebradas (figs. 8, 9A, 11). Esto se puede sustentar por el hecho de que la sabana de Bogotá, en sus inicios, era una gran laguna y la fauna que allí habita está adaptada a este medio (Calvachi, 2002; García-Flores y Maza-Álvarez, 1995).
Agradecimientos
A la empresa de Acueducto de Bogotá, por los permisos para el ingreso a los sitios de investigación; a la Universidad de los Andes y a la Universidad Distrital Francisco José de Caldas, en especial al Laboratorio de Zoología y Ecología Acuática LAZOEA; al grupo de investigaciones microbiológicas CIMPAT y al grupo en Artrópodos KUMANGUI, por los recursos e instalaciones que facilitaron la presente investigación; a Saúl Martin, Alejandro Zambrano, Nédiker González, Alexander García García, Alejandro Romero y Santiago Cifuentes, por su colaboración como guías y asistentes de campo.

Referencias
Agostinho, A. Thomaz, M. y Gomes, L. (2005). Conservation of the biodiversity of Brazil’s inland waters. Conservation Biology, 19, 646–652. https://doi.org/10.1111/j.1523-1739.2005.00701.x
Álvarez, F. (2009). Medidas de rango de acción y relación de desplazamientos con la biometría del cangrejo de la sabana Neostrengeria macropa (Crustacea: Decapoda: Pseudothelphusidae) en el parque embalse del Neusa, municipio de Tausa (Cundinamarca) (Tesis). Universidad el Bosque. Bogotá D.C.
Álvarez-León, R. y Gutiérrez-Bonilla, F. (2007). Situación de los invertebrados acuáticos introducidos y trasplantados en Colombia: antecedentes, efectos y perspectivas. Revista Academia Colombiana de Ciencias, 31, 557–574.
Amat, G., Andrade-C, G. y Amat-García, E. (2007). Libro rojo de los invertebrados terrestres de Colombia. Bogotá: Conservación Internacional Colombia/ Instituto de Ciencias Naturales Universidad Nacional de Colombia.
Anderson, R. y Martínez-Meyer, E. (2004). Modelling species geographic distribution for preliminary conservation assessments: an implementation with the spiny pocket mice (Heteromys) of Ecuador. Biological Conservation, 116, 167–179. https://doi.org/10.1016/S0006-3207(03)00187-3
Argmap. (2010). Maps throughout this book were created using ArcGIS® software by Esri. ArcGIS® and ArcMap™ are the intellectual property of Esri and are used herein under license. Copyright © Esri. All rights reserved. For more information about Esri® software: www.esri.com
Arias-Pineda, J. (2013). Nuevo registro del cangrejo sabanero Neostrengeria macropa (Decapoda: Pseudothelphusidae) para el suroriente de la sabana de Bogotá (Colombia). Boletín de la Sociedad Entomológica Aragonesa, 53, 263–265.
Arias-Pineda, J., García, A. y Campos, M. (2014). Montane crabs (Decapoda: Pseudothelphusidae) from the cloud forest of the Sumapaz eastern subregion, Tolima (Colombia). Boletín de la Sociedad Entomológica Aragonesa, 55, 253–264.
Arias-Pineda, J., Martin, S., Chipatecua, D., García, A. y Realpe, E. (2016). Ritmo de actividad del cangrejo sabanero, Neostrengeria macropa (Milne-Edwards, 1853) en el embalse de San Rafael, La Calera, Colombia (Crustacea: Decapoda: Pseudothelphusidae). Boletín de la Sociedad Entomológica Aragonesa, 59, 237–245.
Arias-Pineda, J. y Realpe, E. (2014). Ampliación de la distribución conocida del cangrejo sabanero, Neostrengeria macropa (Milne- Edwards, 1853) (Decapoda: Pseudothelphusidae), en la sabana de Bogotá Colombia). Boletín de la Sociedad Entomológica Aragonesa, 55, 141–146.
Arias-Pineda, J. y Rodríguez, W. (2012). New record of the invasive species Procambarus (Scapulicambarus) clarkii (Girard 1852) (Crustacea, Decapoda, Cambaridae) from the Colombian Eastern Cordillera. Boletín de la Sociedad Entomológica Aragonesa, 51, 313–315
Avise, C. (2008). Phylogeography: retrospect and prospect. Journal of Biogeography, 36, 3–15. https://doi.org/10.1111/j.1365-2699.2008.02032.x
Avise, C., Arnold, J., Ball, R. M., Bermingham, E., Lamb, T., Neigel, L. E., Reeb, C. A. y Saunders, N. C. (1987). Intraspecific phylogeography: The mitocondrial DNA Bridge between population ge-netics and systematics. Annual Review in Ecology and Systematics, 18, 489–522. https://doi.org/10.1146/annurev.es.18.110187.002421
Bergkamp, G. y Orlando, B. (1999). Exploring collaboration between the Convention on Wetlands (Ramsar, Iran 1971) and the UN Framework Convention on Climate Change. Climate Iniatiative, IUCN, Washington, USA.
Brown, J. y Lomolino, M. (1998). Biogeography. Sunderland, MA: Sinauer. https://doi.org/10.1002/mmnz.20000760118
Calvachi, Z. B. (2002). La biodiversidad bogotana, una mirada regional. La Tadeo, 67, 89–98.
Campos, M. R. (1992). New species of freshwater crabs of the genus Neostrengeria (Crustacea: Decapoda: Pseudothelphusidae) From Colombia. Proceedings of the Biological Society of Washington, 105, 540–554.
Campos, M. R. (1994). Contribución al conocimiento del género Neostrengeria en Colombia. Bogotá: Academia de Ciencias naturales físicas y exactas.
Campos, M. R. (2005a). The freshwater crabs from Colombia. A taxonomic and distributional study. Bogotá: Academia Colombiana de Ciencias naturales físicas y exactas.
Campos, M. R. (2005b). Procambarus (Scapulicambarus) clarkii (Girard, 1852) (Crustacea: Decapoda: Cambaridae). Una langostilla no nativa de Colombia. Revista Academia Colombiana de Ciencias, 29, 295–302.
Campos, M. R. (2010a). A new species of freshwater crab of the genus Phallangothelphusa Pretzmann, 1965, from Colombia (Crustacea: Decapoda: Pseudothelphusidae), with a key to the species of the genus. Proceedings of the Biological Society of Washington, 123, 27–31. https://doi.org/10.2988/09-25.1
Campos, M. R. (2010b). Estudio taxonómico de los crustáceos decápodos de agua dulce (Trichodactylidae, Pseudothelphusidae) de Casanare, Colombia. Revista Academia Colombiana de Ciencias Físicas y Exactas, 34, 257– 266.
Campos, M. R. (2014). Crústaceos decápodos de agua dulce de Colombia. Bogotá: Biblioteca José Jerónimo Triana No. 27. Universidad Nacional de Colombia. Facultad de Ciencias, Instituto de Ciencias Naturales.
Campos, M. R. y Magalhaes, C. (2014). Colombiathelphusa, a new genus of freshwater crab from Colombia, and the first location record of Eidocamptophallus chacei (Pretzmann, 1967) (Crustacea: Decapoda: Pseudothelphusidae). Zootaxa, 3860, 571–579. http://doi.org/10.11646/zootaxa.3860.6.5
Campos, M. R. y Lasso, C. A. (2015). Libro rojo de los cangrejos dulceacuícolas de Colombia. Bogotá. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH)/ Instituto de Ciencias Naturales de la Universidad Nacional de Colombia.
Campos, M. R. y Pedraza, M. (2007). Estudio de la variación morfológica del gonópodo de Strengeriana maniformis (Brachyura: Pseudothelphusidae) mediante aplicación de morfometría geométrica. Caldasia, 29, 143–152.
Campos, M. R. y Rodríguez, G. (1985). A new species of Neostrengeria (Crustacea, Decapoda, Pseudothelphusidae) with notes on the geographical distribution of the genus. Proceedings of the Biological Society of Washington, 98, 718–727.
Campos, M. R. y Rodríguez, G. (1993). Three new species of Strengeriana from Colombia (Crustacea: Decapoda: Pseudothelphusidae). Proceedings of the Biological Society of Washington, 106, 508–513.
Chapman, D. (1996) Water Quality Assessments: A Guide to the Use of Biota, Sediments and Water in Environmental Monitoring. Londres, Chapman and Hall Ltd.
http://doi.org/10.4324/noe0419216001
Chapman, D. y Kimstach, V. (1996) Selection of water quality variable. W of biota, sediments and water quality assessments: a guide to of the use of biota. En D. Chapman (Ed.), Sediments and water in environment monitoring, 2nd Edition (pp. 59–126). Londres: CRC Press.
Coll-Morales, J. (1988). El cultivo controlado de los cangrejos de río. Revista Latinoamericana de Acuicultura, 35, 25–41.
Collares-Pereira, M. J., Cowx, I. G., Ribeiro, F., Rodríguez, J. Á. y Rogado, L. (2000). Threats imposed by water resource development schemes on the conservation of endangered fish species in the Guadiana River Basin in Portugal. Fisheries Management and Ecology, 7, 167–178. https://doi.org/10.1046/j.1365-2400.2000.00202.x
Cumberlidge, N., Ng, P. K. L., Yeo, D. C. J., Magalhaes, C., Campos, M. R., Alvarez, F. et al. (2009). Freshwater crabs and the biodiversity crisis: importance, threats, status, and conservation challenges. Biological Conservation, 142, 1665–1673. http://doi.org/10.1016/j.biocon.2009.02.038
Diez, J. M., Florentin, O. y Lovrich, G. A. (2011). Distribución y estructura poblacional del cangrejo Halicarcinus planatus (Brachyura, Hymenosomatidae) en el Canal Beagle, Tierra del Fuego. Revista de Biología Marina y Oceanografía, 46, 141–155. http://doi.org/10.4067/S0718-19572011000200005
Flórez-Brand, P. E. y Espinosa-Beltrán, J. O. (2011). Presencia y dispersión del cangrejo rojo americano (Procambarus clarkii, Girard, 1852) (Decapoda: Cambaridae) en el departamento del Valle del Cauca. Colombia. Biota Colombiana, 12, 57–62.
Fundación Humedales. (2004). Caracterización biofísica, ecología y sociocultural del complejo de humedales del valle de Ubaté, Fúquene, Cucunuba y Palacio. Informe general. Bogotá: Instituto de Recursos Biológicos, Alexander Von Humbolt. http://hdl.handle.net/20.500.12324/33295
García-Flores, M. y Maza-Álvarez, J. A. (1995). Origen y propiedad de los sedimentos. Manual de ingeniería de ríos, Capítulo 7. México D.F.: Instituto de Ingeniería de la UNAM.
Garzón, A., Hernández, S. y Valderrama, M. (2005). Caracterización del estado de las poblaciones del cangrejo de agua dulce Neostrengeria macropa (H. Milne Edwards, 1853) bajo explotación, su uso y problemática de la cuenca alta del río Bogotá. Informe final. Bogotá: Fundación Omacha/ Conservación Internacional.
Guisan, A. y Thuiller, W. (2005). Predicting species distribution: offering more than simple habitat models. Ecology Letters, 8, 999–1009. https://doi.org/10.1111/j.1461-0248.2005.00792.x
Hawkins, B. A. (2001). Ecology’s oldest pattern? Trends in Ecology and Evolution, 16, 470. https://doi.org/10.1016/S0169-5347(01)02197-8
Hernández-Barrero, S., Garzón, A. C. y Valderrama, M. (2007). Conservación y manejo del cangrejo de la sabana (Neostrengeria macropa) en la laguna de Fúquene dentro de un contexto regional. En L. Franco Vidal y G. Andrade (Eds.), Fúquene, Cucunubá y Palacio. Conservación de la biodiversidad y manejo sostenible en un ecosistema lagunar andino (pp. 203–229). Bogotá: Fundación Humedales/ Instituto de Recursos Biológicos Alexander von Humboldt.
Hudson, M. D, Brittain, V. y Phillips, G. (2016). Behavior response to temperature change by the freshwater crabs Neostrengeria macropa, (H. Milne Edwards, 1853) (Brachyura: Pseudothelphusidae) in Colombia. Journal of Crustacean Biology, 10, 1–8. https://doi.org/10.1163/1937240X-00002431
IDEAM (Instituto de Hidrología, Meteorología y Estudios Ambientales). (2017). Tiempo y clima en el territorio colombiano. Sección Clima. Recuperado de: http://www.ideam.gov.co/web/tiempo-y-clima/seguimiento
IGAC (Instituto Coreográfico Agustín Codazzi). (1992). Cundinamarca, características geográficas. Santafé de Bogotá: IGAC.
La Torre-Cuadros, M. D., Herrando-Pérez, S. y Young, K. (2007). Diversity and structural patterns for tropical montane and premontane forests of central Peru, with an assessment of the use of higher-taxon surrogacy. Biodiversity and Conservation, 16, 2965–2988. https://doi.org/10.1007/s10531-007-9155-9
Lanteri, A. y Confalonieri, V. (2003). Filogeografía: objetivos, métodos y ejemplos. En J. J. Morrone y J. Llorente (Eds.), Una perspec-tiva latinoamericana de la biogeografía (pp. 185–194). México D.F.: Conabio.
Lorente, I., Gamo, D., Gómez, J. L., Santos, R., Flores, L., Camacho, A. et al. (2004). Los efectos biológicos del cambio climático. Ecosistemas, 13, 103–110.
Magalhães, C. (2001). Diversity, distribution, and habitats of the macro-invertebrate fauna of the Río Paraguay and Río Apa, Paraguay, with emphasis on Decapod Crustaceans. En A Biological Assessment of the Acuatic Ecosystems of the Río Paraguay Basin, Alto Paraguay, Paraguay. Conservation International. RAP Bulletin of Biological Assessment, 19, 68–72.
Magalhães, C. (2003). Familias Pseudothelphusidae e Trichodactylidae. En G.A.S. de Melo (Ed.), Manual de identificação dos Crustacea Decapoda de água doce do Brasil (pp.143–287). São Paulo: Editora Loyola.
Magalhães, C., Campos, M. R., Collins, P. A. y Mantellato, F. L. (2016). Diversity, distribution and conservation of freshwater crabs and shrimps in South America. En T. Kawai y N. Cumberlidge (Eds.), A global overview of the conservation of freshwater decapod crustacean (pp. 303–322). Londres: Springer Interntional Publishing.
Margalef, R. (1983). Limnología. Barcelona: Ediciones Omega, S. A.
Morales-Castilla, I. y García-Valdés, R. (2014). Gradientes latitudinales de diversidad inversos, ¿excepciones que prueban la regla? Ecosistemas, 23, 4–12.
Ortiz, R. C. (1981). Contribución al conocimiento del cangrejo de la sabana Hypolobocera (Neostrengeria macropa) Milne-Edwards (1853), Crustacea: Brachyura: Pseudothelphusidae (Tesis). Universidad Jorge Tadeo Lozano. Colombia, Bogotá.
Peterson, A. T. (2011). Ecological niche conservatism: a time-structured review of evidence. Journal of Biogeography, 38, 817– 827. https://doi.org/10.1111/j.1365-2699.2010.02456.x
Peterson, A. T., Soberón, J. y Sanchez-Cordero, V. (1999). Conservation of ecological niches in evolutionary time. Science, 285, 1265–1267. https://doi.org/10.1126/science.285.5431.1265
Phillips, S. J., Anderson, R. P. y Schaphire, R. E. (2006). Maximum entropy modeling of species geographic distributions. Ecological Modeling, 190, 231–259. https://doi.org/10.1016/j.ecolmodel.2005.03.026
Pinilla, G. A., Duarte, J. C. y Vega, M. L. (2010). Índice de estado limnológico (IEL) para evaluar las condiciones ecológicas de las ciénagas del Canal del Dique, Colombia. Acta Biológica Colombiana, 15, 169-188.
R core team. (2013). A language and environment for statistical computing. R foundation for Statistical Computing. Vienna, Austria. Available at http://www.R-project.org
Ramírez, R. (2008). Tamaño y estructura poblacional del cangrejo de la sabana (Neostrengeria macropa) Crustacea: Brachyura: Pseudothelphusidae en el embalse del Neusa (Parque forestal embalse del Neusa) Cundinamarca (Tesis). Universidad el Bosque. Bogotá, D.C.
Ramírez, A. y Viña, G. (1998). Limnología colombiana. Bogotá: Editorial Panamericana.
Ramsar, R. (2000). Notas informativas sobre los valores y funciones de los humedales: mitigación del cambio climático. Bogotá: Convención de los Humedales.
Roa-Fuentes, C. A., Prada-Pedreros, S., Álvarez-Zamora, R., Rivera, R. C. y Maldonado-Ocampo, J. A. (2013). Abundancia relativa y dieta de Grundulus bogotensis (Characiformes: Characidae) en el altiplano Cundiboyacense, Colombia. Universitas Scientiarum, 18, 73–82. https://doi.org/10.11144/Javeriana.SC18-1.ardg
Rodríguez, C. C. (2006). Relaciones entre temperatura, exposición y altitud, en lado Ribeiro (Tesis). Área de edafología y química agrícola. Departamento de Biología Vegetal y Ciencia del suelo. Universidad de Vigo, España.
Rodríguez, G. (1982). Les crabes de´Eau douce D´ Amerique. Faune Tropicale. XXII. Paris: Oficina de Investigación Científica y Técnica en el Extranjero (ORSTOM).
Rodríguez, G. y Díaz, H. (1981). New species of freshwater crabs from the Andes (Crustacea: Decapoda: Pseudothelphusidae). Senckenbergiana Biologica, 61, 305 – 312.
Rodríguez, G. y Herrera, F. (1994). A new troglophilic crab, Chaceus turikensis, from Venezuela, and additional notes on the stygobiont crab Chaceus caecus Rodríguez and Bosque, 1990 (Decapoda: Brachyura: Pseudothelphusidae). Mémoires de Biospéologie, 21, 121–126.
Rodríguez, G. y Magalhães, C. (2005). Recent Advances in the biology of de neotropical freshwater crab family Pseudothelphusidae (Crustacea: Decapoda: Brachyura). Revista Brasileira de Zoología, 22, 354–365. https://doi.org/10.1590/S0101-81752005000200009
Socorro, B. C. (2009). Análisis de hábitat optimo y modelado de nicho ecológico para la conservación del venado cola blanca en el centro de Veracruz, México (Tesis de maestría). Instituto de Ecología A.C. México D.F.
Stephens, P. R. y Wiens, J. J. (2003). Explaining species richness from continents to communities: the time-for-speciation effect in emydid turtles. The American Naturalist ,161, 112–128. https://doi.org/10.1086/345091
UICN Redlist (2012). www.iucnredlist.org/details/134285/0 http://www.icanh.gov.co/m/index.php?idcategoria=5136
Valderrama, M. y Garzón, A. C. (2004). Indicadores de estado (abundancia relativa y estructura en tamaños) y algunas anotaciones biológicas y ecológicas de las poblaciones de capitán de la sabana Eremophilus mutisii, guapucha Grundulus bogotensis y cangrejo de la sabana Neostrengeria macropa en las lagunas de Fúquene y Cucunubá. Caracterización biofísica, ecológica y socio cultural del complejo de humedales del Valle de Ubate: Fuquene, Cucunubá y Palacio, Informe final. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Vázquez-Domínguez, E. (2002). Phylogeography, historical patterns and conservation of natural ar-eas. En D. M. Nelson, G. Day, J. C. Sportza, L. M. Loucky y C. Vásquez (Eds.), Protected areas and the regional planning imperative in North America (pp. 369–378). Calgary: University of Calgary Press.
Wiens, J. J. y Donoghue, M. J. (2004). Historical biogeography, ecology and species richness. Trends in Ecology and Evolution, 19, 639–644. https://doi.org/10.1016/j.tree.2004.09.011




