Alexander Llanes-Quevedo a, c *, Luis Enrique Sánchez-Ramos b y Adolfo G. Navarro-Sigüenza c
a Universidad Nacional Autónoma de México, Facultad de Ciencias, Posgrado en Ciencias Biológicas, Circuito Exterior s/n, Ciudad Universitaria, 04510 Ciudad de México, México
b Universidad Nacional Autónoma de México, Centro de Geociencias, Blvd. Juriquilla 3001, Campus UNAM 3001, Juriquilla La Mesa, 76230 Juriquilla, Querétaro, México
c Universidad Nacional Autónoma de México, Facultad de Ciencias, Museo de Zoología, Apartado postal 70-399, 04510 Ciudad de México, México
* Autor para correspondencia: alex.llanesquevedo@gmail.com (A. Llanes-Quevedo)
Recibido: 28 agosto 2023; aceptado: 16 enero 2024
Resumen
Presentamos un análisis de la diversidad y de los patrones biogeográficos de 260 especies de aves residentes de los bosques tropicales de México, realizado a partir de datos históricos (recolectados entre el siglo XVIII y 2007) y registros de presencia de la última década (2013-2023). Realizamos comparaciones del número y cambio de composición de especies, considerando las matrices de distribución “histórica” y “actual”, y un análisis de parsimonia de endemismos. De acuerdo con los datos históricos, la mayor riqueza de especies se localiza en la vertiente del Golfo de México y la península de Yucatán, mientras que los bosques estacionalmente secos de la costa del Pacífico y la Cuenca del Balsas presentaron los valores más altos de especies endémicas. Sin embargo, los datos recopilados en la última década muestran una disminución significativa del número de especies en todas las áreas analizadas. La estimación de la diversidad beta indicó valores elevados de cambio en la composición de especies para las matrices evaluadas. La hipótesis biogeográfica obtenida indica la existencia de 2 grandes grupos: i) vertiente pacífica de México y la Cuenca del Balsas y ii) norte de la provincia Veracruzana, el norte del Istmo de Tehuantepec y la península de Yucatán.
Palabras clave: Análisis de endemismo; Cambios antrópicos; Conservación; Distribución geográfica; Diversidad beta; Neotrópico
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Historical and current patterns of diversity and biogeographic relationships of the resident avifauna of the tropical forests of Mexico
Abstract
We present an analysis of diversity and biogeographic patterns of 260 resident bird species in the tropical forests of Mexico, based on historical data (collected between the 18th century and 2007) and presence records from the last decade (2013-2023). We performed comparisons of the number and composition change of species, considering the “historical” and “current” distribution matrices, and a parsimony analysis of endemicity. According to historical data, the highest species richness is located on the slope of the Gulf of Mexico and the Yucatán Peninsula, while the seasonally dry forests of the Pacific coast and the Balsas Basin presented the highest values of endemic species. However, data collected in the last decade show a significant decline in the number of species in all areas analyzed. The beta diversity estimation indicated high values of change in species composition for the matrices evaluated. Biogeographic hypothesis obtained indicates the existence of 2 main groups: i) Pacific slope of Mexico and the Balsas Basin and ii) north of the Veracruzan province, the north of the Isthmus of Tehuantepec and the Yucatán Peninsula.
Keywords: Analysis of endemicity; Anthropic changes; Conservation; Geographic distribution; Beta diversity; Neotropics
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
El estudio de los patrones de distribución de las especies es esencial para reconstruir su historia evolutiva y potenciar los esfuerzos de conservación en el contexto contemporáneo de pérdida acelerada de la biodiversidad. El arreglo espacial de la diversidad biológica es el producto complejo de la historia compartida entre las biotas y las áreas que éstas ocupan. Uno de los mejores ejemplos de esta complejidad lo constituye la biota mexicana, cuya diversidad es un reflejo de la posición geográfica, historia geológica, relieve y clima de México (Ramamoorthy et al., 1993). En este país pueden distinguirse hasta 17 provincias fisiográficas y 2 regiones climáticas separadas por el trópico de Cáncer, lo que junto con una posición geográfica limítrofe entre las regiones biogeográficas Neártica y Neotropical, ha producido una diversificación biológica notable a nivel global (Morrone, 2019). La diversidad de México, tanto a nivel de ecosistemas como de especies, se distribuye heterogéneamente, formando patrones espaciales complejos de paisajes con diferente composición biótica, aun entre áreas relativamente cercanas (Koleff et al., 2008).
Los bosques tropicales de México (BTM) se encuentran entre las comunidades vegetales más exuberantes del país, con una compleja estructura y composición taxonómica (Conabio, 2022; https://www.biodiversidad.gob.mx/ecosistemas). La posición geográfica de éstos en el extremo septentrional del Neotrópico, y el confinamiento (durante gran parte de su extensión) entre las costas Atlántica y Pacífica de México y los sistemas montañosos que conforman la Zona de Transición a la Región Neártica, han generado condiciones particulares para la evolución de los componentes bióticos que los caracterizan. La estrecha faja de área ocupada por estos bosques y la influencia de las serranías adyacentes han potenciado el efecto de las oscilaciones climáticas del Pleistoceno en el aislamiento y reconexión de las comunidades forestales neotropicales (Prance, 1982; Toledo, 1982: Metcalfe et al., 2000). Como resultado de estos procesos, los BTM están caracterizados por la presencia de un gran número de taxones endémicos y poblaciones diferenciadas morfológica y/o genéticamente (e.g., aves: Castillo-Chora, Sánchez-González et al., 2021; Llanes-Quevedo et al., 2022; Rocha-Moreira et al., 2020; anfibios: Mulcahy y Mendelson, 2000; mamíferos: Hernández-Canchola y León-Paniagua, 2017). Además, los BTM se encuentran entre los ecosistemas más amenazados de toda Mesoamérica (Ceballos y Valenzuela et al., 2010; Dinerstein et al., 1995; García-Oliva y Jaramillo, 2011).
Los BTM han sido clasificados en 2 tipos principales, bosques húmedos y los estacionalmente secos, atendiendo a la abundancia de las precipitaciones y a las características de su vegetación dominante (Villaseñor y Ortiz, 2013). Los primeros constituyen comunidades dominadas por árboles perennifolios (de entre 35-40 m de altura generalmente), en zonas con precipitación abundante (preciptación media anual superior a 2,000 mm) y entre el nivel del mar y los 1,000 m (Conabio, 2022; https://www.biodiversidad.gob.mx/ecosistemas/). Por otra parte, los bosques estacionalmente secos presentan árboles relativamente más bajos (5-15 m), en zonas cálidas con precipitaciones medias anuales que oscilan entre 300-1,200 mm y largas temporadas de sequía de entre 5 a 8 meses. Generalmente, estos ecosistemas se distribuyen entre el nivel del mar y 1,900 m snm (Conabio, 2022; https://www.biodiversidad.gob.mx/ecosistemas/). Los bosques secos son más abundantes en la vertiente pacífica del país, en las provincias biogeográficas Cuenca del Balsas y Tierras Bajas del Pacífico, mientras que los húmedos se distribuyen, principalmente, en las provincias Veracruzana y Península de Yucatán (Morrone, 2019).
A la fecha, se han realizado varios estudios evolutivos y biogeográficos que han estado encaminados a comprender los patrones de distribución y variación de los BTM y la fauna asociada a ellos. En algunos casos, estos ecosistemas han sido incluidos como parte del análisis de regiones geográficas específicas, como la Península de Yucatán (Cortés-Ramírez, 2012) o el oeste de México (en conjunto con bosques de montaña pertenecientes a la Zona de Transición Mexicana; García-Trejo y Navarro-Sigüenza, 2004). En otros casos, los trabajos se han realizado analizando por separado los bosques húmedos o los estacionalmente secos en México (e.g., plantas del género Bursera: Becerra, 2005; aves de la costa del Pacífico mexicano: Castillo-Chora, Sánchez-González et al., 2020; Ríos-Muñoz y Navarro-Sigüenza, 2012), incluyendo toda Mesoamérica (mamíferos de bosques húmedos: Olguín-Monroy et al., 2013; aves de bosques húmedos: Castillo-Chora, Zamudio-Beltrán et al., 2021; Miller et al., 2011;) o abarcando el Neotrópico (e.g., aves: Prieto-Torres, Rojas-Soto, Bonaccorso et al., 2019; Prieto-Torres, Rojas-Soto, Santiago-Alarcón et al., 2019).
Sin embargo, a pesar de que las provincias neotropicales mexicanas, que incluyen los bosques tropicales de México y América Central, constituyen una unidad biogeográfica natural (i.e., el dominio Mesoamericano; Morrone, 2014), ningún trabajo ha integrado el estudio de faunas asociadas a todas ellas para la obtención de patrones biogeográficos conjuntos. Por ello, en el presente trabajo realizamos un análisis de la distribución geográfica de la riqueza histórica y actual de especies de aves residentes en los BTM y generamos una hipótesis de regionalización biogeográfica basada en un análisis de parsimonia de endemismos (Rosen y Smith, 1988; PAE, por sus siglas en inglés: Parsimony Analysis of Endemicity).
Debido a su gran diversidad y a la atención que históricamente ha recibido su estudio, las aves se han convertido en modelos para los trabajos de evolución biológica y biogeografía (Brumfield, 2012). En sentido general, las aves cuentan con un buen estado de conocimiento (Peterson et al., 2016), una taxonomía relativamente estable (Sangster, 2009), así como gran diversidad ecológica, etológica y de vagilidad (Navarro-Sigüenza et al., 2014; Sekercioglu, 2006). El estudio de los patrones históricos y actuales de distribución de la riqueza de este grupo resulta relevante para mejorar la comprensión de su historia evolutiva y la de los ecosistemas que ocupan, así como para la planeación efectiva de su conservación y manejo. Además, la regionalización basada en este taxón ampliamente distribuido constituye un paso de avance en la investigación de la biogeografía del área, dado que la mayoría de los estudios biogeográficos previos parten de la separación de los bosques tropicales húmedos de los estacionalmente secos, y casi siempre abarcan solo el análisis de alguno de ellos (e.g., Prieto-Torres et al., 2019). La generación de hipótesis de relación entre las áreas ocupadas por los BTM permitirá contar con un marco de referencia útil para contrastarlos en el futuro con información de la variación genética de poblaciones y/o especies, y evaluar la congruencia de los patrones recuperados.
Materiales y métodos
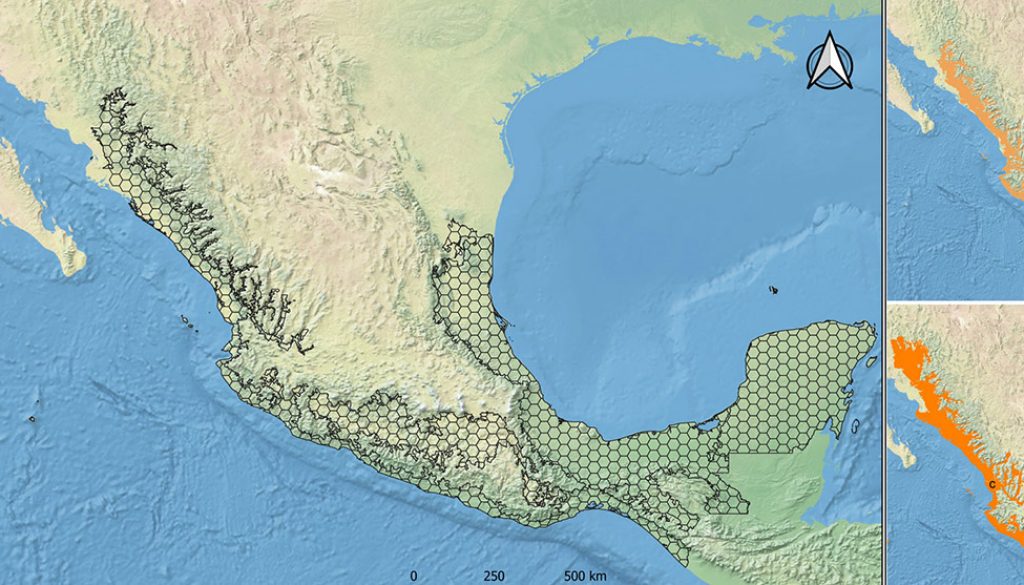
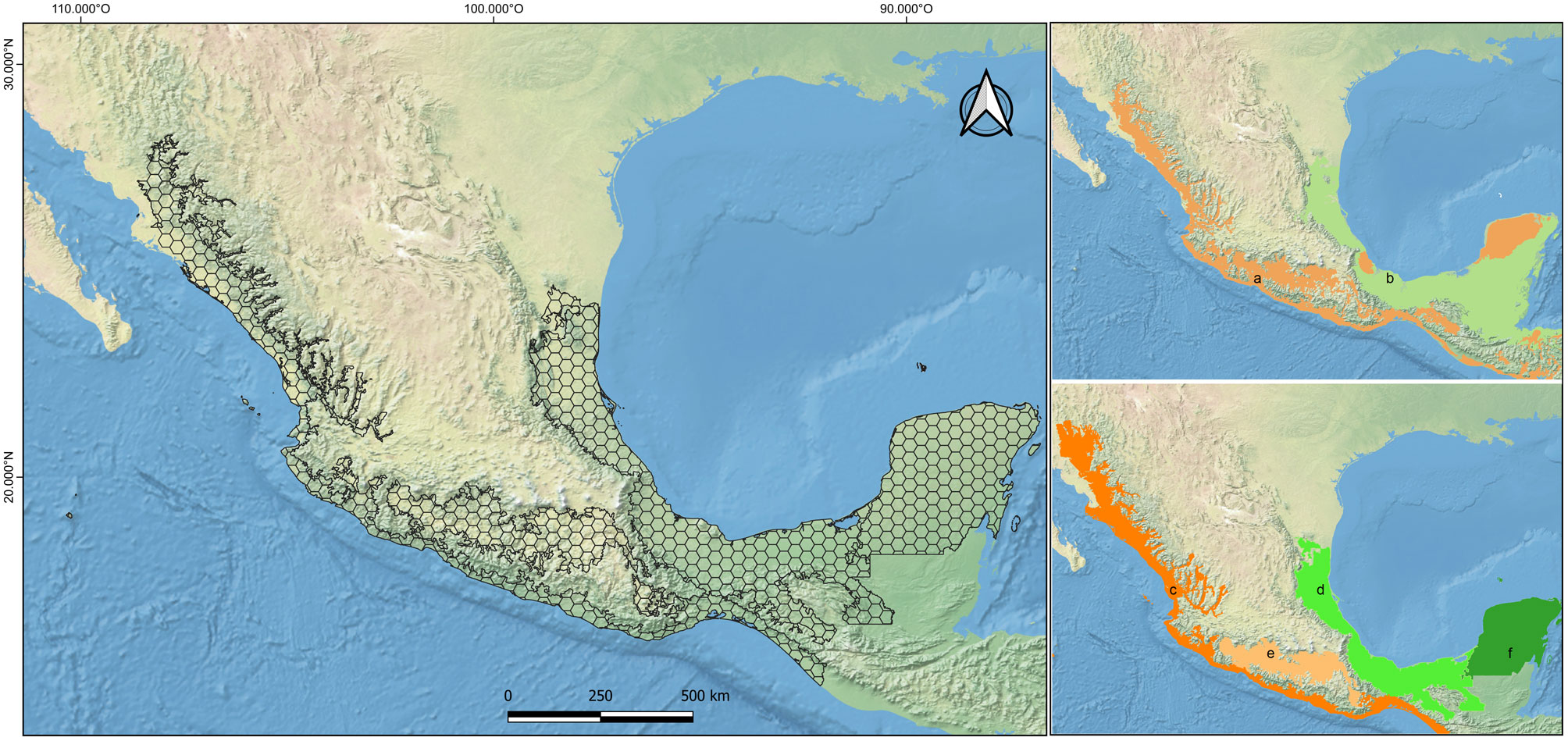
El área de estudio incluye las 4 provincias neotropicales, en sentido estricto, ubicadas en México (sensu Morrone, 2019; fig. 1): Tierras bajas del Pacífico (localizada en una franja angosta e ininterrumpida que recorre la costa de Sinaloa, Nayarit, Jalisco, Colima, Michoacán, Guerrero, Oaxaca y Chiapas), Cuenca del Balsas (ubicada en el centro del país, en parte de Guerrero, México, Jalisco, Michoacán, Morelos, Oaxaca y Puebla), Veracruzana (costa del Golfo de México de Veracruz, Tabasco, Tamaulipas y parte de San Luis Potosí, Hidalgo, Puebla, Oaxaca, Chiapas y Campeche) y Península de Yucatán (sureste de México, abarcando los estados de Campeche, Yucatán y Quintana Roo). Sobre el mapa digital en formato “shapefile” de esta área se construyó una gradilla conformada por hexágonos de 0.33 grados de diámetro (fig. 1) para representar de mejor manera a la forma de los espacios geográficos analizados (Morrone et al., 2017), como ha sido sugerido en los trabajos de Kobelkowski-Vidrio et al. (2014) y Sánchez-Ramos et al. (2018). A partir de ésta, se realizaron los análisis subsecuentes de diversidad y patrones biogeográficos.
Se analizaron datos de presencia y mapas distribucionales de 260 especies de aves pertenecientes a 82 familias y 179 géneros residentes en los BTM (material suplementario, tabla S1). Las especies fueron seleccionadas de acuerdo con los siguientes criterios: 1) especies nativas; 2) especies con datos de presencia disponibles en el portal del Servicio de Información sobre Biodiversidad Global (GBIF por sus siglas en inglés, Global Biodiversity Information Facility) y mapas distribucionales en el Atlas de las Aves de México (Navarro-Sigüenza y Peterson, 2007); 3) especies para las que se ha descrito la ocupación de los BTM de acuerdo con el compendio ornitológico Birds of the World (Cornell University, 2023, https://birdsoftheworld.org/bow); 4) especies residentes permanentes en el área analizada; y 5) categoría específica de acuerdo con la AOU (Chesser et al., 2022). De esta forma, fueron excluidas del análisis especies introducidas, migratorias y aves acuáticas (e.g., Anseriformes, Gruiformes y Aequorlitornithes, sensu Prum et al., 2015).
Recopilación de mapas de distribución y datos de presencia. Construimos 2 bases de datos de presencia de las especies con la intención de recuperar los patrones históricos y actuales de la distribución de la avifauna de los BTM. Para obtener los patrones históricos, compilamos los mapas de distribución de las especies seleccionadas del Atlas de las Aves de México (Navarro-Sigüenza y Peterson, 2007). Dichos mapas fueron construidos con información de más de 750 mil registros georreferenciados de aves de México a partir de los cuales se realizaron modelos predictivos de la distribución de las especies con la aplicación del algoritmo GARP (Navarro-Sigüenza y Peterson, 2007; Navarro-Sigüenza et al., 2009). Los registros provienen de especímenes de museos (colectados entre el siglo XVIII y 2007), literatura e información original de diferentes especialistas de más de 80 colecciones científicas en México, Estados Unidos, Canadá y varios países de Europa (Navarro-Sigüenza y Peterson, 2007). A partir de estos mapas, se extrajeron los puntos de coincidencia con las celdas definidas dentro de la gradilla del área de estudio y se generaron matrices de presencia (1, presencia; 0, ausencia) de las especies (columnas) por cada celda (filas).
Por otra parte, para obtener un panorama más actualizado de la diversidad de la avifauna de los BTM, recopilamos datos primarios de presencia de este grupo (combinaciones de especies-latitud y longitud-localidad-año de registro) en GBIF en la última década, es decir, en el rango temporal comprendido entre 2013-2023 (GBIF.org [31 March 2023-03 April 2023], GBIF Occurrence Downloads: https://doi.org/10.15468/dl.xceppm, doi.org/
10.15468/dl.cbxx4j, doi.org/10.15468/dl.b5y3qg, doi.org/
10.15468/dl.rc73kz, doi.org/10.15468/dl.e6bh6c, doi.org/
10.15468/dl.9knvwp, doi.org/10.15468/dl.gr2t9j, doi.org/
10.15468/dl.577f73, doi.org/10.15468/dl.bjqw2a, doi.org/
10.15468/dl.prpy8u). A partir de los datos recopilados, se realizaron filtrados manuales para eliminar las especies excluidas de acuerdo con los criterios antes establecidos y los registros duplicados por celda.
Patrones de riqueza de las aves de los BTM. Para visualizar los patrones de distribución de las especies de aves de los BTM, construimos mapas de riqueza en QGIS v.3.18 Zurich (QGIS.org, 2022) empleando ambas bases de datos. Para cada matriz, superpusimos los puntos únicos de presencia de cada especie por hexágono en la gradilla y posteriormente proyectamos en el mapa los valores de la suma de especies registradas en cada celda. Además, realizamos proyecciones incluyendo únicamente las especies endémicas y cuasiendémicas de México, de acuerdo con Berlanga et al. (2015). En ese trabajo, se consideran como endémicas a aquellas especies cuya distribución geográfica se encuentra restringida a los límites políticos del territorio mexicano y como cuasiendémicas, aquellas con áreas de distribución que se extienden ligeramente fuera de México (≤ 35,000 km2), debido a la continuidad de los hábitats (González-García y Gómez-de Silva, 2002). Para estos 3 grupos de datos, calculamos la significación estadística de la diferencia de los valores de riqueza entre las matrices histórica y actual mediante pruebas de U de Mann-Whitney, luego de la comprobación de la falta de normalidad de los datos con la prueba de Kolmogórov-Smirnov. Los cálculos fueron realizados con el software GraphPadPrism v8.0.2 (San Diego, California, USA, www.graphpad.com).
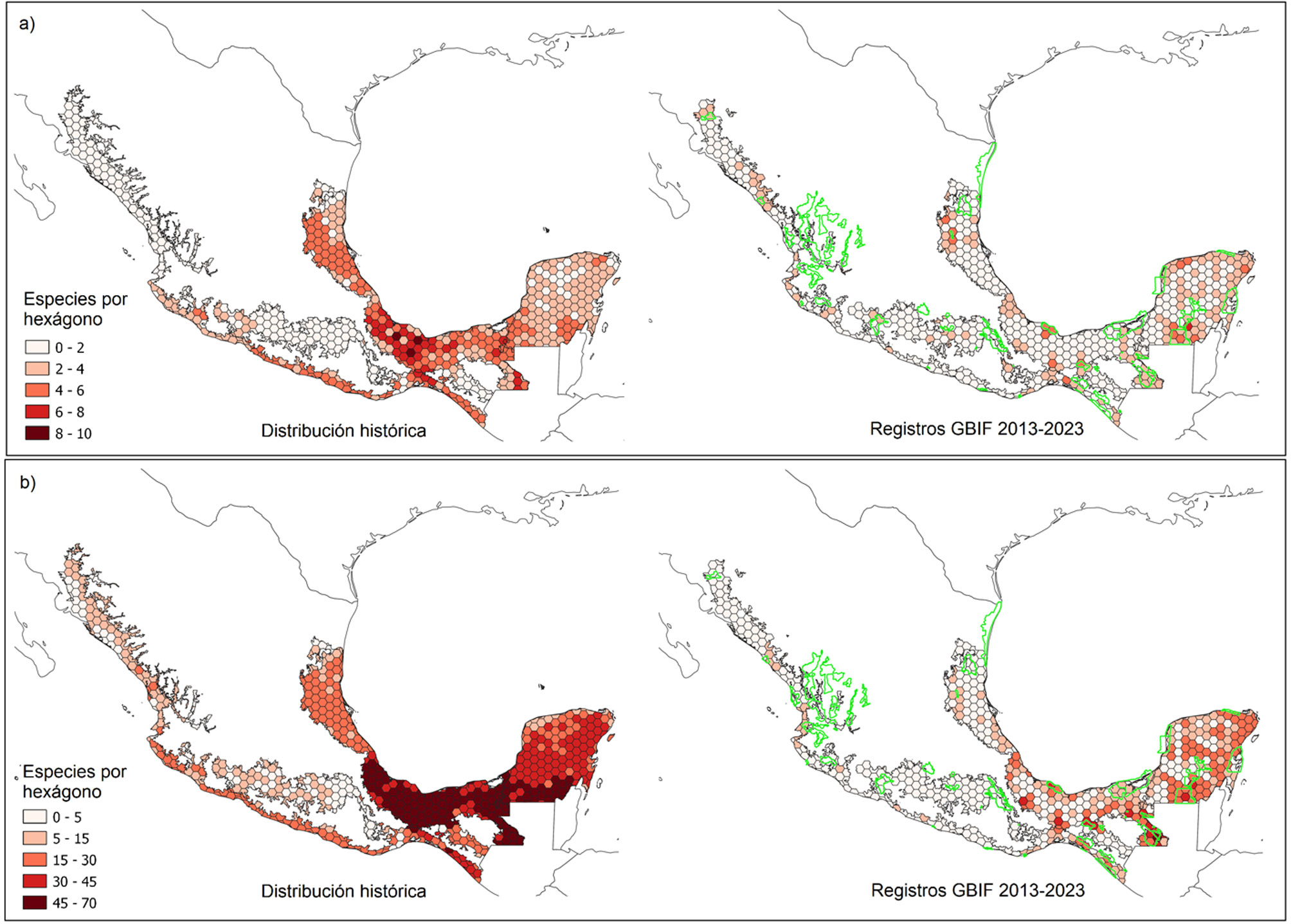
Adicionalmente, recopilamos la información concerniente al riesgo de extinción de cada especie de acuerdo con la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (2022; IUCN, por sus siglas en inglés) y la Norma Oficial Mexicana NOM-059 (Semarnat, 2010). Agrupamos las especies en las categorías de IUCN: “en peligro crítico”, “en peligro” y “vulnerable”, y de acuerdo con las categorías de la NOM-059: “probablemente extintas en el medio silvestre”, “en peligro de extinción”, “amenazadas” y “sujetas a protección especial” y proyectamos en el mapa su suma para cada celda de la gradilla. Para la generación de estos mapas, no se incluyeron las especies clasificadas como de menor preocupación y aquellas no evaluadas o con datos insuficientes.
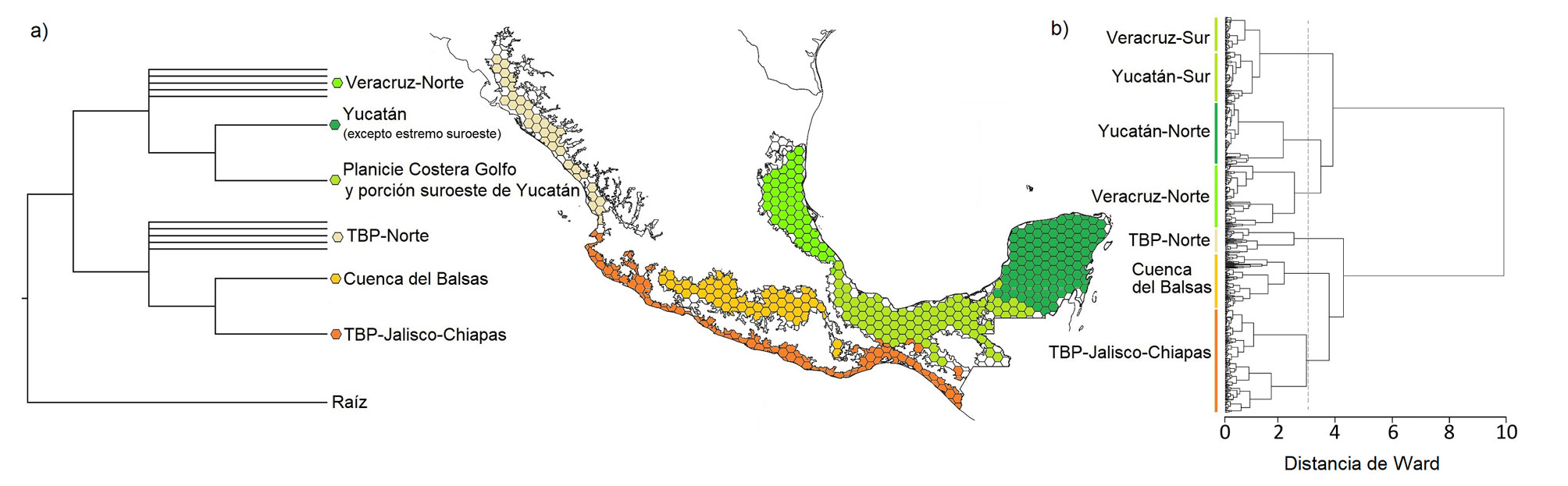
Finalmente, estimamos el cambio en la composición de especies de aves en los BTM (diversidad β; Whittaker, 1972) mediante el cálculo del índice de Sørensen (βSOR) con el paquete “betapart” (Baselga y Orme, 2012) en R v.4.1 (R Development Core Team, 2021). Ese índice de disimilitud está dado por 2 componentes: el recambio de especies medido con el índice de Simpson (βSIM) y el anidamiento, medido con el índice βNES (Baselga, 2010). Esto permite cuantificar las diferencias asociadas con las especies no compartidas, independientemente de la riqueza específica de las áreas (Koleff et al., 2003) y reducir los sesgos que pueden generar tamaños de biotas diferentes en el análisis (Baselga, 2010). La estimación de β se realizó con la función “beta.pair” del mencionado paquete, mediante el cálculo del promedio de las combinaciones pareadas entre las celdas de la gradilla y su desviación estándar. Estos cálculos se efectuaron con ambas matrices: 1) para la totalidad del área de estudio, 2) considerando por separado para cada una de las bioprovincias que la componen y 3) de manera cruzada entre esas unidades biogeográficas. Además, construimos un dendrograma a partir de un análisis de clasificación de la matriz de disimilitud de datos históricos con el método de Ward (Murtagh y Legendre, 2014), para visualizar las relaciones entre las áreas e inferir los procesos que han generado los patrones de distribución de las especies.
Análisis de parsimonia de endemismos y regionalización biogeográfica. Para evaluar las relaciones entre las áreas donde se distribuyen los BTM, implementamos un PAE (Morrone y Escalante, 2002; Rosen y Smith, 1988) con base en la matriz de datos históricos y la gradilla de 0.33°. Los análisis fueron realizados con el software NONA 2.0 (Goloboff, 1999) a través de WinClada versión 1.00.08 (Nixon, 2002). Para el enraizamiento del cladograma incluimos un área hipotética con solo ausencias, de acuerdo con lo recomendado por Rosen y Smith (1988) y Morrone (1994). Para optimizar la búsqueda de la topología más parsimoniosa, utilizamos la opción de búsqueda de “ratchet” (Mouillot et al., 2013; Nixon, 1999) con 500 iteraciones por repetición, una retención de árbol por iteración y 40% de muestreo de los caracteres. De los árboles obtenidos, seleccionamos los más parsimoniosos y a partir de éstos, calculamos el consenso estricto. Para este árbol se calcularon los índices de consistencia (CI), de retención (RI) y longitud (L). Las agrupaciones de hexágonos obtenidas (respaldadas por al menos una especie —sinapomorfías— o combinación única de especies) mediante el PAE, se visualizaron en mapas construidos en el sistema de información geográfica QGIS v.3.18 (QGIS.org, 2022).
Resultados
Para las 260 especies seleccionadas, recopilamos sendos mapas de distribución a partir del Atlas de Aves de México (Navarro-Sigüenza y Peterson, 2007) y 37,289 registros recientes únicos georreferenciados en la zona de estudio. Estas especies representan aproximadamente 24% de la avifauna total registrada para México (1,107 especies; Berlanga et al., 2015) e incluyen 33 especies endémicas y 22 cuasiendémicas de este país (material suplementario, tabla S1).
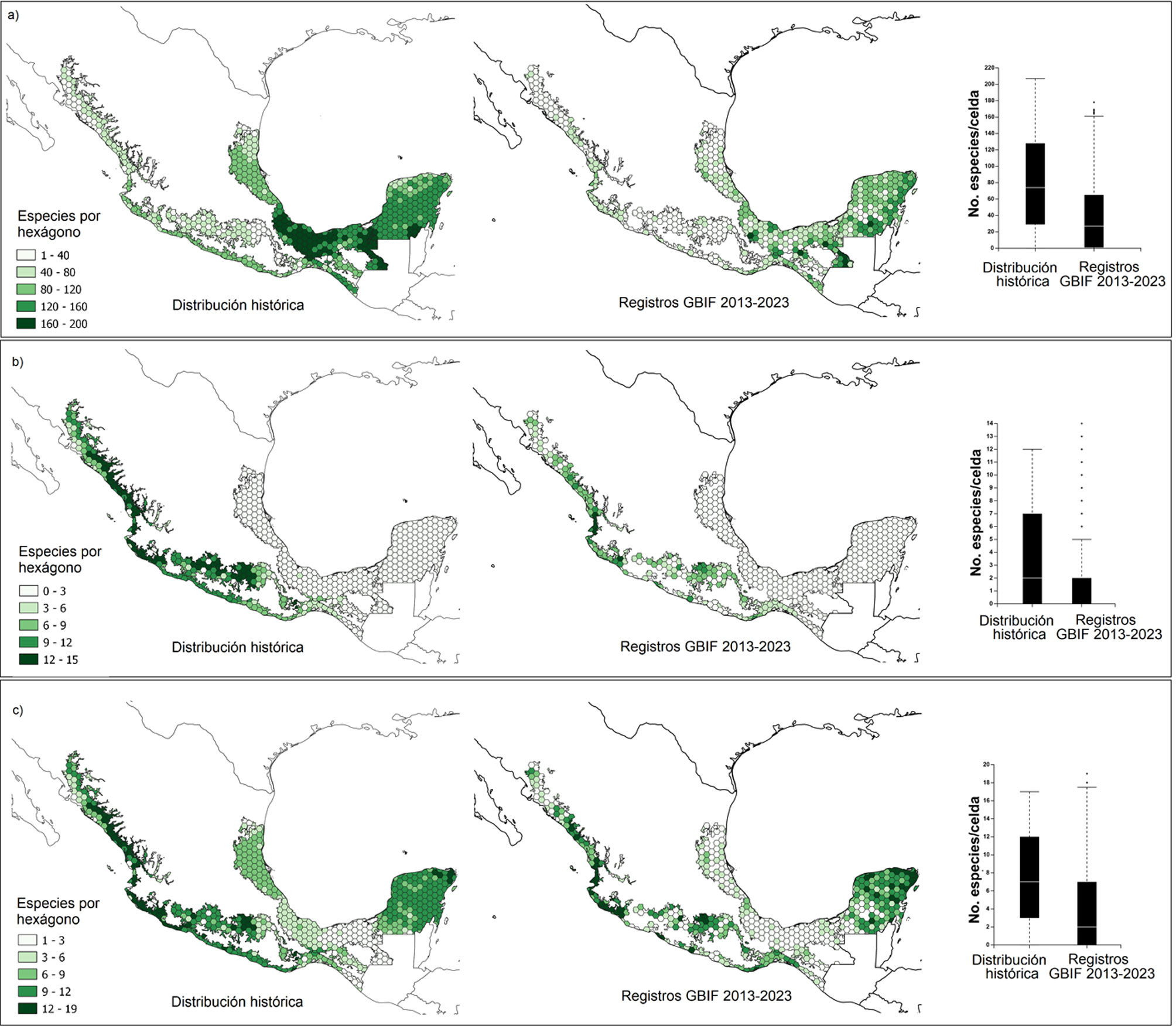
Tabla 1
Valores de cambio en la composición de especies —estimados mediante el cálculo del índice βSOR— de aves residentes permanentes de los bosques tropicales de México (BTM) en conjunto y en cada una de las provincias biogeográficas donde éstos se distribuyen. βSIM indica el recambio de especies medido con el índice de Simpson y βNES, el anidamiento de acuerdo con Baselga (2010).
| Distribución Histórica | ||||||||
| Provincia biogeográfica | n especies | n celdas | βSOR | βSIM | βNES | |||
| Media | Desv.est. | Media | Desv.est. | Media | Desv.est. | |||
| Cuenca del Balsas | 149 | 122 | 0.475 | 0.245 | 0.239 | 0.18 | 0.235 | 0.195 |
| Península de Yucatán | 206 | 150 | 0.196 | 0.153 | 0.066 | 0.057 | 0.13 | 0.128 |
| Tierras Bajas del Pacífico | 222 | 285 | 0.391 | 0.186 | 0.181 | 0.142 | 0.209 | 0.155 |
| Veracruzana | 236 | 254 | 0.352 | 0.183 | 0.163 | 0.127 | 0.189 | 0.156 |
| BTM en conjunto | 260 | 811 | 0.488 | 0.198 | 0.279 | 0.155 | 0.209 | 0.147 |
| Distribución GBIF 2013-2023 | ||||||||
| Provincia biogeográfica | n especies | n celdas | βSOR | βSIM | βNES | |||
| Media | Desv.est. | Media | Desv.est. | Media | Desv.est. | |||
| Cuenca del Balsas | 102 | 98 | 0.666 | 0.24 | 0.344 | 0.312 | 0.321 | 0.308 |
| Península de Yucatán | 208 | 149 | 0.422 | 0.238 | 0.144 | 0.146 | 0.277 | 0.241 |
| Tierras Bajas del Pacífico | 213 | 203 | 0.653 | 0.237 | 0.342 | 0.283 | 0.31 | 0.27 |
| Veracruzana | 233 | 235 | 0.589 | 0.232 | 0.285 | 0.238 | 0.304 | 0.256 |
| BTM en conjunto | 260 | 685 | 0.695 | 0.216 | 0.412 | 0.269 | 0.284 | 0.252 |
Patrones de riqueza de las aves de los BTM. Los números de especies por celda variaron significativamente según la matriz empleada: para la matriz de datos históricos los valores estuvieron entre 21 y 207 con un promedio de 82; para la matriz de datos actuales los números fueron menores, entre 1-178, con un promedio significativamente menor, 52 especies (Mann-Whitney, p ≤ 0.0001; fig. 2a). Al considerar los datos históricos, las áreas con mayores valores de riqueza de especies por celda fueron los bosques húmedos de las planicies del norte del Istmo de Tehuantepec, las inmediaciones de la Selva Lacandona y la Península de Yucatán. Las celdas con menores números de especies se encontraron hacia los extremos septentrionales del área de estudio, en las vertientes del Golfo de México y del Golfo de California. De acuerdo con los registros de presencia de la última década, el este de la Península de Yucatán, Chiapas y algunas áreas del centro y sur Veracruz, albergan los mayores números de especies del país (con entre 80 y 200 especies). Sin embargo, el número de celdas con altos valores de riqueza es significativamente menor que el obtenido a partir de la matriz de datos históricos.
Por otra parte, la riqueza histórica de especies endémicas por hexágono varió entre 0 y 12 (fig. 2b), alcanzando los mayores valores en las áreas ocupadas por los bosques estacionalmente secos del oeste del país en Jalisco, Nayarit y Sinaloa, y los de la Cuenca del Balsas, en Guerrero, Puebla y Oaxaca. Las áreas correspondientes a la provincia Veracruzana y Península de Yucatán presentaron bajos valores de endemismo, generalmente por debajo de 3 especies endémicas por hexágono. Al incluir las especies cuasiendémicas, se encontraron los mayores valores en la vertiente Pacífica de México (generalmente entre 6 y 17 taxones por celda), aunque también aparecieron como áreas importantes los bosques húmedos de la Península de Yucatán y de la porción norteña de la provincia Veracruzana (fig. 2c). La evaluación de los registros de presencia más actuales reveló, tanto para las especies endémicas como para las cuasiendémicas, un número significativamente menor de especies por celda (Mann-Whitney, p ≤ 0.0001; fig. 2b, c). Estas disminuciones son más apreciables hacia las costas de Michoacán y Guerrero, y el oeste de la Cuenca del Balsas para las especies endémicas, mientras que para las cuasiendémicas, también se obtienen esas áreas, además de prácticamente la totalidad de la provincia Veracruzana. Por otra parte, para Yucatán se obtuvo que los registros de GBIF entre 2013-2023 indican disminuciones puntuales en algunas áreas de la península y un aumento respecto al número de cuasiendémicas obtenido por la matriz histórica. Estos incrementos se han reportado cerca de importantes asentamientos humanos y enclaves turísticos como el área comprendida entre Holbox-Cancún-Playa del Carmen-Tulum, por ejemplo.
Respecto a la distribución de aves con algún grado de amenaza según la IUCN y la NOM-059 (fig. 3), se encontró un patrón actual de reducción en la distribución de especies en los BTM. De acuerdo con la matriz histórica, las áreas del norte del Istmo de Tehuantepec presentaron los mayores números de especie por celda con valores de 5 a 9 y 42 a 70, respectivamente. Los bosques húmedos de la porción norteña de la provincia Veracruzana, los de la Península de Yucatán y los bosques secos del Pacífico (en los estados Jalisco, Colima, Michoacán, Guerrero y Oaxaca) también presentaron valores relativamente altos de especies de aves residentes con riesgo de extinción (generalmente por encima de 3 especies amenazadas según IUCN y 28 según las NOM-059). Sin embargo, de acuerdo con la matriz de datos actuales, el número de estas áreas es sensiblemente menor, así como el número de especies distribuidas en ellas. Para las especies dentro de las listas de amenaza de IUCN y de la NOM-59, las áreas más críticas parecen ser el norte y sur de la Península de Yucatán, el este de Chiapas, el Istmo de Tehuantepec y algunas localidades de Veracruz, Nayarit y Sinaloa.
La estimación de los índices de diversidad β para el área de estudio indicó un alto cambio en la composición de especies de los BTM para los 2 grupos de datos evaluados (tabla 1). Sin embargo, a partir de la matriz de datos actuales se obtuvieron valores (βSOR = 0.695, βSIM = 0.412 y βNES = 0.284) que indican una mayor disimilitud entre las áreas que la estimada a partir de los datos históricos de distribución (βSOR = 0.488, βSIM = 0.279 y βNES = 0.209). Al descomponer el área de estudio en las provincias biogeográficas, encontramos que para ambas matrices, la Península de Yucatán presentó los menores índices (histórica: βSIM = 0.153, βNES = 0.066; actual: βSIM = 0.144, βNES = 0.277) y la provincia Cuenca del Balsas, los mayores (histórica: βSIM = 0.239, βNES = 0.235; actual: βSIM = 0.344, βNES = 0.321). El cálculo de β pareada entre las bioprovincias indicó que los mayores valores de disimilitud se encuentran entre las celdas correspondientes a los bosques distribuidos hacia las vertientes del Atlántico y el Pacífico (tabla 2); siendo más similares, las localizadas dentro cada una de estas vertientes.
El análisis de clasificación a partir de la matriz histórica generó 2 agrupaciones principales (fig. 4). La primera incluyó a las áreas correspondientes a los bosques tropicales de la vertiente Atlántica de México (que contiene 235 de las 260 especies analizadas y 25 únicas de esta área). Este conjunto se dividió en 2 subconjuntos, uno que contiene las celdas correspondientes a las áreas del sur de Veracruz (aproximadamente desde las inmediaciones de la Faja Volcánica Transmexicana) hasta los límites orientales de Tabasco y otro, subdividido en agrupaciones de celdas del norte de Veracruz y la Península de Yucatán. La segunda agrupación principal incluyó las celdas localizadas en la costa del Pacífico (231 especies, 21 especies únicas) y a su vez se subdividió en 2 grupos. El primero formado por los hexágonos ubicados desde Sinaloa hasta la porción media de Jalisco, mientras que el segundo subgrupo se organizó en otros 2 conjuntos de celdas, uno que contiene la gran mayoría de hexágonos del área de la Cuenca del Balsas y el otro con las localizadas desde el centro-este de Jalisco hasta Guatemala, incluyendo aquellas localizadas al sur del Istmo de Tehuantepec.
Análisis de parsimonia de endemismos y regionalización biogeográfica. A partir de la matriz histórica se obtuvieron 3 árboles igualmente parsimoniosos (CI = 6, RI = 80, L = 4,311), con los que se calculó el cladograma de consenso estricto (fig. 4a; material suplementario, fig. S1; CI = 6, RI = 88 y L = 5,184). Este último reveló la existencia de 2 agrupamientos principales: uno que contiene la mayoría de las celdas de los BTM de la vertiente del Pacífico y otro las de la vertiente del Golfo de México y el Mar Caribe. Dentro del primero están contenidas las celdas correspondientes a los bosques secos localizados desde Sinaloa hasta la porción media de Jalisco aproximadamente, y un grupo de celdas que a su vez se subdivide en 2: un conjunto que contiene todas las áreas restantes de los bosques secos del Pacífico mexicano (desde Jalisco hasta Chiapas, por toda la costa occidental) y otro que contiene los bosques de la Cuenca del Balsas, con algunas celdas aledañas pertenecientes a la provincia Tierras Bajas del Pacífico. Por otra parte, el grupo que contiene los bosques húmedos y secos de la vertiente Atlántica presenta los hexágonos de las áreas más septentrionales de la distribución de los bosques húmedos en la vertiente del Golfo de México hasta el centro de Veracruz, y un grupo que incluye al resto de las celdas. Este último grupo se subdivide a su vez en 2 agrupaciones resueltas: una que contiene las celdas localizadas en la Planicie Costera del Golfo de México (según Morrone, 2019) en la porción centro-oriental del norte del Istmo de Tehuantepec y otra con las celdas correspondientes a la parte norte y centro de la provincia Península de Yucatán.
Discusión
Los bosques neotropicales presentan valores excepcionales de diversidad y complejos patrones de distribución, como resultado de múltiples eventos geológicos, ecológicos y evolutivos (Brumfield, 2012; Duellman, 1982; Steadman et al., 2017), especialmente en el territorio mexicano, donde entran en contacto con los componentes bióticos de la región Neártica (Escalante et al., 1993; Morrone, 2019). Las aves representan una parte importante de esa diversidad (Haffer, 1987; Stotz, 1996), por lo que el estudio de sus patrones biogeográficos constituye una aproximación relevante para entender los procesos históricos y ecológicos que han moldeado la biodiversidad de los BTM. Estos bosques se consideran entre los ecosistemas más amenazados a nivel mundial principalmente por las altas tasas de deforestación, cambio de uso de suelo, minería y tráfico de vida silvestre, entre otros (Ceballos et al., 2010; Dinerstein et al., 1995; García-Oliva y Jaramillo, 2011). Por tanto, el entendimiento de la historia evolutiva de los BTM es esencial, no solo desde el punto de vista teórico, sino para la planeación eficiente de su conservación, especialmente dado el panorama actual de degradación de la biodiversidad debido a las presiones antropogénicas y el cambio climático (Cuervo-Robayo et al., 2020; Prieto-Torres et al., 2020).
Patrones de riqueza de las aves de los BTM. Los patrones históricos de diversidad que encontramos fueron congruentes con la literatura, tanto para los datos de riqueza de especies total como para las endémicas (Navarro-Sigüenza et al., 2014; Peterson y Navarro-Sigüenza, 2016; Ríos-Muñoz y Navarro-Sigüenza, 2012). La mayor concentración de especies se presenta al norte del Istmo de Tehuantepec a lo largo de la vertiente del Golfo de México y de la península de Yucatán, mientras que el mayor número de especies endémicas del país se concentra a lo largo de la planicie costera del Pacífico. Al incluir las especies cuasiendémicas, encontramos que la Península de Yucatán y el norte de Veracruz son las principales áreas de agregación de estas especies, las cuales tienen un alto valor de conservación si se considera que México constituye la mayor parte de su área distribucional.
Tabla 2
Valores de cambio en la composición de especies (índice βSOR) de aves residentes permanentes de los bosques tropicales de México (BTM) entre las provincias biogeográficas donde se distribuyen. Por encima de la diagonal se muestran los valores de diversidad de acuerdo con los registros obtenidos a partir de GBIF (2013-2023). Por debajo de la diagonal se muestran los valores de acuerdo a los registros históricos de distribución.
| Cuenca del Balsas | Península de Yucatán | Tierras Bajas del Pacífico | Veracruzana | ||
| Cuenca del Balsas | – | 0.514 | 0.375 | 0.454 | De acuerdo con los registros de GBIF |
| Península de Yucatán | 0.34 | – | 0.197 | 0.099 | |
| Tierras Bajas del Pacífico | 0.229 | 0.152 | – | 0.122 | |
| Veracruzana | 0.266 | 0.101 | 0.058 | – | |
| De acuerdo con la distribución histórica |
La conformación de la avifauna de México es resultado de diferentes procesos históricos que han afectado a diferentes escalas espaciales y temporales a este territorio. Así, por ejemplo, la avifauna de Península de Yucatán se ha conformado a partir de elementos de procedencia continental, antillana y endémica del área, aunque este es el componente minoritario (Cortés-Ramírez et al., 2012; Escobar-Luján et al., 2021; Paynter, 1955). Las características del paisaje de la península, que carece de accidentes geográficos notables que puedan funcionar como barreras, han propiciado la dispersión de taxones mesoamericanos y de las islas del Caribe (Vuilleumier, 1985), así como el mantenimiento del flujo de genes entre sus poblaciones, limitando los procesos de diferenciación y especiación. El endemismo de esta área se ha conformado por especies de distribución relictual que se han diferenciado por haber colonizado tempranamente el área, o por presentar elevadas tasas de evolución (Paynter, 1955). Por otra parte, la conformación de la avifauna de los bosques secos del occidente de México ha estado afectada principalmente por el aislamiento producido por la Faja Volcánica Transmexicana, la sierra Madre del Sur y los cambios paleoclimáticos. Estas barreras geográficas para la dispersión, junto con los ciclos climáticos del Pleistoceno, han generado efectos de aislamiento y contacto periódicos, que a su vez derivaron en procesos de diferenciación de poblaciones de aves y la formación de taxones endémicos (Arbeláez-Cortés et al., 2014; Becerra, 2005; Castillo-Chora, Sánchez-González et al., 2021; Morrone, 2014; Navarro-Sigüenza et al., 2017).
Los patrones generales de riqueza histórica total descritos en este trabajo son congruentes con los encontrados en otros grupos de vertebrados como mamíferos, anfibios y reptiles de México (Koleff et al., 2008). Las áreas que contienen altos valores de riqueza de especies de aves (mayores de 60%) coinciden, con algunas diferencias, con las zonas de mayor riqueza de especies de mamíferos y, en una medida menor, con las de anfibios y reptiles (Koleff et al., 2008). Respecto a la concentración de especies endémicas, la costa del Pacífico, la Faja Volcánica Transmexicana y la sierra Madre del Sur son las áreas más importantes para anfibios y reptiles (Flores-Villela, 1993; Ochoa-Ochoa y Flores-Villela, 2006), mientras que para los mamíferos son la Cuenca del Balsas y la Faja Volcánica Transmexicana (Ceballos et al., 2005; Escalante et al., 2020).
Respecto al escenario actual de diversidad de la avifauna de los BTM, nuestros análisis indican una disminución de la riqueza de especies en comparación con los datos históricos y los modelos de distribución potencial del Atlas de las Aves de México (Navarro-Sigüenza y Peterson, 2007; Navarro-Sigüenza et al., 2009). Esta diferencia podría estar determinada en parte por las propias fuentes de datos. La metodología empleada para elaborar los mapas de distribución de esta obra podría tener un efecto de sobreestimación de las áreas reales de presencia de los taxones, mientras que los registros de presencia en GBIF podrían ofrecer una sub-representación de la distribución actual real debido a diversos factores, como la accesibilidad de las áreas, la experiencia de los observadores en la identificación de especies y los hábitos y detectabilidad de éstas, entre otras. Sin embargo, es poco probable que éstas sean las únicas fuentes de discordancia entre las matrices obtenidas.
Además de lo previamente expuesto, la diferencia entre los patrones de riqueza histórica y actual de las aves de los BTM podría estar fuertemente influenciada por los cambios de uso de suelo y vegetación que han ocurrido sistemáticamente en México desde el siglo XVI (González, 1999). En este país, las tasas de deforestación anual entre 1976 y 2015 han oscilado entre 92,000 y 776,000 ha de bosque (FAO, 2015; Velázquez et al., 2002). Esto ha derivado en una disminución de las selvas húmedas de 12,600,000 ha en 1976 a aproximadamente 8,800,000 ha en 2015, y de los bosques estacionalmente secos, de más de 25,000,000 a menos de 22,500,000 ha en el mismo periodo (Semarnat, 2023). Las zonas más críticas de deforestación se encuentran en Veracruz, Campeche, Quintana Roo, Yucatán, Chiapas, Michoacán y Jalisco (Conafor, 2020), lo cual concuerda con las áreas de mayor disminución de la riqueza de aves por celda para todas las categorías evaluadas en este trabajo.
La distribución de las especies con algún grado de amenaza según las listas de IUCN y la NOM-059, tuvo un comportamiento similar al de los conjuntos de datos anteriores. Si bien al considerar los datos históricos se podría esperar que se distribuyeran mayormente en grandes extensiones en la Planicie Costera del Golfo de México, el norte de Veracruz y la porción sureste de la Península de Yucatán (con algunos hexágonos concentrando más de 60 especies amenazadas según la NOM-059 y hasta 8 según la IUCN), este panorama es bastante diferente al emplear la matriz con datos recientes. Con esta última, se obtiene que esas especies quedan confinadas a escasas celdas (generalmente agrupadas en números de 2 a 3 en prácticamente toda el área evaluada, lo que correspondería con áreas de 60 a 90 km2), en su mayoría no contiguas, con la excepción de Yucatán. La mayor parte de hexágonos con alta concentración de especies en peligro no se encuentra representada en el sistema de Áreas Naturales Protegidas Federales de México; fundamentalmente aquellos ubicados en Veracruz y en la costa del Pacífico (fig. 3; http://sig.conanp.gob.mx/), lo que constituye un factor de riesgo adicional para la conservación de varias especies de aves y sus hábitats.
La baja cobertura de áreas de importancia para las aves dentro del Sistema Nacional de Áreas Naturales Protegidas —menos de 15% de la superficie ocupada actualmente por los BTM— ya ha sido señalada anteriormente por otros autores (e.g., Navarro-Sigüenza et al., 2011; Peterson y Navarro-Sigüenza, 2016; Ramírez-Albores et al., 2021). Sin embargo, esta situación persiste a pesar de la definición de al menos 7 nuevas áreas protegidas en la última década, ninguna de las cuales está enfocada a la preservación de los BTM. Este escenario es más dramático si se considera que las agregaciones de especies endémicas o con áreas de distribución restringida no son coincidentes para todos los grupos de vertebrados, por lo que para los planes de manejo no es factible usar unos grupos para diseñar la conservación de otros (Koleff et al., 2008).
Los análisis de diversidad β indicaron altos valores de cambio en la composición de especies entre las diferentes áreas para cada una de las matrices evaluadas, tanto en el análisis regional como a nivel de las provincias biogeográficas (sensu Morrone, 2019). Esto concuerda con resultados previamente obtenidos para mamíferos, aves y reptiles no aviares en extensas áreas geográficas como Europa, el este de China y el bosque Atlántico de Brasil (Si et al., 2015; Svenning et al., 2011; Rodríguez-Da Silva et al., 2014), donde se ha encontrado que el aumento de la diversidad β está relacionado con factores como la heterogeneidad topográfica y valores relativamente altos de temperatura media anual y evapotranspiración. Nuestros datos, además, indican que este cambio en la composición de la avifauna es mayor para el conjunto de datos actuales. Esto podría ser resultado de la pérdida desigual de especies en las áreas históricamente ocupadas por los BTM y tendría importantes consecuencias para éstos, dadas las múltiples funciones ecológicas de las aves en los bosques tropicales (Sekercioglu, 2006).
Los índices de disimilitud calculados indican valores relativamente similares de recambio y anidamiento en todas las provincias biogeográficas analizadas. Para las 2 matrices analizadas, el valor del componente anidamiento representó entre 48 a 66% de la diversidad β total. La Cuenca del Balsas y la Península de Yucatán fueron las bioprovincias con menor y mayor valor proporcional de este componente en relación al cambio total. Respecto al componente recambio, éste presentó los mayores valores relativos al cambio total en la Cuenca del Balsas (datos históricos) y Tierras Bajas del Pacífico (datos actuales) y los menores en la Península de Yucatán para las 2 matrices empleadas. En general, estos resultados apoyan la importancia del anidamiento como componente de la diversidad en comunidades afectadas por las oscilaciones climáticas (Baselga et al., 2012; Dobrovolski et al., 2012), como las que se han inferido para los BTM durante Pleistoceno. Según Baselga et al. (2012), el patrón de anidamiento es esperable en taxones que han experimentado contracciones en sus áreas de distribución y que luego del cambio de las condiciones ambientales, han tenido dinámicas de expansiones poblacionales y colonización de nuevas áreas. Por otra parte, el componente recambio presentó una contribución proporcional a la diversidad β total, relativamente similar a la del anidamiento. Esto sugiere también la gran importancia de las presiones selectivas fuertes del ambiente y de los procesos de diferenciación sobre las especies en el patrón general de cambio en la composición taxonómica de los BTM (Baselga et al., 2012).
El análisis de la diversidad β de los BTM, además, permitió la clasificación de las áreas de acuerdo con su similitud. Los bosques estacionalmente secos del Pacífico se agregaron, formando un grupo único, subdividido en: áreas desde Sinaloa hasta el estado de Jalisco, la Cuenca del Balsas y áreas localizadas desde el centro-este de Jalisco hasta Guatemala. Por otra parte, los bosques húmedos y los parches de bosque estacionalmente secos de la vertiente Atlántica se concentraron en un mismo clúster. La disimilitud en la composición de especies de plantas y animales entre diferentes áreas ocupadas por bosques secos ha sido previamente documentada (Banda et al., 2016; Oswald et al., 2017; Prieto-Torres et al., 2019; Ríos-Muñoz y Navarro-Sigüenza, 2012) y se ha sugerido que se debe a una compleja historia evolutiva y eventos de diferenciación que han ocurrido de forma independiente en los parches formados por estas comunidades. Nuestro trabajo corrobora estos hallazgos y además indica que, en el caso de la comparación entre los bosques secos de México, la disimilitud no solo se debe a los procesos de divergencia evolutiva que han caracterizado la historia biogeográfica del Pacífico, sino también a un efecto de la colonización de los parches distribuidos en el Golfo de México por taxones presentes en los bosques húmedos aledaños.
Análisis de parsimonia de endemismos y regionalización biogeográfica. Los PAE permiten el descubrimiento de áreas con patrones distribucionales congruentes y, por tanto, la obtención de hipótesis de regionalización biogeográfica a través del reconocimiento de conjuntos particulares de biotas (Morrone, 2004; Morrone y Escalante, 2002). Aun cuando han recibido críticas como método en biogeografía histórica (e.g., Brooks y van Veller, 2003; Peterson, 2008), los PAE permiten tener un acercamiento a las relaciones históricas entre las áreas en ausencia de información filogenética para sus especies (Humphries y Parenti, 1999; Morrone, 2004).
La flora y fauna de los BTM ha sido estudiada con diferentes marcadores moleculares y métodos de inferencia filogenética. Al igual que sucede con la mayoría de las regionalizaciones biogeográficas realizadas, la mayor parte de los estudios filogeográficos y sistemáticos han estado enfocados en especies distribuidas en solo un tipo de bosque (e.g., bosque estacionalmente seco: Arbeláez-Cortez et al., 2014; Castillo-Chora, Sánchez-González et al., 2021; o bosque húmedo: Castillo-Chora, Zamudio-Beltrán et al., 2021; Miller et al., 2011). Los pocos trabajos que incluyen taxones de ambos tipos de bosque distribuidos en las 4 provincias neotropicales de México no incluyen completamente esas unidades biogeográficas (Llanes-Quevedo et al., 2022; Ortiz-Ramírez et al., 2020; Rocha-Moreira et al., 2020), ya sea porque las especies de interés no ocupan completamente esas áreas o por deficiencias en el muestreo. Dadas estas limitaciones, el empleo del PAE con base en los datos distribucionales de aves residentes en los BTM es útil porque ofrece un panorama más completo, aunque con una limitada resolución de las relaciones jerárquicas entre las áreas neotropicales de México.
Nuestros resultados muestran una correspondencia con la regionalización fisiográfica de México de Morrone (2019). Sin embargo, de las 4 provincias neotropicales del país en ese trabajo, solo la de la Cuenca del Balsas constituye un grupo monofilético. Las provincias Tierras Bajas del Pacífico y Veracruzana se encontraron como agrupaciones parafiléticas, conteniendo celdas correspondientes a esas provincias más las de la Cuenca del Balsas y Península de Yucatán, respectivamente. Esta última provincia biogeográfica se subdividió en 2 grupos. La mayor parte de las celdas correspondientes al centro y norte de la península formaron un grupo, que es hermano del que que contiene los hexágonos de la Planicie Costera del Golfo de México (sureste de Veracruz y Tabasco) y otros del suroeste de Campeche.
La evolución biótica de la Cuenca del Balsas ha estado marcada por el efecto aislante de las provincias fisiográficas que la delimitan (la Faja Volcánica Transmexicana al norte, la sierra Madre del Sur al sur y la sierra Norte de Oaxaca al oriente) y la continuidad con los bosques tropicales de la costa del Pacífico (Morrone, 2014). Esta provincia biogeográfica comprende amplias y disyuntas áreas de bosque tropical estacionamente seco y constituye uno de los “hotspots” más importantes para el endemismo en México (Vázquez-Reyes et al., 2018). Nuestros resultados apoyan la identidad biogeográfica de esta región recuperada a través de análisis previos de distribución de las especies endémicas y variables ambientales (Morrone, 2019), así como de otros que han hipotetizado su relación cercana con los bosques de las Tierras Bajas del Pacifico, específicamente aquellos distribuidos desde el sur de Jalisco hasta Chiapas (Arbeláez-Cortés et al., 2014; Montaño-Rendón et al., 2015; Morrone et al., 1999).
Para la bioprovincia de Tierras Bajas del Pacífico, por otra parte, ha sido documentada la diferenciación —tanto a nivel de composición de especies, como a nivel genético— en varios grupos faunísticos (Arbeláez-Cortez et al., 2014; García-Trejo y Navarro-Sigüenza, 2004; Prieto-Torres et al., 2019). En aves, García-Trejo y Navarro-Sigüenza (2004) encontraron que tanto taxones de montaña, como de tierras bajas, apoyan una separación del área comprendida desde Sonora hasta el sur de Nayarit (Euptilotis neoxenus, Campephilus imperialis, Aphelocoma wollweberi, Cyanocorax beecheii, Melanerpes uropygialis y Corvus sinaloae) del resto de las Tierras Bajas del Pacífico. La zona aledaña a la bahía de Banderas —donde la Faja Volcánica Transmexicana llega prácticamente hasta la costa en la parte sur de la bahía— podría constituir una barrera geográfica, limitando la distribución de especies como Callipepla douglasii, Ortalis wagleri, Calocitta colliei, Cyanocorax beecheii y Vireo paluster hacia el sur y Calocitta formosa, Ortalis poliocephala y Cyanocorax sanblasianus hacia el norte (García-Trejo y Navarro-Sigüenza, 2004).
Por otra parte, las bioprovincias Veracruzana y de Yucatán han sido reconocidas como unidades biogeográficas en estudios a partir de la regionalización propuesta por Rzedowski (1978) (Morrone, 2005, 2006, 2017, 2019). Sin embargo, otros trabajos basados en diversos taxones (e.g., Sceloporus: Smith, 1941; vertebrados de México y Centroamérica: Stuart, 1964; Monroy-Olguín et al., 2012) han indicado una regionalización algo diferente, reflejando la complejidad fisiográfica, historia geológica y evolución biótica de estas áreas. Los patrones de la biodiversidad de la Península de Yucatán son consecuencia de su formación geológica “reciente” (Paynter, 1955), así como de los episodios de regresiones y transgresiones marinas que han llegado a producir variaciones en su área de superficie emergida de hasta 50% (Vázquez-Domínguez y Arita, 2010). Además, los cambios climáticos durante el Pleistoceno han provocado que las condiciones xéricas en la península actuaran como barrera ecológica, aislando a las poblaciones en la región de Petén (Lavin et al., 1991; Licona-Vera et al., 2018; Ortiz-Ramírez et al., 2020). La provincia Veracruzana también ha tenido una evolución geológica heterogénea, su parte más norteña ha estado emergida desde, al menos, el Mioceno tardío (12-10 millones de años), mientras que la región al sur del macizo ígneo de Palma Sola es bastante más reciente, quedando completamente emergida durante la transición del Plioceno al Pleistoceno (Ferrari et al., 2005; Jácome Paz et al., 2022).
Las celdas correspondientes a la Planicie Costera del Golfo de México (que incluye las porciones sureñas de Veracruz, Campeche y Tabasco) formaron un grupo diferente del resto de hexágonos de las provincias Veracruzana y Península de Yucatán. Esta agrupación es consecuencia del patrón distribucional de diversos taxones de aves como Tinamus major, Crypturellus soui, C. boucardi, Harpia harpya y Patagioenas nigrirostris, entre otros. La Planicie Costera del Golfo de México (sensu Morrone, 2019) forma parte del puente centroamericano, lo que ha favorecido el establecimiento de un gran número de taxones provenientes del sur y, en menor medida, del norte (Vuilleumier, 1985). Esto determina los altos valores de riqueza de especies y el bajo número de especies endémicas. En esta área se ubica la porción norte del Istmo de Tehuantepec, accidente geográfico que constituye un corredor biológico y área de contacto entre las cuencas del Atlántico y del Pacífico (Pérez-García y Meave, 2006; Wendt, 1992), lo que podría explicar la agrupación de un pequeño número de celdas de la Provincia Veracruzana con la de las Tierras bajas del Pacífico y viceversa. Estudios genéticos enfocados en taxones como Lepidocolaptes affinis (Arbeláez-Cortés et al., 2010), Icterus pustulatus (Cortés-Rodríguez et al., 2008), Melanerpes santacruzi (Llanes-Quevedo et al., 2022) y Podocarpus matudae (Ornelas et al., 2010), no han encontrado diferenciación genética entre poblaciones separadas por el istmo, lo que sugiere que este accidente ha permitido la dispersión de individuos y el flujo de genes entre poblaciones distribuidas en las vertientes Atlántica y Pacífica de México (Arbeláez-Cortés et al., 2010; Llanes-Quevedo et al., 2022; Navarro-Sigüenza et al., 2008).
Podemos concluir que los patrones de distribución identificados y la regionalización obtenida con el PAE en este trabajo, nos permiten tener una aproximación a la complejidad de la historia evolutiva de la avifauna de los BTM. Las condiciones ambientales actuales y las variaciones pleistocénicas en el clima y la vegetación, posiblemente han repercutido de manera diferente en los bosques secos y húmedos, generando diversos escenarios que han conducido a una diferenciación desigual de la avifauna de la región. Los patrones biogeográficos que presentamos aquí, sugieren la interacción de procesos de vicarianza y dispersión, que solo pueden resolverse mediante el estudio de las filogenias moleculares que permiten desentrañar las múltiples historias evolutivas (compartidas o idiosincráticas) que han conformado los patrones de distribución de la biodiversidad.
Además, este trabajo aporta indicios relevantes de la drástica variación de los patrones de esta distribución en el corto periodo de unos cientos de años. Aun cuando las fuentes de datos empleadas presentan sesgos importantes, nuestros resultados tienen al menos 2 grandes implicaciones para los estudios de la biodiversidad en los BTM: indican áreas poco muestreadas que deben ser atendidas para registrar y proteger su biodiversidad, e indican áreas que ya no son adecuadas para las especies por cambios de uso de suelo y vegetación, y que con poca probabilidad volverán a serlo en un futuro —e.g., asentamientos humanos o tierras de cultivo. Esto último ha de ser considerado en estudios de modelado de distribución potencial y de impacto de presiones selectivas sobre genofondo de las especies (e.g., “genomic offset”; Capblancq et al., 2020), para predecir correctamente las áreas de idoneidad ambiental y genómica hacia el futuro, así como para la evaluación del estado de conservación de las especies por organismos nacionales e internacionales.
Agradecimientos
Este trabajo es parte de los requisitos para obtener el título de Doctor en Ciencias de AL-Q en el Posgrado en Ciencias Biológicas de la UNAM. Este trabajo se realizó bajo el financiamiento de la Dirección General de Asuntos del Personal Académico (IN214621) y la beca de doctorado otorgada a AL-Q por el Consejo Nacional de Ciencia y Tecnología. LES-R agradece por la beca de posdoctorado a DGAPA-UNAM. Queremos agradecer a Juan Morrone, Leopoldo Vázquez, Luis E. Eguiarte, Alicia Mastretta, Luis A. Sánchez González, Blanca Hernández, Carlos Lara y un revisor anónimo por sus valiosos comentarios a versiones previas de esta contribución. Ronal Pacheco Sánchez, Ronald Fernández y Reinhard Matadamas colaboraron con apoyo en el manejo de bases de datos, análisis estadísticos y la elaboración de las figuras.
Referencias
Arbeláez-Cortés, E., Milá, B. y Navarro-Sigüenza, A. G. (2014). Multilocus analysis of intraspecific differentiation in three endemic bird species from the northern Neotropical dry forest. Molecular Phylogenetics and Evolution, 70, 362–377. https://doi.org/10.1016/j.ympev.2013.10.006
Banda, K., Delgado-Salinas, A., Dexter, K. G., Linares-Palomino, R., Oliveira-Filho, A., Prado, D. et al. (2016). Plant diversity patterns in Neotropical dry forests and their conservation implications. Science, 353, 1383–1387. https://doi.org/10.1126/science.aaf5080
Baselga, A. (2010). Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography, 19, 134–143. https://doi.org/10.1111/j.1466-8238.2009.00490.x
Baselga, A. y Orme, C. D. L. (2012). betapart: an R package for the study of beta diversity. Methods in Ecology and Evolution, 3, 808–812. https://doi.org/10.1111/j.2041-210X.2012.00224.x
Becerra, J. X. (2005). Timing the origin and expansion of the Mexican tropical dry forest. Proceedings of the National Academy of Sciences, 102, 10919–10923. https://doi.org/10.1073/pnas.0409127102
Berlanga-García, H., Gómez de Silva, H., Vargas-Canales, V. M., Rodríguez-Contreras, V. y Sánchez-González, L. A. (2015). Aves de México: lista actualizada de especies y nombres comunes [Birds of Mexico: updated checklist of species and common names]. Mexico D.F.: Conabio.
Brooks, D. R. y Van Veller, M. G. (2003). Critique of parsimony analysis of endemicity as a method of historical biogeography. Journal of Biogeography, 30, 819–825. https://doi.org/10.1046/j.1365-2699.2003.00848.x
Brumfield, R. T. (2012). Inferring the origins of lowland Neotropical birds. The Auk, 129, 367–376. https://doi.org/10.1525/auk.2012.129.3.367
Capblancq, T., Fitzpatrick, M. C., Bay, R. A., Exposito-Alonso, M. y Keller, S. R. (2020). Genomic prediction of (mal)adaptation across current and future climatic landscapes. Annual Review of Ecology, Evolution, and Systematics, 51, 245–269. https://doi.org/10.1146/annurev-ecolsys-020720-042553
Castillo-Chora, V. D. J., Sánchez-González, L. A., Mastretta-Yanes, A., Prieto-Torres, D. A. y Navarro-Sigüenza, A. G. (2021). Insights into the importance of areas of climatic stability in the evolution and maintenance of avian diversity in the Mesoamerican dry forests. Biological Journal of the Linnean Society, 132, 741–758. https://doi.org/10.1093/biolinnean/blaa202
Castillo-Chora, V. D. J., Zamudio-Beltrán, L. E., Pozo, C. y Hernández-Baños, B. E. (2021). Phylogeography of Habia fuscicauda (Cardinalidae) indicates population isolation, genetic divergence and demographic changes during the Quaternary climate shifts in the Mesoamerican rainforest. Journal of Ornithology, 162, 961–976. https://doi.org/10.1007/s10336-021-01904-x
Ceballos, G. y Oliva, G. (coords.) (2005). Los mamíferos silvestres de México. México D.F.: Conabio/ Fondo de Cultura Económica.
Ceballos, G. y Valenzuela, D. (2010). Diversidad, ecología y conservación de los vertebrados de Latinoamérica. En G. Ceballos, Lourdes Martínez, A. García, E. Espinoza, J. Bezaury y R. Dirzo (Eds.), Diversidad, amenazas y áreas prioritarias para la conservación de las selvas secas del Pacífico de México (pp. 93–118). México D.F.: FCE/ Conabio/ Conanp/ Alianza WWF-Telcel/ Ecociencia, S.C./ Telmex.
Chesser, R. T., Billerman, S. M., Burns, K. J., Cicero, C., Dunn, J. L., Hernández-Baños, B. E. et al. (2022). Sixty-third supplement to the American Ornithological Society’s Check-list of North American Birds. Ornithology, 139, ukac020.
Cortés-Ramírez, G., Gordillo-Martínez, A. y Navarro-Sigüenza, A. G. (2012). Patrones biogeográficos de las aves de la península de Yucatán. Revista Mexicana de Biodiversidad, 83, 530–542. https://doi.org/10.22201/ib.20078706e.2012.2.963
Cortés-Rodríguez, N., Hernández-Baños, B. E., Navarro-Sigüenza, A. G. y Omland, K. E. (2008). Geographic variation and genetic structure in the Streak-backed Oriole: low mitochondrial differentiation reveals recent divergence. Condor, 110, 729–739. https://doi.org/10.1525/cond.2008.8578
Cuervo-Robayo, A. P., Ureta, C., Gómez-Albores, M. A., Meneses-Mosquera, A. K., Téllez-Valdés, O. y Martínez-Meyer, E. (2020). One hundred years of climate change in Mexico. Plos One, 15, e0209808. https://doi.org/10.1371/journal.pone.0209808
Dinerstein, E., Olson, D. M., Graham, D. J., Webster, A. L., Primm, S. A., Bookbinder, M. P. et al. (1995). Una evaluación del estado de conservación de las eco-regiones terrestres de América Latina y el Caribe. Washington D.C.: Banco Mundial.
Duellman, W. E. (1982). Quaternary climatic-ecological fluctuations in the lowland tropics: Frogs and forests. En G. T. Prance (Ed.), Biological diversification in the Tropics (pp. 389–402). New York: Columbia University Press.
Escalante, P., Navarro, A. G. y Peterson, A. T. (1993). A geographic, historical and ecological analysis of land bird diversity in Mexico. Pp 281–307, En T. P. Ramamoorthy, R. Bye, A. Lot y J. Fa (Eds.), Biological diversity in Mexico, origins and distribution. New York: Oxford University Press.
Escalante, T., Varela-Anaya, A. M., Noguera-Urbano, E. A., Elguea-Manrique, L. M., Ochoa-Ochoa, L. M., Gutiérrez-Velázquez, A. L. et al. (2020). Evaluation of five taxa as surrogates for conservation prioritization in the Transmexican Volcanic Belt, Mexico. Journal for Nature Conservation, 54, 125800. https://doi.org/10.1016/j.jnc.2020.125800
Escobar-Luján, J., Castaño-Quintero, S. M., Villalobos, F., Lira-Noriega, A., Chiappa-Carrara, X. et al. (2022). Current and future geographic patterns of bird diversity dimensions of the Yucatán Peninsula and their representativeness in natural protected areas. Neotropical Biodiversity, 8, 242–252. https://doi.org/10.1080/23766808.2022.2087282
FAO (2015). Global Forest Resources Assessment 2015. FAO, Roma.
Ferrari, L., Tagami, T., Eguchi, M., Orozco-Esquivel, M. T., Petrone, C. M., Jacobo-Albarrán, J. et al. (2005). Geology, geochronology and tectonic setting of late Cenozoic volcanism along the southwestern Gulf of Mexico: the eastern Alkaline Province revisited. Journal of Volcanology and Geothermal Research, 146, 284–306. https://doi.org/10.1016/j.jvolgeores.2005.02.004
Flores-Villela, O. (1993) Herpetofauna of Mexico: distribution and endemism. En T. P. Ramamoorthy, R. Bye, A. Lot y J. Fa (Eds.), Biological diversity of Mexico: origins and distribu-
tions (pp. 253-280). Nueva York: Oxford University Press.
García-Oliva, F. y Jaramillo, V. J. (2011). Impact of anthropogenic transformation of seasonally dry tropical forests on ecosystem biogeochemical processes. En R. Dirzo, H. S. Young, H. A. Mooney y G. Ceballos (Eds.), Seasonally dry tropical forests: ecology and conservation (pp. 159–172). Washington D.C.: Springer.
García-Trejo, E. A. y Navarro, A. G. (2004). Patrones biogeográficos de la riqueza de especies y el endemismo de la avifauna en el oeste de México. Acta Zoológica Mexicana, 20, 167–185. https://doi.org/10.21829/azm.2004.2022336
Goloboff, P. A. (1999). Analyzing large data sets in reasonable times: solutions for composite optima. Cladistics, 15, 415–428. https://doi.org/10.1006/clad.1999.0122
González, J. A. (1999). Algunas cuestiones sobre el ambiente, la población y la economía en Veracruz central: un ensayo etnohistórico. En J. A. González y R. S. del Amo (Eds.), Agricultura y sociedad en México: diversidad, enfoques, estudios de caso (pp. 157–333) México D.F.: Universidad Iberoamericana.
González-García, F. y Gómez de Silva, H. (2003). Especies endémicas: riqueza, patrones de distribución y retos para su conservación. En H. Gómez de Silva y A. Oliveras de Ita (Eds.), Conservación de aves: experiencias en México (pp. 150–194). México D.F.: Cipamex/ National Fish and Wildlife Foundation/ Conabio.
Haffer, J. (1987). Biogeography of Neotropical birds. En T. C. Whitmore y G. T. Prance (Eds.), Biogeography and Quaternary history in Tropical America (pp. 105–150). Oxford: Clarendon Press.
Hernández-Canchola, G. y León-Paniagua, L. (2017). Genetic and ecological processes promoting early diversification in the lowland Mesoamerican bat Sturnira parvidens (Chiroptera: Phyllostomidae). Molecular Phylogenetics and Evolution, 114, 334–345. https://doi.org/10.1016/j.ympev.2017.06.015
Humphries, C. J. y Parenti, L. R. (1986). Cladistic biogeography. Oxford monographs on biogeography, No. 2. Oxford: Clarendon Press.
IUCN (International Union for Conservation of Nature). (2023). The IUCN Red List of Threatened Species. Version 2022–2. Accessed on 01 February 2023. https://www.iucnredlist.org
Jácome-Paz, M. P., Torres-Orozco, R., Espinasa-Pereña, R., de la Fuente-Rivera, J. R., Sánchez, J. O. R. y Delgado-Granados, H. (2022). Review of geology and geomorphology of the Xalapa Monogenetic Volcanic Field, eastern Trans-Mexican Volcanic Belt. Journal of Volcanology and Geothermal Research, 432, 107689. https://doi.org/10.1016/j.jvolgeores.2022.107689
Koleff, P., Gaston, K. J. y Lennon, J. J. (2003). Measuring beta diversity for presence–absence data. Journal of Animal Ecology, 72, 367–382. https://doi.org/10.1046/j.1365-2656.2003.00710.x
Koleff, P., Soberón, J., Arita, H., Dávila, P., Flores-Villela, O., Halffter, G. et al. (2008). Patrones de diversidad espacial en grupos selectos de especies. En Capital natural de México (pp. 323–364). México D.F.: Conabio.
Lavin, M., Mathews, S. y Hughes, C. (1991). Chloroplast DNA variation in Gliricidia sepium (Leguminosae): intraspecific phylogeny and tokogeny. American Journal of Botany, 78, 1576–1585. https://doi.org/10.1002/j.1537-2197.1991.tb11437.x
Licona-Vera, Y., Ortiz-Rodríguez, A. E., Vásquez-Aguilar, A. A. y Ornelas, J. F. (2018). Lay mistletoes on the Yucatán Peninsula: post-glacial expansion and genetic differentiation of Psittacanthus mayanus (Loranthaceae). Botanical Journal of the Linnean Society, 186, 334–360. https://doi.org/10.1093/botlinnean/box098
Llanes-Quevedo, A., Mastretta-Yanes, A., Sánchez-González, L. A., Castillo-Chora, V. J. y Navarro-Sigüenza, A. G. (2022). The tangled evolutionary history of a long-debated Mesoamerican taxon: The Velazquez Woodpecker (Melanerpes santacruzi, Aves: Picidae). Molecular Phylogenetics and Evolution, 170, 107445. https://doi.org/10.1016/j.ympev.2022.107445
Metcalfe, S. E., O’Hara, S. L., Caballero, M. y Davies, S. J. (2000). Records of Late Pleistocene–Holocene climatic change in Mexico —a review. Quaternary Science Reviews, 19, 699–721. https://doi.org/10.1016/S0277-3791(99)00022-0
Miller, M. J., Lelevier, M. J., Bermingham, E., Klicka, J. T., Escalante, P. y Winker, K. (2011). Phylogeography of the Rufous-tailed Hummingbird (Amazilia tzacatl). The Condor, 113, 806–816. https://doi.org/10.1525/cond.2011.100226
Montaño-Rendón, M., Sánchez-González, L. A., Hernández-Alonso, G. y Navarro-Sigüenza, A. G. (2015). Genetic differentiation in the Mexican endemic Rufous-backed Robin, Turdus rufopalliatus (Passeriformes: Turdidae). Zootaxa, 4034, 495–514. https://doi.org/10.11646/zootaxa.4034.3.4
Morrone, J. J. (1994). On the identification of areas of endemism. Systematic Biology, 43, 438–441. https://doi.org/10.2307/2413679
Morrone, J. J. (2004). Homología biogeográfica: las coordenadas espaciales de la vida, Vol. 37. México D.F.: UNAM.
Morrone, J. J. (2005). Hacia una síntesis biogeográfica de México. Revista Mexicana de Biodiversidad, 76, 207–252. https://doi.org/10.22201/ib.20078706e.2005.002.303
Morrone, J. J. (2006). Biogeographic areas and transition zones of Latin America and the Caribbean islands based on panbiogeographic and cladistic analyses of the entomofauna. Annual Review of Entomology, 51, 467–494. https://doi.org/10.1146/annurev.ento.50.071803.130447
Morrone, J. J. (2014). Biogeographical regionalization of the Neotropical region. Zootaxa, 3782, 1–110. https://doi.org/10.11646/zootaxa.3782.1.1
Morrone, J. J. (2019). Regionalización biogeográfica y evolución biótica de México: encrucijada de la biodiversidad del Nuevo Mundo. Revista Mexicana de Biodiversidad, 90, e902980. https://doi.org/10.22201/ib.20078706e.2019.90.2980
Morrone, J. J. y Escalante, T. (2002). Parsimony analysis of endemicity (PAE) of Mexican terrestrial mammals at different area units: when size matters. Journal of Biogeography, 29, 1095–1104. https://doi.org/10.1046/j.1365-2699.2002.00753.x
Morrone, J. J., Escalante, T. y Rodríguez-Tapia, G. (2017). Mexican biogeographic provinces: map and shapefiles. Zootaxa, 4277, 277–279. https://doi.org/10.11646/zootaxa.
4277.2.8
Morrone, J. J., Espinosa-Organista, D., Aguilar-Zúñiga, C. y Llorente-Bousquets, J. (1999). Preliminary classification of the Mexican biogeographic provinces: A parsimony analysis of endemicity based on plant, insect, and bird taxa. Southwestern Naturalist, 44, 508–515. https://doi.org/10.2307/367235
Mouillot, D., De Bortoli, J., Leprieur, F., Parravicini, V., Kulbicki, M. y Bellwood, D. R. (2013). The challenge of delineating biogeographical regions: nestedness matters for Indo-Pacific coral reef fishes. Journal of Biogeography, 40, 2228–2237. https://doi.org/10.1111/jbi.12194
Mulcahy, D. G. y Mendelson III, J. R. (2000). Phylogeography and speciation of the morphologically variable, widespread species Bufo valliceps, based on molecular evidence from mtDNA. Molecular Phylogenetics and Evolution, 17, 173–189. https://doi.org/10.1006/mpev.2000.0827
Murtagh, F. y Legendre, P. (2014). Ward’s Hierarchical Agglomerative Clustering Method: which algorithms implement ward’s criterion? Journal of Classification, 31, 274–295. https://doi.org/10.1007/s00357-014-9161-z
Navarro-Sigüenza, A. G., Gordillo-Martínez, A. y Peterson, A. T. (2009). Mapeando la diversidad de las aves de México. TIP Revista Especializada en Ciencias Químico-Biológicas, 12, 91–95.
Navarro-Sigüenza, A. G., Lira-Noriega, A., Arizmendi., M. C., Berlanga, H., Koleff, P., García-Moreno, J. et al. (2011). Áreas de conservación para las aves de México: integrando criterios de priorización. En Conabio-Conanp (Coords.), Planeación para la conservación de la biodiversidad terrestre en México: retos en un país megadiverso (pp. 108–129). México D.F.: Conabio-Conanp.
Navarro-Sigüenza, A. y Peterson, A. T. (2007). Mapas de las aves de México basados en WWW. Final report SNIB-Conabio project CE015. Bases de datos-Conabio, proyectos E018 y A002. SNIB-Conanp/ Facultad de Ciencias, Universidad Nacional Autónoma de México.
Navarro-Sigüenza, A. G., Peterson, A. T., Nyari, A., García-Deras, G. M. y García-Moreno, J. (2008). Phylogeography of the Buarremon brush-finch complex (Aves, Emberizidae) in Mesoamerica. Molecular Phylogenetics and Evolution, 47, 21–35. https://doi.org/10.1016/j.ympev.2007.11.030
Navarro-Sigüenza, A. G., Rebón-Gallardo, M., Gordillo-Martínez, A., Townsend, P. A., Berlanga-García, H. y Sánchez-González, L. A. (2014). Biodiversidad de aves en México. Revista Mexicana de Biodiversidad, 85, S476–S495. https://doi.org/10.7550/rmb.41882
Navarro-Sigüenza, A. G., Vázquez-Miranda, H., Hernández-Alonso, G., García-Trejo, E. A. y Sánchez-González, L. A. (2017). Complex biogeographic scenarios revealed in the diversification of the largest woodpecker radiation in the New World. Molecular Phylogenetics and Evolution, 112, 53–67. https://doi.org/10.1016/j.ympev.2017.04.013
Nixon, K. C. (1999). The parsimony ratchet, a new method for rapid parsimony analysis. Cladistics, 15, 407–414. https://doi.org/10.1006/clad.1999.0121
Nixon, K. C. (2002). WinClada, version 1.00. 08. Published by the author, Ithaca, NY.
Ochoa-Ochoa, L. M. y Flores-Villela, O. (2006). Áreas de diversidad y endemismo de la herpetofauna mexicana. México D.F.: UNAM/ Conabio.
Olguín-Monroy, H. C., Gutiérrez-Blando, C., Ríos-Muñoz, C. A., León-Paniagua, L. y Navarro-Sigüenza, A. G. (2013). Regionalización biogeográfica de la mastofauna de los bosques tropicales perennifolios de Mesoamérica. Revista de Biología Tropical, 61, 937–969.
Ornelas, J. F., Ruiz-Sánchez, E. y Sosa, V. (2010) Phylogeography of Podocarpus matudae (Podocarpaceae): pre-Quaternary relicts in northern Mesoamerican cloud forests. Journal of Biogeography, 37, 2384–2396. https://doi.org/10.1111/j.1365-2699.2010.02372.x
Ortiz-Rodríguez, A. E., Licona-Vera, Y., Vásquez-Aguilar, A. A., Hernández-Soto, M., López-Huicochea, E. A. y Ornelas, J. F. (2020). Genetic differentiation among Psittacanthus rhynchanthus (Loranthaceae) populations: Novel phylogeographic patterns in the Mesoamerican tropical lowlands. Plant Systematics and Evolution, 306, 1–20. https://doi.org/10.1007/s00606-020-01638-y
Oswald, J. A., Overcast, I., Mauck III, W. M., Andersen, M. J. y Smith, B. T. (2017). Isolation with asymmetric gene flow during the nonsynchronous divergence of dry forest birds. Molecular Ecology, 26, 1386–1400. https://doi.org/10.1111/mec.14013
Paynter, Jr. R. A. (1955). The ornithogeography of the Yucatán Peninsula. Peabody Museum of Natural History Bulletin, 9, 1–347.
Pérez-García, E. A. y Meave, J. A. (2006) Coexistence and divergence of tropical dry forests and savannas in southern México. Journal of Biogeography, 33, 438–447. https://doi.org/10.1111/j.1365-2699.2005.01459.x
Peterson, A. T. (2008). Parsimony analysis of endemism (PAE) and studies of Mexican biogeography. Revista Mexicana de Biodiversidad, 79, 541–542. https://doi.org/10.22201/ib.20078706e.2008.002.544
Peterson, A. T. y Navarro-Sigüenza, A. G. (2016). Bird conservation and biodiversity research in Mexico: status and priorities. Journal of Field Ornithology, 87, 121–132. https://doi.org/10.1111/jofo.12146
Peterson, A. T., Navarro-Sigüenza, A. G. y Gordillo-Martínez, A. (2016). The development of ornithology in Mexico and the importance of access to scientific information. Archives of Natural History, 43, 294–304.
Prance, G. T. (1982). A review of the phytogeographic evidences for Pleistocene climate changes in the Neotropics. Annals of the Missouri Botanical Garden, 9, 594–624.
Prieto-Torres, D. A., Lira-Noriega, A., & Navarro-Sigüenza, A. G. (2020). Climate change promotes species loss and uneven modification of richness patterns in the avifauna associated to Neotropical seasonally dry forests. Perspectives in Ecology and Conservation, 18, 19–30. https://doi.org/10.1016/j.pecon.2020.01.002
Prieto-Torres, D. A., Rojas-Soto, O. R., Bonaccorso, E., Santiago-Alarcon, D. y Navarro-Sigüenza, A. G. (2019). Distributional patterns of Neotropical seasonally dry forest birds: a biogeographical regionalization. Cladistics, 35, 446–460. https://doi.org/10.1111/cla.12366
Prieto-Torres, D. A., Rojas-Soto, O. R., Santiago-Alarcon, D., Bonaccorso, E. y Navarro-Sigüenza, A. G. (2019). Diversity, endemism, species turnover and relationships among avifauna of Neotropical seasonally dry forests. Ardeola, 66, 257–277. https://doi.org/10.13157/arla.66.2.2019.ra1
Prum, R. O., Berv, J. S., Dornburg, A., Field, D. J., Townsend, J. P., Lemmon, E. M. et al. (2015). A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing. Nature, 526, 569–573. https://doi.org/10.1038/nature15697
QGIS.org (2022). QGIS 3.18 Geographic Information System. QGIS Association. http://www.qgis.org
Ramamoorthy, T. P., Bye, R., Lot, A. y Fa, J. (Eds.). (1993). Biological diversity in Mexico, origins and distribution. New York: Oxford Univ. Press
Ramírez-Albores, J. E., Prieto-Torres, D. A., Gordillo-Martínez, A., Sánchez-Ramos, L. E. y Navarro-Sigüenza, A. G. (2021). Insights for protection of high species richness areas for the conservation of Mesoamerican endemic birds. Diversity and Distributions, 27, 18–33. https://doi.org/10.1111/ddi.13153
Remsen, J. V., Stotz, D. F. y Winker, K. (2022). Check-list of North American Birds (online). American Ornithological Society. Disponible en: https://checklist.americanornithology.org/taxa/
Ríos-Muñoz, C. A. y Navarro-Sigüenza, A. G. (2012). Patterns of species richness and biogeographic regionalization of the avifaunas of the seasonally dry tropical forest in Mesoamerica. Studies on Neotropical Fauna and Environment, 47, 171–182. https://doi.org/10.1080/01650521.2012.734175
Rocha-Moreira, L., Hernandez-Baños, B. E. y Smith, B. T. (2020). Spatial predictors of genomic and phenotypic variation differ in a lowland Middle American bird (Icterus gularis). Molecular Ecology, 29, 3084–3101. https://doi.org/10.1111/mec.15536
Rosen, B. R. y Smith, A. B. (1988). Tectonics from fossils? Analysis of reef-coral and sea-urchin distributions from late Cretaceous to Recent, using a new method. Geological Society, London, Special Publications, 37, 275–306. https://doi.org/10.1144/GSL.SP.1988.037.01.19
Rzedowski, J. (1978). Vegetación de México. Ciudad de México: Limusa
Sánchez-Ramos, L. E., Gordillo-Martínez, A., Gutiérrez-Arellano, C. R., Kobelkowsky-Vidrio, T., Ríos-Muñoz, C. A. y Navarro-Sigüenza, A. G. (2018). Bird diversity patterns in the nuclear Central American highlands: A conservation priority in the northern Neotropics. Tropical Conservation Science, 11, 1940082918819073. https://doi.org/10.1177/194008291881907
Sekercioglu, C. H. (2006). Increasing awareness of avian ecological function. Trends in Ecology and Evolution, 21, 464–471. https://doi.org/10.1016/j.tree.2006.05.007
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2010). Norma Oficial Mexicana Nom-059-semarnat-2010, Protección Ambiental-Especies Nativas de México de Flora y Fauna Silvestres-Categorías de Riesgo y Especificaciones para su Inclusión, Exclusión o Cambio-Lista de Especies en Riesgo. Diario Oficial de la Federación, Segunda Sección. Secretaría del Medio Ambiente y Recursos Naturales. México.
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2023). Informe del Medio Ambiente, Ecosistemas Terrestres 2. Disponible en: https://apps1.semarnat.gob.mx:8443/dgeia/informe18/tema/cap2.html
Smith, H. M. (1941). Las provincias bióticas de México, según la distribución geográfica de las lagartijas del género Sceloporus. Anales de la Escuela Nacional de Ciencias Biológicas, 2, 103–110.
Steadman, D. W., Oswald, J. A. y Rincόn, A. D. (2015). The diversity and biogeography of late Pleistocene birds from the lowland Neotropics. Quaternary Research, 83, 555–564. https://doi.org/10.1016/j.yqres.2015.02.001
Stotz, D. F., Fitzpatrick, J. W., Parker III, T. A. y Moskovits, D. K. (1996). Neotropical birds: ecology and conservation. University of Chicago Press.
Stuart, L. C. (1964). Fauna of Middle America. En R. C. West (Eds.), Handbook of Middle American Indians, Vol. 1 (pp. 316–363). Austin: University of Texas Press.
Toledo, V. M. (1982). Pleistocene changes of vegetation in tropical Mexico. En Biological diversification in the tropics. Proceedings, fifth International Symposium of the Association for Tropical Biology, held at Macuto Beach, Caracas, Venezuela, February 8–13, 1979. Edited by GT Prance. New York: Columbia University Press, 1982.
Trejo, I. y Dirzo, R. (2002). Floristic diversity of Mexican seasonally dry tropical forests. Biodiversity and Conservation, 11, 2063–2084.
Vázquez-Domínguez, E. y Arita, H. T. (2010). The Yucatán Peninsula: biogeographical history 65 million years in the making. Ecography, 33, 212–219.
Vázquez-Reyes, L. D., Jiménez-Arcos, V. H., SantaCruz-Padilla, S. A., García-Aguilera, R., Aguirre-Romero, A., Arizmendi, M. D. C. et al. (2018). Aves del Alto Balsas de Guerrero: diversidad e identidad ecológica de una región prioritaria para la conservación. Revista Mexicana de Biodiversidad, 89, 873–897. https://doi.org/10.22201/ib.20078706e.2018.3.2314
Velázquez, A., Mas J. F., Bocco G. y Palacio-Prieto J. L. (2010). Mapping land cover changes in Mexico, 1976–2000 and applications for guiding environmental management policy. Singapore Journal of Tropical Geography, 31, 152–162. https://doi.org/10.1111/j.1467-9493.2010.00398.x
Villaseñor, J. L. y Ortiz, E. (2014). Biodiversidad de las plantas con flores (División Magnoliophyta) en México. Revista Mexicana de Biodiversidad, 85, S134–S142. https://doi.org/10.7550/rmb.31987
Vuilleumier, F. (1985). Fossil and recent avifaunas and the interamerican interchange. En F. G. Stehli y S. D. Webb (Eds.), The great American biotic interchange. Topics in Geobiology (pp. 387-424). Boston: Springer.
Wendt, T. (1998) Composición, afinidades florísticas y orígenes de la flora arbórea el dosel de los bosques tropicales húmedos de la vertiente mexicana del Atlántico. En T. P. Ramamoorthy, R. Bye, A. Lot y J. Fa (Compiladores). Diversidad biológica de México: orígenes y distribución. (pp. 581–664). México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Whittaker, R. H. (1972). Evolution and measurement of species diversity. Taxon, 21, 213–251. https://doi.org/10.2307/1218190