Peces nativos y pesca artesanal en la cuenca Usumacinta, Guatemala
Christian Barrientos a, *, Yasmín Quintana a, Diego J. Elías a, b y Rocío Rodiles-Hernández c
a Centro de Estudios Conservacionistas, Universidad de San Carlos de Guatemala, Avenida La Reforma 0-63, Zona 10 Guatemala, Guatemala
b LSU Museum of Natural Science (Ichthyology), Department of Biological Sciences, Louisiana State University, Baton Rouge, LA 70803 EUA
c Colección de Peces, Departamento de Conservación de la Biodiversidad, El Colegio de la Frontera Sur, Carretera Panamericana y Periférico Sur s/n, 29290 San Cristóbal de Las Casas, Chiapas, México
*Autor para correspondencia: cbarrientos@wcs.org (C. Barrientos)
Resumen
La ictiofauna nativa de la cuenca del río Usumacinta se documentó en el noroeste de Guatemala para conocer la composición de los peces nativos en 20 sitios y su importancia en la pesca artesanal. El estudio incluyó recolecta de las especies con diversas artes de pesca, evaluación de abundancia de las especies mediante muestreos en transectos e identificación de las mismas en los mercados de venta, y en entrevistas con pescadores. Se identificó un total de 54 especies, 38 géneros, 18 familias y 8 órdenes. Las familias más abundantes fueron Characidae (3 especies), Poeciliidae (12 especies) y Cichlidae (22 especies), y en términos de riqueza el 68% de las especies corresponden a las familias Cichlidae y Poeciliidae. Al menos 38 especies nativas y 7 exóticas fueron identificadas en la pesca artesanal, de las cuales Centropomus undecimalis., Megalops atlanticus y Atractosteus tropicus son de alto valor comercial. Entre las 7 especies exóticas identificadas solo las especies del género Pterygoplichthys no son parte de la pesca artesanal. Los peces del área se dividen en 2 grandes grupos, uno en las zonas bajas de Petén y otro en las zonas altas de Las Verapaces y la pesca artesanal varía de acuerdo con este patrón. Según el estudio, a pesar de las especies exóticas, la pesca en la cuenca del Usumacinta está basada principalmente en especies nativas. Se requieren medidas de control del pez diablo exótico Pterygoplichthys spp. para evitar la propagación de sus poblaciones y mitigar los efectos negativos en la comunidad íctica nativa.
Palabras clave:
Cichlidae; Poeciliidae; Norte Centroamérica; Peces exóticos; Ictiofauna
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Native fish fauna and artisanal fisheries in the Usumacinta basin, Guatemala
Abstract
The native fish fauna was characterized in 20 sites along three drainage areas of the Usumacinta river basin in northwestern Guatemala to understand the native fish fauna contribution and its importance to artisanal fisheries. We collected fish using different fishing gears, and we assessed the relevance of fish species to the artisanal fishery through surveys based on aquatic transects, interviews with fishermen and fish markets sellers. A total of 54 species, 38 genera, 18 families, and eight orders were identified. The most abundant families were Characidae, Cichlidae, and Poeciliidae. In terms of richness, 68% of the species corresponded to Cichlidae and Poeciliidae. At least 38 native and 7 non-native species were identified as part of the artisanal fishery, with Centropomus undecimalis., M. atlanticus, and A. tropicus having high commercial value. Seven non-native species were identified, all of them part of the artisanal fishery except for species in the genus Pterygoplichthys. Two main groups were identified: the lowlands of Petén and the other in the highlands of Verapaces, accordingly the artisanal fishery in those 2 zones. Analysis suggests that regardless of the presence of non-native species, the artisanal fishery in the Usumacinta basin continues to rely on native species. This study underscores the importance of native species to local artisanal fisheries, and the need for strategies to conserve and manage the basin and control introduced Pterygoplichthys spp. genus to prevent the spread of the population and the negative effects on the native fish community.
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Cichlidae; Poeciliidae; Northern CentralAmerica; Non-native fish; Ichthyofauna
Introducción
Los recursos pesqueros se encuentran amenazados a nivel mundial (Hilborn et al., 2003; Pauly et al., 2002). Entre las amenazas principales están la contaminación, destrucción de ecosistemas, el cambio climático, introducción de especies exóticas y pesca excesiva (Hilborn et al., 2003). A pesar de éstas, la pesca continúa creciendo y muchos recursos pesqueros son subestimados o no son incluidos en las estadísticas globales. Tal es el caso de la pesca de aguas continentales, en especial las de agua dulce, donde la sobrepesca (Allan et al., 2005; Pauly y Zeller, 2016) y su efecto en términos de biodiversidad (Ricciardi y Rasmussen, 1999) pasan desapercibidos.
Las pesquerías artesanales son sistemas complejos, difíciles de evaluar y monitorear, implicando que los “stocks” o efectivos de especies nativas en estos sistemas son vulnerables a la sobrepesca local (Orenzans et al., 2005). La pesca artesanal ha sido poco estudiada en aguas continentales de zonas tropicales a pesar de que en Latinoamérica es comúnmente practicada (Inda-Díaz et al., 2009; Welcome et al., 2001).
Guatemala es uno de los países en vías de desarrollo con diversos ecosistemas de agua dulce donde la actividad pesquera artesanal está basada en especies nativas dulceacuícolas. Esta pesca representa un alto valor económico y social para las comunidades en zonas rurales locales. Hace 30 años se estimaba que en los grandes lagos como el lago Izabal, lago de Atitlán y lago Petén Itzá se producía una pesca de 1,000 TM/año (Matthes, 1986), y recientemente se estimó que en Río Dulce la pesquería puede producir hasta 70 TM/año (Quintana y Barrientos, 2011). Este valor ha sido poco reconocido, y existe poca información detallada en la cual se caracteriza la pesca artesanal y las especies de importancia económica en los ríos y lagos del país (Barrientos, 2016; Dickinson, 1974; Quintana, 2015; Quintana y Barrientos, 2011). La pesca documentada está enfocada en especies marinas y en la producción acuícola (FAO, 2014), y los esfuerzos de gobierno para fomentar la pesca artesanal se han enfocado en la liberación de especies exóticas (e.g., tilapia) (Kihn et al., 2006). La práctica intensiva de la pesca artesanal en Guatemala, se ha visto reflejada en niveles históricos donde la pesca ha disminuido e incluso colapsado a nivel local (Dickinson, 1974).
La cuenca del río Usumacinta se ubica dentro del área de endemismo (AE) Grijalva-Usumacinta, en el norte de Centroamérica y el sur de México y posee la mayor riqueza de especies endémicas de peces en la región (Matamoros et al., 2015). El 58% de extensión de la cuenca se encuentra en el norte de Guatemala y el 42% en el sur de México (March y Fernández, 2003). El norte de Guatemala ha sido considerado por muchos investigadores como un área con poca alteración de sus sistemas acuáticos (Barrientos et al., 2015; Granados-Dieseldorff et al., 2012; Valdez-Moreno et al., 2005). Sin embargo, los pocos esfuerzos de conservación y las políticas de desarrollo han incentivado el crecimiento demográfico en la cuenca (Schwartz, 1990), que a su vez ha favorecido prácticas de aprovechamiento insostenibles y deterioro ambiental. Las amenazas latentes en la cuenca son el cambio uso de suelo para ganado y monocultivos extensivos, la contaminación de ecosistemas acuáticos, e invasión por especies exóticas, como ejemplos bagres armados, tilapias y carpas (Kihn et al., 2006).
La importancia de la ictiofauna nativa de la cuenca destaca por su biodiversidad regional, su contribución a la pesca artesanal y la vulnerabilidad de la cuenca del río Usumacinta. En este contexto, la hipótesis del estudio es que la pesca artesanal actual de la cuenca del Usumacinta no depende de especies exóticas. Por tanto, los objetivos de este trabajo son documentar la composición pesquera a nivel artesanal en la parte alta de la cuenca, así como identificar los artes de pesca más usados para este fin en las distintas localidades. Esta información permitirá reconocer la importancia de la ictiofauna en la parte alta de la cuenca del Usumacinta, identificar cuáles son las principales especies de importancia pesquera a través de la cuenca y los sitios prioritarios para la conservación de la ictiofauna nativa.
Materiales y métodos
La cuenca del río Usumacinta es parte de la vertiente del golfo de México y conforma el río más largo y caudaloso de Centroamérica (Suárez, 2011). El Usumacinta nace en las planicies del norte de Guatemala y ocupa 45,000 km2 del territorio del país (MARN, 2011), donde aproximadamente el 40% de la cuenca se encuentra incluido en el Sistema Guatemalteco de Áreas Protegidas (Conap, 2015). Esta zona cuenta con una precipitación media anual de 1,500 mm (INSIVUMEH, 2015). En la cuenca del río Usumacinta se estima una población humana de 13.5 millones (Inegi, 2015), la cual está principalmente establecida en la parte alta de la cuenca (March y Fernández, 2003).
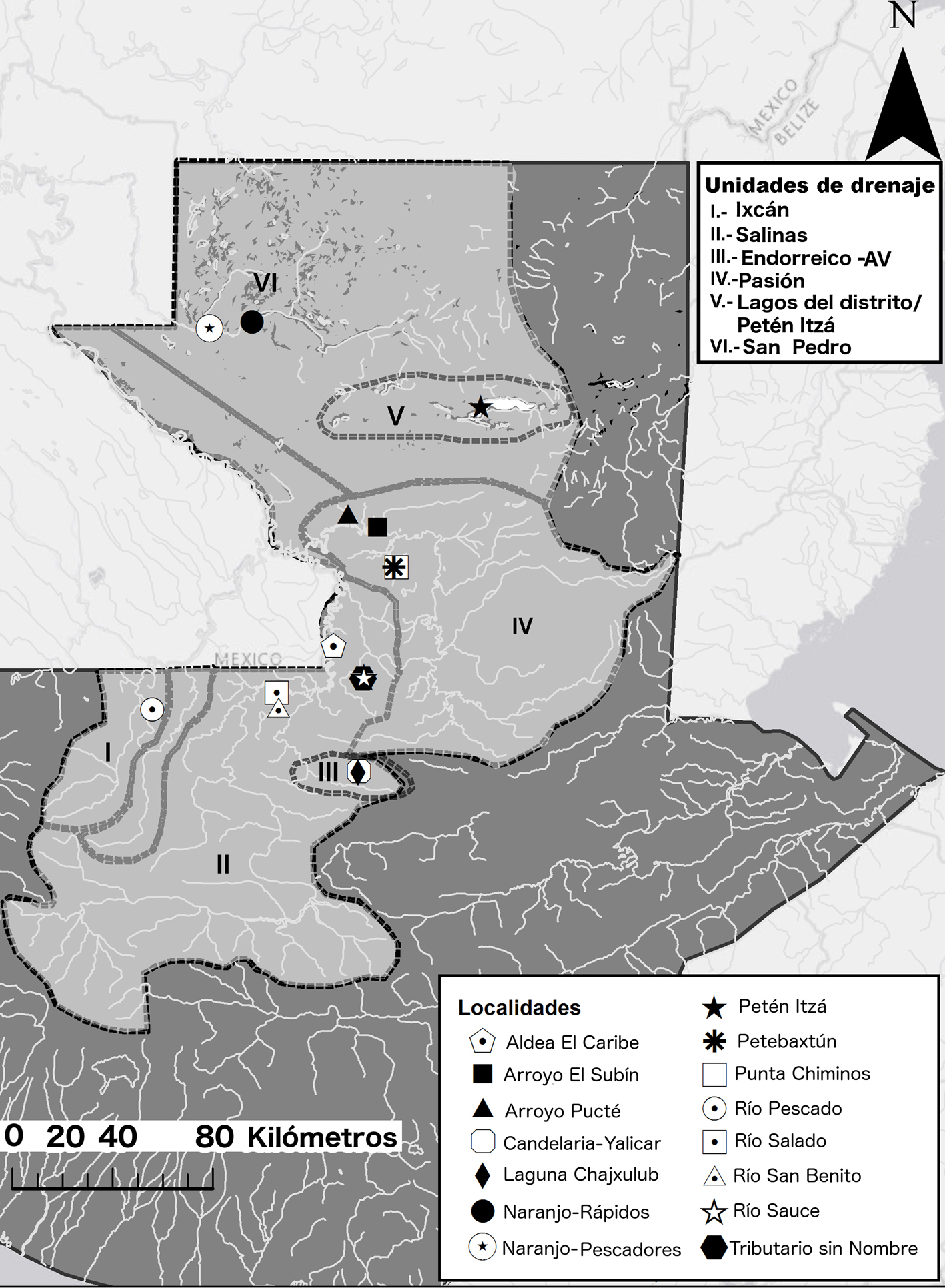
En la cuenca del río Usumacinta han sido reportadas 118 especies de peces (Miller, 1988) y en la parte alta de la cuenca, en la región de Las Verapaces y El Petén han sido registradas 88 especies que incluyen a especies tanto dulceacuícolas como catádromas (Granados-Dieseldorff et al., 2012; McBride y Matheson, 2011; Valdez-Moreno et al., 2005), de las cuales algunas son de alta importancia en las pesquerías artesanales de la cuenca (Hernández-Vidal et al., 2014; Perera-García et al., 2008, 2011). En este estudio se realizaron recolectas de peces en 3 diferentes subcuencas de la parte alta del río Usumacinta: San Pedro, La Pasión y Salinas, también conocido como río Chixoy o río Negro (MARN, 2009) (fig. 1).
En total se muestrearon 20 localidades (fig. 1) en ambientes lóticos y lénticos y sistemas endorreicos ubicados en los departamentos Quiché, Alta Verapaz y Petén. De éstas 20, solamente en 5 (río Tzetoc, La Pasión, Centro de Acopio Sayaxche, El Naranjo y Mercado Santa Elena) se realizaron encuestas a pescadores (tabla 1). La selección de sitios de muestreo en las distintas áreas se realizó a partir de los vacíos de información que se detectaron a partir de una revisión de la literatura (Barrientos et al., 2015; Granados-Dieseldorff et al., 2012; Kihn et al., 2006; Valdez-Moreno et al., 2005) y de registros en colecciones científicas (e.g. MUSHNAT, LSU, Field Museum, Fishbase2), así como, en la importancia de la pesca artesanal en centros regionales (observaciones Barrientos).
Los muestreos se realizaron en la época seca durante enero y marzo del año 2016, con diferentes técnicas de recolecta. Con el propósito de cuantificar la riqueza ictiofaunística, en cada uno de los sitios muestreados se utilizaron las artes (i.e., electropesca, red de arrastre, atarraya) de pesca que el hábitat en los sitios de muestreo permitía (e.g., hábitat rocoso implicaba electropesca; arrastre en playas; atarraya en pozas laterales o lugares de mediana profundidad). La riqueza de especies en cada sitio se complementaba al combinar los resultados de los distintos artes de pesca similar a otros investigadores de la región (Willink et al., 2000).
Los muestreos en zonas litorales, con profundidad menor a 1 m, se muestrearon con un aparato de electropesca de mochila (Samus special electronics, modelo SUM725) en zonas rocosas, con troncos y sustratos con vegetación sumergida. A pesar de la versatilidad del aparato de electrificación, éste fue inefectivo en ríos con conductividad alta (> 1,200 µS/cm), ya que la conductividad disminuye su eficiencia (Hill y Willis, 1994; Steeves et al., 2003). La temperatura también es un factor que puede disminuir la efectividad de la electrificación, sin embargo, los meses del muestreo presentan menor temperatura en la zona (INSIVUMEH, 2015). El muestreo se limitó a 50 m de orilla.
El muestreo con arrastre playero se realizó en áreas con una profundidad menor a 1.4 m, cercanas a la orilla en las zonas litorales y regularmente sin vegetación. Este arte de pesca fue efectivo donde no se pudo utilizar la electropesca. La red utilizada fue de 8 m de largo × 2 m de alto, con una luz de malla de 0.5 cm. El muestreo fue limitado a 5 repeticiones con una distancia de mínimo 3 m donde el hábitat era adecuado. Sin embargo, el número de repeticiones fue limitado por la pendiente en la orilla o la profundidad del sedimento en los sitios donde no hubo suficiente hábitat disponible, en tales casos se realizó la mayor cantidad de arrastres posibles.
El muestreo con atarraya, de monofilamento de 3 m de diámetro con luz de malla de 20 mm, se realizó en zonas de profundidad intermedia (1.5-2.5 m) en sustratos suaves sin estructura físicas, esto es sin vegetación, rocas o troncos. En remansos de ríos considerados por los locales como caudalosos se utilizó una atarraya especial conocida como atarraya de bolsa, arte de pesca que sí fue efectivo. El muestreo se limitó a 10 lanzamientos por cada hábitat adecuado, ya que muchos de estos lanzamientos son de resultado cero.
Los especímenes fueron fijados con formaldehído al 10% y después de una semana, lavados en agua por un día, finalmente preservados en etanol al 70%. Los especímenes fueron depositados en las colecciones del Museo de Historia Natural de la Universidad de San Carlos de Guatemala (MUSHNAT), en la Colección de Peces de El Colegio de la Frontera Sur en San Cristóbal de las Casas, Chiapas (ECOSC) y en la Colección Ictiológica del Museo de Vertebrados de Southeastern Louisiana University (SLU). Las muestras de tejidos de algunos especímenes se conservaron en etanol no desnaturalizado al 95%. La nomencaltura de las especies se basó en el catálogo de peces en línea de la Academia de Ciencias de California (Eschmeyer y Fong, 2016).
Los datos de caracterización de la pesca artesanal se recolectaron con metodologías complementarias: a) transectos acuáticos para toma de datos, b) encuestas a pescadores disponibles en las comunidades y comercializadores para obtener datos cualitativos y c) observación de producto de mercados. Entre la información recopilada se incluyó época de pesca, especies objeto, artes de pesca, número de pescadores, tipos de embarcación, sin embargo, mucha de la información fue omitida ya que era desconocida para el entrevistado, lo cual limitó el análisis que fue de tipo cualitativo en artes de pesca y localidades. También se identificaron las especies directamente de las faenas después de jornadas de pesca diurna y nocturna. Algunas de las descripciones de peces se complementaron con fotos que los investigadores presentaban a los pescadores. El número de entrevistados en cada río fue limitado por el número de pescadores o mercados en el área. En total, en 5 localidades ya mencionadas se entrevistaron a 23 revendedoras y 13 pescadores en distintas comunidades. Esto debido a que sólo en dos ríos del muestreo hay pescadores de tiempo completo. Muchos de los mercados contenían especies provenientes del lago de Izabal. Estos peces no fueron tomados en cuenta por no ser de la cuenca Usumacinta.
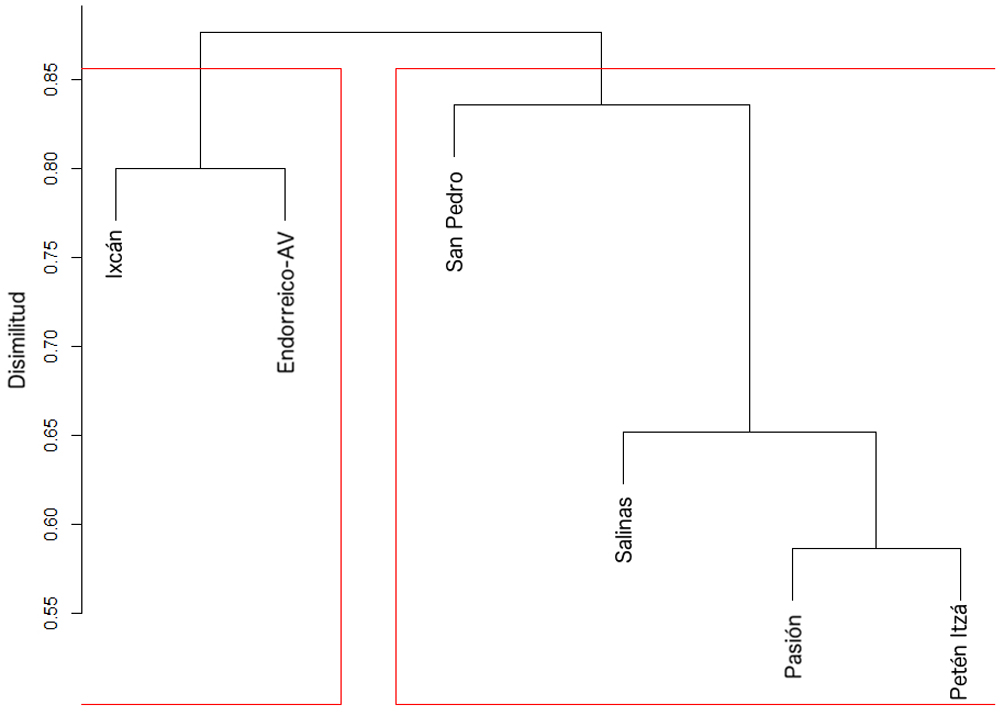
De las 20 localidades muestreadas (tabla 1), 5 correspondieron a datos y especímenes adquiridos a través de pescadores o mercados locales. Para el análisis solo se usó información obtenida directamente en las recolectas realizadas en las 15 localidaes de muestreo, sin incluir las 5 de pescadores o mercados. La información de la composición íctica de los ríos fue analizada a través de un análisis de agrupamiento jerárquico, utilizando el algoritmo UPGMA (Unweighted Pair Group Method with Arithmetic mean) y el algoritmo de similitud de Sorensen con el paquete VEGAN (Oksanen et al. 2017) en R ver. 3.1.0 (R Core Team, 2015), para entender las relaciones entre las distintas subcuencas basadas en su composición taxonómica. También se calculó el índice de correlación cofenético el cual permite evaluar si las relaciones recobradas a través del análisis de agrupamiento reflejan la información contenida en la matriz de datos crudos, valores cercanos a 1 indican una alta correlación entre el conjunto original de datos y las relaciones recobradas por el análisis agrupamiento (Saraçli et al., 2013; Sokal y Rohlf, 1962).
Tabla 1
Localidades de muestreo (n=20) en Guatemala, por departamento y área de drenaje, con sus respectivas coordenadas asociadas. Se incluyó la división política como referencia importante para identificar las localidades.
|
Área de drenaje |
Departamento |
Localidad |
Coordenadas |
Altitud |
|
|
Latitud (N) |
Longitud (W) |
m snm |
|||
|
Ixcán |
Quiché |
Río Pescado |
15°56’21.37” |
-91°4’10.02” |
154 |
|
Salinas |
Alta Verapaz |
Río Salado |
15°59’53.16” |
-90°37’14.84” |
146 |
|
Río San Benito |
15°56’45.06” |
-90°36’51.80” |
164 |
||
|
Río Tzetoc (Pescadores) |
——— |
———– |
|||
|
Tributario (sin nombre) |
16°2’46.86” |
-90°18’34.27” |
161 |
||
|
Río Sauce |
15°3’7.59” |
-90°18’22.82” |
165 |
||
|
Mercado Ixcán, Playa Grande |
15°59’24.14” |
-90°46’7.47” |
167 |
||
|
El Petén |
Aldea El Caribe |
16°9’41.65” |
-90°24’57.60” |
131 |
|
|
Endorreico AV |
Alta Verapaz |
Candelaria-Yalicar |
15°43’31.59” |
-90°19’35.33” |
353 |
|
Laguna Chajxulub |
15°43’14.30” |
-90°19’39.29” |
358 |
||
|
Pasión |
El Petén |
La Pasión (Pescadores) |
————- |
————- |
|
|
Arroyo Pucté |
16°36’48.78” |
-90°21’51.52” |
125 |
||
|
Arroyo El Subin |
16°34’6.92” |
-90°15’27.5” |
134 |
||
|
Laguna Petexbatum |
16°25’47.86” |
-90°12’0.63” |
123 |
||
|
Punta Chiminos |
16°25’47.47” |
-90°12’1.28” |
123 |
||
|
Centro de acopio Sayaxché (pescadores) |
16°31’46.45” |
-90°11’23.06” |
125 |
||
|
San Pedro |
El Naranjo (rápidos) |
17°15’6.56” |
-90°51’42.96” |
131 |
|
|
El Naranjo (pescadores) |
17°14’3.49” |
-90°48’40.28” |
120 |
||
|
Lagos del distrito |
Lago Petén Itzá |
16°58’59.88” |
-89°53’9.6” |
160 |
|
|
Mercado Santa Elena |
————- |
————- |
En una reciente prospección de la pesca artesanal del norte de Guatemala se definieron 2 tipos de modelos de pesca, el primero es a nivel de los ríos San Pedro y La Pasión, los cuales poseen pescadores de tiempo completo, y la pesca es la fuente primaria de ingresos en varias de las familias (Quintana y Barrientos, 2011). Ambos ríos registran un caudal de agua permanente (53 y 332 m3/s, respectivamente) y están entre los 5 ríos con más caudal en Guatemala. El segundo tipo de pesca se encontró en la zona montañosa de Guatemala, donde la pesca es sólo complemento de las actividades de agricultura. En este caso los ríos poseen menor caudal (< 25 m3/s) en comparación a los de las tierras bajas y son de menor tamaño y la productividad es mesotrófica a oligotrófica (comentario personal: Bessie Oliva, Facultad de Ciencias Químicas).
Tabla 2
Listado taxonómico de especies registradas en las áreas de drenaje durante el muestreo y mencionadas en las encuestas sobre la pesca artesanal, especificando el área de drenaje donde fueron registradas (* = especie exótica para Guatemala) (** = solo registrada en el muestreo ictiológico y no en mercados).
|
Tabla 2 Continuación. |
|||||||
|
Familia |
Especie |
Pasión |
San Pedro |
Salinas |
Ixcán |
EndorreicoAV |
Lagos del distrito |
|
Familia |
Especie |
Pasión |
San Pedro |
Salinas |
Ixcán |
EndorreicoAV |
Lagos del distrito |
|
Lepisosteidae |
Atractosteus tropicus |
x |
x |
||||
|
Characidae |
Astyanax aeneus |
x |
|||||
|
Hyphessobrycon compressus ** |
|||||||
|
Bryconidae |
Brycon guatemalensis |
x |
|||||
|
Lacantuniidae |
Lacantunia enigmatica |
x |
x |
||||
|
Locaridae |
Pterygoplichthys pardalis |
x |
x |
||||
|
Pterygoplichthys disjunctivus |
x |
x |
x |
||||
|
Ictaluridae |
Ictalurus meridionalis |
x |
x |
||||
|
Heptapteridae |
Rhamdia guatemalensis |
x |
x |
x |
x |
||
|
Rhamdia laticauda |
x |
||||||
|
Ariidae |
Cathorops aguadulce |
x |
|||||
|
Potamarius nelsoni |
x |
||||||
|
Clupeidae |
Dorosoma petenense |
x |
|||||
|
Atherinopsidae |
Atherinella alvarezi ** |
x |
|||||
|
Atherinella sp. ** |
x |
||||||
|
Cyprinidae |
Cyprinus carpio* |
x |
x |
||||
|
Ctenopharyngodon idella* |
x |
x |
|||||
|
Rivulidae |
Cynodonichthys tenuis** |
||||||
|
Poeciliidae |
Belonesox belizanus ** |
||||||
|
Gambusia sexradiata ** |
|||||||
|
Gambusia sp. ** |
|||||||
|
Phallichthys fairweatheri ** |
|||||||
|
Poecilia mexicana |
x |
||||||
|
Poecilia sphenops ** |
|||||||
|
Pseudoxiphophorus bimaculatus ** |
|||||||
|
Scolichthys greenwayi ** |
|||||||
|
Xiphophorus alvarezi ** |
|||||||
|
Xiphophorus helleri ** |
|||||||
|
Xiphophorus maculatus ** |
|||||||
|
Xiphophorus sp.1 ** |
|||||||
|
Synbranchidae |
Ophisternon aenigmaticum ** |
||||||
|
Centropomidae |
Centropomus undecimalis |
x |
x |
||||
|
Sciaenidae |
Aplodinotus grunniens |
x |
x |
||||
|
Gerreidae |
Eugerres mexicanus |
x |
x |
||||
|
Cichlidae |
Cribroheros robertsoni |
x |
x |
x |
|||
|
Mayaheros uropthalmus |
x |
x |
x |
||||
|
Cincelichthys pearsei |
x |
x |
x |
||||
|
Kihnichthys ufermanni |
x |
x |
|||||
|
Maskaheros argenteus |
x |
x |
x |
||||
|
Oscura heterospila |
x |
x |
x |
x |
|||
|
Parachromis friedrichsthalii |
x |
x |
x |
x |
x |
||
|
Parachromis managuensis* |
x |
x |
x |
||||
|
Petenia splendida |
x |
x |
x |
x |
|||
|
Rheoheros lentiginosus |
x |
x |
|||||
|
Rocio octofasciata |
x |
x |
x |
||||
|
Chuco godmanni |
x |
||||||
|
Chuco intermedium |
x |
x |
|||||
|
Thorichthys helleri |
x |
x |
x |
||||
|
Thorichthys meeki |
x |
x |
|||||
|
Thorichthys pasionis |
x |
||||||
|
Thorichthys affinis |
x |
||||||
|
Trichromis salvini |
x |
x |
x |
||||
|
Vieja bifasciata |
x |
||||||
|
Vieja melanura |
x |
x |
x |
||||
|
Oreochromis niloticus* |
x |
||||||
|
Orechromis sp.* |
x |
Resultados
Los datos de riqueza de cada localidad fueron analizados a nivel de áreas de drenaje, estas áreas se pueden considerar subcuencas, ya que todo el estudio es en la cuenca del Usumacinta. Se recolectó un total de 1,368 individuos correspondientes a 54 especies, 38 géneros, 18 familias y 8 órdenes (tabla 2). Del total de individuos recolectados, aproximadamente el 78% está representado por 3 familias, Characidae con 39%, seguida por Poeciilidae y Cichlidae con 21 y 18%. La especie Lacantunia enigmatica fue registrada. En términos de riqueza, aproximadamente el 68% de especies recolectadas estuvo representado por las familias Cichlidae y Poeciilidae, con aproximadamente 43 y 25%, respectivamente. Entre las 54 especies recolectadas, 7 fueron exóticas, como tilapias (Oreochromis niloticus, Oreochromis sp.), carpa común (Cyprinus carpio), carpa herbívora (Ctenopharyngodon idella), guapote (Parachromis managuensis) y peces diablo (Pterygoplichthys pardalis y P. disjunctivus) en las faenas, mercados y centros de acopio de La Pasión, San Pedro y Petén Itzá.
En los resultados del análisis de agrupamiento de las comunidades ícticas se formaron 2 grupos, los cuales presentaron un corte aproximadamente 0.25 de similitud (fig. 2). El índice de correlación cofenético fue c = 0.9134, lo que indicó que las relaciones recobradas reflejan la información contenida en la matriz de datos originales. Un grupo estuvo compuesto por las localidades de recolecta en las áreas de drenaje del río San Pedro, Pasión, Salinas y el lago Petén Itzá, las cuales desembocan hacia el río Usumacinta, a excepción del lago Petén Itzá, el cual es considerado una cuenca endorreica. El segundo grupo está compuesto por localidades de recolecta en las áreas de drenaje del Ixcán y sistemas lóticos y lénticos endorreicos en Alta Verapaz, Guatemala (endorreico-AV), dichos sitios se ubican en la región intermontana del norte de Guatemala. El área de drenaje del Ixcán desemboca en el río Usumacinta, mientras que los sistemas lóticos y lénticos endorreico-AV, no poseen una conexión actual evidente con el río Usumacinta.
En la pesca artesanal se identificaron 38 especies de peces. Los grupos más representados en la pesca artesanal en el área norte son los cíclidos y los siluriformes (tabla 2). Entre las especies de importancia comercial se observó que la pesca está compuesta por especies como el sábalo (M. atlanticus) y los robalos (Centropomus spp.). Sin embargo, existen variaciones en la composición de especies capturadas, lo cual está influido por el tipo de sistema, si es léntico o lótico, y el área de drenaje asociada. Tal es el caso de las localidades en el cauce principal del río Usumacinta (ríos La Pasión y San Pedro), en el cual se puede observar que además de cíclidos y siluriformes, el robalo, sábalo y peje lagarto o machorra (Atractosteus tropicus) son de alta importancia en la pesca artesanal. Otras especies de menor tamaño de las familias Poeciliidae, Characidae y Atherinopsidae se comercializan secas (“charales”) y en grandes cantidades, o bien son utilizadas como carnada en la pesca artesanal, pero no todas las especies (tabla 2).
La comercialización de pescado en algunas áreas de drenaje del estudio está influida por la pesca de otras regiones del país. Durante la época seca se registró la comercialización de especies de la cuenca del Polochic, provenientes del lago de Izabal o río Dulce (i.e., Vieja maculicauda) en el área de Playa Grande en Ixcán. Así mismo, se registró comercialización de peces provenientes de la cuenca del Polochic y río La Pasión en áreas del distrito central de Petén.
Entre las artes de pesca artesanal se identificó el uso de atarraya, redes agalleras de diferente luz de malla, trampas nasa, hilo de pesca con anzuelo y arpón. Sin embargo, no todas los artes de pesca se practican en todos los sitios, sino que el uso de diferentes artes de pesca varía dependiendo del tipo y características del hábitat (tamaño, corriente, fondo, etc.; tabla 3). Igualmente ocurre con el uso de embarcaciones, donde ríos como La Pasión, San Pedro y Salinas, permiten la navegación para la pesca. En estos ríos las embarcaciones utilizadas fueron regularmente sencillas, desde cayucos de madera con remo, hasta embarcaciones de fibra de vidrio con motor. Por otro lado, existen los segmentos de fuerte corriente y fondo rocoso donde la pesca ocurrió principalmente desde las orillas o caminando y buceando. Cabe destacar que los lugares donde se observó mayor pesca artesanal y comercialización de pescado fueron Sayaxché, Naranjo, área central de Petén e Ixcán. En el resto de los sitios, la pesca artesanal está más dirigida al consumo.
Tabla 3
Artes de pesca y frecuencia de uso identificadas en las cuencas del norte de Guatemala por el número de pescadores que la reportan (x = 1-2, xx = 3-5, xxx > 5). Otro: en los lagos del distrito se usa fisga.
|
Área de drenaje |
Atarraya |
Trasmallo |
Trampas nasa |
Anzuelo |
Arpón |
Otro |
|
Zonas endorreicas de Alta Verapaz |
xxx |
x |
x |
|||
|
San Pedro |
xxx |
xxx |
x |
xxx |
xx |
|
|
La Pasión |
xxx |
xxx |
xxx |
|||
|
Salinas |
xx |
xx |
x |
x |
||
|
Ixcán |
xx |
x |
x |
x |
||
|
Lagos del distrito |
xx |
xxx |
xxx |
xx |
x |
Discusión
Es reconocido que la diversidad y distribución de peces de agua dulce está influida por las relaciones históricas (aislamiento, reconexión, entre otros) de las cuencas hidrográficas (Hulsey et al., 2004; Unmack, 2001). El norte de Centroamérica ha experimentado cambios en su configuración desde el Paleoceno hasta el Mioceno (Iturralde-Vinent y MacPhee, 1999; Pindell, 1994; Rosen, 1975) y ha sido propuesto que los orígenes del principal componente de la ictiofauna en esta región —familias Cichlidae y Poeciilidae— son previos (Cenozoico temprano) (McMahan et al., 2013; Tagliacollo et al., 2015) al tiempo estimado del cierre del istmo de Panamá que ocurrió hace 20 millones de años (Bacon et al., 2015). Además, se ha planteado la hipótesis de que durante el Plio-Pleistoceno, las fluctuaciones climáticas tuvieron un fuerte impacto en los cuerpos de agua en esta región (Anselmetti et al., 2006; Brenner et al., 2002; Hodell et al., 2008). Esta compleja historia de eventos geológicos y climáticos es probablemente una de las principales fuerzas que ha moldeado la distribución de la riqueza íctica en esta región.
El 68% de especies recolectadas en este estudio pertenecen a las familias Cichlidae y Poeciilidae, ésto coincide con la riqueza de especies reportadas para Centroamérica, la cual está caracterizada por especies secundarias y con afinidades marinas, que son principalmente dominada por ambas familias (Bussing, 1985; Greenfield y Thomerson, 1999; Kihn et al., 2006; Matamoros et al., 2009, 2015; McMahan et al., 2013; Miller, 1966; Myers, 1966). La especie Lacantunia enigmatica fue recientemente registrada por primera vez para Guatemala (Quintana, resultados no publicados).
La riqueza íctica de la región del noroeste de Guatemala puede ser explicada por las relaciones hídricas entre las subcuencas. Los ríos San Pedro, La Pasión y Salinas desembocan directamente al cauce principal del río Usumacinta, lo cual hace posible la conexión dentro de las diferentes áreas, a excepción del área de los lagos del distrito de Petén (lago Petén Itzá) que se encuentra aislada actualmente. Es probable que los procesos históricos y climáticos recientes (Plio-Pleistoceno) permitieran una conexión histórica entre esta zona y las áreas adyacentes, lo cual explica la similitud en la composición de la diversidad íctica de esta región (Matamoros et al., 2012, 2015; Miller, 1966; Myers, 1966).
Aunque las localidades de recolecta del área del endorreico AV actualmente no poseen conexión con ningún drenaje mayor (río Usumacinta o Cahabón), ha sido propuesto que estas cuencas endorreicas en el departamento de Alta Verapaz, Guatemala, estuvieron conectadas históricamente (Mioceno-Plioceno) con ríos de esta región (Rosen, 1979).
Los resultados resaltan la importancia de no solo entender las relaciones actuales de las cuencas hidrográficas y la distribución de la especies ícticas presentes en esta región, sino también el contexto y procesos históricos (geológicos y climáticos) que han moldeado la región, lo cual permite comprender mejor las relaciones entre la composición íctica en las diferentes subcuencas de esta compleja región de Centroamérica. Aún más, este panorama regional favorece la necesidad de valorar y profundizar el conocimiento de la pesquerías desde un punto de vista histórico y su impacto en las distintas subcuencas hidrográficas, entendiendo que son procesos que moldean actualmente la región a pequeña escala con efectos en toda el área (Orenzans et al., 2005).
Además de las especies nativas, la composición de las pesquerías en el norte de Guatemala también tiene un componente pesquero de especies exóticas. Tilapias, guapote tigre, carpa común y carpa herbívora son 4 especies que han sido utilizadas desde 1980 a 1990, aunque registradas en muestreos ictiológicos casi 2 lustros después (Willink et al., 2000), y algunas de ellas introducidas por política del Estado de Guatemala (UNIPESCA, 2008). Este mismo problema existe en México por una agresiva política de introducción de especies exóticas y fomento de acuicultura con estas especies (Amador-del Ángel y Wakida-Kusunoki, 2014). En los mercados de Ixcán y Sayaxché es común observar carpa, guapote y tilapias en las ventas de pescado. En las entrevistas, los comercializadores indicaron que la tilapia proviene de granjas acuícolas. En el caso de Ixcán, incluso puede venir de granjas acuícolas mexicanas (comentario de vendedores en mercado). En Guatemala también existen algunas granjas de tilapia, aunque es necesario recopilar la información de la distribución de las mismas, es posible que muchas granjas no estén registradas y sean iniciativa de propietarios individuales o pequeñas asociaciones de comunitarios (observación autores).
Otras especies exóticas, como los bagres armados del género Pterygoplichthys, fueron registradas en el 2005 en el río San Pedro (Wakida-Kusunoki y Amador-del Ángel, 2009) y actualmente han invadido todos los ambientes en los ríos Pasión y Usumacinta. En este estudio, los datos muestran que estas especies de bagres armados han influido de una manera alarmante en la dinámica de los pescadores, quienes capturan incluso hasta el 100% de biomasa compuesta únicamente por estas especies, lo cual es considerado como un impacto negativo a las pesquerías de valor comercial (Mendoza et al., 2007). Aunque no existe un estudio para cuantificar su influencia en la pesca artesanal, se observó que la faena de pescadores que utilizan trasmallos en el río La Pasión puede llegar a estar compuesta hasta en un 75% por estas especies.
En la actualidad, el río San Pedro es una zona con menos biomasa de bagres armados que el río La Pasión. A pesar de que la invasión de este género fue detectada desde hace más de 10 años, en Guatemala no se han generado alternativas a los pescadores para que utilicen estas especies y se realice un manejo adecuado para controlar sus poblaciones. Los bagres armados se encuentran incluso en el lago Petén Itzá, donde fueron reportados en el 2009 (Barrientos y Quintana, 2011), a pesar de que actualmente no cuenta con una conexión a nivel superficial. Una hipótesis de colonización de los bagres armados en el lago es su liberación desde estanques o acuarios, ya que se observó que algunos hoteles del área los utilizan para la limpieza en los pequeños estaques de ornamento. Este género ha sido registrado en la pesca en el lago Petén Itzá mediante el uso de atarraya desde las orillas (Barrientos y Quintana, 2011), la cual es considera como arte ilegal de pesca en el lago, sin embargo no se ha reportado alguna biomasa grande capturada como la registrada en La Pasión, lo cual hace pensar que no hay poblaciones en reproducción en el lago.
De las observaciones de pesca entre los ríos San Pedro y La Pasión, se puede interpretar que el río San Pedro aun cuenta con una captura mayor de especies nativas, comparado con el río La Pasión. A diferencia de otros sistemas en la cuenca del Usumacinta (Huerta et al., 2013), en Guatemala, la pesca artesanal depende principalmente de las especies nativas, siendo los cíclidos un grupo destacado en riqueza de captura y biomasa obtenida, al igual que lo reportado por Inda-Díaz et al. (2009) para 2 sistemas en la selva Lacandona. A pesar de que en términos de riqueza, las especies exóticas son pocas, en términos de abundancia y biomasa en mercados de las áreas de drenaje de los ríos la Pasión e Ixcán, éstas son relevantes (observación autores), aunque provienen de la acuacultura. Aun así, se puede decir que la pesca artesanal en las áreas del muestreo depende de las poblaciones de peces nativos en la zona. Por ejemplo, en el río San Pedro, el 100% de las especies objetivo de pesca son nativas y la obstrucción por pesca causada por los bagres armados en las redes es mínima o inexistente.
La influencia de las tilapias en mercados proviene principalmente de la acuicultura, ya que las poblaciones en ríos y lagos naturales son reducidas. Probablemente, la única excepción es el río La Pasión donde se observan carpas y tilapias con los pescadores. Es necesario realizar más estudios para explicar la abundancia de tilapias que se observa en el mercado, ya que muchos de los vendedores desconocen su origen. Finalmente, la biomasa de guapotes y carpas capturada en cuerpos de aguas naturales es mínima, y ambas especies, al igual que la tilapia, son bien aceptadas en los mercados locales.
Los resultados de este estudio muestran que los peces exóticos presentan poblaciones con números relativamente bajos excepto para los bagres armados en el río La Pasión, que es el que tiene más productividad, a nivel trófico, de los ecosistemas acuáticos estudiados (observación personal C. Barrientos), lo cual confirma que la pesca artesanal no depende de las especies exóticas. Sin embargo, se reconoce que el registro de especies exóticas en los distintos ecosistemas estudiados es preocupante ya que su presencia ha sido reportada como una de las principales causas de deterioro ambiental (Hilborn et al., 2003) y se propone que no es el caso para el área de estudio en Guatemala. Debido a ésto, planteamos la hipótesis de que las especies nativas están siendo resilientes a la presencia de las especies exóticas, similar al caso de Florida en Estados Unidos, donde más de la mitad de la riqueza de peces es exótica, pero no se han visto deterioros importantes en la poblaciones nativas (Trexler et al., 2000). Sin embargo, las pesquerías artesanales están caracterizadas por ser de pequeña escala en áreas grandes y con un “stock” definido (Orenzans et al., 2005); esto implica que estos efectivos de especies nativas son vulnerables a la sobrepesca local y a cambios drásticos en las especies dominantes del sistema, como ya ocurre en la planicie de inundación del Usumacinta en México (González-Bocanegra et al., 2011; Ramírez-Guevara y Rodiles- Hernández 2013), lo cual implicaría que las especies exóticas dominarían el sistema y dependerían siempre de las instituciones de gobierno para mantener la pesca a través de la siembra de alevines en estos ecosistemas. Actualmente, no existe una política de resiembras de especies introducidas por parte del gobierno de Guatemala, como lo fue en los años 1950-60 (Kihn et al., 2006). Finalmente, el deterioro ambiental por la deforestación regional (Cabrera y Cuc, 2002) es causa de otros impactos ambientales negativos a lo largo de la cuenca; muchas veces exacerbado por la sobrepesca, que puede afectar la calidad del agua y la composición de la comunidad íctica, por lo que la resiliencia de estas comunidades dependerá más de factores a nivel regional, que local (Trexler et al., 2005). Lo cual hace imperativo que el trabajo en las comunidades ictiológicas del Usumacinta se planifique como cuenca, incluyendo ambos países.
Agradecimientos
Este trabajo se realizó a través de un convenio de cooperación y financiamiento entre El Colegio de la Frontera Sur (ECOSUR) y la Organización Nacional para la Conservación del Ambiente (ONCA). Agradecemos a Julio Morales director ejecutivo de ONCA y a personal directivo y administrativo de ECOSUR por facilitar las gestiones del proyecto. Agradecemos a Francisco Castañeda y Mercedes Barrios, del Centro de Estudios Conservacionistas, CECON, de la Universidad de San Carlos por el aval para la licencia de investigación (Núm. 14/2015), otorgada por el Consejo Nacional de Áreas Protegidas de Guatemala, a quien también agradecemos la confianza en esta investigación. RR agradece al proyecto “Conectividad y Diversidad Funcional de la Cuenca del Rio Usumacinta” (FID-ECOSUR), al Conacyt (265570), así como al Sistema Nacional de Investigadores, por los apoyos.
Referencias
Allan, J. D., Abell, R., Hogan, Z. E. B., Revenga, C., Taylor, B. W., Welcomme, R. L. et al. (2005). Overfishing of inland waters. BioScience, 55, 1041–1051.
Amador-del Ángel, L. E. y Wakida-Kusunoki, A. T. (2014). Peces invasores en el sureste de México. En R. Mendoza y P. Koleff (Eds.), Especies acuáticas invasoras en México (pp. 425–433). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Anselmetti, F., Ariztegui, D., Hodell, D., Hillesheim, M., Brenner, M., Gilli, A. et al. (2006). Late Quaternary climate-induced lake level variations in Lake Petén Itzá, Guatemala, inferred from seismic stratigraphic analysis. Palaeogeography, Palaeoclimatology, Palaeoecology, 230, 52–69.
Bacon, C., Silvestro, D., Jaramillo, C., Smith, B., Chakrabarty, P. y Antonelli, A. (2015). Biological evidence supports an early and complex emergence of the Isthmus of Panama. Proceedings of the National Academy of Sciences, 112, 6110–6115.
Barrientos, C. (2016). Life history variation and artisanal fishery assessment of the giant cichlid (Petenia splendida Gunther 1862) in Guatemalan lakes (Tesis). Gainesville: Universidad de Florida.
Barrientos, C., Elías, D. y Quintana Y. (2015). Fishes from Lake Yaxhá, Mayan Biosphere Reserve, Petén, Guatemala. Check List, 11, 1751.
Brenner, M., Rosenmeier, M., Hodell, D. y Curtis J. (2002). Paleolimnology of the Mayan lowlands. Ancient Mesoamerica, 13, 141–157.
Bussing, W. (1985). Patterns of the distribution of the Central American icthyofauna. En F. G. Stehli y S. D. Webb (Eds.), The great American biotic interchange. (pp. 453–473). New York: Springer.
Cabrera, J. y Cuc, P. (2002). Diagnóstico socioambiental de la cuenca del río Usumacinta. Costa Rica: Fundación Kukulkan/ Fundación del Servicio Exterior para la Paz y el Desarrollo Democrático, Universidad de Costa Rica, Universidad Nacional de Costa Rica.
Conap (Consejo Nacional de Áreas Protegidas). (2015). Listado de Áreas Protegidas. Guatemala: SIGAP-Conap.
Dickinson, J. C. III. (1974). Fisheries of Lake Izabal, Guatemala. Geographical Review, 64, 385–409.
Eschmeyer, W. y Fong, J. (2016). Species by family/Subfamily. California Academy of Sciences. Recuperado 10 Jul 2016 de
http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp http://research.calacademy.org/research/ichthyology/catalog/fishcatmain.asp
FAO (Organización de las Naciones Unidas para la Alimentación y la Agricultura ). (2014). Contribución de la pesca y la acuicultura a la seguridad alimentaria y el ingreso familiar en Centroamérica. Panamá: FAO.
González-Bocanegra, K., Romero-Berny, E., Escobar- Ocampo, M. y García-Del Valle, Y. (2011). Aprovechamiento de fauna silvestre por comunidades rurales en los humedales de Catazajá-La Libertad, Chiapas, México. Ra Ximhai. Revista Científica de Sociedad, Cultura y Desarrollo Sostenible, 7, 219–230.
Granados-Dieseldorff, P., Christensen, M. F. y Kihn-Pineda, P. H. (2012). Fishes from Lachuá Lake, Upper Usumacinta Basin, Guatemala. Check List, 8, 95–101.
Greenfield, D. y Thomerson, J. (1999). Fishes of the continental waters of Belize. Gainesville: University Press of Florida.
Hernández-Vidal, U., Chiappa-Carrara, X. y Contreras-Sánchez, W. (2014). Reproductive variability of the common snook, Centropomus undecimalis, in environments of contrasting salinities interconnected by the Grijalva-Usumacinta fluvial system. Ciencias Marinas, 40, 173–185.
Hilborn, R., Branch, T. A., Ernst, B., Magnusson, A., Minte-Vera, C. V., Scheuerell, M. D. et al. (2003). State of the world’s fisheries. Annual review of Environment and Resources, 28, 359.
Hill, T. D. y Willis, D. W. (1994). Influence of water conductivity on pulsed AC and pulsed DC electrofishing catch rates for largemouth bass. North American Journal of Fisheries Management, 14, 202–207.
Hodell, D., Anselmetti, F., Ariztegui, D., Brenner, M., Curtis, J. H., Gilli, A. et al. (2008). An 85-ka record of climate change in lowland Central America. Quaternary Science Reviews, 27, 1152–1165.
Huerta, M., Perera, M., Hernández, R., Mendoza, M. y Ortíz, M. C. (2013). Variación interanual de la abundancia pesquera en la cuenca alta del río Usumacinta, Tabasco, México. En M. Rey-Méndez y C. Lodeiros (Eds.), V Foro Iberoamericano de los Recursos Marinos y de Acuicultura (pp. 717–722). Coruña, España: Asociación Cultural Foro dos Recursos Mariños e da Acuicultura das Rías Galegas, Santiago de Compostela.
Hulsey, C. D., García-de León, Y., Sánchez, D. A., Hendrickson y Near, T. J. (2004). Temporal diversification of Mesoamerican cichlid fishes across a major biogeographic boundary. Molecular Phylogenetics and Evolution, 31, 754–464.
Inda-Díaz, E., Rodiles-Hernández, R., Naranjo, E. J. y Mendoza-Carranza, M. (2009). Subsistence fishing in two communities of the Lacandon Forest, Mexico. Fisheries Management and Ecology, 16, 225–234.
INE (Instituto Nacional de Estadística). (2013). Caracterización departamental Quiché 2012. Gobierno de Guatemala. Recuperado 20 enero 2017, de: http://www.ine.gob.gt/sistema/uploads/2013/12/09/AwfjjE8PjNlI3D4DnpYnoGmtL7oux9xH.pdf
INE (Instituto Nacional de Estadística). (2014a). Caracterización Departamental Petén. Gobierno de Guatemala. Recuperado 20 enero 2017, de: http://www.ine.gob.gt/sistema/uploads/2015/07/20/YoImMZU2iSnS17Ss6YXKdD0T5G3bLGO9.pdf
INE (Instituto Nacional de Estadística). (2014b). Caracterización departamental Alta Verapaz 2013. Gobierno de Guatemala. Recuperado 20 En 2017 de http://www.ine.gob.gt/sistema/uploads/2015/07/20/1fSmvhzbhVOQ5jcalarWvnNo3yoeBPu0.pdf
INE (Instituto Nacional de Estadística). (2014c). Caracterización departamental Baja Verapaz. 2013. Gobierno de Guatemala. Recuperado 20 En 2017 de http://www.ine.gob.gt/sistema/uploads/2015/07/20/qbEeQbwGXa5WQixxu25uPY5KHyg2zZlf.pdf
INE (Instituto Nacional de Estadística). (2014d). Caracterización departamental Totonicapan 2013. Gobierno de Guatemala. Recuperado 20 En 2017 de http://www.ine.gob.gt/sistema/uploads/2015/07/20/EfsWFqUtoEkcXfE2PB1sVbSpfVPHbJVY.pdf
INE (Instituto Nacional de Estadística). (2014e). Caracterización departamental Huehuetenango 2013. Gobierno de Guatemala. Recuperado 20 Enero 2017 de http://www.ine.gob.gt/sistema/uploads/2015/07/20/yYXFscGDOuzXzAzSVWOzGnaa1WSaqajj.pdf
Inegi (Instituto Nacional de Estadística y Geografía). (2015). Principales resultados de la Encuesta Intercensal 2015: Campeche / Instituto Nacional de Estadística y Geografía. México D.F.: Inegi.
INSIVUMEH (Instituto Nacional de Sismología, Vulcanología, Meteorología, e Hidrología). (2015). Ríos de Guatemala. INSIVUMEH. Gobierno de la República de Guatemala. Recuperado 20 En 2017 de http://www.insivumeh.gob.gt/riosdeguatemala.html#RED HIDROLOGICA
Iturralde-Vinent, M. A. y MacPhee, R. D. (1999). Paleogeography of the Caribbean region: implications for Cenozoic biogeography. Bulletin of the American Museum of Natural History, 238.
Kihn, P. H., Cano, E. y A. Morales, A. (2006). Peces de las aguas interiores de Guatemala. En E. Cano (Eds.), Biodiversidad de Guatemala. Vol 1. (pp. 457–485). Guatemala: Universidad del Valle.
March, I. J. y Fernández, J. C. (2003). La gran Cuenca del río Usumacinta: una contradicción regional. En P. García y Z. Mich (Eds.), Agua, medio ambiente y desarrollo en el siglo XXI: México desde una perspectiva global y regional (pp. 117–135). México D.F.: Semarnat/ Instituto Mexicano de Tecnología del Agua.
MARN (Ministerio de Ambiente y Recursos Naturales). (2009). Mapa de cuencas hidrograficas a escala 1:50,000, República de Guatemala: Método de Pfafstetter (Primera aproximación). Guatemala: Ministerio de Ambiente y Recursos Naturales.
MARN (Ministerio de Ambiente y Recursos Naturales). (2011). Cuencas hidrográficas de Guatemala. Guatemala: Ministerio de Ambiente y Recursos Naturales.
Matamoros, W., Kreiser, B. R. y Schaefer, J. F. (2012). A delineation of Nuclear Middle America biogeographical provinces based on river basin faunistic similarities. Reviews in Fish Biology and Fisheries, 22, 351–365.
Matamoros, W., McMahan, C., Chakrabarty, P., Albert, J. y Schaefer, J. (2015). Derivation of the freshwater fish fauna of Central America revisited: Myers’s hypothesis in the twenty first century. Cladistics, 31, 177–188.
Matamoros, W., Schaefer, J. y Kreiser, B. (2009). Annotated checklist of the freshwater fishes of continental and insular Honduras, Zootaxa, 2307, 1–38.
Matthes, H. (1986). La situacion de la pesca y acuicultura en Guatemala y los lineamientos para su desarrollo futuro. Guatemala: Food and Agriculture Organization of the United Nations.
McBride, R. S. y Matheson, R. (2011). Florida’s diadromous fishes: biology, ecology, conservation, and management. Florida Scientist, 743.
McMahan, C. D., Chakrabarty, P., Sparks, J. S., Smith, W. L. y Davis, M. P. (2013). Temporal patterns of diversification across global cichlid biodiversity (Acanthomorpha: Cichlidae). Plos One, 8, e71162.
Mendoza, R., Contreras, S., Ramírez, C., Koleff, P., Alvarez, P. y Aguilar, V. (2007). Los peces diablo: especies invasoras de alto impacto. Biodiversitas, 70, 2–5.
Miller, R. (1966). Geographical distribution of Central American freshwater fishes. Copeia, 1966, 773–802.
Miller, R. (1988). Mesoamerican fishes of the Río Usumacinta basin: composition, derivation, and conservation. En G. H. Dalrymple, W. F. Loftus y F. S. Bernardino Jr. (Eds.), Wildlife in the everglades and Latin American wetlands. (pp. 9–10). Miami: Florida International University.
Myers, G. (1966). Derivation of the freshwater fish fauna of Central America. Copeia, 1966, 766–773.
Oksanen, J., Blanchet, G., Friendly, M., Kindt R., Legendre, P., McGlinn D. et al. (2017). Vegan: community ecology package. R package version 2.4-3. https://CRAN.R-project.org/package=vegan
Orensanz, J. M., Parma, A. M., Jerez, G., Barahona, N., Montecinos, M. y Elías, I. (2005). What are the key elements for the sustainability of “S-fisheries”? Insights from South America. Bulletin of Marine Science, 76, 527–556.
Pauly, D., Christensen, V., Guénette, S., Pitcher, T. J., Sumaila, U. R., Walters, C. J. et al. (2002). Towards sustainability in world fisheries. Nature, 418, 689–695.
Pauly, D. y Zeller, D. (2016). Catch reconstructions reveal that global marine fisheries catches are higher than reported and declining. Nature Communications, 7, 10244.
Perera-García, M. A., Mendoza-Carranza, M., Contreras-Sánchez, W. M., Huerta-Ortíz, M., y Pérez-Sánchez, E. (2011). Reproductive biology of common snook Centropomus undecimalis (Perciformes: Centropomidae) in two tropical habitats. Revista de Biología Tropical, 59, 669–681.
Perera-García, M. A., Mendoza-Carranza, M. y Páramo-Delgadillo, S. (2008). Dinámica reproductiva y poblacional del robalo, Centropomus undecimalis (Perciformes: Centropomidae), en barra San Pedro, Centla, México. Universidad y Ciencia, 24, 49–59.
Pindell, J. (1994). Evolution of the Gulf of Mexico and the Caribbean. En D. Stephen y T. Jackson (Eds.), Caribbean geology: an introduction (pp. 13–39). Kingston: University of West Indies Publishers´Association.
Quintana, Y. (2015). Assessment of the artisanal giant cichlid (Petenia splendida) fishery in Lake Petén Itzá, Guatemala (Tesis). Gainesville: University of Florida.
Quintana, Y. y Barrientos, C. (2011). Especies pesqueras de importancia comercial en el Parque Nacional Río Dulce: valoración económica y estrategias para su manejo. Guatemala: Fondo Nacional para la Conservación.
R Core Team (2015). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Disponible en: https://www.R-project.org/
Ramírez-Guevara, N. N. y Rodiles-Hernández, R. (2013). El impacto de especies invasoras: el caso de la familia Loricariidae (Siluriformes). En Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Conabio) (Ed.), La biodiversidad en Chiapas: estudio de estado (pp. 302–303). Ciudad de México: Comision Nacional para el Conocimiento de la Biodiversidad (Conabio)/ Gobierno del Estado de Chiapas, México.
Ricciardi, A. y Rasmussen, J. B. (1999). Extinction rates of North American freshwater fauna. Conservation Biology, 13, 1220–1222.
Rosen, D. (1975). A vicariance model of Caribbean biogeography. Systematic Biology, 24, 431–464.
Rosen, D. (1979). Fishes from the uplands and intermontane basins of Guatemala: revisionary studies and comparative geography. Bulletin American Museum Natural History, 162, 269–375.
Saraçli, S., Doğan, N. y Doğan I. (2013). Comparison of hierarchical cluster analysis methods by cophenetic correlation. Journal of Inequalities and Applications, 2013, 203.
Schwartz, N. B. (1990). Forest society: a social history of Petén, Guatemala. Philadelphia: University of Pennsylvania Press.
Sokal, R. y Rohlf, F. (1962). The comparison of dendograms by objective methods. Taxon, 11, 33–40.
Steeves, T. B., Slade, J. W., Fodale, M. F., Cuddy, D. W. y Jones, M. L. (2003). Efectiveness of using backpack electrofishing gear for collecting sea lamprey (Petromyzon marinus) larvae in Great Lakes Tributary. Journal of Great Lakes Research, 29,161–173.
Suárez, G. (2011). Cuencas hidrográficas de Guatemala. Guatemala: DGPEA-MARN.
Tagliacollo, V., Duke-Sylvester, S., Matamoros, W., Chakrabarty, P. y Albert, J. (2017) Coordinated dispersal and pre-Itshmian assembly of the Central American ichthyofauna. Systematic Biology, 66, 183–196.
Trexler, J. C., Loftus, W. F., Jordan, F., Lorenz, J. J., Chick, J. H. y Kobza, R. M. (2000). Empirical assessment of fish introductions in a subtropical wetland: an evaluation of contrasting views. Biological Invasions, 2, 265–277.
Trexler, J. C., Loftus, W. F. y Perry, S. (2005). Disturbance frequency and community structure in a twenty-five year intervention study. Oecologia, 145, 140–152.
UNIPESCA (Unidad Nacional de Pesca y Acuicultura). (2008). Informe de la pesca y la acuicultura en Guatemala 2004-2007. Documento Técnico No. 1. Guatemala: Ministerio de Agricultura, Ganadería y Alimentación (MAGA).
Unmack, P. (2001). Biogeography of Australian freshwater fishes. Journal of Biogeography, 2, 1053–1089.
Valdez-Moreno, M. E., Pool-Canul, J. y Contreras-Balderas, S. (2005). A checklist of the freshwater ichthyofauna from El Petén and Alta Verapaz, Guatemala, with notes for its conservation and management. Zootaxa, 1072, 43–60.
Wakida-Kusunoki, A. T. y Amador-del Angel, L. E. (2009). Nuevos registros de los plecos Pterygoplichthys pardalis (Castelnau 1855) y P. disjunctivus (Weber 1991) (Siluriformes: Loricariidae) en el sureste de México. Hidrobiológica, 18, 251–256.
Welcome, R. L. (2001). Inland fisheries. Ecology and management. Objectives for the fishery. London: Blackwell Science Ltd.
Willink, P.W., Barrientos, C., Kihn, P. H. y Chernoff, B. (2000). Un estudio ictiológico del Parque Nacional Laguna del Tigre, Petén, Guatemala. En B. Bestelmeyery y L. E. Alonso (Eds.), Rapid assessment program. A biological assessment of Laguna del Tigre National Park, Petén, Guatemala (pp.134–142). Washington D.C.: Conservation International.
