Determinación de peces presas consumidos por toninas (Tursiops truncatus) que vararon en la Isla del Carmen, Campeche
Karem Leonela Naranjo-Ruiz a, *, Alberto Delgado-Estrella b, María Raisa Karenina Morquecho-León c y Yassir Edén Torres-Rojas a
a Instituto de Ecología Pesqueria y Oceanografia del Golfo de México, Campus 6 Av. Héroe de Nacozari 480, 24079 Campeche, Campeche, México
b Facultad de Ciencias Naturales, Universidad Autónoma del Carmen, Campus III, Av. Central s/n esquina con Fracc. Mundo Maya, 24115 Campeche, Campeche, México
c Laboratorio de Zoología Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México, Av. de los Barrios Número 1, Col. Los Reyes Iztacala, 54090 Tlalnepantla, Estado de México, México
*Autor para correspondencia: leonaranjor@hotmail.com (K.L. Naranjo-Ruiz)
Resumen
Diferentes mamíferos acuáticos están en los niveles más altos de la trama trófica, por lo que resulta importante comprender las interacciones entre las especies que coexisten en su ambiente. Este es el primer estudio de análisis de hábitos alimentarios en toninas (Tursiops truncatus) del sur del golfo de México, para laguna de Términos. El objetivo de este trabajo fue aportar información sobre su alimentación, específicamente de especies ícticas. Los peces fueron identificados a través de otolitos encontrados como parte del contenido estomacal de toninas varadas, utilizando sus características morfológicas, así como la topografía de la cara interna. En total se analizaron 4,953 otolitos, identificando 34 especies ícticas pertenecientes a 18 familias, registrando que las de mayor preferencia fueron Ariidae y Sciaenidae, presentes en casi todas las temporadas y clases de edad. Además, se comprobó que las especies demersales representan más de la mitad de la dieta de las toninas y que la alimentación de T. truncatus es muy diversa en cuanto a peces presa, lo que permite comprender mejor las estrategias de alimentación, que en el presente estudio fue de tipo generalista. Finalmente, no se encontraron diferencias significativas en la alimentación entre ejemplares que formaron parte del estudio.
Palabras clave: Hábitos alimentarios; Otolitos; Delfines
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Determination of prey consumed by bottlenose dolphins (Tursiops truncatus), obtained from strandings in Carmen Island, Campeche
Abstract
Several aquatic mammals are at the highest levels of the food web, their study is important to understand the interactions among species that coexist in the same environment. This is the first feeding habits research of the bottlenose dolphins (Tursiops truncatus) on the southern Gulf of Mexico specifically at Términos Lagoon. The objective of this work was to provide information about their feeding, particularly of fish species. The fish were identified through otoliths found in the stomach content of stranded dolphins, using their morphological characteristics, as well as the topography of the inner face. A total of 4,953 otoliths were analyzed, identifying 34 fish species belonging to 18 families where the highest preference were Ariidae and Sciaenidae, present in almost all seasons and age classes. In addition, it was found that demersal species represent more than the half of the prey fish of T. truncatus, which allows a better understanding of feeding strategies, that in the present study was a generalist type. Finally, there were no significant differences in feeding between specimens that were part of the study.
Keywords: Feeding habits; Otoliths; Dolphins
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Las toninas Tursiops truncatus son depredadores generalistas, con una dieta que incluye cefalópodos, crustáceos y gran variedad de peces pelágicos y bentónicos, esto de acuerdo con las presas disponibles en su zona de distribución (Dos Santos et al., 2007). Como parte de la alimentación de las toninas se tienen registros de prevalencia de peces soníferos y asociados a pastos marinos. En ejemplares varados muertos en las costas de Florida, las familias de peces más sobresalientes han sido Sciaenidae y Sparidae (Berens et al., 2010; Dunshea et al., 2013); también destacaron las familias Mugilidae, Haemulidae, Lutjanidae y Labridae en el estudio de Barros y Odell (1990), para la misma zona.
Los estudios sobre determinación de la dieta de los depredadores marinos están conformados principalmente al examinar 4 tipos de muestras: los contenidos estomacales, regurgito, vómitos y heces; considerando lo anterior, los otolitos son los únicos restos fácilmente identificables de los peces-presa ingeridos por los depredadores marinos ictiófagos (García-Godos, 2001), por lo que los varamientos ofrecen una excelente oportunidad de estudiar a los mamíferos acuáticos. Revisar los cadáveres es de especial interés pues ayuda en la evaluación de las evidencias de interacción que tienen con las actividades humanas y tratar de determinar las posibles causas de muerte (Pugliares et al., 2007), además de que hace posible el análisis directo del alimento consumido por estos cetáceos al momento de analizar las cavidades gástricas.
Tursiops truncatus representa la única especie de cetáceo que habitan dentro del Área de Protección de Flora y Fauna Laguna de Términos (APFFLT) y actualmente no se cuenta con información en relación a los hábitos alimentarios para esta especie dentro de la laguna. Además, se encuentra bajo protección especial (NOM-059-Semarnat-2010) y en la lista roja de la IUCN en la categoría de vulnerable, donde se destaca la necesidad de conocer la relación de la especie con los recursos y el hábitat; por lo que el objetivo principal de este trabajo fue identificar a través de otolitos, las especies ícticas que forman parte de los hábitos alimentarios de las toninas y las características ecológicas que tienen estos depredadores hacia sus presas, ya que se han reconocido por ser depredadores oportunistas y generalistas (Chávez-Martínez, 2017; Dos Santos et al., 2007; Hernández-Millán et al., 2015; Niño-Torres et al., 2011) por lo que, con el análisis de los ejemplares de este trabajo, se aportará información base a la ecología trófica de estos organismos.
Materiales y métodos
Se atendieron 35 varamientos registrados en la zona costera de la isla del Carmen, Campeche (fig. 1) en los años 2014 a 2016, siguiendo el protocolo de Atención a Varamientos de Mamíferos Marinos emitido por las autoridades ambientales de México (DOF, 2014). Se extrajeron las cavidades gástricas con presencia de contenido estomacal.

Estas cavidades gástricas fueron fijadas con alcohol al 70%. El análisis del contenido estomacal consistió en cortar por mitades las cavidades y lavar con agua corriente, depositando todo el contenido sobre tamices de 250 y 300 µm. Con pinzas de disección se procedió a separar y extraer los otolitos más grandes (Sagitta) de los cráneos de peces. Los otolitos fueron limpiados con toallas húmedas para retirar cualquier tipo de materia adherida a éstos. Posteriormente fueron agrupados según la forma en general y guardados en frascos de vidrio o tubos Ependorf según la cantidad de material, cada frasco fue rotulado con información del varamiento como fecha, sexo y localidad.
La identificación de los otolitos se realizó en el Laboratorio de Conservación de la Biodiversidad, UNAM Parque Científico y Tecnológico. Los otolitos agrupados por formas fueron fotografiados con un microscopio óptico AXIO Zoom V16 marca Zeiss adaptado con la cámara AXICAM-506 color y las fotografías se obtuvieron a través del programa ZEN 2 (“blue edition”; fig. 2). Esto permitió resaltar e identificar los principales rasgos morfológicos, para posteriormente ser comparados e identificados a través del análisis morfológico tomando como referencia el catálogo virtual Análisi de FORmes d’ Otólits (Shape Analysis of Fish of Otoliths; Lombarte et al., 2006) y el trabajo de caracterización morfológica de los otolitos Sagittae del Atlántico mexicano (Morquecho-León, 2016). Se comprobó la presencia en el área de estudio de cada especie de pez identificada mediante la revisión de las listas de Yáñez-Arancibia et al. (1985), McEachran y Fechhelm (2005) y Gallardo-Torres et al. (2014). De las especies identificadas se consultó el tipo de hábitat en páginas web especializadas (Froese y Pauly, 2018; UICN, 2019; Robertson et al., 2015). Por otro lado se contabilizó el número de individuos considerando que cada pez posee un par de otolitos (izquierdo y derecho).
Para evaluar las presas principales en la dieta de T. truncatus se calculó el índice de importancia geométrico (IIG) (Assis, 1996):
IIG = (%FA + %N) / √2
donde se consideró la frecuencia de aparición (%FA) y el porcentaje por número de presas (%N). Este índice conduce a una comparación gráfica y una clasificación jerárquica de presas en clases de importancia, en donde las presas ocasionales se desarrollan en valores de 0 a 10; las presas secundarias en valores de 10 a 30 y las presas preferentes o principales en valores de 40 o más (Assis, 1996; Jaramillo-Londoño, 2009).
Se realizó un análisis de similitud (Anosim) con el programa PRIMER 6.0 (PRIMER-E, Auckland, New Zealand) para evaluar diferencias en las dietas entre sexos (machos y hembras), clases de edad (cría, juvenil y adulto) y temporadas climáticas (nortes, lluvias y secas). Dicho análisis busca obtener la similitud media entre grupos. Los resultados de Anosim son representados en una escala de R que va de +1 a -1. Entre más cercano sea el valor a +1 indicará que las muestras más similares se encuentran dentro de los mismos grupos. Los valores cercanos a 0 ocurren si las similitudes altas y bajas están perfectamente mezcladas y no tienen relación con el grupo e indican una distribución completamente aleatoria dentro del grupo. Y un valor de R de -1 indica que las muestras más similares se encuentran en diferentes grupos.
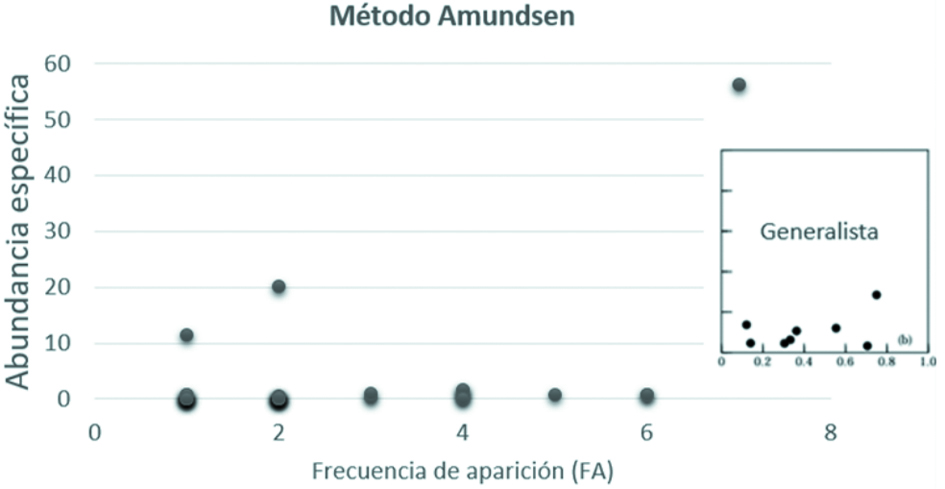
Se utilizó el enfoque gráfico de Amundsen et al. (1996) para determinar la estrategia alimentaria. Este método se basa en una representación bidimensional del índice de frecuencia de las presas y de la abundancia específica de las mismas. Las presas ubicadas en la parte superior del gráfico son consumidas por depredadores especialistas, las que se ubican en la parte baja del diagrama serán consumidas por depredadores más generalistas.

Resultados
Del total de varamientos atendidos, 17 (55%) tuvieron contenido estomacal, de éstos tres tuvieron únicamente restos de tejidos altamente digeridos y espinas que no fueron posibles de identificar. Por lo tanto solo se analizó el contenido de 14 ejemplares (45% del total y 82% de los que tuvieron presencia de contenido estomacal) los cuales tuvieron presencia de otolitos.
De los ejemplares cuyo contenido fue analizado se documentaron datos en los que se incluyeron temporada climática y clase de edad, basándose en la longitud total de las toninas (tabla 1). Cuatro fueron hembras, 9 machos y un organismo del cual no fue posible determinar el sexo. Cuatro fueron crías, 3 subadultos y 7 adultos, por lo que el mayor número de contenidos analizados fueron de ejemplares adultos. El mayor número de ejemplares fue de la temporada de lluvias con un total de 6 ejemplares, seguido de nortes (5 ejemplares) y secas (3 ejemplares).
Se analizaron 4,953 otolitos correspondientes a 2,526 peces, lográndose identificar 34 especies, pertenecientes a 26 géneros, 18 familias y 8 órdenes (tabla 2). En el caso específico de la familia Ariidae, no fue posible llegar al nivel de especie debido a la similitud que presentan los otolitos Lapillus (que para esta familia son los de mayor tamaño) entre las especies Bagre marinus y Ariopsis felis. Con base al tipo de hábitat de las especies identificadas, se determinó que 56% presentaron hábitat demersal, 20% pelágico, 15% bentopelágico y 9% nerítico. Tomando en cuenta la presencia de cada especie de pez en cada contenido estomacal, se determinó la frecuencia (tabla 3) que presentaron las presas de las toninas. Se identificaron como las especies de mayor frecuencia a los peces de la familia Ariidae (B. marinus o A. felis), así como a los de la familia Sciaenidae (Cynoscion arenarius, Cynoscion nothus y Micropogonias undulatus). El índice de importancia geométrica (fig. 3) indicó que las especies de la familia Ariidae (A. felis o B. marinus) corresponden a las especies principales (IIG=75.06), seguidas de especies de la familia Sciaenidae: C. arenarius (IIG = 30.85), C. nothus (IIG = 30.77) y M. unduladus (IIG = 25.83) como especies secundarias.
Los resultados de la prueba estadística Anosim indicó similitud para las categorías sexo (Rglobal = -0.235), estado ontogénico (Rglobal = -0.19) y para la categoría de temporadas climáticas (Rglobal = -0.07). El análisis de estrategia alimenticia (Amundsen) (fig. 4) dio como resultado que los individuos analizados presentaron una dieta más generalizada.
Discusión
En el análisis de los contenidos estomacales de ejemplares T. truncatus que vararon en la Isla del Carmen se encontraron principalmente restos de peces, donde los otolitos fueron los más abundantes y mejor conservados. Esto es debido a la composición de carbonato de calcio y cristales de Aragonita que estas estructuras tienen (Sagitta y Lapillus), por lo que soportan en gran medida los procesos de digestión (Volpedo y Vaz-Dos Santos, 2015).
A través de la revisión de tipo de hábitat de las especies ícticas identificadas, se comprobó que las especies demersales representan más de la mitad de la dieta de las toninas. Esto se relaciona con el comportamiento alimentario de las toninas al momento de la caza, quienes pueden utilizar la estrategia de alimentación cerca del fondo (Duffy-Echevarría et al., 2007; Silber y Fertl, 1995) o incluso capturan a los peces en el sedimento (Lewis, 2003). Las especies pelágicas y bentopelágicas también forman parte importante en la dieta de esta especie como ha sido señalado en otros trabajos (Bräger et al., 2016; Giménez et al., 2017; Gladilina y Gol’din, 2014; Wells y Scott, 2009). Esto comprueba qué tan generalistas pueden ser las estrategias alimenticias que tienen los delfines.
Tabla 1
Datos de los ejemplares de toninas (T. truncatus) varados atendidos en Isla del Carmen, Campeche (2014-2016) con presencia de otolitos en el contenido estomacal (H: hembra; M: macho; ND: no determinado).
|
Clave asignada |
Fecha de varamiento |
Temporada |
Sexo |
Longitud total (m) |
Clase de edad |
|
H1401A |
07-feb-14 |
Secas |
H |
2 |
Cría |
|
M1402S |
06-may-14 |
Secas |
M |
2.29 |
Subadulto |
|
M1403A |
06-ago-14 |
Lluvias |
M |
2.64 |
Adulto |
|
M1404C |
11-oct-14 |
Nortes |
M |
1.98 |
Cría |
|
H1505C |
25-ago-15 |
Lluvias |
H |
2.05 |
Cría |
|
M1506A |
07-sep-15 |
Lluvias |
M |
2.51 |
Adulto |
|
M1607A |
08-may-16 |
Secas |
M |
2.42 |
Adulto |
|
M1608A |
12-jun-16 |
Lluvias |
M |
2.70 |
Adulto |
|
H1609S |
15-jun-16 |
Lluvias |
H |
2.30 |
Subadulto |
|
X1610A |
03-jul-16 |
Lluvias |
ND |
2.60 |
Adulto |
|
H1611A |
19-oct-16 |
Nortes |
H |
2.58 |
Adulto |
|
M1612S |
28-oct-16 |
Nortes |
M |
2.27 |
Subadulto |
|
M1613C |
05-nov-16 |
Nortes |
M |
1.74 |
Cría |
|
M1614A |
07-nov-16 |
Nortes |
M |
2.70 |
Adulto |
Tabla 2
Lista de especies de peces identificados mediante otolitos, agrupadas en orden taxónomico.
|
Familia |
Especie |
Tipo de hábitat |
|
Elopidae |
Elops saurus |
nerítico |
|
Engraulidae |
Anchoa cayorum |
pelágico |
|
A. cubana |
pelágico/nerítico |
|
|
A. mitchilli |
pelágico/nerítico |
|
|
Cetengraulis edentulus |
pelágico/nerítico |
|
|
Ariidae |
Ariopsis felis |
nerítico |
|
Bagre marinus |
demersal |
|
|
Cathorops melanopus |
bentopelágico |
|
|
Batrachoididae |
Opsanus beta |
demersal |
|
Mugilidae |
Mugil cephalus |
bentopelágico |
|
Belonidae |
Strongylura marina |
pelágico |
|
S. timucu |
pelágico |
|
|
Centropomidae |
Centropomus paralellus |
demersal |
|
C. undecimalis |
demersal |
|
|
Carangidae |
Chloroscombrus chrysurus |
pelágico/nerítico |
|
Selene setapinnis |
bentopelágico |
|
|
Lutjanidae |
Lutjanus griseus |
demersal |
|
Gerreidae |
Diapterus auratus |
demersal |
|
D. rhombeus |
demersal |
|
|
Eucinostomus gula |
demersal |
|
|
E. jonesii |
demersal |
|
|
Haemulidae |
Haemulon aurolineatum |
demersal |
|
H. plumierii |
demersal |
|
|
Orthopristis chrysoptera |
demersal |
|
|
Sparidae |
Calamus sp. |
demersal |
|
Sciaenidae |
Bairdiella chrysoura |
demersal |
|
Cynoscion arenarius |
demersal |
|
|
C. nothus |
demersal |
|
|
Micropogonias undulatus |
demersal |
|
|
Labridae |
Halichoeres bivittatus |
demersal |
|
Gobiidae |
Awaous banana |
bentopelágico |
|
Trichiuridae |
Trichiurus lepturus |
bentopelágico |
|
Paralichthyidae |
Cyclopsetta chittendeni |
nerítico/demersal |
|
Tetraodontidae |
Sphoeroides |
demersal |
Tabla 3
Especies y valores obtenidos para frecuencia de aparicion (% FA), porcentaje numerico (% N) y el índice de importancia geometrico (IIG).
|
Especies |
% FA |
% N |
IIG |
|
Fam. Ariidae |
50 |
56.15 |
75 |
|
C. arenarius |
43 |
0.78 |
31 |
|
C. nothus |
43 |
0.66 |
31 |
|
M. undulatus |
36 |
0.82 |
26 |
|
E. gula |
14 |
20.17 |
24 |
|
O. beta |
29 |
1.75 |
21 |
|
D. auratus |
29 |
1.52 |
21 |
|
B. chrysoura |
29 |
1.13 |
21 |
|
C. melanopus |
29 |
0.31 |
20 |
|
S. testudineus |
29 |
0.19 |
20 |
|
M. cephalus |
21 |
0.93 |
16 |
|
A. banana |
21 |
0.27 |
15 |
|
C. chittendeni |
7 |
11.45 |
13 |
|
E. jonesii |
14 |
0.62 |
11 |
|
C. edentulus |
14 |
0.35 |
10 |
|
T. lepturus |
14 |
0.31 |
10 |
|
C. paralellus |
14 |
0.27 |
10 |
|
C. undecimalis |
14 |
0.08 |
10 |
|
D. rhombeus |
14 |
0.08 |
10 |
|
H. plumierii |
14 |
0.08 |
10 |
|
No identificado |
14 |
0.08 |
10 |
|
S. marina |
14 |
0.08 |
10 |
|
H. aurolineatum |
7 |
0.74 |
6 |
|
A. cayorum |
7 |
0.66 |
6 |
|
C. chrysoptera |
7 |
0.19 |
5 |
|
A. mitchilli |
7 |
0.08 |
5 |
|
C. chrysurus |
7 |
0.08 |
5 |
|
L. griseus |
7 |
0.08 |
5 |
|
Calamus sp. |
7 |
0.04 |
5 |
|
E. saurus |
7 |
0.04 |
5 |
Cabe señalar que este estudio se realizó únicamente con ejemplares que vararon muertos y de los cuales se desconocen las causas de muerte, por lo que de los 31 varamientos atendidos, solamente 14 ejemplares tuvieron presencia de contenido estomacal. Se ha propuesto que los estudios con cadáveres de mamíferos acuáticos no son representativos (Dunshea et al., 2013; Hernández-Millán et al., 2015); sin embargo, cada varamiento es un evento único y la información obtenida ha resultado relevante en muchos de los casos.
En este trabajo las variables que fueron comparadas (sexo, clase de edad y temporada climática) no presentaron diferencias significativas. Específicamente en la categoría de sexo, la mayor frecuencia la presentaron ejemplares machos (64%) por lo que no se pudo hacer una comparación representativa, pues el número de hembras analizadas fue relativamente bajo en comparación con los machos (2 hembras, 36%), sin embargo, Hernández-Millán et al., (2015) señalan que a pesar de tener un número de muestra pequeño (n = 10), lograron obtener diferencias significativas entre sexos. Pate y McFee (2012), en 82 estómagos analizados, no encontraron diferencias estadísticas significativas entre las especies consumidas, el número de presas y el peso del alimento, lo que indica que el número de muestra no siempre es un factor determinante que permita encontrar diferencias.
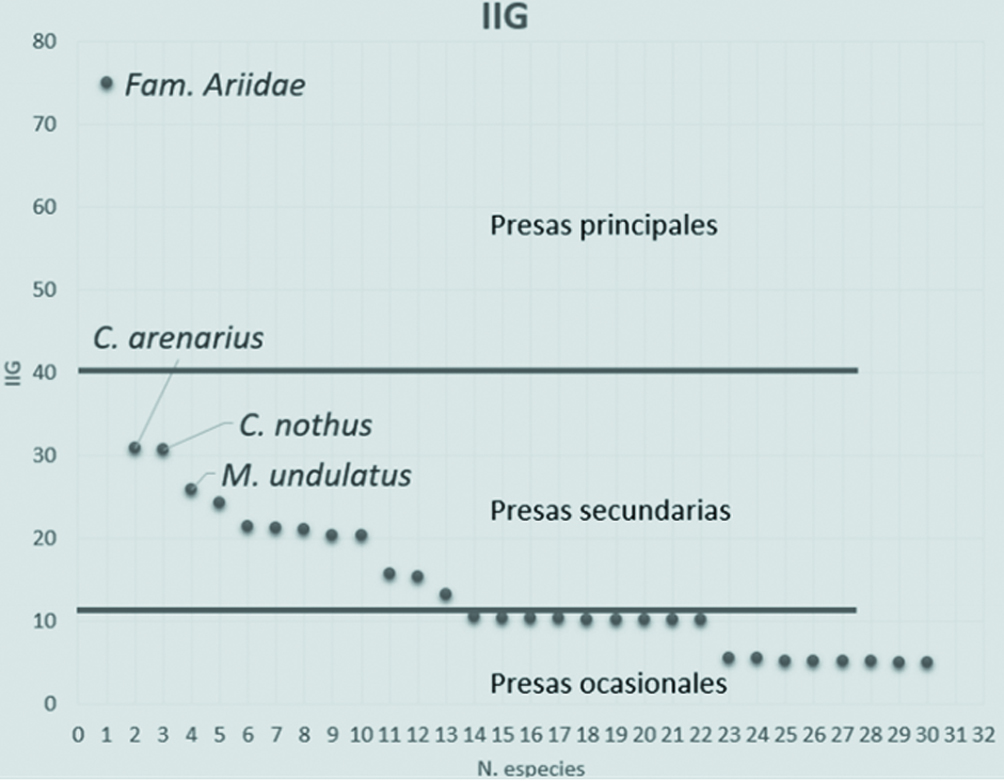
En los resultados del IIG, la familia Ariidae; fue la principal presa en la alimentación de las toninas. Esta familia es reconocida por tener la mayor abundancia en el ecosistema laguna de Términos (Yáñez-Arancibia et al., 1988).
En lo que respecta al análisis de contenidos estomacales previos de la especie T. truncantus, la familia Ariidae no se ha presentado como importante en la alimentación. Actualmente, solo existe un trabajo de investigación basado en evidencia de interacción de bagres con T. truncatus (Ronje et al., 2017), en el cual se describe la estrategia de decapitación y el desecho de la región cefálica de los peces por parte de las toninas. Además, el estudio menciona que los grupos de toninas que realizan esta estrategia son manadas únicas, lo que pareciera ser que se trata de una conducta transmitida de generación en generación dentro de la manada.
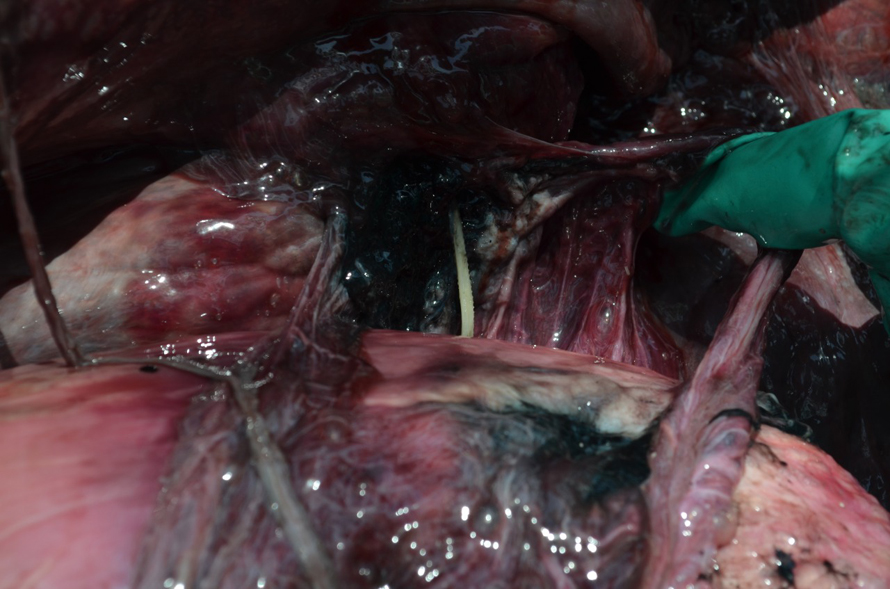
Dentro de la laguna de Términos mediante avistamiento directo sobre la conducta de alimentación de toninas silvestres, se ha observado a algunas manadas evitar la ingesta completa de estos peces, consumiendo solo la parte caudal dejando la región cefálica flotando, lo que podría subestimar la representación en el consumo de estos peces. Sin embargo, al igual que en el estudio de Ronje et al. (2017) se demuestra cómo no todas las toninas realizan esta misma estrategia de decapitación de peces, al encontrarse los otolitos de peces de la familia Ariidae (bagres) como parte del contenido estomacal. Además, ya se tienen registros de afectaciones por ingesta de estos peces en toninas que han varado en las costas de Florida (Ronje et al., 2017), así como también en las costas de Isla del Carmen (fig. 5), en donde se ha visto que las espinas de los bagres han perforado las cavidades gástricas, pudiendo estar relacionados, en algunos casos, con la muerte “natural” de los ejemplares varados.
Los cetáceos, de manera general, utilizan la ecolocalización como una estrategia de alimentación (Jensen et al., 2009). Específicamente T. truncatus, la más estudiada, se caracteriza por combinar la ecolocalización pasiva (Giacomo et al., 2015) y activa, lo cual significa que escuchan a las presas de manera pasiva y posteriormente las localizan de manera activa (Branstetter y Mercado, 2006). Las evidencias de esta estrategia se han registrado en trabajos como los de Barros y Odell (1990), Berens et al. (2010) y Dunshea et al. (2013) para toninas, y de Pérez-Cortez et al. (1996) para la vaquita Phocoena sinus.
Los peces de la famila Sciaenidae, también conocidos como roncadores por ser peces que emiten sonidos, resultaron como especies secundarias en la alimentación de las toninas y podrían estar jugando un papel importante en su alimentación debido a la fácil detección, aunado a que son muy comunes dentro de la laguna de Términos (Ayala-Pérez et al., 2015). Diversos estudios de contendidos estomacales como los ya mencionados, indican que las especies de la familia Sciaenidae son los de mayor dominancia, como en la laguna de los Patos en Brasil (Castello y Junín, 2008).
Tursiops truncatus ha mostrado diferentes técnicas o estrategias de alimentación (Connor, Wells et al., 2000; Nowacek, 2002; Torres y Read, 2009). Pueden vararse voluntariamente luego de haber conducido a los peces hasta la playa (Duffy-Echevarría et al., 2008; Gisburne y Connor, 2015; Silber y Fertl, 1995), utilizar esponjas como protección en el rostro para obtener peces escondidos bajo rocas (Patterson y Mann, 2011), usar a moluscos como herramienta de alimentación e ingesta (Allen et al., 2011), golpear con la aleta caudal en aguas somera de zonas de camas de pastos marinos para lograr que los peces salgan de su refugio (Connor, Heithaus et al., 2000).
Los resultados obtenidos con el método Amundsen (1996), permiten comprobar como esta especie es capaz de explotar de diferentes formas los recursos que se encuentren disponibles, las toninas incluidas en este estudio presentaron una estrategia alimentaria de tipo generalista, similar a lo registrado por Giménez et al. (2017); es decir, las toninas presentan una dieta más generalizada y con una variación individual, incrementando la diversidad de presas consumidas.
Las especies Diapterus auratus, Opsanus beta y Sphoeroides testudineus fueron, en tercer lugar, las especies de mayor frecuencia, encontrándose en 4 estómagos diferentes cada una. Dichas especies ya han sido registradas como parte de la dieta de las toninas en trabajos realizados en Florida (Barros et al., 1990; Dos-Santos et al., 2007), sin embargo, no han sido mencionados como importantes.
El mayor número de especies ícticas identificadas se registró en los 5 varamientos ocurridos durante la temporada de nortes con un total de 24 especies, seguido por la temporada de lluvias (6 varamientos) donde se identificaron 18 especies. Este resultado pudiera estar relacionado con lo mencionado por Yáñez-Arancibia et al. (1988) y Ayala-Pérez et al. (2015) quienes encontraron que, para estas mismas temporadas, hubo mayor cantidad de especies de peces, utilizando el sistema lagunar como sitio de alimentación. En este trabajo durante la temporada de secas se presentó la menor diversidad con un total de 11 especies identificadas.
Con los resultados obtenidos se comprobó que las estrategias alimentarias de las toninas T. truncatus son de tipo generalista, presentando preferencia por especies demersales y pelágicas, mientras que en otros estudios se han considerado de tipo oportunista, corroborando que las estrategias alimenticias de las toninas pueden cambiar de acuerdo al hábitat en que se encuentren.
Las presas principales de las que se alimenta T. truncatus en laguna de Términos pertenecen a las familias Ariidae y Sciaenidae, quienes presentaron la mayor frecuencia en los contenidos estomacales.
La realización de estudios de contenidos estomacales en animales marinos, como los cetáceos derivados de varamientos, representan una importante oportunidad para generar conocimiento de la relación (depredador-presa) de estos delfines con los recursos del medio en el que habitan, permitiendo conocer interacciones que no es posible ver a través de avistamientos; gracias a esto, fue posible determinar la importancia que tiene la familia Ariidae en la alimentación de los delfines de Laguna de Téminos.
De manera general, una limitante para la realización de este tipo de estudios es el hecho de que los varamientos son eventos que ocurren de manera esporádica; sin embargo, se recomienda que sin importar el grado de descomposición que tengan los organismos, se haga la revisión de las cavidades gástricas debido a que los otolitos, que se utilizan para identificación de las especies, resisten la degradación mecánica y química y proporcionan información importante.
Agradecimientos
Al Centro de Investigación de Ciencias Ambientales (CICA) especialmente a Amparo Rodríguez y a su equipo de trabajo. A los integrantes de la Red Universitaria de Atención a Varamientos de Mamíferos Acuáticos, especialmente a Zayra N. Jiménez Cuervo. Al laboratorio de Conservación de la Biodiversidad, Unidad Multidisciplinaria de Docencia e Investigación Sede Parque Científico, Facultad de Ciencias UNAM, a cargo de Alfredo Gallardo Torres. A Laura E. Vázquez Maldonado por todo el apoyo durante la realización de este trabajo. La recolecta de muestras de toninas varadas se amparó con los permisos de colecta científica otorgados por la DGVS-SEMARNAT: SGPA/DGVS/08666/14, SGPA/DGVS/05358/16.
Referencias
Allen, S. J., Bejder, L. y Krützen, M. (2011). Why do Indo-Pacific bottlenose dolphins (Tursiops sp.) carry conch shells (Turbinella sp.) in Shark Bay, Western Australia? Marine Mammal Science, 27, 449–454. https://doi.org/10.1111/j.1748-7692.2010.00409.x
Amundsen, P. A., Gabler, H. M. y Stalduick, F. J. (1996). A new approach to graphical analysis of feeding strategy from stomach contents data modification of the Costello (1990) method. Journal of Fish Biology, 48, 607–614. https://doi.org/10.1111/j.1095-8649.1996.tb01455.x
Assis, C. A. (1996). A generalized index for stomach contents análisis on fish. Scientia Marina, 60, 385–389.
Ayala-Pérez, L. A., Ramos-Miranda, J., Flores-Hernández, D., Sosa-López, A. y Martínez-Romero, G. E. (2015). Ictiofauna marina y costera de Campeche. San Francisco de Campeche, Campeche: Universidad Autónoma de Campeche/ Unversidad Autónoma Metropolitana-Xochimilco.
Barros, B. N. y Odell, K. D. (1990). Food habits of Bottlenose dolphin in the Southeastern United States. En S. Leatherwood y R. Reeves (Eds.), The Bottlenose dolphin (pp. 309–328). San Diego, California: Academic Press. https://doi.org/10.1016/b978-0-12-440280-5.50020-2
Berens, E. J., Gannon, D. P., Barros, B. N. y Wells, R. (2010). Prey selection by resident common bottlenose dolphins (Tursiops truncatus) in Sarasota Bay, Florida. Marine Biology, 157, 931–942. https://doi.org/10.1007/s00227-009-1371-2
Bräger, Z., Gonzalvo, J., Agazzi, S. y Bearzi, G. (2016). Identification of Bottlenose dolphin (Tursiops truncatus) prey using fish scale analysis. Aquatic Mammals, 42, 63–73. https://doi.org/10.1578/am.42.1.2016.63
Branstetter, B. K. y Mercado, E. III. (2006). Sound localization by Cetaceans. International Journal of Comparative Psychology, 19, 26–61.
Castello, H. P. y Junín, M. (2008). Un etograma parcial y estudios de los hábitos alimentarios del delfín, Tursiops truncatus (Cetacea, Delphinidae) en el estuario de la Laguna de los Patos, RS, Brasil, Revista de la Universidad Maimónides Las Ciencias, 1, 37–53.
Chávez-Martínez, K. (2017). Interacción entre el tursión (Tursiops truncatus) y la pesca artesanal de Alvarado, Veracruz, en función de la captura, calidad nutricional y composición isotópica de la comunidad de peces (Tesis de Maestría en Ciencias). Centro de Investigación Científica y de Educación Superior de Ensenada, Baja California.
Connor, R. C., Heithaus, M. R., Berggren, P. y Miksis, J. L. (2000). “Kerplunking”: surface fluke-splashes during shallow-water bottom foraging by bottlenose dolphins. Marine Mammal Science, 16, 646–653. https://doi.org/10.1111/j.1748-7692.2000.tb00959.x
Connor, R. C., Wells, R. S., Mann, J. y Read, A. J. (2000). The bottlenose dolphin: social relationships in a fission-fusion society. En J. Mann, R. C. Connor, P. L. Tyack y H. Whitehead (Eds.), Cetacean societies: field studies of bottlenose dolphins and whales (pp. 91–126). Chicago: University of Chicago Press.
DOF (Diario Oficial de la Federación). (2014). Acuerdo mediante el cual se expide el Protocolo de atención para varamiento de mamíferos marinos. Agosto, 2015, disponible en: http://dof.gob.mx/nota_detalle.php?codigo=5348898&fecha=17/06/2014
Dos Santos, M. E., Coniglione, C. y Louro, S. (2007). Feeding behaviour of the bottlenose dolphin, Tursiops truncatus (Montagü, 1821) in the Sado estuary, Potugal, and review of its prey species, Revista Brasileira de Zoociëncias, 9, 3–39.
Duffy-Echevarría, E. E., Connor, R. C., y St. Aubin, D. J. (2008). Observations of strand-feeding behavior by bottlenose dolphins (Tursiops truncatus) in Bull Creek, South Carolina. Marine Mammal Science, 24, 202–206. https://doi.org/10.1111/j.1748-7692.2007.00151.x
Dunshea, G., Barros, B. N., Berens-McCabe, E. J., Gales, N. J., Hindell, M. A., Jarman, S. N. et al. (2013). Stranded dolphin stomach contents represent the free-ranging population’s diet. Biology Letters, 9, 20121036. http://dx.doi.org/10.1098/rsbl.2012.1036
Froese, R. y Pauly, D. (Editors). (2018). FishBase. World Wide Web electronic publication. Disponible en: www.fishbase.org
Gallardo-Torres, A., Badillo-Alemán, M., Rivera-Félix, V., Rubio-Molina, J., Galindo-de Santiago, C., Loera-Pérez, J. et al. (2014). Catálogo de peces de la costa norte de Yucatán, segunda edición. Mérida: Universidad Nacional Autónoma de México.
García-Godos, N. I. (2001). Patrones morfológicos del otolito Sagitta de algunos peces óseos del mar Peruano. Boletín Instituto del Mar de Perú, 20, 1–2.
Giacomo, G., Whitlow, W. L. A. y Anna, N. (2015). Differences in foraging activity of deep sea diving odontocetes in the Ligurian Sea as determined by passive acoustic recorders. Deep-Sea Research Part I. Amsterdam: Elsevier. http://dx.doi.org/10.1016/j.dsr.2015.10.002
Giménez, J., Marcelo, A., Ramírez, F., Verborgh, P., Gauffier, P. y Esteban, R. (2017). Diet of bottlenose dolphins (Tursiops truncatus) from the Gulf of Cadiz: insights from stomach content and stable isotope analyses. Plos One, 12, e0184673. https://doi.org/10.1371/journal. pone.0184673
Gisburne, T. J. y Connor, R. C. (2015). Group size and feeding success in strand-feeding bottlenose dolphins (Tursiops truncatus) in Bull Creek, South Carolina. Marine Mammal Science, 31, 1252–1257. https://doi.org/10.1111/mms.12207
Gladilina, E. V. y Gol’din, P. (2014). New prey fishes in diet of black sea bottlenose dolphins, Tursiops truncatus (Mammalia, Cetacea). Vestnik Zoologii, 48, 83–92. https://doi.org/10.2478/vzoo-2014-0009
Hernández-Millán, G., Berrow, S., Begoña-Santos, M., Reid, D. y Rogan, E. (2015). Insights into trophic ecology of bottlenose dolphins (Tursiops truncatus) in Irish Waters. Aquatic Mammals, 41, 226–239. https://doi.org/10.1578/am.41.2.2015.226
Jaramillo-Londoño, A. M. (2009). Estudio de la biología trófica de cinco especies de peces bentónicos de la costa de Cullera. Relaciones con la acumulación de metales pesados (Tesis doctoral). Universidad Politécnica de Valencia, España
Jensen, F. H., Bejder, L., Wahlberg, M. y Madsen, P. T. (2009). Biosonar adjustments to target range of echolocating bottlenose dolphins (Tursiops sp.) in the wild. The Journal of Experimental Biology, 212, 1078–1086. https://doi.org/10.1242/jeb.025619
Lewis, J. S. (2003). Mud plume feeding, a unique foraging behaviour of the bottlenose dolphin in the Florida Keys. Gulf of Mexico Science, 1, 92–97. https://doi.org/10.18785/goms.2101.09
Lombarte, A., Chic, Ò., Parisi-Baradad, V., Olivella, R., Piera, J y García-Ladona, E. (2006). A web-based environment from shape analysis of fish otoliths. The AFORO database. Scientia Marina, 70, 147–152. https://doi.org/10.3989/scimar.2006.70n1147
McEachran, J. D. y Fechhelm, J. D. (2005). Fishes of the Gulf of México, Volume 2. Austin: University of Texas Press.
Morquecho-León, M. R. K. (2016). Caracterización morfológica de los otolitos Sagittae del Atlántico mexicano, según su forma de vida (Tesis). Universidad Nacional Autónoma de México, México D.F.
Niño-Torres, C. A., Urbán-Ramírez, J. y Vidal, O. (2011). Mamíferos marinos del golfo de California: guía ilustrada. Publicación especial Núm.2. México D.F.: Alianza WWF/ México-Telcel.
Nowacek, D. P. (2002). Sequential foranging behaviour of bottlenose dolphins, Tursiops truncatus, in Sarasota Bay, Fl. Behaviour, 139, 1125–1145. https://doi.org/10.1163/15685390260437290
Pate, S. M. y McFee, W. E. (2012). Prey species of bottlenose dolphins (Tursiops truncatus) from South Carolina Waters. Southeastern Naturalist, 11, 1–22. https://doi.org/10.1656/058.011.0101
Patterson, E. M. y Mann, J. (2011). The ecological conditions that favor tool use and innovation in wild bottlenose dolphins (Tursiops sp.). Plos One, 6, e22243. https://doi.org/10.1371/journal.pone.0022243
Pérez-Cortez, H., Silber, H. G. K. y Villa, R. B. (1996). Contribución al conocimiento de la alimentación de la vaquita, Phocoena sinus. INP. SEMARNAP. Ciencia Pesquera, 13, 66–72.
Pugliares, R. K., Bogomolni, A., Touhey, M. K., Herzig, M. S., Harry, T. C. y Moore, J. M. (2007). Marine mammal necropsy: and introductory guide for stranding responders and field biologists. Technical Report. Woods Hole, Massachusetts: Woods Hole Oceanographic Institute. https://doi.org/10.1575/1912/1823
Robertson, D. R., Peña, E. A., Posada, J. M. y Claro, R. (2015). Peces costeros del Gran Caribe: sistema de información en línea. Versión 1.0 Instituto Smithsonian de Investigaciones Tropicales, Balboa, República de Panamá. Disponible en: https://biogeodb.stri.si.edu/caribbean/es/pages
Ronje, E. I., Barry, K. P., Sinclair, C., Grace, M. A., Barros, B. N., Allen, J. et al. (2017). A common bottlenose dolphin (Tursiops truncatus) prey handling technique for marine catfish (Ariidae) in the northern Gulf of México. Plos One, 12, e0181179. https://doi.org/10.1371/journal.pone.0181179
Silber, G. K. y Fertl, D. (1995). Intentional beaching by bottlenose dolphins (Tursiops truncatus) in the Colorado River Delta, México. Aquatic Mammals, 21, 183–186.
Torres, L. G. y Read, A. J. (2009). Where to catch a fish? The influence of foraging tactics on the ecology of bottlenose dolphins (Tursiops truncatus) in Florida Bay, Florida. Marine Mammal Science, 25, 797–815. https://doi.org/10.1111/j.1748-7692.2009.00297.x
UICN (Unión Internacional para la Conservación de la Naturaleza). (2019). The IUCN Red List of Threatened Species. Version 2018-2. http://www.iucnredlist.org
Volpedo, A. V. y Vaz-Dos Santos, A. M. (2015). Métodos de estudios con otolitos: principios y aplicaciones/ Métodos de estudos com otólitos: princípios e aplicações. Ciudad Autónoma de Buenos Aires: Instituto de Investigaciones en Producción Animal, Universidad de Buenos Aires.
Wells, S. R. y Scott, M. D. (2009). Common Bottlenose dolphin Tursuiops truncatus. En W. F. Perrin, B. Würsig y J. G. M. Thewissen (Eds.), Encyclopedia of marine mammals, Second Edition (pp. 249–255). San Diego, CA: Acadenmic Press. https://doi.org/10.1016/b978-0-12-804327-1.00072-8
Yáñez-Arancibia, A., Lara-Domínguez, A. L., Sánchez-Gil, P. y Álvarez-Guillén, H. (1988). Evaluación ecológica de las comunidades de peces en la Laguna de Términos y la sonda de Campeche. En A. Yáñez-Arancibia y J. W. Day Jr. (Ed.), Ecología de los ecosistemas costeros en el sur del golfo de México: la región de la Laguna de Términos (pp 323–356). México D.F.: Instituto de Ciencias del Mar y Limnología, UNAM/ Coast. Ecol. Inst. LSU.
Yáñez-Arancibia, A., Lara-Domínguez, A., L., Sánchez-Gil, P., Vargas-Maldonado, I., García-Abad, M., Álvarez-Guillen, H. et al. (1985). Ecología y evaluación de comunidades de peces en ecosistemas costeros: interacciones estuario-plataforma en el sur del Golfo de México. En A. Yáñez-Arancibia (Ed.), Fish community ecology in estuaries and coastal lagoons: (pp. 475–498). México D.F.: Universidad Nacional Autónoma de México.



