Ek del-Val a, b, Ana María Flores-Gutiérrez a, Angélica Obregón-Ochoa c y Horacio Paz a, d, *
a Universidad Nacional Autónoma de México, Instituto de Investigaciones en Ecosistemas y Sustentabilidad, Antigua Carretera a Pátzcuaro Núm. 8701, Col. Ex-Hacienda de San José de La Huerta, 58190 Morelia, Michoacán, México
b University of California-Santa Cruz, Department of Environmental Studies, 1156 High Street, Santa Cruz CA 95064, EUA
c Universidad Nacional Autónoma de México, Centro de Investigaciones en Geografía Ambiental, Antigua Carretera a Pátzcuaro Núm. 8701, Col. Ex-Hacienda de San José de La Huerta, 58190 Morelia, Michoacán, México
d University of California, Berkeley, Department of Integrative Biology & Center for Stable Isotope Biogeochemistry, 3040 Valley Life Sciences Bldg., Berkeley, CA 94720-3140 EUA
*Autor para correspondencia (hpaz@iies.unam.mx) (H. Paz)
Recibido: 6 enero 2022; aceptado: 15 junio 2022
Resumen
Las islas mexicanas representan un reservorio de biodiversidad importante que se encuentra amenazado por el cambio global. En épocas recientes, la isla Socorro, archipiélago Revillagigedo ha experimentado importantes pertubaciones tales como brotes poblacionales de la langosta centroamericana (Schistocerca piceifrons). En este estudio se evaluó la abundancia poblacional de la langosta en la isla Socorro y su efecto sobre la vegetación nativa, además, se exploró la relación de la abundancia anual histórica con variables climáticas. Se realizaron muestreos de S. piceifrons en 25 parajes con diferentes tipos de vegetación, en la temporada de lluvias y secas de 2018. También se evaluó el daño por herbívoros sobre las especies de plantas comunes. No se observaron mangas de S. piceifrons y las langostas fueron más abundantes en lluvias. Los niveles de herbivoría fueron bajos (< 7%). Se detectó que la abundancia de langostas se asocia con años en los cuáles se presentan temperaturas moderadas y alta humedad atmosférica. Debido a que en años anteriores se ha reportado una población numerosa de S. piceifrons, se recomienda monitorear periódicamente su abundancia; sin embargo, dada la situación actual, no se considera que deban llevarse a cabo acciones de control sobre las langostas.
Palabras clave: Especie invasora; Herbivoría; Herbívoro; Archipiélago Revillagigedo; Vulnerabilidad
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Centro American locust (Schistocerca piceifrons) population in Socorro Island and its impact on vegetation
Abstract
Mexican islands are an important biodiversity reservoir that is threatened by the introduction of invasive exotic species. In recent times, Socorro island, Revillagigedo Archipelago, has experienced significant environmental disturbances including population outbreaks from the Centro American locust (Schistocerca piceifrons). Since S. piceifrons can cause significant damage on native plants, the present study evaluated the population status of S. piceifrons at Socorro island and its effect upon native vegetation. Also, we evaluated historic annual locust abundance in relation to climatic variables in the island. We sampled S. piceifrons in 25 island sites with different vegetation types, once during the dry season and once in the rainy season of 2018. We also evaluated herbivory on most common plants. We did not observe any S. piceifrons gregarious behavior and solitary locusts were more abundant during the rainy season. Herbivory levels were low (< 7%). We detected that locust abundance was associated to moderate temperature years with high atmospheric humidity. Since outbreaks have been reported previously, we recommend continuing locust monitoring, however current situation does not suggest to start any control measures on S. piceifrons populations.
Keywords: Invasive species; Herbivory; Herbivore; Revillagigedo Archipelago; Vulnerability
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introduction
Las islas son sistemas ecológicos con alto valor en biodiversidad, ya que albergan un número importante de especies endémicas en el mundo (Kier et al. 2009). En México, si bien las islas suman menos de 1% del territorio, albergan el 8% de las especies de vertebrados reportadas para el país de las cuáles 3.7% son endémicas, así como 120 especies de plantas endémicas (Aguirre-Muñoz et al., 2018). Estos sistemas son altamente vulnerables a los efectos negativos de las actividades antropogénicas, vía la pérdida de los hábitats naturales y por la introducción de especies invasoras, factores que pueden hacer sinergia (Aguirre-Muñoz et al., 2016).
Las langostas voladoras son insectos que han despertado gran interés en la comunidad científica, debido a la creciente evidencia de picos poblacionales que consumen fracciones importantes de la productividad vegetal, principalmente en sistemas agrícolas, pero también en sistemas naturales y estas explosiones demográficas han sido documentadas históricamente (Bennett, 1975; Peng et al., 2020). Su distribución en el mundo tropical se ha extendido, tanto en ambientes continentales como insulares, por lo que entender su biología y comportamiento ecológico resulta estratégico para la seguridad alimentaria y para la conservación de la biodiversidad (Barrientos-Lozano et al., 2021).
Los efectos ambientales causados por los picos poblacionales de herbívoros generalistas pueden ser particularmente drásticos en las islas, en donde los procesos de recolonización de la vegetación están limitados y en donde desequilibrios en los mecanismos de regulación poblacional pueden resultar en la extinción local de especies (Kaiser-Bunbury et al., 2010; Latchininsky, 2008; Smith-Ramírez et al., 2017).
En América, una de las especies más conocidas es la langosta del caribe, Schistocerca piceifrons (Walker, F., 1870), cuya presencia en México se reporta en regiones del trópico seco como Yucatán, la costa del Pacífico, y también en varias islas como es el caso del archipiélago de Revillagigedo (Barrientos-Lozano et al., 2021).
En la isla Socorro, en años recientes, el reporte de picos poblacionales y la presencia de fases gregarias de dicha especie han provocado preocupación por su potencial efecto sobre la vegetación de la isla y el mantenimiento de su biodiversidad (Cano-Santana et al., 2006, Song et al., 2006).
De acuerdo con Song et al. (2016), la isla Socorro históricamente fue invadida por 2 especies de langostas del género Schistocerca las cuales parecen ocupar diferentes zonas de la isla, sin embargo, existen vacíos de información que impiden rastrear la historia de colonización con mayor detalle. Schistocerca nitens se distribuye en la zona media del volcán Evermann, y S. piceifrons ocupa las bajas elevaciones hasta la cima del volcán y es poco común en los bosques. Una tercera especie (S. americana socorro), que se propone como endémica solo está presente en los bosques.
Las langostas son especies polifénicas que presentan una fase solitaria y una gregaria; los cambios de una fase a otra se asocian con incrementos en la densidad de la población debido a cambios ambientales, una vez que entran en fase gregaria, las langostas presentan cambios físicos, de comportamiento, fisiológicos y alimenticios (Simpson et al., 1999). Al volverse gregarias se asocian en grupos conocidos como mangas y se estima que una manga puede llegar a tener hasta 150 millones de individuos por km2, lo cual puede representar una gran amenaza para las especies vegetales (Song et al., 2006). En la isla Socorro, se han reportado eventos de brotes poblacionales acompañados por la observación de conductas gregarias (mangas) en múltiples ocasiones, particularmente a partir de 1993 (Hanna, 1926; Song et al., 2006). En el estudio más reciente, Cano et al. (2006) pudieron observar 17 mangas de langostas y llegaron a la conclusión de que las langostas no parecían presentar un problema importante para la vegetación de la isla Socorro, dado que el nivel de daño estimado sobre la vegetación no rebasó 4% de la productividad total de la isla en ese año. Sin embargo, esto contrasta con observaciones previas de daños severos sobre la vegetación y con la evidencia del potencial destructivo en otros ecosistemas (Barrientos-Lozano
et al., 2021).
Dado que S. piceifrons causa daños importantes sobre cultivos y vegetación nativa en otras partes de México y del mundo, y dado que se ha encontrado que existe una sinergia positiva entre el aumento de la temperatura provocado por el cambio climático y la aparición de picos poblacionales (Peng et al. 2020), el presente estudio tuvo como objetivo evaluar el estado de la población actual de S. piceifrons en la isla Socorro y su efecto sobre la vegetación nativa.
Materiales y métodos
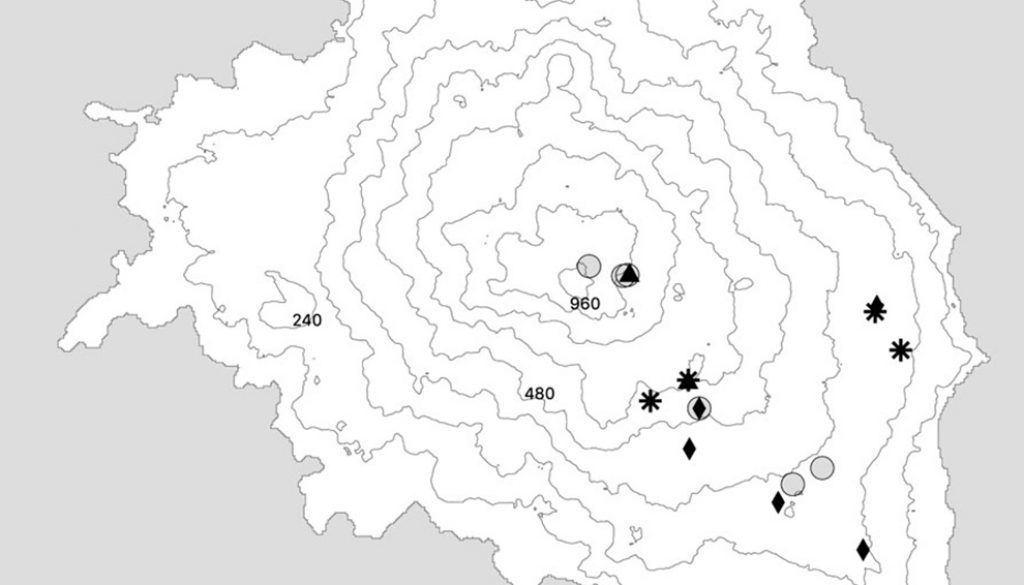
La isla Socorro forma parte de la Reserva de la Biosfera Archipiélago Revillagigedo (RBAR), está ubicada a 790 km al oeste de Manzanillo, México (18º42’28” N, 11º02’49” O; fig. 1) y representa el territorio mexicano más alejado en el Océano Pacífico. La isla Socorro es la más grande del archipiélago (140 km2) y está constituida alrededor del volcán Evermann con una altitud máxima de 1,040 m snm. La vegetación de la isla está conformada por matorral subtropical deciduo y siempreverde así como por pequeños parches de bosques tropicales (Levin y Moran, 1989). La flora y fauna de la isla comprende 117 plantas vasculares (26% endémicas), 103 especies de aves (8 endémicas) y un reptil endémico. Existen pocos estudios relacionados con la diversidad de artrópodos en isla Socorro. Palacios-Vargas et al. (1982) reportan 128 especies de artrópodos, 16 órdenes de hexápodos, arácnidos, ácaros y quilópodos. Song et al. (2006) y Cano-Santana et al. (2006) reportan la presencia de 3 especies de langostas: Schistocerca americana socorro, S. piceifrons y S. nitens. Desde hace 150 años y hasta 2009 (Ortiz-Alcaraz et al., 2019), la isla mantuvo una población abundante de borregos exóticos (Ovis aries) que consumieron activamente la vegetación, reduciendo la cobertura en 30% y provocando una erosión severa en varios lugares; como consecuencia de esta intensa herbivoría hubo una modificación importante de los hábitats (Álvarez-Cárdenas et al., 1994; Maya-Delgado et al., 1994; Walter y Levin, 2008). Después de la erradicación de los borregos las áreas erosionadas comenzaron a ser colonizadas por plantas nativas y exóticas, por lo que la isla se encuentra en un proceso de sucesión secundaria significativo (Ortiz-Alcaraz et al., 2019).
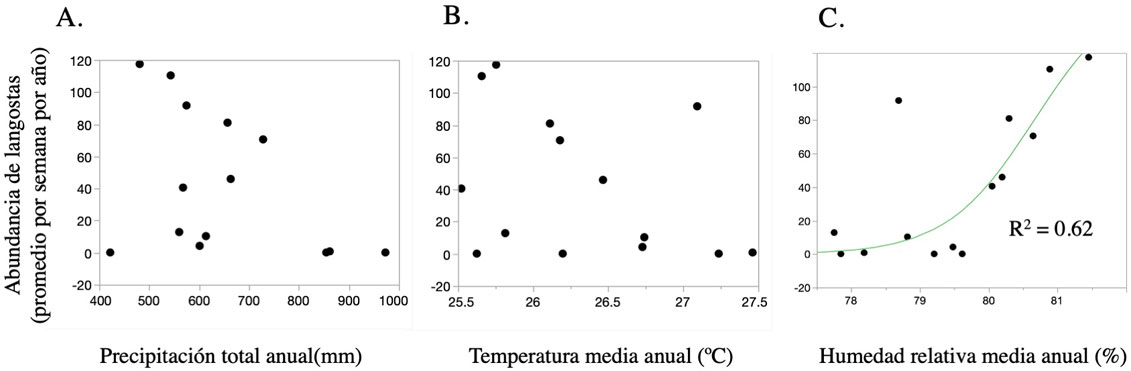
Como parte de las actividades cotidianas, el personal de la Secretaría de Marina (Semar) asentado en la isla Socorro, realiza un monitoreo semanal de la presencia de S. piceifrons en los alrededores del sector naval y en las zonas bajas al este y sureste de la isla. El monitoreo es realizado por 1 sola persona 1 día por semana y se basa en un recorrido de 5 km por la brecha entre la base naval y la pista aérea atravesando pastizales y matorrales. La persona que realiza el monitoreo estima el número total de langostas que se observan desde la brecha a ambos lados. En aquellos casos en los que el observador reportó un rango en su estimación se tomó el valor medio. Dado que en los reportes de la Semar no se especifica un área de observación, dichos datos no pudieron traducirse a densidades. Sin embargo, ya que el protocolo fue consistente entre años, decidimos analizar estos datos obtenidos entre 2003 y 2018 para identificar si existía un patrón histórico en la fluctuación de S. piceifrons en la isla. El análisis se realizó considerando el promedio de langostas reportadas por semana por año, se graficaron los datos y se evaluaron las fluctuaciones poblacionales en el periodo 2003-2018. Las semanas en la que no se llevaron a cabo monitoreos debido al mal clima y otros factores, no se consideraron para calcular los promedios anuales. Es importante aclarar, que si bien estos datos son útiles para detectar fluctuaciones poblacionales anuales, no son útiles para ubicar densidades reales.
Los datos de las variables climáticas como la temperatura (ºC), precipitación (mm) y humedad relativa (%) se obtuvieron del proyecto “POWER” del Centro de Investigación Langley de la NASA (LaRC), financiado a través del Programa de Ciencias de la Tierra/Ciencias Aplicadas de la NASA (NASA, 2021). En el criterio de selección temporal se insertó la consulta para el mismo periodo (2003-2018), con un tiempo de resolución diario para las coordenadas 18o72’59” N, 110o94’40” O correspondiente a la altitud de 103 m snm. Se seleccionaron los parámetros: temperatura de la corteza terrestre, humedad relativa del aire a 2 m (la relación entre la presión parcial real de vapor de agua y la presión parcial en saturación expresada en porcentaje) y precipitación. Finalmente, para cada año se calcularon los valores promedio diario de las temperaturas de la corteza terrestre (de aquí en adelante llamada temperatura de la superficie), así como la humedad relativa del aire y la precipitación total.
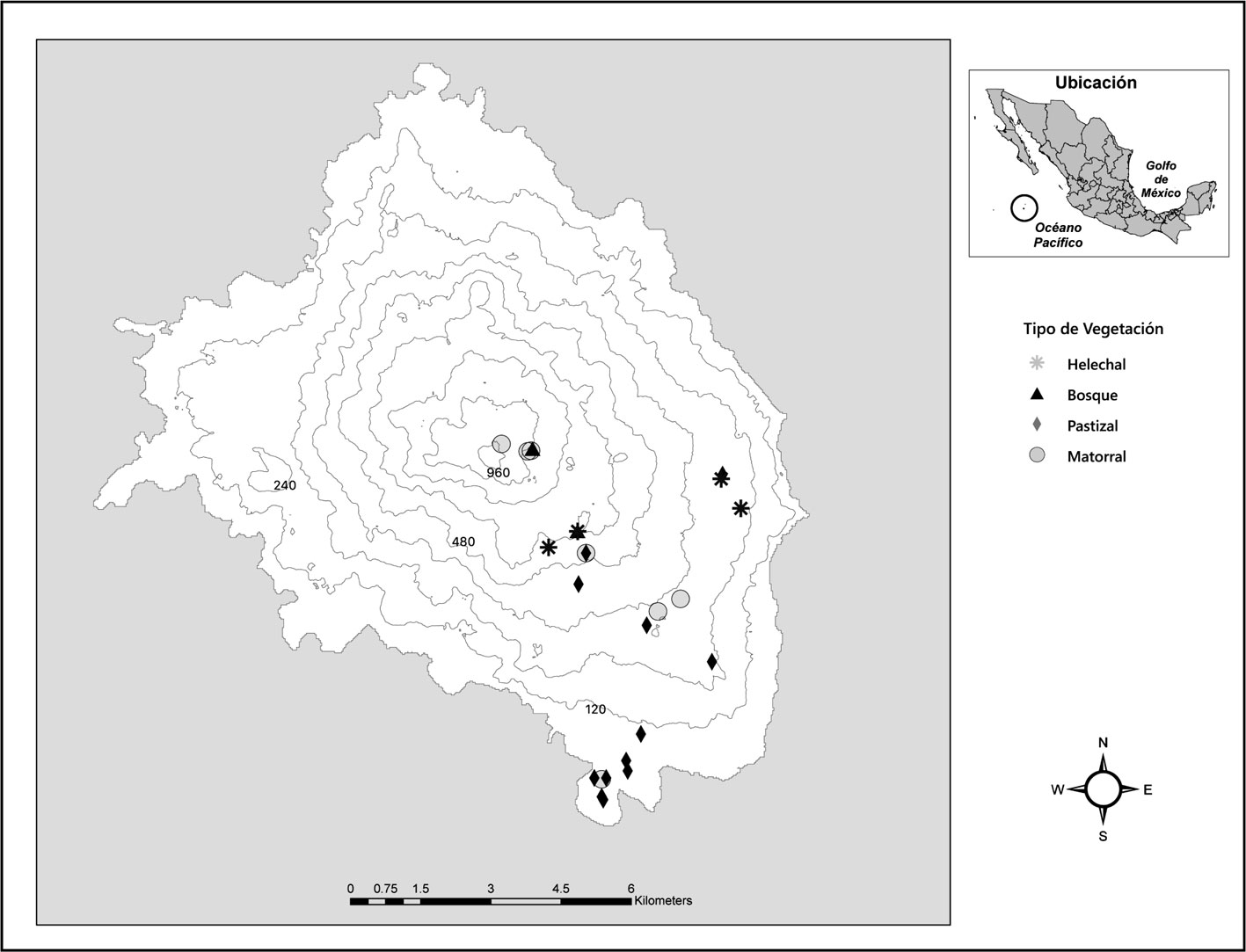
Durante 2018 se llevó a cabo una evaluación directa de la población de adultos de S. piceifrons en 2 ocasiones, durante la estación de secas y de lluvias (mayo y octubre) en 25 sitios dentro de la isla. En cada sitio, el monitoreo se llevó a cabo en 4 transectos de 2 × 50 m con una distancia de 25 m entre cada uno. En cada transecto, el conteo de langostas adultas (aladas) de S. piceifrons se realizó por 2 observadores: una persona caminaba el transecto golpeando la vegetación con una red entomológica y otra persona contaba cuantas langostas volaban conforme se iba avanzando por el transecto (modificado de Cano et al., 2006). Se contabilizaron solo las langostas presentes en los transectos. Capturas frecuentes con las redes en cada sitio permitieron verificar que se trataba de los adultos de S. piceifrons, de acuerdo a fotografías de referencia de las 3 especies publicadas por Cano-Santana et al. (2006). Para conocer la densidad de langostas por sitio se calculó la cantidad de langostas por el área muestreada. Este conteo si bien subestimó las densidades reales de langostas al no considerar las fases preadultas, fue útil para explorar las preguntas planteadas sobre la distribución espacial y estacional de las langostas en la isla.
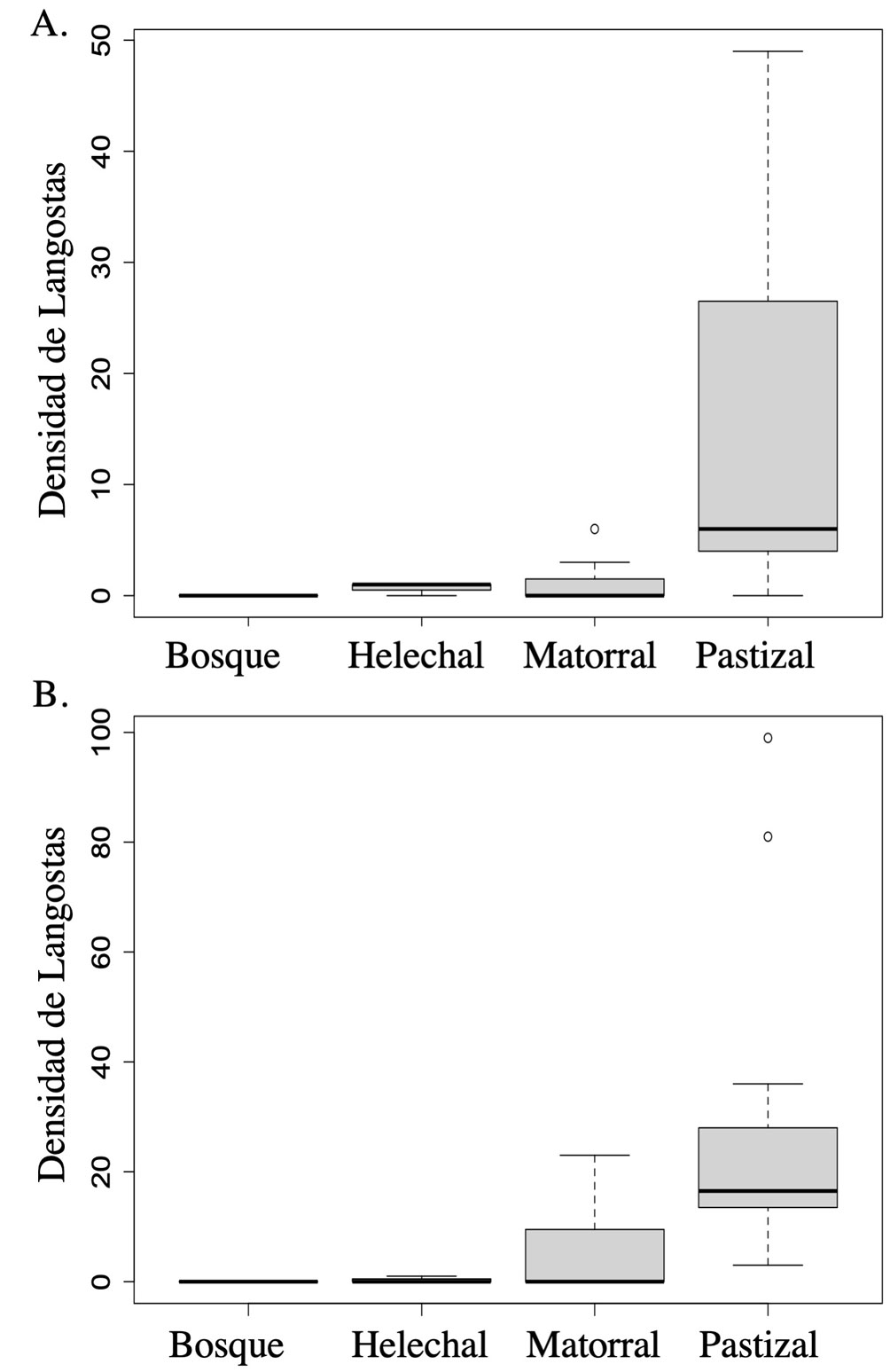
Los 25 sitios de muestreo se distribuyeron en un gradiente altitudinal que abarcó los principales tipos de vegetación de la isla: pastizal, matorral, helechal y bosque, separados por al menos 500 m entre sí (fig. 1), resultando en 12 sitios para el pastizal, 7 para el matorral, 4 para el helechal, 2 para el bosque (tabla 1).
Con el fin de determinar el daño foliar ocasionado por las langostas y otros insectos herbívoros sobre la vegetación, se eligieron entre 3 y 6 especies de plantas dominantes en cada sitio de muestreo una vez en la temporada de lluvias y una vez en la temporada de secas. Se seleccionaron 10 individuos de cada especie y se midió el porcentaje de área foliar removida en 10 hojas de cada planta, utilizando categorías de daño foliar y se calculó el porcentaje de daño por planta. Posteriormente, se calculó el índice de herbivoría por planta propuesto por Domínguez y Dirzo (1995), que representa una estimación visual del daño ocasionado en la planta por los herbívoros. Este método tiene las categorías de daño: 0, 1, 2, 3, 4 y 5, a las cuales les corresponden los rangos de porcentajes de daño: sin herbivoría, 1-5%, 6-12%, 13-25%, 26-50% y 51-100%, respectivamente. Se calculó un promedio de herbivoría por especie por sitio.
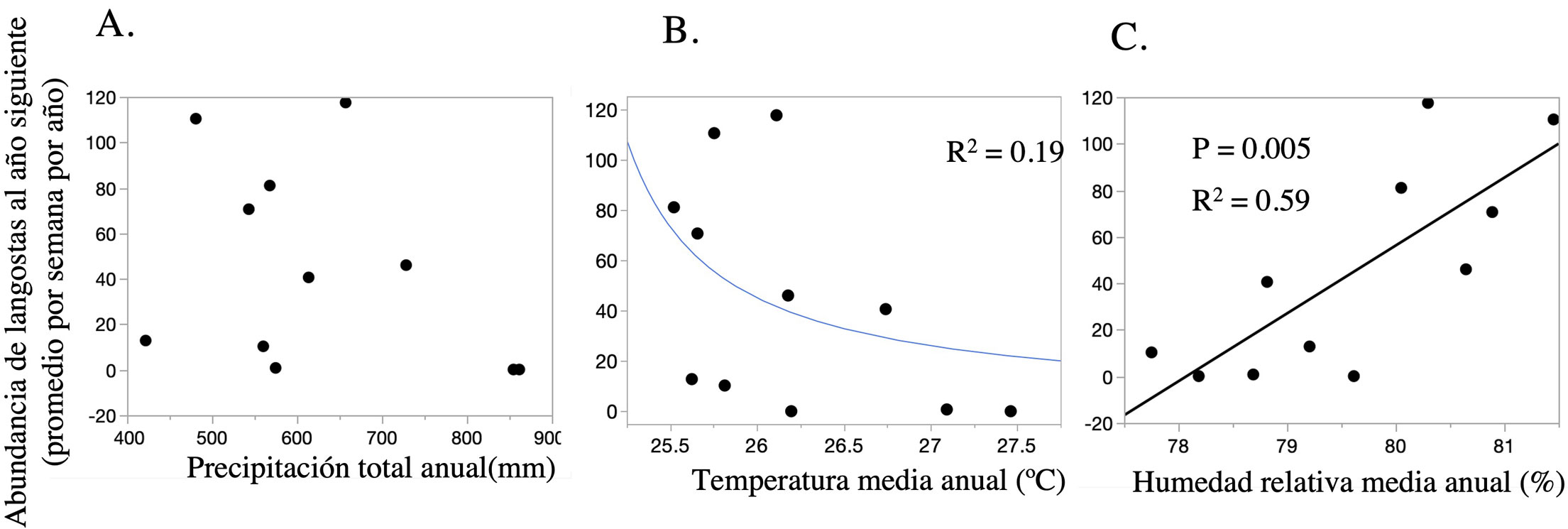
Para explorar la posible relación entre la variación poblacional de S. piceifrons reportada entre 2003 y 2018 por Semar con las variables climáticas, realizamos regresiones lineales y no lineales entre la abundancia anual de langostas y los promedios diarios por año de la precipitación, la temperatura de la superficie, y la humedad relativa del aire. En todos los casos, en primer lugar ajustamos una relación lineal y posteriormente una no lineal para decidir cuál tenía un mejor ajuste para los datos, utilizando la R2 como criterio. Dado que el esfuerzo de muestreo (número de evaluaciones de presencia de langostas por mes) difería entre años, decidimos no explorar las relaciones entre las variables climáticas a una escala intranual y únicamente utilizamos los promedios anuales para temperatura y humedad relativa, así como la precipitación total anual. Por último, para representar los nichos climáticos de S. picefrons en la Isla Socorro, graficamos la abundancia de la langosta sobre los gráficos de 2 dimensiones climáticas, considerando los pares de variables climáticas que se correlacionaron significativamente con la abundancia. Dado que las variables climáticas específicas de un año afectan el desempeño de los individuos que nacen el siguiente año (en términos de crecimiento y sobrevivencia) y su descendencia, se analizó el efecto de las variables climáticas sobre la abundancia de S. piceifrons del mismo año, así como la abundancia del año siguiente. Las regresiones se realizaron en JMP 16.0 (SAS, Inc, USA, 2018).
Tabla 1
Sitios de muestreo por tipo de vegetación y las especies que dominan en cada uno.
| Tipo de vegetación | Especies de plantas dominantes | Sitio |
| Bosque | Bumelia socorrensis T.S. Brandegee
Ilex socorroensis T.S. Brandegee |
12, 19 |
| Helechal | Pteridium caudatum L.
Dodonaea viscosa Jacq. |
4, 8, 13, 25 |
| Matorral | Croton masonii
Opuntia sp. Pasto no identificado |
3, 5, 11, 14, 20, 21, 22 |
| Pastizal | Pasto no identificado
Dodonaea viscosa Jacq. Eupatorium pacificum Robinson ex I.M. Johnst Bidens socorrensis Moran et Levin Waltheria indica L. |
1, 2, 6, 7, 9, 10, 15, 16, 17, 18, 23, 24 |
Para evaluar el efecto del tipo de vegetación (pastizal, matorral, helechal y bosque) sobre la densidad de langostas, se realizó un análisis de varianza (Andeva) de 2 vías, tomando el tipo de vegetación y la temporada como variables explicativas, y considerando al sitio como factor de anidación (medidas repetidas, siguiendo a Crawley [2012]). El dato de densidad fue transformado como log x+1. Posteriormente se evaluaron posibles efectos de la altitud sobre la densidad de langostas, esto solo para el matorral y el pastizal debido a que estos ocurren en un rango altitudinal amplio (0-600 m snm), en tanto que los otros tipos de vegetación presentan rangos muy estrechos. En este caso, para cada tipo de vegetación se empleó un modelo de covarianza (Andecova), considerando a la altitud como regresor y a la temporada como factor y al sitio como factor de anidación. Para evaluar si existían diferencias en herbivoría a nivel de la comunidad entre los diferentes tipos de vegetación, se realizó un Andeva de 2 vías similar al antes descrito para la densidad; en este caso considerando la herbivoría por planta (transformada con la raíz cuadrada del arcoseno) como la variable de respuesta y el tipo de vegetación y temporada de muestreo como variables explicativas, considerando al sitio como factor de anidación. Además, para las especies más importantes, se analizaron las diferencias en herbivoría entre temporadas con Andeva de una vía. El análisis por tipo de vegetación no fue posible, ya que con frecuencia las especies no estuvieron presentes en varios tipos de vegetación. Por último, para evaluar si los niveles de herbivoría observados para cada especie se relacionaban con la temporada del año y la densidad de langostas, se realizaron análisis de covarianza, considerando la herbivoría por especie (transformada con la raíz cuadrada del arcoseno) como variable de respuesta, la temporada como factor, la densidad de langostas por transecto como regresor y el sitio como factor de anidación. Se analizaron las 15 especies más comunes (tabla 2). Los análisis estadísticos se realizaron en el ambiente de programación R (R Core Team, 2021).
Resultados
Los datos históricos recabados por el personal de la Secretaría de Marina documentan fluctuaciones muy marcadas en las abundancias anuales de langostas en isla Socorro, las abundancias fluctuaron entre 0 y 120 individuos en promedio por semana, en particular se encontraron 2 picos de abundancia, uno en 2006 y otro en 2016 (fig. 2). Con respecto a la precipitación anual, dentro del periodo de estudio se registraron años muy secos con 400 mm y años muy húmedos con 1,000 mm. Estas variaciones en precipitación no se relacionaron con las abundancias de S. piceifrons reportadas (fig. 3A). En contraste, a pesar de que las fluctuaciones interanuales en la temperatura de la superficie y la humedad relativa diarias fueron moderadas (25.5 a 27.5 °C y 77% a 82% HR), se detectaron algunas correlaciones con la abundancia de langostas. Tomando los datos del año en cuestión, la abundancia de langostas se incrementa con la humedad relativa, mientras que no hay una tendencia clara con relación a la temperatura. En ambos casos, la alta abundancia de langostas en el 2016 representa un valor atípico (outlier) de la tendencia general, lo cual fue más notorio para el caso de la humedad relativa (fig. 3B, C). Para el caso de la humedad relativa, se observó una clara tendencia sigmoidal positiva, que se pierde por la influencia del valor de abundancia del 2016 (fig. 3). Al analizar los efectos de las variables climáticas sobre la abundancia de langostas al año siguiente se detectaron tendencias más fuertes, tanto con relación a la humedad relativa como a la temperatura (fig. 4B, C). En este caso, la abundancia de langostas se incrementa con la humedad relativa y disminuye al incrementarse la temperatura superficial observada el año anterior. Para estos análisis no se observaron valores atípicos evidentes (fig. 4). Se puede observar que las langostas se ven favorecidas por temperaturas moderadas y humedades relativas altas (fig. 5).
Tabla 2
Herbivoría por especie de planta (promedio ± EE) en 2 temporadas del año. Se muestran los valores de F, grados de libertad y p
| Especie | % Herbivoría en mayo (secas) |
% Herbivoría en octubre (lluvias) |
F (g.l.) | p |
| Ipomoea sp. | 12.0 ± 0.01 | 6.2 ± 1.8 | 4.12 (1,18) | 0.06 |
| Guettarda insularis | 7.8 ± 3.0 | 11.1 ± 1.8 | 1.14 (1,48) | 0.29 |
| Dodonea viscosa | 7.4 ± 3.0 | 9.1 ± 0.9 | 9.81 (1,186) | 0.002 |
| Croton masonii | 6.6 ± 5.0 | 14.0 ± 1.0 | 25.7 (1,138) | < 0.001 |
| Ilex socorrensis | 6.4 ± 0.7 | 5.3 ± 0.6 | 0.12 (1,48) | 0.73 |
| Bumelia socorrensis | 5.3 ± 3.4 | 2.8 ± 0.3 | 0.16 (1,48) | 0.69 |
| Psidium socorrensis | 5.1 ± 2.0 | 5.7 ± 0.6 | 0.14 (1,138) | 0.91 |
| Waltheria americana | 4.9 ± 3.7 | 7.3 ± 0.6 | 1.96 (1,288) | 0.17 |
| Senna obtusifolia | 3.1 ± 0.01 | 1.0 ± 0.4 | 3.52 (1,18) | 0.07 |
| Oreopanax xalapense | 2.6 ± 0.02 | 7.0 ± 2.3 | Muy pocos individuos | |
| Eupatorium pacificum | 2.1 ± 1.1 | 3.7 ± 0.5 | 0.02 (1,93) | 0.89 |
| Erigeron socorrensis | 1.7 ± 0.1 | 0.4 ± 0.1 | 8.32 (1,58) | 0.005 |
| Cordia curassavica | 1.1 ± 0.3 | 1.3 ± 0.4 | 1.33 (1,107) | 0.25 |
| Pteridium caudatum | 0.6 ± 0.5 | 1.2 ± 0.3 | 0.03 (1,78) | 0.86 |
| Salvia pseudomisella | 0.2 ± 0.01 | 1.3 ± 0.5 | 0.03 (1,18) | 0.87 |
En el muestreo directo realizado en 2018, encontramos durante la temporada de lluvias una densidad total de S. piceifrons de 378 individuos en 10,000 m2, mientras que durante la temporada de secas, fueron solamente 216 individuos en 10,000 m2 en total; es de resaltar que a partir de los 500 m snm no se observaron langostas. Por otro lado, encontramos que la densidad de langostas varía entre tipos de vegetación (F3,20 = 8.79, p < 0.001), siendo más abundantes en el pastizal y el matorral, y estando ausentes en el bosque y el helechal (fig. 6), y fueron más abundantes en la temporada de lluvias (F1,20 = 9.00, p = 0.007), sin evidencia de una interacción (F3,20 = 1.36, p = 0.28). Por otra parte, no se detectó relación entre la densidad de S. piceifrons y la altitud en los 2 tipos de vegetación con amplia distribución: para el pastizal (F1,10 = 0.86, p = 0.37) ni para el matorral (F1,5 = 2.25, p = 2.19), y no hubo interacción significativa con la temporada (F1,10 = 0.20, p = 0.66 para el pastizal y F1,5 = 5.7, p = 0.07 para el matorral).

Es importante hacer notar que durante 2018 no se registró la presencia de ninguna agrupación o manga de langostas, ni se observó el comportamiento gregario descrito por algunos autores en otros años (Cano-Santana et al., 2006; Song et al., 2006). Durante la temporada de lluvias, en octubre de 2018, también se identificaron 2 individuos, uno juvenil y otro adulto de la especie endémica de langostas (Schistocerca americana socorro) en una zona de matorral. Fue evidente que se trataba de individuos de la especie endémica debido a su coloración, proporción de estructuras y su longitud total, que contrasta con S. piceifrons.

Los niveles de herbivoría que presentó la vegetación arbustiva y arbórea de la isla fueron bajos y difirieron entre entre tipos de vegetación (F3,18 = 4.39, p = 0.02); el pastizal y bosque presentaron mayores niveles de daño (8.0 ±0.8% y 6.9±1.7%, respectivamente) con respecto al matorral y helechal (4.7±0.6% y 3.7±1.0%, fig. 7). Asimismo, la herbivoría difirió entre temporadas (F1,17 = 6.13, p = 0.03). Para la temporada de secas la herbivoría fue de 5.1 ± 3.2% mientras que en lluvias subió un poco a 6.9 ± 0.3% (fig. 7B). Las diferencias entre tipos de vegetación se mantuvieron entre temporadas (F3,17 = 0.64, p = 0.60).
Las especies estudiadas presentaron un gradiente de herbivoría que va de 0.19 a 14%, las especies con mayor herbivoría son Ipomoea sp., Guettarda insularis, Dodonea viscosa, Croton masonni, e Ilex socorroensis, mientras que las plantas con poca herbivoría son Salvia pseudomisella, Pteridium caudatum y Cordia curassavica, este orden se presentó tanto para la temporada de secas como para lluvias, para la mayoría de las especies se presentó una mayor herbivoría en la temporada de lluvias (tabla 2).

Al analizar la relación entre la herbivoría y la densidad de langostas por especie, solo se detectó una relación significativas para Dodonea viscosa, la especie más abundante. En este caso, el efecto de la herbivoría varió entre temporadas (F1,5 = 10.42, p = 0.02); para la temporada de secas la herbivoría aumentó con la densidad de langostas (F1,9 = 9.88, p = 0.01), en tanto que fue independiente de las langostas en las lluvias (F1,7 = 1.54, p = 0.25).
Discusión
Los datos históricos (2003-2018) de la abundancia de S. piceifrons en la isla Socorro mostraron 2 picos que podrían considerarse como brotes poblacionales, ya que se salen del patrón observado en años anteriores y posteriores. Este comportamiento poblacional es un patrón típico de las poblaciones de insectos que, generalmente, se relaciona con cambios en la disponibilidad de recursos o variables ambientales (Hodgson et al., 2010), en particular las langostas son conocidas por tener este tipo de comportamiento (Barrientos-Lozano et al., 2021). En este estudio se encontró evidencia que sugiere una relación positiva entre años con humedades relativas altas y temperaturas moderadas con la abundancia de langostas, particularmente con las abundancias al año siguiente. Se ha propuesto que estos insectos son sensibles a la humedad relativa, ya que requieren un ambiente húmedo para el desarrollo de sus huevos y ninfas (Barrientos-Lozano et al., 2021), factor que puede ser relevante en la isla Socorro, que presenta regímenes de precipitación bajos en comparación con otros sitios de distribución de S. piceifrons (Barrientos-Lozano et al., 2021). La zona Este a bajas altitudes, zona principal del monitoreo histórico de S. piceifrons en la isla, presenta condiciones especialmente secas debido a las altas temperaturas, pero la importante entrada de neblina marina aporta no solo humedad, sino agua al suelo, que favorece el crecimiento de las plantas (obs. pers.). Esto puede explicar por qué no detectamos correlaciones positivas entre la abundancia y la precipitación, pero sí con la humedad relativa. De hecho, la correlación negativa detectada con la temperatura apunta en la misma dirección; condiciones con alta humedad y temperatura moderada resultan en baja sequía que puede favorecer a la población de S. piceifrons en la isla tanto vía requerimientos del desarrollo (huevos y ninfas), como vía la disponibilidad de alimento.
Dado que la información de este monitoreo de langostas a largo plazo no es muy detallada, sería importante realizar estudios con mayor precisión, tanto poblacionales como experimentales para poder inferir con mayor certeza la relación entre las variables ambientales y las poblaciones de langosta.
El patrón encontrado con los datos recabados por personal de la Semar, aunados a los resultados de Song et al. (2006) y de Cano-Santana et al. (2006) y a las densidades de S. piceifrons obtenidas por el muestreo directo que se llevó a cabo en este estudio, no sugiere que haya un crecimiento desmedido de la población de S. piceifrons en la isla, sino fluctuaciones que podrían entrar dentro de incrementos y decrementos poblacionales considerados como normales. Sin embargo, dado que existen indicios de que hay una relación de la abundancia de S. piceifrons y las variables ambientales de humedad relativa y temperatura, es importante continuar con el monitoreo de los insectos para detectar posibles crecimientos poblacionales diferentes a lo observado en este periodo estudiado así como un monitoreo ambiental detallado y de largo plazo, para poder manejar la población si fuese necesario. Es importante hacer notar también que Cano-Santana et al. (2006) sugirieron que los brotes masivos de langostas podrían estar influenciados por los cambios en la vegetación ocasionados por el pastoreo de los borregos en la isla, que propiciaron el establecimiento de malezas exóticas, sin embargo, desde 2009 los borregos fueron eliminados completamente de la isla y por ello es probable que las condiciones de alimentación para S. piceifrons no sean tan favorables en épocas recientes.
La población de S. piceifrons mostró una distribución espacial heterogénea en la isla, en concordancia con los resultados de Cano-Santana et al. (2006), las langostas fueron localizadas preferentemente asociadas a la vegetación de tipo pastizal y matorral en altitudes menores a 500 m snm. Estudios previos con S. piceifrons sugieren una limitación por baja temperatura, ya que esta especie tiende a distribuirse en regiones con temperaturas relativamente altas (Barrientos-Lozano et al., 2021), y se ha mostrado que los adultos tienen un desempeño subóptimo por debajo de los 20 ºC (Hernández-Zul et al., 2013). Por otra parte, Cano-Santana et al. (2006) sugieren además posibles factores alimentarios, ya que, en su fase solitaria, estas langostas mostraron preferencias por las especies dominantes del pastizal y matorral en contraste a las del bosque. Nuestro análisis altitudinal para el pastizal y matorral, sugieren que no hay un efecto de la altitud para la densidad de langostas en el rango de 0 a 500 m snm. En conjunto, los datos y reportes disponibles hasta ahora sugieren que esta franja altitudinal reúne las condiciones necesarias para su óptimo desarrollo, contemplando tanto sus preferencias alimentarias como las condiciones ambientales. Es importante hacer notar que las preferencias alimentarias parecen relajarse en la fase gregaria (Cano-Santana et al., 2006), pudiendo alimentarse de casi todas las especies que le fueron ofrecidas (59 especies de plantas), por lo que en situaciones de escasez es probable que puedan alimentarse de las especies del bosque y zonas cubiertas por helechos. Esta situación de riesgo para las plantas del bosque se espera que sea moderada por temperaturas bajas que ocurren por encima de los 500 m de altitud, que podrían limitar el establecimiento de las langostas en esta zona. No obstante, dicha situación podría alterarse en el futuro cercano debido a la modificación de los pisos bioclimáticos esperados a consecuencia del cambio climático, cuestión que deberá ser abordada por estudios futuros.
Con respecto a la estacionalidad, S. piceifrons presentó una mayor densidad en la temporada de lluvias como ha sido reportado previamente para la isla Socorro (Cano-Santana et al., 2006) y también para Yucatán (Poot-Pech et al., 2018). Es probable que este patrón de densidad corresponda a 2 generaciones por año, como lo encontrado por Hernández-Zul et al. (2013), quienes sugieren que la primera generación del año tendría un tamaño menor debido a la alimentación deficiente de los adultos de la segunda generación del año anterior, provocada por escasez de alimento de buena calidad en el otoño.
La evaluación del daño por herbívoros en la vegetación de la isla Socorro (máximo 14%, promedio 7%) mostró niveles similares a los reportados en estudios previos en la isla: valores entre 4-10% de daño foliar (Cano-Santana et al., 2006) y valores entre 2-20% (Ruiz-Guerra et al., 2019), así como a los reportados para otros ecosistemas estacionales como los bosques tropicales caducifolios de la costa pacífica y del centro de México (Dirzo y Boege, 2008). Al relacionar las abundancias de S. piceifrons con los niveles de herbivoría, no se encontró una correlación significativa entre la densidad de esta especie y la herbivoría a nivel de la comunidad de plantas; sin embargo, la herbivoría en Dodonea viscosa sí presentó una correlación significativa con la densidad de las langostas. En el estudio de Cano-Santana et al. (2006), se documenta que esta especie destaca entre las preferidas por las langostas en los experimentos de aceptabilidad, por lo que de haber brotes, esta especie puede estar dentro de las más afectadas. Para el resto de las especies, en ambas estaciones, la herbivoría no tuvo relación con la densidad de langostas, por lo que el daño observado sobre las plantas no puede atribuirse solamente a las langostas, sino probablemente es la suma de la herbivoría realizada por el conjunto de herbívoros de la isla.
Podemos concluir que la densidad de S. piceifrons encontrada durante el periodo de este estudio indica que su población no es un riesgo para las plantas nativas, ya que no se encuentran agregadas en mangas ni presentaron densidades altas por hectárea en ninguno de los 25 sitios muestreados y que corresponden a los principales tipos de vegetación (pastizal, matorral, helechal, bosque). El pastizal y el matorral fueron los tipos de vegetación con mayor abundancia de langostas y las plantas con mayor daño fueron Dodonea viscosa y Psidium socorrensis, pero esta correlación solo se dio durante la temporada de secas, y el nivel de daño experimentado por las plantas es bajo (< 15%).
Debido a que en años anteriores se han detectado fluctuaciones en la abundancia de la población de S. piceifrons, con años donde la población es muy numerosa, se recomienda monitorear periódicamente para identificar de forma temprana cualquier amenaza posible de las langostas voladoras a la vegetación de la isla. Además, dado que la correlación con la abundancia de langostas y las condiciones ambientales del año anterior fue significativa, con humedades relativas altas y temperaturas bajas se incrementan las langostas, se debería tener particular cuidado para monitoreo los años subsecuentes que presenten estas condiciones. Con los resultados encontrados, no se considera que deban llevarse a cabo acciones de control de langostas.
Agradecimientos
Este estudio fue desarrollado como parte del proyecto “Fortalecimiento de la efectividad del manejo y la resiliencia de las Áreas Naturales Protegidas para proteger la biodiversidad amenazada por el Cambio Climático”, implementado por El Fondo de las Naciones Unidas para el (PNUD), ejecutado por la Comisión Nacional de Áreas Naturales Protegidas (Conanp) y financiado por el Global Environment Facility (GEF). Los autores agradecen al personal de Semar y GECI por el apoyo logístico durante las expediciones a la isla Socorro, así como a la Conanp por los permisos oficiales para trabajar allí. Agradecemos también a Eloy Pat y a Lizet Solís por el apoyo técnico durante el trabajo de campo. Ek del Val y Horacio Paz agradecen el apoyo PASPA, DGAPA, UNAM para estancia sabática.
Referencias
Álvarez-Cárdenas, S., Castellanos-Vera, A., Galina-Tessaro P. y Arnaud, G. (1994). Aspectos de la población y el hábitat del borrego doméstico (Ovis aries). En A. Ortega-Rubio y V. Castellanos (Eds.) La isla Socorro, Reserva de la Biosfera Archipiélago de Revillagigedo, México (pp. 301–317). La Paz, B.C.S.: Centro de Investigaciones Biológicas del Noroeste.
Aguirre-Muñoz, A., Bedolla-Guzmán, Y., Hernández-Montoya J., Latofski-Robles, M., Luna-Mendoza, L., Méndez-Sánchez, F. et al. (2018). The conservation and restoration of the Mexican islands, a successful comprehensive and collaborative approach relevant for global biodiversity. En A. Ortega-Rubio (Ed.), Mexican natural resources management and biodiversity conservation (pp. 177–192). Springer International Publishing AG. https://doi.org/10.1007/978-3-319-90584-6_9
Aguirre-Muñoz, A., Samaniego-Herrera, A., Luna-Mendoza, L., Ortiz-Alcaraz, A., Méndez-Sánchez, F. y Hernández-Montoya, J. (2016). La restauración ambiental exitosa de las islas de México: una reflexión sobre los avances a la fecha y los retos por venir. En E. Ceccon y C. Martínez- Garza (Eds.), Experiencias mexicanas en la restauración de los ecosistemas (pp. 487–512). Cuernavaca, Morelos, México: CRIM-UNAM/ Universidad Nacional Autónoma de Morelos/ CONABIO.
Barrientos-Lozano, L., Song, H., Rocha-Sánchez, A. Y. y Torres-Castillo, J. A. (2021). State of the art management of the Central American Locust Schistocerca piceifrons piceifrons (Walker, 1870). Agronomy, 11, 1024. https://doi.org/10.3390/agronomy11061024
Bennett, L. V. (1975). Development of a desert locust plague. Nature, 256, 486–48.
Cano-Santana, Z. (2006). Ecología e historia natural de Schistocerca americana socorro y S. piceifrons piceifrons en isla Socorro, México. Ciudad de México: Conabio. Recuperado el 01 de diciembre del 2021 de: https://www.snib.mx/iptconabio/resource?r=SNIB-BS007#anchor-description
Crawley, M. J. (2012). The R book. West Sussex, UK: John Wiley & Sons Ltd.
Dirzo, R. y Boege, K. (2008). Patterns of herbivory and defense in tropical dry and rain forests. En W. P. Carson y Schintzer S. A. (Eds.), Tropical forest community ecology (pp. 63–78). Chichester, UK: Wiley-Blackwell.
Domínguez, C. A. y Dirzo, R. (1995). Rainfall and flowering synchrony in a tropical shrub: variable selection on the flowering time of Erythroxylum havanense. Evolutionary Ecology, 9, 204–216.
Hanna, G. D. (1926). Expedition to the Revillagigedo Islands, Mexico, in 1925. Proceedings of the California Academy of Sciences, 15, 1–113.
Hernández-Zul, M. I., Quijano-Carranza, J. A., Yáñez-López, R., Ocampo-Velázquez, R. V., Torres-Pacheco, I., Guevara-González, R. G. et al. (2013). Dynamic simulation model of Central American Locust Schistocerca piceifrons (Orthoptera: Acrididae). Florida Entomologist, 96, 1274–1283. https://doi.org/10.1653/024.096.0405
Hodgson, J. A., Thomas, C. D., Oliver, T. H., Anderson, B. J., Berenton, T. M. y Crone, E. E. (2010). Predicting insect phenology across space and time. Global Change Biology, 17, 1289–1300.
JMP®, Version 16.0 (2018). Cary, NC: SAS Institute Inc.
Kaiser-Bunbury, C. N., Traveset, A. y Hansen, D. M. (2010). Conservation and restoration of plant-animal mutualisms on oceanic islands. Perspectives in Plant Ecology, Evolution and Systematics, 12, 131–143.
Kier, G., Kreft, H., Lee, T. M., Jetz, W., Ibisch, P. L., Nowicki, C. et al. (2009). A global assessment of endemism and species richness across island and mainland regions. Proceedings of the National Academy of Science, 106, 9322–9327
Latchininsky, A. V. (2008). Grasshopper outbreak challenges conservation status of small Hawaiian Island. Journal of Insect Conservation, 12, 343–357.
Levin J. A. y Moran, R. (1989). The vascular flora of Isla Socorro, México. Michigan: San Diego Society of Natural History, University of Michigan.
Maya-Delgado, Y., Salinas-Zavala, F. y Troyo-Diéguez, E. (1994). Estado actual del suelo y propuestas para su conservación. En A. Ortega-Rubio y V. Castellanos (Eds.), La isla Socorro, Reserva de la Biosfera Archipiélago de Revillagigedo (pp. 63–75). La Paz: Centro de Investigaciones Biológicas del Noroeste.
NASA Langley Research Center (2021). Prediction Of World-
wide Energy Resources (POWER). Hampton, VA, USA: LaRC. Recuperado el 2 de diciembre 2021, https://power.larc.nasa.gov/
Ortiz-Alcaraz, A., Aguirre-Muñoz, A., Méndez-Sánchez, F., Rojas-Mayoral, E., Solís-Carlos, F., Rojas-Mayoral, B. et al. (2019). Ecological restoration of Socorro Island, Revillagigedo Archipelago, Mexico: the eradication of feral sheep and cats. En C. R. Veitch, M. N. Clout, A. R. Martin, J. C. Russell y C. J. West (Eds.), Island invasives: scaling up to meet the challenge (pp. 267–273). Occasional Paper SSC No. 62. Gland, Switzerland: IUCN.
Palacios-Vargas, J. G., Lampallas, J. y Hogue, C. L. (1982). Preliminary list of the insects and terrestrial Arthropoda of Socorro Island, Islas Revillagigedo, Mexico. Bulletin Southern California Academy of Sciences, 81, 138–147.
Peng, W., Ling Ma, N., Zhang, D., Zhou, Q., Yue, X., Ching-Khoo, S. et al. (2020). A review of historical and recent locust outbreaks: links to global warming, food security and mitigation strategies. Environmental Research, 19, 110046. https://doi.org/10.1016/j.envres.2020.110046
Poot-Pech, M. A., Ruiz-Sánchez, E., Gamboa-Angulo, M., Ballina-Gómez, H. S. y Reyes-Ramírez, A. (2018). Population fluctuation of Schistocerca piceifrons piceifrons (Orthoptera: Acrididae) in the Yucatán Península and its relation with the environmental conditions. Revista de Biología Tropical, 66, 403–414.
R Core Team (2021). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL: https://www.R-project.org/
Ruiz-Guerra, B., Aguilar-Chama, A., González de León, S. y Guevara, B., (2019). Invasive species appear to disrupt the top-down control of herbivory on a Mexican Oceanic Island. Pacific Science, 73, 1–16. https://doi.org/10.2984/73.1.1
Simpson, S. J., McCaffery, A. R. y Hägele, B. F. (1999). A behavioural analysis of phase change in the desert locust. Biological Reviews, 74, 461–480.
Smith-Ramírez, C., Vargas, R., Castillo, J., Mora, J. P. y Arellano-Cataldo, G. (2017). Biodiversity and Conservation, 26, 1507–1524.
Song, H., Weissman, D. W., Barrientos-Lozano, L. y Cano-Santana, Z. (2006). The locust island. American Entomologist, 52, 168–181.
Walter, H. S. y Levin, G. A. (2008). Feral sheep on Socorro Island: facilitators of alien plant colonization and ecosystem decay. Diversity and Distributions, 14, 422–431.