Francisco Guerra-Martínez a, b, *, Arturo García-Romero c,
Miguel Ángel Martínez-Morales d y José López-García c
a Universidad Nacional Autónoma de México, Posgrado en Ciencias Biológicas, Edificio D, 1º Piso, Circuito de Posgrados, Ciudad Universitaria, Alcaldía Coyoacán, 04510 Ciudad de México, México
b Universidad Nacional Autónoma de México, Escuela Nacional de Estudios Superiores, Unidad Mérida, Tablaje Catastral Núm. 6998, Carretera Mérida-Tetiz Km. 4.5, 97357 Ucú, Yucatán, México
c Universidad Nacional Autónoma de México, Instituto de Geografía, Departamento de Geografía Física, Circuito de la Investigación Científica s/n, Ciudad Universitaria, Alcaldía Coyoacán, 04510 Ciudad de México, México
d Colegio de la Frontera Sur, Departamento de Conservación de la Biodiversidad, Carretera Panamericana s/n, Barrio de María Auxiliadora, 29290 San Cristóbal de las Casas, Chiapas, México
*Autor para correspondencia: guerraf@comunidad.unam.mx (F. Guerra-Martínez)
Recibido: 8 marzo 2020; Aceptado: 13 noviembre 2020
Resumen
En este estudio se analizan los patrones de recuperación de la estructura, la composición y la diversidad de plantas en bosques secundarios de bosque tropical seco (BTS) en paisajes agrícolas de Tehuantepec, Oaxaca. Para ello, se estableció una cronosecuencia con 19 parcelas (incluyendo una de bosque maduro) de 20 m × 20 m con una edad conocida de abandono de entre 3 y 50 años. En cada parcela se censaron las plantas leñosas con diámetro a la altura del pecho mayor o igual a 5 cm; se identificaron las especies y se registró su diámetro y altura. Los resultados indican que tras el abandono de la actividad agrícola, los bosques se regeneran naturalmente, lo cual debe considerarse en las estrategias para la conservación de los BTS frente al cambio global. Asimismo, la composición de especies presente en los bosques secundarios puede ayudar a guiar las estrategias de restauración ecológica activa que aceleren el proceso de sucesión ecológica. La resiliencia ecológica del BTS en áreas de abandono agrícola está dada por la recuperación de atributos más que por la resistencia al disturbio agrícola.
Palabras clave: Abandono agrícola; Cambio global; Cronosecuencia; Restauración ecológica pasiva; Sucesión secundaria
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Ecological resilience of the tropical dry forest: recovery of the structure, composition and diversity in Tehuantepec, Oaxaca
Abstract
This study analyzes the recovery patterns of the structure, composition, and diversity of plants in secondary tropical dry forests (TDF) in agricultural landscapes of Tehuantepec, Oaxaca. A chronosequence was established with 19 plots (including a plot of mature forest) of 20 m × 20 m, with a known age of abandonment between 3 and 50 years. In each plot, woody plants with DBH ≥ 5 cm were counted; the species were identified and their diameter and height were recorded. The results indicate that after the abandonment of agricultural activity, forests regenerate naturally, which should be considered in the strategies for TDF conservation in the context of global change. Also, the composition of species present in secondary forests could help to guide active ecological restoration strategies that may accelerate the process of ecological succession. The ecological resilience of the BTS in former agricultural areas is given by the recovery of attributes rather than by resistance to agricultural disturbance.
Keywords: Agricultural abandonment; Global change; Chronosequence; Passive ecological restoration; Secondary succession
Introducción
El bosque tropical seco (BTS), sensu Murphy y Lugo (1986), representa 40% de los bosques tropicales a nivel mundial (Miles et al., 2006); en México la cifra se eleva a 68%, con lo que se constituye como el bosque tropical más representativo del país (INEGI, 2017). Sin embargo, en la actualidad el BTS continúa siendo uno de los ecosistemas más vulnerables a la transformación, principalmente debido a la deforestación para el establecimiento de actividades agrícolas o ganaderas de tipo intensivas o de subsistencia (Sánchez-Azofeifa y Portillo-Quintero, 2011; Miles et al., 2006; Mooney, 2011). Estos disturbios reducen o eliminan los atributos ecológicos de las comunidades del BTS afectadas (e.g., área basal, riqueza de especies, diversidad; Rykiel, 1985). No obstante, los ecosistemas poseen resiliencia ecológica, la cual está conformada por 2 componentes: la resistencia y la recuperación que les permiten retornar a condiciones similares previas al disturbio (Hodgson et al., 2015; Lloret et al., 2011). La resistencia consiste en la capacidad del ecosistema de tolerar el impacto inmediato de un disturbio exógeno (Hodgson et al., 2015). En la práctica, se identifica como la disminución del valor en alguno de los atributos del ecosistema durante el disturbio o inmediatamente al finalizar el mismo y se puede estimar a través de la relación entre el valor que adopta el atributo antes y durante el disturbio (Kaufman, 1982; Lloret et al., 2011; MacGillivray y Grime, 1995). Por otra parte, la recuperación corresponde al restablecimiento del atributo afectado después del disturbio y se reconoce como un aumento en el valor del atributo afectado; se estima como la relación entre el valor del atributo una vez finalizado el disturbio y el valor adquirido durante el restablecimiento (Lloret et al., 2011).
La recuperación de los atributos ecológicos en parcelas abandonadas ocurre a partir de una secuencia de etapas de sucesión ecológica (Chazdon, 2014). Recientemente, en diversas regiones del mundo, el abandono de las actividades agropecuarias ha permitido la recuperación de diversos atributos en los BTS, la cual puede seguir una o múltiples trayectorias sucesionales en función de diversos factores (e.g., condiciones bióticas y abióticas, estado de deterioro) y permitir a los ecosistemas alcanzar condiciones similares a las presentes antes de un disturbio (Arroyo-Rodríguez et al., 2017; Derroire et al., 2016; Poorter et al., 2019; Rozendaal et al., 2019). Los bosques en recuperación se denominan bosques secundarios y para todos los ecosistemas su superficie ha aumentado alrededor del mundo, mientras que la de los bosques naturales ha disminuido a nivel global (Chazdon, 2014; FAO, 2015; Wright y Muller-Landau, 2006).
Cabe señalar que la recuperación del BTS está altamente condicionada por la marcada estacionalidad temporal de la precipitación. Durante la estación seca, debido a la ausencia de lluvias, el agua se convierte en el factor que más limita el desarrollo y la supervivencia de las plantas; mientras que en la estación húmeda, caracterizada por una mayor inestabilidad atmosférica y desarrollo de nubosidad, la limitación de la luz regula el crecimiento y la reproducción de las plantas (Bullock, 1995; Lebrija-Trejos et al., 2010; Maass y Burgos, 2011; Sánchez-Azofeifa et al., 2005). La estacionalidad temporal de la precipitación determina la diversidad, la fenología, las formas de crecimiento, la demografía, la estructura y la fisonomía de las comunidades en proceso de recuperación tanto a nivel local como regional (Bullock, 1995; Maass y Burgos, 2011; Miles et al., 2006; Mooney et al., 1995).
El estudio de la sucesión ecológica en los BTS se ha abordado principalmente mediante el uso de cronosecuencias que implican la sustitución del tiempo por el espacio (i.e., las parcelas de estudio cuentan con diferentes edades sucesionales; Chazdon, 2014). No obstante que los estudios a largo plazo pueden aportar más información sobre la dinámica de la comunidad, las cronosecuencias permiten predecir con mayor fiabilidad la recuperación en el tiempo de sus atributos ecológicos, como la estructura, la composición y la diversidad (Chazdon et al., 2007; Johnson y Miyanishi, 2008). Además, debido a que la sucesión secundaria en los BTS puede llevar desde 50 años hasta más de un siglo para alcanzar valores cercanos a los bosques maduros en alguno de sus atributos (composición de especies; Chazdon et al., 2007; Kennard, 2002; Lebrija-Trejos et al., 2008, 2010), en la práctica resulta más accesible disponer de cronosecuencias en lugar de parcelas analizadas longitudinalmente desde un enfoque dinámico (Chazdon, 2014; Chazdon et al., 2009; Johnson y Miyanishi, 2008).
En la evaluación de la resiliencia ecológica en los BTS, es deseable considerar sus 2 componentes reconocibles, la resistencia y la recuperación. Sin embargo, ante disturbios antrópicos como la deforestación para el establecimiento de áreas agrícolas, los BTS muestran casi nula resistencia al disturbio y son eliminados prácticamente en su totalidad. Por lo tanto, el análisis de la resiliencia ecológica de estos ecosistemas se ha enfocado en evaluar los atributos de la vegetación que se recuperan después del disturbio (Lebrija-Trejos et al., 2008; Lebrija-Trejos, Meave et al., 2010). La recuperación del BTS transcurre desde comunidades de plantas de sucesión temprana hasta el reclutamiento de un número mayor de especies de plantas del bosque maduro en etapas sucesionales intermedias y tardías (Lebrija-Trejos, Pérez-García et al., 2010). A medida que la sucesión secundaria avanza y cada vez más especies de bosque maduro se reincorporan a los bosques secundarios, el ensamble de nuevas especies pueden enriquecer las funciones del ecosistema y aumentar su resiliencia ecológica (Gunderson, 2000).
En las llanuras costeras del estado de Oaxaca, estudios recientes muestran que debido al abandono de las actividades agrícolas que afectan a la región, algunos atributos del BTS, como la cobertura, han presentado una tendencia hacia la recuperación en los últimos 20 años (Guerra-Martínez et al., 2019). La expansión y densificación de la cobertura de bosques secundarios es de gran importancia para el desarrollo de suelo, la recarga de mantos acuíferos y el restablecimiento de la fauna nativa, entre otros servicios ecosistémicos, lo que justifica el interés por el proceso de recuperación del BTS, de su trayectoria sucesional y si esta sigue una ruta hacia la recuperación de otros atributos de mayor relevancia ecológica, como la diversidad de especies (Lomelí-Jiménez et al., 2017).
El objetivo de este estudio fue analizar los patrones de recuperación de la estructura (altura del dosel, densidad de individuos y área basal), la composición y la diversidad de especies en comunidades del BTS ubicadas en paisajes agrícolas. Primero, analizamos la recuperación de los atributos ecológicos del BTS mediante una cronosecuencia establecida en paisajes agrícolas. Segundo, empleamos modelos no lineales para determinar el patrón de recuperación de los atributos ecológicos a lo largo de la sucesión ecológica. Y tercero, determinamos las etapas sucesionales presentes en la cronosecuencia a partir de la composición de especies.
Con base en lo anterior, en este trabajo nos planteamos las siguientes preguntas de investigación: ¿cómo es la dinámica de la recuperación de los atributos ecológicos de las comunidades durante la sucesión ecológica de los bosques secundarios después del abandono de las actividades agrícolas? y ¿en cuánto tiempo se recuperan sus atributos ecológicos a un estado similar previo al disturbio?
Material y métodos
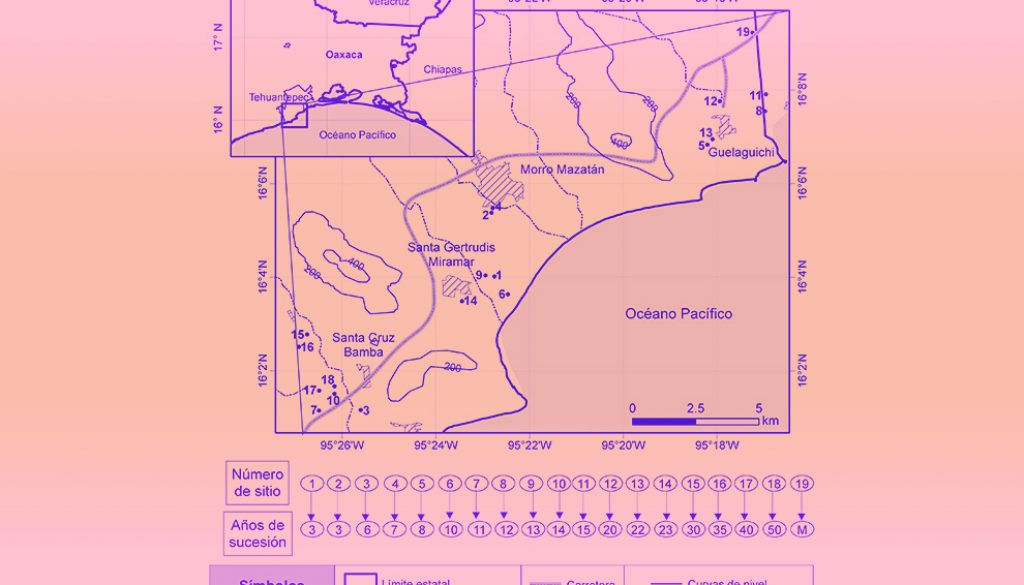
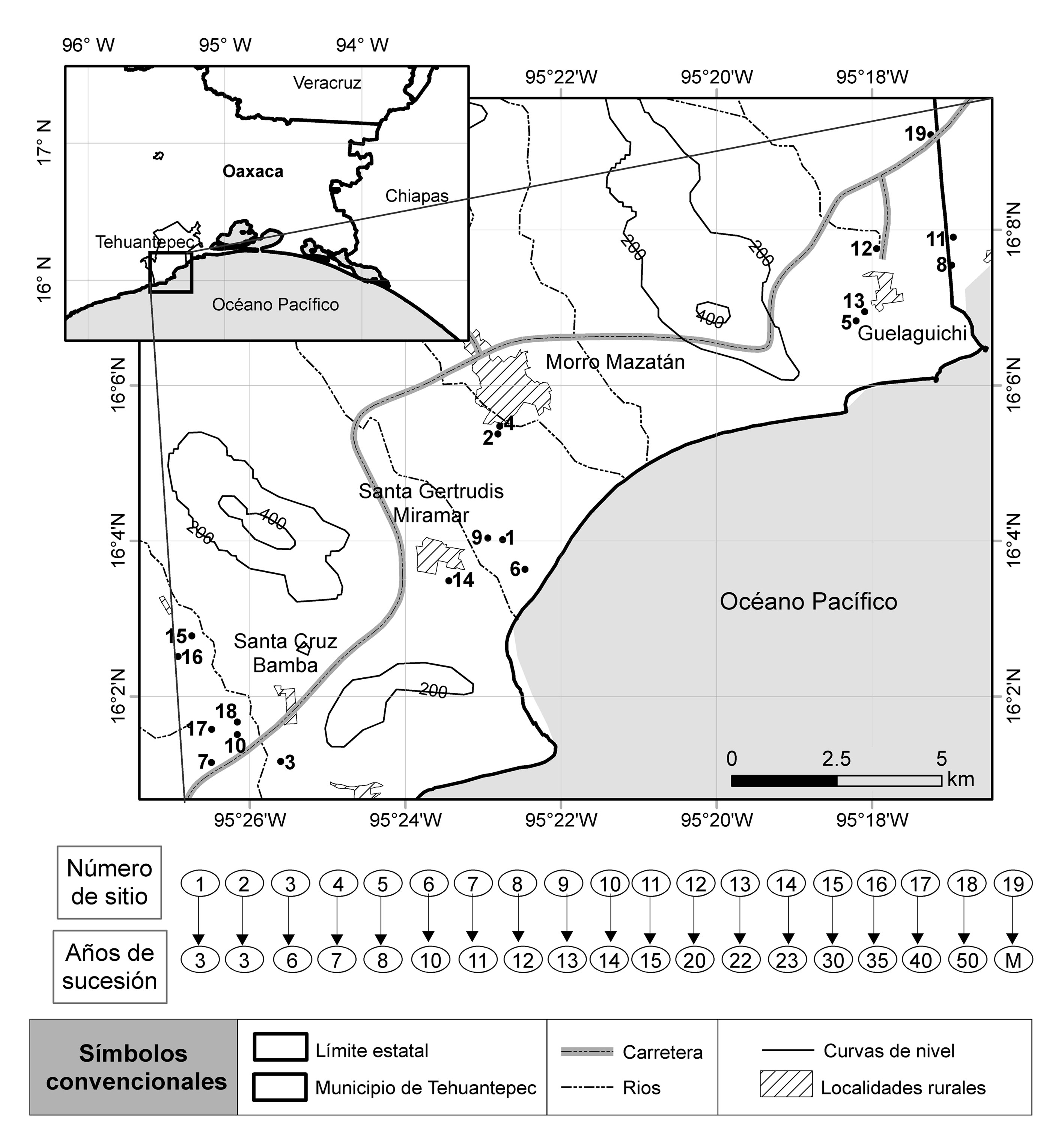
El estudio consideró los paisajes agrícolas de 4 localidades costeras: Guelaguichi, Santa Gertrudis Miramar, Santa Cruz Bamba y Morro Mazatán, ubicadas en el municipio de Santo Domingo Tehuantepec (1,201.88 km2; coordenadas extremas: 16°27’ N, 95°38’ O y 15°55’ N, 95°10’ O), estado de Oaxaca (fig. 1). El municipio posee un gradiente altitudinal de 0 a 1,400 m snm, incluyendo sierras bajas complejas (51.57%) y sierras altas complejas (16.83%) modeladas sobre basamentos sedimentarios y metamórficos del Cretácico; así como llanuras costeras (18.93%) y llanuras costeras con lomeríos (12.67%), que se distribuyen entre 0 y 600 m snm. La temperatura media anual tiene una variación de entre 20 y 30°C, y la precipitación va de los 700 a los 1,000 mm anuales (INEGI, 2010), y de acuerdo con el sistema de clasificación climática de Köppen modificado por García (2004); el clima en las llanuras costeras es cálido subhúmedo muy seco (Aw0) y en los lomeríos con elevaciones <500 m snm es cálido subhúmedo seco (Aw1) (Salas-Morales et al., 2018), habiendo una estación húmeda que dura entre 5 y 7 meses (principalmente de junio a octubre) y una estación de estiaje que dura entre 6 y 7 meses (principalmente de noviembre a mayo) (Lebrija-Trejos, Pérez-García et al., 2010; Salas-Morales et al., 2015).
La cobertura del suelo en el municipio está conformada en su mayoría por BTS (74.88%), seguido de agricultura (18.95%) como principal uso del suelo, bosque templado y mesófilo (2.86%), zona urbana (1.36%), dunas costeras (0.73%), pastizal inducido (0.54%), áreas sin vegetación (0.35%), palmar inducido (0.23%), manglar (0.08%) y cuerpos de agua (0.02%; INEGI, 2010). Las llanuras costeras están ocupadas por poblaciones humanas (< 2,000 habitantes) que mantienen sus actividades agrícolas como principal medio de sustento; sin embargo, el patrón de uso de suelo se caracteriza por innumerables parcelas abandonadas que presentan distintos niveles de recuperación de BTS.
Para evaluar los cambios ocurridos en atributos ecológicos de las comunidades del BTS, específicamente relativos a la estructura, la composición y la diversidad de especies arbóreas, se estableció una cronosecuencia con 19 parcelas. Una de ellas fue establecida en áreas de bosque maduro sin evidencia de actividades humanas, mientras que las 18 restantes corresponden a parcelas con diferentes edades de abandono de las actividades agrícolas. Con la intención de acotar la variabilidad ambiental, únicamente se seleccionaron parcelas ubicadas a < 30 m snm y sobre llanuras costeras con el mismo sustrato geológico (sedimentos aluviales). Asimismo, todas las parcelas elegidas presentan un patrón de uso de suelo agrícola y muestran recuperación de la cobertura de los bosques secundarios después del abandono de las actividades agrícolas. Igualmente, se consultó información de la recuperación de la cobertura a nivel regional y de las causas que promueven el cambio a partir del análisis de la información espacial existente para la región (Guerra-Martínez et al., 2019).
Para determinar la edad de abandono de la parcela se consideraron 2 estrategias: a partir de un seguimiento visual de ortofotos digitales de 1995 proporcionadas por el Instituto Nacional de Geografía y Estadística y mediante imágenes satelitales históricas disponibles en la plataforma Google Earth para los años 2004, 2009, 2012, 2014, 2016 y 2018. De manera simultánea, se realizaron entrevistas a los actores clave (al comisariado ejidal y propietarios de las parcelas) para corroborar la información del tiempo de abandono. Las parcelas en etapas sucesionales fueron de 3, 6, 7, 8, 10, 11, 12, 13, 14, 15, 20, 22, 23, 30, 35, 40 y 50 años de abandono (fig. 1).
Las dimensiones de las parcelas de estudio fueron de 20 m × 20 m. Se registraron todas las plantas leñosas con diámetros a la altura del pecho (DAP: medido a 1.30 m de altura) ≥ 5 cm. Para cada individuo se registró la altura y el DAP; las especies registradas se identificaron en campo, mientras que los individuos no identificados fueron recolectados y reconocidos (con el apoyo de algunos miembros de la comunidad local) con sus nombres comunes, y posteriormente fueron identificadas a nivel de género y especie a partir de listados florísticos (Pérez-García y Meave, 2005; Torres-Colín et al., 1997), bases de datos de presencia (Conabio, 2016; Osorio-Olvera et al., 2018; Robertson et al., 2014) y comparación con las recolectas registradas para la región (Pérez-Báez et al., 2016; Smithsonian Institution, 2019). Para la clasificación taxonómica de las plantas se usó el sistema de clasificación APG IV (Angiosperm Phylogeny Group) a través de la plataforma POWO (Plants of the World Online).
Las variables estructurales consideradas fueron la altura del dosel, la densidad de individuos y el área basal. La altura del dosel se calculó mediante un promedio de las alturas de los 8 individuos más altos de la parcela; mientras que la densidad de individuos por parcela se obtuvo del número de individuos presentes por unidad de superficie; por su parte, el área basal por parcela se determinó de la sumatoria de las áreas de cada individuo estimadas a partir de la fórmula del área de un círculo.
La diversidad de las parcelas fue analizada a partir de la riqueza de especies observada (S; número total de especies en la parcela) y el índice de diversidad de Shannon (H’). Estos parámetros son una referencia de cambio a lo largo de la cronosecuencia. Además, ambos indicadores son empleados recurrentemente, lo que permite realizar comparaciones con otros bosques secundarios y maduros.
La recuperación del BTS y la trayectoria sucesional medidas a partir de los atributos de estructura y diversidad en la cronosecuencia se analizó a partir de una serie de modelos de regresión logística jerárquica (modelos HOF; Huisman et al., 1993) que permiten describir los patrones temporales de la sucesión ecológica en los bosques secundarios. Se elaboraron modelos a partir de las parcelas de bosques secundarios (hasta 50 años de abandono), excluyendo la parcela de bosque maduro dado que se desconoce el tiempo de sucesión ecológica. Los modelos HOF describen 5 respuestas: el modelo I (MI) se ajusta en el tiempo a una tendencia no significativa; el modelo II (MII) se ajusta a una tendencia de incremento o decremento con la edad sucesional, donde el máximo es igual al límite superior; el modelo III es similar al MII, solo que el máximo no alcanza el límite superior; el modelo IV (MIV) muestra un incremento o decremento simétricos; finalmente, el modelo V (MV), que describe un incremento o decremento a diferentes tasas. Adicionalmente, en el análisis se incluyen 2 modelos bimodales (MVI y MVII). El límite superior del modelo se estableció a partir de los valores más altos encontrados en el conjunto de datos. La selección del modelo con mayor ajuste a los datos se realizó a partir del criterio de información de Akaike (AIC) (Huisman et al., 1993). Asimismo, la prueba incluye un método de remuestreo (bootstrap) para garantizar la estabilidad de los modelos (Jansen y Oksanen, 2013).
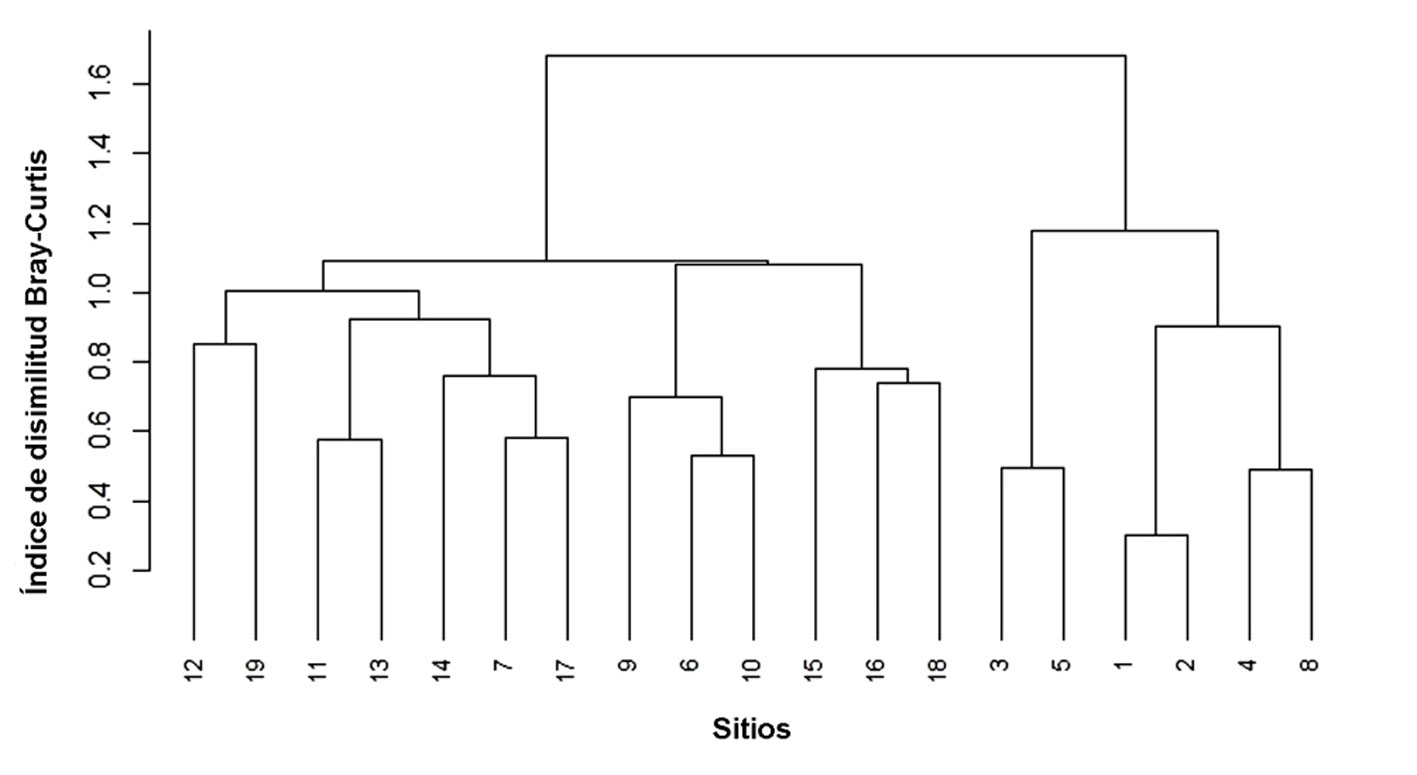
Para analizar los patrones sucesionales que muestra la composición de especies se realizó una prueba NMDS (Non-metric multidimensional scaling ordination) a partir de los valores del índice de disimilitud de Bray-Curtis. Además, se realizó un análisis de conglomerados jerárquicos con el método de Ward para complementar la ordenación e identificar grupos ecológicos.
Los análisis estadísticos fueron realizados en R Project versión 3.6.1 (R Core Team, 2019); los índices de diversidad alfa y la prueba NMDS fueron obtenidos mediante el paquete vegan (Oksanen et al., 2019); los modelos de regresión logística jerárquica (HOF) fueron realizados con el paquete eHOF (Jansen y Oksanen, 2013), y el análisis de conglomerados jerárquicos fue realizado mediante el paquete stats.
Resultados
Se registraron 1,122 individuos y 82 especies de plantas (9 identificadas a nivel de género y 12 diferenciadas como morfoespecies), distribuidas en 26 familias (apéndice 1), de las cuales la familia Fabaceae presentó la mayor riqueza con 24 especies (29%), seguida de la familia Boraginaceae con 6 especies (7%) y las familias Burseraceae, Euphorbiaceae y Polygonaceae con 4 especies cada una (5% para cada familia). Nueve especies concentraron 70% de la abundancia total: Vachellia farnesiana (30.9%), Vachellia campeachiana (7.1%), Trema micranthum (7%), Mariosousa coulteri (6.7%), Prosopis juliflora (6.5%), Forchhammeria pallida (3.8%), Prosopis laevigata (3.8%), Leucaena lanceolata (3.7%) y Cordia seleriana (2.1%).
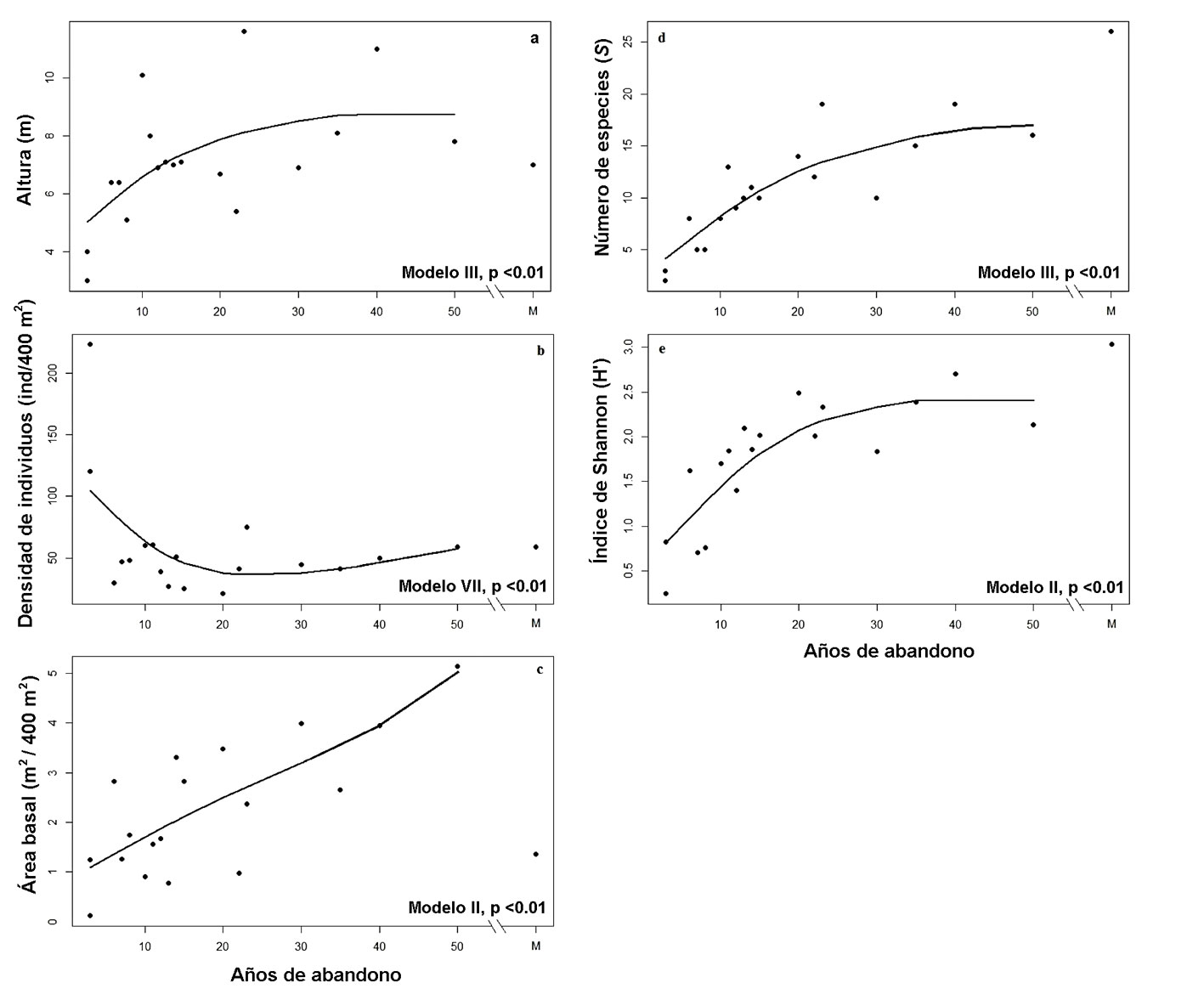
El patrón sucesional de los atributos de estructura muestra diferentes comportamientos. La altura del dosel mostró una tendencia de incremento en los valores conforme aumentó el tiempo de abandono, sin embargo, el máximo no alcanzó el límite superior y disminuyó en las parcelas de sucesión más avanzada, ajustándose al modelo III (p < 0.01; fig. 2a). La densidad de individuos mostró una dinámica bimodal; al inicio de la sucesión la densidad de individuos fue elevada, disminuyendo en etapas intermedias de la sucesión hacia una tendencia de ligero aumento en etapas avanzadas (modelo VII, p < 0.01; fig. 2b). El área basal mostró un incremento conforme la sucesión avanza, con lo cual los datos se ajustaron al modelo II (p < 0.01; fig. 2c).
Con respecto a los atributos de diversidad, el número de especies mostró una tendencia de incremento en los valores conforme aumentó el tiempo de abandono, pero el máximo no alcanzó el límite superior y se ajustó al modelo III (p < 0.01; fig. 2d). El índice de Shannon (H’) mostró un aumento en sus valores conforme la sucesión avanza, ajustándose al modelo II (p < 0.01; fig. 2e). Los valores de los atributos estructurales y de diversidad se muestran en el apéndice 2.
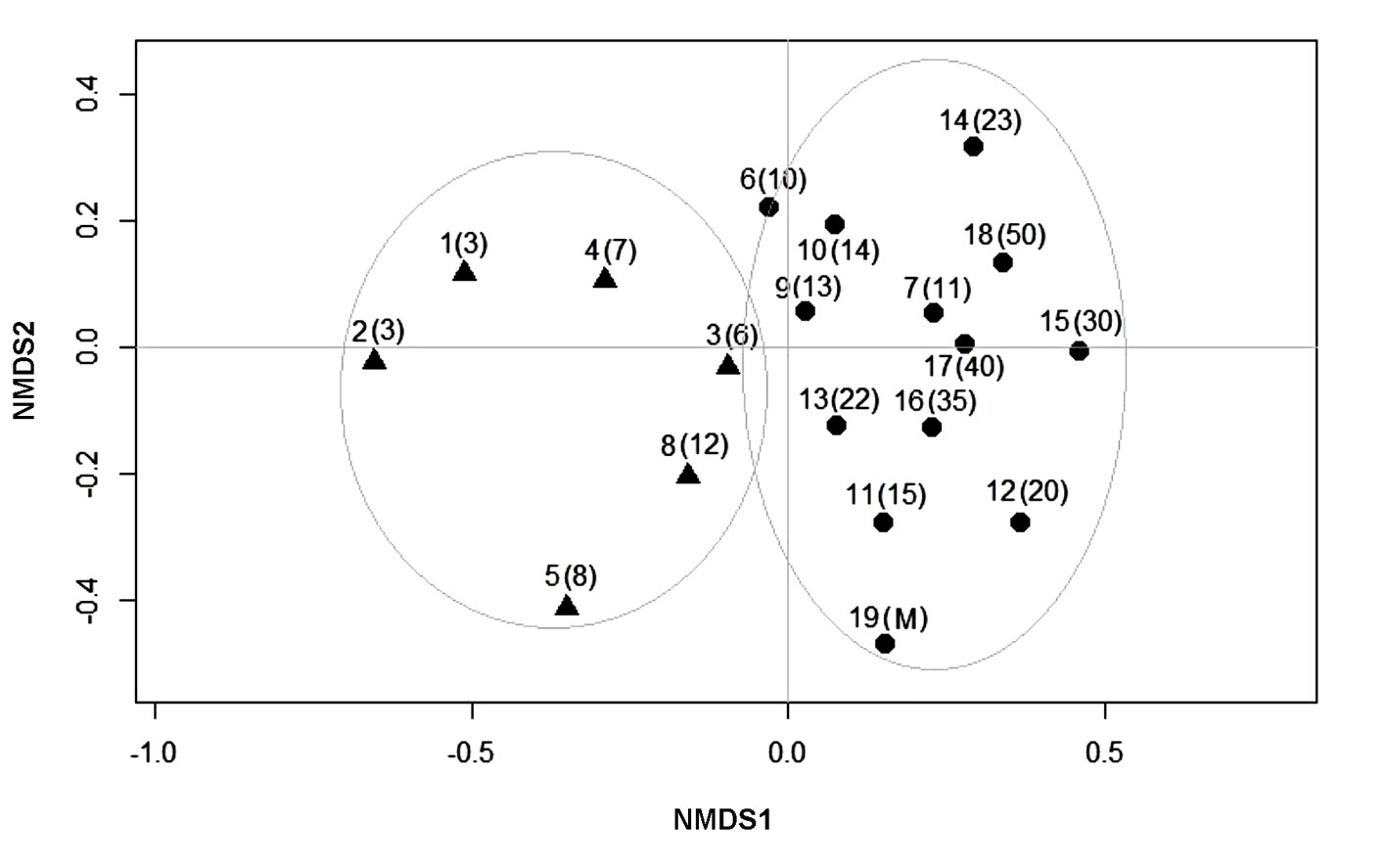
La ordenación NMDS fue de 2 dimensiones con un estrés de 0.17, valor clasificado como estrés de tipo 1, lo que permite realizar una interpretación adecuada. Los cambios sucesionales en la composición de especies se muestran en la ordenación NMDS (fig. 3). El análisis permite distinguir 2 grupos principales de parcelas: el grupo 1 con especies de sucesión temprana y el grupo 2 con especies de sucesión intermedia y especies presentes en el bosque maduro. En el primer grupo se encuentran las parcelas 1 a 5 y la parcela 8 que corresponden a una edad sucesional de 3 a 12 años. En estas parcelas sobresale la presencia de especies como Vachellia farnesiana, Mariosousa coulteri, Vachellia campeachiana, Crateva tapia y Prosopis juliflora. El segundo grupo es el más robusto ya que integra las parcelas 6, 7 y 9 a 19, incluida la parcela de bosque maduro, donde sobresalen especies como: Amphipterygium adstringens, Trema micranthum, Cordia seleriana, Crateva tapia, Dalechampia scandens, Forchhammeria pallida, Haematoxylum brasiletto, Leucaena lanceolata, Malpighia emarginata, Mimosa benthamii, Parkinsonia aculeata, Pithecellobium dulce, Prosopis juliflora, Randia thurberi y Tabernaemontana donnell-smithii. El análisis de conglomerados jerárquicos confirma al menos 2 grupos principales de parcelas que coinciden con la membresía de las parcelas detectada en la ordenación NMDS (fig. 4).
Discusión
Los resultados sugieren que las parcelas que contaban con un uso del suelo agrícola tradicional (roza, tumba y quema) y posteriormente fueron abandonadas son capaces de recuperar diversos atributos ecológicos de estructura, composición y diversidad de la vegetación a niveles secundarios y llegar, en algunos casos, a niveles del bosque maduro. Este patrón ecológico ha sido reportado en otros estudios realizados en BTS donde la altura del dosel, el área basal, el número de especies y el índice de diversidad se incrementan conforme el tiempo de abandono es mayor (Avella et al., 2019; Kennard, 2002; Lebrija-Trejos et al., 2008; Powers et al., 2009). Las investigaciones sobre la recuperación de atributos en bosques secundarios reconocen que los BTS se restablecen después de un disturbio, a partir de una serie de etapas de sucesión ecológica (Chazdon, 2014).
La altura del dosel aumentó a lo largo de la sucesión, pero disminuyó en las parcelas con mayor tiempo de abandono. El área basal de los bosques secundarios también mostró una tendencia de incremento en sus valores con el avance de la sucesión, una situación que coincide con lo reportado en otras investigaciones (Kennard et al., 2002; Lebrija-Trejos et al., 2008). Sin embargo, la parcela de BTS maduro presentó valores más bajos; por ello, para fines comparativos entre los valores estructurales de los bosques secundarios y el bosque maduro, es necesario disponer de más de una parcela de bosque maduro como referencia, debido a la elevada heterogeneidad en los valores de estructura del BTS que se presentan en la región (Salas-Morales et al., 2018).
La densidad de individuos mostró una respuesta diferente al principio de la sucesión, durante los primeros 5 años de abandono presentó una alta densidad de individuos, similar a estudios previos (Kennard, 2002; Ruiz et al., 2005); después, la densidad disminuyó y se mantuvo a niveles constantes en el transcurso de la sucesión (Kennard, 2002; Lebrija-Trejos, Pérez-García et al., 2010), volviendo a aumentar después de 35 años de abandono. Una dinámica sucesional en la que no necesariamente aumentan los valores estructurales con el transcurso de la sucesión (Beltrán-Rodríguez et al., 2018). Esto sugiere que la edad de abandono no necesariamente es la principal variable que explica el comportamiento de la recuperación de la estructura durante la sucesión ecológica (Chazdon et al., 2007; Lebrija-Trejos, Pérez-García et al., 2010). La dinámica de la densidad de individuos es multifactorial; en este caso, se puede deber a la elevada disponibilidad de espacio al comienzo de la sucesión, lo que permite el establecimiento de muchos individuos de talla pequeña (Rivera y Aide, 1998), particularmente de aquellas especies con mayor capacidad para germinar y establecerse al inicio de la sucesión, como ocurre con especies como Vachellia farnesiana, V. campeachiana y Prosopis laevigata que mostraron alta densidad al inicio. Posteriormente, estas especies comienzan a competir por recursos como luz, agua y espacio mediante mecanismos densodependientes que regulan el número de individuos (Chazdon et al., 2007; Silver et al., 2000). Además, las condiciones microclimáticas y la disponibilidad de nutrientes en el suelo también pueden explicar la dinámica de la densidad de individuos (Powers et al., 2009).
El número de especies y el índice de diversidad mostraron una tendencia de incremento al avanzar la sucesión ecológica, siendo el bosque maduro el que presentó los valores más altos. Un patrón que ha sido detectado en otros estudios, en donde los valores del índice de diversidad de los bosques secundarios no alcanza a los presentes en los bosques maduros (Lebrija-Trejos et al., 2008). Durante la sucesión secundaria, el aumento en el número de especies comúnmente presentes en el bosque maduro es más rápida que la pérdida de especies de estados sucesionales tempranos (Lebrija-Trejos, Pérez-García et al., 2010), lo que se refleja en una rápida recuperación del número de especies y de la diversidad (en 10 años alcanzan 50% de los valores presentes en el bosque maduro de referencia). La composición de los bosques secundarios en recuperación muestra que diversas especies del bosque maduro no se encuentran al inicio de la sucesión; sin embargo, éstas se van reclutando conforme avanza el tiempo de abandono, lo que corresponde a etapas sucesionales intermedias y tardías, en las cuales las comunidades se vuelven más sombrías y frías, este patrón ocurre tanto en la temporada de lluvias como en la de sequía, pero es más notoria durante las lluvias (Lebrija-Trejos, Pérez-García et al., 2010). Conforme los bosques secundarios se desarrollan y las condiciones ambientales cambian, se incorporan cada vez más especies que pertenecen a diferentes grupos funcionales (e.g., especies de rápido crecimiento tolerantes a la luz y especies de lento crecimiento tolerantes a la sombra) que coexisten, en su mayoría, en etapas intermedias de la sucesión (Lebrija-Trejos et al., 2011). El patrón de la composición de especies en el área muestra que las primeras etapas sucesionales son dominadas por especies pioneras, que después son reemplazadas por especies de fases sucesionales intermedias y avanzadas, un patrón sucesional reconocido de la composición de especies (Chazdon, 2014; Quesada et al., 2013). Además, la aparición y combinación de nuevas especies en el transcurso de la sucesión ecológica enriquece las funciones del ecosistema (e.g., aumentando la productividad), lo que repercute en una mayor resiliencia ecológica (Gunderson, 2000).
Las diferencias generales presentes en los sitios a lo largo de la cronosecuencia pueden relacionarse con factores climáticos, edáficos y topográficos (Salas-Morales et al., 2018). Además, también existen diferencias entre los sitios por el tiempo que estuvieron bajo uso agrícola, tipo de cultivo y prácticas de cultivo, tipo de suelo, tamaño del claro (menor dimensión implica mayor cantidad de semillas), disponibilidad de propágulos y lluvia de semillas durante los primeros años de abandono, así como por las actividades extractivas al inicio de la sucesión (Kennard, 2002). Por lo tanto, para tener una comprensión más completa del patrón de recuperación del BTS a partir de cronosecuencias de bosques secundarios y maduros de la región costera de Oaxaca, es fundamental recabar la mayor información posible sobre las condiciones de las parcelas que integran una cronosecuencia (Salas-Morales et al., 2018).
La recuperación de los bosques secundarios hacia BTS maduros es rápida en la región. A partir de los 10 años de abandono, los valores estructurales de los bosques secundarios superan los observados en el bosque maduro; asimismo, a partir de los 20 años de abandono ya cuentan con aproximadamente 75% de los valores de diversidad presentes en el bosque maduro de referencia. Se ha reportado que las parcelas abandonadas, después de un uso de suelo agrícola, presentan una mayor recuperación de los atributos de estructura y biomasa, que de la riqueza de especies, lo que posiblemente explica por qué los valores de los atributos de estructura en el bosque secundario superaron los presentes en el bosque maduro de referencia (Dupuy et al., 2012).
Con respecto a los componentes de la resiliencia ecológica (resistencia y recuperación), la resistencia del BTS ante la deforestación como disturbio en la región es nula, ya que los valores de los atributos ecológicos llegan casi a cero dada la remoción de la vegetación nativa. Sin embargo, la ausencia de uso de maquinaria pesada evita la remoción de raíces que fungen como la fuente que permitirá la recuperación del BTS tras un eventual abandono del sitio. Por lo tanto, la resiliencia de los BTS en áreas agrícolas de la región de estudio está dada por la velocidad de la recuperación de los diversos atributos ecológicos más que por la resistencia al disturbio (Lloret et al., 2011). En general, la recuperación del BTS ocurre en su mayoría a partir del rebrote de plantas más que de la capacidad de las semillas de permanecer en latencia (Vesk y Westoby, 2004). Sin embargo, al parecer la latencia de las semillas permite el aumento en el número de especies y la diversidad conforme avanza la sucesión ecológica en el BTS.
Por otro lado, la recuperación de los atributos del BTS a nivel local respalda el hecho de que la recuperación observada en estudios a escalas menos detalladas, con insumos de percepción remota (Guerra-Martínez et al., 2019), corresponde efectivamente a una recuperación gradual en los valores de estructura, composición y diversidad y no únicamente al restablecimiento de la cobertura de las copas. Una vez que cesan las actividades agrícolas, las parcelas abandonadas muestran una capacidad autónoma de recuperar los atributos ecológicos que los convierten en bosques secundarios y, con el avance de la sucesión, estos atributos tienden a presentar características de los bosques maduros. El cese del disturbio antrópico es suficiente para disparar la recuperación de los atributos ecológicos en las áreas agrícolas abandonadas, ya que favorece el inicio de un proceso de restauración ecológica pasiva regida por la sucesión ecológica. Los patrones sucesionales descritos en este estudio son una referencia para establecer estrategias de manejo para los BTS. Por ejemplo, el conocer las especies que se presentan en cada etapa sucesional del BTS puede ser una estrategia para acelerar la sucesión secundaria y proponer trayectorias sucesionales a partir del establecimiento de especies de estados sucesionales intermedios y tardíos. Esto tiene implicaciones tanto en la conservación y la restauración del BTS, así como en la implementación de estrategias para contrarrestar el cambio climático, debido a la notable capacidad de capturar y almacenar cantidades grandes de CO2 por parte de los bosques secundarios
en áreas de BTS.
Agradecimientos
El primer autor agradece al Posgrado en Ciencias Biológicas de la Universidad Nacional Autónoma de México (UNAM) por la formación académica. Al Consejo Nacional de Ciencia y Tecnología (Conacyt) por la beca otorgada para realizar los estudios de doctorado de los cuales deriva este trabajo. Agradecemos al Instituto de Geografía, UNAM, por la infraestructura proporcionada y al Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT) de la UNAM, que permitió la investigación a través del proyecto IN300821. MAMM lamentamos tu pérdida.
Apéndice 1. Listado florístico de las especies leñosas presentes en parcelas de bosque secundario y la parcela de bosque maduro. Para cada familia, se indica entre paréntesis el número de géneros y especies.
| Taxa | Forma de crecimiento | Parcelas en la que se presenta |
| ACHATOCARPACEAE (1/1) | ||
| Achatocarpus gracilis H. Walter | Árbol o arbusto | 13, 15, 18, 19 |
| ANACARDIACEAE (2/2) | ||
| Amphipterygium adstringens (Schltdl.) Schiede ex Standl. | Árbol o arbusto | 19 |
| Spondias sp. | Árbol | 11 |
| APOCYNACEAE (1/1) | ||
| Tabernaemontana donnell-smithii Rose | Arbusto | 12, 14 |
| Apéndice 1. Continúa | ||
| Taxa | Forma de crecimiento | Parcelas en la que se presenta |
| BIGNONIACEAE (2/2) | ||
| Crescentia alata Kunth | Árbol | 8 |
| Mansoa hymenaea (DC.) A. H. Gentry | Bejuco | 7, 14 |
| BIXACEAE (1/1) | ||
| Cochlospermum vitifolium (Willd.) Spreng. | Árbol | 7 |
| BORAGINACEAE (2/6) | ||
| Cordia dentata Poir. | Árbol o arbusto | 6 |
| Cordia elaeagnoides A. DC. | Árbol | 14, 16 |
| Cordia seleriana Fernald | Árbol o arbusto | 6, 13, 14, 16, 18 |
| Cordia sp. | Árbol o arbusto | 12, 19 |
| Varronia curassavica Jacq. | Árbol o arbusto | 14 |
| Varronia inermis (Mill.) Borhidi | Árbol o arbusto | 7, 8, 9 |
| BURSERACEAE (1/4) | ||
| Bursera ariensis (Kunth) McVaugh et Rzed. | Árbol | 18 |
| Bursera copallifera (Moc. et Sessé ex DC.) Bullock | Árbol | 14 |
| Bursera simaruba (L.) Sarg. | Árbol | 16, 17, 19 |
| Bursera sp. | Árbol | 10 |
| CACTACEAE (1/1) | ||
| Pachycereus pecten-aboriginum (Engelm. ex S. Watson) Britton et Rose | Árbol candelabriforme | 8, 11, 12, 19 |
| CANNABACEAE (2/2) | ||
| Celtis iguanaea (Jacq.) Sarg. | Árbol o arbusto | 8, 12, 15, 16, 17, 19 |
| Trema micranthum (L.) Blume. | Árbol o arbusto | 3, 4, 6, 7, 9, 10, 11, 13, 14, 15, 16, 17, 18 |
| CAPPARACEAE (2/2) | ||
| Crateva tapia L. | Árbol | 7, 12, 14, 15, 16, 18 |
| Morisonia incana (Kunth) Christenh. et Byng | Árbol o arbusto | 14 |
| CARICACEAE (1/1) | ||
| Jacaratia mexicana A.DC. | Árbol | 18 |
| COMBRETACEAE (1/1) | ||
| Combretum fruticosum (Loefl.) Stuntz | Bejuco o arbusto | 14 |
| EUPHORBIACEAE (4/4) | ||
| Cnidoscolus sp. | Árbol o arbusto | 12 |
| Dalechampia scandens L. | Bejuco | 5, 19 |
| Euphorbia schlechtendalii Boiss. | Arbusto | 3, 7, 9, 17, 18 |
| Jatropha cinerea (Ortega) Müll.Arg. | Árbol o arbusto | 11, 16 |
| FABACEAE (14/24) | ||
| Enterolobium cyclocarpum (Jacq.) Griseb. | Árbol | 12, 18 |
| Gliricidia sepium (Jacq.) Steud. | Árbol o arbusto | 3, 15 |
| Haematoxylum brasiletto H.Karst. | Árbol | 11, 15, 19 |
| Apéndice 1. Continúa | ||
| Taxa | Forma de crecimiento | Parcelas en la que se presenta |
| Leucaena lanceolata S.Watson | Árbol | 3, 6, 7, 10, 13, 17, 19 |
| Leucaena leucocephala (Lam.) de Wit | Árbol | 14 |
| Leucaena sp. | Árbol | 10, 11, 19 |
| Libidibia coriaria (Jacq.) Schltdl. | Árbol o arbusto | 16 |
| Libidibia sp. | Árbol o arbusto | 15 |
| Lonchocarpus cochleatus Pittier | Árbol o arbusto | 18 |
| Lonchocarpus guatemalensis Benth. | Árbol o arbusto | 14 |
| Lonchocarpus sp. | Árbol o arbusto | 9, 12, 16, 17, 18 |
| Lysiloma divaricatum (Jacq.) J.F.Macbr. | Árbol | 3, 15, 16, 17, 19 |
| Mariosousa coulteri (Benth.) Seigler et Ebinger | Árbol | 2, 4, 6, 9, 14, 16 |
| Mimosa benthamii J.F.Macbr. | Arbusto | 9, 10, 13 |
| Mimosa zimapanensis Britton | Arbusto | 12 |
| Mimosa sp. | Arbusto | 10 |
| Parkinsonia aculeata L. | Árbol o arbusto | 8, 11, 13, 16, 19 |
| Pithecellobium dulce (Roxb.) Benth. | Árbol o arbusto | 4, 6, 8, 9, 13, 19 |
| Pithecellobium lanceolatum (Humb. et Bonpl. ex Willd.) Benth. | Árbol o arbusto | 19 |
| Prosopis juliflora (Sw.) DC. | Árbol o arbusto | 7, 9, 10, 12, 13, 14, 16, 17, 18, 19 |
| Prosopis laevigata (Humb. et Bonpl. ex Willd.) M.C.Johnst. | Árbol o arbusto | 1, 2, 4 |
| Senna atomaria (L.) H.S.Irwin et Barneby | Árbol o arbusto | 14, 15 |
| Vachellia campeachiana (Mill.) Seigler et Ebinger. | Árbol | 3, 5, 7, 9, 10, 11, 12, 13, 17, 19 |
| Vachellia farnesiana (L.) Wight et Arn. | Árbol | 1, 2, 3, 4, 5, 8, 12 |
| MALPIGHIACEAE (1/1) | ||
| Malpighia emarginata DC. | Arbusto | 19 |
| MALVACEAE (1/1) | ||
| Guazuma ulmifolia Lam. | Árbol o arbusto | 6, 8, 10, 14, 17, 18 |
| MELIACEAE (1/1) | ||
| Trichilia havanensis Jacq. | Árbol o arbusto | 17, 19 |
| MUNTINGIACEAE (1/1) | ||
| Muntingia calabura L. | Árbol o arbusto | 14 |
| POLYGONACEAE (3/4) | ||
| Coccoloba barbadensis Jacq. | Árbol o arbusto | 7, 17 |
| Coccoloba liebmannii Lindau | Árbol o arbusto | 5, 19 |
| Podopterus mexicanus Bonpl. | Árbol o arbusto | 7, 11, 12, 17 |
| Ruprechtia fusca Fernald | Árbol o arbusto | 9 |
| PRIMULACEAE (1/1) | ||
| Bonellia macrocarpa (Cav.) B.Ståhl et Källersjö | Árbol o arbusto | 5, 7, 8, 17 |
| RESEDACEAE (1/1) | ||
| Forchhammeria pallida Liebm. | Árbol | 7, 8, 10, 11, 16, 17, 18, 19 |
| RHAMNACEAE (1/1) | ||
| Sarcomphalus amole (Sessé et Moc.) Hauenschild | Árbol o arbusto | 6 |
| Apéndice 1. Continúa | ||
| Taxa | Forma de crecimiento | Parcelas en la que se presenta |
| RUBIACEAE (1/3) | ||
| Randia cinerea (Fernald) Standl. | Árbol o arbusto | 17 |
| Randia sp. | Árbol o arbusto | 17 |
| Randia thurberi S.Watson | Árbol o arbusto | 17, 19 |
| SALICACEAE (1/1) | ||
| Casearia corymbosa Kunth | Árbol o arbusto | 14 |
| SAPINDACEAE (1/1) | ||
| Thouinidium decandrum (Bonpl.) Radlk. | Árbol | 10, 14, 18 |
| ZYGOPHYLLACEAE (1/1) | ||
| Guaiacum coulteri A.Gray | Árbol o arbusto | 16, 18 |
Apéndice 2. Atributos de estructura, composición y diversidad de especies leñosas en parcelas de BTS con bosque secundario y la parcela de bosque maduro.
| Parcela | Años de abandono | Altura (m) | Número de individuos por ha | Área basal (m2/400 m2) | Número de especies (S) | Índice de Shannon (H’) |
| 1 | 3 | 3 | 5,575 | 0.13 | 3 | 0.826 |
| 2 | 3 | 4 | 3,000 | 1.27 | 2 | 0.245 |
| 3 | 6 | 6.4 | 750 | 2.86 | 8 | 1.622 |
| 4 | 7 | 6.4 | 1,175 | 1.28 | 5 | 0.708 |
| 5 | 8 | 5.1 | 1,200 | 1.76 | 5 | 0.762 |
| 6 | 10 | 10.1 | 1,500 | 0.93 | 8 | 1.703 |
| 7 | 11 | 8 | 1,525 | 1.58 | 13 | 1.843 |
| 8 | 12 | 6.9 | 975 | 1.69 | 9 | 1.398 |
| 9 | 13 | 7.1 | 675 | 0.79 | 10 | 2.098 |
| 10 | 14 | 7 | 1,275 | 3.34 | 11 | 1.854 |
| 11 | 15 | 7.1 | 625 | 2.85 | 10 | 2.019 |
| 12 | 20 | 6.7 | 525 | 3.51 | 14 | 2.491 |
| 13 | 22 | 5.4 | 1,025 | 0.99 | 12 | 2.008 |
| 14 | 23 | 11.6 | 1,875 | 2.40 | 19 | 2.329 |
| 15 | 30 | 6.9 | 1,125 | 4.03 | 10 | 1.837 |
| 16 | 35 | 8.1 | 1,025 | 2.68 | 15 | 2.386 |
| 17 | 40 | 11 | 1,250 | 3.99 | 19 | 2.701 |
| 18 | 50 | 7.8 | 1,475 | 5.18 | 16 | 2.134 |
| 19 | B. maduro | 7 | 1,475 | 1.38 | 26 | 3.030 |
Referencias
Arroyo-Rodríguez, V., Melo, F. P. L., Martínez-Ramos, M., Bongers, F., Chazdon, R. L., Meave, J. A. et al. (2017). Multiple successional pathways in human-modified tropical landscapes: new insights from forest succession, forest fragmentation and landscape ecology research. Biological Reviews, 92, 326–340. https://doi.org/10.1111/brv.12231
Avella, M. A., García G. N., Fajardo-Gutiérrez, F. y González-Melo, A. (2019). Patrones de sucesión secundaria en un bosque seco tropical interandino de Colombia: implicaciones para la restauración ecológica. Caldasia, 41, 12–27. https://doi.org/10.15446/caldasia.v41n1.65859
Beltrán-Rodríguez, L. A., Valdez-Hernández, J. I., Luna-Cavazos, M., Romero-Manzanares, A., Pineda-Herrera, E., Maldonado-Almanza, B. et al. (2018). Estructura y diversidad arbórea de bosques tropicales caducifolios secundarios en la Reserva de la Biosfera Sierra de Huautla, Morelos. Revista Mexicana de Biodiversidad, 89, 108–122. https://doi.org/10.22201/ib.20078706e.2018.1.2004
Bullock, S. H. (1995). Plant reproduction in neotropical dry forests. En S. H. Bullock, H. A. Mooney y E. Medina (Eds.), Seasonally dry tropical forests: (pp. 277–303). Cambridge: Cambridge University Press. https://doi.org/10.1017/CBO9780511753398.011
Chazdon, R. L. (2014). Second growth: the promise of tropical forest regeneration in an age of deforestation. Yokohama, Japan: University of Chicago Press. Retrieved from https://books.google.com.mx/books?id=buJcngEACAAJ
Chazdon, R. L., Letcher, S. G., van Breugel, M., Martínez-Ramos, M., Bongers, F. y Finegan, B. (2007). Rates of change in tree communities of secondary Neotropical forests following major disturbances. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 362, 273–289. https://doi.org/10.1098/rstb.2006.1990
Chazdon, R. L., Peres, C. A., Dent, D., Sheil, D., Lugo, A. E., Lamb, D. et al. (2009). The potential for species conservation in tropical secondary forests. Conservation Biology, 23, 1406–1417. https://doi.org/10.1111/j.1523-1739.2009.01338.x
Conabio. (2016). EncicloVida. México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Recuperado el 07 octubre, 2019 de: http://www.enciclovida.mx
Derroire, G., Balvanera, P., Castellanos-Castro, C., Decocq, G., Kennard, D. K., Lebrija-Trejos, E. et al. (2016). Resilience of tropical dry forests – a meta-analysis of changes in species diversity and composition during secondary succession. Oikos, 125, 1386-1397. https://doi.org/10.1111/oik.03229
Dupuy, J. M. J., Hernández-Stefanoni, J. L., Hernández-Juárez, R. A., Tetetla-Rangel, E., López-Martínez, J. O., Leyequién-Abarca, E. et al. (2012). Patterns and correlates of tropical dry forest structure and composition in a highly replicated chronosequence in Yucatan, Mexico. Biotropica, 44, 1–12. https://doi.org/10.1111/j.1744-7429.2011.00783.x
FAO (Organización de las Naciones Unidas para la Alimentación y la Agricultura). (2015). Global forest resources assessment 2015. Desk reference. https://doi.org/10.1002/2014GB005021
García, E. (2004). Modificaciones al sistema de clasificación climática de Köppen. México D.F.: Instituto de Geografía, Universidad Nacional Autónoma de México.
Guerra-Martínez, F., García-Romero, A., Cruz-Mendoza, A. y Osorio-Olvera, L. (2019). Regional analysis of indirect factors affecting the recovery, degradation and deforestation in the tropical dry forests of Oaxaca, Mexico. Singapore Journal of Tropical Geography, 40, 387–409. https://doi.org/10.1111/sjtg.12281
Gunderson, L. H. (2000). Ecological resilience —in theory and application. Annual Review of Ecology and Systematics, 31, 425–439. https://doi.org/10.1146/annurev.ecolsys.31.1.425
Hodgson, D., McDonald, J. L. y Hosken, D. J. (2015). What do you mean, “resilient”? Trends in Ecology and Evolution, 30, 503–506. https://doi.org/10.1016/j.tree.2015.06.010
Huisman, J., Olff, H. y Fresco, L. F. M. (1993). A hierarchical set of models for species response analysis. Journal of Vegetation Science, 4, 37–46. https://doi.org/10.2307/3235732
INEGI (Instituto Nacional de Estadística y Geografía). (2010). Compendio de información geográfica municipal 2010, Santo Domingo Tehuantepec, Oaxaca. Aguascalientes, Ags., México.
INEGI (Instituto Nacional de Estadística y Geografía). (2017). Uso del suelo y vegetación, escala 1:250000, serie VI (continuo nacional). Aguascalientes, México.
Jansen, F. y Oksanen, J. (2013). How to model species responses along ecological gradients – Huisman-Olff-Fresco models revisited. Journal of Vegetation Science, 24, 1108–1117. https://doi.org/10.1111/jvs.12050
Johnson, E. A. y Miyanishi, K. (2008). Testing the assumptions of chronosequences in succession. Ecology Letters, 11, 419–431. https://doi.org/10.1111/j.1461-0248.2008.01173.x
Kaufman, L. H. (1982). Stream aufwuchs accumulation: disturbance frequency and stress resistance and resilience. Oecologia, 52, 57–63. https://doi.org/10.1007/BF00349012
Kennard, D. K. (2002). Secondary forest succession in a tropical dry forest: patterns of development across a 50-year chronosequence in lowland Bolivia. Journal of Tropical Ecology, 18, 53–66. https://doi.org/10.1017/S0266467402002031
Kennard, D. K., Gould, K., Putz, F. E., Fredericksen, T. S. y Morales, F. (2002). Effect of disturbance intensity on regeneration mechanisms in a tropical dry forest. Forest Ecology and Management, 162, 197–208. https://doi.org/10.1016/S0378-1127(01)00506-0
Lebrija-Trejos, E., Bongers, F., Pérez-García, E. A. y Meave, J. A. (2008). Successional change and resilience of a very dry tropical deciduous forest following shifting agriculture. Biotropica, 40, 422–431. https://doi.org/10.1111/j.1744-7429.2008.00398.x
Lebrija-Trejos, E., Eduardo, A. P., Meave, J. A., Poorter, L. y Bongers, F. (2011). Environmental changes during secondary succession in a tropical dry forest in Mexico. Journal of Tropical Ecology, 27, 477–489. https://doi.org/10.1017/S0266467411000253
Lebrija-Trejos, E., Meave, J. A., Poorter, L., Pérez-garcía, E. A. y Bongers, F. (2010). Pathways, mechanisms and predictability of vegetation change during tropical dry forest succession. Perspectives in Plant Ecology, Evolution and Systematics, 12, 267–275. https://doi.org/10.1016/j.ppees.2010.09.002
Lebrija-Trejos, E., Pérez-García, E. A., Meave, J. A., Bongers, F. y Poorter, L. (2010). Functional traits and environmental filtering drive community assembly in a species-rich tropical system. Ecology, 91, 386–398. https://doi.org/10.1890/08-1449.1
Lloret, F., Keeling, E. G. y Sala, A. (2011). Components of tree resilience: effects of successive low-growth episodes in old ponderosa pine forests. Oikos, 120, 1909–1920. https://doi.org/10.1111/j.1600-0706.2011.19372.x
Lomelí-Jiménez, A. J., Pérez-Salicrup, D. R., Figueroa-Rangel, B. L., Mendoza-Cantú, M. E., Cuevas-Guzmán, R., Andresen, E. et al. (2017). Are changes in remotely sensed canopy cover associated to changes in vegetation structure, diversity, and composition in recovered tropical shrublands? Plant Ecology, 218, 1021–1033. https://doi.org/10.1007/s11258-017-0750-x
Maass, M. y Burgos, A. (2011). Water dynamics at the ecosystem level in seasonally dry tropical forests. En R. Dirzo, H. S. Young, H. A. Mooney y G. Ceballos (Eds.), Seasonally dry tropical forests: ecology and conservation (pp. 141–156). Washington, DC: Island Press. https://doi.org/10.5822/978-1-61091-021-7_9
MacGillivray, C. W. y Grime, J. P. (1995). Testing Predictions of the Resistance and Resilience of Vegetation Subjected to Extreme Events. Functional Ecology, 9, 640. https://doi.org/10.2307/2390156
Miles, L., Newton, A. C., DeFries, R. S., Ravilious, C., May, I., Blyth, S. et al. (2006). A global overview of the conservation status of tropical dry forests. Journal of Biogeography, 33, 491–505. https://doi.org/10.1111/j.1365-2699.2005.01424.x
Mooney, H. A. (2011). Synthesis and promising lines of research on seasonally dry tropical forests. En R. Dirzo, H. S. Young, H. A. Mooney y G. Ceballos (Eds.), Seasonally dry tropical forests: ecology and conservation (pp. 301–306). Washington, DC: Island Press/Center for Resource Economics. https://doi.org/10.5822/978-1-61091-021-7_17
Mooney, H. A., Bullock, S. H. y Medina, E. (1995). Introduction. In S. H. Bullock, H. A. Mooney y E. Medina (Eds.), Seasonally dry tropical forests (pp. 1–8). Cambridge, RU: Cambridge University Press.
Murphy, P. G. y Lugo, A. E. (1986). Ecology of tropical dry forest. Annual Review of Ecology and Systematics, 17, 67–88. https://doi.org/10.1146/annurev.es.17.110186.000435
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D. et al. (2019). vegan: Community Ecology Package. https://cran.r-project.org/package=vegan
Osorio-Olvera, L., Barve, V., Barve, N., Soberón, J. y Falconi, M. (2018). ntbox: From getting biodiversity data to evaluating species distribution models in a friendly GUI environment. R package version 0.2.5.4. Recuperado el 25 noviembre, 2019 de: https://github.com/luismurao
Pérez-Báez, G., Cata, V., Riestenberg, K., López-Cartas, R., López-López, R. G., Morales-Carranza, G. et al. (2016). Guie’ gui’xhi stinu guidxi riale bi. Plantas representativas de la ventosa, Oaxaca. Smithsonian Institution. Recuperado el 25 noviembre, 2019 de: www.naturalhistory.si.edu/neho/laventosa
Pérez-García, E. A. y Meave, J. A. (2005). Heterogeneity of xerophytic vegetation of limestone outcrops in a tropical deciduous forest region in southern México. Plant Ecology, 175, 147–163. https://doi.org/10.1007/s11258-005-4841-8
Poorter, L., Rozendaal, D. M. A., Bongers, F., de Almeida-Cortez, J. S., Almeyda Zambrano, A. M., Álvarez, F. S. et al. (2019). Wet and dry tropical forests show opposite successional pathways in wood density but converge over time. Nature Ecology and Evolution, 3, 928–934. https://doi.org/10.1038/s41559-019-0882-6
Powers, J. S., Becknell, J. M., Irving, J. y Pérez-Aviles, D. (2009). Diversity and structure of regenerating tropical dry forests in Costa Rica: Geographic patterns and environmental drivers. Forest Ecology and Management, 258, 959–970. https://doi.org/10.1016/j.foreco.2008.10.036
Quesada, M., Álvarez-Añorve, M., Ávila-Cabadilla, L., Castillo, A., Lopezaraiza-Mikel, M., Martén-Rodríguez, S. et al. (2013). Tropical dry forest ecological succession in Mexico: synthesis of a long-term study. En A. Sanchez-Azofeifa, J. S. Powers, G. W. Fernandes y M. Quesada (Eds.), Tropical dry forests in the Americas: ecology, conservation and management (pp. 17–33). Boca Raton, FL: CRC Press/ Taylor y Francis.
R Core Team. (2019). R: a language and environment for statistical computing. Vienna, Austria. https://www.r-project.org/
Rivera, L. W. y Aide, T. M. (1998). Forest recovery in the karst region of Puerto Rico. Forest Ecology and Management, 108, 63–75. https://doi.org/10.1016/S0378-1127(97)00349-6
Robertson, T., Döring, M., Guralnick, R., Bloom, D., Wieczorek, J., Braak, K. et al. (2014). The GBIF integrated publishing toolkit: Facilitating the efficient publishing of biodiversity data on the internet. Plos One, 9, e102623. https://doi.org/10.1371/journal.pone.0102623
Rozendaal, D. M. A., Bongers, F., Aide, T. M., Alvarez-Dávila, E., Ascarrunz, N., Balvanera, P. et al. (2019). Biodiversity recovery of Neotropical secondary forests. Science Advances, 5, eaau3114. https://doi.org/10.1126/sciadv.aau3114
Ruiz, J., Fandino, M. C. y Chazdon, R. L. (2005). Vegetation structure, composition, and species richness across a 56-year chronosequence of dry tropical forest on Providencia Island, Colombia1. Biotropica, 37, 520–530. https://doi.org/10.1111/j.1744-7429.2005.00070.x
Rykiel, J. E. J. (1985). Towards a definition of ecological disturbance. Australian Journal of Ecology, 10, 361–365. https://doi.org/10.1111/j.1442-9993.1985.tb00897.x
Salas-Morales, S. H., González, E. J. y Meave, J. A. (2018). Canopy height variation and environmental heterogeneity in the tropical dry forests of coastal Oaxaca, Mexico. Biotropica, 50, 26–38. https://doi.org/10.1111/btp.12491
Salas-Morales, S. H., Meave, J. A. y Trejo, I. (2015). The relationship of meteorological patterns with changes in floristic richness along a large elevational gradient in a seasonally dry region of southern Mexico. International Journal of Biometeorology, 59, 1861–1874. https://doi.org/10.1007/s00484-015-0993-y
Sánchez-Azofeifa, G. A. y Portillo-Quintero, C. (2011). Extent and drivers of change of neotropical seasonally dry tropical forests. En R. Dirzo, H. S. Young, H. A. Mooney y G. Ceballos (Eds.), Seasonally dry tropical forests: ecology and conservation (pp. 45–57). Washington, D.C.: Island Press. https://doi.org/10.5822/978-1-61091-021-7
Sánchez-Azofeifa, G. A., Quesada, M., Rodríguez, J. P., Nassar, J. M., Stoner, K. E., Castillo, A. et al. (2005). Research priorities for neotropical dry forests. Biotropica, 37, 477–485. https://doi.org/10.1111/j.1744-7429.2005.00066.x
Silver, W. L., Ostertag, R. y Lugo, A. E. (2000). The potential for carbon sequestration through reforestationof abandoned tropical agricultural and pasture lands. Restoration Ecology, 8, 394–407. https://doi.org/10.1046/j.1526-100X.2000.80054.x
Smithsonian Institution. (2019). Flowering plants and ferns La Ventosa Ethnobotany Botany. Recuperado el 30 julio, 2019 de: https://www.si.edu/collection/search?edan_q=*:*yedan_fq[]=set_name:%22La+Ventosa+Ethnobotany%22
Torres-Colín, R., Torres-Colín, L., Dávila-Aranda, P. y Villaseñor, J. L. (1997). XVI. Flora of the district of Tehuantepec, Oaxaca. Mexico florist listings. México D.F.: Instituto de Biología, Universidad Nacional Autónoma de México.
Vesk, P. A. y Westoby, M. (2004). Sprouting ability across diverse disturbances and vegetation types worldwide. Journal of Ecology, 92, 310–320. https://doi.org/10.1111/j.0022-0477.2004.00871.x
Wright, S. J. y Muller-Landau, H. C. (2006). The future of tropical forest species. Biotropica, 38, 287–301. https://doi.org/10.1111/j.1744-7429.2006.00154.x