Pedro de Jesús Parra-Gil (a), Karen Baltazar-Meneses (b), Ignacio Castellanos (b), *, Jesús Romero-Nápoles (c), Miguel Ángel Martínez-Morales (d) y Jorge Arturo Cid-Becerra (e)
Laboratorio de Fitopatología y Plagas, Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo, Avenida Universidad, Km. 1, Rancho Universitario, 43600 Tulancingo, Hidalgo, México
b Centro de Investigaciones Biológicas, Universidad Autónoma del Estado de Hidalgo, Carretera Pachuca-Tulancingo, Km. 4.5, 42074 Mineral de la Reforma, Hidalgo, México
c Instituto de Fitosanidad, Colegio de Posgraduados, Km. 36.5 Carretera federal México-Texcoco, 56230 Montecillo, Estado de México, México
d Departamento de Conservación de la Biodiversidad, El Colegio de la Frontera Sur, Carretera Panamericana y Periférico Sur s/n, Barrio María Auxiliadora, 29290 San Cristóbal de las Casas, Chiapas, México
e Restauración de Ecosistemas A.C., Misión Santo Domingo 3994 Sur, Las Misiones, 81290 Los Mochis, Sinaloa, México
*Autor para correspondencia: ignacioe@uaeh.edu.mx (I. Castellanos)
Recibido: 1 noviembre 2018; aceptado: 7 mayo 2020
Resumen
Para evaluar el efecto que pueden tener los escarabajos (Bruchidae) que consumen semillas durante el establecimiento del mezquite Prosopis laevigata en el valle del Mezquital, Hidalgo, se cuantificó el daño en las semillas de 20 árboles. Se determinó si el daño afecta la viabilidad de las semillas, si los escarabajos tienen preferencia por algún tamaño de semilla y si el tamaño del escarabajo y el tamaño de la semilla de la cual emergen están relacionados. El 22% de las semillas presentó daño por escarabajos en la etapa de predispersión y el daño después de 2, 4 y 6 meses de que éstas caen al suelo fue de 32.0, 54.4 y 66.3%, respectivamente. Las semillas dañadas por los escarabajos no germinaron porque éstos dañan el embrión. Los brúquidos utilizan semillas de mayor tamaño para ovipositar y el tamaño de los escarabajos tuvo una relación positiva y significativa con el tamaño de las semillas de las cuales emergieron. La pérdida de semillas por brúquidos y su preferencia por semillas de mayor tamaño para ovipositar pueden limitar el establecimiento de P. laevigata, aunque aun quedan por evaluar las posibles implicaciones ecológicas de esta depredación de semillas en las poblaciones de mezquite.
Palabras clave: Algarobius; Bruchinae; Leguminosa; Plaga; Prosopis
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Preference and predation of mesquite seeds by beetles (Coleoptera: Bruchidae)
Abstract
To assess the effect of beetles (Bruchidae) that consume seeds on the establishment of Prosopis laevigata in the Mezquital Valley, Hidalgo, the damage they cause in the seeds of 20 trees was quantified. We assessed if the damage affects seed viability, if the beetles have preference for some seed size and if beetle size is related to the size of the seed from which it emerges. Twenty-two percent of the seeds presented damage by beetles in the pre-dispersion stage, and 2, 4 and 6 months after they had fallen to the ground, the damage was 32.0, 54.4 and 66.3%, respectively. The seeds damaged by beetles did not germinate because they damaged the embryo. Bruchids use larger sized seeds for oviposition and beetle size was positively and significantly related with the size of the seeds from which they emerged. The loss of seeds by bruchids and their preference for larger seeds to oviposit may limit the establishment of P. laevigata, although the potential ecological implications of this seed predation still needs to be assessed.
Keywords: Algarobius; Bruchinae; Leguminose; Pest; Prosopis
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Las especies del género Prosopis (Fabaceae) incluyen árboles de zonas áridas y semiáridas que ofrecen diversos beneficios a los ecosistemas donde se encuentran. En estos sitios los árboles contribuyen de forma importante al enriquecimiento del suelo, aumentando el número de microorganismos y nutrientes (Frías-Hernández et al., 1999; Herrera-Arreola et al., 2007). Además, los árboles de mezquite proporcionan polen, néctar y sitios de percha a diversas especies de invertebrados y vertebrados, y sus hojas y vainas son utilizadas como alimento por diferentes especies de vertebrados (Golubov et al., 2001; Sánchez-de la Vega y Godínez-Álvarez, 2010; Sawal et al., 2004). Sus vainas también son utilizadas por el hombre como alimento (Felker et al., 2013; Galindo y García, 1986), mientras que la madera es empleada como combustible y en la construcción (Rodríguez-Anda et al., 2015) y algunas partes de la planta como la corteza y las hojas se emplean como medicamentos (Galindo y García, 1986; García-Andrade et al., 2013) y para la producción de fibra y etanol (Reveles-Saucedo et al., 2010; Saravanakumar et al., 2013).
La tala de los árboles de mezquite para su aprovechamiento, su lenta regeneración natural y el cambio de uso del suelo han causado una reducción importante en la abundancia de las especies de Prosopis en México (Caciano et al., 2011; Flores, 1993; Rodríguez et al., 2014; Vallejo et al., 2012). Aunado a lo anterior, se conoce que las semillas de las especies de Prosopis son consumidas por escarabajos de la familia Bruchidae (Johnson, 1983; Velez et al., 2018), pudiendo dañar desde 5% de las semillas en la etapa de la predispersión (Velez et al., 2018) hasta 100% en semillas almacenadas (Salas-Araiza et al., 2001). La herbivoría por brúquidos es de especial interés, ya que durante su desarrollo larvario se alimentan de las semillas, lo cual puede reducir su viabilidad o no germinar al consumirlas parcial o totalmente (Johnson, 1983; Kingsolver et al., 1977). Sin embargo, el daño por brúquidos también puede elevar la permeabilidad y germinabilidad de las semillas (da Silva y Rossi, 2019; Fox et al., 2010, 2012; Takakura, 2002). Adicionalmente, los brúquidos pueden seleccionar las semillas de mayor tamaño para ovipositar y proporcionarle a sus crías una mayor cantidad y calidad de alimento y como en algunas especies de Prosopis el tamaño de las semillas está relacionado positivamente con su viabilidad (Cope y Fox, 2003; Cuny et al., 2017; Johnson y Kistler, 1987; Manga y Sen, 1995), la depredación diferencial de semillas de mayor tamaño podría restringir el establecimiento de futuras plántulas (Leishman et al., 2000; Moegenburg, 1996). Hasta ahora, no se han analizado los posibles efectos que los brúquidos pueden tener sobre la germinación de semillas de mezquites, particularmente en un paisaje agrícola con relictos de mezquitales e individuos aislados. Por lo tanto, en el presente trabajo evaluamos el efecto del consumo de semillas por brúquidos sobre una población de árboles de P. laevigata en el valle del Mezquital, Hidalgo. Para ello se planteó: 1) cuantificar el porcentaje de semillas de Prosopis laevigata (Humb, et Bonpl. ex Willd.) M.C. Johnst. con daño, 2) determinar si el daño causado por brúquidos afecta la germinación de las semillas, 3) si los insectos tienen preferencia por algún tamaño de semilla, y 4) si existe alguna relación entre el tamaño del escarabajo y el tamaño de la semilla de la cual emergió.
Materiales y métodos
La recolecta de vainas para obtener las semillas se realizó en 20 árboles durante el ciclo de fructificación de 2009-2010 en un área de 20 × 20 km en el valle del Mezquital, Hidalgo. Los 20 árboles, de un diámetro a la altura del pecho > 40 cm, estaban separados entre sí por más de 500 m y alejados por más de 30 m de algún otro árbol en fructificación. Se utilizó una distancia de 500 m entre árboles para tener independencia entre los árboles de estudio (Baltazar-Meneses, 2011). Se recolectó un total de 2,880 vainas de los 20 árboles, 36 de cada árbol en 4 etapas de su desarrollo. La primera recolecta se realizó en junio 2009, cuando las vainas ya secas aun estaban adheridas a la planta (predispersión) y a los 2 (septiembre), 4 (noviembre) y 6 (enero) meses después de que los frutos habían caído al suelo. En los árboles la recolecta se realizó de la siguiente manera: 3 vainas de la parte inferior, 3 de la parte media y 3 de la parte superior del dosel, en cada uno de los 4 puntos cardinales (36 vainas en total en cada árbol). Las vainas recolectadas en el suelo bajo el dosel (36 vainas en cada árbol para cada fecha de recolecta) fueron producidas por los árboles en el año 2009, por lo que representaban la herbivoría acumulada del mismo ciclo. Se recolectaron vainas de 9-12 cm de longitud (10.43 ± 0.13 cm; promedio ± EE, n = 360).
Las vainas recolectadas se colocaron dentro de una incubadora a 25 ± 1 oC y fueron revisadas cada 12 h durante 5 semanas para aislar a los brúquidos que iban emergiendo, posteriormente se obtuvo el porcentaje de semillas con daño. Para cuantificar las semillas dañadas que habían caído al suelo, éstas se revisaron después de 5 semanas de haberlas recolectado. Estudios previos indican que 4 semanas es el tiempo en que los brúquidos completan su desarrollo de huevo a adulto a 25 ± 1 oC, por lo que, si de una semilla no emergió un insecto después de 5 semanas, se consideró que no había sido ovipositada. De esta forma no sólo se cuantificó el daño ocasionado por los insectos que ya habían emergido, sino también el daño ocasionado por los brúquidos que fueron saliendo de las semillas (Velez et al., 2018).
Para determinar si los insectos afectan la germinación de las semillas y medir el daño ocasionado en el tejido interno, se utilizaron semillas de las vainas recolectadas durante la etapa de predispersión. Las semillas se extrajeron manualmente y se revisaron y separaron en 2 grupos, semillas que presentaban orificio de salida de insectos y semillas sin daño. Estas últimas se pusieron en contenedores y fueron inspeccionadas cada 12 h para identificar cada insecto que emergía y la semilla de la que había salido. Si al momento de examinar las semillas se encontraban 2 o más brúquidos, éstos no se consideraban ya que se desconocía la semilla de la cual había emergido cada uno y estas semillas se separaban del resto. Se aislaron e identificaron 179 brúquidos y las semillas de las cuales éstos emergieron en 10 de los 20 árboles. Se seleccionaron al azar 70 de las 179 semillas con orificio de emergencia para evaluar su germinación y compararla con la germinación de 279 semillas sin daño elegidas aleatoriamente. Las semillas sin presencia de brúquidos no presentaban orificio de emergencia, ni larvas y huevos. Las semillas fueron escarificadas mecánicamente y colocadas en cajas Petri con papel filtro húmedo dentro de una incubadora a 35 ± 1 oC para registrar su germinación durante un periodo de 30 días (Sobrevilla-Solis et al., 2013). Para registrar el porcentaje de tejido removido por los insectos, se utilizaron 71 de las 179 semillas con orificios, y también se determinó si había daño en el embrión. El embrión se consideró dañado cuando éste no estaba presente en la semilla. Las semillas se pesaron y su peso se restó del peso registrado en semillas no dañadas. Para estimar el peso que tendría una semilla si no hubiera recibido daño por el brúquido, se utilizó la función lineal Y = 0.0726X + 0.00883, donde Y es el peso estimado que la semilla tendría de no haber sido consumida y X = largo + ancho + espesor de la semilla dañada (R2 = 91%). El largo, ancho y espesor de cada semilla se midió con un micrómetro insertado en uno de los oculares de un microscopio estereoscópico.
Para determinar si los brúquidos tuvieron preferencia por semillas de mayor tamaño para ovipositar, se comparó el peso estimado de las semillas de las cuales emergieron escarabajos (semillas seleccionadas; n = 71) con el peso de semillas sin daño seleccionadas al azar (semillas sin presencia de brúquidos; n = 60). Para estimar el peso que tendría una semilla si no hubiera recibido daño por el brúquido, se empleó la función lineal anteriormente descrita. Para determinar si el tamaño del insecto estaba relacionado con el tamaño de la semilla de la cual emergió, se examinó la relación entre el ancho del pronoto de los insectos y el peso estimado de las semillas. El ancho del pronoto ha sido utilizado como una medida del tamaño corporal en brúquidos, que a su vez está relacionado positivamente con el éxito reproductivo de estos insectos (Colgoni y Vamosi, 2006; Fox et al., 1995; Gianoli et al., 2007).
El porcentaje de germinación de las semillas con y sin daño se comparó con pruebas de bondad de ajuste de X2. Se utilizó un análisis de varianza de una vía para comparar el tamaño de las semillas sin presencia de escarabajos con aquellas seleccionadas por las diferentes especies de brúquidos y las comparaciones a posteriori se realizaron con una prueba de Tukey. Se utilizaron regresiones lineales simples para analizar la relación entre el tamaño de los insectos y el peso estimado de las semillas. Se verificaron los supuestos de homogeneidad de varianzas y normalidad de los datos para el análisis de varianza y la regresión lineal. Todos los análisis se realizaron con el paquete estadístico SAS (SAS Institute, 1997).
Resultados
Se encontró que las especies de brúquidos Mimosestes protractus (Horn, 1873), M. amicus (Horn, 1873), Algarobius johnsoni Kingsolver, 1986 y A. atratus Kingsolver, 1986 se alimentan de semillas de P. laevigata en la etapa de predispersión, al igual que a los 2, 4 y 6 meses después de que éstas han caído al suelo. También se encontró a parasitoides himenópteros emergiendo de estas semillas en un bajo porcentaje (< 1%). En los análisis de germinación, daño de los tejidos internos y selección de semillas solamente se incluyeron semillas de las cuales emergieron individuos de A. johnsoni y A. atratus debido a que se encontraron muy pocos individuos de M. protractus y M. amicus (n = 2/179 y n = 5/179, respectivamente) y solamente para 10 de los 20 árboles se tuvo certeza de que cada brúquido que emergió pertenecía a una semilla particular.
El porcentaje de semillas que presentaron daño causado por brúquidos en la etapa de predispersión fue de 22.0% (1,901 de 8,640 semillas) y después de 2, 4 y 6 meses de que las vainas habían caído al suelo fue de 32.0% (2,923 de 9,135), 54.4% (4,465 de 8,208) y 66.3% (3,100 de 4,680), respectivamente. Los porcentajes de semillas con daño por brúquidos por árbol variaron entre 17 y 29 en la etapa de predispersión y después de 2, 4 y 6 meses de que las vainas habían caído al suelo el porcentaje de semillas con daño por árbol varió entre 29 a 37, 46 a 62 y 56 a 72, respectivamente, y los árboles que recibieron mayor y menor porcentaje de daño en sus semillas no fueron los mismos en los 4 muestreos.
El porcentaje de germinación de las semillas dañadas por brúquidos de la etapa de predispersión fue de 0% (A. johnsoni, n = 35 y A. atratus, n = 35) y difirió del porcentaje de germinación de las semillas sin daño, el cual fue de 15.8% (n = 279) (X2 = 12.63, g.l. = 1, p = 0.001). Algarobius johnsoni y A. atratus removieron el 57.66 ± 1.02% (n = 38) y el 53.92 ± 1.88% (n = 33) del tejido interno de las semillas y ambas especies consumieron el embrión.
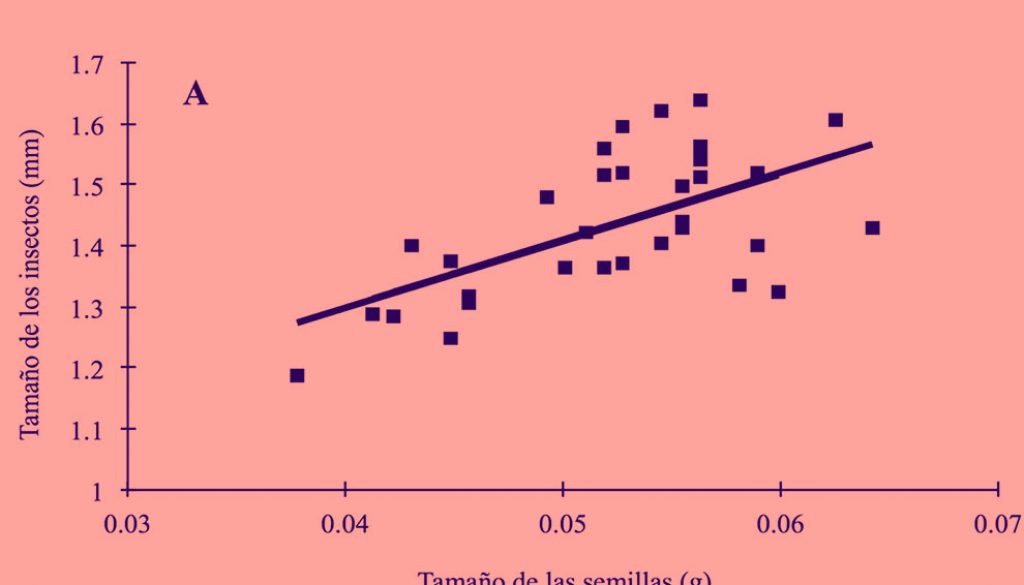
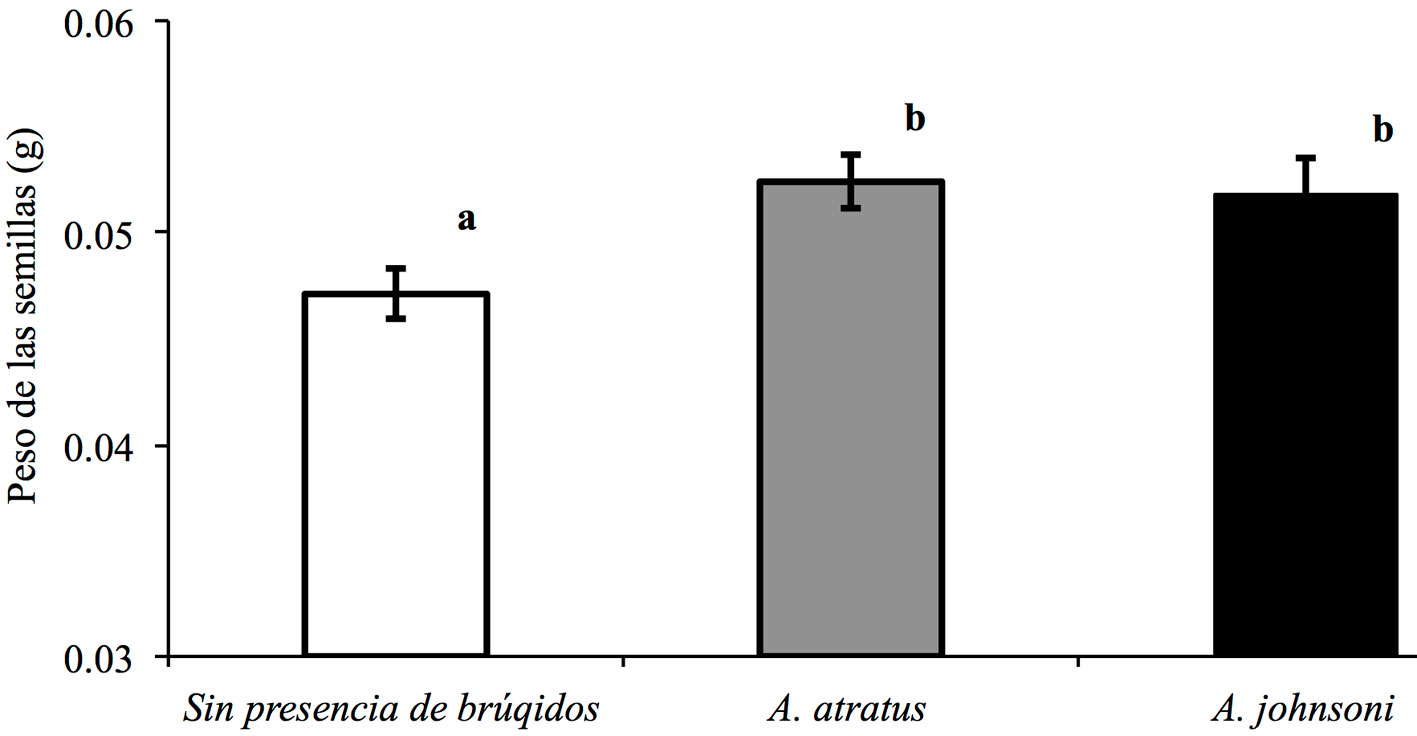
Los datos para el análisis de varianza y la regresión lineal cumplieron con los supuestos de homogeneidad de varianzas y normalidad. Los resultados del análisis mostraron que el tamaño de las semillas seleccionadas por A. atratus (0.052 ± 0.001 g, n = 38) y A. johnsoni (0.051 ± 0.002 g, n = 33) fue significativamente mayor que el tamaño de las semillas sin presencia de brúquidos (0.047 ± 0.001 g, n = 60) (F2,130 = 4.89, p = 0.009; fig. 1) y los tamaños de las semillas seleccionadas por las 2 especies de brúquidos no difirieron significativamente (p = 0.898) (fig. 1). Por otro lado, se encontró una relación positiva y significativa entre el tamaño de los insectos y el tamaño de las semillas de las cuales emergieron (A. atratus: F1,32 = 17.8, R2 = 34.4, p = 0001 y A. johnsoni: F1,30 = 8.8, R2 = 20.6, p = 0.006; fig. 2).
Discusión
Los porcentajes de semillas que presentaron daño por brúquidos en la etapa de predispersión y después de que éstas habían caído al suelo se encuentran dentro de los rangos reportados para otras especies de Prosopis en su hábitat nativo (Ortega-Baes et al., 2001; Velez et al., 2018); sin embargo, en la mayoría de los estudios en los que se ha registrado el daño de las semillas de Prosopis por brúquidos, solamente se ha cuantificado el daño en la etapa de predispersión (Velez et al., 2018). Nosotros encontramos que el porcentaje de daño se incrementa cuando las semillas están en el suelo, lo cual muestra que el daño por brúquidos en la etapa de predispersión representa una subestimación del daño total, como ha sido sugerido por Velez et al. (2018). La actividad de los brúquidos en el valle del Mezquital se detiene en noviembre, cuando los insectos entran en diapausa en el interior de las semillas y se reanuda en marzo, cuando los escarabajos salen de la diapausa (datos no publicados). Por lo tanto, el porcentaje de daño de las semillas podría incrementar si al salir de la diapausa, los brúquidos tienen acceso a las semillas que permanecen en el suelo (Ortega-Baes et al., 2001).
Las 4 especies de brúquidos encontradas en este trabajo ya han sido reportadas alimentándose de las semillas de P. laevigata (Salas-Araiza et al., 2001). También se ha reportado que las especies de Algarobius son los brúquidos más abundantes en P. laevigata (Reséndez-Velázquez y González-Castillo, 2016; Salas-Araiza et al., 2001), lo cual probablemente se debe a que las especies de Algarobius son especialistas de Prosopis, mientras que las especies de Mimosestes se alimentan de varias especies de leguminosas (Johnson, 1983; Kingsolver, 1986).

Las semillas con daño por brúquidos no germinaron. En algunas especies de fabáceas se ha registrado que los orificios hechos por brúquidos en las semillas incrementan su permeabilidad y germinabilidad cuando los insectos consumen un bajo porcentaje de los tejidos y no dañan el embrión (Fox et al., 2012; Halevey, 1974; Lamprey et al., 1974; Takakura, 2002). Sin embargo, esto no ocurrió en las semillas de P. laevigata estudiadas, de las cuales emergieron principalmente A. johnsoni y A. atratus, ya que los insectos dañaron el embrión. Hasta donde tenemos conocimiento, éste es el primer trabajo que demuestra que los brúquidos depredan las semillas de P. laevigata debido al daño que causan al embrión. Sin embargo, otros autores como Palleres (2007), han encontrado que algunos brúquidos como Scutobruchus vinalicola no dañan los embriones de las semillas de algunas especies de Prosopis, P. flexuosa, y solo consumen parcialmente los cotiledones. Por lo tanto, es recomendable realizar pruebas de germinación y cuantificar el daño infringido por los brúquidos en las semillas de diferentes especies de Prosopis para poder tener mayor certeza del efecto que estos escarabajos pueden tener sobre la viabilidad de las semillas (Fox et al., 2012).
Los resultados muestran que los brúquidos A. atratus y A. johnsoni emergen de semillas de mayor tamaño que el tamaño promedio de las semillas sin estos escarabajos. Éste es un fenómeno común en este grupo de escarabajos, ya que las hembras seleccionan para ovipositar semillas que les proporcionen a sus crías una mayor cantidad y/o calidad de recursos (Cope y Fox, 2003; Fox et al., 1996; Szentesi y Jermy, 1993; Yang y Fushing, 2008). Al parecer, la relación positiva entre el tamaño de los individuos de A. atratus y A. johnsoni y el tamaño de las semillas de las cuales emergieron no se debe a la cantidad total de tejido de las semillas ya que los insectos sólo consumieron el 55.6 ± 1.01% del tejido de las semillas (entre 34.2 y 67.9%, n = 71). Por lo tanto, es probable que los insectos estén seleccionando semillas de mayor tamaño debido a que éstas contienen un mayor contenido de nutrientes y/o una menor concentración de metabolitos secundarios, como se ha visto que ocurre en otras especies de brúquidos que seleccionan semillas de mayor tamaño (Schlichta et al., 2018).
Si las semillas de mayor tamaño son seleccionadas primero por los insectos, entonces el tamaño promedio disponible para oviposición iría disminuyendo con el tiempo (e.g., Morandini y de Viana, 2009) y posiblemente también el tamaño de los brúquidos, lo cual tendría repercusiones en el desempeño de los insectos, ya que su tamaño corporal está relacionado con su éxito reproductivo (Fox et al. 1995; Gianoli et al., 2007). Además, si el tamaño de las semillas de P. laevigata está relacionado positivamente con su viabilidad, como en otras especies de Prosopis (Manga y Sen, 1995), los brúquidos afectarían negativamente el establecimiento de las plántulas (Leishman et al., 2000; Moegenburg, 1996). Por lo tanto, es importante entender la dinámica de la interacción de estas 2 especies, y si este tipo de efectos se presentan en otras poblaciones.
En este trabajo se cuantificó la depredación de semillas debida a los insectos que se desarrollan en el interior de las semillas cuando los frutos están adheridos a la planta y cuando éstos han caído al suelo. Sin embargo, es necesario considerar la pérdida de semillas causada por otro tipo de depredadores como las hormigas, las cuales pueden ser responsables de la pérdida adicional de un número importante de semillas del suelo (Milesi y Lopez-De Casanave, 2004, P. Parra-Gil, obs. pers.). Por otro lado, las semillas de Prosopis pueden ser dispersadas por diversas especies de vertebrados y escapar de la depredación que ocurre junto a los árboles progenitores (Campos y Ojeda, 1997; Sánchez-de la Vega y Godínez-Álvarez, 2010; Solbrig y Cantino, 1975; Velez et al., 2016). Adicionalmente, el efecto que pueden tener los vertebrados que se alimentan de las semillas de mezquite con los brúquidos también puede ser un factor importante en la dinámica de la interacción. Por ejemplo, en Sudáfrica se ha intentado controlar una especie invasora de Prosopis empleando brúquidos y la falta de éxito en algunos sitios se debe a que algunos de los vertebrados que se alimentan de las semillas de mezquite matan a los brúquidos que se encuentran desarrollándose en éstas (Zachariades et al., 2011; Zimmermann, 1991). Por ello la cuantificación de diversos componentes del sistema permitirá entender mejor los procesos que llevan a la pérdida de semillas de la planta y que pueden contribuir a conocer y predecir el cambio en el tamaño de las poblaciones de los mezquites en México.
Agradecimientos
Se agradece al Conacyt por el apoyo al proyecto (161702) “Mejoramiento y actualización de la infraestructura experimental para proporcionar apoyo a los posgrados en Biodiversidad y Conservación de la Universidad Autónoma del Estado de Hidalgo”, a la Universidad Autónoma del Estado de Hidalgo (Programa Anual de Investigación 2016) y a la Red temática Conacyt (Biología, manejo y conservación de la fauna nativa en ambientes antropizados) por su apoyo. También agradecemos a José G. García Franco y a dos revisores anónimos por su valiosa ayuda para mejorar el manuscrito.
Referencias
Baltazar-Meneses, K. (2011). Efecto de la pérdida de vegetación natural sobre la depredación de semillas de mezquite por insectos (Coleoptera: Bruchidae) a diferentes escalas espaciales (Tesis de maestría). Universidad Autónoma del Estado de Hidalgo. Pachuca, Hidalgo, México.
Caciano, R. T., Saucedo, J. C. R., Ávalos, J. E., Núñez, L. M. V. y Soto, R. J. (2011). Distribución espacial y cambio de uso de suelo en poblaciones naturales de mezquite. En J. C. R. Saucedo, R. T. Caciano, L. M. V. Núñez, G. S. Pérez y R. R. Serna (Eds.), Importancia de las poblaciones de mezquite en el norte-centro de México (pp. 21–48). Gómez Palacio, Durango: INIFAP II, Sagarpa.
Campos, C. M. y Ojeda, R. A. (1997). Dispersal and germination of Prosopis flexuosa (Fabaceae) seeds by desert mammals in Argentina. Journal of Arid Environments, 35, 707–714. https://doi.org/10.1006/jare.1996.0196
Colgoni, A. y Vamosi, M. (2006). Sexual dimorphism and allometry in two seed beetles (Coleoptera: Bruchidae). Entomological Science, 9, 171–179. https://doi.org/10.1111/j.1479-8298.2006.00164.x
Cope, J. M. y Fox, C. W. (2003). Oviposition decisions in the seed beetle, Callosobruchus maculatus (Coleoptera: Bruchidae): effects of seed size on superparasitism. Journal of Stored Products Research, 39, 355–365. https://doi.org/10.1016/S0022-474X(02)00028-0
Cuny, M. A., Shlichta, G. J. y Benrey, B. (2017). The large seed size of domesticated lima beans mitigates intraspecific competition among seed beetle larvae. Frontiers in Ecology and Evolution, 5, 145. https://doi.org/10.3389/fevo.2017.00145
Da Silva, A. V. y Rossi, M. N. (2019). When a seed-feeding beetle is a predator and also increases the speed of seed germination: an intriguing interaction with an invasive plant. Evolutionary Biology, 33, 200–231. https://doi.org/10.1007/s10682-019-09974-3
Felker, P., Takeoka, G. y Dao, L. (2013). Pod mesocarp flour of North and South American species of leguminous tree Prosopis (Mesquite): composition and food applications. Food Reviews International, 29, 49–66. https://doi.org/10.1080/87559129.2012.692139
Flores, T. F. J. (1993). Atributos ecológicos y aprovechamiento del mesquite. Investigación y Ciencia de la Universidad Autónoma de Aguascalientes, 9, 24–30.
Fox, C. W., Bush, M. L. y Messina, F. J. (2010). Biotypes of the seed beetle Callosobruchus maculatus have differing effects on the germination and growth of their legume hosts. Agricultural and Forest Entomology, 12, 353–362. https://doi.org/10.1111/j.1461-9563.2010.00484.x
Fox, C. W., Martin, J. D., Thakar, M. S. y Mousseau, T. A. (1996). Clutch size manipulations in two seed beetles: consequences for progeny fitness. Oecologia, 108, 88–94. https://doi.org/10.1007/BF00333219
Fox, C. W., McLennan, A. L. y Mousseau, A. T. (1995). Male body size affects female lifetime reproductive success in a seed beetle. Animal Behaviour, 50, 281–284. https://doi.org/10.1006/anbe.1995.0242
Fox, C. W., Wallin, W. G., Bush, M. L., Czesak, M. E. y Messina, F. J. (2012). Effects of seed beetles on the performance of desert legumes depend on host species, plant stage, and beetle density. Journal of Arid Environments, 80, 10–16. https://doi.org/10.1016/j.jaridenv.2011.12.008
Frías-Hernández, J. T., Aguilar-Ledezma, A. L., Olalde-Portugal, V., Balderas-López, J. A., Gutiérrez-Juárez, G., Alvarado-Gil, J. J. et al. (1999). Soil characteristics in semiarid highlands of central Mexico as affected by mesquite trees (Prosopis laevigata). Arid Soil Research and Rehabilitation, 13, 305–312. https://doi.org/10.1080/089030699263339
Galindo, S. y García, E. (1986). The uses of Mesquite (Prosopis spp.) in the highlands of San Luis Potosí, Mexico. Forest Ecology and Management, 16, 49–56. https://doi.org/10.1016/0378-1127(86)90007-1
García-Andrade, M., González-Laredo, R. F., Rocha-Guzmán, N. E., Gallegos-Infante, J. A., Rosales-Castro, M. y Medina-Torres, L. (2013). Mesquite leaves (Prosopis laevigata), a natural resource with antioxidant capacity and cardioprotection potential. Industrial Crops and Products, 44, 36–342. https://doi.org/10.1016/j.indcrop.2012.11.030
Gianoli, E., Suárez, L. H., Gonzáles, W. L., González-Teuber, M. y Acuña-Rodríguez, I. S. (2007). Host-associated variation in sexual size dimorphism and fitness effects of adult feeding in a bruchid beetle. Entomologia Experimentalis et Applicata, 122, 233–237. https://doi.org/10.1111/j.1570-7458.2006.00506.x
Golubov, J., Mandujano, M. C. y Eguiarte, L. E. (2001). The paradox of mesquites (Prosopis spp.): invading species or biodiversity enhancers? Boletín de la Sociedad Botánica de México, 69, 23–30. https://doi.org/10.17129/botsci.1644
Halevy, G. (1974). Effects of gazelles and seed beetles (Bruchidae) on germination and establishment of Acacia species. Israel Journal of Botany, 23, 120–126. https://doi.org/10.1080/0021213X.1974.10676842
Herrera-Arreola, G. Y., Herrera, B., Reyes-Reyes G. y Dendooven, L. (2007). Mesquite (Prosopis juliflora (Sw.) DC.), huisache (Acacia farnesiana (L.) Willd.) and catclaw (Mimosa biuncifera Benth.) and their effect on dynamics of carbon and nitrogen in soils of the semi-arid highlands of Durango Mexico. Journal of Arid Environments, 69, 583–598. https://doi.org/10.1016/j.jaridenv.2006.11.014
Johnson, C. D. (1983). Manual sobre insectos que infectan las semillas de Prosopis. Roma: FAO.
Johnson, C. L. y Kistler, R. A. (1987). Nutritional ecology of bruchid beetles. En F. Slansky, Jr. y J. G. Rodriguez (Eds.), Nutritional ecology of insects, mites, spiders, and related invertebrates (pp. 259–281). Nueva York: Wiley.
Kingsolver, J. M. (1986). A taxonomic study of the genus Algarobius (Coleptera: Bruchidae). Entomography, 4, 109–136.
Kingsolver, J. M., Johnson, C. D., Swier, S. R. y Teran, A. (1977). Prosopis fruits as a resource for invertebrates. En B. B. Simpson (Ed.), Mesquite: its biology in two desert scrub ecosystems (pp. 108–122). Pennsylvania: Dowden, Hutchinson y Ross.
Lamprey, H. F., Halevy, G. y Makacha, S. (1974). Interactions between Acacia, bruchid seed beetles and large herbivores. African Journal of Ecology, 12, 81–85. https://doi.org/10.1111/j.1365-2028.1974.tb00109.x
Leishman, M. R., Wright, I. J., Moles, A. T. y Westoby, M. (2000). The evolutionary ecology of seed size. En M. Fenner (Ed.), Seeds: the ecology of regeneration in plant communities (pp. 31–57). Wallingford: Centre for Agricultural Bioscience International.
Manga, V. K. y Sen, D. N. (1995). Influence of seed traits on germination in Prosopis cineraria (L.). Journal of Arid Environments, 31, 371–375. https://doi.org/10.1016/S0140-1963(05)80039-4
Milesi, F. A. y Lopez-De Casenave, J. (2004). Unexpected relationships and valuable mistakes: non-myrmecochorous Prosopis dispersed by messy leaf cutting ants in harvesting their seeds. Austral Ecology, 29, 558–567. https://doi.org/10.1111/j.1442-9993.2004.01390.x
Moegenburg, S. M. (1996). Sabal palmetto seed size: causes of variation, choices of predators and consequences for seedlings. Oecologia, 106, 539–543. https://doi.org/10.1007/BF00329713
Morandini, M. N. y de Viana, M. L. (2009). Depredación pre-dispersiva de semillas en tres poblaciones del árbol Enterolobium contortisiliquum (Fabaceae). Revista de Biología Tropical, 57, 781–788.
Ortega-Baes, P., de Viana, M. y Saraiva, M. (2001). The fate of Prosopis ferox seeds from unremoved pods at National Park Los Cordones. Journal of Arid Environments, 48, 185–190. https://doi.org/10.1006/jare.2000.0630
Palleres, E. (2007). Efectos de la depredación por insectos sobre semillas de Prosopis flexuosa (Fabaceae, Mimosoideae) y su relación con el consumo por roedores pequeños de desierto del Monte (Tesis). Universidad del Aconcagua. Mendoza, Argentina.
Reséndez-Velázquez, K. L. y González-Castillo, M. P. (2016). Estimate of damage on mesquite pods and seeds (Prosopis laevigata (Willd) M.C. Johnst) (Mimosoideae) caused by bruchids (Coleoptera) in the Municipality of Durango, Durango, Mexico. American Journal of Applied Sciences, 13, 533–539. https://doi.org/10.3844/ajassp.2016.533.539
Reveles-Saucedo, F. O., Rosales-Serna, R., Nava-Berúmen, C. A., Delgado-Licón, E., Cuéllar-Robles, E. I., Carrete-Carreón, F. Ó. et al. (2010). Identificación de especies vegetales con potencial para la producción de biocombustibles líquidos en Durango, México. Revista Mexicana de Ciencias Agrícolas, 1, 45–54.
Rodríguez, S. E. N., Martínez, R. G. E., Ramírez, V. B., Martínez, M. R., Cong, H. M. C., Medina, T. S. M. et al. (2014). Análisis técnico del árbol del mezquite (Prosopis laevigata Humb. et Bonpl ex Willd) en México. Ra Ximhai, 10, 173–193.
Rodríguez-Anda, R., Ramírez-Arango, A. M., Palacios-Juárez, H., Fuentes-Talavera, F. J., Silva-Guzmán, J. A. y Saucedo-Corona, A. R. (2015). Características anatómicas, físico-mecánicas y de maquinado de la madera de mezquite (Prosopis velutina Wooton). Revista Mexicana de Ciencias Forestales, 6, 156–173.
Salas-Araiza, M. D., Romero-Nápoles, J. y Aguilera, E. G. (2001). Contribución al estudio de los brúquidos (Insecta: Coleoptera) asociados a fabaceas arbustivas. Acta Universitaria, 11, 26–32.
Sánchez-de la Vega, G. y Godínez-Álvarez, H. (2010). Effect of gut passage and dung on seed germination and seedling growth: Donkeys and a multipurpose mesquite from a Mexican inter-tropical desert. Journal of Arid Environments, 74, 521–524. https://doi.org/10.1016/j.jaridenv.2009.09.020
Saravanakumar, S. S., Kumaravel, A., Nagarajan, T. y Ganesh, I. (2013). Effects of chemical treatments on physicochemical properties of Prosopis juliflora fibers. Carbohydrate Polymers, 92, 1928–1933. https://doi.org/10.1080/1023666X.2014.903585
SAS Institute. (1997). SAS Statistical analysis for experimental data. Cary, Carolina del Norte: SAS Institute.
Sawal, R. K., Ratan, R. y Yadav, S. B. S. (2004). Mesquite (Prosopis juliflora) pods as a feed resource for livestock-A review. Asian-Australas Journal of Animal Science, 17, 719–725. https://doi.org/10.5713/ajas.2004.719
Shlichta, J. G., Cuny, M. A., Hernández-Cumplido, J., Traine, J. y Benrey, B. (2018). Contrasting consequences of plant domestication for the chemical defenses of leaves and seeds in lima bean plants. Basic and Applied Ecology, 31, 10–20. https://doi.org/10.1016/j.baae.2018.05.012
Sobrevilla-Solís, J. A., López-Herrera, M., López-Escamilla, A. L. y Romero-Bautista, L. (2013). Evaluación de diferentes tratamientos pregerminativos y osmóticos en la germinación de semillas Prosopis laevigata (Humb. y Bonpl. Ex Willd) M. C. Johnston. En G. Pulido-Flores y S. Monks (Eds.), Estudios científicos en el estado de Hidalgo y zonas aledañas (pp. 83–95). Lincoln, Nebraska: Zea Books.
Solbrig, O. T y Cantino, P. D. (1975). Reproductive adaptations in Prosopis (Leguminosae, Mimosidae). Journal of the Arnold Arboretum, 56, 185–212.
Szentesi, A. y Jermy, S. (1993). Predispersal seed predation in leguminose species: seed morphology and bruchid infestation. Oikos, 73, 23–32. https://doi.org/10.1078/1439-1791-00125
Takakura, K. (2002). The specialist seed predator Bruchidius dorsalis (Coleoptera: Bruchidae) plays a crucial role in the seed germination of its host plant, Gleditsia japonica (Leguminosae). Functional Ecology, 16, 252–257. https://doi.org/10.1046/j.1365-2435.2002.00619.x
Vallejo, J. A., Jiménez, R., Cervantes, R., Trucios, R. y Rivera, M. (2012). Potencial productivo y cambio de uso de suelo en poblaciones de mezquite (Prosopis spp.) del centro-norte de México. Agrofaz, 12, 89–98.
Velez, S., Chacoff, N. P. y Campos, C. M. (2016). Seed predation and removal from faeces in a dry ecosystem. Basic and Applied Ecology, 17, 145–154. https://doi.org/10.1016/j.baae.2015.09.002
Velez, S., Chacoff, N. P. y Campos, C. M. (2018). Pre-dispersal seed loss in two Prosopis species (Fabacea: Mimosoidea) from the Monte Desert, Argentina. Ecología Austral, 28, 361–373. https://doi.org/10.25260/EA.18.28.2.0.576
Yang, R. L. y Fushing, H. (2008). Quantifying the effects of host discrimination on egg-laying decision of the cowpea seed beetle, Callosobruchus maculatus. Entomologia Experimentalis et Applicata, 129, 325–331. https://doi.org/10.1111/j.1570-7458.2008.00779.x
Zachariades, C., Hoffmann, J. H. y Roberts, A. P. (2011). Biological control of mesquite (Prosopis species) (Fabaceae) in South Africa. African Entomology, 19, 402–415. https://doi.org/10.4001/003.019.0230
Zimmermann, H. G. (1991). Biological control of mesquite, Prosopis spp. (Fabaceae), in South Africa. Agriculture Ecosystems Environment, 37, 175–186. https://doi.org/10.1016/0167-8809(91)90145-N