Eduardo Reséndiz a, *, Amelly Hyldaí Ramos-Díaz b y Helena Fernández-Sanz a
a Universidad Autónoma de Baja California Sur, Departamento Académico de Ciencias Marinas y Costeras, Carretera al Sur Km 5.5., Apartado postal 19-B, 23080 La Paz, Baja California Sur, México
b Secretaría de Medio Ambiente del Estado de Veracruz, Centro Veracruzano de Investigación y Conservación de la Tortuga Marina, El Raudal de las Flores, Francisco I. Madero No. 3 Col. Centro, 91000 Xalapa, Veracruz, México
*Autor para correspondencia: jresendiz@uabcs.mx (E. Reséndiz)
Recibido: 19 abril 2021; aceptado: 28-junio 2021
Resumen
La distribución y patrones de actividad de las tortugas marinas en áreas de alimentación son fundamentales para su conservación y manejo. Estos análisis pueden revelar datos importantes sobre sus historias de vida, además de explicar su frecuencia de presentación en estos sitios, identificando hábitats críticos. En este estudio se identificaron los patrones de distribución temporal de 2 juveniles de tortuga negra para definir las áreas de mayor uso y patrones de movimiento en un área de alimentación dentro del complejo lagunar Ojo de Liebre, México, uno de los principales sitios de alimentación y desarrollo de tortugas negras en la costa del Pacífico. Para ello, se instalaron 2 radiotransmisores de muy alta frecuencia en 2 tortugas negras juveniles que fueron monitoreadas continuamente con intervalos semanales de agosto 2018 a diciembre 2019. Los datos obtenidos permitieron identificar las zonas de mayor uso y la superficie mensual ocupada por tortuga y por temporada. La presencia y distribución temporal de ambas tortugas indicó que el área brinda las condiciones adecuadas para que ellas usen la zona como sitio de alimentación, desarrollo y/o descanso por periodos prolongados, confirmando que las tortugas muestran alta fidelidad a las zonas de alimentación de la península de Baja California.
Palabras clave: Ecología; Movimientos; Telemetría de muy alta frecuencia; Conservación de tortugas marinas
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Temporal distribution and habitat use of black turtles (Chelonia mydas) in a feeding area of the Ojo de Liebre lagunal complex, Baja California Sur, Mexico
Abstract
The distribution and activity patterns of sea turtles in feeding areas are fundamental for their conservation and management, since they can reveal important facts about sea turtle’s life stories and explain its frequency of presentation at these sites, identifying key habitats. In this study, the temporal distribution patterns of 2 juvenile black turtles were identified to define its habitat use and movement patterns in a feeding area within the Ojo de Liebre lagoonal complex, Mexico, one of the main feeding and development sites of black turtles on the Pacific coast. For this, 2 very high frequency radio transmitters were installed in 2 juvenile black turtles which were continuously monitored at weekly intervals from August 2018 to December 2019. The obtained information allowed identifying the areas of greatest concentration and the monthly surface occupied by turtle and season. The presence and temporal distribution of both turtles indicated that the area provides adequate conditions for the turtles to use the area as a feeding, development and /or resting site for prolonged periods of time, confirming that the turtles show high fidelity to the foraging areas of the Baja California Peninsula.
Keywords: Ecology; Movements; Very high frequency telemetry; Sea turtle conservation
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Las tortugas verdes del Pacífico oriental (Chelonia mydas), localmente conocidas como tortugas negras, son una población regional que se distribuye a lo largo de la costa del Pacífico americano (Dutton et al., 2014), ocupando diferentes regiones geográficas y diversos hábitats durante cada una de las etapas de su ciclo de vida (Cliffton et al., 1982; Dutton et al., 2019). Esta especie está catalogada como en peligro de extinción en la lista roja de la Unión Internacional para la Conservación de la Naturaleza (UICN) (Seminoff, 2004), se encuentra indexada en el Apéndice I de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestre (NOAA, 2011), y dentro de la legislación mexicana NOM-059-SEMARNAT- 2010 (DOF, 2010), se considera como especie en peligro de extinción.
Los hábitats neríticos ricos en pastos marinos y/o algas marinas representan ecosistemas clave donde las tortugas negras se alimentan y crecen hasta alcanzar la madurez sexual (Musick y Limpus, 1997). Particularmente, las lagunas costeras de la península de Baja California fungen como sitios de refugio y forrajeo para esta especie, la cual ha mostrado una alta fidelidad a estas zonas, especialmente durante etapas juveniles (Senko, López-Castro et al., 2010). Algunos aspectos fundamentales que ayudan a comprender la ecología de las tortugas que residen en hábitats neríticos son el rango de actividad, sus movimientos, y el uso de hábitat, entre otros (Mendonça, 1983; White y Garrott, 1990). Para obtener dicha información se ha implementado el uso de herramientas tecnológicas como la telemetría remota o programas de captura en agua; sin embargo, por factores como los costos o la logística, los estudios en esta materia son limitados (Seminoff et al., 2002; Senko, López-Castro et al., 2010).
Dado que una gran proporción de las poblaciones está compuesta por tortugas en etapa juvenil, y que esta etapa es crucial para mantener a las poblaciones estables a largo plazo, los estudios ecológicos son fundamentales para su conservación (Heppel et al., 1996; Hirth y Schaffer, 1974; Wildermann et al., 2018). Recientemente, se ha sugerido que la población del Pacífico oriental pertenece a un linaje único, proponiéndose como una unidad de manejo independiente (Álvarez-Varas et al., 2020); por lo tanto, es necesario generar conocimiento a pequeña escala que permita tomar decisiones para su protección.
La información sobre la distribución y patrones de actividad de la tortuga negra en zonas neríticas puede revelar datos importantes sobre su historia de vida en sus etapas juvenil y adulta, además de explicar la frecuencia de presentación en los sitios de alimentación y descanso, identificando hábitats críticos (Seminoff y Jones, 2006; Seminoff et al., 2002). Los datos disponibles sobre los patrones de movimiento y uso de hábitat de las tortugas negras en hábitats costeros de alimentación y desarrollo de la península de Baja California son limitados (Seminoff et al., 2002; Senko, López-Castro 2010). El objetivo de este estudio fue identificar los patrones de distribución temporal de 2 juveniles de tortuga negra para definir las áreas de mayor uso y patrones de movimiento en un área de alimentación dentro del complejo lagunar Ojo de Liebre, México, utilizando por primera vez telemetría de muy alta frecuencia. Al tratarse de uno de los principales sitios de alimentación y desarrollo de tortugas negras en la costa del Pacífico mexicano, que además ha sido fuertemente impactado por la captura ilegal de tortugas para su consumo, es de suma importancia el desarrollo de este tipo de estudios que permiten fortalecer los planes de manejo y conservación para estas especies y sus hábitats (Reséndiz et al., 2018a; Senko, López-Castro et al., 2010; Wildermann et al., 2018).
Materiales y métodos
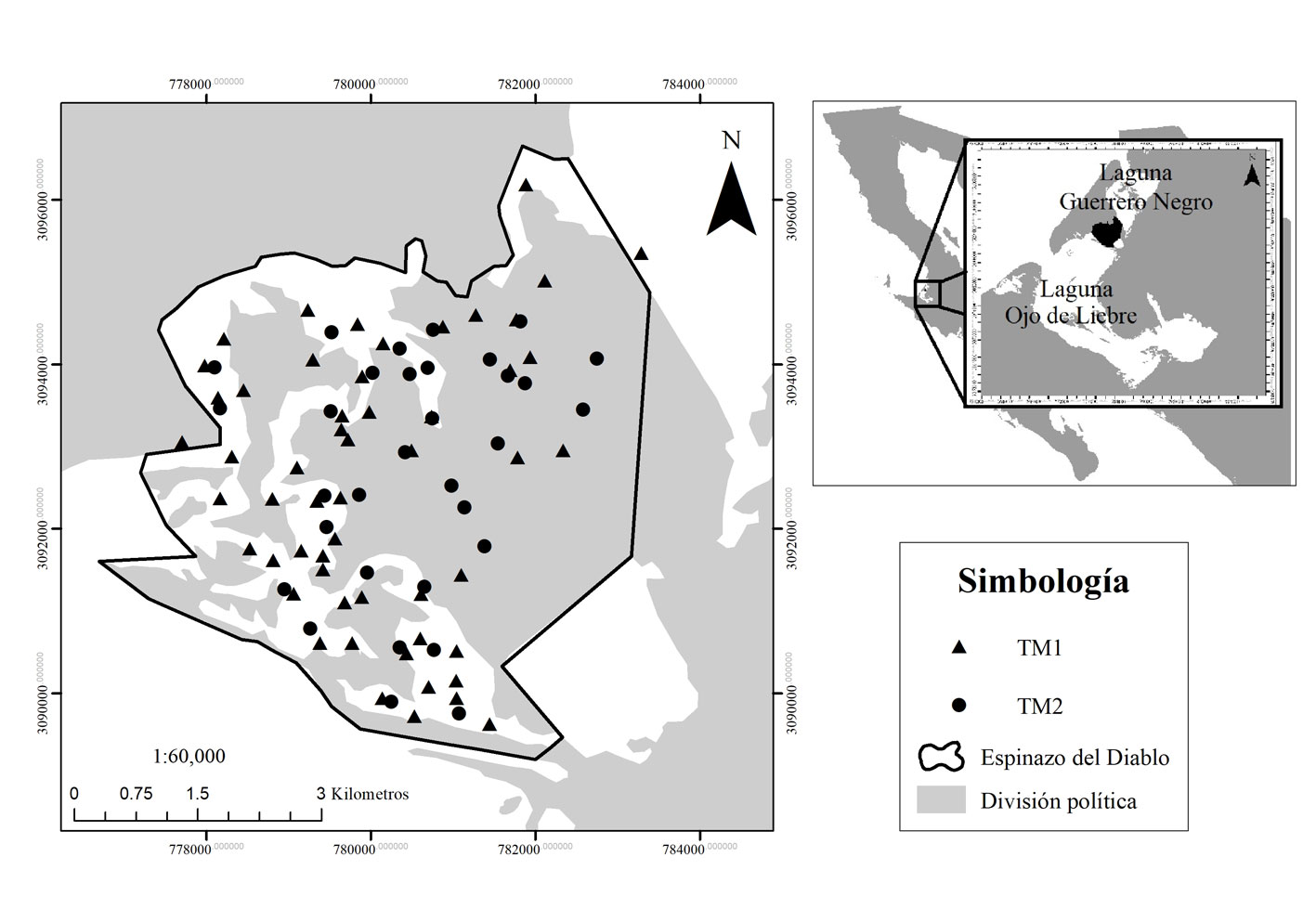
Este estudio se llevó a cabo del 20 de agosto de 2018 al 19 de diciembre de 2019, en la zona “El Espinazo del Diablo” (27°55’6.17” N, 114°9’58.30” O) dentro del complejo lagunar Ojo de Liebre, Baja California Sur (fig. 1). Esta zona tiene una superficie de 28 km2 compuesta por un entramado de canales poco profundos que conectan la laguna Ojo de Liebre con la laguna Guerrero Negro. La masa de agua circulante se caracteriza por ser hipersalina —se incrementa hacia el interior de la laguna de 32 a 41 ppt— y por presentar temperaturas superficiales promedio de 21.29 ºC anuales (ESSA, 2018; Millán-Núñez et al., 1987; Postma, 1965). Los canales presentan una alta abundancia de especies de pastos y macroalgas marinos (Zostera marina, Phyllospadix scoileri, Phyllospadix sp. y Ruppia maritima) y están habitados por tortugas negras juveniles y adultas (Águila-Ramírez et al., 2003; Reséndiz et al., 2018a).
Como parte de un estudio de evaluaciones de salud de tortugas marinas en curso, el 20 de agosto de 2018 y el 18 de septiembre de 2018 se capturaron un total de 18 y 35 tortugas negras respectivamente, con redes de enmalle de monifilamento tipo “Castillo” (100 m × 5 m, tamaño de luz malla de 60 cm) las cuales fueron colocadas durante periodos diurnos de 6-8 horas en canales poco profundos (menos de 5 m) en el Espinazo del Diablo. Las redes fueron revisadas cada hora para minimizar el riesgo de lesión y ahogamiento para las tortugas. Enseguida se registraron la longitud curva del caparazón (LCC; cm) y el peso (kg) de los organismos (Bolten, 1999). De las tortugas capturadas, se seleccionaron 2 juveniles —LCC menor a 77.5 de acuerdo con la talla adulta propuesta por Márquez (1996)— que se identificaron como T1 (tortuga 1) y T2 (tortuga 2).
Las 2 tortugas fueron equipadas con un transmisor de radio de muy alta frecuencia —VHF; MOD, 225 Telonics® con vida útil de ~ 20 meses— con frecuencia de pulso de 60 latidos por minuto y frecuencia VHF específica de 148,000 MHz. Los transmisores VHF fueron fijados al primer y segundo escudo vertebral con tela de fibra de vidrio y resina (Balazs et al., 1996). Las tortugas equipadas fueron marcadas con placas metálicas de Inconel 625 en las aletas traseras (Balazs, 1999) y liberadas ilesas en su sitio de captura inicial el mismo día después del procedimiento.
Posteriormente, se realizó un seguimiento continuo con un intervalo semanal por 4 horas de agosto 2018 a diciembre 2019, con la finalidad de grabar un mínimo de una posición por cada hora. Para ello, la laguna se recorrió realizando transectos en zigzag en una embarcación de 10 m de eslora con motor fuera de borda. Para localizar a los ejemplares marcados se empleó una antena de 3 elementos (RA-14 Telonics®) y un receptor VHF (TR-4 Telonics®) con audífonos Sony® modelo ZX series MDR-ZX310AP, el cual se programó para cubrir la banda de 148 MHz, con el canal 00 de 148.00 MHz para recibir la señal de la T1 y el canal 01 de148.01 MHz para recibir la señal de la T2 con un rango máximo de recepción de transmisiones VHF de ~ 15 km. Para minimizar la perturbación hacia las tortugas, la posición se determinó maniobrando la embarcación a una distancia entre 5 a 10 m de los ejemplares cuya posición fue registrada con un sistema de posicionamiento global —Garmin modelo: GPS MAP 78s [Europe] Ltd.®, Hampshire, Reino Unido; con rango de error = ± 3 m ± 12 m—. Este estudio se llevó a cabo con los permisos: Oficio No. SGPA/DGVS/013214/18 y Oficio No. SGPA/DGVS/12688/19, y se siguieron todos los lineamientos internacionales, nacionales e institucionales aplicables para el manejo ético, cuidado y uso de los animales.

De acuerdo con los datos espaciales obtenidos, se determinó el número y porcentaje mensual de avistamientos para cada tortuga. Para identificar las zonas de mayor uso dentro del Espinazo del Diablo, se empleó la herramienta de densidad de Kernel (Wood et al., 2017). Los datos de ambas tortugas fueron agrupados para determinar la superficie mensual ocupada (área y porcentaje de la laguna) generando polígonos mínimos convexos (PMC) mensuales. Posteriormente, los PMC se emplearon para evaluar diferencias estacionales considerando 2 temporadas: cálida de junio a noviembre y fría de diciembre a mayo. Previo a los análisis estadísticos, los datos fueron sometidos a los supuestos de normalidad (Shapiro-Wilk’s) y en consecuencia se empleó una prueba de t de Student para determinar las diferencias con el programa Statistica v.7. (StatSoft, 2004). Todos los análisis espaciales se realizaron en el programa ArcMap v. 10.2 (ESRI, 2014).
Resultados
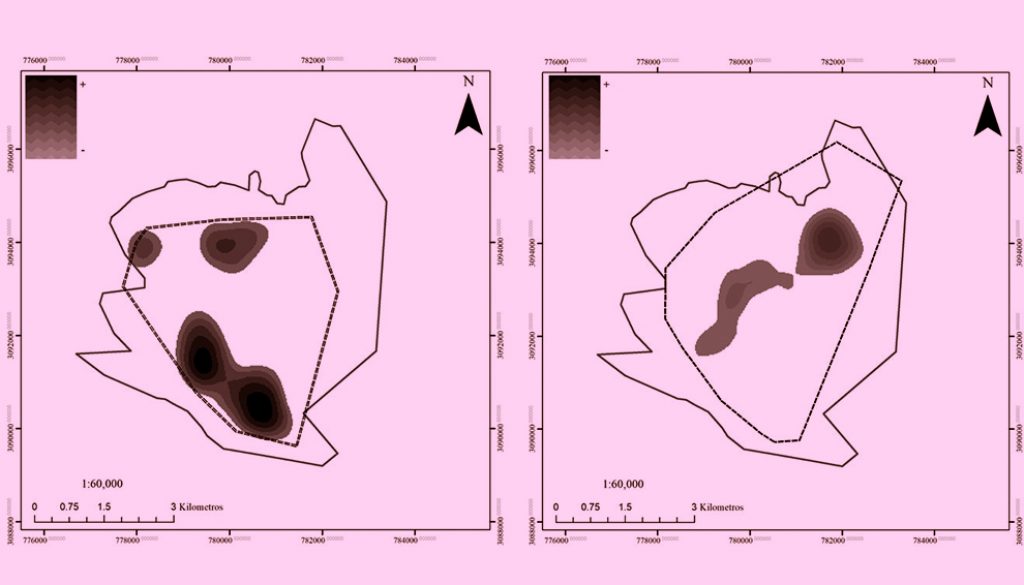
Los datos morfométricos y de captura de las 2 tortugas juveniles marcadas se presentan en la tabla 1. Durante el periodo de rastreo se obtuvieron 87 posiciones geográficas de las tortugas dentro del Espinazo del Diablo (fig. 2), lo cual representó 62.5% de avistamientos para la T1 y 49.1% para la T2 con 55 y 32 registros, respectivamente (tabla 2). Los meses de mayor avistamiento fueron septiembre, octubre y noviembre, mientras que en mayo y julio solo se obtuvieron 3 registros (2 registros de la T1 y 1 de la T2 por mes). La superficie mensual ocupada por ambas tortugas varió de 0.1 a 15.1 km2 (tabla 3), siendo septiembre el de mayor área, mientras que de mayo a julio el área ocupada fue menor a 1 km2. En cuanto a la estacionalidad, el uso de hábitat fue mayor durante la temporada cálida (4.7 ± 5.9 km2) respecto de la temporada fría (3.9 ± 2.9 km2) (fig. 3); sin embargo, no se encontraron diferencias significativas (p = 0.77; df = 10; t-value = -0.2). Asimismo, las zonas de mayor uso por estación se concentraron al norte durante la temporada fría y al sur durante la cálida (fig. 4).
Tabla 1
Datos generales y morfométricos de las tortugas negras (Chelonia mydas) capturadas y liberadas en el Espinazo del Diablo, laguna Ojo de Liebre, Baja California Sur, México
|
ID |
LCC (cm) |
Fecha de captura |
Peso (kg) |
Marcas |
Coordenadas |
Seguimiento |
Seguimiento final |
||||
|
Derecha |
Izquierda |
Latitud |
Longitud |
Fecha |
Hora |
Fecha |
Hora |
||||
|
T1 |
50.3 |
20-ago-2018 |
36 |
1AS966 |
1AS967 |
27°55’6.17” |
114° 9’58.30” |
20-ago-2018 |
15:00 |
19-dic-19 |
15:00 |
|
T2 |
39.2 |
18-sep-2018 |
16 |
1AT065 |
1AT066 |
27°55’6.17” |
114° 9’58.30” |
18-sep-2018 |
16:00 |
19-dic-19 |
16:00 |
ID: Identificación; LCC: longitud curva de caparazón.
Tabla 2
Esfuerzo y porcentaje de avistamientos de los juveniles de tortuga negra (Chelonia mydas) en el Espinazo del Diablo, laguna Ojo de Liebre, Baja California Sur, México, durante 2018 y 2019.
|
Tortuga 1 (T1) |
|||||
|
Año |
Núm. de avistamientos |
Días de esfuerzo |
Días con avistamiento |
Días sin avistamiento |
Avistamientos (%) |
|
2018 |
28 |
18 |
15 |
3 |
83.3 |
|
2019 |
27 |
46 |
25 |
21 |
54.3 |
|
Total |
55 |
64 |
40 |
24 |
62.5 |
|
Tortuga 2 (T2) |
|||||
|
Año |
Núm. de avistamientos |
Días de esfuerzo |
Días con avistamiento |
Días sin avistamiento |
Avistamientos (%) |
|
2018 |
10 |
11 |
8 |
3 |
72.7 |
|
2019 |
22 |
44 |
19 |
25 |
43.2 |
|
Total |
32 |
55 |
27 |
28 |
49.1 |
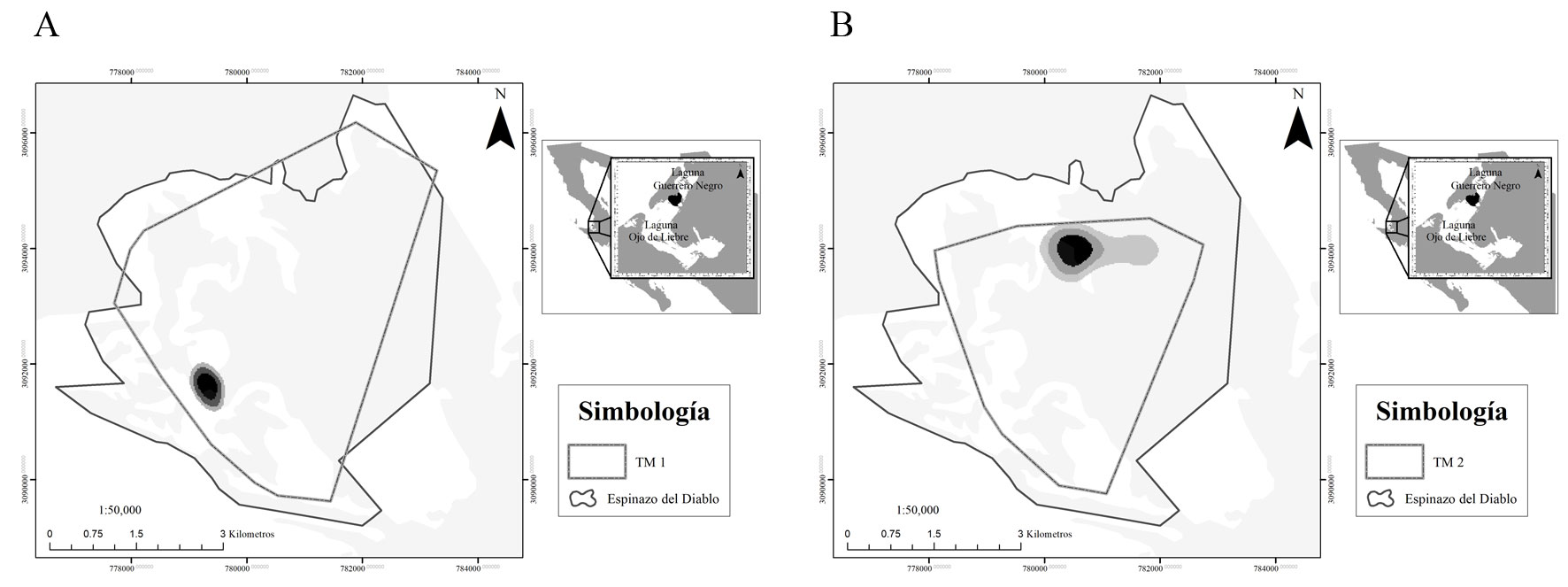
De acuerdo con los avistamientos individuales, la T1 ocupó 21.87 km2 del Espinazo del Diablo, lo que corresponde a 77.8% del total de esta zona; mientras que la T2 ocupó 14.50 km2 (51.7%) del total del área (fig. 3). Igualmente, la zona de mayor uso de la T1 se encontró en los canales de navegación al suroeste de la zona, mientras que la T2 se concentró en los pastizales al noreste del Espinazo del Diablo (fig. 3).
Discusión
El estudio de la distribución temporal de especies amenazadas en vida libre, como las tortugas marinas, es fundamental para comprender aspectos básicos de su ciclo de vida, como su dinámica poblacional, su comportamiento migratorio, su uso de hábitat, su conectividad y su ecología alimenticia, entre otros (Cooke, 2008; Senko, Koch et al., 2010). Este estudio proporciona la primera evaluación de uso de hábitat de tortugas negras en etapa juvenil en el complejo lagunar Ojo de Liebre y evidencia de su reclutamiento anual en este sitio. Las tortugas negras son omnívoras oportunistas y a pesar de que en el complejo lagunar se han reportado nuevos ingredientes de origen animal en su dieta, los pastizales de la laguna y áreas someras con gran abundancia de macroalgas, como el Espinazo del Diablo, son el epicentro de alimentación de las tortugas (Águila-Ramírez et al., 2003; Amorocho y Reina, 2007, 2008; Reséndiz et al., 2016, 2018a, b).
Tabla 3
Área mensual ocupada por los juveniles de tortuga negra (Chelonia mydas) y porcentaje del sitio ocupado en el Espinazo del Diablo, laguna Ojo de Liebre, Baja California Sur, México, durante 2018 y 2019.
|
Mes |
Superficie (km2) |
Porcentaje del área de estudio |
|
Enero |
1.17 |
4.18 |
|
Febrero |
5.72 |
20.43 |
|
Marzo |
5.33 |
19.04 |
|
Abril |
1.8 |
6.43 |
|
Mayo |
0.6 |
2.14 |
|
Junio |
0.5 |
1.79 |
|
Julio |
0.1 |
0.36 |
|
Agosto |
3.9 |
13.93 |
|
Septiembre |
15.1 |
53.93 |
|
Octubre |
8.08 |
28.86 |
|
Noviembre |
8.28 |
29.57 |
|
Diciembre |
1.27 |
4.54 |
El complejo lagunar Ojo de Liebre tiene una gran amplitud de marea, y durante la bajamar, algunas zonas del Espinazo del Diablo pueden quedar expuestas, reduciendo potencialmente el área de distribución de las tortugas, que utilizan los flujos de marea en los canales para desplazarse (Brooks et al., 2009; Postma, 1965; Senko, Koch et al., 2010). Generalmente, la distribución de las tortugas está determinada por la disponibilidad de alimento en áreas de alimentación costeras que no tienen una gran influencia de marea (Seminoff y Jones, 2006). Por ejemplo, en zonas arrecifales donde abundan las algas, las tortugas se concentran en parches muy pequeños como estrategia para realizar un menor gasto energético y aprovechar mejor los recursos por lo que pueden abarcar entre 0.69 y 5.05 km2, rango similar al encontrado en el presente estudio (Makowski et al., 2006). Por otro lado, es importante mencionar que a pesar de que no se registraron avistamientos nocturnos, las tortugas que se alimentan en sitios con mareas fuertes pueden carecer de patrones de movimiento diurno-nocturno, especialmente si se alimentan de recursos alimenticios del intermareal (Brooks et al., 2009; Senko, Koch et al., 2010; Whiting y Miller, 1998). Además, en zonas de abundante recurso suelen estar más activas de día haciendo inmersiones en V, mientras que durante la noche permanecen en el fondo, incluso descansando sobre los mismos parches donde se alimentan (Makowski et al., 2006).

El uso de hábitat durante la temporada cálida fue mayor y se concentró en los canales del sur del Espinazo del Diablo. Durante estos meses, la temperatura del agua es más elevada (ESSA, 2018), y por lo tanto, también lo es el metabolismo de las tortugas, que están más activas y cubren un mayor porcentaje de espacio (Southwood et al., 2003). En temporada fría, las tortugas ocuparon un menor espacio y se concentraron en los pastizales del norte; esto sugiere que, al descender las temperaturas, las tortugas, más pasivas, se mantuvieron cerca de su principal recurso alimenticio.
La presencia y distribución temporal indica que el área brinda las condiciones adecuadas para que las tortugas usen la zona como sitio de alimentación, desarrollo y/o descanso por periodos prolongados (Musik y Limpus, 1997; Seminoff y Jones, 2006). Además, esta información confirma que las tortugas muestran alta fidelidad a las zonas de alimentación de la península de Baja California, principales áreas de alimentación de las tortugas negras en el Pacífico mexicano (Reséndiz et al., 2018a; Senko, Koch et al., 2010).
Diversos estudios a nivel mundial han descrito los movimientos y el uso de hábitat de tortugas juveniles en zonas de alimentación por medio de diferentes herramientas de seguimiento, tales como foto identificación, marcaje, captura y recaptura de organismos y telemetría satelital, entre otros (Barrios-Garrido et al., 2020; Shimada et al., 2016, 2019; Williams et al., 2017). En función de los cambios ambientales y ontogénicos, los autores han reportado que las tortugas verdes juveniles pueden cambiar de zonas de alimentación y regresar periódicamente a las mismas, no obstante, otros estudios han confirmado la fidelidad por periodos prolongados de las tortugas verdes juveniles a un mismo sitio de alimentación como es el caso de nuestro estudio (Barrios-Garrido et al., 2020; Shimada et al., 2016, 2019; Williams et al., 2017).
Esta investigación conforma el primer acercamiento al entendimiento del uso de hábitat y distribución de juveniles de tortuga negra en la zona, proporciona las bases para continuar con estudios que permitan dilucidar las áreas de potencial interés para la conservación de esta especie y permite conocer sus estrategias temporales de uso de hábitat en esta zona costera que destaca como hábitat de alimentación crítico. Finalmente, se sugiere continuar con estudios específicos de telemetría satelital y otras técnicas de seguimiento, las cuales, en conjunto, ayudarán a complementar los planes de manejo y fortalecer las estrategias de conservación para las tortugas marinas y las zonas donde se distribuyen.
Agradecimientos
A Everardo Mariano Meléndez, Oscar Javier Salazar, Noé López Paz, Gabriel Zaragoza Aguilar y Rafael Buelna Grado de la Reserva de la Biosfera El Vizcaíno, Comisión Nacional de Áreas Naturales Protegidas; a Aarón Sánchez Castillo, Fabián Castillo Romero, Joaquín Rivera Rodríguez, y Antonio Zaragoza Aguilar del Área de Conservación Ambiental y Gerencia de Gestión Integral y Planeación de la Empresa Exportadora de Sal S.A. de C.V. por su asistencia durante el trabajo de campo, apoyo y logística a lo largo del desarrollo de esta investigación. Especial agradecimiento a Rafael Riosmena Rodríguez por la cesión de los radiotransmisores.
Referencias
Águila-Ramírez, R. N., Casas-Valdez, M., Ortega-García, S., Núñez-López, R. A. y Cruz-Ayala, M. B. (2003). Spatial and seasonal variation of macroalgal biomas in Laguna Ojo de Liebre, Baja California Sur, México. Hidrobiología, 501, 207–214. https://doi.org/10.1023/A:1026210312362
Álvarez-Varas, R., Heidemeyer, M., Riginos, C., Benítez, H. A., Reséndiz, E., Lara-Uc, M. et al. (2020). Integrating morphological and genetic data at different spatial scales in a cosmopolitan marine turtle species: challenges for management and conservation. Zoological Journal of the Linnean Society, 191, 434–453. https://doi.org/10.1093/zoolinnean/zlaa066
Amorocho, D. F. y Reina, R. D. (2007). Feeding ecology of the East Pacific green sea turtle Chelonia mydas agassizii at Gorgona National Park, Colombia. Endangered Species Research, 3, 43–51.
Amorocho, D. F. y Reina, R. D. (2008). Intake passage time, digesta composition and digestibility in East Pacific green turtles (Chelonia mydas agassizii) at Gorgona National Park, Colombian Pacific. Journal of Experimental Marine Biology and Ecology, 360, 117–124. https://doi.org/10.1016/j.jembe.2008.04.009
Balazs, G. (1999). Factores a Considerar en el Marcado de Tortugas marinas. En K. Eckert, K. Bjorndal, A. Abreu-Grobois y M. Donnelly (Eds.), Research and management techniques for the conservation of sea turtles (pp. 116–125). Washington D.C.: IUCN/ SSC marine turtle specialist group publication no. 4.
Balazs, G. H., Russell, K. M. y Beaver, S. C. (1996). Procedures to attach a satellite transmitter to the carapace of an adult green turtle, Chelonia mydas. En J. A. Keinath, D. E. Barnard, J. A. Musick y B. A. Bell (Eds.), Proceedings 15th Annual Symposium of Sea Turtle Biology and Conservation (pp. 21–26). Carolina del Sur: NOAA Technical Memories NMFS-SEFSC-38.
Barrios-Garrido, H. A., Becker, P., Bjorndal, K. A., Bolten, A. B., Diez, C., Espinoza-Rodríguez, N. et al. (2020). Sources and movements of marine turtles in the Gulf of Venezuela: Regional and local assessments. Regional Studies in Marine Science, 36, 101318. https://doi.org/10.1016/j.rsma.2020.101318
Bolten, A. (1999). Techniques for measuring sea turtles. En K. Eckert, K. Bjorndal, A. Abreu-Grobois y M. Donnelly (Eds.), Research and management techniques for the conservation of sea turtles (pp. 126–131). Washington D.C.: IUCN/ SSC marine turtle specialist group publication no. 4.
Brooks, L. B., Harvey, J. T. y Nichols, W. J. (2009). Tidal movements of East Pacific green turtles Chelonia mydas at a foraging area in Baja California Sur, Mexico. Marine Ecology Progress Series, 386, 263–274.
Cliffton, K., Cornejo, D. O. y Felger, R. S. (1982). Sea turtles of the Pacific coast of Mexico. en K. A. Bjorndal (Ed.), Biology and conservation of sea turtles (pp. 199–209). Washington D.C.: Smithsonian Institution Press.
Cooke, S. J. (2008). Biotelemetry and biologging in endangered species research and animal conservation: relevance to regional, national, and IUCN Red List threat assessments. Endangered Species Research, 4, 165–185. https://doi.org/10.3354/esr00063
DOF (Diario oficial de la federación). (2010). Norma Oficial Mexicana NOM-059-ECOL-2010. Protección ambiental. Especies nativas de México de flora y fauna silvestres. Diario oficial de la Federación, México. Disponible en: https://dof.gob.mx/nota_detalle_popup.php?codigo=5173091
Dutton, P. H., Jensen, M. P., Frey, A., LaCasella, E., Balazs, G. H., Zárate, P. et al. (2014). Population structure and phylogeography reveal pathways of colonization by a migratory marine reptile (Chelonia mydas) in the central and eastern Pacific. Ecology and Evolution, 4, 4317–4331. https://doi.org/10.1002/ece3.1269
Dutton, P. H., LeRoux, R. A., LaCasella, E. L., Seminoff, J. A., Eguchi, T. y Dutton D. L. (2019). Genetic analysis and satellite tracking reveal origin of the green turtles in San Diego Bay. Marine Biology, 166, 3. https://doi.org/10.1007/s00227-018-3446-4
Environmental Systems Research Institute (ESRI) (2014). Software ArcGis Desktop 10.2. www.esri.com
ESSA (Empresa Exportadora de Sal S.A.). (2018). Informe anual de los monitoreos de tortugas marinas en el complejo lagunar Ojo de Liebre B.C.S. Guerrero Negro, México: Reporte anual del Área de Conservación Ambiental y Gerencia de Gestión Integral y Planeación de la Empresa Exportadora de Sal, S.A.
Heppel, S. S., Limpus, C. J., Crouse, D. T., Frazer, N. B. y Crowder, L. B. (1996). Population model analysis for the loggerhead sea turtle, Caretta caretta, in Queensland. Wildlife Research, 23, 143–161. https://doi.org/10.1071/WR9960143
Hirth, H. F. y Schaffer, W. M. (1974). Survival rate of the green turtle, Chelonia mydas, necessary to maintain stable populations. Copeia, 2, 544–546. https://doi.org/10.
2307/1442553
Makowski, C., Seminoff, J. A. y Salmon, M. (2006). Home range and habitat use of juvenile Atlantic green turtles (Chelonia mydas L.) on shallow reef habitats in Palm Beach, Florida, USA. Marine Biology, 148, 1167–1179. https://doi.org/10.1007/s00227-005-0150-y
Márquez, R. (1996). Las tortugas marinas y nuestro tiempo. 3 Ed. México D.F.: Serie La Ciencia para Todos/ 144. Fondo de Cultura.
Mendonça, M. T. (1983). Movements and feeding ecology of immature green turtles (Chelonia mydas) in a Florida lagoon. Copeia, 1983, 1013–1023. https://doi.org/10.2307/1445104
Millán-Núñez, R., Ripa-Soleno, E. y Aguirre-Buenfil, L. A. (1987). Preliminary study of the composition and abundance of the phytoplankton and chlorophytes in Laguna Ojo de Liebre, BCS. Ciencias Marinas, 13, 30–38. https://doi.org/10.7773/cm.v13i1.527
Musick, J. A. y Limpus, C. (1997). Habitat utilization and migration in juvenile sea turtles. En P. L. Lutz y J. A. Musick (Eds.), The biology of sea turtles (pp. 137–164). Boca Raton, Florida: CRC Press.
NOAA (National Marine Fisheries Service). (2011). U.S. National Bycatch Report [W.A. Karp, L.L. Desfosse, S.G. Brooke, Editors]. U.S. Dep. Commer., NOAA Tech. Memo. NMFS-F/SPO-117E, 508. Disponible en: https://spo.nmfs.noaa.gov/sites/default/files/tm117E.pdf
Postma, H. (1965). Water circulation and suspended matter in Baja California lagoons. Netherlands Journal of Sea Research, 2, 566–604. https://doi.org/10.1016/0077-7579(65)90005-0
Reséndiz, E., Fernández-Sanz, H. y Lara, M. (2018a). Baseline health indicators of Eastern Pacific Green Turtles (Chelonia mydas) from Baja California Sur, Mexico. Comparative Clinical Pathology, 27, 1309–1320. https://doi.org/10.1007/s00580-018-2740-3
Reséndiz, E., Fernández-Sanz, H. y Lara, M. (2018b). Chelonia mydas* (Eastern Pacific Green Sea turtle) diet. Herpetological Review, 49, 315.
Reséndiz, E., Riosmena-Rodriguez R. y Marcín-Medina, R. (2016). Chelonia mydas* (Eastern Pacific Green Sea turtle) diet. Herpetological Review, 47, 282–283.
Seminoff, J. A. (2004). Chelonia mydas. The IUCN Red List of Threatened Species. e.T4615A11037468.
Seminoff, J. A. y Jones, T. T. (2006). Diel movements and activity ranges of green turtles (Chelonia mydas) at a temperate foraging area in the Gulf of California, Mexico. Herpetological Conservation and Biology, 1, 81–86.
Seminoff, J. A., Reséndiz, A. y Nichols, W. J. (2002). Home range of green turtles Chelonia mydas at a coastal foraging area in the Gulf of California, Mexico. Marine Ecology Progress Series, 242, 253–265.
Senko, J., Koch, V., Megill, W. M., Carthy, R. R., Templeton, R. P. y Nichols, W. J. (2010b). Fine scale daily movements and habitat use of East Pacific green turtles at a shallow coastal lagoon in Baja California Sur, Mexico. Journal of Experimental Marine Biology and Ecology, 391, 92–100. https://doi.org/10.1016/j.jembe.2010.06.017
Senko, J., López-Castro, M. C., Koch, V. y Nichols, W. J. (2010a). Immature East Pacific Green Turtles (Chelonia mydas) use multiple foraging areas off the Pacific coast of Baja California Sur, Mexico: first evidence from mark-recapture data. Pacific Science, 64, 125–130.
Shimada, T., Jones, R., Limpus, C., Groom, R. y Hamann, M. (2016). Long-term and seasonal patterns of sea turtle home ranges in warm coastal foraging habitats: implications for conservation. Marine Ecology Progress Series, 562, 163–179. https://doi.org/10.3354/meps11972
Shimada, T., Limpus, C. J., Hamann, M., Bell, I., Esteban, N., Groom, R. et al. (2019). Fidelity to foraging sites after long migrations. Journal of Animal Ecology, 89, 1008–1016. https://doi.org/10.1111/1365-2656.13157
Southwood, A. L., Darveau, C. A. y Jones, D. R. (2003). Metabolic and cardiovascular adjustments of juvenile green turtles to seasonal changes in temperature and photoperiod. Journal of Experimental Biology, 206, 4521–4531. https://doi.org/10.1242/jeb.00689
StatSoft, Inc. (2004). STATISTICA (data analysis software system), version 7. www.statsoft.com.
White, G. C. y Garrott, R. A. (1990). Analysis of wildlife radiotracking data. San Diego, California: Academic Press.
Whiting, S. D. y Miller, J. D. (1998). Short term foraging ranges of adult green turtles (Chelonia mydas). Journal of Herpetology, 3, 330–337. https://doi.org/10.2307/1565446
Wildermann, N. E., Gredzens, C., Avens, L., Barrios-Garrido, H. A., Bell, I., Blumenthal, J. et al. (2018). Informing research priorities for immature sea turtles through expert elicitation. Endangered Species Research, 37, 55–76.
https://doi.org/10.3354/esr00916
Williams, J. L., Pierce, S. J., Rohner, C. A., Fuentes, M. M. P. B. y Hamann, M. (2017). Spatial Distribution and Residency of Green and Loggerhead Sea Turtles Using Coastal Reef Habitats in Southern Mozambique. Frontiers in Marine Science, 3. https://doi.org/10.3389/fmars.2016.00288
Wood, L. D., Brunnick, B. y Milton, S. L. (2017). Home range and movement patterns of subadult hawksbill sea turtles in Southeast Florida. Journal of Herpetology, 51, 58–67. https://doi.org/10.1670/15-133