Eberto Novelo a, *, Rosaluz Tavera b y Beatriz Lira b
a Universidad Nacional Autónoma de México, Facultad de Ciencias, Departamento de Biología Comparada, Laboratorio Algas Continentales. Ecología y Taxonomía, Circuito Exterior s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
b Universidad Nacional Autónoma de México, Facultad de Ciencias, Departamento de Ecología y Recursos Naturales, Laboratorio Algas Continentales. Ecología y Taxonomía, Circuito Exterior s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
*Autor para correspondencia: enm@ciencias.unam.mx (E. Novelo)
Recibido: 14 octubre 2022; aceptado: 15 marzo 2023
Resumen
La flora de algas en los lagos y arroyos de la Cantera Oriente de la Reserva Ecológica del Pedregal de San Ángel de la UNAM ha sido monitoreada durante 14 años. Se reunieron los registros semestrales de ese periodo contabilizando 270 taxones de 8 divisiones. El 87% de esa flora se ha presentado de 1 a 7 ocasiones y solo 15 especies se presentaron de 11 a 14 años. En este recuento, 5 especies son nuevos registros para México. La clasificación de las especies como raras, frecuentes o constantes se corresponde con los registros de las recolecciones, pero está en desacuerdo con las calificaciones de las especies por su distribución geográfica (cosmopolita, amplia o restringida), pues 156 especies cosmopolitas fueron raras y solo 11 con esa calificación fueron constantes. Se discuten la importancia del monitoreo de la flora para caracterizar biológicamente un cuerpo de agua, los cambios en la flora y las supuestas respuestas eurioicas de las especies cosmopolitas en condiciones ambientales sin cambios drásticos; se evalúa el impacto de esos aspectos en el recuento florístico nacional y de la Ciudad de México. Este estudio es el primer análisis de algas continentales a largo plazo en nuestro país.
Palabras clave: Algas continentales; Monitoreo; Riqueza florística; Recambio de especies
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
A long-term study of the algal flora in urban lakes
Abstract
The algal flora in the lakes and streams of the Cantera Oriente of the Reserva Ecológica del Pedregal de San Ángel of the UNAM has been monitored for 14 years. Semiannual records were collected for that period, accounting for 270 taxa from 8 divisions. Eighty-seven percent of this flora has been present from 1 to 7 occasions, and only 15 species were present from 11 to 14 years. In this count, 5 species are new records for Mexico. Specifying species as rare, frequent, or constant corresponds with collection data. Still, it is at odds with the species qualification by geographic distribution (cosmopolitan, broad, or restricted), as 156 cosmopolitan species were rare, and only 11 with that rating were constant. We discuss the importance of monitoring the flora to characterize a water body by the biological component, the changes in the flora, and the supposed eurioic responses of cosmopolitan species in environmental conditions without drastic changes; the impact of these aspects on the national and Mexico City floristic count is evaluated. This study is the first long-term analysis of continental algae in our country.
Keywords: Continental algae; Monitoring; Floristic richness; Species turnover
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Los estudios florísticos de algas de aguas continentales son el punto de partida para la conservación de los ambientes acuáticos y de su diversidad biológica. No pueden diseñarse estrategias de conservación si no se conoce el contenido biológico de un área o ambiente. Mientras que los estudios florísticos de plantas vasculares pueden planearse a largo plazo, en el caso de las algas hay que considerar el posible cambio de las poblaciones por razones climáticas, de la química del agua, la imposibilidad fisiológica de las especies para mantenerse en condiciones particulares y también los ciclos de vida relativamente más rápidos, sobre todo cuando la multiplicación vegetativa es tan activa que modifica las concentraciones de nutrientes y otras condiciones fisicoquímicas en el agua. Algunos cambios en la composición de las poblaciones algales pueden ser muy rápidos (en días), otros muy largos (en años) y son evidentes porque los ambientes no son climática o químicamente constantes (por la estacionalidad o por la interacción con la cuenca). La presión de las comunidades humanas que utilizan los cuerpos de agua añade elementos que modifican el ambiente, en ritmos o pulsos, mucho más rápidamente que los procesos naturales y eso también repercute en la dinámica de la flora algal. En este escenario es pertinente plantearse los estudios ficoflorísticos continuos para conservar el ambiente acuático y como una tarea permanente en aquellos cuerpos de agua que queremos recuperar o mantener.
Los métodos para reconocer a las algas se han modificado drásticamente en los últimos 50 años, pasamos de un conocimiento basado principalmente en la morfología y los ciclos de vida, a aquellos basados en ultraestructura, bioquímica y, más recientemente, en filogenética molecular. La taxonomía y la nomenclatura de todos los grupos algales ha cambiado y en especial, en el caso de las algas continentales, a un ritmo acelerado y en las 10 divisiones algales más ricas y diversas; desde el punto de vista práctico es difícil seguir la trayectoria en todas estas divisiones. Además, otro elemento que influye en el reconocimiento específico de las algas es la necesidad de contar con un instrumental de alta resolución para observar los caracteres utilizados en la taxonomía morfológica. Todo lo anterior refuerza la necesidad de estudiar recurrentemente los cuerpos de agua, para mantener vigente la flora que se registra. Si es posible mantenerse actualizado en la taxonomía de los principales grupos y si se cuenta con la infraestructura necesaria, entonces el registro florístico puede dar nota de todos los cambios de un sitio o de un ambiente.
Los lagos y arroyos de la Cantera Oriente de la Reserva Ecológica del Pedregal de San Ángel (REPSA) de la Universidad Nacional Autónoma de México (UNAM) tienen características que permiten su estudio a largo plazo. La Cantera se encuentra bajo resguardo y la presión antrópica se limita principalmente a los afluentes subterráneos de aguas residuales de los asentamientos vecinos y de una planta de tratamiento de agua anexa a la reserva. El aporte principal es de agua pluvial y de manantiales que emergen de la roca volcánica circundante. En términos generales, podría decirse que la calidad del agua de la Cantera parece constante (Cuevas-Madrid et al., 2020; Hernández-Martínez et al., 2007). Por estas condiciones, es un sitio adecuado para realizar prácticas docentes de la materia de Biología de protistas y algas de la carrera de Biología de la Facultad de Ciencias, desde 2006 a la fecha hemos visitado semestralmente este sitio para obtener muestras de agua de las comunidades planctónicas, perifíticas y metafíticas. Los antecedentes a este estudio se incluyen en el apartado de información bibliográfica de la siguiente sección.
El objetivo principal de este trabajo es analizar la información florística reunida en el transcurso de 14 años de recolecciones de algas, así como mostrar las especies que han aparecido regular, esporádica o eventualmente y documentar aquellas especies que, a la fecha, son registros nuevos para México.
Materiales y métodos
La Cantera Oriente de la REPSA de la UNAM se ubica en las coordenadas 19°19’15” – 19°18’48” N, 99°10’25” – 99°10’11” O. Las características más generales del lugar han sido descritas en varias publicaciones e incluyen tipo de sustrato, historia, biodiversidad, flora, ecología (Castillo-Argüero et al., 2007; Cuevas-Madrid et al., 2020; Hernández-Martínez et al., 2007; Lot, 2007; Lot y Cano-Santana, 2009).
Existen publicaciones y tesis sobre las algas de la Cantera Oriente que formaron parte de la información de este estudio cuando se mencionó la fecha de recolección (Ceballos-Ramírez, 2016; Cortés-López, 2011; Isais-López, 2019; Maceda-Ramírez, 2017; Maceda et al., 2017; Novelo et al., 2007, 2009). En este estudio se incluyen las especies de estas fuentes que han sido correctamente registradas.
La recolección de las muestras fue realizada en las comunidades lacustres planctónicas, perifíticas y metafíticas y algunas muestras en condiciones particulares (subaéreas o arroyos someros). Las muestras planctónicas fueron obtenidas filtrando 10 L de agua en una red de plancton con apertura de malla de 10 µm, concentrada en 250 ml. La muestra final fue una alícuota de 20 ml del concentrado. Las muestras metafíticas y perifíticas se obtuvieron de exprimidos de vegetación riparia y raspados directos de varios sustratos (madera sumergida, objetos, piedras). Las muestras fueron preservadas con formol al 2% de concentración final.
No siempre fue posible contar con datos ambientales homogéneos u obtenidos con el mismo equipo, por ello presentamos los datos promediados que son comunes a todos los años: temperatura del agua, pH y conductividad. Los registros fueron obtenidos con un potenciómetro – conductímetro portátil Conductronic (México). Los datos climáticos de temperatura media anual y precipitación fueron obtenidos del Servicio Meteorológico Nacional (SMN, 2022, estación meteorológica 9020 en Tlalpan, Ciudad de México)
Las muestras fueron incorporadas al Herbario de la Facultad de Ciencias (FCME), bajo la colección particular de la Ciudad de México y en resguardo y curación del Laboratorio Algas Continentales. Ecología y Taxonomía de la misma Facultad. Todas las muestras cuentan con preparaciones semipermanentes montadas con gelatina glicerinada (González-González y Novelo, 1986). La mayoría de las muestras fueron obtenidas durante las prácticas escolares de la materia Biología de protistas y algas de la licenciatura de Biología, además de otras recolecciones independientes.
Las muestras fueron observadas en fresco y en las preparaciones semipermanentes con un microscopio Nikon E600 (Tokio, Japón) con contraste interdiferencial. Las fotografías de los ejemplares se hicieron con una cámara digital Nikon DXM 1200C. Se tomaron en cuenta todas las especies registradas en las publicaciones, más las observadas por los autores en el periodo 2006-2019.
Una vez reunida la información, se agrupó por años, pues las fechas de recolección fueron variables en todo el periodo. Se contabilizaron la frecuencia de las especies y la fecha en la que se observaron durante el periodo. Para la evaluación de esa información se hizo un análisis de disimilitud entre los años, a partir de la frecuencia de las especies. Se utilizó el programa XLSTAT-Ecology V.22. Se usó la distancia euclídea con el método de Ward como criterio de aglomeración y el índice de selección de clases o nodos del dendrograma se basó en la entropía, que utiliza el atributo que mejor separa los casos y que no depende del número definido de grupos; el grado de heterogeneidad de cada grupo se estimó con el método de silueta (Molina-López y García-Herrero, 2006).
Resultados
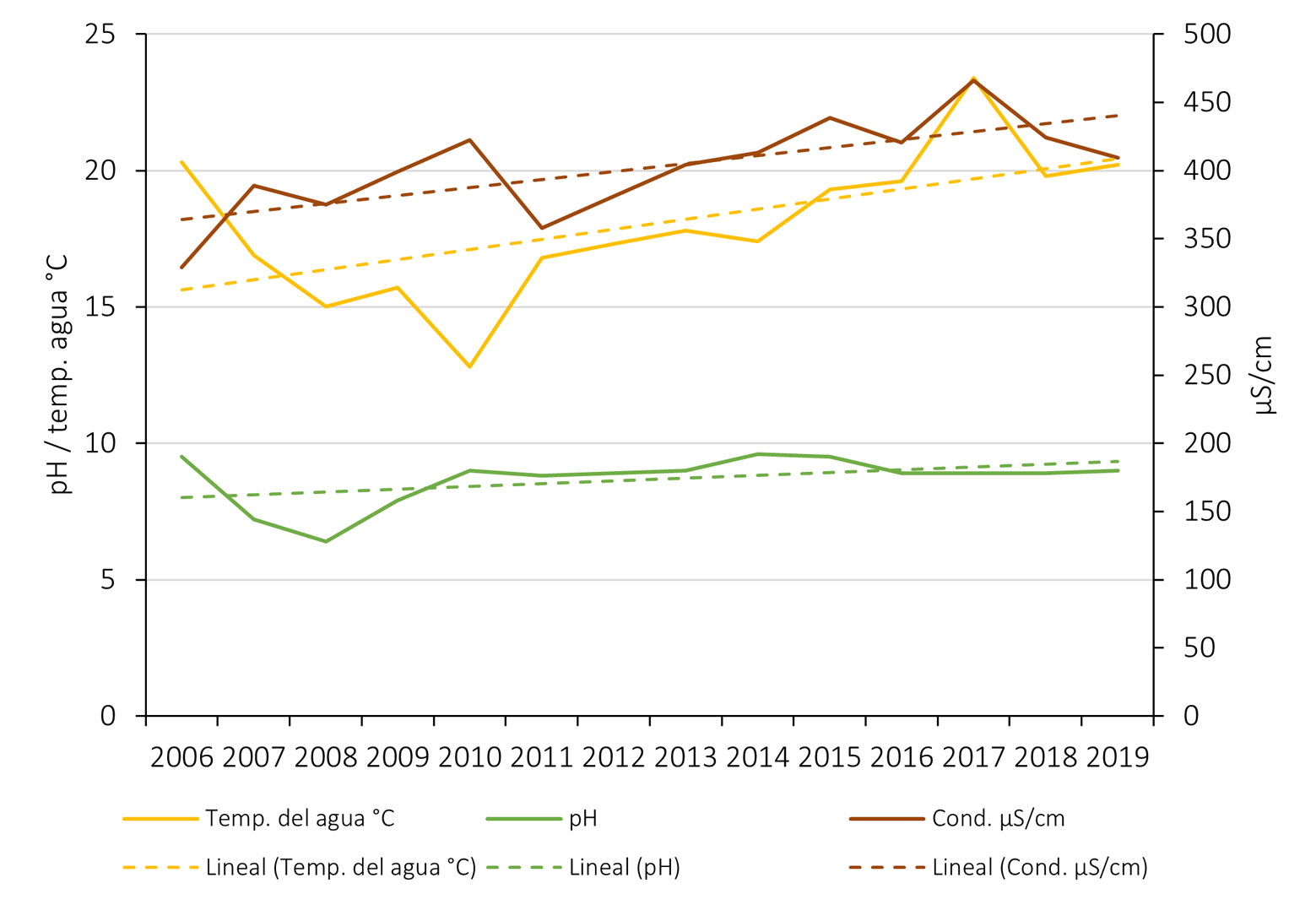
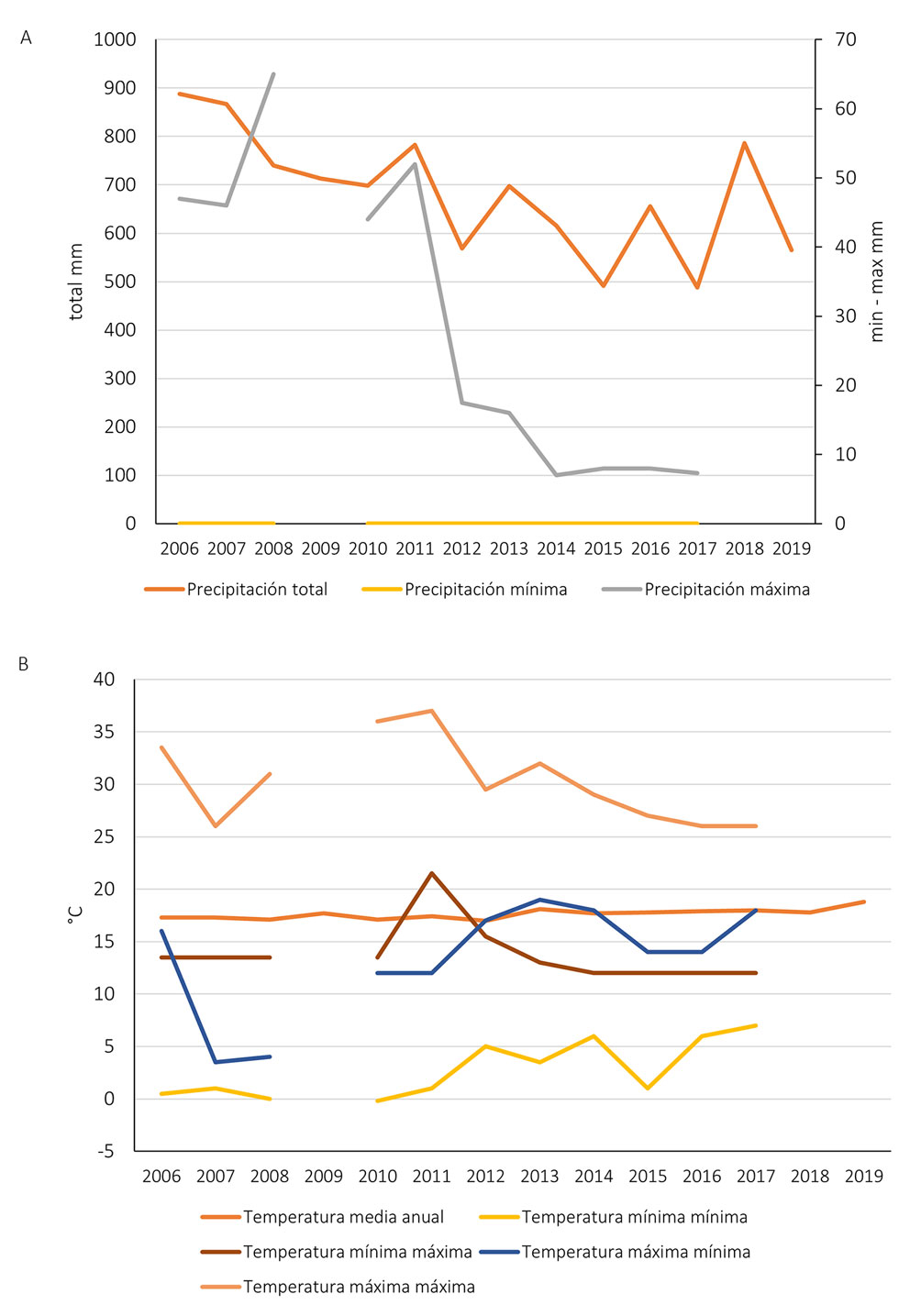
Los valores promediados anuales de temperatura, pH y conductividad de los lagos de la Cantera se muestran en la tabla 1 y en la figura 1. Los datos de temperatura ambiental y precipitación se muestran en la tabla 2 y en la figura 2.
Tabla 1
Valores anuales promediados de los cuerpos de agua de la Cantera Oriente de la REPSA-UNAM.
| Año | Temp. del agua °C | pH | Cond. µS/cm |
| 2006 | 20.3 | 9.5 | 329 |
| 2007 | 16.9 | 7.2 | 389 |
| 2008 | 15.0 | 6.4 | 375 |
| 2009 | 15.7 | 7.9 | 399 |
| 2010 | 12.8 | 9.0 | 423 |
| 2011 | 16.8 | 8.8 | 358 |
| 2012 | 17.3 | 8.9 | 381 |
| 2013 | 17.8 | 9.0 | 404 |
| 2014 | 17.4 | 9.6 | 413 |
| 2015 | 19.3 | 9.5 | 439 |
| 2016 | 19.6 | 8.9 | 420 |
| 2017 | 23.4 | 8.9 | 466 |
| 2018 | 19.8 | 8.9 | 424 |
| 2019 | 20.2 | 9.0 | 409 |
Se obtuvieron 270 taxones en total: 44 Cyanoprokaryota, 91 Bacillariophyta, 109 Chlorophyta, 5 Charophyta, 2 Cryptophyta, 2 Dinophyta, 14 Euglenophyta y 3 Heterokontophyta. El elenco sistemático está compuesto por estas 8 divisiones, 15 clases, 35 órdenes, 76 familias, 142 géneros, 257 especies nominales, 3 variedades, 9 variedades de especies con presencia de la variedad nominal y 1 forma (tabla 3). La lista de taxones ordenada alfabéticamente por género y su presencia en cada año se muestra en la tabla 4.
En este recuento hubo 5 especies de la división Chlorophyta que no han sido documentadas en México y a continuación se presentan sus descripciones e ilustraciones (Novelo y Tavera, 2022).
Chlamydomonas bicocca Pascher.
Süssw.-Fl. 4: 186, 269, fig. 227. 1927.
Chlorophyceae, Chlamydomonadales, Chlamydomonadaceae; fig. 3.
Unicélulas de vida libre. Células adultas esféricas; las jóvenes, ligeramente elipsoidales. Pared celular delgada con una papila apical cilíndrica de la que emergen los 2 flagelos que son ligeramente mayores que el largo de la célula. Cloroplasto en forma de copa que ocupa casi la totalidad de la célula y con un engrosamiento lateral que contiene 2 pirenoides esféricos con gránulos de almidón discretos entre sí. Un estigma apical pequeño. Núcleo central en la luz del cloroplasto. Células de 12-22 µm de diámetro.
Herbario FCME: CM 138; CM 838.
Una especie rara en la Cantera Oriente solo ha sido registrada en 2012 y 2019. Considerada como de amplia distribución principalmente en cuerpos de agua grandes (Ettl, 1983) y según AlgaeBase con registros en Europa y Australia (Guiry y Guiry, 2022).
Tabla 2
Precipitación total anual y temperatura de la Ciudad de México. A = Precipitación total anual en la Ciudad de México, precipitación mínima y precipitación máxima en la estación 9020 en Tlalpan, en mm; B = temperatura media anual en la Ciudad de México en °C; C = temperaturas mínima-mínima y mínima-máxima en la estación 9020 en Tlalpan, en °C; D = temperatura máxima-mínima y máxima-máxima en la estación 9020 en Tlalpan, en °C (SMN, 2022). ND = Datos no disponibles en el SMN.
| Año | A | B | C | D |
| 2006 | 882.4
0 47.0 |
17.3 | 0.5
13.5 |
16.0
33.5 |
| 2007 | 866.5
0 46.0 |
17.3 | 1.0
13.5 |
3.5
26.0 |
| 2008 | 740.9
0 65.0 |
17.1 | 0.0
13.5 |
4.0
31.0 |
| 2009 | 713.1 | 17.7 | ND | ND |
| 2010 | 697.9
0 44.0 |
17.1 | -0.2
13.5 |
12.0
36.0 |
| 2011 | 782.6
52.0 |
17.4 | 1.0
21.5 |
12.0
37.0 |
| 2012 | 568.9
0 17.5 |
17 | 5.0
15.5 |
17.0
29.5 |
| 2013 | 697.8
16.0 |
18.1 | 3.5
13.0 |
19.0
32.0 |
| 2014 | 615.6
0 7.0 |
17.7 | 6.0
12.0 |
18.0
29.0 |
| 2015 | 491.8
0 8.0 |
17.8 | 1.0
12.0 |
14.0
27.0 |
| 2016 | 655.9
0 8.0 |
17.9 | 6.0
12.0 |
18.0
26.0 |
| 2017 | 488
0 7.3 |
18 | 7.0
12.0 |
18.0
26.0 |
| 2018 | 786.2 | 17.8 | ND | ND |
| 2019 | 565.3 | 18.8 | ND | ND |
Chlamydomonas reinhardtii P.A. Dangeard
Ann. Sc. Nat. Bot. ser. 7, 7: 136, pl, 12: figs. 29-339. 1888
Chlorophyceae, Chlamydomonadales, Chlamydomonada-
ceae; fig. 4.
Unicélulas de vida libre o formando agregados palmeloides. Células elipsoidales a esféricas, ligeramente irregulares. Pared celular delgada, sin engrosamientos basales o polares. Con 2 flagelos largos, mayores del largo de la célula que emergen cercanos entre sí y sin papila intermedia en la pared celular. Cloroplasto en forma de copa con la base amplia y ocupa más de la mitad del largo de la célula. Un pirenoide esférico o poligonal, basal, grande con gránulos de almidón continuos. Un estigma lateral, pequeño. Núcleo central en la luz del cloroplasto. Células de 10-20 µm de largo, 7.5-18 µm de ancho.
Herbario FCME: CM 90; CM 955.
En la Cantera Oriente abundó como plancton en la primavera de 2007, 2011, 2019 y formó grandes crecimientos superficiales en los lagos. Es una especie considerada como de amplia distribución mundial y cosmopolita (Ettl, 1983).
Coenocystis tapasteana Komárek
Nova Hedwigia 37: 98, 174, pl. 10: 21. 1983.
Chlorophyceae, Sphaeropleales, Radiococcaceae; fig. 5.
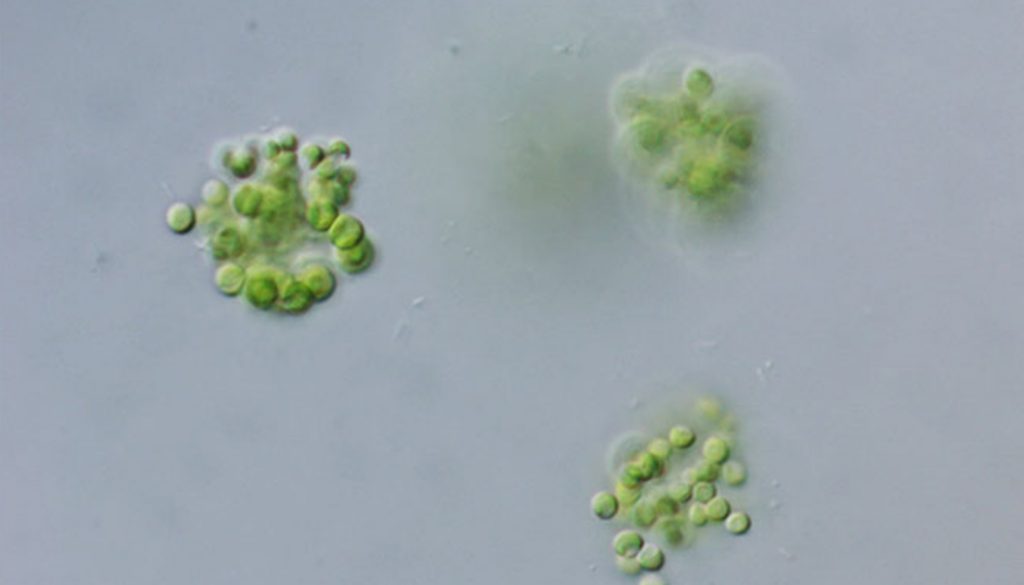
Colonias planctónicas irregulares a globosas, mucilaginosas, que contienen familias de células en grupos generalmente de 4 individuos. Mucílago incoloro, hialino, sin restos de paredes maternas. Células esféricas, generalmente con su vaina individual. Cloroplasto en forma de copa que ocupa de la mitad a 2 tercios del volumen celular. Un pirenoide generalmente basal, circular con gránulos de almidón discretos. Multiplicación por autosporas dispuestas tetraédricamente que son liberadas dentro del mucílago colonial. Células de 6.5-7 µm de diámetro.
Herbario FCME: CM 298; CM 956.
Tabla 3
Elenco sistemático de las algas de la Cantera Oriente, REPSA, UNAM. Entre paréntesis, el número de especies de cada género. Los sistemas utilizados son para Cyanoprokaryota: Komárek et al., 2014 y Hauer y Komárek, 2019. Para Bacillariophyta: Medlin y Kackmarzka, 2004 y Round et al., 2000. Para otros grupos: AlgaeBase (Guiry y Guiry, 2023).
| Bacillariophyta | |||
| Bacillariophyceae | |||
| Achnanthales | |||
| Achnanthaceae: Achnanthes (1) | |||
| Achnanthidiaceae: Achnanthidium (1), Lemnicola (2), Planothidium (1), Platessa (1), Psamothidium (1) | |||
| Cocconeidaceae: Cocconeis (2) | |||
| Bacillariales | |||
| Bacillariaceae: Denticula (1), Hantzschia (1), Nitzschia (9), Tryblionella (2) | |||
| Cymbellales | |||
| Cymbellaceae: Cymbella (2), Cymbopleura (1) | |||
| Gomphonemataceae: Encyonema (1), Gomphonella (1), Gomphonema (9) | |||
| Rhoicospheniaceae: Gomphosphenia (2), Rhoicosphenia (1) | |||
| Eunotiales | |||
| Eunotiaceae: Eunotia (1) | |||
| Fragilariales | |||
| Fragilariaceae: Ctenophora (1), Diatoma (1), Fragilaria (2), Hannea (1), Staurosira (2), Staurosirella (2), Ulnaria (3) |
|||
| Naviculales | |||
| Amphipleuraceae: Frustulia (1) | |||
| Diadesmidaceae: Humidophila (1) | |||
| Diploneidaceae: Diploneis (2) | |||
| Naviculaceae: Caloneis (2), Navicula (6) | |||
| Pinnulariaceae: Pinnularia (2) | |||
| Sellaphoraceae: Sellaphora (2) | |||
| Stauroneidaceae: Craticula (1) | |||
| Rhopalodiales | |||
| Rhopalodiaceae: Epithemia (2), Rhopalodia (2) | |||
| Surirellales | |||
| Surirellaceae: Surirella (2) | |||
| Thalassiophysales | |||
| Catenulaceae: Amphora (4), Halamphora (4) | |||
| Coscinodiscophyceae | |||
| Aulacoseirales | |||
| Aulacoseiraceae: Aulacoseira (1) | |||
| Melosirales | |||
| Melosiraceae: Melosira (1) | |||
| Mediophyceae | |||
| Biddulphiales | |||
| Biddulphiaceae: Terpsinoe (1) |
| Tabla 3. Continúa | |||
| Thalassiosirales | |||
| Stephanodiscaceae: Cyclostephanos (1), Pantocsekiella (1), Stephanocyclus (1), Stephanodiscus (1) | |||
| Charophyta | |||
| Coleochaetophyceae | |||
| Chaetosphaeridiales | |||
| Chaetosphaeridiaceae: Chaetosphaeridium (1) | |||
| Conjugatophyceae | |||
| Desmidiales | |||
| Closteriaceae: Closterium (1) | |||
| Desmidiaceae: Cosmarium (2) | |||
| Klebsormidiophyceae | |||
| Klebsormidiales | |||
| Klebsormidiaceae: Klebsormidium (1) | |||
| Chlorophyta | |||
| Chlorophyceae | |||
| Chaetophorales | |||
| Chaetophoraceae: Stigeoclonium (1) | |||
| Chlamydomonadales | |||
| Chlamydomonadaceae: Chlamydomonas (9), Chloromonas (1), Vitreochlamys (1) | |||
| Cylindrocapsaceae: Fusola (1) | |||
| Palmellopsidaceae: Chlamydocapsa (2) | |||
| Phacotaceae: Pteromonas (3), Coccomonas (1) | |||
| Sphaerocystidaceae: Korschpalmella (1) | |||
| Volvocaceae: Eudorina, (2), Pandorina (2) | |||
| Sphaeropleales | |||
| Characiaceae: Characium (1) | |||
| Hydrodictyaceae: Hydrodictyon (1), Monactinus (2), Pediastrum, (2), Pseudopediastrum (2), Tetraedron (1) | |||
| Neochloridaceae: Fusola (1) | |||
| Radiococcaceae: Coenochloris (2), Coenocystis (2), Eutetramorus (1) | |||
| Scenedesmaceae: Comasiella (1), Coelastrum (3), Desmodesmus (21), Pectinodesmus, (2), Scenedesmus (1), Steinedesmus (1), Tetradesmus (3) | |||
| Schizochlamydaceae: Planktosphaeria (1) | |||
| Schroederiaceae: Schroederia (1) | |||
| Selenastraceae: Ankistrodesmus (3), Chlorolobion (1), Kirchneriella (2), Monoraphidium (2), Quadrigula (1), Messastrum (1) | |||
| Trebouxiophyceae | |||
| Chlorellales | |||
| Chlorellaceae: Actinastrum (2), Chlorella (2), Closteriopsis(1), Dictyosphaerium (1), Keratococcus (1), Micractinium (2), Mucidosphaerium (1) | |||
| Oocystaceae: Didymocystis (1), Ecdysichlamys (1), Lagerheimia (4), Oocystis (4) | |||
| Prasiolales | |||
| Prasiolaceae: Stichococcus (1) | |||
| Ulvophyceae | |||
| Cladophorales | |||
| Cladophoraceae: Cladophora (1), Rhizoclonium (1) | |||
| Ulotrichales | |||
| Ulotrichaceae: Ulothrix (1) | |||
| Ulvales | |||
| Ulvaceae: Phaeophila (1) | |||
| Cryptophyta | |||
| Cryptophyceae | |||
| Cryptomonadales | |||
| Cryptomonadaceae: Cryptomonas (2) | |||
| Cyanoprokaryota | |||
| Cyanophyceae | |||
| Chroococcales | |||
| Aphanothecaceae: Aphanothece (1) | |||
| Chroococcaceae: Chroococcus (3), Gloeocapsopsis (1) | |||
| Microcystaceae: Microcystis (5) | |||
| Coelosphaeriaceae: Snowella (1) | |||
| Heteroleibleiniaceae: Heteroleibleinia (1) | |||
| Leptolyngbyaceae: Leibleinia (1), Leptolyngbya (1) | |||
| Merismopediaceae: Aphanocapsa (4) | |||
| Pseudanabaenaceae: Jaaginema (2), Limnothrix (1), Pseudanabaena (3) | |||
| Synechococcales | |||
| Chamaesiphonaceae: Chamaesiphon (3) | |||
| Pleurocapsales | |||
| Dermocarpellaceae: Cyanocystis (1) | |||
| Hyellaceae: Pleurocapsa (1) | |||
| Xenococcaceae: Xenococcus (2) | |||
| Oscillatoriales | |||
| Gomontiellaceae: Komvophoron (1) | |||
| Microcoleaceae: Microcoleus (1), Planktothrix (1), Porphyrosiphon (1) | |||
| Oscillatoriaceae: Phormidium (4) | |||
| Nostocales | |||
| Aphanizomenonaceae: Dolichospermum (1) | |||
| Scytonemataceae: Scytonema (1) | |||
| Rivulariaceae: Calothrix (1) | |||
| Nostocaceae: Cylindrospermum (1), Nostoc (1) | |||
| Dinophyta | |||
| Dinophyceae | |||
| Peridiniales | |||
| Glenodiniaceae: Glenodiniopsis (1) | |||
| Peridiniopsidaceae: Tyrannodinium (1) | |||
| Euglenophyta | |||
| Euglenophyceae | |||
| Euglenales | |||
| Euglenaceae: Euglena (4), Lepocinclis (3), Monomorphina (1), Phacus (3), Trachelomonas (1) | |||
| Heteronematales | |||
| Peranemataceae: Pseudoperanema (1), Entosiphon (1) | |||
| Heterokontophyta | |||
| Synurophyceae | |||
| Synurales | |||
| Synuraceae: Synura (1) | |||
| Xanthophyceae | |||
| Mischococcales | |||
| Botrydiopsidaceae: Botrydiopsis (1) | |||
| Ophiocytiaceae: Ophiocytium (1) | |||
| Pleurochloridaceae: Chloridella (1) |
Una especie rara en la Cantera Oriente, solo se ha visto en las recolecciones de 2015 y 2019. Es una especie de ambientes eutróficos, conocida de Cuba (Comas-González, 1996), España, Uruguay y Turquía (Guiry y Guiry, 2022).
Korschpalmella mucosa (Korshikov) Hindák.
Biol. Práce Slov. Akad. Vied 34(1/2): 60. 1988.
Chlorophyceae, Chlamydomonadales, Sphaerocystidaceae; fig. 6.
Colonias planctónicas y metafíticas densas de más de 12 células, a veces varios grupos dentro de la colonia. Las células sin un arreglo definido. Mucílago difluente, hialino y amplio. Células esféricas con una pared celular delgada. Cloroplasto en forma de copa que ocupa más de la mitad de la periferia de la célula. Sin pirenoide. Multiplicación por 4 autosporas que se mantienen unidas. Células de 1.5 a 3 µm de diámetro.
Herbario: CM 316, CM 317, CM 367
Esta especie ha sido vista frecuentemente en la Cantera Oriente, en varios años, pero solo hasta ahora ha sido posible identificarla, por eso solo hay registros a partir de 2013. Es una especie registrada principalmente en Europa en lagos de minas de grava (Guiry y Guiry, 2022; Hindák, 1988). Es un nuevo registro para México y el continente americano.
Steinedesmus graevenitzii (C. Bernard) Comas et Komárek.
Preslia 57: 108. 1985.
Chlorophyceae, Sphaeropleales, Scenedesmaceae; fig. 7.
Cenobios y sincenobios planctónicos y metafíticos formados por agrupaciones en múltiplos de 4 células siempre alternadas y en 2 hileras. Células elípticas, las centrales simétricas, las externas ligeramente curvas en los ápices solamente. Las células se unen en más de ¾ de su longitud. Ápices atenuados con polos redondeados y pared más gruesa. Pared celular lisa. Cloroplasto parietal con un pirenoide. Multiplicación por autosporas que se liberan apicalmente de la célula madre. Células de 9.5-18 µm de largo y 3.5-9.2 µm de diámetro.
Herbario FCME: CM 298, CM 351, CM 367, CM 955.
En la Cantera Oriente es una especie reciente, se ha registrado en 2014, 2016, 2017 y 2019 en metafiton y perifiton. Es una especie considerada como de distribución amplia pero más frecuente en los trópicos (Comas-González, 1996). Es posible que muchos registros en los que no se observaron liberación de autosporas o formación de sincenobios se hayan identificado como Scenedesmus obliquus (Turpin) Kützing o Sc. obliquus var. dimorphus (Turpin) Hansgirg cuando en realidad sean Steinedesmus graevenitzii. Este género se caracteriza, según Comas-González (1996), por la liberación apical de las autosporas y la formación de sincenobios, mientras que Scenedesmus libera las autosporas lateralmente y no forma esas agrupaciones de forma consistente.
Discusión
Una flora define y califica biológicamente a un lugar y las interacciones que se desarrollan en él dependen inicialmente de la composición de esa flora (Novelo, 1998). De los 270 taxones encontrados, el componente predominante fue el de las Chlorophyta (109), seguido de las Bacillariophyta (91), Cyanoprokaryota (44), Euglenophyta (14), Charophyta (5), Heterokontophyta (3) y Cryptophyta y Dinophyta con 2 taxones cada una. La mayoría de las Chlorophyta pertenece a las unicelulares cocoides que generalmente se les califica como indicadoras de condiciones eutróficas. El que las Cyanoprokaryota no estén ampliamente representadas en el plancton, pues la mayoría de las registradas son organismos perifíticos o epífitos, significaría que las condiciones no son eutróficas. Sin embargo, los estudios sobre la calidad del agua califican a la Cantera Oriente como eutrófica a hipertrófica (Cuevas-Madrid et al., 2020; Ponce-Márquez y de la Lanza, 2019), pero no muestran información sobre cantidad de materia orgánica; las Euglenophyta y Dinophyta han sido asociadas a la presencia abundante de materia orgánica y en la Cantera fueron grupos muy poco representados en el periodo estudiado. Entonces, una presencia de algas que caracterizan a los ambientes eutróficos no es tan clara en la Cantera Oriente y más aún, si consideramos las variaciones en la riqueza específica a través de los años.
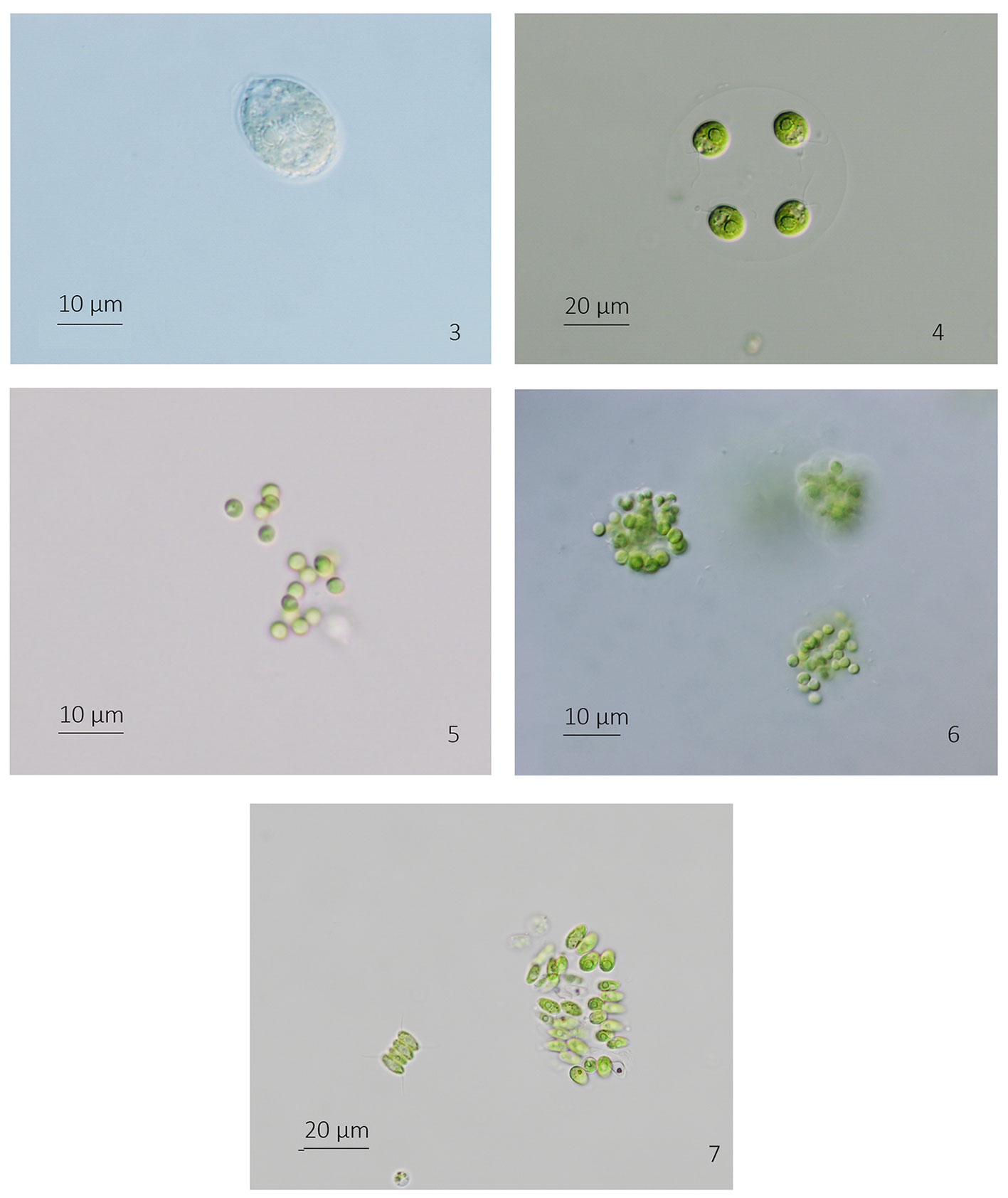
Tabla 4
Lista alfabética de taxones presentes en la Cantera Oriente de la REPSA-UNAM en el periodo 2006-2019. BAC = Bacillariophyta, CHA = Charophyta, CHL = Chlorophyta, CRY = Cryptophyta, CYA = Cyanoprokaryota, DIN = Dinophyta, EUG = Euglenophyta, HET = Heterokontophyta. El número es la frecuencia en el periodo. C = Frecuencia constante, F = frecuente, R = rara,
Co = cosmopolita, Am = distribución amplia, Re = distribución restringida, NR = nuevo registro para México.
| 1 Achnanthes inflata (Kützing) Grunow, BAC, 2006, 2007, 2008, 2010, 2011, 2012, 2013, 2016, 2017, 2019, 10, C, Co |
| 2 Achnanthidium minutissimum (Kützing) Czarnecki, BAC, 2006, 2007, 2008, 2010, 2011, 2012, 2013, 2016, 8, C, Co |
| 3 Actinastrum hantzschii Lagerheim, CHL, 2006, 2007, 2010, 2014, 2015, 2016, 2017, 2018, 2019, 9, C, Co |
| 4 A. hantzschii var. subtile Woloszynska, CHL, 2009, 2013, 2014, 2016, 2018, 5, F, Co |
| 5 Amphora commutata Grunow, BAC, 2006, 2007, 2, R, Co |
| 6 A. copulata (Kützing) Schoeman et Archibald, BAC, 2006, 2007, 2009, 2011, 2012, 2013, 2014, 2015, 2016, 2017, 2018, 11, C, Am |
| 7 A. ovalis (Kützing) Kützing, BAC, 2019, 1, R, Co |
| 8 A. pediculus (Kützing) Grunow, BAC, 2006, 2007, 2, R, Co |
| 9 Ankistrodesmus arcuatus Korshikov, CHL, 2010, 2016, 2018, 2019, 4, R, Co |
| 10 A. falcatus (Corda) Ralfs, CHL, 2013, 2016, 2, R, Co |
| 11 A. fusiformis Corda ex Korshikov, CHL, 2013, 2016, 2, R, Co |
| 12 Aphanocapsa elachista W. West et G.S. West, CYA, 2019, 1, R, Co |
| 13 A. grevillei (Berkeley) Rabenhorst, CYA, 2019, 1, R, Co |
| 14 A. nubila Komárek et Kling, CYA, 2016, 2017, 2018, 2019, 4, R, Co |
| 15 A. planctonica (G. M. Smith) Komárek et Anagnostidis, CYA, 2018, 1, R, Am |
| 16 Aphanothece elabens (Brébisson) Elenkin, CYA, 2006, 2007, 2, R, Co |
| 17 Aulacoseira granulata (Ehrenberg) Simonsen, BAC, 2006, 2007, 2008, 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2016, 2017, 2018, 2019, 14, C, Co |
| 18 Botrydiopsis arhiza Borzì, HET, 2008, 2011, 2, R, Co |
| 19 Caloneis amphisbaena (Bory) Cleve, BAC, 2008, 1, R, Co |
| 20 C. amphisbaena var. subsalina (Donkin) Cleve, BAC, 2006, 2007, 2, R, Re |
| 21 C. bacillum (Grunow) Cleve, BAC, 2006, 2007, 2008, 2017, 4, R, Co |
| 22 Calothrix fritschii f. flexuosa (Fritsch) De Toni, CYA, 2013, 1, R, Re, NR |
| 23 Chaetospheridum globusum (Nordstedt) Klebahn, CHA, 2006, 1, R, Co |
| 24 Chamaesiphon amethystinus (Rostafinski) Lemmermann, CYA, 2013, 1, R, Re |
| 25 C. incrunstans Grunow ex Rabenhorst, CYA, 2006, 2007, 2013, 3, R, Co |
| 26 C. minutus (Rostafinski) Lemmermann, CYA, 2013, 1, R, Co |
| 27 Characium ensiforme Hermann, CHL, 2006, 2007, 2, R, Co |
| 28 Chlamydocapsa ampla (Kützing) Fott, CHL, 2009, 1, R, Co |
| 29 C. planctonica (W. West et G.S. West) Fott, CHL, 2007, 1, R, Co |
| 30 Chlamydomonas angulosa O. Dill, CHL, 2007, 1, R, Co |
| 31 C. bicocca Pascher, CHL, 2012, 2019, 2, R, Re, NR |
| 32 C. conversa Korshikov, CHL, 2016, 1, R, Re |
| 33 C. ehrenbergi Goroschankin, CHL, 2007, 1, R, Co |
| 34 C. globosa Snow, CHL, 2011, 2012, 2016, 2019, 4, R, Am |
| 35 C. mexicana R.A. Lewin, CHL, 2019, 1, R, Re |
| 36 C. monadina Stein, CHL, 2012, 2016, 2, R, Co |
| Tabla 4. Continúa |
| 37 C. reinhardtii Dangeard, CHL, 2007, 2011, 2019, 3, R, Co, NR |
| 38 C. snowiae Printz, CHL, 2009, 2012, 2016, 2018, 4, R, Co |
| 39 Chlorella chlorelloides (Naumann) Bock et al., CHL, 2015, 2016, 2017, 2018, 2019, 5, F, Co |
| 40 C. vulgaris Beijerinck, CHL, 2017, 1, R, Co |
| 41 Chloridella cystiformis Pascher, CHL, 2007, 2009, 2, R, Am |
| 42 Chlorolobion braunii (Nägeli) Komárek, CHL2017, 2019, 2, R, Co |
| 43 Chloromonas grovei (West) Gerloff et Ettl, CHL, 2016, 1, R, Am |
| 44 Chroococcus minor (Kützing) Nägeli, CYA, 2008, 1, R, Co |
| 45 C. minutus (Kützing) Nägeli, CYA, 2006, 2007, 2, R, Co |
| 46 C. obliteratus Richter, CYA, 2006, 2007, 2008, 2015, 2019, 5, F, Re |
| 47 Cladophora glomerata (Linnaeus) Kützing, CHL, 2006, 2007, 2016, 3, R, Co |
| 48 Closteriopsis acicularis (G.M. Smith) Belcher et Swale, CHL, 2006, 2011, 2013, 3, R, Co |
| 49 Closterium pseudolunula Borge, CHA, 2006, 2007, 2009, 2011, 2013, 2015, F, R, Co |
| 50 Coccomonas orbicularis Stein, CHL, 2006, 2008, 2015, 2016, 2017, 5, F, Co |
| 51 Cocconeis placentula var. lineata Ehrenberg, BAC, 2006, 2007, 2014, 3, R, Co |
| 52 C. placentula var. placentula Ehrenberg, BAC, 2006, 2007, 2008, 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2019, 11, C, Co |
| 53 Coelastrum indicum Turner, CHL, 2008, 2009, 2013, 2017, 4, R, Co |
| 54 C. microporum Nägeli, CHL, 2007, 2014, 2015, 2016, 2017, 2018, 6, F, Co |
| 55 C. pseudomicroporum Korshikov, CHL, 2007, 2011, 2012, 2013, 2014, 2015, 2016, 2017, 2018, 9, C, Co |
| 56 Coenochloris fottii (Hindák) Tsarenko, CHL, 2006, 2008, 2, R, Co |
| 57 C. hindakii Komárek, CHL, 2013, 1, R, Co |
| 58 Coenocystis planctonica Korshikov, CHL, 2009, 2018, 2, R, Co, NR |
| 59 C. tapasteana Komárek, CHL, 2014, 2019, 2, R, Re, NR |
| 60 Comasiella arcuata var. platydisca (G.M. Smith) Hegewald et Wolf, CHL, 2012, 2014, 2016, 2017, 2019, 5, F, Co |
| 61 Cosmarium granatum Brébisson ex Ralfs, CHA, 2013, 2018, 2, R, Co |
| 62 C. pseudopyramidatum Lundell, CHA, 2006, 2007, 2008, 2010, 4, R, Co |
| 63 Craticula cuspidata (Kützing) D.G. Mann, BAC, 2006, 2007, 2012, 2014, 2015, 2016, 6, F, Co |
| 64 Cryptomonas ovata Ehrenberg, CRY, 2014, 1, R, Co |
| 65 C. paramaecium (Ehrenberg) Hoef-Emden et Melkonian, CRY, 2006, 2009, 2018, 3, R, Co |
| 66 Ctenophora pulchella (Ralfs ex Kützing) D.M. Williams et Round, BAC, 2013, 1, R, Co |
| 67 Cyanocystis pseudoxenococcoides (Bourrelly) Bourrelly, CYA, 2006, 2007, 2008, 2009, 2010, 2011, 2013, 2014, 2015, 2016, 2017, 2019, 12, C, Re |
| 68 Cyclostephanos dubius (Fricke) Round, BAC, 2010, 1, R, Am |
| 69 Cyclotella meneghiniana Kützing (ahora Stephanocyclus meneghinianus (Kützing) Kulikovski et al.), BAC, 2006, 2007, 2009, 2011, 2012, 2018, 2019, 7, F, Co |
| 70 Cylindrospermum majus Kützing ex Bornet et Flahault, CYA, 2006, 2007, 2008, 2009, 2010, 2011, 2013, 2014, 2015, 2016, 2017, 2019, 12, C, Co |
| 71 Cymbella mexicana (Ehrenberg) Cleve, BAC, 2006, 2007, 2011, 2012, 2019, 5, F, Am |
| 72 C. turgidula Grunow in Schmidt et al., BAC, 2013, 1, R, Co |
| 73 Cymbopleura naviculiformis (Auerswald ex Heiberg) Krammer, BAC, 2006, 2007, 2, R, Re |
| 74 Denticula kuetzingii Grunow, BAC, 2006, 2008, 2013, 2014, 2015, 2016, 2017, 7, F, Co |
| 75 Desmodesmus abundans (Kirchner) Hegewald, CHL, 2006, 2007, 2017, 2019, 4, R, Co |
| 76 D. armatus (Chodat) Hegewald, CHL, 2014, 2017, 2019, 3, R, Co |
| 77 D. armatus var. bicaudatus (Guglielmetti) Hegewald, CHL, 2006, 2007, 2019, 3, R, Am |
| 78 D. armatus var. spinosus (Fritsch et Rich) Hegewald, CHL, 2013, 1, R, Co |
| 79 D. armatus var. subalternans (G.M. Smith) Hegewald, CHL, 2009, 1, R, Co |
| 80 D. bicaudatus (Dedusenko) Tsarenko, CHL, 2009, 2012, 2, R, Re |
| 81 D. brasiliensis (Bohlin) Hegewald, CHL, 2008, 2009, 2010, 2012, 2013, 2014, 2015, 2016, 2017, 2019, 10, C, Co |
| 82 D. communis (Hegewald) Hegewald, CHL, 2006, 2007, 2011, 2012, 2018, 2019, 6, F, Co |
| 83 D. intermedius (R. Chodat) Hegewald, CHL, 2009, 1, R, Co |
| 84 D. kissi (Hortobágyi) Hegewald, CHL, 2006, 2007, 2009, 2013, 2014, 2015, 2016, 2017, 8, C, Co |
| 85 D. lunatus (W. West et G.S. West) Hegewald, CHL, 2011, 2018, 2, R, Co |
| 86 D. magnus (Meyen) Tsarenko 2000, CHL, 2006, 2007, 2008, 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2016, 2017, 2018, 2019, 14, C, Co |
| 87 D. maximus (W. West et G.S. West) Hegewald, CHL, 2006, 2007, 2008, 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2016, 2017, 2018, 2019, 14, C, Co |
| 88 D. opoliensis (Richter) Hegewald, CHL, 2006, 2007, 2011, 2012, 2018, 2019, 6, F, Co |
| 89 D. opoliensis var. carinatus (Lemmermann) Hegewald, CHL, 2011, 2013, 2014, 2015, 2017, 2019, 6, F, Co |
| 90 D. opoliensis var. mononensis (R. Chodat) Hegewald, CHL, 2006, 2007, 2009, 2011, 2012, 2013, 2018, 2019, 8, C, Co |
| 91 D. protuberans (Fritsch et Rich) Hegewald, CHL, 2006, 2007, 2017, 3, R, Co |
| 92 D. serratus (Corda) An et al., CHL, 2019, 1, R, Co |
| 93 D. spinosus (R. Chodat) Hegewald, CHL, 2019, 1, R, Co |
| 94 D. spinulatus (Biswas) Hegewald, CHL, 2013, 2016, 2019, 3, R, Co |
| 95 D. subspicatus (R. Chodat) Hegewald et Schmidt, CHL, 2011, 2016, 2, R, Co |
| 96 Diatoma moniliformis (Kützing) Williams, BAC, 2006, 2009, 2016, 3, R, Re |
| 97 Dictyosphaerium ehrenbergianum Nägeli, CHL, 2013, 2016, 2017, 3, R, Co |
| 98 Didymocystis planctonica Korshikov, CHL, 2006, 2017, 2, R, Co |
| 99 Diploneis elliptica (Kützing) Cleve, BAC, 2019, 1, R, Co |
| 100 D. ovalis (Hilse) Cleve, BAC, 2013, 1, R, Co |
| 101 Dolichospermum planctonicum (Brunnthaler) Wacklin, et al., CYA, 2007, 1, R, Co |
| 102 Ecdysichlamys obliqua G.S. West, CHL, 2006, 1, R, Am |
| 103 Encyonema silesiacum (Bleisch) D.G. Mann, BAC, 2006, 2007, 2, R, Co |
| 104 Entosiphon sulcatus (Dujardin) Stein, EUG, 2006, 1, R, Co |
| 105 Epithemia adnata (Kützing) Brébisson, BAC, 2007, 1, R, Co |
| 106 E. sorex Kützing, BAC, 2006, 2007, 2, R, Co |
| 107 Eudorina elegans Ehrenberg, CHL, 2006, 2007, 2, R, Co |
| 108 E. unicocca G.M. Smith, CHL, 2006, 2007, 2, R, Co |
| 109 Euglena chadefaudii Bourrelly, EUG, 2007, 2008, 2010, 2013, 4, R, Am |
| 110 E. gracilis Klebs 1883, EUG, 2006, 2007, 2012, 3, R, Co |
| 111 E. texta (Dujardin) Hübner, EUG, 2007, 2014, 2, R, Co |
| 112 E. viridis (O.F. Müller) Ehrenberg, EUG, 2006, 1, R, Co |
| 113 Eunotia sudetica O.F. Müller, BAC, 2006, 2007, 2, R, Co |
| 114 Eutetramorus tetrasporus Komárek, CHL, 2006, 2007, 2, R, Am |
| 115 Fragilaria capucina Desmaziéres, BAC, 2006, 2007, 2008, 3, R, Co |
| 116 F. crotonensis Kitton, BAC, 2006, 2007, 2, R, Co |
| 117 Frustulia vulgaris (Thwaites) De Toni, BAC, 2006, 2013, 2, R, Co |
| 118 Fusola viridis Snow, CHL, 2007, 2019, 2, R, Co |
| 119 Glenodiniopsis steinii Woloszynska, DIN, 2007, 1, R, Am |
| 120 Gloeocapsopsis cyanea (Krieger) Komárek et Anagnostidis, CYA, 2006, 2007, 2009, 2013, 2015, 2016, 2017, 2019, 8, C, Re |
| 121 Golenkinia radiata Chodat, CHL, 2006, 2010, 2018, 2019, 4, R, Co |
| 122 Gomphonella olivacea (Hornemann) Rabenhorst, BAC, 2006, 2009, 2011, 2018, 4, R, Co |
| 123 Gomphonema acuminatum Ehrenberg, BAC, 2006, 2007, 2008, 2019, 4, R, Co |
| 124 G. affine Kützing, BAC, 2006, 2007, 2008, 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2016, 2019, 12, C, Co |
| 125 G. clevei Fricke, BAC, 2006, 2007, 2008, 2011, 2013, 2015, 2017, 2019, 8, C, Co |
| 126 G. gracile Ehrenberg, BAC, 2006, 2007, 2009, 2011, 2012, 5, F, Co |
| 127 G. minutum (C. Agardh) C. Agardh, BAC, 2006, 2007, 2008, 2016, 2017, 2019, 6, F, Re |
| 128 G. parvulum (Kützing) Kützing, BAC, 2006, 2007, 2009, 2012, 2013, 5, F, Co |
| 129 G. pseudoaugur Lange-Bertalot, BAC, 2009, 1, R, Re |
| 130 G. pumillum (Grunow) Reichardt et Lange-Bertalot, BAC, 2006, 2007, 2008, 2010, 4, R, Re |
| 131 G. truncatum Ehrenberg, BAC, 2006, 2007, 2014, 3, R, Co |
| 132 Gomphosphenia grovei var. lingulatum (Hustedt) Lange-Bertalot, BAC, 2009, 1, R, Re |
| 133 Gomphosphenia grovei (M. Schmidt) Lange-Bertalot, BAC, 2006, 2007, 2, R, Re |
| 134 Halamphora coffeiformis (Agardh) Levkov, BAC, 2006, 2007, 2011, 2012, 2013, 2014, 2016, 2017, 8, C, Co |
| 135 H. montana (Krasske) Levkov, BAC, 2006, 2007, 2009, 2013, 2015, 5, F, Co |
| 136 H. perpusilla (Grunow) You et Kociolek, BAC, 2006, 2007, 2009, 2014, 2015, 2016, 6, F, Co |
| 137 H. veneta (Kützing) Levkov, BAC, 2006, 2007, 2008, 2010, 2011, 2012, 2014, 2015, 2016, 2018, 2019, 11, C, Co |
| 138 Hannea arcus (Ehrenberg) Patrick, BAC, 2006, 2007, 2, R, Co |
| 139 Hantzschia amphioxys (Ehrenberg) Grunow, BAC, 2006, 2007, 2013, 3, R, Co |
| 140 Heteroleibleinia aquae-dulcis (Skuja) Anagnostidis, CYA, 2012, 2014, 2, R, Re |
| 141 Humidophila contenta (Grunow) Lowe et al., BAC, 2006, 2007, 2, R, Re |
| 142 Hydrodictyon reticulatum (Linneaus) Bory, CHL, 2007, 1, R, Co |
| 143 Jaaginema geminatum (Meneghini ex Gomont) Anagnostidis et Komárek, CYA, 2007, 2008, 2009, 2010, 4, R, Co |
| 144 J. subtilissimum (Kützing ex Forti) Anagnostidis et Komárek, CYA, 2006, 2017, 2, R, Re |
| 145 Keratococcus bicaudatus (A. Braun ex Rabenhorst) J. Petersen, CHL, 2015, 1, R, Co |
| 146 Kirchneriella dianae (Bohlin) Comas, CHL, 2008, 2017, 2, R, Am |
| 147 K. obesa (W. West) G.S. West et W. West, CHL, 2018, 1, R, Co |
| 148 Klebsormidium subtile (Kützing) Mikhailyuk et al., CHA, 2006, 2007, 2008, 3, R, Co |
| 149 Komvophoron schmidle (Jagg) Anagnostidis et Komárek, CYA, 2009, 1, R, Re |
| 150 Korschpalmella mucosa (Korshikov) Hindák, CHL, 2013, 2014, 2017, 3, R, Re, NR |
| 151 Lagerheimia balatonica (Scherffel) Hindák, CHL, 2006, 2007, 2013, 2014, 2016, 2017, 2019, 7, F, Am |
| 152 L. ciliata (Lagerheim) Chodat, CHL, 2006, 2007, 2013, 2015, 4, R, Co |
| 153 L. longiseta var. major G.M. Smith, CHL, 2009, 2011, 2017, 3, R, Am |
| 154 L. subsalsa Lemmermann, CHL, 2013, 1, R, Am |
| 155 Leibleinia epiphytica (Hieronymus) Compère, CYA, 2012, 2019, 2, R, Re |
| 156 Lemnicola exigua (Grunow) Kulikovskiy et al., BAC, 2006, 2007, 2008, 2011, 2014, 5, F, Co |
| 157 L. hungarica (Grunow) Round et Basson, BAC, 2006, 2007, 2008, 2016, 4, R, Co |
| 158 Lepocinclis globulus Perty, EUG, 2006, 1, R, Am |
| 159 L. spirogyroides Marin et Melkonian, EUG, 2006, 1, R, Am |
| 160 L. tripteris (Dujardin) Marin et Melkonian, EUG, 2011, 2012, 2, R, Co |
| 161 Leptolyngbya tenuis (Gomont) Anagnostidis et Komárek, CYA, 2006, 2007, 2, R, Co |
| 162 Limnothrix redekei (Goor) Meffert, CYA, 2006, 2007, 2008, 3, R, Am |
| 163 Melosira varians C.A. Agardh, BAC, 2006, 2007, 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2018, 2019, 11, C, Co |
| 164 Messastrum gracile (Reinsch) García 2016, CHL, 2006, 2007, 2008, 2019, 4, R, Co |
| 165 Micractinium crassisetum Hortobágyi, CHL, 2006, 2007, 2008, 2010, 2011, 2014, 2015, 2016, 2017, 9, C, Co |
| 166 M. pusillum Hortobágyi, CHL, 2006, 2011, 2013, 2015, 2017, 2019, 6, F, Co |
| 167 Microcoleus autumnalis (Gomont) Strunecky et al., CYA, 2008, 1, R, Co |
| 168 Microcystis aeruginosa (Kützing) Kützing, CYA, 2007, 2016, 2018, 2019, 4, R, Co |
| 169 M. botrys Teiling, CYA, 2019, 1, R, Re |
| 170 M. novacekii (Komárek) Compère, CYA, 2006, 1, R, Re |
| 171 M. protocystis Crow, CYA, 2006, 2007, 2016, 2017, 4, R, Co |
| 172 M. wesenbergii (Komárek) Komárek ex Komárek, CYA, 2013, 2016, 2018, 2019, 4, R, Co |
| 173 Monactinus simplex (Meyen) Corda, CHL, 2006, 2007, 2008, 3, R, Co |
| 174 M. simplex var. echinulatum (Wittrock) Pérez et al., CHL, 2006, 2007, 2, R, Co |
| 175 Monomorphina pyrum (Ehrenberg) Mereschkowsky, EUG, 2006, 1, R, Co |
| 176 Monoraphidium contortum (Thuret) Komarková-Legenerová, CHL, 2013, 2014, 2015, 2016, 2017, 2019, 6, F, Co |
| 177 M. griffithii (Berkeley) Komárková-Legnerová, CHL, 2010, 2012, 2018, 2019, 4, R, Co |
| 178 Mucidosphaerium pulchellum (Wood) Bock et al., CHL, 2007, 2017, 2, R, Co |
| 179 Navicula capitatoradiata Germain, BAC, 2006, 2007, 2, R, Co |
| 180 N. cryptocephala Kützing, BAC, 2006, 2007, 2008, 3, R, Co |
| 181 N. cryptotenella Lange-Bertalot, BAC, 2006, 2007, 2008, 2014, 2019, 5, F, Co |
| 182 N. radiosa Kützing, BAC, 2006, 2007, 2, R, Co |
| 183 N. subrhynchocephala Hustedt, BAC, 2006, 2007, 2009, 3, R, Co |
| 184 N. trivialis Lange-Bertalot, BAC, 2006, 2007, 2008, 3, R, Co |
| 185 Nitzschia amphibia Grunow, BAC, 2006, 2007, 2014, 2018, 4, R, Co |
| 186 N. angusteforaminata Lange-Bertalot, BAC, 2007, 1, R, Co |
| 187 N. clausii Hantzsch, BAC, 2006, 2007, 2, R, Co |
| 188 N. communis Rabenhorst, BAC, 2006, 2007, 2010, 2016, 4, R, Co |
| 189 N. dissipata (Kützing) Rabenhorst, BAC, 2006, 2007, 2008, 2014, 2019, 5, F, Co |
| 190 N. frustulum (Kützing) Grunow, BAC, 2006, 2007, 2008, 2013, 4, R, Co |
| 191 N. inconspicua Grunow, BAC, 2006, 2007, 2010, 2014, 4, R, Co |
| 192 N. linearis W. Smith, BAC, 2006, 2010, 2, R, Co |
| 193 N. palea (Kützing) W. Smith, BAC, 2006, 2008, 2012, 2018, 4, R, Co |
| 194 Nostoc microscopicum Carmichael ex Bornet et Flahault, CYA, 2006, 2007, 2015, 2016, 4, R, Co |
| 195 Oocystis borgei Snow, CHL, 2019, 1, R, Co |
| 196 O. lacustris Chodat, CHL, 2012, 2019, 2, R, Co |
| 197 O. marssonii Lemmermann, CHL, 2006, 2007, 2014, 2015, 2016, 2017, 6, F, Am |
| 198 O. tainoensis Komárek, CHL, 2006, 2007, 2, R, Am |
| 199 Ophiocytium arbusculum (A. Braun ex Kützing) Sande Lacoste et Suringar, HET, 2007, 1, R, Co |
| 200 Pandorina charkowiensis Korshikoff, CHL, 2006, 2007, 2009, 2010, 2011, 2014, 2015, 2016, 2017, 2019, 10, C, Am |
| 201 P. morum (O.F. Müller) Bory, CHL, 2006, 2007, 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2016, 2017, 2018, 2019, 13, C, Co |
| 202 Pantocsekiella ocellata (Pantocsek) Kiss et Ács, BAC, 2007, 2008, 2013, 3, R, Co |
| 203 Pectinodesmus javanensis (Chodat) Hegewald, Bock et Krienitz, CHL, 2019, 1, R, Co |
| 204 P. pectinatus (Meyen) Hegewald et al., CHL, 2009, 2014, 2016, 2017, 4, R, Co |
| 205 Pediastrum boryanum var. brevicorne A. Braun (ahora Pseudopediastrum brevicorne (A. Braun) Jena et Bock), CHL, 2006, 2007, 2008, 2009, 2013, 2014, 2016, 7, F, Co |
| 206 P. simplex var. clathratum Schröter, CHL, 2013, 1, R, Am |
| 207 Phacus longicauda (Ehrenberg) Dujardin, EUG, 2006, 2007, 2, R, Co |
| 208 P. pseudoswirenkoi Prescott, EUG, 2006, 2007, 2, R, Am |
| 209 P. triqueter (Ehrenberg) Perty, EUG, 2006, 2007, 2013, 2014, 4, R, Co |
| 210 Phaeophila endophyta (Möbius) Nielsen, CHL, 2006, 2009, 2, R, Re |
| 211 Phormidium aerugineo-coeruleum (Kützing ex Gomont) Anagnostidis et Komárek, CYA, 2006, 2007, 2013, 2015, 4, R, Co |
| 212 P. kuetzingianum (Kirchner) Anagnostidis et Komárek, CYA, 2006, 2007, 2008, 3, R, Re |
| 213 P. taylorii (Drouet et Strickland) Anagnostidis, CYA, 2006, 2007, 2, R, Am |
| 214 P. tergestinum (Kützing) Anagnositidis et Komárek, CYA, 2006, 2007, 2008, 2009, 2010, 2011, 2012, 2019, 8, C, Co |
| 215 Pinnularia acrosphaeria W. Smith, BAC, 2006, 2007, 2008, 2010, 2019, 5, F, Co |
| 216 P. tropica Hustedt, BAC, 2006, 2007, 2008, 2012, 4, R, Co |
| 217 Planktosphaeria gelatinosa G.M. Smith, CHL, 2006, 2017, 2, R, Co |
| 218 Planktothrix agardhii (Gomont) Anagnostidis et Komárek, CYA, 2006, 2007, 2008, 2009, 2010, 2012, 2016, 2017, 8, C, Co |
| 219 Planothidium lanceolatum (Brébisson ex Kützing) Lange-Bertalot, BAC, 2006, 2007, 2012, 2013, 4, R, Co |
| 220 Platessa conspicua (Mayer) Lange Bertalot, BAC, 2006, 2007, 2, R, Co |
| 221 Pleurocapsa minor Hansgirg emend. Geitler, CYA, 2013, 2016, 2017, 3, R, Co |
| 222 Porphyrosiphon martensianus (Meneghini ex Gomont) Anagnostidis et Komárek, CYA, 2006, 2007, 2008, 2009, 2010, 2012, 2013, 2014, 2015, 2016, 2019, 11, C, Co |
| 223 Psamothidium chlidanos (Hohn et Hellerman) Lange-Bertalot, BAC, 2006, 2007, 2019, 3, R, Re |
| 224 Pseudanabaena catenata Lauterborn, CYA, 2007, 2012, 2, R, Co |
| 225 P. moniliformis Komárek et Kling, CYA, 2007, 2008, 2009, 2010, 2011, 2013, 2014, 2015, 2016, 2017, 2019, 11, C, Re |
| 226 P. mucicola (Naumann et Huber-Pestalozzi) Schwabe, CYA, 2019, 1, R, Am |
| 227 Pseudopediastrum boryanum (Turpin) Hegewald, CHL, 2006, 2007, 2011, 2013, 2014, 2018, 2019, 7, F, Co |
| 228 P. boryanum var. longicorne (Reinsch) Tsarenko, CHL, 2006, 2012, 2019, 3, R, Co |
| 229 Pseudoperanema trichophorum (Ehrenberg) Larsen, EUG, 2006, 1, R, Re, NR |
| 230 Pteromonas aculeata Lemmermann, CHL, 2006, 2009, 2012, 2014, 2015, 2016, 2018, 2019, 8, C, Am |
| 231 P. angulosa Chodat, CHL, 2006, 2007, 2008, 2012, 2018, 5, F, Co |
| 232 P. golenkiniana Pascher, CHL, 2006, 2013, 2, R, Re |
| 233 Quadrigula closterioides (Bohlin) Printz, CHL, 2006, 2007, 2008, 2010, 2013, 2016, 2017, 7, F, Co |
| 234 Rhizoclonium hieroglyphium (C. Agardh) Kützing, CHL, 2006, 2007, 2008, 2009, 2010, 2011, 2013, 2014, 2015, 2016, 10, C, Co |
| 235 Rhoicosphenia abbreviata (Agardh) Lange-Bertalot, BAC, 2006, 2007, 2008, 2012, 4, R, Co |
| 236 Rhopalodia gibba (Ehrenberg) O.F. Müller, BAC, 2006, 2007, 2008, 3, R, Co |
| 237 R. gibberula (Ehrenberg) O.F. Müller, BAC, 2006, 2007, 2008, 2009, 2010, 2011, 2012, 2013, 2014, 2015, 2016, 2017, 2019, 13, C, Co |
| 238 Scenedesmus similagineus Hortobágyi, CHL, 2006, 2019, 2, R, Re |
| 239 Schroederia setigera (Schröder) Lemmermann, CHL, 2008, 1, R, Co |
| 240 Scytonema schmidtii Gomont, CYA, 2007, 2009, 2011, 2013, 2014, 2015, 2016, 2017, 2019, 9, C, Co |
| 241 Sellaphora laevissima (Kützing) D.G. Mann, BAC, 2006, 2007, 2008, 3, R, Co |
| 242 S. pupula (Kützing) Mereschkowsky, BAC, 2006, 2007, 2008, 3, R, Co |
| 243 Snowella lacustris (Chodat) Komárek et Hindák, CYA, 2006, 2008, 2016, 3, R, Co |
| 244 Staurosira construens Ehrenberg, BAC, 2006, 2007, 2008, 2011, 2012, 2014, 2015, 2019, 8, C, Co |
| 245 S. venter (Ehrenberg) Cleve et Möller, BAC, 2006, 2011, 2012, 2015, 2018, 2019, 6, F, Co |
| 246 Staurosirella pinnata (Ehrenberg) D.M. Williams et Round, BAC, 2006, 2007, 2, R, Co |
| 247 S. pinnata var. trigona (Brun et Héribaud-Joseph) Aboal et P.C. Silva, BAC, 2007, 1, R, Re |
| 248 Steinedesmus graevenitzii (C. Bernard) Comas et Komárek, CHL, 2014, 2016, 2019, 3, R, Re, NR |
| 249 Stephanodiscus hantzschii Grunow, BAC, 2008, 2009, 2010, 2015, 2016, 2017, 6, F, Co |
| 250 Stichococcus bacillaris Nägeli, CHL, 2006, 2007, 2008, 2019, 4, R, Co |
| 251 Stigeoclonium tenue (C. Agardh) Kützing, CHL, 2006, 2007, 2, R, Co |
| 252 Surirella brebissonii Krammer et Lange-Bertalot, BAC, 2006, 2007, 2010, 2012, 2013, 5, F, Co |
| 253 S. brightwellii W. Smith, BAC, 2008, 2013, 2, R, Am |
| 254 Synura petersenii Korschikoff, HET, 2006, 2007, 2008, 3, R, Co |
| 255 Terpsinoe música Ehrenberg, BAC, 2006, 2007, 2016, 2017, 4, R, Co |
| 256 Tetradesmus incrassatulus (Bohlin) Wynne, CHL, 2009, 1, R, Co |
| 257 T. lagerheimii Wynne et Guiry, CHL, 2006, 2007, 2009, 2011, 2016, 2018, 2019, 7, F, Co |
| 258 T. obliquus (Turpin) Wynne, CHL, 2009, 2012, 2013, 2018, 2019, 5, F, Co |
| 259 Tetraedron caudatum (Corda) Hansgirg, CHL, 2016, 2018, 2, R, Co |
| 260 Trachelomonas allia Drezepolski, EUG, 2006, 2007, 2019, 3, R, Co |
| 261 Tryblionella debilis Arnott, BAC, 2006, 2007, 2008, 2013, 4, R, Co |
| 262 T. hungarica (Grunow) Frenguelli, BAC, 2006, 2009, 2010, 2013, 2015, 2016, 6, F, Co |
| 263 Tyrannodinium edax (Schilling) Calado, DIN, 2019, 1, R, Re |
| 264 Ulnaria acus (Kützing) Aboal, BAC, 2007, 2011, 2012, 3, R, Co |
| 265 U. delicatissima var. angustissima (Grunow) Aboal et P.C. Silva, BAC, 2006, 2007, 2008, 2010, 2011, 2012, 2013, 2014, 2015, 2016, 2019, 11, C, Am |
| 266 U. ulna (Nitzsch) Compère, BAC, 2006, 2007, 2008, 2011, 2018, 5, F, Co |
| 267 Ulothrix tenerrima (Kützing) Kützing, CHL, 2006, 2013, 2, R, Co |
| 268 Vitreochlamys gloeosphaera (Pascher et Jahoda) Massjuk, CHL, 2006, 2007, 2008, 2009, 2010, 2011, 2012, 2013, 2016, 2017, 10, C, Re |
| 260 Xenococcus bicudoi Montejano et al., CYA, 2013, 1, R, Re |
| 270 X. lamellosus Gold-Morgan et al., CYA, 2006, 2007, 2012, 2015, 4, R, Re |
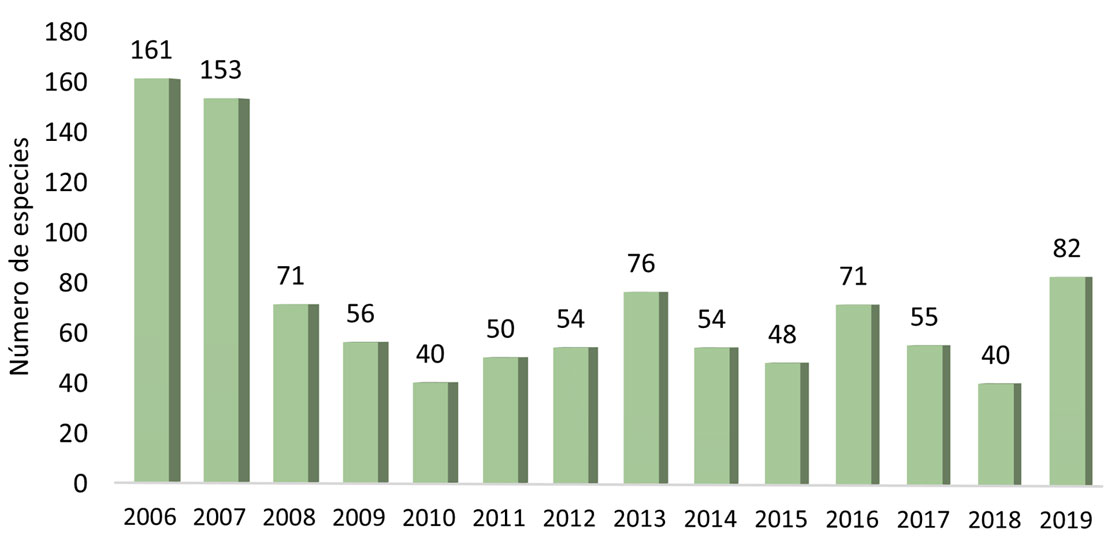
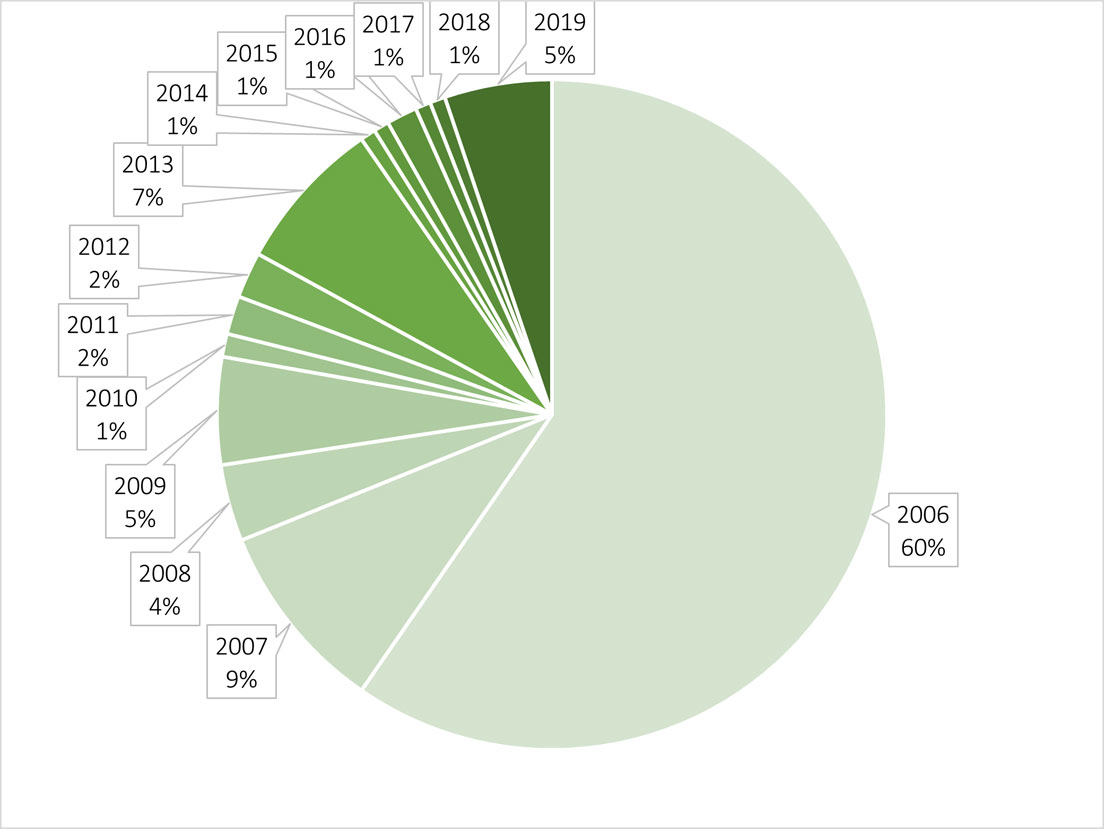
Durante los 14 años estudiados, la ficoflora registró 56 especies en promedio; en particular, los años con mayor riqueza fueron 2006, 2007 y 2019, con 161, 153 y 82 especies, respectivamente. Para el periodo 2008 al 2018, la riqueza registró entre 76 y 40 especies. Estas diferencias podrían atribuirse al esfuerzo de muestreo de recolecciones anuales, pues en los años con más riqueza se hicieron recolecciones mensuales, aunque solo en 2019 se hizo durante todo el año. El resto de los años fueron recolecciones semestrales, a inicio y mediados de año. Podríamos considerar al promedio de especies (56) como el núcleo principal de la flora (fig. 8).
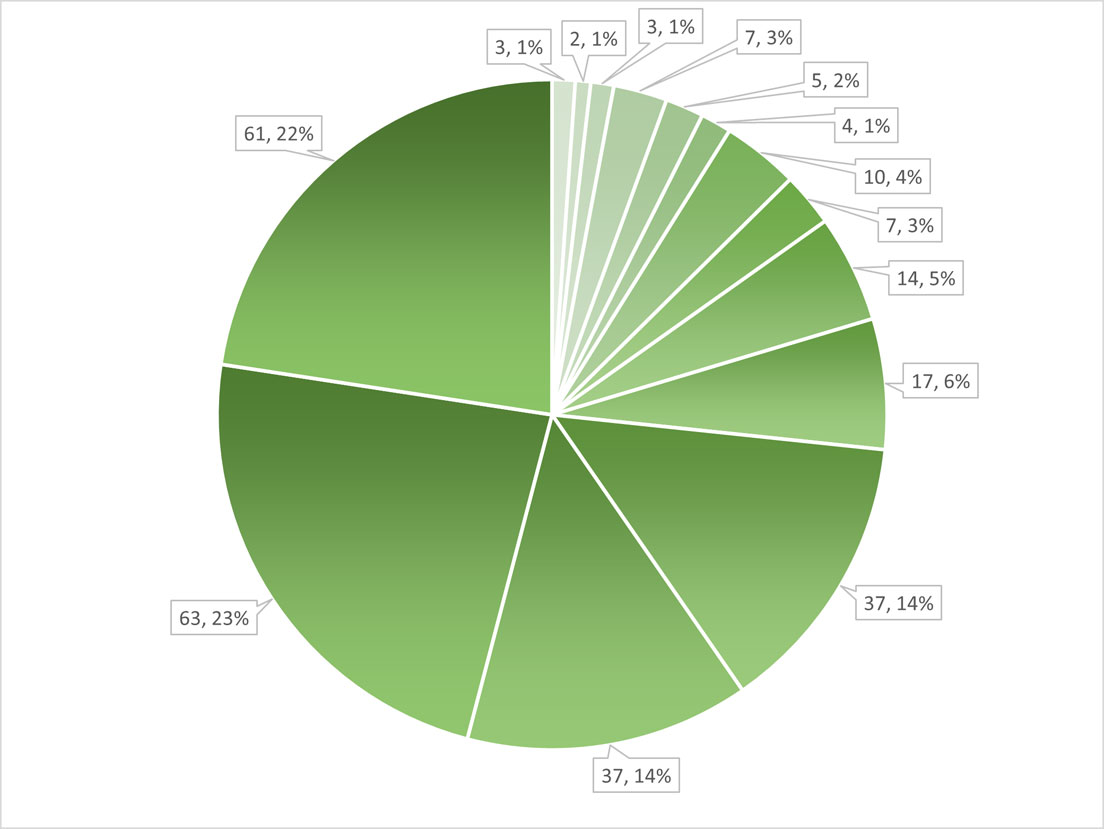
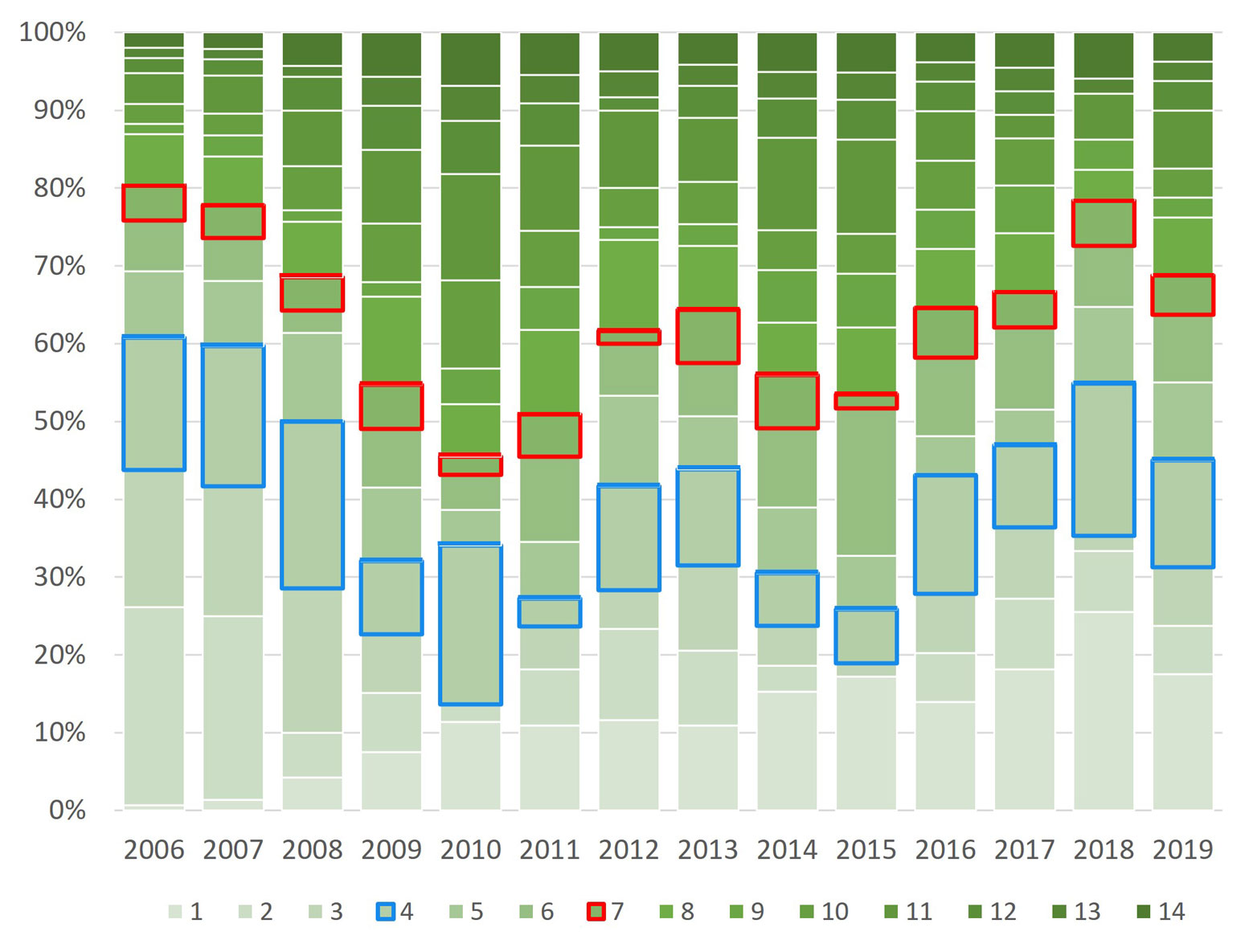
Al analizar la frecuencia de presencia de las especies, la riqueza anual y total, confieren una mejor visión de la composición de la flora mencionada arriba. La mayor proporción de la riqueza total solo fue encontrada en 1 o 2 ocasiones y solo 3 especies estuvieron presentes durante todo el periodo y 2 durante 13 años (figs. 9, 10). Es decir, 60% de la riqueza total solo apareció 1 a 3 veces en 14 años, 26% se mantuvo durante 4 a 6 veces. Mientras que solo 40 especies (15%) estuvieron presentes en 7 a 14 años.
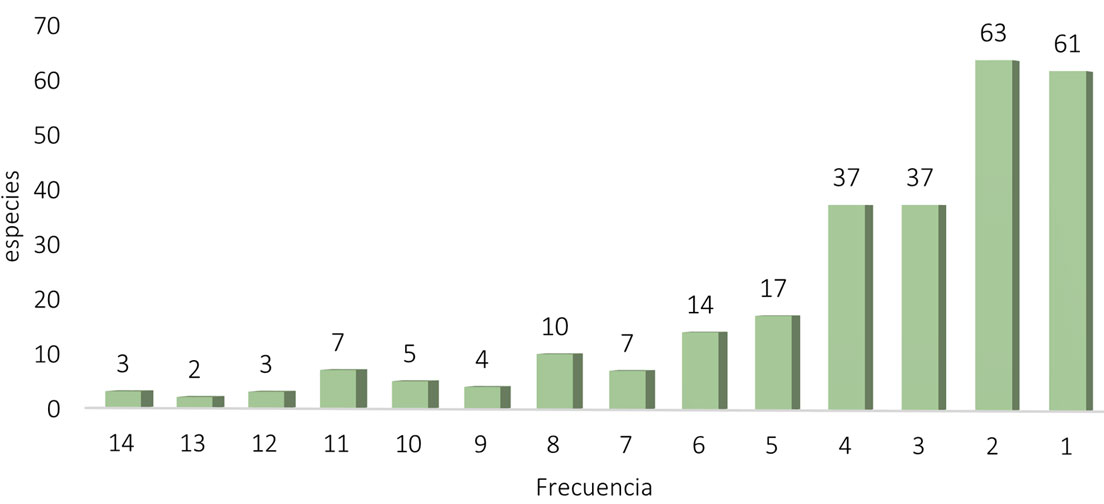
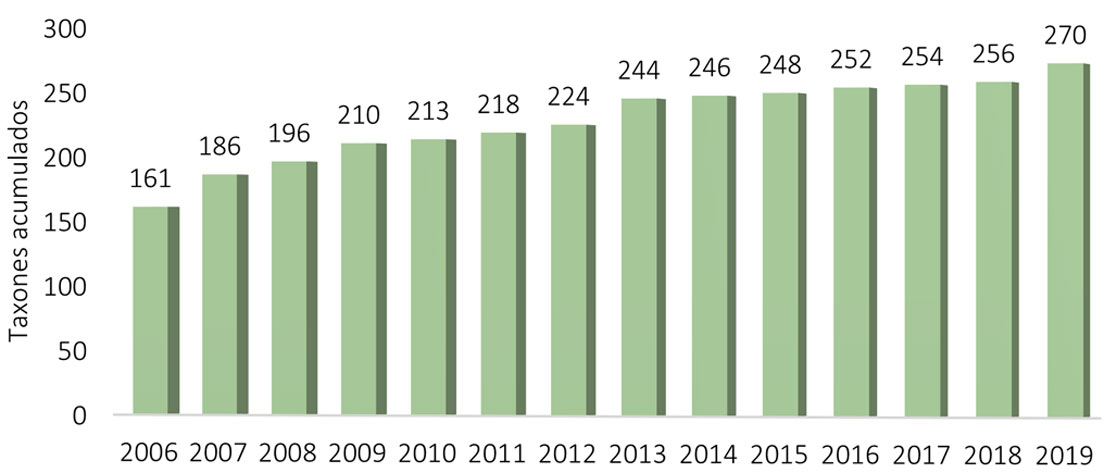
Sin embargo, esas 40 especies se presentaron de forma discontinua y eso lo podemos ver en una gráfica de especies acumuladas. Después de los 2 primeros años, aparecieron de 2 a 20 especies cada año en la Cantera (tabla 5, figs. 11, 12). Como puede verse, 69% de las especies aparecieron en los 2 primeros años, pero si se compara con la distribución de frecuencias, resulta que muy pocas especies estuvieron presentes más de 3 años, el resto no tuvo la frecuencia suficiente como para caracterizar la Cantera de forma constante. Otra forma de visualizar esta distribución es con la contribución de frecuencias de especies en cada año, en la figura 13 se presenta la contribución en cada año, de especies con frecuencias de 4 a 7. El gradiente de color indica desde una mayor contribución de especies, a especies presentes solo una vez. En esta figura se pueden observar 2 elementos, los años con menor riqueza son los que presentaron, proporcionalmente, especies más frecuentes, mientras que en los años con más especies, sus frecuencias fueron menores, es decir, esos años comparten menos especies. Si 60% de la flora total solo se presentó de 1 a 3 veces y 25% de 4 a 6 veces, tendríamos que caracterizar la Cantera con 15% de la flora (con frecuencias de 7 a 14). Sin embargo, de las 8 especies más frecuentes (Cylindrospermum majus, Gomphonema affine, Pandorina morum, Rhopalodia gibberula, Aulacoseira granulata, Desmodesmus magnus y D. maximus), 7 son especies de distribución amplia y consideradas como eurioicas. Mientras que Cyanocystis pseudoxenococcoides se ha registrado en condiciones contrastantes en el Ártico, las islas Guadalupe y México según AlgaeBase y bdLACET (Guiry y Guiry, 2022; Novelo y Tavera, 2022); es decir, esta especie parece tener una capacidad de respuesta muy amplia a las condiciones ambientales. En cuanto a las 32 especies presentes, de 7 a 11 veces solo Vitreochlamys gloeosphaera es una especie poco conocida en México, pero registrada frecuentemente en Europa y el Medio Oriente, según AlgaeBase (Guiry y Guiry, 2022), el resto son especies de muy amplia distribución geográfica, frecuentes en varios tipos de ambientes y en condiciones muy diversas.
En cambio, en el sector de las especies poco frecuentes (162 especies), hay una mezcla de tipos de especies tanto de distribución amplia como restringida, hay especies poco conocidas y algunas no registradas para México. Es un grupo heterogéneo que no permite reunirlo bajo alguna categoría geográfica o ambiental.
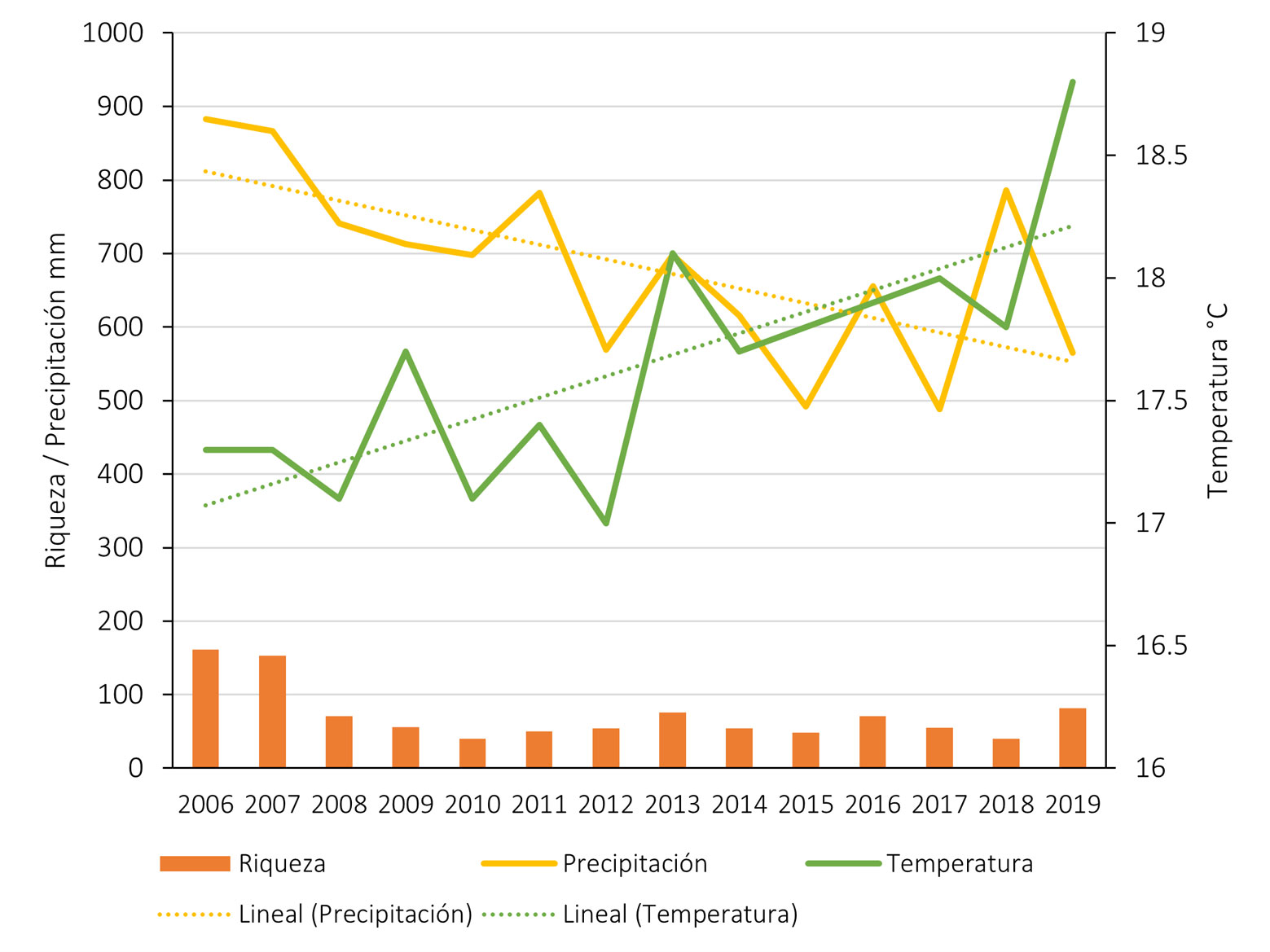
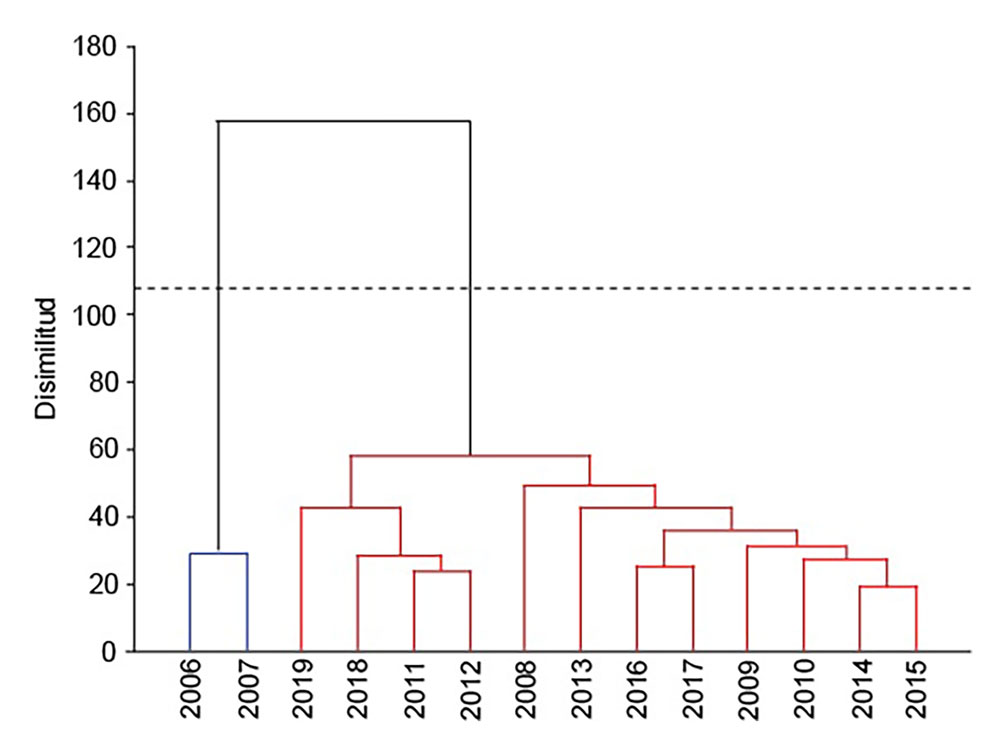
Esas diferencias entre los años podrían estar más relacionados con los cambios climáticos más generales que con los cambios de condiciones del agua. La temperatura del agua, el pH y la conductividad no muestran cambios drásticos de un año a otro, aunque sí una tendencia a un aumento gradual en las 3 variables. Parece que el aumento en la precipitación anual coincide con un aumento en el número de especies más que el aumento de temperatura (por ejemplo, en los años 2013, 2016 y 2018, fig. 14). Los datos de riqueza no son de un cambio constante como para asociarlos a los cambios en las condiciones del agua. Más bien siguen un patrón irregular muy similar a los datos climáticos. Si la química del agua no puede explicar los cambios y los de tipo climático son poco definitivos, quizá la composición específica de cada año podría explicar mejor los cambios en el periodo. Para ello hicimos un análisis de disimilitud considerando la frecuencia de aparición de las especies. Este análisis mostró solo 2 grupos, aun con las diferencias en el esfuerzo de muestreo: los años 2006-2007 y el resto. De este último, la distancia euclídea nos muestra que solo 3 pares de años consecutivos se parecen (2011-2012, 2014-2015, 2016-2017) y con una disimilitud evidente en la clase en la que cada par fue agrupado por el análisis (fig.15).
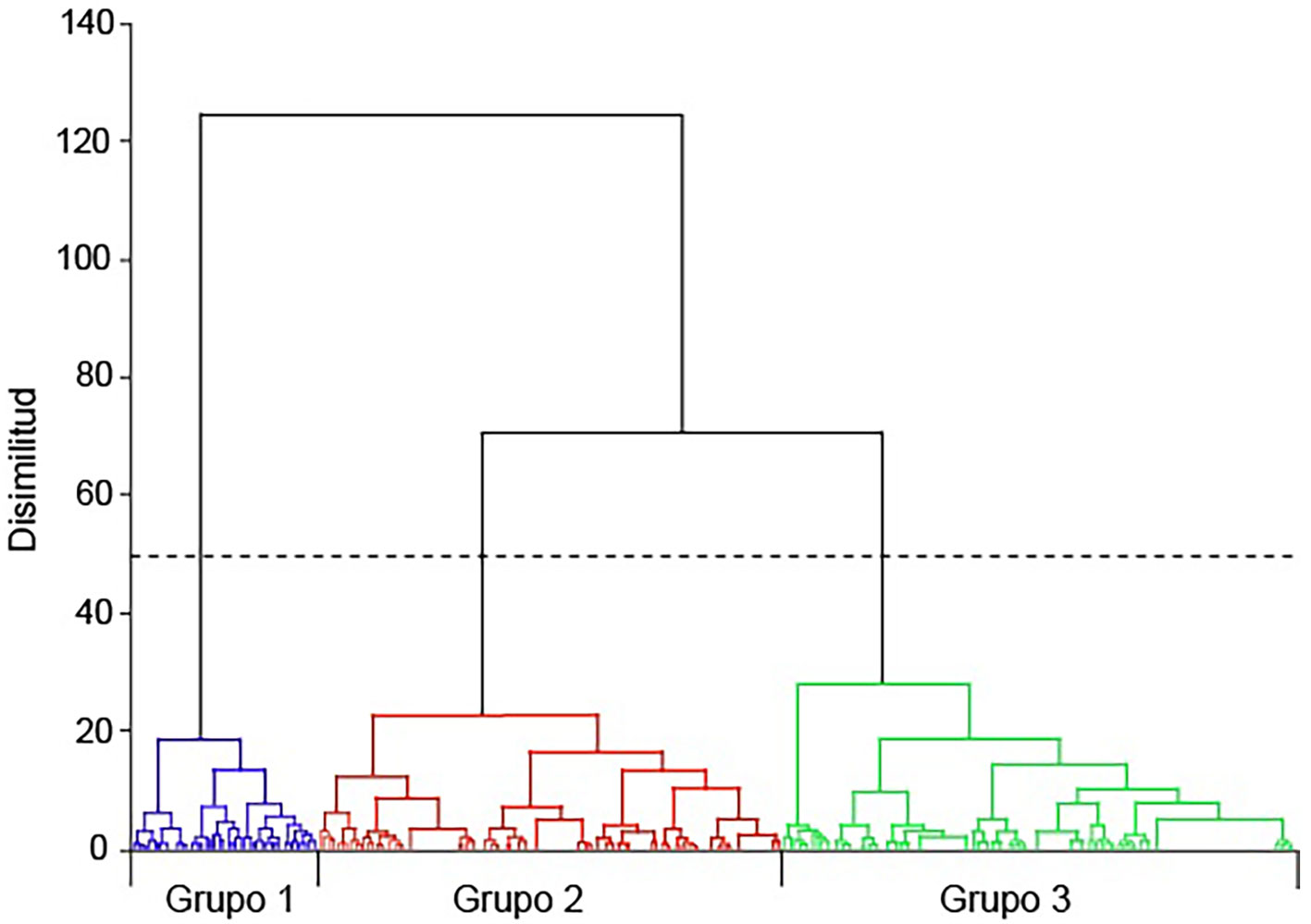
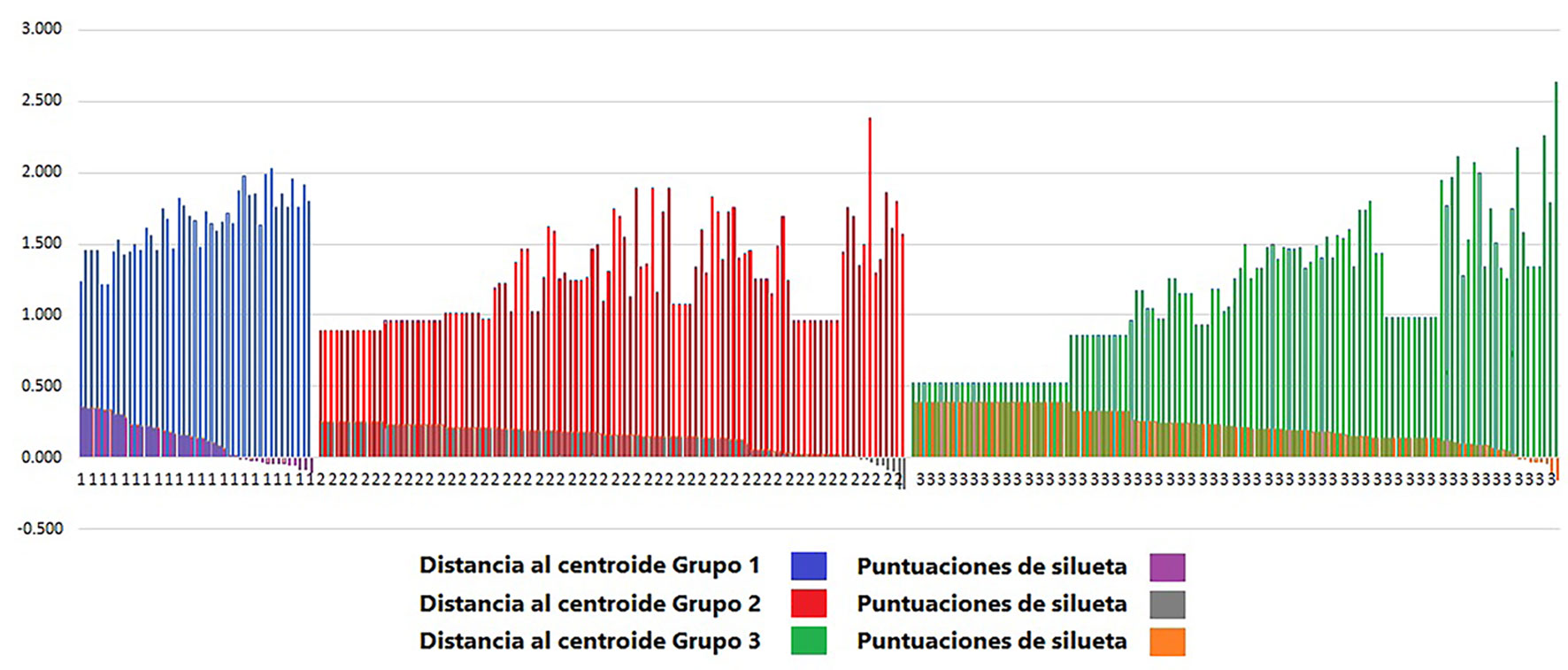
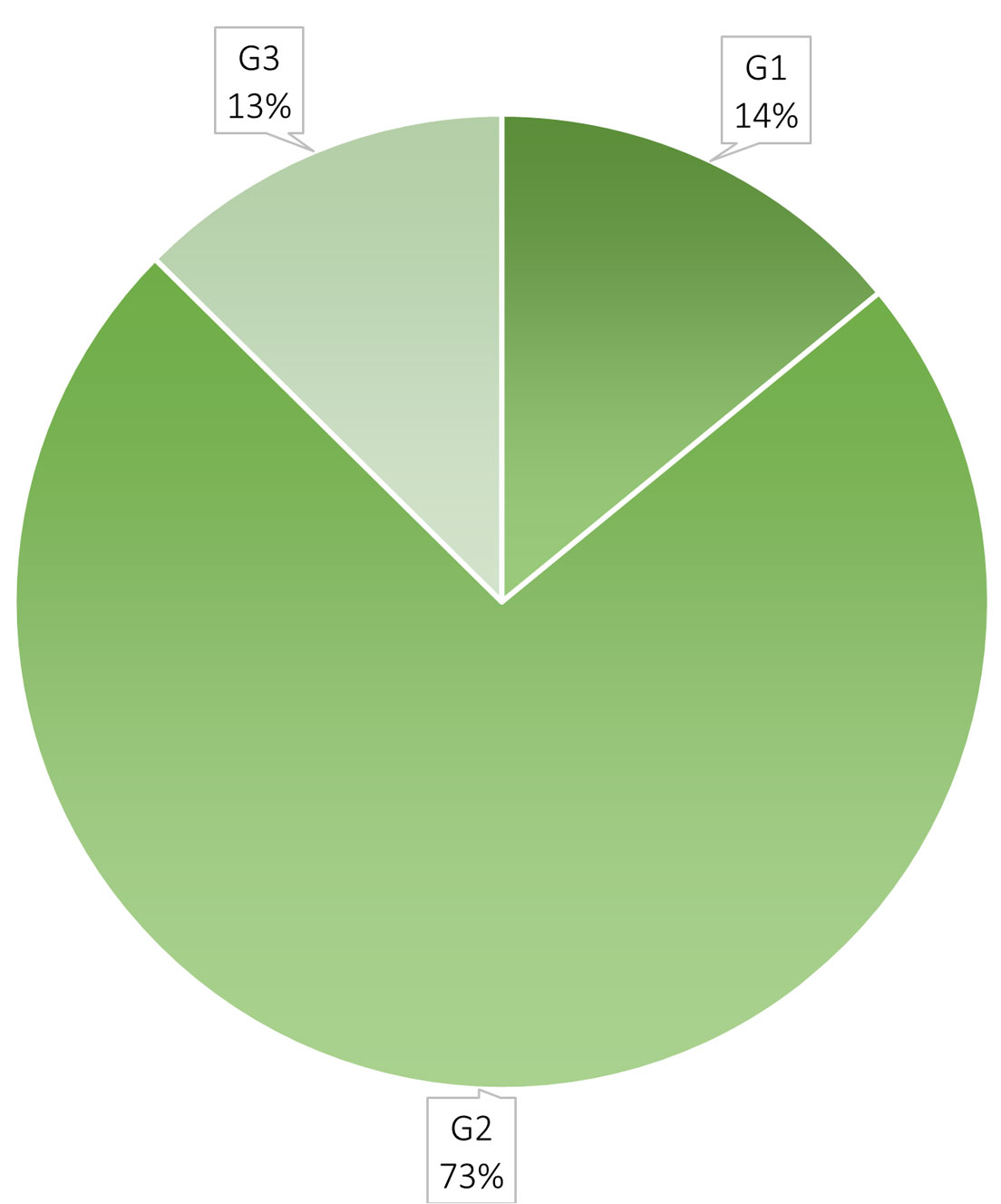
Si evaluamos la presencia de las especies en el periodo tenemos agrupaciones mucho más complejas (fig. 16). Para explicarlas, presentamos en la tabla 6 los números reunidos por el análisis en cada clase (grupo) con la numeración de las especies de la tabla 4. Al observar las disimilitudes de las agrupaciones de las especies, en el dendrograma de la figura 16 se muestran 3 grupos, el grupo 1 incluye las especies con alta frecuencia (> 7), mientras el grupo 2 reúne especies con baja frecuencia (< 5) y, finalmente, el grupo 3 contiene a las especies con frecuencia intermedia (5-7). Los traslapes podrían explicarse por la presencia según el año, sin embargo, no hubo ninguna diferencia entre los años para la mayor parte de estudio (agrupación por año, fig. 15). Las puntuaciones de silueta (fig. 17) indican si la ubicación dentro de un grupo es o no la correcta, dependiendo de la cercanía con respecto a 1.0 del valor de la puntuación. En la gráfica se aprecia que las puntuaciones de silueta más altas (más cercanas a 1.0) se corresponden con el grupo 3, le sigue el grupo 2 y al final el grupo 1, el más heterogéneo (artificial) de los 3. Esto significa que las especies reunidas en el grupo 1 no necesariamente están agrupadas por su frecuencia sino por su presencia en determinados años. Dado que la mayoría de las especies tienen una frecuencia baja, la diferencia entre los años no es notable y no permite identificar un patrón de distribución temporal. Esto se refleja en un valor de inercia entre los grupos muy bajo (< 30%). A partir de este resultado del análisis, podríamos calificar las frecuencias de la siguiente manera: Raras son las que estuvieron presentes de 1 a 4 veces, frecuentes aquellas cuya presencia fue de 5 a 7 veces y constantes las que estuvieron de 8 a 14 veces en el periodo. Los porcentajes mostrados en la figura 10 podrían agruparse como aparece en la figura 18. Y el número de especies de acuerdo con su tipo, según la tabla 6 es: 198 especies son raras, 38 especies son frecuentes y 34 especies son constantes. La distribución de las presencias en el periodo parece que mantiene a un grupo de 15 especies, aunque no siempre estén presentes. De ese grupo (Amphora copulata, Halamphora veneta, Melosira varians, Porphyrosiphon martensianus, Ulnaria delicatissima var. angustissima, Cocconeis placentula var. placentula, Pseudanabaena moniliformis), solo la última es poco frecuente en México y con una distribución geográfica limitada pues ha sido registrada en el lago de Chalco (Martell-Ortiz, 2019), también AlgaeBase indica que existe en el lago Victoria en África y en Brasil (Guiry y Guiry, 2022).
Tabla 5
Número de especies determinadas en 2006 y nuevos registros de cada año en la Cantera Oriente, REPSA – UNAM.
| Año | Especies distintas |
| 2006 | 161 |
| 2007 | 25 |
| 2008 | 10 |
| 2009 | 14 |
| 2010 | 3 |
| 2011 | 5 |
| 2012 | 6 |
| 2013 | 20 |
| 2014 | 2 |
| 2015 | 2 |
| 2016 | 4 |
| 2017 | 2 |
| 2018 | 2 |
| 2019 | 14 |
Un muestreo semestral durante 14 años no mostró tendencias en la composición de la flora algal. A diferencia de lo registrado para el lago Atezca en el que fueron notables los cambios en un periodo de 10 años (Díaz-Pardo et al., 1998), con una predominancia de clorofíceas en los primeros años y de cyanoprokaryotas en los últimos, con una gran abundancia de Microcystis aeruginosa, especie ocasional en la Cantera Oriente. En este sitio, la incorporación de especies cada año y su inconstancia durante el periodo no puede explicarse con los datos ambientales con los que se cuenta. Los registros de especies asociados a condiciones ambientales en la literatura de la Cantera Oriente son los que aquí aparecen como especies frecuentes y constantes o sin una referencia clara (Ceballos-Ramírez, 2016; Cuevas-Madrid et al., 2020; Ponce-Márquez y de la Lanza, 2019) (tabla 7).
Tabla 6
Especies distribuidas por grupos de disimilitud según el método de Ward. Los números dentro de cada grupo corresponden a la numeración de las especies de la tabla 4.
| Resultados por grupo: | |||
| Grupo | 1 | 2 | 3 |
| Número de especies por grupo | 43 | 108 | 119 |
| Varianza dentro de cada grupo | 2.808 | 1.677 | 1.503 |
| Distancia mínima al centroide | 1.211 | 0.885 | 0.524 |
| Distancia media al centroide | 1.644 | 1.249 | 1.126 |
| Distancia máxima al centroide | 2.029 | 2.381 | 2.634 |
| Especies: | 1, 2, | 4, 7, | 5, 8, |
| 3, 6, | 9, 10, | 16, 20, | |
| 17, 50, | 10, 11, | 25, 27, | |
| 52, 54, | 12, 13, | 29, 30, | |
| 55, 63, | 14, 15, | 33, 37, | |
| 67, 70, | 18, 19, | 41, 45, | |
| 74, 81, | 21, 22, | 46, 47, | |
| 84, 86, | 23, 24, | 48, 49, | |
| 87, 89, | 26, 28, | 51, 62, | |
| 120, 124, | 31, 32, | 69, 71, | |
| 125, 134, | 34, 35, | 73, 75, | |
| 136, 137, | 36, 38, | 77, 82, | |
| 151, 165, | 39, 40, | 88, 90, | |
| 166, 176, | 42, 43, | 101, 103, | |
| 197, 200, | 44, 53, | 105, 106, | |
| 201, 205, | 56, 57, | 107, 108, | |
| 218, 222, | 58, 59, | 110, 111, | |
| 225, 233, | 60, 61, | 113, 114, | |
| 234, 237, | 64, 65, | 115, 116, | |
| 240, 244, | 66, 68, | 117, 118, | |
| 249, 265, | 72, 76, | 119, 123, | |
| 268 | 78, 79, | 126, 127, | |
| 80, 83, | 128, 130, | ||
| 85, 91, | 131, 132, | ||
| Tabla 6. Continúa | |||
| Resultados por grupo: | |||
| 92, 93, | 135, 138, | ||
| 94, 95, | 139, 141, | ||
| 96, 97, | 142, 143, | ||
| 98, 99, | 148, 152, | ||
| 100, 102, | 156, 157, | ||
| 104, 109, | 160, 161, | ||
| 112, 121, | 162, 163, | ||
| 122, 129, | 164, 171, | ||
| 133, 140, | 173, 174, | ||
| 144, 145, | 179, 180, | ||
| 146, 147, | 181, 182, | ||
| 149, 150, | 183, 184, | ||
| 153, 154, | 185, 186, | ||
| 155, 158, | 187, 188, | ||
| 159, 167, | 189, 190, | ||
| 168, 169, | 191, 193, | ||
| 170, 172, | 194, 198, | ||
| 175, 177, | 199, 207, | ||
| 178, 192, | 208, 209, | ||
| 195, 196, | 211, 212, | ||
| 202, 203, | 213, 214, | ||
| 204, 206, | 215, 216, | ||
| 210, 217, | 219, 220, | ||
| 221, 226, | 223, 224, | ||
| 228, 229, | 227, 231, | ||
| 230, 238, | 232, 235, | ||
| 239, 243, | 236, 241, | ||
| 248, 253, | 242, 245, | ||
| 256, 258, | 246, 247, | ||
| 259, 263, | 250, 251, | ||
| 269 | 252, 254, | ||
| 255, 257, | |||
| 260, 261, | |||
| 262, 264, | |||
| 266, 267, | |||
| 270 |
Tabla 7
Variables ambientales promedio. Fuente bibliográfica: (1) Ceballos-Ramírez (2016); (2) Cuevas-Madrid et al. (2020); (3) Hernández-Martínez et al. (2007); (4) Novelo et al. (2007); (5) Ponce-Márquez y de la Lanza (2019). ND = No disponible.
| 1 | 2 | 3 | 4 | 5 | |
| Alcalinidad total mg/L | ND | ND | 77.5 | ND | ND |
| Amonio | ND | 0.05 mg/L | 2.0 µmol | 0.37 mg/L | 16.5 µmol |
| Conductividad µS/cm | ND | 400 | 328.9 | ND | 464 |
| Dureza Ca | 1.32 ppm | 24.5 mg/L | 34.9 mg/L | 0.32 ppm | ND |
| Dureza Mg | 0.99 ppm | 13.5 mg/L | ND | 1.59 ppm | ND |
| Dureza total mg/L | ND | ND | ND | ND | 119 |
| Fosfatos mg/L | 2.05 | 0.09 | ND | ND | ND |
| P reactivo disuelto nM | ND | ND | 22.1 | ND | ND |
| P total | ND | 0.19 mg/L | 43.9 µmol | 2.16 mg/L | 88.5 µmol |
| Nitratos | 5.25 mg/L | 5.85 mg/L | 33.6 µmol | 5.5 mg/L | ND |
| Nitritos | 1.17 mg/L | 0.09 mg/L | 0.1 µmol | 0.06 mg/L | 0.5 µmol |
| Nitrógeno total | ND | 8.85 mg/L | 67.9 µmol | ND | ND |
| pH (unidades) | 8.2 | 8.1 | 7.5 | ND | 8.0 |
| Potasio soluble mg/L | ND | ND | 4.5 | ND | ND |
| Sílice (SiO2) mg/L | 28.8 | ND | ND | 26.6 | 37.0 |
| Sodio soluble mg/L | ND | ND | 25.1 | ND | ND |
| Temperatura °C | 15.1 | 17.6 | 17.3 | 18.7 | ND |
| Transparencia cm | ND | 74.5 | 71.0 | ND | ND |
Como puede verse en los datos de la tabla 7, a falta de una evaluación de poblaciones y densidad, las explicaciones de presencia y sobre todo de desaparición no pueden asociarse a ningún cambio significativo en la química del agua a través del tiempo.
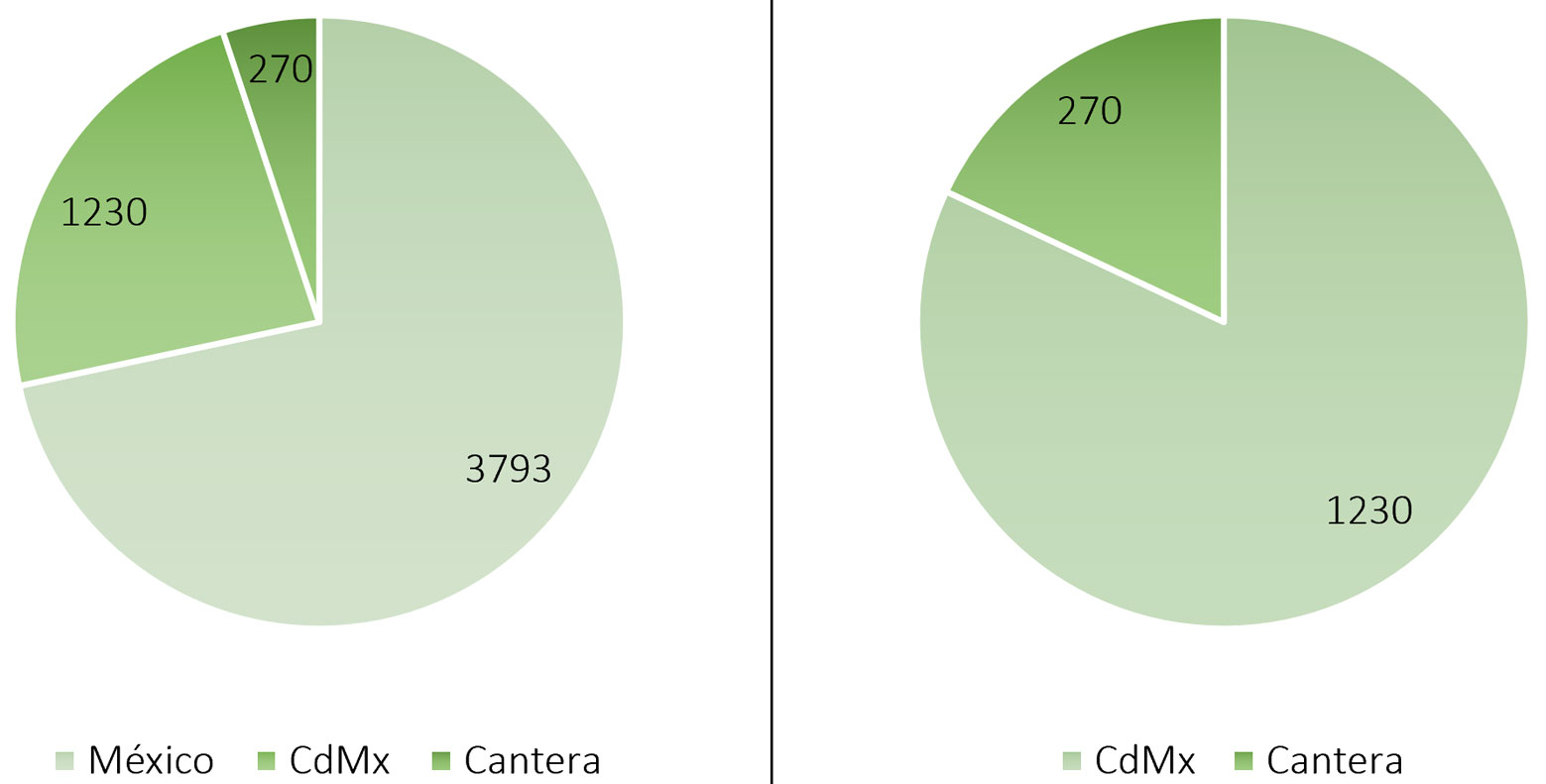
La importancia de la flora de la Cantera Oriente reside no solo en su condición cambiante, sino en el aporte a la ficoflora nacional. En México se han registrado 3,793 taxones de algas continentales (Novelo y Tavera, 2022), de ésos, 1,230 corresponden a la Ciudad de México. De las 270 especies registradas en Cantera, 159 cuentan con al menos una ilustración y solo 32 con una descripción, aunque están descritas e ilustradas en publicaciones de otras partes del país. Estos números equivalen a una contribución de 5% de la flora nacional y a una de 22% de la Ciudad de México (fig. 19).
La evaluación de la biodiversidad de algas de la Cantera Oriente también tiene un componente biogeográfico que tiene relación con la dispersión efectiva de las especies llamadas cosmopolitas a lo largo del periodo estudiado. De los 270 nombres de este trabajo y utilizando los datos de bdLACET (Novelo y Tavera, 2022), 203 nombres (75%) pueden ser considerados como cosmopolitas (encontradas en 2 o más continentes); 29 (11%) como de distribución amplia (solo en América) y 38 (14%) de distribución restringida (solo en México, hasta ahora). Como en la mayoría de los casos, el registro en las floras indica frecuencia y no recurrencia o abundancia, es difícil comparar la presencia ocasional entre floras. La mayoría de los datos disponibles son de tipo anecdótico o se afilia la presencia a una condición ambiental (especies “eutróficas”, “alcalífilas”, etc.) a partir de los datos de alguna recolección (mensual o menos frecuente). En el caso de las especies frecuentes, es posible que se subestime la variación morfológica que puede enmascarar especies crípticas o que no se haga una determinación más cuidadosa que con las novedades. Además, en las especies que incluyen varios sinónimos es posible subestimar toda la variación presente en una distribución geográfica amplia.
¿Por qué las especies cosmopolitas se presentan en la Cantera Oriente como raras, si su distribución geográfica podría entenderse como una amplia capacidad de respuesta a diferentes condiciones ambientales? Es posible que esa capacidad se confunda con la eficacia en la dispersión y con la respuesta diferencial a todas las variables ambientales. Una distribución geográfica de tipo cosmopolita no es una posible explicación de la presencia o frecuencia recurrente en un sitio en particular; como en la Cantera Oriente, las especies se desarrollan por un conjunto de condiciones muy diversas, en los que los factores fisicoquímicos del agua, climáticos y sobre todo la presencia de otras especies participan permanente y activamente durante periodos mucho más largos que los estacionales o anuales. Como bien dicen Sharma y Rai (2011): “Sin embargo, bajo la limitación de dispersión y la heterogeneidad ambiental, la diversidad global de microalgas será mucho mayor debido a factores ambientales locales que promueven especies endémicas.” ¿Podremos seguir hablando de una flora característica de la Cantera Oriente? parece que no.
Agradecimientos
A Guadalupe Vidal por el mantenimiento de cultivos, el procesamiento, la curación de muestras y de preparaciones semipermanentes. A la Secretaría Ejecutiva de la REPSA, en especial a Antonio Lot, a Luis Zambrano y a Francisco Martínez por su apoyo con los permisos y la logística durante las recolecciones. A los dos revisores por sus cuidadosos comentarios y correcciones que mejoraron este artículo.
Referencias
Castillo-Argüero, S., Martínez-Orea, Y., Romero-Romero, M. A., Guadarrama-Chávez, P., Núñez-Castillo, O., Sánchez-Gallén, I. et al. (2007). La reserva ecológica del Pedregal de San Ángel. Aspectos florísticos y ecológicos. Cd. de México: Coordinación de la Investigación Científica, Universidad Nacional Autónoma de México.
Ceballos-Ramírez, A. D. (2016). Estudio florístico ficológico anual de la Cantera Oriente de la Reserva Ecológica del Pedregal de San Angel (REPSA) (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México, Cd. de México.
Comas-González, A. (1996). Las Chlorococcales dulceacuícolas de Cuba, Vol. 99. Berlin – Stuttgart: J. Cramer.
Cortés-López, E. (2011). El género Pteromonas (Chlorophyta, Volvocales) en cuerpos de agua urbanos de la Ciudad
de México (Tesis). Universidad Nacional Autónoma de México, Cd. de México.
Cuevas-Madrid, H., Lugo-Vázquez, A., Peralta-Soriano, L., Morlán-Mejía, J., Vilaclara-Fatjo, G., Sánchez-Rodríguez, M. R. et al. (2020). Identification of key factors affecting the trophic state of four tropical small water bodies. Water, 12, 1454. https://doi.org/10.3390/w12051454
Díaz-Pardo, E., Vázquez, G. y López-López, E. (1998). The phytoplankton community as a bioindicator of health conditions of Atezca Lake, Mexico. Aquatic Ecosystems Health and Mangement, 1, 257 – 266. https://doi.org/10.1016/S1463-4988(98)00025-6
Ettl, H. (1983). Chlorophyta I. Phytomonadina. En H. Ettl, J. Gerloff, H. Heynig y D. Mollenhauer (Eds.), Süßwasserflora von Mitteleuropa, Band 9. Sttutgart: Gustav Fischer Verlag.
González-González, J. y Novelo, E. (1986). Algas. En A. Lot y F. Chiang (Eds.), Manual de Herbario. Administración y manejo de colecciones, técnicas de recolección y preparación de ejemplares botánicos (pp. 47–54). México D.F.: Consejo Nacional de Flora de México. https://doi.org/10.13140/2.1.1888.2884
Guiry, M. D. y Guiry, G. M. (2022). AlgaeBase. World-wide electronic publication. Consultado 27 de septiembre de 2022: http://www.algaebase.org
Hauer, T. y Komárek, J. (2022). CyanoDB.cz 2.0. On-line database of cyanobacterial genera. Word-wide electronic publication, University of South Bohemia e Institute of Experimental Botany of the Czech Academy of Sciences. Consultado el 27 de septiembre de 2022 de: http://www.cyanodb.cz
Hernández-Martínez, Ó., Quiroz-Flores, A., Ramírez-García, P. y Lot, A. (2007). Paisaje lacustre: ecología de la vegetación acuática. En A. Lot (Ed.), Guía ilustrada de la Cantera Oriente. Caracterización ambiental e inventario biológico (pp. 45–59). Secretaría Ejecutiva de la Reserva Ecológica del Pedregal de San Ángel. Cd. de México: Coordinación de la Investigación Científica, Universidad Nacional Autónoma de México.
Hindák, F. (1988). Studies on the Chlorococcal algae (Chlorophyceae) IV (Vol. 34/1-2). Bratislava: Veda Pub, House of the Slovak Academy of Sciences.
Isais-López, N. M. (2019). Diversidad de especies del género Chlamydomonas de la Cantera Oriente y evaluación de su crecimiento bajo diferentes condiciones de cultivo (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Cd. de México.
Komárek. J., Kaštovský, J., Mareš, J. y Johansen, J. R. (2014). Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach. Preslia, 86, 295–335.
Lot, A. (2007). La Cantera Oriente: a manera de introducción. En A. Lot (Ed.), Guía ilustrada de la Cantera Oriente. Caracterización ambiental e inventario biológico (pp. 7–11). Cd. de México: Secretaría Ejecutiva de la Reserva Ecológica del Pedregal de San Ángel, Coordinación de la Investigación Científica, Universidad Nacional Autónoma de México.
Lot, A. y Cano-Santana, Z. (Eds.). (2009). Biodiversidad del ecosistema del Pedregal de San Angel. Libro conmemorativo del 25 aniversario de la Reserva Ecológica de Ciudad Universitaria (1983-2008). Cd. de México: Universidad Nacional Autónoma de México.
Maceda-Ramírez, C. R. (2017). Cianoprocariontes asociadas a clorofitas filamentosas y macrófitas en ambientes lóticos de la Cantera Oriente, Ciudad de México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Cd. de México.
Maceda, R., Tavera, R. y Novelo, E. (2017). Ecología de cianoprocariontes epífitas que habitan ambientes lóticos de la Cantera Oriente, Ciudad de México. Hidrobiológica, 27, 327–336.
Martell-Ortiz, C. I. (2019). Composición florística del fitoplancton del Lago de Chalco, Ciudad de México, México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Cd. de México.
Medlin, L. K. y Kaczmarska, I. (2004). Evolution of the Diatoms. V. Morphological and cytological support for the major clades and taxonomic revision. Phycologia, 43, 245–270. https://doi.org/10.2216/i0031-8884-43-3-245.1
Molina-López, J. J. y García-Herrero, J. (2006). Técnicas de análisis de datos. Universidad de Jaén. Recuperado el 30 de mayo de 2022 de: http://matema.ujaen.es/jnavas/web_recursos/archivos/weka%20master%20recursos%20naturales/apuntesAD.pdf
Novelo, E. (1998). Floras ficológicas del Valle de Tehuacán, Puebla (Tesis doctoral). Facultad de Ciencias, Universidad Nacional Autónoma de México. México, D.F.
Novelo, E., Ponce, E., Ramírez, R. y Ramírez, M. (2007). Algas. En A. Lot (Ed.), Guía ilustrada de la Cantera Oriente. Caracterización ambiental e inventario biológico (pp. 63–95). Cd. de México: Secretaría Ejecutiva de la Reserva Ecológica del Pedregal de San Ángel, Coordinación de la Investigación Científica, Universidad Nacional Autónoma de México. Disponible en: https://ru.ameyalli.dgdc.unam.mx/handle/123456789/231
Novelo, E., Ponce, M. E. y Ramírez, R. (2009). Las microalgas de la Cantera Oriente. En A. Lot y Z. Cano-Santana (Eds.), Biodiversidad del ecosistema del Pedregal de San Ángel. Libro conmemorativo del 25 aniversario de la Reserva Ecológica de Ciudad Universitaria (1983-2008) (pp. 71–79). Cd. de México: Universidad Nacional Autónoma de México. Disponible en: https://ru.ameyalli.dgdc.unam.mx/handle/123456789/230
Novelo, E. y Tavera, R. (2022). bdLACET. Un buscador de algas pensado para ficólogos y no tan ficólogos. Consultado el 27 de septiembre de 2022: https://bdlacet.mx/
Ponce-Márquez, M. E. y de la Lanza-Espino, G. (2019). Phytoplanktonic composition and indicative species of water quality in high artificial ponds at Mexico city. International Journal of Hydrology, 3, 345–349. https://doi.org/10.15406/ijh.2019.03.00198
Round, F. E., Crawford, R. M. y Mann, D. G. (2000). The diatoms: biology and morphology of the genera. Cambridge: Cambridge University Press.
Sharma, N. K. y Rai, A. K. (2011). Biodiversity and biogeography of microalgae: progress and pitfalls. Environmental Reviews, 19, 1–15. https://doi.org/10.1139/A10-020
SMN (Servicio Metereológico Nacional). Comisión Nacional del Agua. Climatología / Información Climatológica/ Información Estadística / Climatológica. Estación meteorológica 9020 en Tlalpan, Ciudad de México. Consultado el 27 de septiembre de 2022. Disponible en: https://smn.conagua.gob.mx/es/climatologia/informacion-climatologica/informa
cion-estadistica-climatologica