Maripili Ramírez-Nava, Margarita Caballero * y Diana Avendaño
Universidad Nacional Autónoma de México, Instituto de Geofísica, Laboratorio de Paleolimnología, Circuito de la Investigación s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
*Autor para correspondencia: maga@igeofisica.unam.mx (M. Caballero)
Recibido: 6 octubre 2021; aceptado: 16 marzo 2022
Resumen
Se analizaron la abundancia relativa y la variabilidad morfológica de 4 especies y 1 variedad del género Aulacoseira (Bacillariophyceae) en sedimentos lacustres provenientes de lagos con diferentes características climáticas, morfométricas, fisicoquímicas y nivel trófico. Las afinidades ecológicas se investigaron a través del método de promedios ponderados y análisis de correspondencia canónica. Los resultados señalaron al gradiente de temperatura, salinidad y de nivel trófico como las principales variables que determinan la distribución de los taxones. Las especies del género tuvieron una distribución en aguas con pH circumneutrales levemente alcalinos y salinidades bajas. Aulacoseira granulata tuvo la mayor frecuencia de presencia y tolerancia por salinidades un poco más elevadas, A. ambigua alcanzó las abundancias relativas más altas, A. nivaloides se distingue por su afinidad a agua fría, de baja salinidad y bajo nivel trófico. Aulacoseira ambigua, A. granulata y A. granulata var. angustissima se distribuyen en ambientes de agua dulce, meso-eutróficos y A. pusilla tiene una afinidad por agua más turbia y con nivel más alto de fósforo. Este estudio aporta información sobre la variabilidad biológica y distribución ecológica de las especies dentro del género en lagos del centro de México.
Palabras clave: Diatomeas centrales; Morfología; Parámetros ambientales; Ecología; Cuencas lacustres
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Morphological variability and ecological distribution
of species of the genus Aulacoseira (Bacillariophyceae) present in bodies of water in central Mexico
Abstract
Relative abundance and morphological variability of 4 species and 1 variety of the genus Aulacoseira (Bacillariophyceae) were analyzed in sediments from lakes with different climatic, morphometric, physicochemical and tropic level regimes. Canonical correspondence analysis and weighted average optima were used to identify the ecological preferences of each taxon. The results show that temperature, salinity and trophic level were the main environmental variables defining species distribution. The species of the genus Aulacoseira were present only in circumneutral-slightly alkaline localities with low salinity. Aulacoseira granulata was the most frequent taxon and had the higher salinity tolerance, A. ambigua reached the highest relative abundances, A. nivaloides stand out because of its affinity for cold waters, of very low salinity and trophic level. Aulacoseira ambigua, A. granulata, and A. granulata var. angustissima prefered freshwater, meso-eutrophic conditions and A. pusilla turbid waters with high phosphorus concentrations. This study provides information on the biological variability and distribution of the species within the genus in lakes from central Mexico.
Keywords: Central diatoms; Morphology; Environmental parameters; Ecology; Lake basins
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
El género Aulacoseira Thwaites incluye más de 122 especies (Guiry y Guiry, 2020), las cuales se encuentran ampliamente distribuidas en ambientes epicontinentales modernos, así como en el registro fósil desde el Cretácico Tardío (~100 millones de años). Entre las principales características morfológicas del género destacan la forma cilíndrica del frústulo, con un manto desarrollado y ornamentado, en donde las areolas van de redondeadas a rectangulares y pueden tener un arreglo lineal a helicoidal (Buczkó et al., 2010; Kociolek et al., 2014; Lee y Yoon, 1994). La ornamentación del manto termina en un anillo liso (collum), que internamente puede estar engrosado (ringleiste) y que frecuentemente se asocia con la presencia de protuberancias labiadas (rimoportulae). La cara valvar puede ser plana a ligeramente curvada y tiene espinas marginales que permiten la unión de valvas adyacentes, formando cadenas o filamentos, que pueden ser rectos, curvos o incluso en espiral (Krammer y Bertalot, 1991; Round et al., 1990; Tucci et al., 2006; Joh, 2010).
De acuerdo con la “Base de Datos de Algas Continentales” (bdLACET, Novelo y Tavera, 2021), para los ambientes modernos de México se han reportado 10 especies válidas del género. Estas incluyen a: A. alpigena (Grunow) Krammer, A. ambigua (Grunow) Simonsen, A. distans (Ehrenberg) Simonsen, A. granulata (Ehrenberg) Simonsen, A. italica (Ehrenberg) Simonsen, A. muzzanensis (Meister) Krammer, A. nivaloides (K.E. Camburn) J. English y M. Potapova, A. periphytica Novelo, Tavera e Ibarra, A. pusilla (Meister) Tuji y Houk, y A. valida (Grunow) Krammer, además de 3 variedades (A. granulata var. curvata Grunow, A. granulata var. angustissima (O. Müller) Simonsen, y A. italica var. tenuissima (O. Müller) Simonsen). No obstante, la amplia distribución de este género en el territorio mexicano, en términos taxonómicos y ecológicos, es todavía poco conocido, dado que hasta el momento no existe ningún trabajo enfocado a analizar la distribución ecológica de sus especies en nuestro país. Además, en muchos de los estudios donde especies del género han sido reportadas, éstas han formado parte de listados florísticos sin una documentación precisa de su abundancia y las condiciones ambientales en las que viven (e.g., pH, salinidad, dominancia iónica, nutrientes), o los detalles de su morfología necesarios para una identificación taxonómica confiable. Debido a esto existe un cierto nivel de incertidumbre taxonómica en algunos de los reportes del género, sobre todo si se considera que, durante las últimas décadas, el avance de las técnicas de microscopia electrónica ha permitido la observación de detalles en la ultraestructura de las valvas que han llevado a reconsiderar la taxonomía de algunos grupos de especies. Este es el caso, por ejemplo, del complejo de especies morfológicamente muy similares formado por: A. distans, A. nivaloides, A. pusilla y A. alpigena (Bicudo et al., 2016; Crawford y Likhoshway, 1999; Denys et al., 2003; English y Potapova, 2009; Potapova et al., 2008).
Para mejorar el conocimiento de la distribución de las especies del género Aulacoseira en México es necesario ampliar los estudios a nivel regional que documenten su caracterización taxonómica, preferencias ambientales y distribución, destacando el potencial de las especies del género para estudios de calidad del agua (Bicudo et al., 2016; Gómez et al., 1995) y en la reconstrucción de ambientes pasados. En el presente trabajo se documenta la diversidad taxonómica y la distribución de las especies de Aulacoseira a lo largo de gradientes ecológicos (e.g., pH, salinidad, dominancia iónica, nivel trófico) en ambientes lénticos del centro de México.
Materiales y métodos
En el presente estudio se incluyen datos de 46 cuerpos de agua ubicados en la Faja Volcánica Transmexicana (FVTM) (fig. 1, tabla 1). Estos sitios forman parte de la base de datos de diatomeas modernas del centro de México del Laboratorio de Paleolimnología, Instituto de Geofísica, UNAM (Avendaño et al., 2021; Caballero y Sigala, 2017). Para estos sitios se analizó el contenido de diatomeas en sedimentos superficiales de los lagos, que representan un promedio de las poblaciones presentes en el lago durante los últimos meses. También se analizaron las variables ambientales de los lagos agrupadas en diferentes categorías: a) climáticas, b) morfométricas, c) fisicoquímicas y d) de nivel trófico (tabla 2), aunque los parámetros en esta última categoría no fueron determinados en todos los sitios. La categoría de cada lago en el espectro de salinidad fue determinada de acuerdo a sus valores de solidos disueltos totales (SDT, Fritz, 2007; Klobe, 1927) y su nivel trófico se determinó con base en sus valores de clorofila a (OECD, 1982).
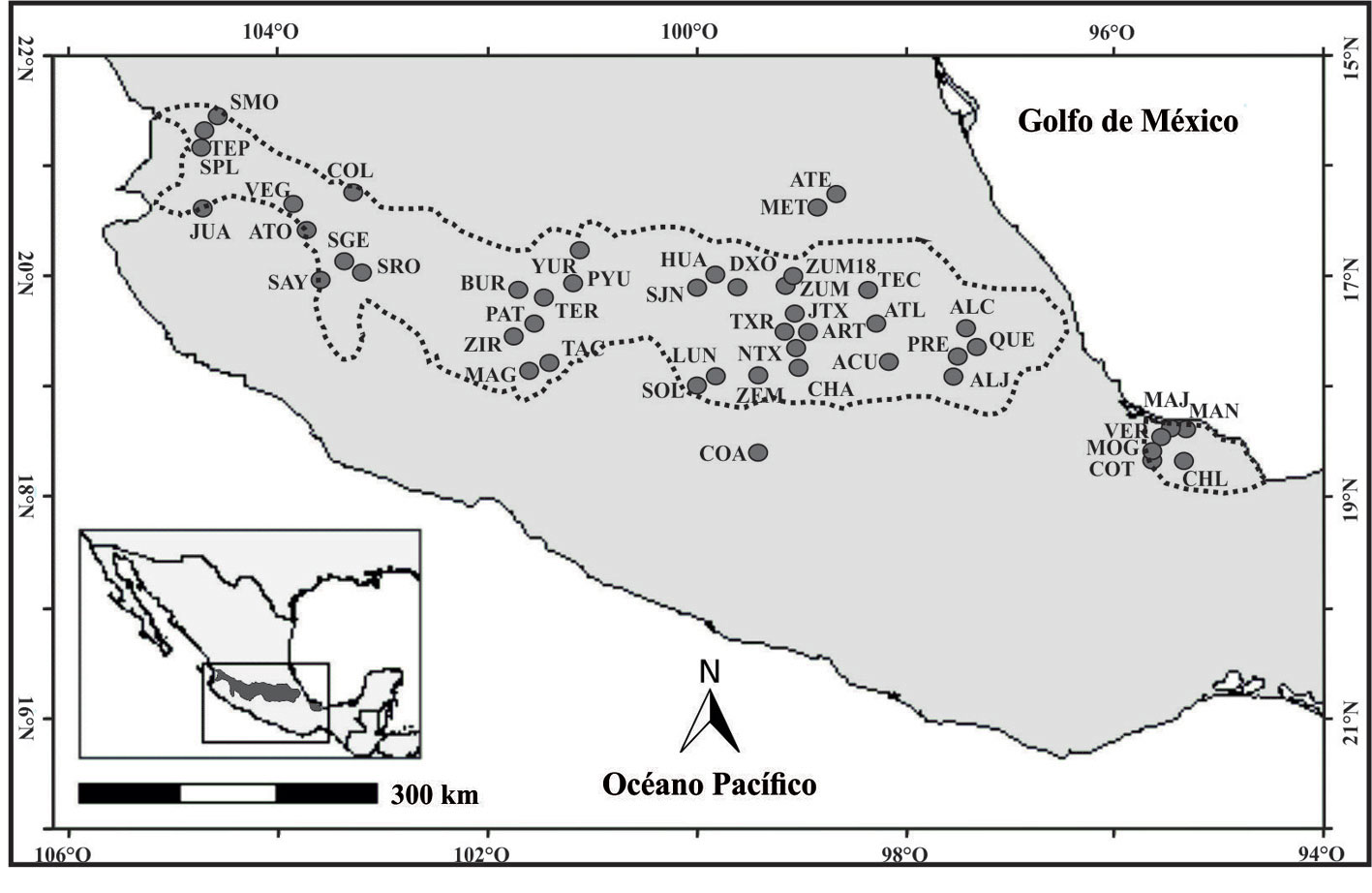
Los métodos para los análisis de diatomeas y para la determinación de las variables ambientales están detallados en publicaciones anteriores (Avendaño et al., 2021; Caballero et al., 2019; Sigala et al., 2017; Vázquez y Caballero, 2013). Las muestras de sedimento superficial fueron recolectadas con una draga de una zona profunda del cuerpo de agua. El sedimento seco (0.5 g) fue procesado con ácido clorhídrico (10%), peróxido de hidrógeno (30%), pirofosfato de sodio (10%) y ácido nítrico concentrado (70%) para eliminar carbonatos, materia orgánica y dispersar los sedimentos. Los concentrados de las muestras se utilizaron para elaborar preparaciones permanentes (2 por sitio) montadas con resina Naphrax®, en las que se realizaron conteos mínimos de entre 200 a 400 valvas en un microscopio de luz (ML) Olympus BX50 a una magnificación de 1,000 x. La identificación taxonómica de las especies se realizó mediante la consulta de bibliografía especializada (Bicudo et al., 2016; Cho, 1999; Denys et al., 2003; Dunck et al., 2012; English y Potapova, 2009; Gómez y Bauer, 2000; Gusev y Kulikovski, 2014; Joh, 2010; Krammer y Bertalot, 1991; Lange-Bertalot, 2001; Lee y Yoon, 1994; Maidana y Díaz, 2001; Pereira et al., 2013; Potapova et al., 2008; Rumrich et al., 2000; Siver y Kling, 1997; Tucci et al., 2006; Tukia y Lepistö, 1999).
Para el análisis morfológico en cada sitio se fotografiaron al azar 50 ejemplares del género Aulacoseira a una magnificación de 1,000 x en un microscopio Zeiss Axioscope. Las mediciones se realizaron utilizando el programa Zeiss-ZEN lite. Adicionalmente, se realizaron observaciones y se tomaron micrografías en un microscopio electrónico de barrido (MEB) JEOL JCM-6000 Plus Neoscope para la revisión de estructuras de importancia para la identificación taxonómica. De esta forma se construyó una base de datos que incluye 1,450 fotografías de ejemplares de Aulacoseira. Los parámetros morfológicos que se consideraron en la medición de las valvas fueron: el diámetro valvar (D), la altura del manto (A), la densidad de estrías y areolas en 10 μm y también se estimó el cociente altura / diámetro valvar (A/D). La densidad de estrías y areolas al ML fueron difíciles de medir en algunos de los especímenes debido a la fina ornamentación del manto, por lo que también se realizaron algunas mediciones de estas variables en el MEB.
Las preferencias ecológicas de las especies se analizaron graficando las abundancias relativas de cada especie contra variables ambientales selectas y calculando su óptimo de distribución por el método de promedios ponderados en la plataforma R versión 3.6 usando el paquete Optimos.Prime (Sathicq et al., 2020). Por otro lado, también se realizaron análisis de correspondencia canónica (ACC) con las abundancias relativas de las especies y las variables ambientales de los sitios en los que se encontraron ejemplares del género. Los parámetros ambientales fueron seleccionados para evitar covarianza entre ellos. Se realizó un primer ACC con un bloque de 7 variables climáticas, morfológicas y fisicoquímicas (tabla 2) de los 29 sitios en los que estuvo presente el género. Por otro lado, se realizó un segundo ACC con 5 variables de nivel trófico disponibles para 27 de los 29 sitios en los que estuvo presente el género (tabla 2). Para los ACC, las variables fisicoquímicas y de nivel trófico (salvo por el pH y la visibilidad de Secchi) fueron transformadas mediante logaritmo (log10). Estos análisis se realizaron en la plataforma R versión 3.6 usando el paquete Vegan (Oksanen et al., 2020).
Tabla 1
Código, nombre, ubicación geográfica y características principales de los 46 lagos estudiados en la FVTM (modificado de Avendaño et al., 2021).
| Código | Nombre | Latitud | Longitud | Dominancia iónica | pH | Halobion | Nivel trófico | ||||
| Aniones | Cationes | TMA
(°C) |
SDT
(mg L-1) |
Disco de Secchi
(m) |
|||||||
| ACU | Acuitlapilco, Edo. Mex. | 19°16’22” | 98°13’43” | HCO3–>>Cl– | Na+>>Mg2+-Ca2+ | 16.3 | 7.4 | 290 | Sd | Dulce | Sd |
| ALC | Alchichica, Pue. | 19°24’44” | 97°24’07” | Cl–>>CO3-2>>SO4-2 | Na+>>Mg2+ | 13.9 | 8.3 | 9,039 | 5.0 | Hiposalino | Mesotrófico |
| ALJ | Aljojuca, Pue. | 19°05’23” | 97°32’05” | HCO3–>>Cl–>SO4-2 | Na+>Mg2+>Ca2+ | 14.7 | 9.5 | 699 | 11.5 | Subsalino | Mesotrófico |
| ART | Texcoco-Artemia, Edo. Mex. | 19°31’35” | 99°00’18” | Cl– | Na+ | 16.7 | 9.5 | 28,427 | 0.1 | Mesosalino | Sd |
| ATE | Atezca, Hgo. | 20°48’22” | 98°44’47” | HCO3– | Ca2+>Mg2+>Na+ | 18.3 | 9.3 | 65 | 2.0 | Dulce | Mesotrófico |
| ATL | Atlangatepec, Tlax. | 19°33’35” | 98°10’38” | HCO3–>>SO4-2>Cl– | Na+>Ca2+>Mg2+ | 12.8 | 7.7 | 212 | 0.1 | Dulce | Eutrófico |
| ATO | Atotonilco, Jal. | 20°23’57” | 103°39’55” | HCO3–>Cl–>>SO4-2 | Na+ | 20.5 | 9.6 | 3,905 | 0.1 | Hiposalino | Mesotrófico |
| BUR | Burro, Mich. | 19°50’07” | 101°30’09” | HCO3–>>Cl– | Na+>Mg2+>Ca2+ | 16.2 | 6.9 | 21 | 0.3 | Dulce | Eutrófico |
| CHA | Chalco, Cd. Mx. | 19°15’36” | 98°58’26” | HCO3–>SO4-2>>Cl– | Na+>>Mg2+>Ca2+ | 16.8 | 9.2 | 1,890 | 0.4 | Subsalino | Sd |
| CHL | Chalchoapan, Ver. | 18°24’58” | 95°08’03” | HCO3–>>Cl– | Mg2+>Ca2+– Na+ | 23.4 | 7.4 | 60 | 0.9 | Dulce | Mesotrófico |
| COA | Coatetelco, Mor. | 18°44’ 43” | 99°20’06” | HCO3–>>SO4-2 | Na+>Mg2+-Ca2+ | 23.6 | 8.3 | 262 | 0.9 | Dulce | Sd |
| COL | Colorada, Jal. | 20°45’56” | 103°58’49” | HCO3–>SO4-2 | Ca2+>Mg2+> Na+ | 19.2 | 7.8 | 469 | 0.6 | Dulce | Hipertrófico |
| COT | Colorada, Ver. | 18°31’21” | 95°23’54” | Cl->>CO3-2 | Na+>Mg2+>Ca2+ | 24.8 | 9.1 | 164 | 0.6 | Dulce | Hipertrófico |
| DXO | Danxhó, Edo. Mex. | 19°53’14” | 99°33’47” | HCO3–>>SO4-2-Cl– | Ca2+-Mg2+> Na+ | 14.8 | 7.2 | 99 | 0.8 | Dulce | Mesotrófico |
| HUA | La Huaracha, Edo. Mex. | 19°57’09” | 99°41’07” | HCO3–>Cl–-SO4 | Mg>Ca2+– Na+ | 13.2 | 8.4 | 67 | 0.3 | Dulce | Hipertrófico |
| JTX | Texcoco-Jalapango, Edo. Mex. | 19°31’05” | 98°57’28” | SO4-2>HCO3–>>Cl– | Na+>>Mg2+ | 16.7 | 9.1 | 1,505 | 0.1 | Subsalino | Sd |
| JUA | Juanacatlán, Jal. | 20°37’37” | 104°44’20” | HCO3–>>SO4-2 | Ca2+> Mg2+> Na+ | 19.7 | 9.2 | 86 | 6.1 | Dulce | Mesotrófico |
| LUN | La Luna, Edo. Mex. | 19°06’24” | 99°45’09” | HCO3–>>SO4-2>Cl– | Ca+2>>Na+>>Mg2+ | 3.9 | 6.3 | 20 | 10.0 | Dulce | Ultraoligotrófico |
| MAG | La Magdalena, Mich. | 19°12’30” | 101°28’22” | HCO3–>>Cl–>SO4-2 | Ca2+>Mg2+>Na+ | 19.1 | 8.8 | 85 | 0.5 | Dulce | Hipertrófico |
| MAJ | Majahual, Ver. | 18°39’27” | 95°18’29” | HCO3–>Cl– | Mg2+-Na+-Ca2+ | 25.7 | 7.1 | 131 | 3.8 | Dulce | Mesotrófico |
| MAN | Manantiales, Ver. | 18°39’43” | 95°14’18” | HCO3–>Cl– | Na+>Mg2+-Ca2+ | 25.7 | 7.4 | 110 | 2.1 | Dulce | Mesotrófico |
| MET | Metztitlán, Hgo. | 20°40’53” | 98°51’56” | HCO3–>>SO4-2>>Cl– | Ca2+> Na+>Mg2+ | 20.7 | 8.9 | 310 | 0.2 | Dulce | Eutrófico |
| MOG | Mogo Tuxtlas, Ver. | 18°33’51” | 95°21’39” | HCO3–>Cl– | Ca2+– Na+>Mg2+ | 24.8 | 8.3 | 164 | 0.6 | Dulce | Hipertrófico |
| NTX | Texcoco-Nabor Carrillo, Edo.Mex. | 19°27’54” | 98°57’38” | Cl–>>HCO3– | Na+>>Mg2+-Ca2+ | 15.6 | 9.6 | 3,746 | 0.1 | Hiposalino | Hipertrófico |
| Tabla 1. Continúa | |||||||||||
| Código | Nombre | Latitud | Longitud | Dominancia iónica | pH | Halobion | Nivel trófico | ||||
| Aniones | Cationes | TMA
(°C) |
SDT
(mg L-1) |
Disco de Secchi
(m) |
|||||||
| PAT | Pátzcuaro, Mich. | 19°33’18” | 101°38’17” | HCO3–>>Cl–>SO4-2 | Na+>>Mg2+>Ca2+ | 16.8 | 8.2 | 647 | 0.2 | Subsalino | Hipertrófico |
| PRE | La Preciosa, Pue. | 19°22’24” | 97°23’07” | HCO3–>Cl–>>SO4-2 | Mg2+> Na+ | 13.9 | 9.3 | 1,333 | 4.6 | Subsalino | Oligotrófico |
| PYU | Piscina de Yuriria, Gto. | 20°12’12” | 101°07’38” | HCO3->Cl–> SO4-2 | Na+>> Mg2+-Ca2+ | 19.2 | 9.4 | 1,118 | 0.3 | Subsalino | Eutrófico |
| QUE | Quechulac, Pue. | 19°22’28” | 97°21’06” | HCO3->>Cl– | Mg2+>Na+>>Ca2+ | 13.9 | 9.0 | 439 | 4.2 | Dulce | Oligotrófico |
| SAY | Sayula, Jal. | 19°57’04” | 103°36’33” | HCO3–>Cl– | Na+>>Mg2+ | 21.1 | 9.3 | 2,658 | 0.1 | Subsalino | Mesotrófico |
| SGE | Santa Gertrudis, Jal. | 20°03’43” | 103°21’14” | HCO3->>Cl– | Ca2+>Mg2+>Na+ | 16.4 | 8.0 | 110 | 0.5 | Dulce | Eutrófico |
| SJN | San Juanico, Edo.Mex. | 19°55’39” | 99°47’19” | HCO3–>>SO4-2-Cl– | Ca2+-Na+-Mg2+ | 13.4 | 7.0 | 170 | 0.4 | Dulce | Eutrófico |
| SMO | Santa María del Oro, Nay. | 21°22’10” | 104°34’09” | HCO3–>Cl– | Na+> Mg2+>Ca2+ | 20.9 | 8.6 | 792 | 11.8 | Subsalino | Mesotrófico |
| SOL | El Sol, Edo.Mex. | 19°06’29” | 99°45’34” | HCO3–>>Cl–>SO4-2 | Ca2+> Mg2+>Na+ | 3.9 | 7.2 | 47 | 2.2 | Dulce | Oligotrófico |
| SPL | San Pedro Lagunillas, Nay. | 21°12’33” | 104°43’37” | HCO3->>Cl– | Na+>>Ca+2>Mg2+ | 22.9 | 8.2 | 182 | 0.7 | Dulce | Hipertrófico |
| SRO | Santa Rosa, Jal. | 20°02’27” | 103°16’58” | HCO3–>>Cl– | Mg2+>Na+-Ca2+ | 16.1 | 9.0 | 175 | 0.3 | Dulce | Mesotrófico |
| TAC | Alberca de Tacámbaro, Mich. | 19°12’38” | 101°27’33” | HCO3– | Mg2+>Ca2+>Na+ | 19.1 | 7.8 | 163 | 0.7 | Dulce | Eutrófico |
| TEC | Tecocomulco, Hgo. | 19°51’37” | 98°23’13” | HCO3–>>Cl– | Na+>>Ca2+-Mg2+ | 13.3 | 8.8 | 213 | 0.4 | Dulce | Eutrófico |
| TEP | Tepetiltic, Nay. | 21°16’30” | 104°41’18” | HCO3–>>Cl– | Ca2+>Mg2+-K+ | 21.8 | 8.3 | 75 | 0.5 | Dulce | Hipertrófico |
| TER | Alberca de Teremendo, Mich. | 19°48’21” | 101°27’15” | HCO3– | Na+-Mg2+>Ca2+ | 16.8 | 8.3 | 309 | 0.2 | Dulce | Hipertrófico |
| TXR | Texcoco-Recreativo, Edo.Mex. | 19°27’60” | 98°59’46” | HCO3–>Cl– | Na+>>Mg2+ | 16.7 | 9.6 | 4,584 | 0.2 | Hiposalino | Sd |
| VEG | La Vega, Jal. | 20°38’49” | 103°51’09” | HCO3–>>Cl–>SO4-2 | Na+>>Ca2+>Mg2+ | 21.7 | 8.5 | 340 | 0.4 | Dulce | Hipertrófico |
| VER | Verde, Ver. | 18°36’43” | 95°20’53” | HCO3–-Cl– | Na+>Mg2+-Ca2+ | 25.7 | 8.9 | 151 | 0.3 | Dulce | Hipertrófico |
| YUR | Yuriria, Gto. | 20°14’51” | 101°08’58” | HCO3–>>Cl–>SO4-2 | Na+>Ca2+> Mg2+ | 19.7 | 8.0 | 447 | 0.2 | Dulce | Eutrófico |
| ZEM | Zempoala, Mor. | 19°03’00” | 99°18’50” | HCO3– | Ca2+>Mg2+>Na+ | 12.0 | 8.8 | 68 | 3.3 | Dulce | Mesotrófico |
| ZIR | Zirahuén, Mich. | 19°26’7” | 101°44’22” | HCO3–>>Cl– | Ca2+-Mg2+-Na+ | 16.0 | 6.5 | 77 | 2.5 | Dulce | Oligotrófico |
| ZUM18 | Zumpango 2018, Edo. Mex. | 19°46’55” | 99°07’58” | HCO3–>Cl–-SO4-2 | Na+>>Mg2+-Ca2+ | 15.0 | 8.5 | 384 | 0.3 | Dulce | Hipertrófico |
TMA (temperatura media anual). SDT (sólidos disueltos totales). Categoría de halobion (mg L-1 de SDT, Klobe 1927, Fritz 2007). Agua dulce (menor a 500 mg L-1 de SDT). Subsalino (500-3000 mg L-1 de SDT). Hiposalino de 3,000-20,000 mg L-1 de SDT). Categoría de nivel trófico (mg m-3 de clorofila a, OECD, 1982). Ultraoligotrófico (≤ 2.5 mg m-3). Oligotrófico (2.5-8.0 mg m-3). Mesotrófico (8.0-25 mg m-3). Eutrófico (25-75 mg m-3). Eutrófico (≥ 75 mg m-3).
Tabla 2
Variables climáticas, morfométricas, fisicoquímicas y de nivel trófico determinadas en los 46 lagos estudiados en la FVTM. Las variables en negritas fueron seleccionadas para los análisis de correspondencia canónicos con variables climáticas, morfométricas y fisicoquímicas (1) y con variables de nivel trófico (2).
| Tipo de variable | Nombre de la variable | Unidades |
| Climática | Promedio anual de temperatura media anual (TMA) 1 | °C |
| Precipitación media anual (PMA) 1 | mm año-1 | |
| Evaporación media anual (EMA) | mm año-1 | |
| Morfométricas | Profundidad máxima | m |
| Profundidad de muestreo | m | |
| Profundidad relativa (PR) 1 | % | |
| Fisicoquímica | Conductividad eléctrica | µS cm-1 |
| Sólidos disueltos totales (SDT) 1 | mg L-1 | |
| pH 1 | ||
| Oxígeno disuelto | mg L-1 | |
| Alcalinidad 1 | mg CaCO3 L-1 | |
| Calcio (Ca2+)
Sodio (Na+) Potasio (K+) Magnesio (Mg2+) |
meq L-1
meq L-1 meq L-1 meq L-1 |
|
| Cloro (Cl–)
Bicarbonatos y Carbonatos (HCO3– + CO3-2) 1 Sulfatos (SO42-) |
meq L-1
meq L-1 meq L-1 |
|
| Nivel trófico | Fósforo total (FT) | µM
µM µM µM |
| Fósforo reactivo soluble (FRS) 2 | ||
| Nitrógeno inorgánico disuelto (NID) 2 | ||
| Sílice (SiO2) 2 | ||
| Clorofila tipo a (Cla) 2 | mg m-3 | |
| Visibilidad de disco de Secchi 2 | m |
Resultados
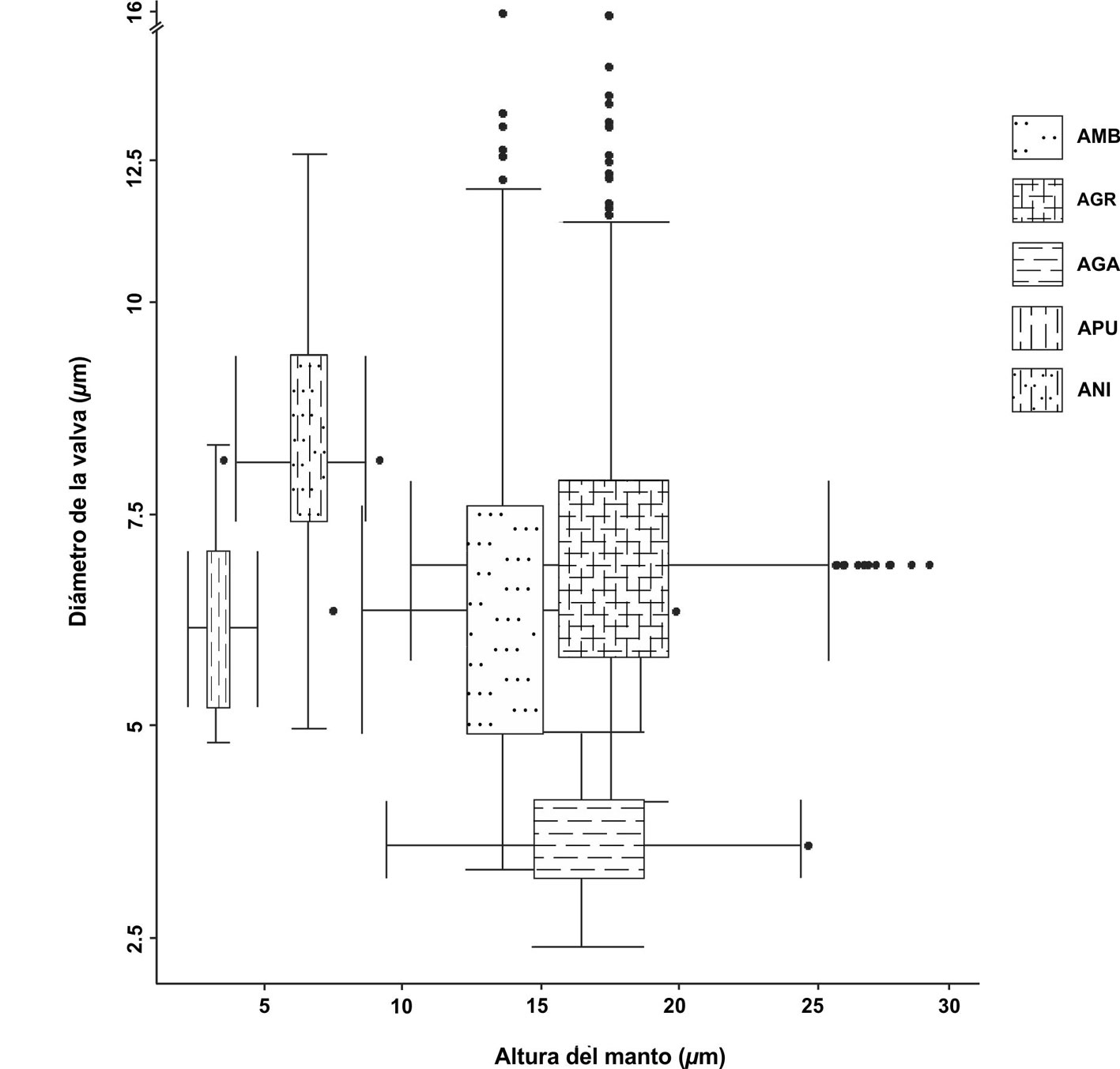
Se determinaron 4 especies y una variedad del género Aulacoseira presentes en 29 de los 46 sitios analizados a lo largo la FVTM: A. ambigua, A. granulata, A. granulata var. angustissima, A. nivaloides y A. pusilla. Los datos resumidos de las mediciones realizadas se presentan en la tabla 3 y en la figura 2 se muestra un diagrama de caja y doble bigote que muestra la variabilidad del tamaño valvar de las especies y variedades del género. En esta gráfica se puede identificar que A. nivaloides y A. pusilla se distinguen por tener el manto más corto, ubicadas a la izquierda de la gráfica, mientras que A. granulata var. angustissima se distingue por su diámetro menor, hacia la parte baja de la gráfica, aunque hay un traslape importante con la variedad nominal. En términos generales A. granulata tiene valvas con manto más desarrollado que A. ambigua, pero existe un traslape importante en el tamaño valvar de las 2 especies.
En la figura 3 se muestra la distribución geográfica de los taxones identificados del género Aulacoseira y sus abundancias relativas en los 29 cuerpos en los que fueron registradas. Se puede observar que A. granulata es la especie que tiene la mayor frecuencia de presencia por estar en 24 de los 29 sitios en los que se registró el género, mientras que las de menor frecuencia son A. nivaloides (1 sitio) y A. pusilla (3 sitios). En cuanto a la abundancia relativa, A. ambigua es la que tiene los valores más elevados y es dominante (> 50% de los conteos) en 5 lagos.
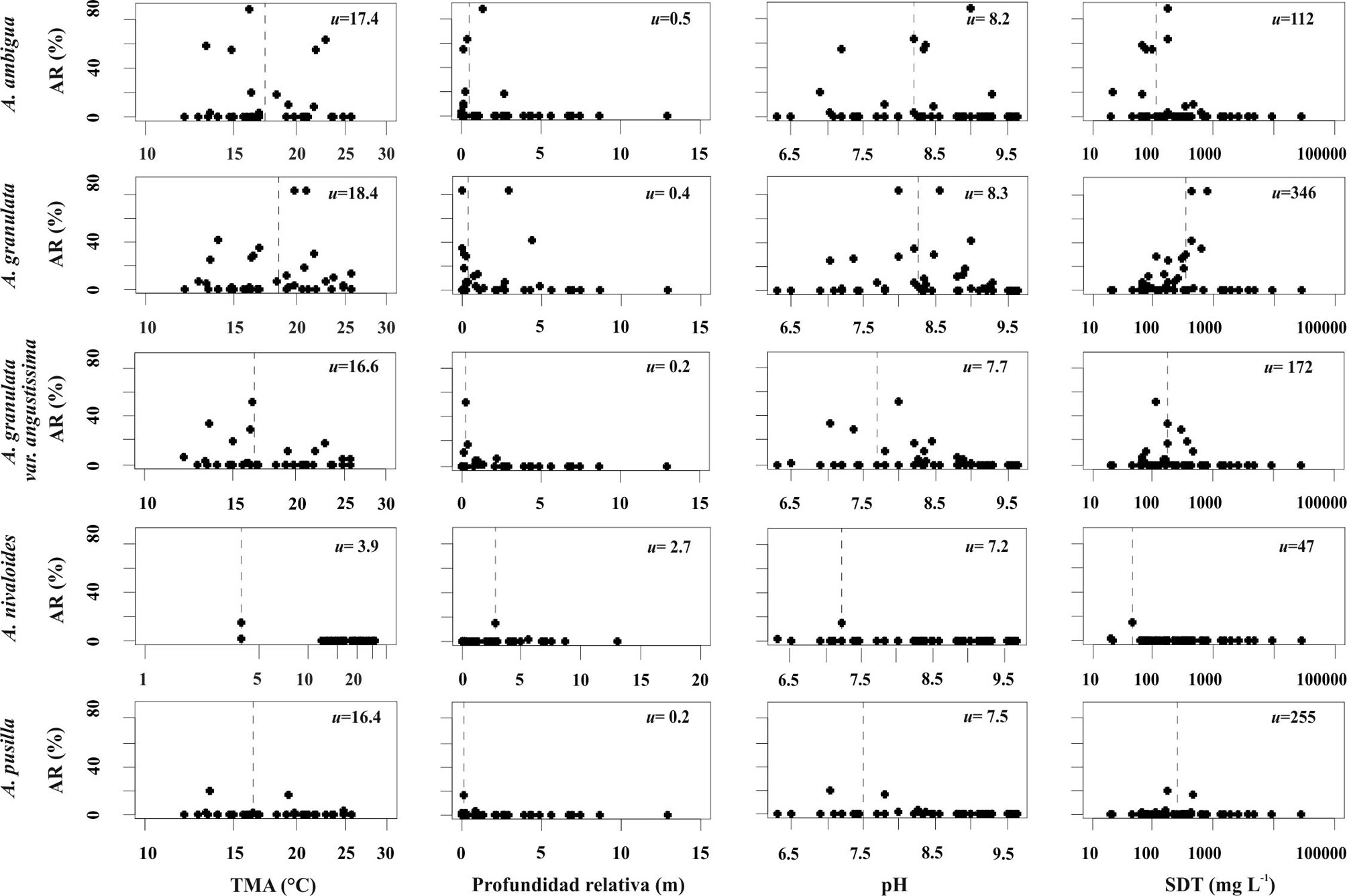
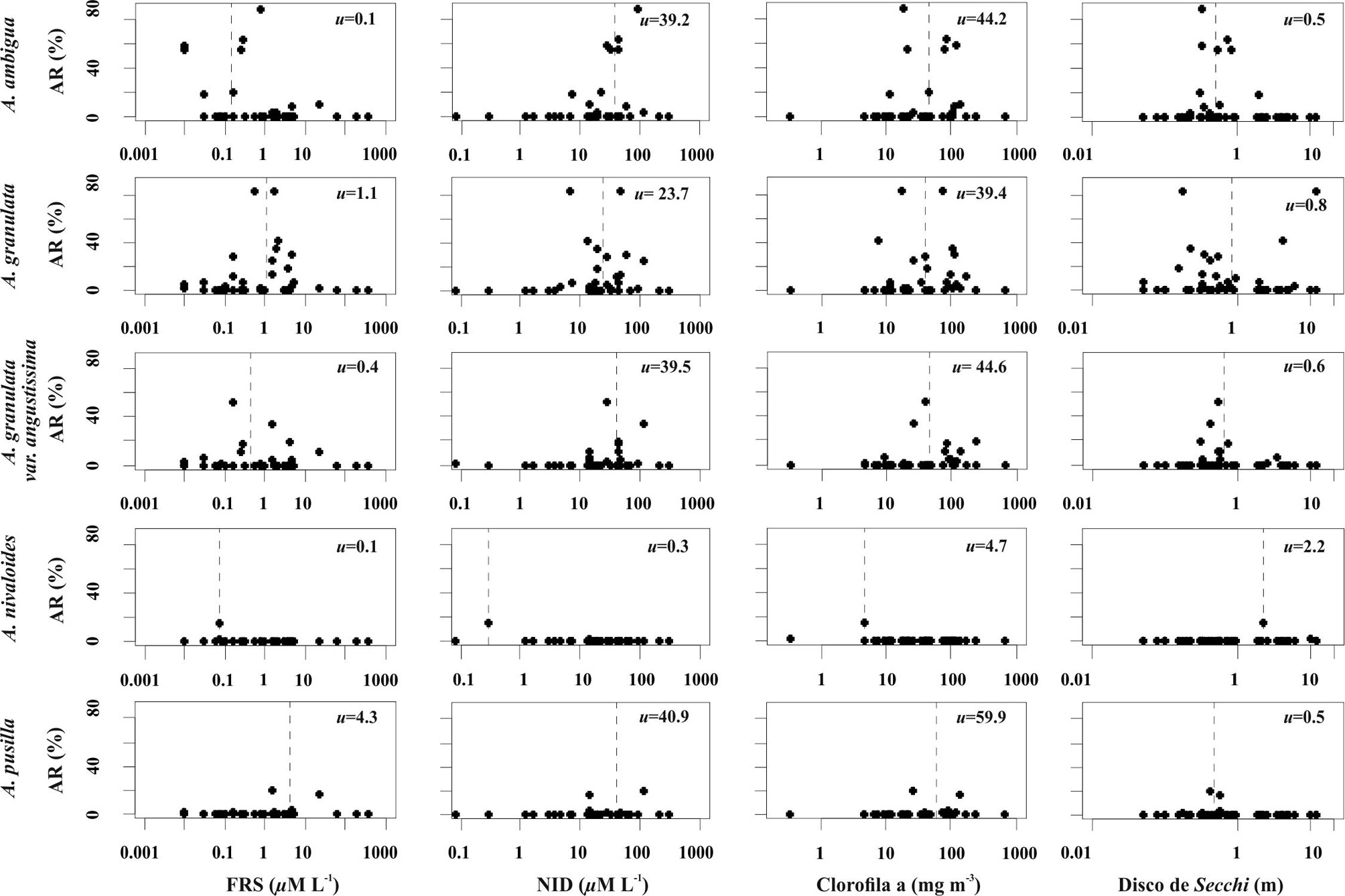
Los taxones identificados se ilustran en las figuras 4 a 8 y sus descripciones morfológicas se presentan en la siguiente sección del trabajo. En las figuras 9 y 10 se presentan los diagramas de la abundancia de las especies con respecto a las variables ambientales seleccionadas, incluyendo sus óptimos de distribución obtenidos por el método de promedios ponderados y los resultados de los ACC se presentan en las figuras 11 y 12. En el primer ACC (fig. 11) se obtuvo una inercia total de 9.65, con una varianza extraída en los primeros 2 ejes de 13.2% y una significancia de p < 0.03. Se identifica que la mayor variabilidad en los datos se asocia con la temperatura media anual (TMA, vector de mayor longitud), seguida por 3 indicadores de concentración iónica en el agua (sólidos disueltos totales [SDT], alcalinidad y carbonatos) y precipitación media anual (PMA≠). En el segundo ACC (fig. 12) se obtuvo una inercia total de 8.32, con una varianza extraída en los primeros 2 ejes de 17.5% con una significancia de p < 0.02. Se identifica la mayor variabilidad asociada con las concentraciones de nitrógeno inorgánico disuelto (NID = NH3+NO2+NO3) y de sílice (vectores de mayor longitud).

Descripciones
Aulacoseira ambigua (Grunow) Simonsen (fig. 4a-g).
Basiónimo: Melosira crenulata var. ambigua Grunow in Van Heurck.
Sinónimo: Melosira ambigua (Grunow in Van Heurch) O. Müller
Frústulos cilíndricos con manto desarrollado (fig. 4a-g) que presentan areolas redondas a elongadas, formando hileras curvadas hacia la derecha con respecto al eje pervalvar (fig. 4a-f). La cara valvar es plana a ligeramente convexa, lisa y frecuentemente sin areolas, aunque algunas valvas de separación pueden tener areolas en el margen (Siver y Kling, 1997) (fig. 4f). Las valvas tienen espinas marginales sobre las costillas que separan las hileras de areolas del manto (fig. 4d) y que permiten la formación de cadenas o filamentos, ya sean rectos (fig. 4a, b) o curvos (fig. 4c). Las valvas conectantes o de unión se caracterizan por tener espinas cortas de forma triangular o bifurcada con lóbulos redondeados (fig. 4e) y las valvas desconectantes o de separación (al final de la cadena) por espinas triangulares pequeñas y afiladas (fig. 4d) (Joh, 2010; Potapova et al., 2008; Siver y Kling, 1997). El engrosamiento interno del anillo liso del manto (ringleiste) es hueco y corto (fig. 4g) y al microscopio óptico se observa como un angostamiento que corresponde al sulco en forma de letra “U” (fig. 4b) (Bicudo et al., 2016; Joh, 2010; Pereira et al., 2013; Siver y Kling, 1997). De igual manera, el pseudosulco con forma de letra “V” (fig. 4a, b), es distinguible en la zona de contacto entre 2 valvas adyacentes. Las valvas tienen por lo menos una protuberancia labiada (rimoportula) con una apertura exterior de forma elongada (fig. 4e, g) que se localiza al final de una de las hileras de areolas, a la altura del anillo liso del manto (Cho, 1999; Potapova et al., 2008; Siver y Kling, 1997). En este anillo se distribuyen irregularmente pequeñas protuberancias de sílice.
Tabla 3
Parámetros morfométricos de las valvas de los 5 taxones del género Aulacoseira identificados en 29 lagos estudiados en la FVTM.
| Parámetros morfológicos | A. ambigua | A. granulata | A. granulata var. angustissima | A. nivaloides | A. pusilla | |
| Diámetro valvar
(D, µm) |
Mínimo
Máximo Promedio y desviación estándar |
3.3
15.8 6.5±1.9 |
4.1
15.9 7.0±1.5 |
2.4
4.9 3.6±0.6 |
4.9
11.8 8.4±1.5 |
4.8
8.3 7.0±0.8 |
| Altura del manto
(A, µm) |
Mínimo
Máximo Promedio y desviación estándar |
7.5
19.6 13.7±1.9 |
10.3
29.1 17.8±3.1 |
9.4
24.9 16.8±3.1 |
3.6
9.5 6.5±1.2 |
2.2
4.8 4.6±4.2 |
| Proporción A/D | Mínimo
Máximo |
0.8
4.7 |
0.9
4.2 |
2.1
8.6 |
0.3
1.4 |
0.3
0.7 |
| Areolas en 10 µm | 8 a 16 | 7 a 16 | 8 a 16 | 12 a 16 | 8 a 16 | |
| Estrías en 10 µm | 8 a 16 | 8 a 16 | 8 a 16 | 12 a 16 | 12 a 16 |

Los tamaños de los ejemplares observados para los sitios del centro de México (tabla 3) tuvieron un diámetro valvar que en general encaja con los rangos reportados en la literatura, que van de 4 a 17 µm, pero que incluso pueden alcanzar valores tan pequeños como 3.2-3.7 µm (Bicudo et al., 2016; Cho,1999; Gómez y Bauer, 2000). En cuanto a la altura del manto se encontraron algunos valores que sobrepasan ligeramente los rangos bibliográficos máximos de 17 µm. Esta especie estuvo presente en 14 de los sitios estudiados (fig. 4) y en su mayoría los ejemplares observados tuvieron mantos valvares rectos. Los ejemplares con un mayor diámetro tuvieron valvas rectas y fueron identificados en San Pedro Lagunillas (SPL), Zirahuén (ZIR) y Pátzcuaro (PAT). En Danxhó (DXO) y La Huaracha (HUA) se identificaron formas predominantemente curvas, con el manto más esbelto y el diámetro valvar más pequeño que en los otros sitios (figs. 4c, 5d, g). Los óptimos estimados para esta especie fueron 17.4 °C para TMA, 0.5% para PR, 8.2 para pH, 112 mg L-1 para salinidad (SDT), 0.1 µM para FRS, 39.2 para µM NID, 44.2 mg m-3 para clorofila a y 0.5 m para visibilidad de Secchi.
Aulacoseira granulata (Ehrenberg) Simonsen (fig. 5a-g).
Basiónimo: Gaillonella granulata Ehrenberg.
Sinónimo: Melosira granulata (Ehrenberg) Ralfs in Pritchard.
Frústulos cilíndricos con manto profundo (fig. 5a-e) y cara valvar plana, que en las valvas de separación puede tener poros finos distribuidos homogéneamente (fig. 5f). Las valvas tienen espinas marginales que permiten la formación de cadenas o filamentos cortos, rectos o curvos. Las valvas de unión (dentro de la cadena, fig. 5c, e) tienen espinas cortas, planas, triangulares, sobre las costillas que separan las hileras de areolas del manto. Las valvas de separación (al final de la cadena), tienen espinas cónicas que se originan de la fusión de 2 costillas (fig. 5f); con 1 a 3 espinas tan largas como la altura del manto (figs. 5a, d), y que corresponden con un surco o sutura en la valva adyacente (fig. 5b, d) (Tucci et al., 2006; Potapova et al., 2008; Joh, 2010). El manto presenta areolas redondeadas a cuadradas, formando hileras que pueden ser rectas en las valvas de separación (figs. 5b, d) o curvadas a la derecha con respecto al eje pervalvar en las valvas de unión (fig. 5c, e). El engrosamiento interno del anillo liso del manto (ringleiste) es sólido y corto (fig. 5g). Las protuberancias labiadas (rimoportulae) se ubican a 2 o 3 areolas del anillo liso del manto, aunque también es posible observarlas a 2 o 3 areolas de la cara valvar y en las células de separación pueden observarse en la ranura de la espina larga (fig. 5d). El anillo liso del manto se encuentra ornamentado con pequeñas protuberancias de sílice (Siver y Kling, 1997).

Los tamaños de los ejemplares del centro de México (tabla 3) estuvieron muy cerca de los rangos bibliográficos reportados de entre 4 a 17 μm e inclusive hasta 30 μm de diámetro valvar y 4 a 24 µm de alto del manto (Krammer y Lange-Bertalot 1991; Potapova y English, 2010). De acuerdo con Cho (1999), la ornamentación del manto puede presentar 3 tipos de patrones, el grueso (α) de 7-10 areolas en 10 µm, el intermedio (β) de 10-15 areolas en 10 µm y el fino (γ) de 15 areolas en 10 µm. En los ejemplares observados en las muestras del centro de México se observaron estos 3 patrones de ornamentación del manto. Esta especie fue identificada en 24 de los sitios estudiados (fig. 3) y las valvas con los diámetros menores se observaron en el sitio La Vega (VEG), en tanto que los mayores diámetros se registraron en los sitios Colorada (COL) y Danxhó (DXO), y fueron valvas con un patrón de ornamentación grueso (α). Los ejemplares observados tuvieron 1 o 2 espinas como máximo en las valvas de separación. Los óptimos estimados para esta especie fueron 18.4 °C para TMA, 0.4% para PR, 8.3 para pH, 346 mg L-1 para salinidad (SDT), 1.1 mM para FRS, 23.7 para mM NID, 39.4 mg m-3 para clorofila a y 0.8 m para visibilidad de Secchi.



Aulacoseira granulata var. angustissima (O. Müller) Simonsen (fig. 6a-d).
Basiónimo: Melosira granulata var. angustissima O. Müller.
Sinónimo: Melosira granulata subsp. angustissima (O. Müller) Cleve-Euler.
Esta variedad se distingue por tener frústulos más delgados (< 4 µm, fig. 6a-d) con una proporción A/D alta, mayor a 3 (Bicudo et al., 2016; Joh, 2010). En los ejemplares del centro de México las valvas de esta variedad fueron en su mayoría rectas (fig. 6b-d), excepto en los sitios Verde (VER) y Mogo (MOG) en donde también se identificaron valvas curvas (fig. 6a). En general, los ejemplares presentaron una espina larga en las valvas de separación (fig. 6a, c). Esta variedad estuvo presente en 13 de los sitios estudiados, los ejemplares de mayor diámetro se registraron en Colorada (COL), mientras que las de mayor altura valvar se encontraron en Zempoala (ZEM). Los óptimos estimados para esta variedad fueron 16.6 °C para TMA, 0.2% para PR, 7.7 para pH, 172 mg L-1 para salinidad (SDT), 0.4 mM para FRS, 39.5 para mM NID, 44.6 mg m-3 para clorofila a y 0.6 m para visibilidad de Secchi.
Aulacoseira nivaloides (K.E. Camburn) J. English y M. Potapova (fig. 7a-i).
Basiónimo: Melosira distans var. nivaloides Camburn in Camburn y Kingston.
Sinónimo: Aulacoseira distans var. nivaloides (Camburn) Siver y Kling.
Frústulos cilíndricos, con manto recto y relativamente corto (fig. 7a-g), por lo que muestran un aspecto rectangular en vista cingular (English y Potapova, 2009; Maidana y Díaz, 2001). La cara de la valva es cóncava (fig. 7c, e) o convexa (fig. 7b, f) con areolae redondeadas relativamente grandes (0.2-0.5 µm) distribuidas en toda la superficie (fig. 7d, h). La valva presenta espinas marginales situadas cada segunda o tercera costilla (fig. 7e-g), las cuales permiten la formación de cadenas cortas. Las espinas son puntiagudas y estrechas (English y Potapova, 2009), pero se han observado ejemplares en los que las espinas presentan protuberancias laterales en forma de ancla (fig. 7h) (Siver y Kling, 1997). Las areolas del manto pueden ser redondas a levemente elongadas y forman estrías paralelas a levemente inclinadas a la derecha (fig. 7b). El manto tiene un anillo liso ancho (fig. 7e) con un engrosamiento interno (ringleiste) poco desarrollado (fig. 7i) (English y Potapova, 2009; Siver y Kling, 1997).
Los ejemplares de esta especie se encontraron únicamente en el lago de altura El Sol (SOL), ubicado dentro del cráter del Nevado de Toluca. En trabajos anteriores realizados en este lago esta especie fue identificada como A. distans (Caballero, 1995; Cuna et al., 2014), pero ahora se reconoce que los ejemplares observados pertenecen a A. nivaloides, una especie que fue separada del complejo de especies similares a A. distans en 2009 (English y Potapova, 2009). La cara valvar cóncava/convexa es una de las características diagnósticas de A. nivaloides que la distingue de A. distans, con una cara valvar plana. La distribución de las espinas, presente en cada segunda o tercera costilla, también es característica de A. nivaloides, mientras que en otras especies dentro de este complejo las espinas están presentes en todas las costillas. En los ejemplares observados se identificaron 2 patrones de ornamentación del manto, uno relativamente fino (fig. 7c, f) con una densidad de estrías de 20 en 10 µm y otro más grueso (fig. 7b, e) con 15 estrías en 10 µm. Los óptimos estimados para esta variedad fueron 3.9 °C para TMA, 2.7% para PR, 7.2 para pH, 47 mg L-1 para salinidad (SDT), 0.1 µM para FRS, 0.3 para µM NID, 4.7 mg m-3 para clorofila a y 2.2 m para visibilidad de Secchi.
Aulacoseira pusilla (Meister) Tuli y Houk (fig. 8a-f).
Basiónimo: Melosira pusilla Meister.
Sinónimo: Aulacoseira subborealis (Nygaard) Denys, Muylaert y Krammer.
Frústulos cilíndricos con manto ligeramente convexo y corto (fig. 8a, d, e), por lo que es posible observarlos tanto en vista cingular como en vista valvar (fig. 8b). La cara valvar es plana o levemente convexa (fig. 8b, f), con areolas relativamente chicas y dispersas (fig. 8b, f) (Potapova et al., 2008; Tuji, 2015). Las espinas se encuentran en el margen de la cara valvar (fig. 8d, e), al final de cada 2 o 3 costillas pervalvares (Denys et al., 2003; Potapova et al., 2008) y pueden ser rectas o ligeramente curveadas, anchas en la base y afiladas. Las areolas del manto son pequeñas, redondeadas y forman hileras que curvean hacia la derecha (fig. 8a, d, e) (Bicudo et al., 2016; Potapova et al., 2008). El anillo interno se encuentra bien desarrollado (fig. 8c, f), en este anillo se ubican varias protuberancias labiadas (rimoportulae, fig. 8f), las cuales en el exterior se aprecian como aberturas simples y en el interior como un tubo corto que se extiende hacia la mitad del anillo (Bicudo et al., 2016; Potapova et al., 2008; Tuji y Williams, 2006).
Los tamaños de los ejemplares observados (tabla 3) fueron cercanos a rangos reportados en las referencias bibliográficas que van de 4.5 a 7.5 de diámetro valvar y de 2.2 a 4.5 de altura del manto (Potapova, 2010). En MEB se observaron ejemplares con areolas distribuidas sobre toda la cara valvar plana, pero un ejemplar presentó la cara valvar ligeramente cóncava y con una zona hialina en la parte central (fig. 8f). Algunos ejemplares presentaron espinas más largas y afiladas (fig. 8e). La especie A. pusilla se identificó en 3 de los sitios estudiados (fig. 4), San Juanico (SJN), Mogo (MOG) y Colorada (COL). En un trabajo anterior, en el lago Mogo, esta especie había sido reportada como Aulacoseira sp. (Vázquez y Caballero, 2013). Los óptimos estimados para esta variedad fueron 16.4 °C para TMA, 0.2% para PR, 7.5 para pH, 255 mg L-1 para salinidad (SDT), 4.3 mM para FRS, 40.9 para mM NID, 59.9 mg m-3 para clorofila a y 0.5 m para visibilidad de Secchi.
Discusión
La forma de la valva de los 5 taxones del género Aulacoseira identificados en el presente estudio, permite identificar 2 grupos de especies, las de manto corto (< 8 mm) y relaciones A/D bajas (£ 1) que incluyen a A. pusilla y A. nivaloides, y las de manto alto o profundo y relaciones A/D mayores (> 1) que incluyen a A. ambigua, A. granulata y A. granulata var. angustissima. La especie con el tamaño valvar más pequeño, y con el manto menos desarrollado, es A. pusilla, mientras que A. nivaloides tiene valvas un poco más grandes y cuadradas. En promedio A. granulata tuvo las valvas de mayor tamaño, y sobre todo con mantos más profundos comparados con A. ambigua, aunque existe un amplio traslape de rangos entre ambas especies. La variedad A. granulata var. angustissima se distingue por su diámetro menor (< 4 mm), y relaciones A/D altas (> 3); sin embargo, los ejemplares estudiados tuvieron una elevada variabilidad morfológica con un amplio traslape con la variedad nominal (fig. 2).
Los 5 taxones encontrados (A. ambigua, A. granulata, A. granulata var. angustissima, A. nivaloides y A. pusilla) han sido reportados previamente para ambientes modernos de México (Novelo y Tavera, 2021). En este trabajo no encontramos ejemplares pertenecientes a 7 de las especies reportadas para el género en México. Para 4 de éstas (A. muzzaensis, A. periphytica, A. italica y A. valida), muy posiblemente se deba a que estas especies tienen una distribución geográfica fuera de la zona estudiada o en ambientes que no fueron muestreados en este trabajo, por ejemplo, en ríos. Para los 3 restantes (A. alpigena, A. ambigua y A. distans), que son especies de manto corto, consideramos que es muy probable que correspondan con lo que en este trabajo identificamos como A. pusilla o A. nivaloides.
En el presente estudio, A. granulata fue la especie que se encontró con mayor frecuencia, ya que estuvo presente en 83% de los sitios en los que se registró el género Aulacoseira (fig. 4) y en 52% de todos los sitios estudiados. Esto coincide con la bdLACET (Novelo y Tavera, 2021) en donde esta especie tiene un número de reportes en México mucho mayor que cualquier otra del género. Esta especie fue dominante (> 50% de los conteos) en 2 lagos: Santa María del Oro (82%) y Yuriria (62%). Su variedad A. granulata var. angustissima también fue frecuente ya que se identificó en 45% de los sitios en los que estuvo presente el género y en 28% de los sitios estudiados. En la mayoría de los sitios estuvo en asociación con la variedad nominal, aunque solo fue dominante (> 50%) en un sitio (Santa Gertrudis, 52%).
La segunda especie más frecuente fue A. ambigua, presente en 48% de los sitios en los que se registró el género y en 30% de los lagos estudiados. Sus abundancias relativas fueron las más altas, ya que fue dominante en 5 sitios: Santa Rosa (89%), San Pedro Lagunillas (63%), La Huaracha (59%), Danxhó (56%) y Tepetiltic (55%). Las especies con menor frecuencia fueron A. pusilla, que se identificó solo en 3 sitios (6.5% del total de lagos) y A. nivaloides, que estuvo presente en solo 1 sitio (2% del total de lagos). Estas especies nunca fueron dominantes; A. pusilla tuvo su abundancia relativa más alta en San Juanico (19%) mientras que A. nivaloides tuvo una abundancia de 14% en el único sitio en el que estuvo presente (El Sol).
Se observó que las especies del género Aulacoseira estuvieron presentes en un amplio rango de temperatura (TMA de 3.9 a 18.4º C) y niveles tróficos (desde oligotróficos hasta hipertróficos), sin embargo, todos los sitios en los que se presentaron tuvieron valores de pH circumneutrales a levemente alcalinos (7.2 a 8.3) y la mayoría con una salinidad baja, dentro del rango del agua dulce (SDT < 500 mg L-1), excepto por Santa María del Oro que excede levemente este límite (SDT = 792 mg L-1). No obstante, ninguna especie del género estuvo presente en los sitios con salinidades elevadas (SDT > 1,000 mg L-1) que forman parte de los 46 lagos estudiados. Esta es una distribución consistente con lo encontrado para las especies del género en África (Gasse et al., 1995). Además, las 29 cuencas lacustres en las que habitan las especies del género Aulacoseira (tabla 1, fig. 4) se caracterizan por una dominancia iónica con proporciones similares de los cationes calcio (Ca2+), magnesio (Mg2+) y sodio-potasio (Na++K+), mientras que en los aniones dominaron los bicarbonatos y carbonatos (HCO3– + CO32).
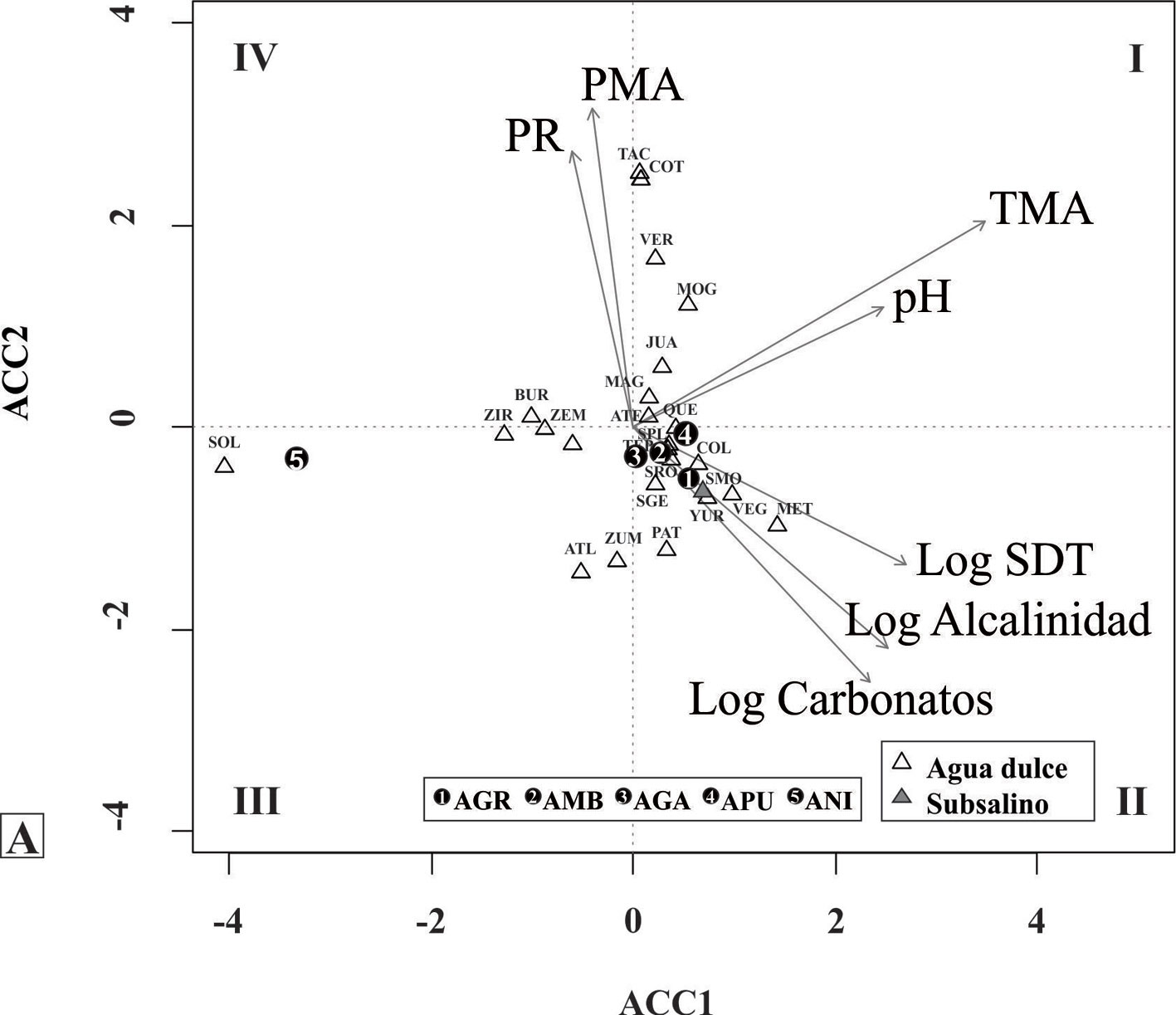
En cuanto a la distribución de cada una de las especies, los ACC permitieron identificar a la TMA, salinidad, PMA, DIN y SiO2 como los principales gradientes ambientales que explican su distribución. En los ACC (figs. 11, 12), así como en las gráficas de abundancia y los promedios ponderados (figs. 9, 10) se puede apreciar que A. nivaloides tiene una distribución asociada con una baja TMA, salinidad, y nivel trófico, pero una elevada visibilidad de Secchi. Sus óptimos para TMA, salinidad y clorofila a son los más bajos (3.9°C, 47 mg L-1 y 4.7 mg m-3) y el de visibilidad de Secchi es el más alto (4.7 m). Entre los lagos analizados, este taxón estuvo presente solamente en el lago El Sol, un lago oligotrófico de altura; cabe destacar que en otras regiones del mundo esta especie también ha sido reportada en lagos oligotróficos de montaña (Maidana y Díaz, 2001).
Por su parte, A. pusilla (presente en 3 sitios) muestra una afinidad por valores elevados de sílice, FRS, y clorofila a, así como por aguas con valores bajos de visibilidad de Secchi. Los óptimos estimados para clorofila a y FRS son los más elevados (59.9 mg m-3, 4.3 µM). En la literatura existen pocas referencias a las afinidades ecológicas de esta especie, en parte por las dificultades para su correcta identificación; sin embargo, se ha reportado como una diatomea común en ambientes turbios, eutróficos, ricos en fósforo (Denys et al., 2003), en concordancia con lo encontrado en este análisis. La distribución de A. ambigua, A granulata y A. granulata var. angustissima son muy similares, pero el análisis realizado en este trabajo indica que A. granulata tolera concentraciones de FRS más elevadas en comparación con A. ambigua y A. granulata var. angustissima. Afinidades similares fueron reportadas para estas mismas especies en los trabajos clásicos de Kilham y Kilahm (1986) realizados en lagos africanos. En cuanto a salinidad, A. granulata tolera condiciones al límite entre el agua dulce y subsalina (SDT = 500 mg L-1), A. pusilla muestra una posición intermedia (óptimo de 255 mg L-1) mientras que A. ambigua y A. granulata var. angustissima prefieren salinidades menores (óptimos de 112 y 172 mg L-1). También se identificó que entre estas 4 especies, A. granulata es la que tiene preferencia por una mayor PR (el porcentaje que representa la profundidad máxima con respecto al diámetro de un lago), lo que indica que habita preferencialmente en lagos más profundos.
Podemos concluir que los resultados muestran la presencia de 4 especies y una variedad del género Aulacoseira distribuidas en 29 sitios de 46 estudiados a lo largo de la FVTM. Tres de estos taxones tienen un manto desarrollado (A. ambigua, A. granulata y A. granulata var. angustissima) y 2 un manto corto (A. nivaloides y A. pusilla). Aulacoseira granulata es la especie que se registra con mayor frecuencia en las localidades estudiadas y A. ambigua la que tuvo las mayores abundancias relativas.
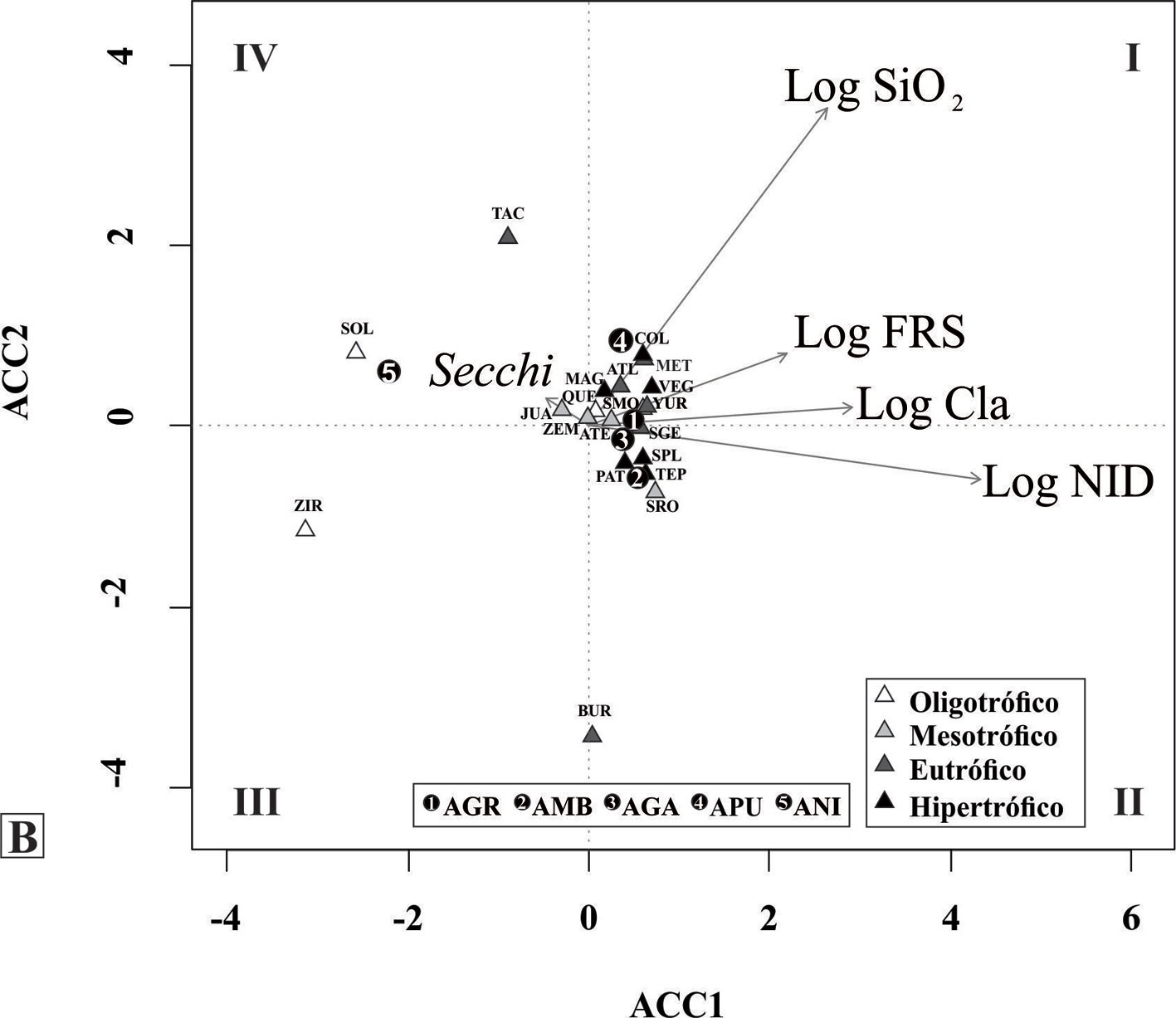
Las especies del género Aulacoseira mostraron una distribución preferencial en aguas circumneutrales a levemente alcalinas y de baja salinidad (SDT < 1,000 mg L-1). Los gradientes ambientales más importantes que diferencian a las especies fueron la temperatura, salinidad, concentraciones de nitrógeno y sílice. Estos gradientes permiten separar a A. nivaloides del resto de las especies, ya que es la única con una afinidad por agua fría, con salinidad baja y nivel de nitrógeno, fósforo y clorofila a muy bajo. Con respecto al resto de las especies, A. pusilla se distribuye en los ambientes con mayores concentraciones de fósforo, seguida de A. granulata y en los niveles más bajos A. ambigua y A. granulata var angustissima. Con respecto a salinidad A. granulata es la que tiene mayor tolerancia seguida de A. pusilla y en los niveles más bajos, A. granulata var. angustissima y A. ambigua.
Agradecimientos
Al Posgrado en Ciencias del Mar y Limnología, UNAM por las facilidades otorgadas para la elaboración de este trabajo. Al Consejo Nacional de Ciencia y Tecnología (CONACyT) por la beca otorgada (41357) al primer autor para realización de la presente investigación. A Laura Gómez del Servicio Académico de Microscopía Electrónica de Barrido (SAMEB), Instituto de Ciencias del Mar y Limnología-UNAM por su apoyo técnico; a Susana Sosa del laboratorio de Paleoecología, Paleoclimatología y Cambio climático, Instituto de Geología-UNAM por su apoyo técnico.
Referencias
Avendaño, D., Caballero, M. y Vázquez, G. (2021). Ecological distribution of Stephanodiscus niagarae Ehrenberg in central Mexico and niche modeling for its last glacial maximum habitat suitability in the Nearctic realm. Journal of Paleolimnology, 66, 1-14. https://doi.org/10.1007/s10933-021-00178-w
Bicudo, D., Tremarin, P., Almeida, P., Zorzal-Almeida, S., Wengrat, S., Faustino, S. et al. (2016). Ecology and distribution of Aulacoseira species (Bacillariophyta) in tropical reservoirs from Brazil. Diatom Research, 31, 199–215. https://doi.org/10.1080/0269249X.2016.1227376
Buczkó, K., Magyari, E. y Ognjanova-Rumenova, N. (2010). Taxonomy, morphology and distribution of some Aulacoseira taxa in glacial lakes in the South Carpathian Region. Polish Botanical Journal, 55, 149-163.
Caballero, M. (1995). Late Quaternary paleolimnology of Lake Chalco, the Basin of Mexico (Tesis doctoral). Inglaterra, University of Hull.
Caballero, M. y Sigala, I. (2017). Datos hidrogeoquímicos. Base de datos. Instituto de Geofísica, UNAM. Ciudad de México. https://datosabiertos.unam.mx [consultado 27 septiembre 2021].
Caballero, M., Lozano-García, S., Ortega-Guerrero, B. y Correa-Metrio, A. (2019). Quantitative estimates of orbital and millennial scale climatic variability in central Mexico during the last~40,000 years. Quaternary Science Reviews, 205, 62–75. https://doi.org/10.1016/j.quascirev.2018.12.002
Cho, K. J. (1999). Morphology and taxonomy on Diatom Genus Aulacoseira in the Naktong River. Algae, 14, 143–153.
Crawford, R. y Likhoshway, Y. (1999). The frustule structure of original material of Aulacoseira distans (Ehrenberg) Simonsen. Diatom Research, 14, 239-250. https://doi.org/10.1080/0269249X.1999.9705468
Cuna, E., Zawisza, E., Caballero, M., Ruíz-Fernández, C. y Lozano-García, S. (2014). Environmental impacts of Little Ice Age cooling in central México recorded in the sediments of a tropical alpine lake. Journal of Paleolimnology, 51, 1–4. https://doi.org/10.1007/s10933-013-9748-0
Denys, L., Muylaert, K., Krammer, K., Joosten, T., Reid, M. y Rioual, P. (2003). Aulacoseira subborealis stat. nov. (Bacillariophyceae): a common but neglected plankton diatom. Nova Hedwigia, 77, 407–427. https://doi.org/10.1127/0029-5035/2003/0077-0407
Dunck, B., De Souza, I. y Machado, M. (2012). Planktonic diatoms in lotic and lentic environments in the Lago dos Tigres hydrologic system (Britânia, Goiás, Brazil): Coscinodiscophyceae and Fragilariophyceae. Brazilian Journal of Botany, 35, 181–193. https://doi.org/10.1590/S0100-84042012000200007
English, J. y Potapova, M. (2009). Aulacoseira pardata sp. nov., A. nivalis comb. nov., N. nivaloides comb. et stat. nov., and their occurrences in western North America. Proceedings of the Academy of Natural Sciences of Philadelphia, 158, 37–48.
Fritz, S. (2007). Salinity and climate reconstruction from diatoms in continental lake deposits. En S. A. Elias (Ed.), Encyclopedia of Quaternary Science (pp. 514–522). Amsterdam: Elsevier.
Gasse, F., Juggins, S. y Khelifa, L. B. (1995). Diatom-based transfer functions for inferring past hydrochemical characteristics of African lakes. Palaeogeography, Palaeoclimatology, Palaeoecology, 117, 31–54.
Gómez, N. y Bauer, D. (2000). Diversidad fitoplanctónica en la franja costera sur del Río de la Plata. Biología Acuática, 19, 7–26.
Gómez, N., Riera, J. y Sabater, S. (1995). Ecology and morphological variability of Aulacoseira granulata (Bacillariophyceae) in Spanish reservoirs. Journal of Plankton Research, 17, 1–16. https://doi.org/10.1093/plankt/17.1.1
Guiry, M. y Guiry, G. (2021). AlgaeBase. World-wide electronic publication, National University of Ireland, Galway Base de datos https://www.algabase.org [consultado 3 feb 2021].
Gusev, E. y Kulikovski, M. (2014). Centric diatoms from Vietnam reservoirs with description of one new Urosolenia species. Nova Hedwigia, Beiheft, 143, 111–126. https://doi.org/10.1127/1438-9134/2014/006
Joh, G. (2010). Algal Flora of Korea. Vol. 3. Number 1. Chrysophyta: Bacillariophyceae: Centrales. Freshwater Diatoms I. Incheon, South Korea: National Institute of Biological Resources. Ministry of Environment.
Kilham, P., Kilham, S. S. y Hecky, R. E. (1986). Hypothesized resource relationships among African planktonic diatoms. Limnology and Oceanography, 31, 1169–1181.
Kociolek, P., Theriot, E., Williams, D. Julius, M., Stoermer, E. y Kingston J. (2014). Chapter 15. Centric and Araphid diatoms. En J. Wehr, R. Sheath y J. Kociolek (Eds.), Freshwater Algae of North America. Ecology and Classification. 2ª ed. Cambridge, MS: Academic Press. https://doi.org/10.1016/B978-0-12-385876-4.00015-3
Kolbe, R. W. (1927). Zur ökologie, morphologie und systematik der brackwasser-diatomeen: Die kieselalgen des Sperenberger salzgebiets: Jena Fischer.
Krammer, K. y Lange-Bertalot, H. (1991). Sübwasserflora von Mittleleuropa. Vol. 2/3 Bacillariophyceae: Centrales, Fragilariaceae, Eunotiaceae. Gustav Fischer Verlag.
Lange-Bertalot, H. (2001). Diatoms of Europe. Diatoms of the European inland waters and comparable habitats. Berlin: Ganter Verlag.
Lee, K. y Yoon, S. (1994). Morphologic accounts on the diatom Genus Aulacoseira, the dominant of the Han River. Algae, 9, 135–143
Maidana, N. y Díaz, V. (2001). Diatomeas de lagos oligotróficos andinos (Provincia de Neuquén, Argentina). Boletín de la Sociedad Argentina de Botánica, 36, 15–27.
Novelo, E. y Tavera, R. (2021). bdLACET Base de datos de algas continentales. Facultad de Ciencias, UNAM. México [consultado 11 junio 2021]. Disponible en https://bdlacet.mx
Oksanen, J., Blanchet, G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D. et al. (2020). Community Ecology Package “Vegan” [online]. Paquete de R versión 2.5-7. Disponible en: https://cran.r-project.org/web/packages/vegan/vegan.pdf
Organization for Economic Cooperation and Development (OECD). (1982). Eutrophication of waters. Monitoring, assessment and control. Paris: Organization for Economic Cooperation and Development.
Pereira, K., Tremarin, P. I. y Veiga, T. A. (2013). Taxonomic studies of centric diatoms (Diatomeae): unusual nanoplanktonic forms and new records for Brazil. Acta Botanica Brasilica, 27, 237–251.
Potapova, M. (2010). Aulacoseira pusilla. En Diatoms of North America, Base de datos https://diatoms.org/species/aulacoseira_pusilla. [Consultado 27 septiembre 2021].
Potapova, M., Bixby, R., Charles, D., Edlund, M., Enache, M., Furey, P. et al. (2008). Representatives of the genus Aulacoseira Thwaites in NAWQA simples. Eighteenth NAWQA Workshop on Harmonization of Algal Taxonomy April 27-29, 2007. Report No. 08-07. The Academy of Natural Sciences of Philadelphia.
Potapova, M. y English, J. (2010). Aulacoseira granulata. Diatoms of North America, Base de datos https://diatoms.org/species/aulacoseira_pusilla. [Consultado 27 septiembre 2021].
Round, F. E., Crawford, R. M. y Mann, D. G. (1990). The diatoms. Biology y morphology of the genera. Cambridge: Cambridge University Press.
Rumrich, U., Lange-Bertalot, H. y Rumrich, M. (2000). Diatoms of the Andes. Berlín: A.R.G Gantner Verlang K.G.
Sathicq, M., Nicolosi-Gelis, M. y Cochero, J. (2020). Calculating autoecological data (optima and tolerance range) for multiple species with the ‘optimos. prime’ R package. Austral Ecology, 45, 845–850. https://doi.org/10.1111/aec.12868.
Sigala, I., Caballero, M., Correa-Metrio, A., Lozano-García, S., Vázquez, G., Pérez, L. et al. (2017). Basic limnology of 30 continental waterbodies of the Transmexican Volcanic Belt across climatic and environmental gradients. Boletín de la Sociedad Geológica Mexicana, 69, 310–370. https://doi.org/10.18268/BSGM2017v69n2a3
Siver, P. y Kling, H. (1997). Morphological observations of Aulacoseira using scanning electron microscopy. Canadian Journal of Botany, 75, 1807–1835. https://doi.org/10.1139/b97-894
Tucci, A., Orth, L., Segecin, R. y Bicudo, C. (2006). Criptogamos do Parque Estadual das Fontes do Ipiranga, Sao Paulo, SP. Algas, 20: Coscinodiscophyceae. Hoehnea, 33, 115–122.
Tuji, A. (2015). Distribution and Taxonomy of the Aulacoseira distans Species Complex Found in Japanese Harmonic Artificial Reservoirs. Bulletin of the National Museum of Nature and Science. Series B, Botany, 41, 53–60.
Tuji, A. y Williams, D. (2006). Type examination of the freshwater centric diatom Aulacoseira pusilla (F. Meister) Tuji et Houki. Diatom, 22, 70–73.
Tukia, J. y Lepistö, L. (1999). Sizes variations of planktonic Aulacoseira Thwaites (Diatomeae) in water and in sediment from Finnish lakes of varying trophic state. Journal of Plankton Research, 21, 757–770.
Vázquez, G. y Caballero, M. (2013). The structure and species composition of the diatom communities in tropical volcanic lakes of eastern Mexico. Diatom Research, 28, 77–91.




