Gabriel Suárez-Varón a, *, Diego Cortez b, Maricela Villagrán-Santa Cruz c,
Ulises Rojas-Hernández a y Oswaldo Hernández-Gallegos a
a Universidad Autónoma del Estado de México, Facultad de Ciencias, Laboratorio de Herpetología, Instituto Literario # 100, 50000 Toluca, Estado de México, México
b Universidad Nacional Autónoma de México, Centro de Ciencias Genómicas, Avenida Universidad # 2001, 62210 Cuernavaca, Morelos, México
c Universidad Nacional Autónoma de México, Facultad de Ciencias, Departamento de Biología Comparada, Laboratorio de Biología Tisular y Reproductora, Circuito Exterior s/n, Ciudad Universitaria, Coyoacán, 04510 Ciudad de México, México
*Autor para correspondencia: biogabrielsv@gmail.com (G. Suárez-Varón)
Recibido: 20 octubre 2020; aceptado: 3 marzo 2021
Resumen
En lagartijas ovíparas existe un intervalo frecuente en el desarrollo embrionario que alcanzan los huevos al momento de la oviposición entre el estadio 26 y 33. Dicha variación se ha relacionado con el origen de la viviparidad y permite la exploración de los efectos experimentales en el desarrollo embrionario después de la oviposición. Sin embargo, para la mayoría de las especies de lagartijas, el estadio embrionario en la oviposición es desconocido. El presente estudio detalla por primera vez en Corytophanidae el estadio embrionario en la oviposición de Basiliscus vittatus. Se colectaron hembras grávidas para obtener nidadas de reciente oviposición. De cada nidada, un huevo al azar fue disecado con la finalidad de determinar el estadio embrionario en la oviposición, además de medir variables morfométricas de la hembra y de los huevos. Los resultados muestran que en B. vittatus, las hembras ovipositan en 4 estadios embrionarios: 29 a 32; sin embargo, existe una preferencia por ovipositar en estadios embrionarios intermedios (estadios 30 y 31). De las diferentes variables registradas, el estadio en la oviposición solo se asocia con el largo máximo del huevo. El estadio en la oviposición de B. vittatus parece estar relacionado con factores fisiológicos y morfológicos de las hembras, así como por su estrategia de forrajeo.
Palabras clave: Corytophanidae; Desarrollo; Estadio embrionario; Oviposición
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Variation of the embryonic stage of Basiliscus vittatus (Squamata: Corytophanidae) at oviposition
Abstract
In oviparous lizards there is a frequent interval in the embryonic development that the eggs reach at the time of oviposition between stage 26 and 33. This variation has been related to the origin of viviparity and allowing the exploration of the effects of specific experimental conditions on embryonic development after oviposition. However, for most species of lizards the embryonic stage at oviposition is unknown. The present study details for first time in Corytophanidae the embryonic stage at oviposition of Basiliscus vittatus. Gravid females were collected to obtain recently oviposited clutches. From each clutch, a random egg was dissected in order to determine the embryonic stage at oviposition, in addition to measuring morphometric variables of the female and the eggs. Our results show that in B. vittatus, females oviposit in 4 embryonic stages: 29 to 32; however, there is a preference for ovipositing in intermediate embryonic stages (stages 30 and 31). Of the different variables recorded, the stages at oviposition are associated with the maximum length of the egg. The stage at oviposition of B. vittatus seems to be related to physiological and morphological factors of the females, as well as their foraging strategy.
Keywords: Corytophanidae; Development; Embryonic stage; Oviposition
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Muchos aspectos que integran la biología de las lagartijas se enfocan en partes del ciclo de vida que contemplan estadios postoviposición como la ecología o características de historia de vida (Andrews et al., 2017; Granados-González et al., 2020; Woolrich-Piña et al., 2020). El desarrollo embrionario es un proceso que inicia con la fecundación y finaliza con el nacimiento (Andrews, 2002). Muchas investigaciones han estudiado cómo la temperatura afecta el desarrollo embrionario, la capacidad de retención embrionaria e incluso las estrategias ecológicas y variaciones filogenéticas en los escamados (Andrews et al., 2013; Andrews y Rose, 1994; Braña et al., 1991; García-Collazo et al., 2012). Dichos estudios han modelado hipótesis sobre el desarrollo embrionario y, particularmente, sobre el origen de la viviparidad en reptiles a partir de sus conspecíficos ovíparos (Andrews et al., 2013). La hipótesis del surgimiento de la viviparidad ha sido apoyada por estudios sobre la retención embrionaria, estrés hídrico, grosor del cascarón, temperatura y, con menor énfasis, el estadio embrionario en la oviposición (Andrews y Mathies, 2000; Andrews y Rose, 1994; Andrews et al., 2017; Calderón-Espinosa et al., 2006; Heulin et al., 2002; Meza-Lázaro, 2004; Rafferty y Reina, 2012; Shine, 1983).
El desarrollo embrionario ha sido descrito y dividido para su estudio siguiendo los rasgos morfológicos que presenta el embrión. Se han generado tablas de desarrollo embrionario que permiten seguir y definir los estadios durante el desarrollo (Py-Daniel et al., 2017). Tradicionalmente, la tabla de desarrollo más utilizada en estudios experimentales para comparación embriológica y para determinar el estadio del desarrollo embrionario en lacertilios (Andrews et al., 2008; Hopwood, 2007; Py-Daniel et al., 2017) es la descrita por Dufaure y Hubert (1961). Esta tabla incluye 40 estadios e inicia desde el clivaje (estadio 1), culminando con el embrión formado completamente, previo a la eclosión o nacimiento (estadio 40).
El proceso de oviposición involucra una transición de la embriogénesis dentro del oviducto de la madre y el nido (Andrews y Mathies, 2000). En reptiles ovíparos existe una variación considerable en el desarrollo embrionario que alcanzan los huevos al momento de la oviposición (Heulin et al., 2002). Por ejemplo, la oviposición en estadios tempranos de desarrollo es común en Crocodylia (néurula, Ferguson, 1985), Testudines y Rhyncocephalia (ambos en gástrula, Ewert, 1985; Moffat, 1985). En lacertilios existen especies que ovipositan tempranamente (Chamaeleo lateralis, estadio 8, Blanc, 1974) y otros que lo hacen cuando el embrión ha alcanzado un desarrollo prácticamente completo (estadio 39.5, DeMarco, 1993; García-Collazo et al., 2012; Mathies y Andrews, 1996). También se han observado variaciones intraespecíficas y entre nidadas en el estadio embrionario en la oviposición (Braña et al., 1991; Calderón-Espinoza et al., 2006). Pese a esta variación, la mayoría de los lacertilios ovipositan en el estadio 30 (basados en la tabla de desarrollo embrionario de Dufaure y Hubert [1961]), el cual es considerado el más frecuente al momento de la oviposición en reptiles (Mathies y Andrews, 1999). En el estadio 30, el embrión está al inicio del segundo tercio del desarrollo embrionario completo y se encuentra entre el intervalo de estadios 26 a 32, donde ocurre la deposición de calcio para formar por completo el cascarón, además de la incorporación de proteínas como el albumen para que el huevo pueda continuar su desarrollo expuesto al medioambiente (Andrews y Mathies, 2000; Shine, 1983).
Un aspecto importante al realizar estudios experimentales en huevos de reptiles es conocer el estadio normal de oviposición, como en el trabajo de Rodríguez-Díaz y Braña (2012). Este trabajo describe que al analizar nidadas de Zootoca vivipara en el mismo estadio en la oviposición (33) se puede observar una eclosión más temprana (días de incubación) como consecuencia de experimentar con elevación y temperatura de incubación. Entonces, el estadio embrionario en la oviposición permite tener un control y un panorama amplio de los efectos experimentales resultantes, así como de las hipótesis a explorar. La ausencia de esta información en diversos experimentos de incubación puede generar sesgos que podrían sobre-estimar efectos experimentales (e.g., térmicos, hídricos, retención embrionaria) al que los huevos y hembras grávidas son sometidos, forzando la detección de similitudes o diferencias no existentes o que no son apoyadas metodológicamente (Andrews, 2004). Entonces, el conocimiento del estadio embrionario en la oviposición debe ser una característica necesaria de análisis para poner a prueba diversas hipótesis como el origen de la viviparidad. Por ejemplo, en tortugas, cocodrilos y tuátaras dados los tempranos estadios embrionarios en la oviposición que presentan se puede inferir por qué en estos grupos no surgió la viviparidad, mientras que en escamados, a pesar de las variaciones existentes en el desarrollo embrionario, la viviparidad ocurrió en múltiples ocasiones (Andrews, 1997; Qualls et al., 1997; Shine, 1983).
En el trabajo de Andrews y Mathies (2000), se conocía el estadio en la oviposición de aproximadamente 1.1% de las especies de escamados (i.e., 63 especies de las ~ 5,500 especies de escamados ovíparos descritos en aquel momento). Desde entonces se ha incrementado el número a 25 especies adicionales para alcanzar solo 1.3% de las especies de escamados (i.e., 88 especies de las 6,905 especies de lacertilios descritos en la actualidad; Uetz et al., 2021). Asimismo, se han descrito diversos factores que pueden afectar el estadio en la oviposición, éstos incluyen aspectos morfológicos, fisiológicos y ecológicos. Dentro de los factores morfológicos más importantes se encuentra el grosor y estructura del cascarón, la vascularización de membranas extraembrionarias y del oviducto (Andrews, 1997; Masson y Guillette, 1987; Packard y DeMarco, 1991). Entre los factores fisiológicos, se encuentra la disponibilidad de oxígeno y de agua en el oviducto (Mathies y Andrews, 1996; Smith et al., 2015). Ambos factores promueven variaciones en la difusión de gases y, por consiguiente, en la cantidad de oxígeno disponible para los huevos en el oviducto (Masson y Guillette, 1987). Finalmente, existen factores ecológicos que afectan el estadio en la oviposición, como la retención de los huevos en el oviducto por periodos más largos de tiempo para aumentar la sobrevivencia de la descendencia o, por el contrario, ovipositar tempranamente para reducir las tasas de mortalidad de las hembras grávidas al disminuir el exceso de carga y aumentar su capacidad de escape ante un depredador (Andrews y Mathies, 2000; Sinervo y Licht, 1991).
Basiliscus vittatus es una lagartija ovípara que presenta un modo de forrajeo pasivo (Cooper et al., 2013); no obstante, se ha sugerido que al mostrar características como altas velocidades de escape, cuerpos cilíndricos y valores de masa relativa de la nidada (MRN) comparables con especies de forrajeo activo (e.g. Aspidoscelis), pueda encontrarse en una posición intermedia entre ambos extremos de forrajeo (Suárez-Varón et al., 2019). Por otra parte, aunque recientemente se dieron a conocer diversas características de la nidada y de las crías (Suárez-Varón, 2017; Suárez-Varón et al., 2019), no hay información disponible del estadio embrionario al momento de la oviposición para esta lagartija. En el presente estudio aportamos información, por primera vez para la familia Corytophanidae, del estadio embrionario en la oviposición de B. vittatus. Este trabajo, a diferencia de estudios previos (Hernández-Gallegos et al., 2011; Manríquez-Morán et al., 2005), incluye un tamaño de muestra significativo. El estadio en la oviposición de B. vittatus podría ser de gran utilidad para entender el papel de la temperatura en el desarrollo embrionario y en la determinación del sexo en B. vittatus.
Materiales y métodos
Se recolectaron hembras grávidas de B. vittatus durante la temporada reproductora de 2019, la cual corresponde a los meses desde abril a julio en la Selva del Marinero localizada en el municipio de Catemaco, Veracruz (18°26’36.3” N, 94°37’81.9” O, 177 m snm) (Suárez-Varón et al., 2019). La captura se llevó a cabo bajo el permiso de colecta científica SEMARNAT-08-043. La zona de estudio presenta selva alta perennifolia como vegetación y un clima cálido-húmedo con una marcada estacionalidad que comprende una estación lluviosa de junio a febrero y un periodo de sequía de marzo a mayo (Ibarra-Manríquez y Sinaca, 1987; Urbina-Cardona et al., 2006). Las hembras fueron capturadas manualmente y, en ocasiones, con una caña de pescar en sitios donde es común observarlas.
La condición reproductora se valoró al recolectar las hembras mediante una palpación abdominal (Cuellar, 1984). A las hembras que presentaron huevos se les registró la fecha de colecta, la longitud hocico-cloaca (LHC; precisión 0.01 mm) y la masa corporal (MC; precisión 0.1 g). Las hembras fueron trasportadas al Laboratorio de Herpetología en la Universidad Autónoma del Estado de México, donde fueron mantenidas individualmente en terrarios de 1 m × 50 cm × 50 cm (largo, ancho y alto), provistos de suelo proveniente del área de estudio y lámparas incandescentes de 75 watts en un extremo del mismo para crear un gradiente térmico entre 20 y 40 °C. Las hembras se alimentaron cada tercer día con larvas de tenebrio (Tenebrio molitor) y se les proporcionó agua ad libitum. Los terrarios se revisaron diariamente cada 3 horas (8:00 a 20:00 h) a través de un orificio lateral que ocultaba la presencia del observador, para determinar la flacidez abdominal de las hembras como señal de oviposición o la observación in situ de los huevos.
Los huevos fueron colectados el día de la oviposición, esta fecha se utilizó para determinar el número de días preoviposición (DPO) como los días transcurridos desde la colecta de la hembra grávida hasta la oviposición de cada hembra. Se tomó un huevo aleatoriamente de cada nidada y se registró su masa (MH), así como largo y ancho máximo (LM y AM, respectivamente) y su volumen al momento de la oviposición (VH) estimado por la ecuación: V = 4/3 π (1/2 LM) (1/2 AM)2. Posteriormente, los huevos fueron fijados en formaldehído (10%) para preparar las muestras y poder determinar el estadio de desarrollo embrionario en la oviposición basados en la tabla de desarrollo embrionario propuesta por Dufaure y Hubert (1961). Adicionalmente, algunos valores de las variables de la masa relativa de la nidada (MRN), AM y LM fueron tomados de Suárez-Varón et al. (2019) y complementados con nueva información generada de las variables medidas en el presente estudio.
Con los datos obtenidos se realizaron pruebas de normalidad para todas las variables y se aplicaron regresiones lineales para comprobar si existe alguna relación entre las características de las hembras (LHC, MC, DPO, MRN) y de los huevos (AM, LM y VH) respecto al estadio embrionario en la oviposición (EO). Por otra parte, se realizó una prueba de Chi cuadrada con la finalidad de determinar si existe un estadio embrionario en la oviposición seleccionado con mayor frecuencia en el proceso de oviposición de B. vittatus (Zar, 1999). Todos los análisis fueron realizados con un alfa de 0.05 en el software SPSS.
Resultados
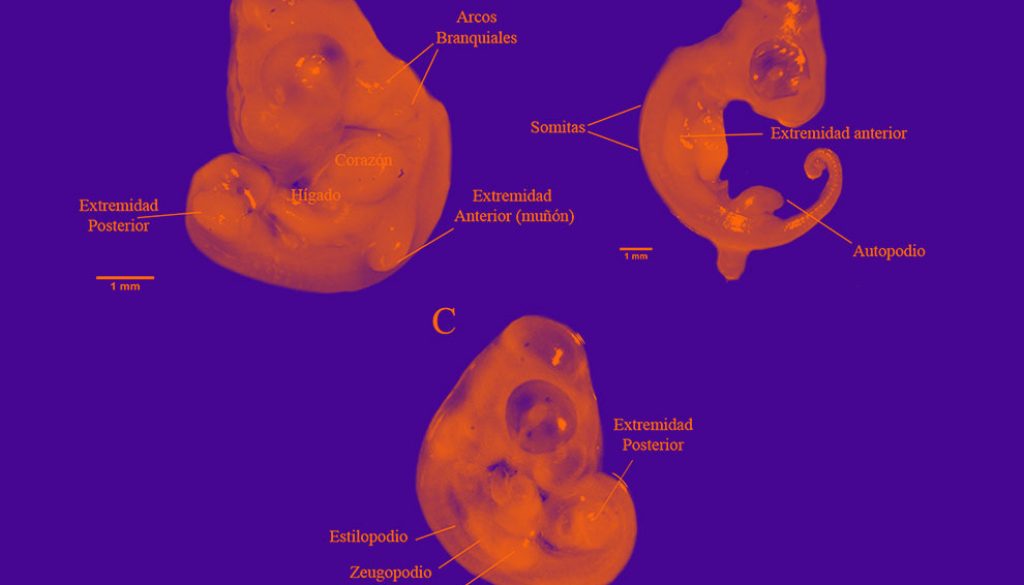
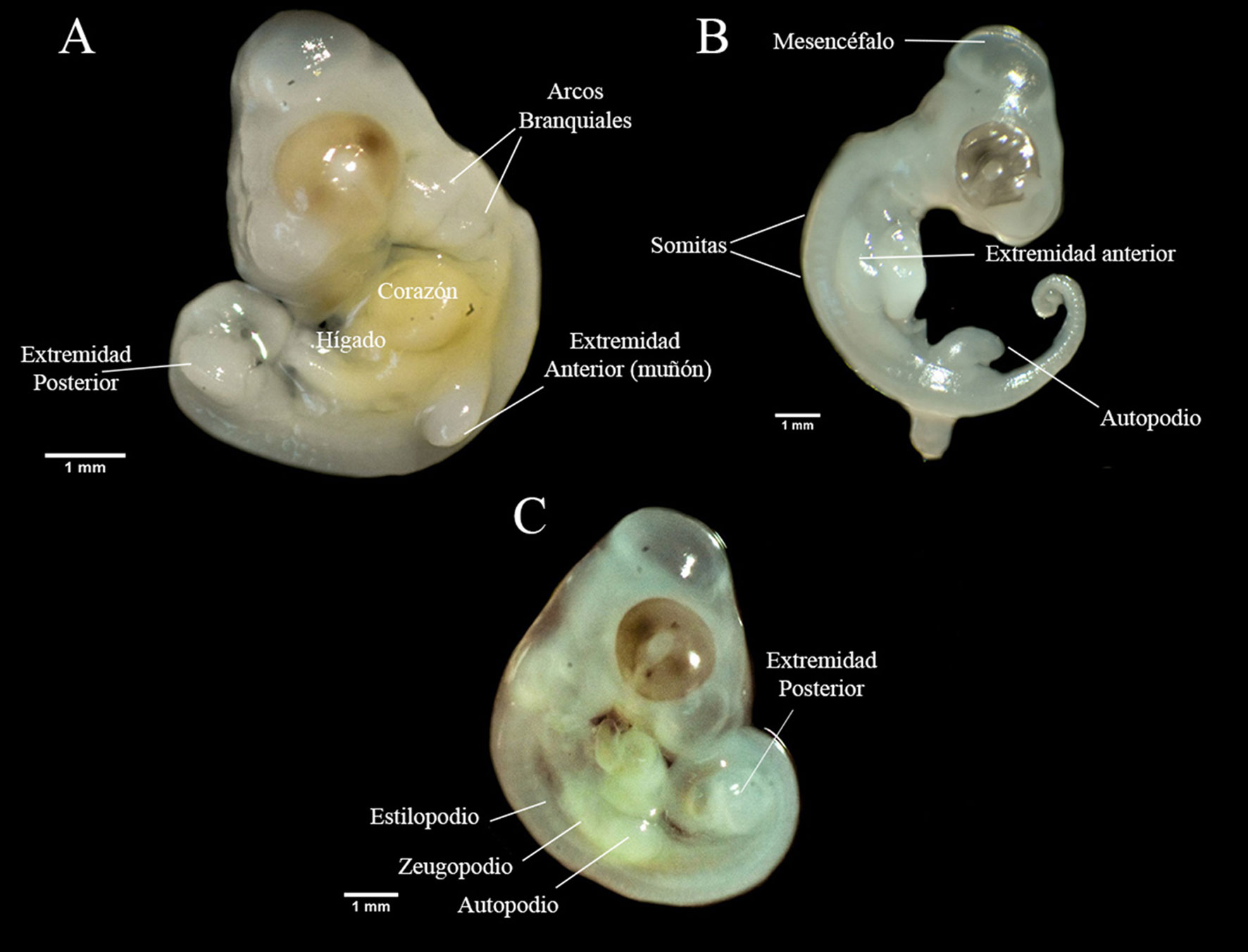
Fueron colectadas un total de 37 hembras grávidas. Los datos sobre su morfología y la de los huevos se muestran en la tabla 1. Los estadios embrionarios en la oviposición de B. vittatus fueron: 29 (n = 3), 30 (n = 14), 31 (n = 14) y 32 (n = 6) con una media que corresponde al estadio 30.6 ± 0.14 EE. Durante el estadio 29 se observó el inicio de la diferenciación de las extremidades con forma de muñón y 40 pares de somitas. Mientras que en el estadio 30 se observó un muñón más desarrollado con una cresta pequeña, ligera pigmentación del ojo y las 5 hendiduras branquiales se encontraron abiertas (fig. 1A). Durante el estadio 31 las extremidades en forma de muñón comenzaron a aplanarse en la zona más distal formando el autopodio, ojos prominentes y más pigmentados (fig. 1B). En el estadio 32 los embriones tenían diferenciados el zeugopodio y estilopodio en las extremidades (fig. 1C).
Tabla 1
Estadística descriptiva de la morfología corporal de las hembras: longitud hocico cloaca (LHC), masa corporal (MC), días preoviposición (DPO), masa relativa de la nidada (MRN) y huevos al momento de la oviposición: estadio embrionario (EO), largo máximo (LM), ancho máximo (AM) y volumen (VH) de Basiliscus vittatus de la Selva del Marinero, Catemaco, Veracruz.
|
Característica |
Media |
EE |
Min |
Max |
CV % |
N |
|
Estadio embrionario |
30.6 |
0.14 |
29 |
32 |
2.8 |
37 |
|
LHC (mm) |
126.9 |
1.2 |
106 |
139.1 |
6.07 |
37 |
|
MC (g) |
57.4 |
1.9 |
37 |
87 |
20.2 |
37 |
|
MRN |
0.18 |
0.006 |
0.06 |
0.27 |
21.8 |
37 |
|
LM (mm) |
19.43 |
0.21 |
16.4 |
22.27 |
6.57 |
37 |
|
AM (mm) |
11.25 |
0.12 |
9.74 |
12.72 |
6.69 |
37 |
|
VH (mm3) |
1,284.22 |
31.6 |
899.17 |
1,745.74 |
14.9 |
37 |
|
DPO |
41.18 |
3.11 |
8.0 |
95.0 |
45.9 |
37 |
La prueba de Chi cuadrada se utilizó para probar el modelo correspondiente a ovipositar en estadios intermedios (30 y 31) o extremos (29 y 32), de acuerdo con los estadios embrionarios obtenidos. Dicha prueba mostró que existe una preferencia por ovipositar en estadios embrionarios intermedios (i.e., 30-31; X2 = 9.7, g.l. = 1, p = 0.001). Adicionalmente, los análisis de regresión lineal señalaron que el estadio embrionario en la oviposición se asocia con el largo máximo del huevo (EO = 23.3864 + 0.372561 * LM, r = 0.54, p = 0.005), pero no con la MRN u otras características (tabla 2), mientras el volumen del huevo se correlaciona positivamente con el ancho máximo (VH = -1172.87 + 219.13 * AM, r = 0.86, p = 0.0001).
Tabla 2
Regresiones lineales entre características de la hembra: longitud hocico cloaca (LHC), masa corporal (MC), días preoviposición (DPO), masa relativa de la nidada (MRN) y de los huevos: largo máximo (LM), ancho máximo (AM) y volumen (VH) del estadio embrionario de Basiliscus vittatus al momento de la oviposición (EO) en la Selva del Marinero, Catemaco, Veracruz.
|
Característica |
r2 |
p |
|
LHC vs EO |
0.97 |
0.56 |
|
MC vs EO |
0.10 |
0.54 |
|
LM vs EO |
0.29 |
0.005 |
|
AM vs EO |
0.01 |
0.94 |
|
VH vs EO |
0.74 |
0.61 |
|
MRN vs EO |
0.07 |
0.871 |
|
DPO vs EO |
0.07 |
0.875 |
Discusión
Si bien, el grado del desarrollo embrionario alcanzado en la oviposición varía entre reptiles, un patrón común para escamados es ovipositar en el estadio 30 (Andrews y Mathies, 2000). Los resultados del presente estudio indican que, aunque el estadio a la oviposición es variable en B. vitattus (29-32), las hembras ovipositan preferencialmente en los estadios 30 y 31. Estos estadios parecen ser un aspecto recurrente en la mayoría de las lagartijas que dejan una nidada anual, como ocurre en Lampropholis delicata (Andrews y Mathies, 2000; Andrews et al., 2017; Shine, 1983). Estadios embrionarios más allá del 32 requieren la capacidad de las hembras para retener sus huevos en el oviducto por largos periodos y, en consecuencia, se esperaría que un estadio embrionario más avanzado al momento de la oviposición sea reflejo de una duración mayor en el tiempo (días) de retención de los huevos en el oviducto (Heulin et al., 2002; Shine, 1983). Los días preoviposición (DPO) no mostraron relación con el estadio embrionario en la oviposición, esto explica que la variación embrionaria es debida a la influencia de factores fisiológicos y ambientales y no al estrés del cautiverio. Y, aunque se ha documentado variación intranidada en algunas especies de lagartijas (Calderón-Espinoza et al., 2006), en B. vittatus la evidencia de 2 nidadas que fueron encontradas en campo (misma zona de estudio) y cuyos embriones se encontraron en el mismo estadio embrionario (n = 5, estadio 38, n = 6, estadio 39, Suárez-Varón, obs. pers.), sugiere que los huevos son ovipositados en el mismo estadio embrionario. De este modo, B. vittatus posee la capacidad de retener huevos más allá de la moda del estadio normal de desarrollo embrionario (30), pero no después del intervalo máximo (32). Esto implica una retención de 14.4 días que corresponden al tiempo del desarrollo embrionario desde el estadio 29 al 32 (Suárez-Varón, datos no publicados) respecto a un nido de reciente oviposición encontrado en campo con una temperatura de 28 °C (Suárez-Varón et al., 2016). Entonces, aunque en esta población es poco probable que las hembras tengan más de una nidada, como sucede en poblaciones de B. vittatus que se distribuyen más al sur y donde las condiciones ecológicas permiten que la reproducción ocurra durante todo el año, la evidencia actual indica que en la población estudiada existe una sola nidada que se extiende de marzo a julio (Hirth, 1963; Suárez-Varón, 2015). Esta característica favorece la presencia de estadios embrionarios en la oviposición que rondan el estadio 30, contrario a aquellas especies con múltiples nidadas por año, donde los huevos pueden ser ovipositados en estadios más tempranos de desarrollo (Andrews y Mathies, 2000).
La oviposición de los huevos en estadios embrionarios más tempranos a los que presenta B. vittatus se ha relacionado con una disminución en los costos asociados al modo de forrajeo activo, ya que, retener por más tiempo los huevos dentro los oviductos representa mayor riesgo de depredación para la hembra e incluso compromete la sobrevivencia de la descendencia (Braña et al., 1991; Vitt y Congdon, 1978; Vitt y Price, 1982). Por ello, probablemente la presión selectiva debió favorecer aquellas especies con forrajeo activo para que desarrollaran una oviposición tan pronto como la formación del cascarón estuviera completa, aunque esto implicara dejar huevos en un estadio embrionario temprano (Mathies y Andrews, 1999). Por ejemplo, como consecuencia de un forrajeo activo, varias especies de teiidos dejan sus huevos más tempranamente que B. vittatus, 21-22 como ocurre en Aspidoscelis uniparens (Billy, 1988), 18 para Aspidoscelis sacki (Hernández-Gallegos et al., 2011), 18 Aspidoscelis costatus costatus (López-Moreno, 2011). Esto es contrario a lo que ocurre en algunas especies con forrajeo pasivo, donde la capacidad de retención embrionaria permite llegar a estadios de desarrollo tardíos (e.g., como sucede en Sceloporus scalaris, 39.5 [Mathies y Andrews, 1996] y Sceloporus aeneus 39 [García-Collazo et al., 2012]).
Por otra parte, el máximo estadio embrionario en la oviposición de B. vittatus debe estar limitado por las demandas de oxígeno del embrión en el oviducto al presentar un estadio mayor de desarrollo, ya que después del estadio 30 comienza una fase de crecimiento exponencial del embrión, durante el cual los tractos reproductores no pueden continuar la embriogénesis como sucede en otras lagartijas (Andrews, 2002; Braña et al., 1991; Shine, 1983). Por lo tanto, se ha sugerido que valores bajos de oxígeno (hipoxia) en los oviductos limitan el intercambio gaseoso; siendo la hipoxia una de las condiciones que mejor explican las limitantes del desarrollo y metabolismo embrionario (Andrews, 2002; Andrews y Mathies, 2000; Rafferty et al., 2013). Además, la concentración de oxígeno en el oviducto también ha sido ligada a temperaturas ambientales que favorecen aquellas especies distribuidas en climas fríos y con forrajeo pasivo (García-Collazo et al., 2012; Mathies y Andrews, 1996). Por lo que, el máximo estadio a la oviposición es producto del tiempo que las hembras pueden retener los huevos dentro el oviducto (Shine y Bull, 1979).
Los análisis de regresión lineal mostraron que un incremento en el largo máximo de los huevos proporciona un desarrollo embrionario más avanzado. Esto implica una distención abdominal de las hembras para permitir el mantenimiento de los huevos durante un lapso mayor que en el caso de B. vittatus, correspondería a máximo 2 estadios embrionarios pasando la fase normal de oviposición. Mientras que el volumen y el ancho máximo permanecen estables dado que no se asociaron con el estadio embrionario en la oviposición, pero sí entre ellas. El aumento en estas características (AM y VH) por la adición de agua y crecimiento del embrión incrementaría los costos (e.g., mortalidad, fisiológicos) relacionados con la retención de huevos, reduciendo así la cantidad y presión del oxígeno disponible e induciendo a la hipoxia (Braña et al., 1991; Rafferty et al., 2013). Parece ser que la morfología de B. vittatus limita el tamaño de los huevos (e.g., especialmente su ancho y volumen), dado que su volumen está en función del ancho máximo; es decir, el ancho máximo limita el incremento del volumen. Como consecuencia, mantener los huevos por más tiempo dificultaría el proceso de oviposición debido a la pequeña apertura cloacal que poseen las hembras (Suárez-Varón et al., 2019).
Un estudio previo ha registrado cómo en B. vittatus la MRN se correlaciona con el tamaño de nidada (media = 6.2 huevos) y cómo el tamaño de la nidada y el volumen de los huevos están limitados por la LHC de las hembras (ver figs. 2, 3 en Suárez-Varón et al. [2019]). En el presente estudio, la ausencia de correlación de la MRN con EO sugiere que la energía que las hembras destinan a la reproducción no influye sobre el estadio embrionario en la oviposición, contrario a los hallazgos en diferentes especies de Lacerta, donde valores mayores en MRN corresponden a estadios embrionarios más avanzados (Braña et al., 1991). Además, las limitaciones impuestas en el volumen y ancho máximo de los huevos son un indicativo de que el crecimiento, tamaño del huevo, y por tanto, el estadio embrionario en la oviposición, son limitados por la morfología corporal de las hembras y los requerimientos fisiológicos dentro de los oviductos para continuar el desarrollo embrionario (Andrews, 2002).
Adicionalmente, características como la velocidad de escape, las tasas de depredación y las conductas asociadas al forrajeo pasivo reflejarían altos valores en la MRN y, por tanto, la capacidad de una mayor retención embrionaria (Braña et al., 1991; Vitt y Price, 1982). Estas condiciones favorecerían encontrar estadios en la oviposición avanzados en el desarrollo embrionario, contrario a lo que ocurre con B. vittatus y en la mayoría de las especies, que no muestran una prolongada retención embrionaria.
La familia Corytophanidae incluye 3 géneros, Corytophanes + Laemanctus y Basiliscus como el género hermano, siendo Corytophanes percarinatus la única especie vivípara dentro del género y la familia (Townsend et al., 2004; Vieira et al., 2005). La viviparidad en C. percarinatus podría ser una adaptación a las deficiencias térmicas de las zonas frías con alta elevación y latitud donde habita (McCoy, 1968; Townsend et al., 2004), así como se ha sugerido para algunas especies del género Sceloporus (Mathies y Andrews, 1995; Andrews, 2000). La divergencia entre Corytophanes + Laemanctus y Basiliscus se estima que ocurrió hace 61.7 millones de años, quedando el género Basiliscus filogenéticamente alejado de C. percarinatus (Taylor et al., 2017). Son necesarios más estudios que involucren información sobre características de la historia de vida y particularmente del estadio en la oviposición de la familia Corytophanidae, ello para inferir la evolución de la viviparidad en la familia.
La variación en el estadio embrionario en la oviposición puede estar moldeada por características de historia de vida que promueven ventajas selectivas a las hembras para modificar el momento de la oviposición y, por tanto, del desarrollo embrionario al responder a fluctuaciones ambientales y fisiológicas (Andrews y Mathies, 2000; Rafferty y Reina, 2012). Es importante conocer el estado embrionario en la oviposición de B. vittatus, ya que permite completar huecos dentro de su historia natural, además, permite entender mejor si la temperatura de incubación afecta la proporción de sexos (Suárez-Varón, 2017), puesto que nidadas de B. vittatus incubadas a 28 °C dieron como resultado 100% de hembras (Suárez-Varón, datos no publicados); mientras que Acosta et al. (2019), descubrieron un nuevo sistema cromosómico XY en la especie. Estos hallazgos podrían indicar que, a pesar de que B. vittatus es una especie con presencia de cromosomas sexuales, la temperatura de incubación podría estar anulando el sistema cromosómico sesgando las proporciones sexuales como ocurre en Pogona vitticeps (Holleley et al., 2015). Entonces, estudiar el estadio en la oviposición permite ver los efectos directos que produce la temperatura sobre el desarrollo embrionario y en el mecanismo de determinación sexual de la especie.
En conclusión, tanto los aspectos morfológicos como los fisiológicos, así como la posible influencia del modo de forrajeo, aparentemente determinan el estadio en la oviposición en aquellas especies donde la retención embrionaria no ha sido favorecida. Adicionalmente, es necesario realizar comparaciones de este estudio con poblaciones de B. vittatus que presentan nidadas múltiples, donde se esperarían estadios embrionarios en la oviposición más tempranos. Son necesarios más esfuerzos para conocer esta característica y generar mejores aproximaciones de las variaciones y factores que afectan el estadio embrionario en la oviposición en lagartijas.
Agradecimientos
A la comunidad de la Selva del Marinero por su hospitalidad y asistencia en campo. A Justin L. Rheubert por su ayuda con la traducción del abstract.
Referencias
Acosta, A., Suárez-Varón, G., Rodríguez-Miranda, L. A., Lira-Noriega, A., Aguilar-Gómez, D., Gutiérrez-Mariscal, M. et al. (2019). Corytophanids replaced the Pleurodont XY system with a new pair of XY chromosomes. Genome Biology and Evolution, 11, 2666–2677. https://doi.org/10.1093/gbe/evz196
Andrews, R. M. (1997). Evolution of viviparity: variation between two sceloporine lizards in the ability to extend egg retention. Journal of Zoology, 243, 579–595. https://doi.org/10.1111/j.1469-7998.1997.tb02803.x
Andrews, R. M. (2000). Evolution of viviparity in squamate reptiles (Sceloporus spp.): a variant of the cold-climate model. Journal of Zoology, 250, 243–253. https://doi.org/10.1111/j.1469-7998.2000.tb01075.x
Andrews, R. M. (2002). Low oxygen: a constraint on the evolution of viviparity in reptiles. Physiological and Biochemical Zoology, 75, 145–154. https://doi.org/10.1086/339388
Andrews, R. M. (2004). Patterns of embryonic development. En D. C. Deeming (Ed.), Reptilian incubation environment, evolution and behaviour (pp. 75–102). Nottingham, UK: Nottingham University Press.
Andrews, R. M., Brandley, M. C. y Greene, V. W. (2013). Developmental sequences of squamate reptiles are taxon specific. Evolution and Development, 15, 326–343. https://doi.org/10.1111/ede.12042
Andrews, R. M., Díaz-Paniagua, C., Marco, A. y Portheault, A. (2008). Developmental arrest during embryonic development of the common chameleon (Chamaeleo chamaeleon) in Spain. Physiological and Biochemical Zoology, 81, 336–344. https://doi.org/10.1086/529449
Andrews, R. M. y Mathies, T. (2000). Natural history of reptilian development: constraints on the evolution of viviparity. Bioscience, 50, 227–238. https://doi.org/10.1641/0006-3568(2000)050[0227:NHORDC]2.3.CO;2
Andrews, R. M., Pezaro, N., Doody, J. S., Guarino, F. y Green, B. (2017). Oviposition to hatching: Development of Varanus rosenbergi. Journal of Herpetology, 51, 396–401. https://doi.org/10.1670/16-124
Andrews, R. M. y Rose, B. R. (1994). Evolution of viviparity: constraints on egg retention. Physiological Zoology, 67, 1006–1024. https://doi.org/10.1086/physzool.67.4.30163876
Billy, A. (1988). Observations on the embryology of the unisexual lizard Cnemidophorus uniparens (Teiidae). The Zoological Society of London, 215, 55–81. https://doi.org/10.1111/j.1469-7998.1988.tb04885.x
Blanc, F. (1974). Table de développement de Chamaeleo lateralis Gray, 1831. Annales D´Embryologie et de Morphogenese, 7, 99–115.
Braña, F., Bea, A. y Arrayago, M. J. (1991). Egg retention in lacertid lizards: relationships with reproductive ecology and the evolution of viviparity. Herpetologica, 47, 218–226.
Calderón-Espinosa, M. L., Andrews, R. M. y Méndez-De la Cruz, F. (2006). Evolution of egg retention in the Sceloporus spinosus group: exploring the role of physiological, environmental, and phylogenetic factors. Herpetological Monographs, 20, 147–158. https://doi.org/10.1655/0733-1347(2007)20[147:EOERIT]2.0.CO;2
Cooper, W., Castañeda, G., García-De la Peña, C., Wilson, B., Caldwell, J. y Vitt, L. (2013). Foraging modes of some Jamaican, Costa Rican, and Mexican lizards. Herpetology Notes, 6, 591–597.
Cuellar, O. (1984). Reproduction in a parthenogenetic lizard: with a discussion of optimal clutch size and a critique of the clutch weight/body weight ratio. The American Midland Naturalist, 111, 242–258. https://doi.org/10.2307/2425319
DeMarco, V. (1993). Estimating egg retention times in sceloporine lizards. Journal of Herpetology, 27, 453–458. https://doi.org/10.2307/1564836
Dufaure, J. P. y Hubert, J. (1961). Table de développment du lézard vivipare: Lacerta (Zootoca) vivipara Jacquin. Archives Anatomie Microscopie Morphologie Expérimental, 50, 309–328.
Ewert, M. A. (1985). Embryology of turtles. En C. Gans, F. Billett y P. F. A. Maderson (Eds.), Biology of the Reptilia, Vol. 14, Development A (pp. 75–267). New York: John Wiley and Sons.
Ferguson, M. W. J. (1985). Reproductive biology and embryology of the crocodilians. En C. Gans, F. Billett y P. F. A. Maderson (Eds.), Biology of the Reptilia, Vol. 14, Development A (pp. 329–491). New York: John Wiley and Sons.
García-Collazo, R., Villagrán-Santa Cruz, M., Morales-Guillaumin, E., Meza-Lázaro, R. N. y Méndez-de la Cruz, F. R. (2012). Egg retention and intrauterine embryonic development in Sceloporus aeneus (Reptilia: Phrynosomatidae): implications for the evolution of viviparity. Revista Mexicana de Biodiversidad, 83, 802–808. http://dx.doi.org/10.7550/rmb.33595
Granados-González, G., Pérez-Almazán, C., Gómez-Benitez, A., Walker, J. y Hernández-Gallegos, O. (2020). Aspidoscelis costatus costatus (Squamata, Teiidae): high elevation clutch production for a population of a whiptail lizards. Herpetozoa, 33, 131–137. https://doi.org/10.3897/herpetozoa.33.e54901
Hernández-Gallegos, O., Pérez-Almazán, C., López-Moreno, A. E., Granados-González, G. y Walker, J. (2011). Aspidoscelis sacki (Sack’s Spotted Whiptail). Reproduction. Herpetological Review, 42, 428.
Heulin, B., Ghielmi, S., Vogrin, N., Surget-Groba, Y. y Guillaume, C. P. (2002). Variation in eggshell characteristics and in intrauterine egg retention between two oviparous clades of the lizard Lacerta vivipara: insight into the oviparity-viviparity continuum in squamates. Journal of Morphology, 252, 255–262. https://doi.org/10.1002/jmor.1103
Hirth, H. F. (1963). The ecology of two lizards on a tropical beach. Ecological Monographs, 33, 83–112. https://doi.org/10.2307/1948557
Holleley, C., O´Meally, D., Sarre, S., Marshall-Graves, J., Ezaz, T., Matsubara, K. et al. (2015). Sex reversal triggers the rapid transition from genetic to temperature-dependent sex. Nature, 523, 79–82. https://doi.org/10.1038/nature14574
Hopwood, N. (2007). A history of normal plates, tables and stages in vertebrate embryology. The International Journal of Developmental Biology, 51, 1–26. https://doi.org/10.1387/ijdb.062189nh
Ibarra-Manríquez, G. y Sinaca, C. (1987). Listado florístico de México VII, de la estación de Biología Tropical “Los Tuxtlas”. México D.F.: Instituto de Biología, UNAM.
López-Moreno, A. E. (2011). Efecto de la temperatura de incubación sobre el fenotipo de Aspidoscelis costata costata (Squamata: Teiidae) (Tesis de maestría). Facultad de Ciencias. Universidad Autónoma del Estado de México. Toluca, México.
Manríquez-Morán, N. L., Villagrán-Santa Cruz, M. y Méndez-De la Cruz, F. (2005). Reproductive biology of the parthenogenetic lizard, Aspidoscelis cozumela. Herpetologica, 61, 435–439. https://doi.org/10.1655/04-41.1
Masson, G. R. y Guillette, L. J. Jr. (1987). Changes in oviductal vascularity during the reproductive cycle of three oviparous lizards (Eumeces obsoletus, Sceloporus undulatus and Crotaphytus collaris). Journal of Reproduction and Fertility, 80, 361–372. https://doi.org/10.1530/jrf.0.0800361
Mathies, T. y Andrews, R. M. (1995). Thermal and reproductive biology of high and low elevation populations of the lizard Sceloporus scalaris: implications for the evolution of viviparity. Oecologia, 104, 101–111. https://doi.org/10.1007/BF00365568
Mathies, T. y Andrews, R. M. (1996). Extended egg retention and its influence on embryonic development and egg water balance: Implications for the evolution of viviparity. Physiological Zoology, 69, 1021–1035. https://doi.org/10.1086/physzool.69.5.30164244
Mathies, T. y Andrews, R. M. (1999). Determinants of embryonic stage at oviposition in the lizard Urosaurus ornatus. Physiological and Biochemical Zoology, 72, 645–655. https://doi.org/10.1086/316707
McCoy, C. J. (1968). Reproductive cycles and viviparity in Guatemalan Corytophanes percarinatus (Reptilia: Iguanidae). Herpetologica, 24, 175–178.
Meza-Lázaro, R. N. (2004). Reconstrucción de la evolución de la viviparidad en el género Sceloporus: evaluación de los estadios a la oviposición y del grosor del cascarón (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. México D. F.
Moffat, L. A. (1985). Embryonic development and aspects of reproductive biology in the tuatara, Sphenodon punctatus. En C. Gans, F. Billett y P. F. A. Maderson (Eds.), Biology of the Reptilia, Vol. 14, Development A (pp. 493–521). New York: John Wiley and Sons. https://doi.org/10.2307/2409155
Packard, M. y DeMarco, V. (1991). Eggshell structure and formation in eggs of oviparous reptiles. En D. C. Deeming y M. Ferguson (Eds.), Egg incubation: its effects on embryonic development in birds and reptiles (pp. 53–69). Cambridge: Cambridge University Press. https://doi.org/10.1017/CBO9780511585739.006
Py-Daniel, T. R., Soares-de Lima, A. K., Campos-Lima, F., Pic-Taylor, A., Pires-Junior, O. R. y Sebben, A. (2017). A staging table of post-ovipositional development for the south American collared lizard Tropidurus torquatus (Squamata: Tropiduridae). The Anatomical Record, 300, 277–290. https://doi.org/10.1002/ar.23500
Qualls, C. P., Andrews, R. M. y Mathies, T. (1997). The evolution of viviparity and placentation revisited. Journal of Theoretical Biology, 185, 129–135. https://doi.org/10.1006/jtbi.1996.0294
Rafferty, A. R., Evans, R. G., Scheelings, T. y Reina, R. (2013). Limited oxygen availability in utero may constrain the evolution of live birth in reptiles. The American Naturalist, 181, 245–253. https://doi.org/10.1086/668827
Rafferty, A. R. y Reina, R. D. (2012). Arrested embryonic development: a review of strategies to delay hatching in egg-laying reptiles. Proceedings of the Royal Society B, 279, 2299–2308. https://doi.org/10.1098/rspb.2012.0100
Rodríguez-Díaz, T. y Braña, F. (2012). Altitudinal variation in egg retention and rates of embryonic development in oviparous Zootoca vivipara fits predictions from de cold-climate model on the evolution of viviparity. Journal of Evolutionary Biology, 25, 1877–1887. https://doi.org/10.1111/j.1420-9101.2012.02575.x
Shine, R. (1983). Reptilian reproductive modes: the oviparity-viviparity continuum. Herpetologica, 39, 1–8.
Shine, R. y Bull, J. (1979). The evolution of live-bearing in lizards and snakes. The American Naturalist, 113, 905–923. https://doi.org/10.1086/283444
Sinervo, B. y Licht, P. (1991). Proximate constraints on the evolution of egg size, number, and total clutch mass in lizards. Science, 252, 1300–1302. https://doi.org/10.1126/science.252.5010.1300
Smith, C., Telemeco, C. R., Angilletta, M. y VandenBrooks, J. M. (2015). Oxygen supply limits the heat tolerance of lizard embryos. Biology Letters, 11, 20150113. https://doi.org/10.1098/rsbl.2015.0113
Suárez-Varón, G. (2015). Ecología de Basiliscus vittatus (Squamata, Corytophanidae): estructura poblacional y proporción sexual (Tesis). Facultad de Ciencias, Universidad Autónoma del Estado de México. Toluca, México.
Suárez-Varón, G. (2017). Características de la nidada y de las crías de Basiliscus vittatus (Squamata: Corytophanidae) (Tesis de maestría). Facultad de Ciencias, Universidad Autónoma del Estado de México. Toluca, México.
Suárez-Varón, G., Suárez-Rodríguez, O., Granados-González, G., Villagrán-Santa Cruz, M., Gribbins, K. M., Cortez-Quezada, D. et al. (2019). Relative clutch mass of Basiliscus vittatus Wiegmann, 1828 (Squamata, Corytophanidae): female morphological constraints. Herpetozoa, 32, 211–219. https://doi.org/10.3897/herpetozoa.32.e35910
Suárez-Varón, G., Suárez-Rodríguez, O., Gribbins, K. M. y Hernández-Gallegos, O. (2016). Basiliscus vittatus. oviposition site. Mesoamerican Herpetology, 3, 1006–1007.
Taylor, G., Santos, J., Perrault, B., Morando, M., Vásquez-Almazán, C. y Sites, J. (2017). Sexual dimorphism, phenotypic integration, and the evolution of head structure in casque-headed lizards. Ecology and Evolution, 7, 8989–8998. https://doi.org/10.1002/ece3.3356
Townsend, J. H., McCranie, J. y Wilson, L. (2004). Corytophanes percarinatus. Catalogue of American Amphibians and Reptiles, 791, 1–3.
Uetz, P., Freed, P. y Hošek, J. (2021). The Reptile Database. Recuperado el 19 febrero, 2021 de: http://www.reptile-database.org.
Urbina-Cardona, J. N., Olivares-Pérez, M. y Reynoso, V. H. (2006). Herpetofauna diversity and microenvironment correlates across a pasture-edge-interior ecotone in tropical rainforest fragments in the Los Tuxtlas Biosphere Reserve of Veracruz, México. Biological Conservation, 132, 61–75. https://doi.org/10.1016/j.biocon.2006.03.014
Vieira, G., Colli, G. y Báo, S. (2005). Phylogenetic relationships of corytophanid lizards (Iguania, Squamata, Reptilia) based on a partitioned and total evidence analyses of sperm morphology, gross morphology, and DNA data. Zoologica Scripta, 34, 605–625. https://doi.org/10.1111/j.1463-6409.2005.00208.x
Vitt, L. J. y Congdon, J. D. (1978). Body shape, reproductive effort and relative clutch mass in lizards: resolution of a paradox. The American Naturalist, 112, 595–608.
Vitt, L. J. y Price, H. J. (1982). Ecological and evolutionary determinants of relative clutch mass in lizards. Herpetologica, 38, 237–255.
Woolrich-Piña, G., Smith, G., Lemos-Espinal, J. A., Márquez-Guerra, S., Alvarado-Hernández, A. y García-Montiel, J. (2020). Ecology of Xenosaurus fractus (Squamata: Xenosauridae) from Sierra Nororiental, Puebla, México. Current Herpetology, 39, 1–12. https://doi.org/10.5358/hsj.39.1
Zar, J. H. (1999). Biostatistical analysis. Prentice Hall, New Jersey.