Felipe de Jesús Rodríguez-Romero a, *, Sandra Galindo-Gil a y Ruth Moreno-Barajas b
a Universidad Autónoma del Estado de México, Facultad de Ciencias, El Cerrillo Piedras Blancas, Carretera Toluca-Ixtlahuaca Km. 15.5, 50200 Toluca, Estado de México, México
b Universidad Autónoma del Estado de México, Facultad de Planeación Urbana y Regional, Mariano Matamoros casi esquina con Av. Paseo Tollocan, 50130 Toluca, Estado de México, México
*Autor para correspondencia: fjrr@uaemex.mx (F.J. Rodríguez-Romero)
Recibido: 8 abril 2021; aceptado: 11 agosto 2022
Resumen
Sceloporus aeneus y Sceloporus bicanthalis son especies de reciente evolución, similares en morfología e historia de vida, pero difieren en el modo reproductor y número de escamas cantales. Sin embargo, este último carácter es altamente variable y es el único, a una escala morfológica, que se ha usado hasta la fecha para diferenciarlas. En el presente trabajo se analizó el grado de variación morfológica de las escamas cefálicas, mediante morfometría geométrica y estadística multivariada, para determinar si el uso de estos métodos permite separar con mayor precisión ambas especies. Para ello, se utilizaron fotografías digitales de S. aeneus y S. bicanthalis y se colocaron marcas en escamas de la región dorsal, ventral y lateral de la cabeza. Los resultados muestran diferencias significativas en la forma de las escamas entre ambas especies para todas las vistas, de manera que cada especie presenta un morfotipo definido en lo que respecta a la escutelación del cráneo. El análisis sugiere que ambas especies pueden ser identificadas mediante variaciones en la forma de las escamas parietal e interparietal y no por el número de escamas cantales.
Palabras clave: Escutelación craneal; Squamata; Escamas cantales; Especies hermanas; Alta montaña
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Morphological variation of the cephalic scales in Sceloporus aeneus and Sceloporus bicanthalis: species separation by geometric morphometry
Abstract
Sceloporus aeneus and Sceloporus bicanthalis have recently been split into different species, they are similar in morphology and life history but differ in reproductive mode and number of canthal scales. However, this last character is highly variable, but it is the only morphological character that is currently used to differentiate them. In the present work, the degree of morphological variation of the cephalic scales was analyzed, using geometric morphometry and multivariate statistics to determine if the use of these methods allows differentiating both species. Digital photographs of S. aeneus and S. bicanthalis were used and scale marks were placed on the dorsal, ventral and lateral region of the head. The results show significant differences in the shape of the scales between the 2 species. Therefore, each species presents a defined morphotype in terms of skull scutellation. The analysis suggests that both species can be more reliably identified by variations in the shape of the parietal and interparietal scales than by the number of canthal scales.
Keywords: Cranial scutellation; Squamata; Canthal scales; Sister species; High mountains
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
La clasificación taxonómica de los organismos y el entendimiento de la diversidad biológica se apoyan en descripciones morfológicas (Adams et al., 2004). Tradicionalmente, los estudios morfométricos se basaron en el análisis de variables lineales cuantitativas tales como ancho, longitud y altura del cuerpo (Zelditch et al., 2004). Después surgieron nuevos estudios denominados como “morfometría geométrica”, que es definida como la fusión entre la geometría y la biología, y comprende el estudio de la forma en un espacio bi o tridimensional permitiendo investigar a detalle los cambios morfológicos de los organismos (Bookstein, 1982). La investigación de caracteres morfológicos mediante el uso de información geométrica y su análisis por métodos estadísticos constituyen una herramienta muy robusta, principalmente cuando se utilizan métodos multivariados que permiten realizar mapas homólogos y apreciaciones de formas, sujetas a modificaciones que pueden conducir a diferencias, inclusive, a nivel de separación de especies en los grupos a estudiar (González et al., 2007; Malhotra et al., 2004).
Sceloporus aeneus y Sceloporus bicanthalis son especies semélparas (Rodríguez-Romero, 2004), de reciente evolución (Benabib et al., 1997; Wiens y Reeder, 1997), son similares en la forma del cuerpo, tipo de forrajeo, dieta, patrones de actividad, requerimientos térmicos y comportamiento termorregulador (Andrews et al., 1999), pero difieren en el modo reproductor, ya que S. aeneus es ovípara y S. bicanthalis es vivípara (Davis y Smith, 1953; Guillette, 1981), así como en la presencia de 1 y 2 pares de escamas cantales, respectivamente (Smith, 1937, 1939; Smith y Taylor, 1950).
Otro factor importante de considerar es que el intervalo de distribución altitudinal de S. aeneus y S. bicanthalis se solapa en algunas cotas de elevación en diferentes zonas geográficas, ya que la especie vivípara se restringe al intervalo vertical comprendido entre los 1,600 a 4,500 m snm; no obstante, se reconocen otras poblaciones de esta especie vivípara en elevaciones menores (Chávez-León y Lemos-Espinal, 2021), mientras que la especie ovípara se encuentra entre los 1,858 y los 4,000 m snm (Chávez-León y Lemos-Espinal, 2021; Meza, 2007; Sinervo et al., 2010).
Sceloporus aeneus se localiza en una gran variedad de hábitats como los bosques de pino, pastizales, áreas rocosas y grietas de rocas a nivel de piso, además está presente en hábitats modificados como zonas agrícolas y pastizales inducidos. Mientras que S. bicanthalis, se puede observar en hábitats primarios, se encuentra asociada a los ambientes con pastos amacoyados o pastizales en combinación con bosques de pino abiertos y ausente en zonas perturbadas (Canseco-Márquez y Gutierrez-Mayen, 2010).
Por varias décadas, las características morfológicas que definen a S. aeneus y S. bicanthalis han sido objeto de discusión. Smith (1939) realizó una comparación con respecto a caracteres morfológicos de estas 2 especies, por ejemplo, el número de escamas cantales, el número de escamas frontoparietales, la proporción tibia-cabeza y coloración de la región gular, concluyendo que ambas especies son muy similares morfológicamente. Por otra parte, un estudio realizado por Davis y Smith (1953), determinó que S. aeneus es ovípara y que S. bicanthalis es vivípara, con lo cual se propuso que el modo de paridad es una de las características que separan ambas especies. Posteriormente, Guillette (1981) realizó un estudio de la anatomía y ciclo reproductor de estas 2 especies, en donde detalla la morfología de oviductos y ovarios, además de la vascularidad de los oviductos, con lo que confirma la propuesta de Davis y Smith (1953).
Por otra parte, Thomas y Dixon (1976), y posteriormente Guillette y Jones (1985), al realizar estudios morfológicos de escamas cantales y de patrones de coloración, coincidieron en que el número de escamas cantales y el modo de paridad son caracteres que separaban a las especies con una certeza de 100%. Sin embargo, el patrón de la coloración de la garganta para su diagnóstico muestra solo 90% de confiabilidad. Por el contrario, Sites et al. (1992) mencionan que la única diferencia morfológica entre S. aeneus y S. bicanthalis es la presencia de 1 o 2 escamas cantales; aunque este carácter no es confiable en todas las poblaciones que examinaron, a pesar de que son relativamente consistentes en algunas de ellas, sus resultados indican que no deberían ser consideradas como un carácter sistemático que define a dichas especies. Aunado a lo anterior, un estudio ecomorfológico realizado con morfometría lineal, demuestra que no existen diferencias significativas entre las medidas de longitud de la cabeza de S. aeneus y de S. bicanthalis, así como tampoco en el número de escamas cantales en las poblaciones del Nevado de Toluca que se analizaron (Ríos-Rodas y Rodríguez-Romero, 2008).
Las escamas en reptiles son caracteres que comúnmente se miden y se reportan para propósitos taxonómicos, y en particular, las escamas cefálicas se utilizan como indicadores de la morfología cefálica, ya que abarcan toda la superficie externa de la cabeza (Bruner et al., 2005). Además de lo anterior, algunos estudios recientes en lacértidos europeos han registrado una alta variación en las escamas frontales, parietales e interparietales, asociada a la morfogénesis del cráneo en la sutura frontoparietal y en la musculatura parietooccipital, que participan principalmente en la dieta y en el comportamiento social (Bruner y Constantini, 2007, 2009), y en algunos casos reflejan dimorfismo sexual (Bruner et al., 2005; Kaliontzopoulou et al., 2007).
El objetivo del presente estudio fue analizar la forma de las escamas cefálicas de ambas especies mediante el uso de la morfometría geométrica, para indicar si la morfología de las escamas puede ser usada como un nuevo carácter diagnóstico para separar a las especies. Además, se analizó el número de escamas cantales en un número mayor de poblaciones a las de estudios previos, para definir si es el principal caracter de diagnosis en estas 2 especies, tal como se sugiere en la literatura.
Materiales y métodos
Los ejemplares utilizados para este estudio fueron depositados en la Colección de Anfibios y Reptiles del Estado de México (CAREM en trámite de registro) de la Facultad de Ciencias de la Universidad Autónoma del Estado de México. Se seleccionaron únicamente organismos adultos, de ambos sexos, con longitud hocico cloaca (LHC) a partir de 39 mm en hembras y 37 mm en machos, para la especie ovípara; a partir de 31 mm de LHC en hembras y 32 mm en machos en la especie vivípara (Rodríguez-Romero, 2004).
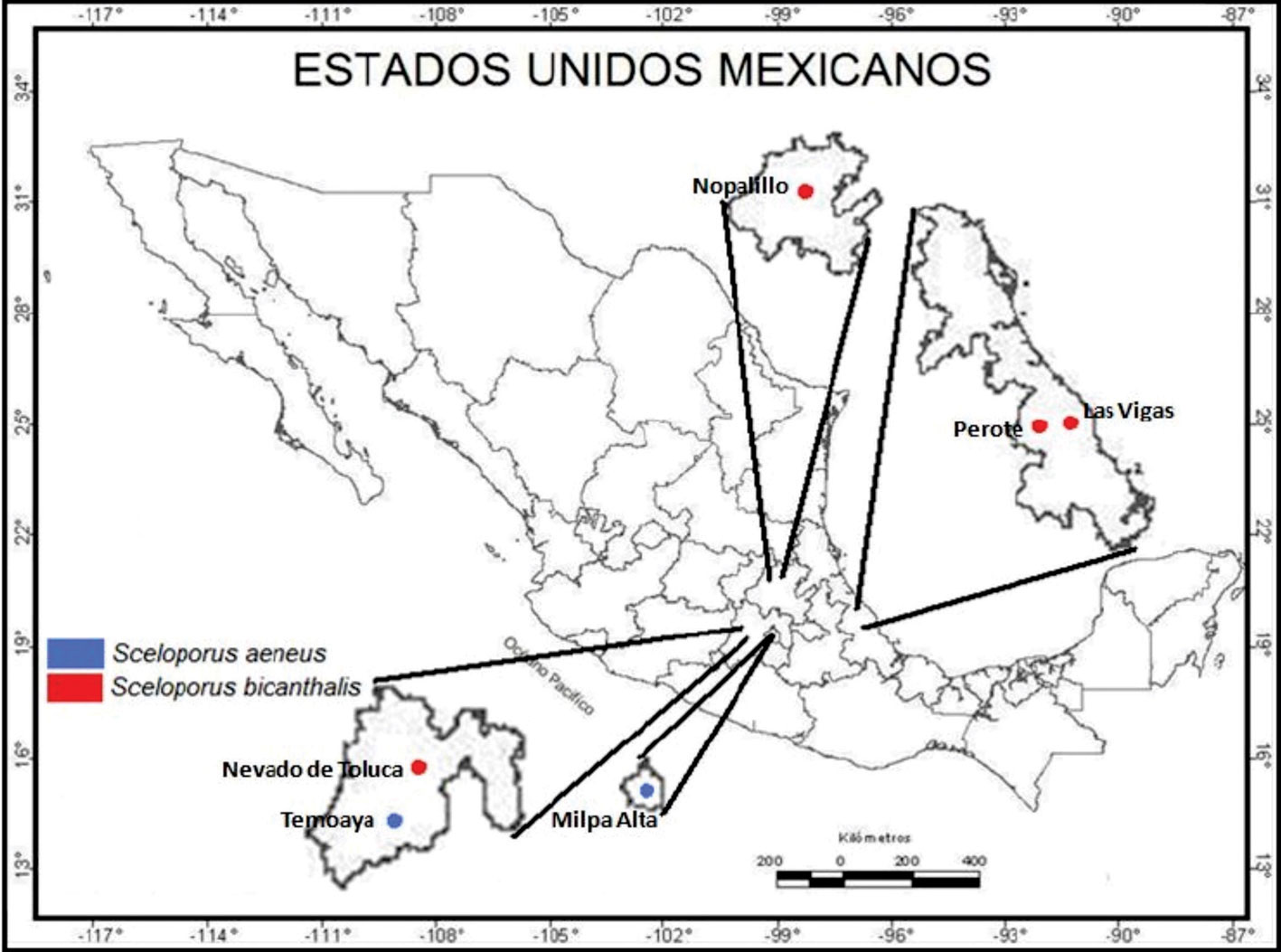
Se utilizaron en total 84 individuos, de los cuales 28 pertenecen a S. aeneus de 2 localidades: Milpa Alta en la Ciudad de México y Temoaya en el Estado de México. En tanto que 56 organismos corresponden a S. bicanthalis con 4 poblaciones: Nevado de Toluca en el Estado de México, Nopalillo en Hidalgo, y Las Vigas y Perote en Veracruz (fig. 1). Para este estudio, sólo se utilizaron individuos adultos de ambos sexos por localidad.
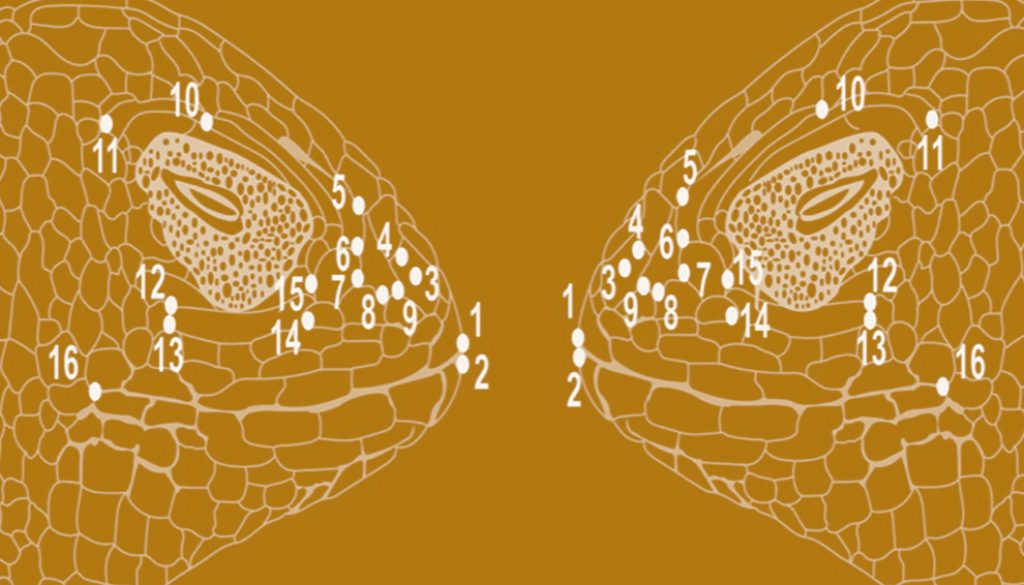
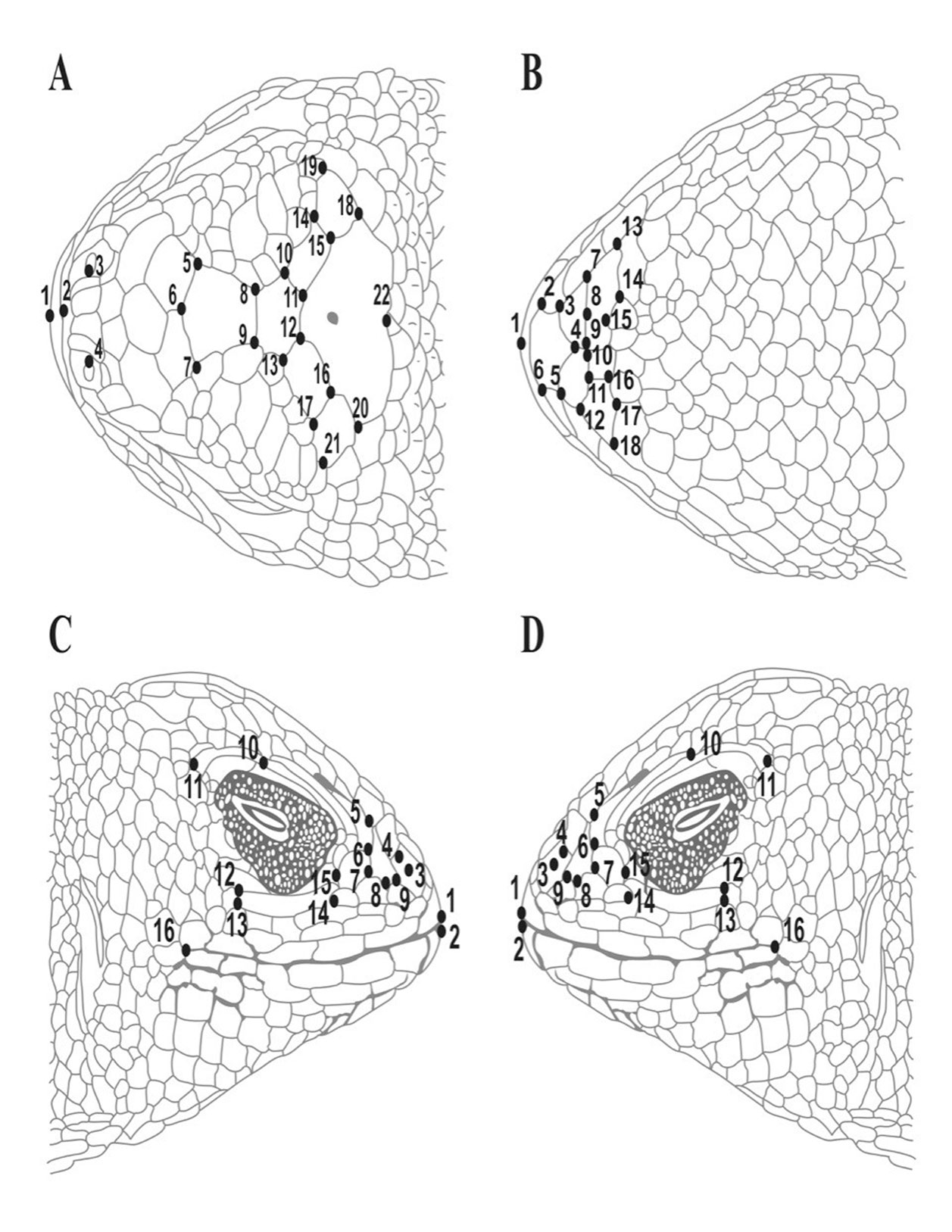
El área cefálica de cada organismo fue fotografiada utilizando el mismo procedimiento para todos, con una cámara digital (Sony DSLR-α350, resolución 14 MP) colocada a 20 cm de altura de la muestra, usando un tripié, y una escala milimétrica (0.1 mm) de referencia. Se digitalizaron 26, 18 y 16 marcas anatómicas bidimensionales y homólogas en las escamas localizadas en vistas dorsal, ventral y lateral (derecho e izquierdo) (Bookstein, 1982), respectivamente, usando para ello tpsUtil y tpsDig 2.15 (Rohlf, 2010; fig. 2, tabla 1). Las coordenadas “x” e “y” de las marcas de cada especie fueron alineadas mediante la superimposición de procrustes (Rohlf, 1999), utilizando el módulo CoordGen6f (Sheets, 2001) incluido en la paquetería Integrated Morphometrics Package (IMP). Este método elimina los efectos de escala, orientación y posición al realizar una serie de ajustes de tamaño, de desplazamientos y de rotaciones algebraicas, de tal manera que permanece la configuración de la forma de las estructuras. Esta información se representa por variables continuas que son utilizadas para comparar grupos de individuos mediante estadística multivariada (Zelditch et al., 2004).
Para evaluar el porcentaje de variación en la forma de las escamas de la cabeza entre S. aeneus y S. bicanthalis se realizó un análisis de componentes principales (ACP) sobre las coordenadas procrustes (PCAGen6n, IMP). Posteriormente, se obtuvo la placa fina de deformación de cada especie mediante el análisis Thin Plate Spline, utilizando el mismo módulo del software IMP (Sheets, 2001).
Las comparaciones entre poblaciones, se realizaron visualmente mediante análisis de variables canónicas al detectar las agrupaciones de individuos en el espacio multivariado de la figura resultante. Este análisis además provee funciones discriminantes que a posteriori permiten clasificar especímenes desconocidos o individuos imposibles de identificar confiadamente con las claves taxonómicas convencionales. Expuesto lo anterior, un análisis de variables canónicas (CVA, por sus siglas en inglés) fue empleado para discriminar ambas especies en función de la forma de las escamas cefálicas, utilizando el módulo CVAGen6 (IMP; Sheets, 2001). Finalmente, para evaluar si las diferencias encontradas son significativas entre los morfotipos, se realizó la comparación de las 2 especies con el módulo TwoGroupeh (IMP). En todas las pruebas estadísticas se utilizó un nivel de significancia de 0.05. Con respecto a los caracteres merísticos de la escutelación, se realizó el conteo de las escamas cantales con la ayuda de las fotografías digitales en su vista lateral derecha e izquierda.
Resultados
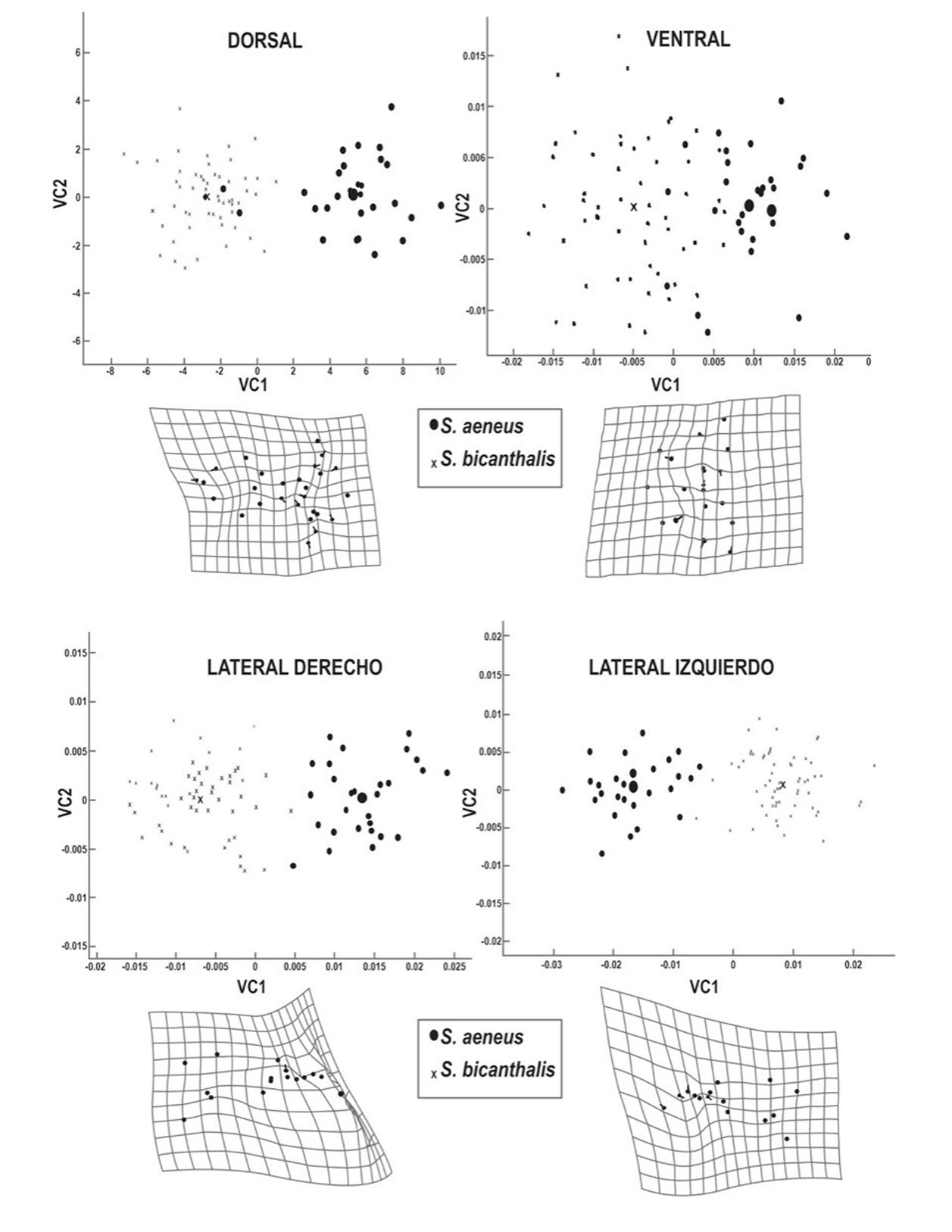
Las gradillas de deformación muestran un morfotipo bien definido para cada especie en las 4 vistas analizadas, la vista dorsal de S. aeneus presenta amplificación lateral de las escamas interparietal y parietales, mientras que para S. bicanthalis se observa una extensión de la frontal anterior indicada hacia la parte anterior de la cabeza de los organismos, asociado a una reducción del borde anterior de ésta hasta la rostral (fig. 3a). En la vista ventral, S. aeneus muestra menor variación, la parte posterior se extiende a nivel de los bordes del segundo par de escamas mentales posteriores y para el caso de S. bicanthalis, el acortamiento frontal de la escama mental está asociado a la reducción longitudinal del cráneo (fig. 3b). Referente a la vista lateral derecha, S. aeneus exhibe una proyección hacia la parte posterior del cráneo, mientras que en S. bicanthalis se presenta mayor deformación enmarcada en la sección posterior, mostrando una reducción longitudinal (fig. 3c). En lo que respecta a la vista lateral izquierda, ambas especies presentan variación en la parte posterior, S. aeneus muestra una compresión muy marcada en la parte inferior, en la escama subocular que, además, se observa con una extensión hacia la parte posterior de la cabeza, mientras que en S. bicanthalis ocurre lo contrario, la parte posterior se extiende de forma longitudinal y la subocular presenta una compresión hacia el frente (fig. 3d).
El ACP indica que los primeros 2 componentes explican la mayor varianza en las vistas analizadas, la vista dorsal muestra mayor variación de forma con 73% de la varianza acumulada, las vistas laterales presentan cerca de 50%, en tanto que en la vista ventral sólo representa 20%. El AVC y la prueba de F de Goodall (dorsal: F = 3.48, df = 48, p = 1.0769 x10-14, ventral: F = 1.79, df = 32, p = 0.0042, lateral derecho: F = 20.10, df = 28, p = 0.0001 y lateral izquierdo: F = 13.37, df = 28, p = 0.0001) indican una separación significativa en la forma de las escamas para las 4 vistas (tabla 2, fig. 4).
Con respecto a los datos merísticos, todos los individuos observados de S. aeneus presentan 1 par de escamas cantales (1 en cada lado de la cabeza), mientras que S. bicanthalis muestra variación en el número de escamas cantales, de 56 organismos analizados, 27 (48%) presentaron 2 pares de escamas (2 escamas en cada lado de la cabeza) y las restantes 29 (52%) presentaron números par o impar de éstas (tabla 3).
Discusión
En estudios anteriores se sugiere que la morfología de S. aeneus y S. bicanthalis es definida por factores históricos como el aislamiento geográfico y las relaciones de parentesco, además del tipo de paridad (Benabib et al., 1997; Guillette, 1981; Mink y Sites, 1996); sin embargo, con respecto a su morfología general externa son similares (Smith, 1939). No obstante lo anterior, en el presente estudio observamos que las diferencias morfométricas de las escamas cefálicas pudieran estar asociadas principalmente a procesos ecológicos como la alimentación y uso de hábitat, tal como se ha sugerido en un estudio realizado en Tropidurus, en el cual determinan que existe evolución adaptativa de la forma de la cabeza asociada con la inclusión de presas duras en su dieta (Kohlsdorf et al., 2008). Para este estudio, S. aeneus muestra un morfotipo de cabeza triangular, con las escamas interparietales y parietales más prominentes, resultando en una mandíbula más ancha, comparada con su especie hermana vivípara.
Tabla 1
Descripción de las marcas anatómicas para obtener la forma de las escamas de la cabeza de las especies del presente estudio.
| Números correspondientes a cada marca anatómica (landmark) | Descripción |
| Vista dorsal | |
| 1 | Punto máximo de la curvatura de la rostral |
| 2 | Borde posterior de la rostral |
| 3, 4 | Bordes internos de las narinas |
| 5, 7 | Bordes medios anteriores de la frontal anterior |
| 6 | Borde anterior de la frontal anterior |
| 8, 9 | Bordes anteriores de la frontal posterior |
| 10, 13 | Bordes medio posterior de la frontal posterior |
| 11, 12 | Bordes posteriores de la frontal posterior |
| 14, 15-16, 17 | Bordes posteriores de la frontoparietal |
| 18, 19-20-21 | Bordes posteriores de la parietal |
| 22 | Borde posterior de la interparietal |
| 23, 24 | Unión de la primera supraorbital y la cantal |
| 25, 26 | Borde posterior de la última supraorbital |
| Vista ventral | |
| 1 | Punto de la curvatura máxima de la punta de la mental |
| 2, 6 | Bordes medios anteriores de la mental |
| 3, 5 | Bordes medio posterior de la mental |
| 4 | Borde posterior de la mental |
| 7, 9-10, 12 | Bordes medio posterior de la primera postmental |
| 8 | Borde posterior de la primera postmental |
| 11 | Borde anterior de la primera postmental |
| 13, 15-16, 18 | Bordes medio posterior de la segunda postmental |
| 14, 17 | Bordes posteriores de la segunda postmental |
| Vista lateral | |
| 1, 2 | Extremo superior e inferior de la mandíbula |
| 3, 4 | Borde anterior y posterior de la narina |
| 5 | Borde posterior de la cantal |
| 6, 7 | Bordes anteriores de la preocular |
| 8, 9 | Bordes anteriores de la cantal |
| 10, 11 | Bordes anterior y posterior de la última superciliar |
| 12, 13 | Bordes posteriores de la subocular |
| 14, 15 | Bordes anteriores de la subocular |
| 16 | Borde posterior de la última supralabial |
En el caso de S. bicanthalis, que posee generalmente 2 pares de cantales, solo se tomó en cuenta la configuración de las marcas anatómicas de 1 par (una para la vista lateral derecha y 1 en la lateral izquierda).
Hay evidencias recientes que sugieren que una combinación entre el tipo de forrajeo, la competencia por el alimento y la diversidad de presas ingeridas, puede generar diferencias morfológicas en la estructura de la mandíbula (González et al., 2007). Esto concuerda con el hecho de que S. aeneus ocupa una gran variedad de hábitats, incluyendo aquellos modificados por la actividad agrícola (Canseco-Márquez y Gutiérrez-Mayén, 2010). Por otro lado, se observó que ocurre lo contrario en S. bicanthalis, ya que muestra la cabeza en forma alargada, lo cual es derivado de una compresión longitudinal, principalmente, en la parte posterior del cráneo y que es reforzado por la morfología en la vista ventral. Esta morfología indica que S. bicanthalis consume, indudablemente, presas pequeñas y menos diversas porque solo se encuentra en ambientes con macoyos, pastizales alpinos o pastizales en bosques de pino abierto, y eso podría limitar su presencia en zonas perturbadas (Canseco-Márquez y Gutiérrez-Mayén, 2010; Galindo-Gil et al., 2015; Rodríguez-Romero, 2004).
Los datos indican que la morfología de S. aeneus está determinada por una mayor actividad de forrajeo y para la captura de presas más grandes que su especie hermana, además de que tiene mayor disponibilidad de microhábitats para explorar a diferencia de su contraparte vivípara (Andrews et al., 1999; Galindo et al., 2015; Lara-Reséndiz, 2008). Esto también se ha observado en Phrynosoma orbiculare, cuya forma de la cabeza presenta una correlación con el consumo y tipo de hormigas (Montanucci, 1989).
Los resultados del presente estudio, concuerdan con la variación observada en las escamas interparietal y parietales, tal como se ha visto en otros grupos de lagartijas como Podarcis muralis y Lacerta bilinieata (Bruner et al., 2005; Kaliontzopoulou et al., 2007), en las que se describe que la morfología de la cabeza también se relaciona con la morfogénesis del cráneo en la sutura frontoparietal, patrón que parece ser común en lacertilios de talla pequeña.
Tabla 2
Valores obtenidos del análisis de componentes principales (ACP) y el análisis de variables canónicas (AVC). Componente principal 1 = CP1 y componente principal 2 = CP2.
| ACP | AVC | |||||
| Vista del cráneo | Varianza
explicada (%) |
Varianza
acumulada |
||||
| CP1 | CP2 | Lambda
de Wilk’s |
Grados de libertad | p | ||
| Dorsal | 67 | 6 | 73 % | 0.223 | 48 | 0.0004 |
| Ventral | 15 | 5 | 20 % | 0.4468 | 32 | 0.0107 |
| Lateral derecho | 29 | 14 | 43 % | 0.1858 | 28 | 2.06 x 10-12 |
| Lateral izquierdo | 22 | 17 | 39 % | 0.1932 | 28 | 5.74 x 10-12 |
Tabla 3
Número de escamas cantales presentes en cada lado de la cabeza (derecho-izquierdo) de S. aeneus y S. bicanthalis en las poblaciones estudiadas. El número entre paréntesis indica el número de ejemplares de la “n” total de cada población que presentaron las diferentes combinaciones de escamas (par: 1-1, 2-2 o impar: 2-1, 1-2).
| Especie | Población (n) | Número de cantales en cada lado de la cabeza |
| Sceloporus aeneus | Milpa Alta, Ciudad de México 17 | 1-1 (17) |
| Temoaya, Estado de México 11 | 1-1 (11) | |
| S. bicanthalis | Nevado de Toluca, Estado de México 20 | 2-2 (10), 2-1 (5) y 1-1 (5) |
| Las Vigas, Veracruz 10 | 2-2 (6), 2-1 (1),1-2 (1) y 1-1 (2) | |
| Nopalillo, Hidalgo 20 | 2 2-2 (7), 2-1 (2), 1-2 (7) y 1-1 (4) | |
| Perote, Veracruz 6 | 2-2 (4), 2-1 (1) y 1-2 (1) |
En lo que respecta a la gran variación morfológica y en el número de las escamas cantales, sugerimos que puede ser el resultado de la reciente evolución de estas especies hermanas, lo cual indica que S. bicanthalis (especie descendiente) aún no se ha separado morfológicamente del todo de S. aeneus (especie ancestral), ya que un gran porcentaje de los ejemplares que se analizaron aún presentan un solo par de escamas cantales, ésto a pesar del aislamiento geográfico y reproductor entre poblaciones (Grummer et al., 2014; Leaché et al., 2013; Meza, 2007). Con base en la variación encontrada en el número de escamas cantales de S. bicanthalis, se sugiere no considerarlas como carácter diagnóstico para dicha especie, lo que corrobora lo observado en estudios anteriores de Thomas y Dixon (1976) y Ríos-Rodas y Rodríguez-Romero (2008), en los que indican que las escamas cantales pudieron haber evolucionado independientemente en varias poblaciones y no siguen un patrón geográfico evidente.

A partir del análisis de la escutelación del cráneo, se sugiere considerar las formas de las escamas interparietales y parietales como nuevos caracteres taxonómicos para identificar diferentes poblaciones de S. aeneus y S. bicanthalis mediante la morfometría geométrica, incluso en aquellas que pudieran encontrarse en simpatría si es que las hay. Tal como se ha manejado con otros grupos, como los mosquitos Anopheles, cuya mayoría de las especies del subgénero Nyssorhynchus pudieron ser diferenciadas al analizar la forma de las venas de las alas empleando morfometría geométrica como herramienta de apoyo a las claves convencionales (Calle et al., 2008), o en otro estudio, que apoya el uso de estas técnicas geométricas para diferenciar especies de gran controversia taxonómica, como fue el realizado en Phrynosoma orbiculare, donde se analizan diversas poblaciones en varias localidades mediante mofometría lineal y geométrica, demostrando que esta última tiene la fortaleza estadística para definir 2 subespecies al considerar la forma del cráneo, cuernos occipitales y temporales como nuevos caracteres para su diferenciación (Moreno-Barajas et al., 2013).
Finalmente, es importante mencionar que la morfometría geométrica es una herramienta de gran utilidad para analizar la morfología de las escamas cefálicas de estos 2 taxones y definir la identidad de las especies en cuestión, ya que no hay otros caracteres fenotípicos evidentes; ante ello, proponemos los esquemas de los puntos geométricos usados en este trabajo para estandarizar la determinación de ejemplares, vía fotografías digitales y análsis multivariado de la forma.
Agradecimientos
A Alma S. Velázquez Rodríguez por sus comentarios al manuscrito, así mismo a la Universidad Autónoma del Estado de México por el financiamiento del proyecto 2555/2007 U, para la realización del presente estudio.
Referencias
Adams, C., Rohlf, F. J. y Slice, D. E. (2004). Geometric morphometrics: ten years of progress following the “revolution”. Italian Journal of Zoology, 7, 5–16. https://doi.org/10.1080/11250000409356545
Andrews, R., Méndez-de la Cruz, F., Villagrán, M. y Rodríguez, F. (1999). Field and select body temperatures of the lizards Sceloporus aeneus and Sceloporus bicanthalis. Journal of Herpetology, 33, 93–100. https://doi.org/10.2307/1565547
Benabib, M., Kjer, K. M. y Sites, J. W. Jr. (1997). Mitochondrial DNA sequence-based phylogeny and the evolution of viviparity in the Sceloporus scalaris group (Reptilia: Squamata). Evolution, 51, 1262–1275. https://doi.org/10.2307/2411055
Bookstein, F. L. (1982). Foundations of morphometrics. Annual Review of Ecology and Systematics, 13, 451–470. https://doi.org/10.1146/annurev.es.13.110182.002315
Bruner, E. y Constantini, D. (2007). Head morphological variation in Podarcis muralis and Podarcis sicula: a landmark-based approach. Amphibia-Reptilia, 28, 566–573. https://doi.org/10.1163/156853807782152525
Bruner, E. y Constantini, D. (2009). Head morphology and degree of variation in Lacerta bilineata, Podarcis muralis and Podarcis sicula. International Journal of Morphology, 27, 667–676. https://doi.org/ 10.4067/S0717-95022009000300008
Bruner, E., Constantini, D., Fanfani, A. y Dell’Omo, G. (2005). Morphological variation and sexual dimorphism of the cephalic scales in Lacerta bilineata. Acta Zoologica (Stockholmo), 86, 245–254. https://doi.org/10.1111/j.1463-6395.2005.00206.x
Calle, D. A., Quiñones, M. L., Erazo, H. F. y Jaramillo, N. (2008). Discriminación por morfometría de 11 especies de Anopheles (Nyssorhynchus) presentes en Colombia. Biomédica, 28, 371–385. https://doi.org/10.7705/biomedica.v28i3.75
Canseco-Márquez, L. y Gutiérrez-Mayén, M. G. (2010). Anfibios y reptiles del valle de Tehuacán-Cuicatlán. Ciudad de México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Fundación para la Reserva de la Biosfera Cuicatlán A.C./ Benemérita Universidad Autónoma de Puebla.
Chávez-León, G. y Lemos-Espinal, J. A. (2021). Anfibios y reptiles de bosques bajo manejo silvicultural. Folleto técnico núm. 32. Ciudad de México: Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias/ Centro Nacional de Investigación Disciplinaria en Conservación y Mejoramiento de Ecosistemas Forestales.
Davis, W. B. y Smith, H. M. (1953). Lizards and turtles of the Mexican state of Morelos. Herpetologica, 9, 100–108.
Galindo-Gil, S., Rodríguez-Romero, F. J., Velázquez-Rodríguez, A. S. y Moreno-Barajas, R. (2015). Correlaciones morfológicas entre la forma de la cabeza, dieta y uso de hábitat de algunos Sceloporus de México: un análisis cuantitativo. International Journal of Morphology, 33, 295–300. http://dx.doi.org/10.4067/S0717-95022015000100047.
González, L. A., López-Rojas, H., Bonilla-Rivero, A., Prieto A. y Velásquez, J. (2007). Variación morfológica de la región cefálica del lagarto Ameiva ameiva (Linnaeus 1758) (Sauria: Teiidae) en un bosque húmedo del Parque Nacional del Ávila, Venezuela. Caracas: SABER, Universidad de Oriente, Venezuela.
Grummer, J. A., Bryson, R. W., Jr. y Reeder, T. W. (2014). Species delimitation using Bayes factors: simulations and application to the Sceloporus scalaris species group (Squamata: Phrynosomatidae). Systematic Biology, 63, 119–133. https://doi.org/10.1093/sysbio/syt069
Guillette, L. J., Jr. (1981). Reproductive strategies and the evolution of the viviparity in two allopatric population of the Mexican lizard, Sceloporus aeneus (PhD Thesis). University of Colorado, Boulder, Colorado, USA.
Guillete, L. J. Jr. y Jones, R. E. (1985). Ovarian, oviductal and placental morphology of the reproductively bimodal lizard species, Sceloporus aeneus. Journal of Morphology, 184, 85–98. https://doi.org/10.1002/jmor.1051840109
Kaliontzopoulou, A., Carretero, M. A. y Llorente, G. A. (2007). Multivariate and geometrics in the analysis of sexual dimorphism variation in Podarcis lizards. Journal of Morphology, 268, 152–165. https://doi.org/10.1002/jmor.10494.
Kohlsdorf, T., Grizante, M. B., Navas C. A. y Herrel A. (2008). Head shape evolution in Tropidurinae lizards: Does locomotion constrain diet? Journal of Evolutionary Biology, 21, 781–790. https://doi.org/10.1111/j.1420-9101.2008.01516.x
Lara-Reséndiz, R. A. (2008). Eficiencia de la termorregulación y modelación del nicho ecológico de dos especies hermanas de Sceloporus con diferente modo reproductor (Tesis maestría), Universidad Nacional Autónoma de México. Ciudad de México.
Leaché, D., Palacios, J. A., Minin, V. N. y Bryson, R. W. Jr. (2013). Phylogeography of the Trans-Volcanic bunchgrass lizard (Sceloporus bicanthalis) across the highlands of south-eastern Mexico. Biological Journal of the Linnean Society, 110, 852–865. https://doi.org/10.1111/bij.12172
Malhotra, A., Thorpe, R. S. y Stuart. B. L. (2004). A morphometric analysis of Trimeresurus vogeli (David, Vidal and Pauwels, 2001), with new data on diagnostic characteristics, distribution and natural history. Herpetological Journal, 14, 65–77.
Meza, L. R. N. (2007). Sistemática filogenética del complejo Sceloporus aeneus (Squamata: Phrynosomatidae) (Tesis maestría). Facultad de Ciencias, Universidad Nacional Autónoma de México. Ciudad de México.
Mink, D. y Sites, J. W. Jr. (1996). Species limits, phylogenetic relationships and origins of viviparity in scalaris complex of the lizard genus Sceloporus (Phrynosomatidae: Sauria). Herpetologica, 52, 551–571.
Moreno-Barajas, R., Rodríguez-Romero, F., Velázquez-Rodríguez, A. y Aragón-Martínez, A. (2013). Variación
geográfica en Phynosoma orbiculare (Sauria: Prynoso-matidae): análisis de las subespecies. Acta Zoológica Mexicana, 29, 129–143. https://doi.org/10.21829/azm.2013.291390
Montanucci, R. R. (1989). The relationship of morphology to diet in the horned lizard genus Phrynosoma. Herpetologica, 45, 208–216.
Ochoa-Ochoa, L., Flores-Villela, O., García-Vázquez, U., Correa-Cano, M. y Canseco-Márquez, L. (2006). Áreas potenciales de distribución de la herpetofauna de México. Especie: Sceloporus aeneus (recortes). Recuperado el 01 enero, 2022 de: http://www.conabio.gob.mx/informacion/gis/layouts/scel_aenegw.gif
Ríos-Rodas, L. y Rodríguez-Romero, F. (2008). Ecomorfología de las lagartijas Sceloporus aeneus y Sceloporus bicanthalis en el Eje Neovolcánico de México. En A J. Sánchez, M. G. Hidalgo, S. L. Arriaga y W. M. Contreras (Eds.), Perspectivas en zoología mexicana (pp. 139–151). Villa Hermosa, Tabasco, México.
Rodríguez-Romero, F. (2004). Demografía comparada de dos species de lacertilios emparentados del género Sceloporus (Sauria: Phrynosomatidae) con diferente modo reproductor (Tesis doctoral). Universidad Nacional Autónoma de México. Ciudad de México.
Rohlf, F. J. (1999). Shape statistics: Procrustes superimpositions and tangent spaces. Journal of Classification, 16, 197–223. https://doi.org/10.1007/s003579900054
Rohlf, F. J. (2010). tpsDig versión 2.15. Department of Ecology and Evolution, State University of New York. Recuperado
el 20 enero, 2022 de: https://www.sbmorphometrics.org
Rohlf, F. J. (2010). tpsUtil. Department of Ecology and Evolution, State University of New York. Recuperado el 20 enero, 2022 de: https://www.sbmorphometrics.org
Sheets, H. D. (2001) Software IMP © (Integrated Morphometric Package). Deparment of Physics, Canisius College, State University of New York at Buffalo. Recuperado el 20 de enero, 2022 de: https://www.sbmorphometrics.org
Sinervo, B., Méndez-de la Cruz, F., Miles, D. B., Heulin, B., Bastiaans, E., Villagran-Santa Cruz, M. et al. (2010). Erosion of lizard diversity by climate change and altered thermal niches. Science, 328, 894–899. https://doi.org/10.1126/science.1184695
Sites, J. W., Archie, J. W., Cole, C. J. y Flores-Villela, O. (1992). A review of phylogenetic hypotheses for lizards of the
genus Sceloporus (Phrynosomatidae): implications for ecological and evolution studies. Bulletin of the American Museum of Natural History, 213, 1–110.
Smith, H. M. (1937). A synopsis of the Variabilis group of lizard genus Sceloporus with descriptions of new subspecies. Occasional Papers of the Museum of Zoology University of Michigan, 358, 1–14
Smith, H. M. (1939). The Mexican and Central American lizards of the genus Sceloporus. Zoological Series Field Museum of Natural History, 26, 353–358.
Smith, H. M. y Taylor E. H. (1950). An annotated checklist and key to the reptiles of Mexico exclusive of the snakes. Bulletin of the U. S. National Museum, 199, 1–253.
Thomas, R. A. y Dixon, J. R. (1976). A revaluation of the Sceloporus scalaris group (Sauria: Iguanidae). The Southwestern Naturalist, 20, 523–536.
Wiens, J. J. y Reeder, T. (1997). Phylogeny of the spiny lizards (Sceloporus) based on molecular and morphological evidence. Herpetological Monographs, 11, 1–101. https://doi.org/10.2307/1467007
Zelditch, M. L., Swiderski, D. L., Sheets, H. D. y Fink, W. L. (2004). Geometric morphometrics for biologists: a primer. San Diego, California: Elsevier Academic Press.