Efecto del cambio climático en la distribución de especies clave en la vegetación de duna costera en la península de Yucatán, México
Natalia Ovando-Hidalgo (a), Juan Tun-Garrido (b), Gabriela Mendoza-González (c) y Víctor Parra-Tabla (a, *)
a Departamento de Ecología Tropical, Campus de Ciencias Biológicas y Agropecuarias, Universidad Autónoma de Yucatán, Km. 15.5 carretera Mérida-Xtmakuil, 97000 Mérida, Yucatán, México
b Departamento de Botánica, Campus de Ciencias Biológicas y Agropecuarias, Universidad Autónoma de Yucatán, Km. 15.5 carretera Mérida- Xtmakuil, 97000 Mérida, Yucatán, México
c Cátedra Conacyt- Facultad de Ciencias, Unidad Multidisciplinaria de Docencia e Investigación-Sisal, Universidad Nacional Autónoma de México, Unidad Académica de Yucatán, Parque Científico y Tecnológico, carretera Sierra Papacal, Chuburná Puerto, Km 5, 97302 Mérida, Yucatán, México
*Autor para correspondencia: victor.parratabla@gmail.com (V. Parra-Tabla)
Resumen
Las consecuencias del cambio climático sobre los ecosistemas pueden depender de su efecto sobre la distribución de especies, que juegan un papel clave en las comunidades. El objetivo de este trabajo fue modelar la distribución potencial, actual y futura, de 5 especies clave de la vegetación de duna costera de la península de Yucatán. Particularmente, se evaluaron los cambios en áreas actualmente destinadas a la conservación. Se empleó el método de máxima entropía usando los escenarios RCP 4.5 y 8.5, que respectivamente consideran un incremento moderado y uno drástico de emisiones de gases de efecto invernadero y el modelo general de circulación CNRM-CM5 al horizonte 2080. Los modelos mostraron que bajo ambos escenarios, la distribución de las especies disminuyó notablemente con una reducción de entre 72% a 94% para el escenario 4.5 y de 82% a 93% para el escenario 8.5, y que la mayoría de las áreas naturales protegidas no mantendrán las condiciones ambientales favorables para las 5 especies estudiadas. Sin embargo, se identificó que las áreas protegidas al noreste de la península, y una zona no protegida al norte de Yucatán, podrían conservar una limitada área que favorecería la distribución de dichas especies.
Palabras clave: Áreas protegidas; Cambio climático; Dunas costeras; Especies clave; Modelación de nicho ecológico
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Effect of climate change on the distribution of keystone species of the coastal dune vegetation in the Yucatán Peninsula, Mexico
Abstract
The consequences of climate change on ecosystems may depend largely on their effect on the distribution of species that play a key role in communities. The aim of this work was to model the potential distribution, current and future, of 5 key species of coastal dune vegetation of the Yucatán Peninsula. Particularly the expected changes in areas currently destined for conservation were evaluated. The maximum entropy method was used, including the RCP 4.5 and 8.5 scenarios, which respectively consider a moderate and drastic increase in greenhouse gas emissions, and the general CNRM-CM5 circulation model to the 2080 horizon. The models showed that under both scenarios, the distribution of the selected species would decrease markedly, with a reduction from 72% to 94% for scenario 4.5 and from 82% to 93% for scenario 8.5, and that most of the protected natural areas would not maintain favorable environmental conditions for the 5 species studied. However, it was identified that protected areas northeast of the peninsula, and an unprotected area at the north of the state of Yucatán, could conserve a limited area that would favor the distribution of these species.
Keywords: Protected areas; Climate change; Coastal dunes; Key species; Ecological niche modeling (…revisar si estas key words corresponden a su version en español; no las proporcionó en la versión original)
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
En las últimas décadas se ha incrementado el interés por evaluar los efectos que el cambio climático (CC) tendrá sobre la estructura de las comunidades naturales (i.e., composición de especies) y sobre la funcionalidad de los ecosistemas (Hannah et al., 2002; Prisco et al., 2013; Thuiler et al., 2005). Se espera que debido al incremento en las temperaturas y los cambios en los regímenes de precipitación asociados al CC, uno de sus efectos más importantes será sobre los patrones de distribución de las especies (Hughes, 2000; Thuiler et al., 2005). Sin embargo, debido a las diferencias interespecíficas en los requerimientos particulares que definen el nicho ecológico de cada especie, así como a las diferencias en su tolerancia a gradientes ambientales y en general a su capacidad de adaptación, se puede predecir que los cambios en los patrones de distribución de las especies no serán iguales (Miko, 1999). Por el contrario, es esperable que mientras que algunas especies disminuirán su distribución, otras podrían cambiarlo o expandirlo y quizá algunas otras puedan no ser afectadas (Hannah et al., 2002; Kritikos, 2003; Mendoza-González et al., 2013).
Sin embargo, también es importante considerar que el cambio en el patrón de distribución en una especie en particular debida al CC, no se restringa solo al efecto en esa especie, ya que puede esperarse que esto tenga diferentes consecuencias en la estructura y funcionamiento en las comunidades en las que se encuentre o a las que se vaya introduciendo. La importancia de las consecuencias del cambio en la distribución de las especies por el CC dependerá fuertemente del papel que jueguen dichas especies dentro de la comunidad (Cannizzo et al., 2017; Castellanos et al., 2009; Schweiger y Settle, 2008). Es decir que la importancia relativa del cambio en el patrón de distribución de una u otra especie no será necesariamente equivalente y dependerá del efecto que cada una tenga en la funcionalidad de la comunidad (Bergin y Kimberley, 1997; Martínez et al., 2014; Reckendorf et al., 1985). Desde el punto de vista de la biología de la conservación, debe ser de especial interés entender el efecto que el CC puede tener sobre especies clave dentro de las comunidades. Las especies clave se definen como aquellas que tienen un efecto en la estructura y funcionalidad del ecosistema desproporcionalmente mayor al que se esperaría por su abundancia relativa (Paine, 1995), afectando la diversidad de especies en una comunidad (Davic, 2003). A pesar de que existe un número creciente de estudios en los que se han modelado los cambios en la distribución de especies debidas al CC (e.g., Kritikos et al., 2003; Mendoza-González et al., 2013), es importante considerar de manera particular el efecto en especies clave de las comunidades, de tal forma que nos permita entender los efectos potenciales sobre la funcionalidad de los ecosistemas y en la diversidad de las especies que éstos contienen.
Adicionalmente, es importante hacer notar que el estudio de los cambios en los patrones de distribución de especies clave sería de mucha utilidad para ayudar a confirmar o redefinir áreas de protección de ecosistemas amenazados (Brown y Charles 1997; D’Amen et al., 2011; Saunders y Easley, 2007; Tabor et al., 2018), ya que es probable que los cambios en la distribución de algunas especies pueda resultar en una reducción de su distribución que no abarque zonas protegidas (D’Amen et al., 2011; Saunders y Easley, 2007; Tabor et al, 2018). Si bien esta posibilidad pone en duda la capacidad de que muchas áreas protegidas realmente puedan asegurar la persistencia a largo plazo de la diversidad biológica que contienen (Hockings, 1998, 2003), su análisis puede permitir definir o redefinir nuevas áreas de conservación (Ponce et al., 2012).
Mundialmente, las zonas costeras han sido uno de los ecosistemas que han estado sujetos a fuertes presiones que las han modificado drásticamente, como la deforestación y el cambio de uso de suelo para desarrollos turísticos, la incidencia de especies invasoras y la contaminación (Del Vecchio, 2015; Lara, 2008; Martínez et al., 2004; Parra-Tabla et al., 2018), siendo considerados de los ecosistemas terrestres más vulnerables debido al CC (Del Vecchio, 2015; Martínez et al., 2004; Prisco et al., 2013). En estos ecosistemas existen especies de plantas que son esenciales para su funcionamiento, ya que de ellas depende la fijación del sustrato que permite el establecimiento de otras especies de plantas, así como de la fauna que se asocia a ellas (Acosta et al., 2009; Castellanos et al., 2009; Martínez et al., 2004). La fijación del sustrato promovida por estas especies tiene como consecuencia cambios microambientales que incluyen una mayor retención de la humedad y un incremento en la cantidad de nutrientes en el suelo, beneficiando de esta forma a otras especies de plantas (Espejel, 1987; Koske et al., 2008; Martínez et al., 2014). Si bien se han hecho diferentes estudios de cambios en la distribución de las especies por efectos del cambio climático en zonas costeras (e.g., Del Vecchio, 2015; Faggi y Dandon, 2011; Harley et al., 2006; Mendoza-González et al., 2013), aparentemente estos no se han enfocado de manera particular en especies clave, ni en si dichos cambios podrían afectar las áreas que actualmente están destinadas para la conservación de ese tipo de vegetación.
En este trabajo se presenta un análisis del cambio potencial en la distribución de 5 especies características de la vegetación de dunas costeras en la costa de la península de Yucatán México, que han sido consideradas como clave debido a su papel como fijadoras del sustrato y por su alta dominancia dentro de la estructura de las comunidades (Espejel 1987; Parra-Tabla et al., 2018). La zona costera de la península de Yucatán se considera de especial importancia para la conservación, ya que junto con el sistema de dunas costeras del golfo de México, es considerada uno de los ecosistemas costeros más diversos a nivel mundial (Espejel 1987; Martínez et al., 2004), cuya vegetación ha sido influenciada por las regiones biogeográficas del Caribe y del golfo de México (Castillo y Moreno-Casasola, 1998; Espejel, 1987; Jiménez-Orocio et al., 2015). De igual forma, la península de Yucatán es una de las regiones de México donde existe un número importante de áreas destinadas a la conservación, las cuales incluyen importantes porciones de zonas costeras (Mendoza-González et al., 2016; Moreno-Casasola et al., 2014). En este estudio se pretende específicamente: a) describir la distribución potencial actual de 5 especies clave en la zona costera de la península de Yucatán, México; b) proyectar su distribución potencial bajo los escenarios de cambio climático RCP 4.5 (que considera una estabilización de emisiones de carbono) y RCP 8.5 (que considera un aumento considerable en las emisiones de carbono), y finalmente, c) evaluar si bajo esos escenarios las zonas actualmente consideradas como de conservación, mantendrían las condiciones ambientales requeridas para esas especies de tal forma que podrían seguir contribuyendo a la conservación de la vegetación de dunas costeras.
Materiales y métodos
La península de Yucatán posee un clima cálido con patrones estacionales de precipitaciones que varían de 750 a 1,400 mm al año, cuyas cantidades anuales aumentan con la disminución de la latitud (Veleva et al., 1997). Posee 2 estaciones marcadas, secas (noviembre-mayo) y lluvias (junio-octubre). De acuerdo con García (2004) tiene 3 tipos de climas principales según el sistema Köppen: Bs (T = 25.4 – 27.2 °C; P = 469 – 610.8 mm) Aw0 (T = 26 – 27.7 °C; P = 940 – 1,136 mm) y Aw2 (26.4 – 26 °C; P = 1,400 – 1,600 mm).
La península de Yucatán es una planicie calcárea, donde se pueden encontrar representadas calizas, tizas y yesos (Neeti et al., 2012). Es considerada por diversos autores una región biogeográfica por sí misma, debido a que comparte una gran cantidad de especies (Espinosa et al., 2008; Morrone et al., 2002; Rzedowski, 1978; Rzedowski y Reyna-Trujillo, 1990). De hecho, toda la plataforma de Yucatán tiene identidad geológica y forma parte de la placa tectónica del Caribe (Rzedowski y Reyna-Trujillo, 1990). Dentro de esta zona podemos encontrar 25 áreas naturales protegidas (ANP) reconocidas a nivel mundial por su alto valor ambiental (Rodríguez-Zúñiga et al., 2013), 21 de éstas son costeras (fig. 1).
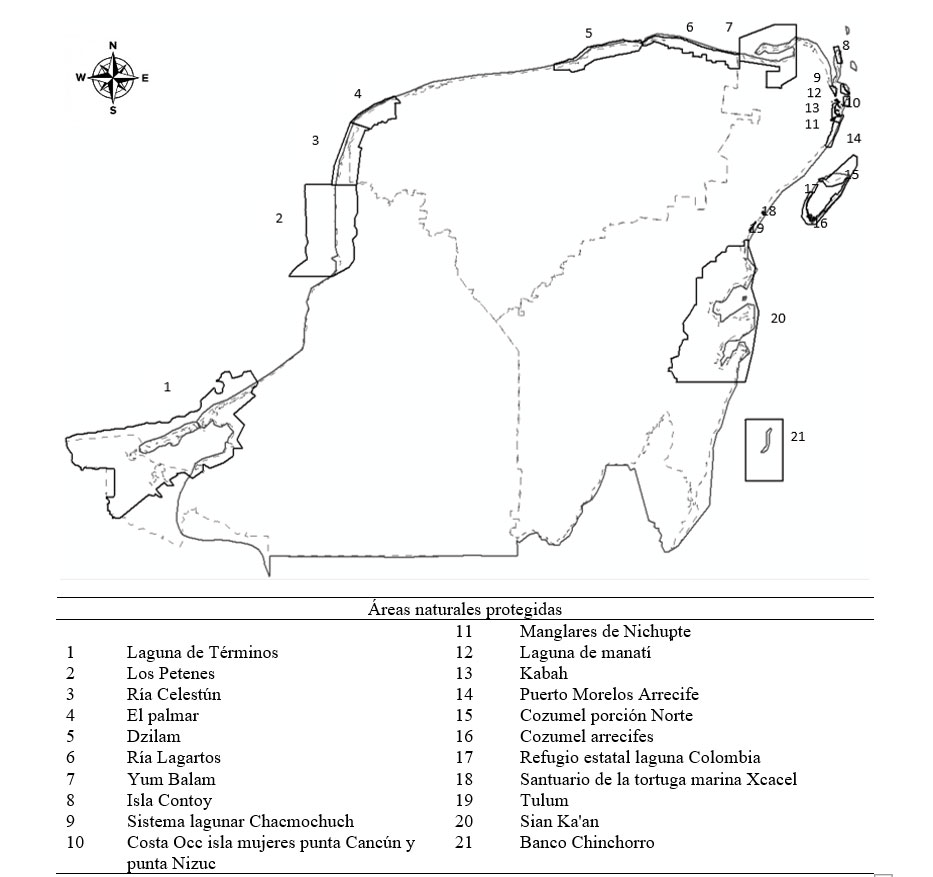
La vegetación de duna costera está presente en 81% del litoral de playa de la península, excepto en algunas áreas naturales ocupadas por manglar y sistemas lagunares, así como por asentamientos urbanos debido al establecimiento de puertos y desarrollos veraniegos (Flores y Espejel, 1994). A diferencia de algunos sistemas del golfo de México, se les considera un sistema de dunas fijas en las que la sedimentación está controlada por la vegetación (Eskuche, 1992; Rust e Illenberg, 1996; Torres et al., 2010). Las comunidades de dunas de esta región presentan una estructura diversa debido a las características hidrológicas, climáticas y edáficas en el litoral (Angulo et al., 2018; Espejel, 1987), lo cual se ve reflejado en los caracteres funcionales de las especies de plantas que les permiten soportar condiciones de alta temperatura, baja disponibilidad de agua y alta exposición a la sal (Martínez et al., 2014, Munguía-Rosas et al., 2019). Espejel (1984) clasificó la vegetación de dunas en 2 tipos, considerando su cercanía al mar. El primero es el pionero, ubicándose cerca de la línea de costa, que se caracteriza por la presencia de especies herbáceas y arbustivas de talla pequeña (≤ 5 m), más tolerantes a las condiciones ambientales extremas. El segundo es un matorral, encontrándose hacia el interior, donde el sustrato arenoso está fijo y la vegetación alcanza una altura mayor.
Para el estudio se eligieron 5 especies clave (tabla 1) consideradas por su papel como fijadoras del sustrato en la zona de duna costera embrionaria y porque todas ellas presentan altos valores de dominancia dentro de sus comunidades (Espejel, 1987; Parra-Tabla et al., 2018). Las 5 especies seleccionadas fueron: Cakile edentula (Brassicaceae), especie herbácea que en México se localiza casi exclusivamente en la península de Yucatán (Espejel et al., 2017), que se ubica en la zona de plantas pioneras sobre la línea de costa y presenta una alta tolerancia a las inundaciones provocadas por los ciclos de mareas (Angulo et al., 2018); Ernodea littoralis (Rubiaceae), especie arbustiva que se localiza en la zona de pioneras, aunque también se puede encontrar en el matorral costero, en México se distribuye principalmente en la península de Yucatán y en Veracruz, formando matorrales densos que ayudan a la estabilización de suelos (Moreno-Casasola y Espejel, 1986); Scaevola plumieri (Goodeniaceae), es un arbusto especialmente abundante en la península de Yucatán, aunque también se le puede localizar a lo largo de la costa del golfo de México y del Pacífico (Espejel et al., 2017); Suriana maritima (Surianaceae), un arbusto común de la vegetación costera de la península de Yucatán y Veracruz (Parra-Tabla et al., 2018; Villaseñor, 2016), al igual que S. plumieri, es de las pocas especies arbustivas que ocupan la zona de pioneras fijando el sustrato y sirviendo como refugio para aves (Castillo y Moreno-Casasola, 1996), y Tournefortia gnaphalodes (Boraginaceae), un arbusto característico de la zona de pioneras y del matorral costero que se distribuye principalmente en la península de Yucatán, siendo una de las especies de plantas más abundantes en la zona de dunas (Mendoza-González et al., 2013; Moreno-Casasola y Espejel, 1986; Parra-Tabla et al., 2018).
Para obtener los datos de distribución de las 5 especies seleccionadas, se consultaron fuentes de información en los sitios: Comisión Nacional para el Conocimiento Uso y Conservación de la Biodiversidad (Conabio), así como las bases de datos del Centro de Investigación Científica de Yucatán (CICY) y de la Universidad Autónoma de Yucatán (UADY). Se construyó una base de datos que fue depurada, eliminando registros repetidos o con errores (e.g., identificaciones erróneas, coordenadas incorrectas fuera de la distribución conocida), obteniendo un total de 749 puntos de presencia distribuidos entre las 5 especies (fig. 2). El total de puntos disponibles para cada especie se dividió en 2 grupos de manera aleatoria e independiente; 85% se emplearon para el entrenamiento del modelado y 15% se usó para validarlos (tabla 1) (Quesada et al., 2017).
Tabla 1
Partición de los registros de presencia de las especies. Número de puntos de entrenamiento y de validación.
|
Especie |
Familia |
Puntos de entrenamiento |
Puntos de validación |
Total |
|
Cakile edentula |
Brassicaceae |
108 |
20 |
128 |
|
Ernodea littoralis |
Rubiaceae |
105 |
19 |
124 |
|
Scaevola plumieri |
Goodeniaceae |
159 |
29 |
188 |
|
Suriana maritima |
Surianaceae |
164 |
30 |
194 |
|
Tournefortia gnaphalodes |
Boraginaceae |
98 |
17 |
115 |
|
749 |

Para la construcción de los modelos de distribución potencial, se emplearon 19 variables ambientales presentes en la base de datos Worldclim (Hijmans et al., 2005) a una resolución de 30 segundos lo cual equivale aproximadamente a 1 km2 por pixel (tabla 2), obtenidas de la interpolación de los registros de las estaciones climáticas para el periodo comprendido entre los años 1950 y 2000 (Hijmans et al., 2005). Para realizar el modelado, se seleccionaron las variables climáticas más importantes y que no estuvieran correlacionadas entre sí, dado que la alta colinealidad entre ellas podría sobreajustar los modelos de distribución (Cruz et al., 2014; Mendoza-González et al., 2013; Peterson y Nakazawa, 2008). Se llevaron a cabo 3 procedimientos de manera independiente por especie: primero, a través de un análisis de jackknife se determinó el efecto de cada variable en la construcción del modelo (Shcheglovitova y Anderson, 2013). Después, se realizó un análisis de componentes principales (ACP) para evaluar el porcentaje de varianza explicada por cada variable bioclimática. Una vez seleccionadas las variables de mayor valor por cada componente, se realizaron correlaciones de Spearman para eliminar una de las 2 que estuvieran altamente correlacionadas. La selección entre ellas se determinó por el número de correlaciones que tuviera con otras variables con valores de r > 0.8.
Debido a que las especies son de distribución exclusivamente costera, se consideró un área de accesibilidad de 10 km al interior de la costa (López-Portillo et al., 2011; Soberón y Peterson, 2005). El área generada posteriormente se recortó con el uso de la capa de la región biogeográfica de Yucatán (Morrone et al., 2002).
Para el modelado del área de distribución potencial de las especies, se empleó el algoritmo MaxEnt versión 3.3 (Phillips y Dudík, 2008), el cual estima la distribución potencial de las especies en función de la distribución más cercana y más uniforme, y en el que los valores esperados para cada una de las características ambientales coincidirán en términos de su valor empírico promedio (Phillips et al., 2006). El algoritmo es de tipo determinista, lo que garantiza la convergencia hacia la máxima probabilidad de distribución (Phillips et al., 2006). Este método ha generado un gran interés porque ha mostrado una precisión predictiva relativamente más alta que otros métodos cuando se aplica a los registros de la especie que indican sólo presencias (Elith et al., 2006; Franklin, 2009).
Para la parametrización del modelo se seleccionó un valor máximo de 1,000 iteraciones, un límite de convergencia de 0.00001 y con un valor de regularización de 1 de acuerdo con Mendoza-González et al. (2013). Las opciones de “clampling” y extrapolación fueron desactivadas para evitar extrapolaciones artificiales de valores extremos desconocidos (Elith et al., 2011).
Tabla 2
Valores (en porcentaje) de la contribución de las variables ambientales a los modelos de distribución potencial de las especies estudiadas. Las variables bioclimáticas más importantes para los modelos se muestran en negritas.
|
Variables utilizadas |
Porcentaje de contribución al modelo |
|||||
|
Cakile edentula |
Ernodea littoralis |
Scaevola plumieri |
Suriana maritima |
Tournefortia gnaphalodes |
||
|
Bio 01 |
Temperatura media anual |
2 |
1.1 |
0 |
3.9 |
0 |
|
Bio 02 |
Intervalo diurno promedio |
1.9 |
10.7 |
2.1 |
0 |
0 |
|
Bio 03 |
Isotérmica (BIO2 / BIO7) (* 100) |
9 |
0 |
0 |
0 |
0 |
|
Bio 04 |
Temperatura estacionalidad (desviación estándar * 100) |
9.7 |
1.8 |
12.6 |
5.1 |
6.1 |
|
Bio 05 |
Temperatura máxima del mes más cálido |
0 |
0 |
0 |
14.1 |
0 |
|
Bio 06 |
Temperatura mínima del mes más frío |
0 |
0 |
0 |
6.3 |
0.3 |
|
Bio 07 |
Rango anual de temperatura |
0 |
0 |
0 |
0 |
15.7 |
|
Bio 08 |
Temperatura media del trimestre más húmedo |
4.7 |
6.6 |
3.9 |
3.8 |
8.4 |
|
Bio 09 |
Temperatura media del trimestre más seco |
0 |
0 |
0 |
0 |
6.7 |
|
Bio 10 |
Temperatura media del cuarto más cálido |
7.4 |
14.1 |
12.1 |
4.7 |
7.2 |
|
Bio 11 |
Temperatura media del trimestre más frío |
0 |
0 |
0 |
0 |
5 |
|
Bio 12 |
Precipitación anual |
62.7 |
7.8 |
57.8 |
51.7 |
28.2 |
|
Bio 13 |
Precipitación del mes más húmedo |
0 |
0 |
0 |
0 |
0 |
|
Bio 14 |
Precipitación del mes más seco |
0 |
10 |
0 |
10.4 |
0 |
|
Bio 15 |
Precipitación estacionalidad (coeficiente de variación) |
2.5 |
7.6 |
3 |
0 |
1 |
|
Bio 16 |
Precipitación del trimestre más húmedo |
0 |
39.9 |
0 |
0 |
4 |
|
Bio 17 |
Precipitación del trimestre más seco |
0.4 |
0 |
0 |
0 |
0 |
|
Bio 18 |
Precipitación del trimestre más cálido |
0 |
0 |
0 |
0 |
17.4 |
|
Bio 19 |
Precipitación del trimestre más frío |
0 |
0 |
8.6 |
0 |
0 |
|
Total |
100 |
100 |
100 |
100 |
100 |
Se seleccionó la salida de los modelos en formato acumulativo en el que los valores van de 1 a 100, donde 100 muestra las áreas con mayor idoneidad climática donde pueda distribuirse la especie de interés.
Dentro del algoritmo, se seleccionó la ejecución del módulo de análisis de similitud multivariada ambiental (MESS por sus siglas en inglés) el cual genera un mapa que muestra la similitud de cualquier punto en un conjunto de puntos de referencia con respeto a las variables predictoras elegidas (Elith et al., 2011). Esta información es de utilidad para determinar las áreas de incertidumbre en las proyecciones con diferentes escenarios de cambio climático.
El tratamiento de los archivos ASCII obtenidos al correr el algoritmo fueron visualizados con el Sistema de Información Geográfica (SIG), ArcGIS 10.2, y transformados a formato ráster. Una vez generados los mapas, se proyectaron con valores continuos y a partir del umbral seleccionado (10 percentil), se generó una rampa de colores en tonos de verde para mostrar el área con mayor idoneidad, dejando en color gris los valores por debajo del umbral.
Para construir la distribución potencial bajo los efectos de cambio climático, se utilizaron 2 escenarios que representan “trayectorias de concentración representativas” (RCPs por sus siglas en inglés) propuestas por el Panel Intergubernamental de Cambio Climático Global (IPCC por sus siglas en inglés). Las RCPs están representadas por el valor del forzamiento radiativo W/m2, que corresponde a la energía solar media absorbida por m2 sobre la tierra (Phillips et al., 2006). Las RCPs difieren de los escenarios empleados hasta 2007 en que contemplan los efectos de las políticas orientadas a mitigar el CC (IPCC, 2013).
El primer escenario utilizado fue el RCP 4.5, dicho escenario considera la implementación de medidas de mitigación, tales como el uso de energías alternas, implementación de programas de reforestación y cambios en la alimentación global orientados a disminuir la superficie de tierras de cultivos y pastizales destinados a la ganadería, lo cual tendría como efecto un incremento moderado en los gases de efecto invernadero presentes en la atmósfera, los cuales hacia el 2100 se estabilizarán en 4.5 W/m2, equivalentes a 538 ppm de CO2, por lo que este escenario es clasificado como de estabilización. El segundo escenario fue el RCP 8.5, bajo éste se observaría una falta de políticas para reducir emisiones y el continuo uso de combustibles fósiles. Esto generaría que para el año 2100, las emisiones de carbono alcancen valores de 8.5 W/m2, equivalentes a 936 ppm de CO2, este escenario es considerado extremo (Van Vuuren et al., 2011; IPCC, 2013). Estos escenarios se seleccionaron por ser los empleados en la actualización para estudios de impacto, vulnerabilidad y adaptación en México y Centroamérica (Fernández et al., 2016).
Ambos escenarios se proyectaron a un horizonte para el año 2080, que ha sido previamente empleado por diversos estudios tales como Mendoza-González (2013) y García et al. (2014). El modelo de cambio climático empleado fue el CNRM-CM5 elaborado por el Centre National de Recherches Meteorologiques (CNRM), de Francia. Se utilizó este modelo por ser uno de los más empleados para la actualización de estudios de impacto, vulnerabilidad y adaptación en México y Centroamérica (Fernández et al., 2016).
La validación de los modelos se realizó a través de una curva ROC, la cual usa el área bajo la curva (AUC por sus siglas en inglés) (Pepe, 2000). El valor de AUC varía de 0 a 1, entre más cercano a 1, el modelo presenta mejor desempeño, mientras que valores cercanos a 0.5 indican que el modelo es igual que lo esperado al azar (Fielding y Bell, 1997). Algunos autores (Ferri et al., 2005; Lobo et al., 2007; Peterson y Nakazawa, 2008) han criticado el uso de las curvas ROC para medir la efectividad de los modelos, ésto principalmente porque resume el rendimiento del modelo con regiones del espacio de la curva ROC con la que el investigador raramente trabajaría (e.g., regiones con bajo nivel de especificidad) y porque pondera los errores de omisión y comisión por igual. A pesar de que en muchas ocasiones estos errores pueden no tener la misma importancia, actualmente se recomienda el uso de ROC parcial para subsanar estos problemas. Éste difiere del ROC total, cuyo eje de valores de las abscisas no es la proporción de errores de comisión, sino el área total predicha por el algoritmo (función del valor del umbral). El ROC parcial establece un parámetro E que es una medida del error que se tolera en las omisiones considerando que el error de omisión es más grave que el de comisión y no considera la totalidad del área bajo la curva, sino creando curvas parciales limitadas en un extremo por el mínimo de sensibilidad aceptable y en el otro, por el máximo de sobre predicción tolerable (Mendoza-González et al., 2016; Peterson y Nakazawa, 2008). Este método emplea los modelos generados por MaxEnt y puntos de presencias independientes a los usados para validación. Como resultado, genera valores para cada punto que van de 0 a 2 empleando la tasa de identificación correcta de las presencias contra el área total predicha por el algoritmo (Barve, 2008). Las proporciones con valores cercanos a 1 describen un comportamiento que es similar al azar y aquellos cercanos a 2, sugieren un mejor desempeño al analizar la presencia frente a la ausencia de la especie en el modelo. Los resultados obtenidos se muestran en la tabla 3. Estos análisis fueron llevados a cabo con el programa Niche Tool Box (http://shiny.conabio.gob.mx).
Tabla 3
Resultados de las curvas ROC parcial y de los valores AUC del análisis de los puntos de calibración de los modelos para cada especie. El valor de proporción promedio de ROC parcial indica el desempeño del modelo. Se muestra el valor de significancia (p) de cada modelo.
|
AUC |
ROC parcial |
|||
|
Especie |
Entrenamiento |
Validación |
Proporción promedio |
p |
|
Cakile edentula |
0.899 |
0.899 |
1.82 |
0.001 |
|
Ernodea littoralis |
0.878 |
0.872 |
1.74 |
0.001 |
|
Scaevola plumieri |
0.885 |
0.913 |
1.79 |
0.001 |
|
Suriana maritima |
0.822 |
0.842 |
1.66 |
0.001 |
|
Tournefortia gnaphalodes |
0.836 |
0.874 |
1.68 |
0.001 |
Finalmente, se crearon 4 mapas del área de distribución, considerando los puntos de registro de las especies, las áreas potenciales de distribución en condiciones climáticas actuales, las áreas potenciales de distribución con el escenario RCP 4.5 y las áreas potenciales de distribución con el escenario RCP 8.5 (ambos al horizonte temporal 2080).
Para identificar las áreas naturales protegidas presentes en el área de estudio, se consultaron las bases de datos de la Conabio y se descargaron los “shapefiles” correspondientes a las reservas federales y estatales de la República Mexicana (http://www.conabio.gob.mx/informacion/gis/?vns=gis root/region/biotic/anpe09gw). A partir de estos polígonos, se seleccionaron los que estaban dentro del área de estudio y se agruparon en una capa independiente para determinar las áreas que se localizan en zonas protegidas en donde se distribuyen las especies de interés.
Resultados
De acuerdo con la prueba de jackknife, la variable precipitación anual (BIO 12), obtuvo un peso alto de contribución en los modelos generados, constituyendo hasta 62.7% para C. edentula, 57.8% para S. plumieri, 51.7% para S. maritima, 28.2% para T. gnaphalodes, mientras que para E. litoralis, obtuvo valores de solo 7.8%, colocándola como la cuarta variable de mayor peso de las 9 que conformaron el modelo. La tabla 2 muestra la contribución de cada variable ambiental a los modelos de distribución potencial para cada especie. Otras variables que también se repiten en todos los modelos fueron la temperatura estacional (BIO 4), la temperatura media del trimestre más húmedo (BIO 8) y la temperatura media del cuarto más cálido (BIO 10) (tabla 2).
El modelo se evaluó bajo 2 pruebas, la curva ROC y la curva ROC parcial. Las especies que obtuvieron valores más elevados en ambas pruebas fueron, en orden de mayor a menor: C. edentula, S. plumieri y E. littoralis, mientras que T. gnaphalodes y S. maritima reportaron los valores más bajos (tabla 3). Los modelos generados para el escenario actual indican que las especies de interés potencialmente tienen una amplia área de distribución en la península de Yucatán, esto puede confirmarse viendo los registros de puntos recolectados, los cuales se distribuyen por toda la zona costera de esta región biogeográfica (fig. 2a) principalmente en la costa norte. Asimismo, los modelos indican que las áreas menos favorables se ubican al este, en la porción central de la costa del estado de Quintana Roo y al oeste en la sección norte del estado de Campeche (fig. 2b).
La especie con mayor área de distribución potencial fue S. plumieri, con 11,681 km2 (tabla 4). Su área potencial se ubica al oeste en la porción sur de Campeche, al norte, a lo largo de toda la costa norte de la península de Yucatán, a excepción de la porción ubicada en el límite entre Yucatán y Quintana Roo. Mientras que al este, se localiza en la porción norte de Quintana Roo y al norte de Cozumel (fig. 2.1b). De acuerdo al tamaño del área de distribución potencial, la siguiente especie fue S. maritima con una superficie de 9,074 km2 (tabla 4). Su área de distribución potencial se extiende desde el oeste en Campeche, donde presenta un fragmento al sur del estado y otro en el centro del mismo ubicado al sur de la zona de los Petenes, así como al norte del estado (fig. 2.2b). En Yucatán, su distribución abarcaría toda la costa en dirección al este, hasta la porción central de Quintana Roo y otra área potencial al sur (fig. 2.2b). Por su parte, T. gnaphalodes tiene un área de distribución potencial de 7,486 km2 (tabla 4). Su área abarcaría desde el oeste, donde se puede localizar en 2 parches, el primero al sur de Campeche y el segundo en la zona central de dicho estado (fig. 2.3b). Al norte, desde el límite entre Campeche y Yucatán, hasta la porción centro-norte de Yucatán, y al este, desde el norte de Quintana Roo, distribuyéndose en dirección sur, con un área de interrupción en la zona central del estado y posteriormente al sur del mismo (fig. 2.3b).
Las especies con una menor área de distribución potencial fueron C. edentula y E. littoralis. C. edentula con 6,153 km2 (tabla 4), al oeste en las porciones sur y centro de Campeche, al norte en Yucatán y al este, desde el norte de Quintana Roo hasta la porción norte de la isla de Cozumel (fig. 2.4b). El área potencial de E. littoralis es de 5,440 km2 (tabla 4), se ubica al oeste en el límite sur de Campeche, al norte a lo largo de la costa de Yucatán y al este en diversas zonas (fig. 2.5). La primera, abarcaría del norte de Quintana Roo hasta la altura de la porción norte de la isla de Cozumel, la segunda en la porción central de Quintana Roo y el tercero en la porción sur del mismo (fig. 2.5b).
Los modelos obtenidos proponen que las especies estudiadas verán afectadas negativamente sus áreas de distribución potencial por efecto del cambio climático (fig. 2c). Dicha afectación es más notoria mientras más extremo es el escenario de cambio (fig. 2d). La especie que presentaría una mayor afectación sería S. maritima, la cual en el escenario más conservador (RCP 4.5) sufriría una disminución de 94% en su área potencial. La distribución potencial se limitaría a 2 zonas: la primera en el centro-noroeste de Yucatán y la segunda al norte de Quintana Roo (fig. 2.2c). Por su parte, en el escenario extremo (RCP 8.5) el área potencial se perdería por completo (fig. 2.2d). La siguiente especie que presentaría mayores afectaciones es C. edentula, la cual en el escenario RCP 4.5 reduciría su área de distribución potencial en un 86.62% (tabla 4). Las zonas remanentes se ubicarían en 2 secciones, la primera sería una reducida área ubicada al centro-noroeste de la península y la segunda, de mayor tamaño, en el extremo noreste de la península, al norte de Quintana Roo (fig. 2.4c). En el escenario RCP 8.5, la reducción con respecto al escenario actual sería de 93.01% (tabla 4). Bajo esta proyección, el área de distribución potencial sería similar a la del escenario anterior pero más reducida, la zona de distribución ubicada al centro-noroeste desaparecería completamente, mientras que la ubicada al noreste se vería disminuida (fig. 2.4d).
Con respecto a S. plumieri, ésta tendría una reducción de 84.55% en su área potencial, bajo el escenario RCP 4.5 (tabla 4). Su distribución se vería limitada a 2 zonas; la primera y de menor dimensión, se ubicaría al centro-noroeste en Yucatán y la segunda al noreste de la península en la porción norte de Quintana Roo (fig. 2.1c). Para el escenario RCP 8.5, la reducción del área sería de 88.93% (tabla 4). En este escenario la distribución de la especie se limitaría a 2 zonas, con ubicaciones similares al escenario anterior, sin embargo, la zona localizada al centro-noroeste se reduciría en tamaño y se ubicaría ligeramente más al oeste que en el escenario anterior, mientras que la zona localizada al noreste es de menor tamaño y más fragmentado (fig. 2.1d).
Las especies menos afectadas por el cambio climático según las proyecciones realizadas serían E. littoralis y T. gnaphalodes. En la RCP 4.5, E. littoralis presentaría una disminución de 73.8% del área potencial predicha (tabla 4). La distribución de la especie en este escenario consistiría en 2 zonas, la primera sería una zona pequeña ubicada al centro-noroeste de Yucatán y la segunda de mayor tamaño, ubicada en el extremo noreste de la península. Sin embargo, para el escenario RCP 8.5, esta especie perdería un 82% de su área de distribución potencial (tabla 4). La única zona potencial para esta especie bajo este modelo, se localizaría al noreste de la península en la sección norte de Quintana Roo, dicha zona a pesar de tener una ubicación similar a la del escenario anterior, se presentaría más segmentada y sería de menor tamaño (fig. 2.5d).
Tabla 4
Áreas con condiciones climáticas favorables para la distribución de las especies de duna costera bajo el escenario actual y 2 proyecciones a futuro en la costa de la península de Yucatán. El área favorable (km2) es la superficie donde se espera que las especies puedan distribuirse. Entre paréntesis se muestra el porcentaje de cambio entre el escenario actual y cada escenario de cambio.
|
Especie |
Escenario actual |
Escenario RCP 4.5 |
Escenario RCP 8.5 |
|
Área favorable |
Área favorable |
Área favorable |
|
|
Cakile edentula |
6,153 |
823 (-86.6%) |
430 (-93%) |
|
Ernodea littoralis |
5,440 |
1,425 (-73.8%) |
895 (-83.5%) |
|
Scaevola plumieri |
11,681 |
1,804 (-84.5%) |
1,292 (-88.9) |
|
Suriana maritima |
9,074 |
529 (-94.2%) |
0 (-100%) |
|
Tournefortia gnaphalodes |
7,486 |
2,048 (-72.6%) |
1,318 (-82.4%) |
Finalmente, para T. gnaphalodes, el escenario RCP 4.5 proyecta una pérdida de 72.64% de distribución potencial (tabla 4). La predicción ocurre en 3 áreas, la primera en la zona centro-noroeste de la península en Yucatán, la segunda al noreste de la península, al norte de Quintana Roo y la tercera al este de la península, en la sección central de Quintana Roo. En la RCP 8.5, el área disminuiría un 82.39% (tabla 4), con un área al noreste de la península en Quintana Roo y la segunda ubicada al centro-noroeste de Yucatán (fig. 2.3d).
Los modelos de distribución potencial generados muestran que las superficies favorables dentro de las áreas protegidas se verán seriamente afectadas en los escenarios de cambio climático, principalmente bajo el escenario más extremo. S. maritima es la especie que perdería mayor porcentaje de cobertura dentro de las zonas protegidas bajo ambos escenarios. En la proyección del escenario con condiciones climáticas actuales, esta especie tiene un área potencial de 3,174 km2 (tabla 5). En este escenario, se le podría localizar en las ANP: Laguna de Términos, Ría Celestún, El Palmar, Dzilam, Ría Lagartos, Yum Balam, Isla Contoy, Costa Occidental Isla Mujeres, Punta Cancún y Punta Nizuc, Sistema Lagunar Chacmochuch, Manglares de Nichupté, Laguna de Manatí, Kabah, Puerto Morelos, Cozumel Arrecifes (en su zona terrestre), Cozumel porción Norte, Laguna Colombia, Xcacel, Tulum y Sian Ka’an (fig. 2.1b). En el escenario RCP 4.5, su área disminuye 97.82%, lo que restringiría su distribución únicamente a las ANP de Yum Balam, Isla Contoy y Sistema Lagunar de Chacmochuch, mientras que para la proyección del escenario RCP 8.5, ya no se distribuiría en ningúna ANP dentro del área de estudio (tabla 5, fig. 2.1c, 2.1d).
C. edentula es la siguiente especie que presentaría una reducción significativa en su área potencial de distribución. En el escenario actual ocupa aproximadamente 2,762 km2 dentro de los polígonos de ANP (tabla 5), Laguna de Términos en su porción sur, Ría Celestún, El Palmar, Dzilam, Ría Lagartos, Yum Balam, Isla Contoy, Costa Occidental Isla Mujeres Punta Cancún y Punta Nizuc, Sistema Lagunar Chacmochuch, Manglares de Nichupté, Laguna de Manatí, Kabah, Costa Occidental Isla Mujeres, Punta Cancún y Punta Nizuc, Puerto Morelos y Cozumel porción norte (fig. 2.2b). Sin embargo, para el escenario RCP 4.5, el área potencial dentro de las ANP se reduciría en 91.41% limitándose a una pequeña porción al este de la ANP de Yum Balam y en el extremo norte de Isla Contoy (tabla 5, fig. 2.2c). Para el escenario RCP 8.5, la pérdida sería de 93.9% con respecto al escenario actual, contando con área potencial únicamente en la ANP de Yum Balam (tabla 5, fig. 2.2d).
Bajo la proyección de distribución potencial actual, S. plumieri estaría presente en todas las ANP con excepción del área de Los Petenes y Sian Ka’an abarcando 3,004 km2 (tabla 5, fig. 2.3b). No obstante, para el escenario RCP 4.5, el área se reduciría 88.65% abarcando únicamente a las ANP: Yum Balam, Isla Contoy, Sistema Lagunar Chacmochuch, Laguna Manatí, Kabah, Manglares de Nichupté, Costa occidental Isla Mujeres, Punta Cancún y Punta Nizuc y Puerto Morelos (tabla 5, fig. 2.3c). Para el escenario RCP 8.5 se reduciría un 91.68%, perdiendo superficie en las ANP de Costa occidental Isla Mujeres, Punta Cancún y Punta Nizuc y Puerto Morelos, mientras que en las ANP de Yum Balam, Isla Contoy, Sistema Lagunar Chacmochuch, Laguna de Manatí, Kabah y Manglares de Nichupté, abarcaría un área menor (tabla 5, fig. 2.3d).
La especie E. littoralis abarca una área potencial de aproximadamente 1,971 km2 en el escenario actual (tabla 5). Esta distribución abarca las ANP de Laguna de Términos (en su porción sur), Ría Celestún, El Palmar, Dzilam, Ría Lagartos, Yum Balam, Isla Contoy, Costa Occidental Isla Mujeres Punta Cancún y Punta Nizuc, Sistema Lagunar Chacmochuch, Manglares de Nichupté, Laguna de Manatí, Kabah, Puerto Morelos, Cozumel porción Norte, Laguna Colombia, Xcacel, Tulum y Sian Ka’an (fig. 2.4b). Para el escenario RPC 4.5, su distribución se reduciría en 84.77%, limitándose a las ANP de Yum Balam, Isla Contoy, Refugio Estatal Sistema Lagunar Chacmochuc, Laguna de Manatí, Manglares de Nichupté, Kabah y Cozumel (tabla 5, fig. 2.4c). Para el escenario RCP 8.5, el área dentro de la reserva de Yum Balam se fragmentaría y su distribución al sureste se reduciría a las ANP de Isla Contoy y Sistema Lagunar Chacmochuch (tabla 5, fig. 2.4d).
Tabla 5
Áreas con condiciones climáticas favorables para la distribución de las especies de duna costera dentro de las 21 áreas naturales protegidas establecidas a lo largo de la costa de la península de Yucatán bajo el escenario actual y 2 proyecciones a futuro. El área favorable (km2) es la superficie donde se espera que las especies puedan distribuirse. Entre paréntesis se muestra el porcentaje de cambio entre el escenario actual y cada escenario de cambio.
|
Especie |
Escenario actual |
Escenario RCP 4.5 |
Escenario RCP 8.5 |
|
Área favorable |
Área favorable |
Área favorable |
|
|
Cakile edentula |
2,762 |
237 (-91.4%) |
167 (-93.9) |
|
Ernodea littoralis |
1,971 |
300 (-84.7%) |
221 (-88.7%) |
|
Scaevola plumieri |
3,004 |
341 (-88.6%) |
251 (-91.6%) |
|
Suriana maritima |
3,174 |
69 (-97.8%) |
0 (-100%) |
|
Tournefortia gnaphalodes |
2,176 |
342 (-84.2%) |
255 (-88.3%) |
Finalmente, T. gnaphalodes es la especie que presentaría menor afectación, en el escenario actual, su área potencial abarca 2,176 km2, distribuidas en todas las ANP de la península con excepción de los Petenes (tabla 5, fig. 2.5b). Para el escenario RCP 4.5 su distribución se limitaría a las ANP de Yum Balam, Isla Contoy, Sistema Lagunar Chacmochuch, Laguna Manatí, Kabah, Manglares de Nichupté, Costa occidental Isla Mujeres, Punta Cancún y Punta Nizuc, Cozumel porción Norte y Puerto Morelos; lo cual se traduciría en una pérdida de 84.2% (tabla 5, fig. 2.5c). Para el escenario RCP 8.5, la disminución del área potencial sería de 88.3%, la especie estaría distribuida dentro de las ANP de Yum Balam, Isla Contoy, Sistema Lagunar Chacmochuch, Laguna Manatí, Kabah, Manglares de Nichupté, Costa occidental Isla Mujeres, Punta Cancún, Punta Nizuc y Puerto Morelos, su área potencial se encontraría más segmentada (tabla 5, fig. 2.5d).
Discusión
Al igual que en otros ecosistemas terrestres, como los desiertos (e.g., Valiente-Banuet y Verdú, 2007), en los ecosistemas de dunas costeras es posible distinguir especies de plantas que son fundamentales para el establecimiento de otras, lo cual finalmente determina la diversidad y afecta directamente la funcionalidad de estos ecosistemas. En este trabajo se eligieron 5 especies clave por ser fijadoras del sustrato y por modificar condiciones microambientales favorables para otras especies, siendo además dominantes en la estructura de estas comunidades (Espejel, 1987; Parra-Tabla et al., 2018). En general, nuestros resultados mostraron que bajo los 2 escenarios de CC la distribución potencial de las especies seleccionadas se vería perjudicada y que estos cambios podrían incrementar el riesgo de afectación en áreas actualmente definidas como de conservación de ecosistemas costeros de la península de Yucatán. De igual forma, nuestros resultados sugieren que ante los escenarios de CC existirían algunas zonas de la península de Yucatán que podrían contener características ambientales propicias para el mantenimiento de las especies seleccionadas.
De acuerdo con los modelos realizados, se pudo apreciar que las 5 especies estudiadas tienen una amplia distribución potencial en la zona costera de la península de Yucatán, particularmente en la costa norte y porciones importantes de Campeche y Quintana Roo. Sin embargo, su distribución se interrumpe en la zona oeste en la porción norte de Campeche. El análisis de la distribución potencial mostró que S. plumieri es la especie con una mayor área de distribución potencial, seguida de S. maritima y T. gnaphalodes, mientras que la especies que contaron con una menor distribución fueron C. edentula y E. littoralis. Estos resultados son consistentes con el hecho de que las especies con mayor distribución potencial están reportadas como especies de distribución amplia dentro de las zonas costeras de México (Espejel et al., 2017; Villaseñor, 2016). S. plumieri abarca además de la península de Yucatán los estados de Veracruz, Tabasco, Tamaulipas y Baja California Sur, Colima, Jalisco y Sinaloa (Espejel et al., 2017), mientras que S. maritima y T. gnaphalodes se localizan desde Veracruz hasta la península de Yucatán (Parra-Tabla et al., 2018; Villaseñor, 2016). Por su parte, E. littoralis y C. edentula son especies que en México se consideran exclusivas de la península de Yucatán (Espejel, 1987; Moreno-Casasola y Espejel, 1986).
Los 5 modelos analizados mostraron a la precipitación anual (BIO 12) como una de las variables más importantes para explicar la distribución de las 5 especies. Este resultado coincide con los estudios realizados por Miller et al. (2010) quienes indican que, en el caso de dunas fijas como las que se localizan en la península de Yucatán, la precipitación es el factor más influyente para la distribución de las especies, aun por encima de los valores relacionados con la temperatura. En el mismo sentido, Castillo et al. (1991) compararon la composición vegetal de 2 sistemas de dunas de Tabasco y Campeche, y concluyeron que las diferencias en composición de la vegetación entre ambos sistemas estaba dada principalmente por las diferencias en precipitación.
Así mismo, los modelos también mostraron que variables como la temperatura estacional (BIO 4), la temperatura media del trimestre más húmedo (BIO 8) y la temperatura media del cuarto más cálido (BIO 10), también contribuyeron para explicar la distribución potencial de las especies utilizadas, aunque de manera menos importante. A este respecto en Sudáfrica, Peter et al. (2003) señalan particularmente a S. plumieri como una de las especies más importantes para la estabilización de la duna, pero también mencionan que su crecimiento puede verse limitado por las altas temperaturas que se registran en verano. En México, Álvarez (2019) identificó la temperatura estacional como una de las variables de mayor importancia para la germinación de C. edentula, mientras que Mendoza-González et al. (2013), observaron que la temperatura del trimestre más húmedo fue una de las variables más relevantes para explicar la distribución potencial de C. edentula y T. gnaphalodes. Estos resultados, en conjunto con los observados en este trabajo, sugieren que a pesar de que el gradiente de temperatura en la península de Yucatán no es tan marcado (Veleva et al., 1997), tanto este factor como la precipitación son determinantes para explicar distribución de las especies seleccionadas.
Los resultados de los modelos bajo los escenarios de cambio climático empleados, señalan que las áreas potenciales de distribución de las especies se verían severamente restringidas bajo ambos escenarios. A pesar de que los requerimientos de cada especie muestran variaciones respecto a la proporción de hábitat que se perdería, en términos generales en el escenario más drástico (RCP 8.5) la disminución sería más pronunciada. En ambos escenarios las áreas donde las especies podrían distribuirse se limitan al norte y noreste de la península de Yucatán. Mendoza-González et al. (2013) también exploraron las posibles consecuencias del CC y el incremento en el nivel del mar en la distribución potencial de 2 de las especies estudiadas en este trabajo (C. edentula y T. gnaphalodes), considerando de igual forma un escenario de cambio climático que propone un cambio drástico (A2) y uno de cambio conservador (B2), para los años 2050 y 2080 (IPCC, 2000). En concordancia con los resultados encontrados en este trabajo, Mendoza-González et al. (2013) observaron que bajo diferentes condiciones de CC el área de distribución de las especies analizadas se reduciría drásticamente. Específicamente señalan que para el año 2080, la distribución potencial de C. edentula se reduciría en más de 3 veces respecto a la distribución potencial actual en el escenario conservador y que en el escenario drástico se perdería por completo. De igual forma para T. gnaphalodes, observaron que en el escenario moderado su distribución potencial se reduciría más de 4 veces respecto a su distribución actual y que en el escenario más drástico también se perdería por completo.
Nuestros resultados mostraron que la especie que se vería más afectada sería S. maritima la cual pasa de ser la segunda especie con más hábitat potencial en la península de Yucatán, a reducirse en 94% en el escenario RCP 4.5 y desaparecer en el RCP 8.5. Por su parte, C. edentula tendría una reducción de 86.6% en el escenario RCP 4.5 y de 93% en el escenario RCP 8.5 y S. plumieri, una reducción de 84.5% en el escenario RCP 4.5 y de 88.9% en el escenario RCP 8.5. Estas 3 especies tienen en común que dentro de los modelos la precipitación anual (BIO 12) contribuyó con más de 50%, lo que sugiere que son susceptibles a los cambios en los regímenes de precipitación anual. Por su parte, los modelos revelaron que las especies que se verían relativamente menos afectadas son T. gnaphalodes, la cual se mantendría como la especie con una mayor área de distribución y E. littoralis. La primera tendría una reducción de su área de 72% en el escenario RCP 4.5 y de 82% en el escenario RCP 8.5; mientras que la segunda tendría una reducción de 73% y de 83% bajo los escenarios RCP 4.5 y RCP 8.5, respectivamente. En contraste con S. maritima, C. edentula y S. plumieri, en T. gnaphalodes y en E. Littoralis, la variable de precipitación anual significó apenas el 28% y el 7.8%, respectivamente, dentro de sus modelos de distribución. Para estas especies, se observó que en conjunto las variables relacionadas con la temperatura explicaban entre 30% y 50%, sugiriendo que aunque el gradiente de temperatura no sea drástico en la península de Yucatán (Valeva et al., 1997), para algunas especies puede ser relevante para explicar su distribución potencial actual y bajo escenarios de CC.
Diversos autores han llamado la atención para que se considere la redefinición de las áreas sujetas a planes de manejo y conservación debido a efectos que podría tener el CC (Mendoza-González et al., 2013, 2016; Prisco et al., 2013; Tabor et al., 2018), ya que al modificarse las condiciones ambientales es probable que algunas especies de interés dejen de ubicarse dentro de las áreas de protección. Esta evaluación es de especial relevancia para las especies consideradas como clave de los ecosistemas en general, pero en particular para asegurar la funcionalidad de ecosistemas protegidos (Stys et al., 2017). Por ejemplo, a través de un análisis de CC en bosques nublados en México, Rojas et al. (2012) mencionan que para el horizonte 2050, existirá poca coincidencia entre las áreas naturales protegidas y las zonas que conservarían condiciones climáticas apropiadas para la distribución de especies características de ese tipo de ecosistemas.
Los resultados de este trabajo nos mostraron que la mayoría de las ANP ubicadas en la zona costera de la península de Yucatán no podrían retener las condiciones ambientales necesarias para el establecimiento de las especies estudiadas. Si bien bajo el escenario actual se observó que aparentemente las 5 especies se distribuyen en la mayoría de las zonas abarcadas por las ANP, con excepción de Los Petenes, se pudo notar en todos los casos que existiría una clara disminución de zonas favorables dentro de los polígonos de las ANP. Nuevamente los modelos sugieren que S. maritima sería la especie más afectada, ya que su área de distribución podría disminuir en 97% en el escenario RCP 4.5 y 100% en el RCP 8.5, en todas las áreas protegidas, seguida de C. edentula y S. plumieri, las cuales perderían 91% y 94%, y 88% y 91%, respectivamente en los escenarios RCP 4.5 y RCP 8.5. Estas especies solo conservarían áreas de distribución en Yum Balam. Por su parte, a pesar de que existiría una disminución de 84% y de 88% en el área estimada para las especies E. littoralis y T. gnaphalodes en los escenarios RCP 4.5 y 8.5, se lograrían conservar áreas potenciales de distribución tanto en la ANP de Yum Balam, como en el noreste de la península que abarcaría la ANP de Costa occidental de Isla Mujeres, Punta Cancún y Punta Nizuc.
Mendoza-González et al. (2016) y Rojas (2018) han sugerido que la zona norte de Yucatán posee condiciones ambientales favorables para el establecimiento de especies de duna costera, incluso bajo los escenarios de CC. De acuerdo con sus resultados, Mendoza-González et al. (2016) proponen que en esa zona sería deseable el establecer un área de protección, ya que particularmente la zona noreste posee una considerable riqueza de especies de plantas de duna costera en la actualidad y las condiciones climáticas apropiadas para mantener dichas especies a futuro. Los resultados de nuestro trabajo apoyan esta sugerencia, ya que se observó que las zonas norte y noreste de la península de Yucatán mantendrían las condiciones climáticas necesarias para la presencia de todas las especies de interés en el escenario RCP 4.5, e incluso para las especies S. plumieri y T. gnaphalodes en el escenario RCP 8.5. Desafortunadamente, la zona central del litoral yucateco no solo carece de ANP que protejan la vegetación de duna costera, sino que actualmente es la zona más afectada por el desarrollo urbano y por la presencia de especies invasoras (Parra-Tabla et al., 2018).
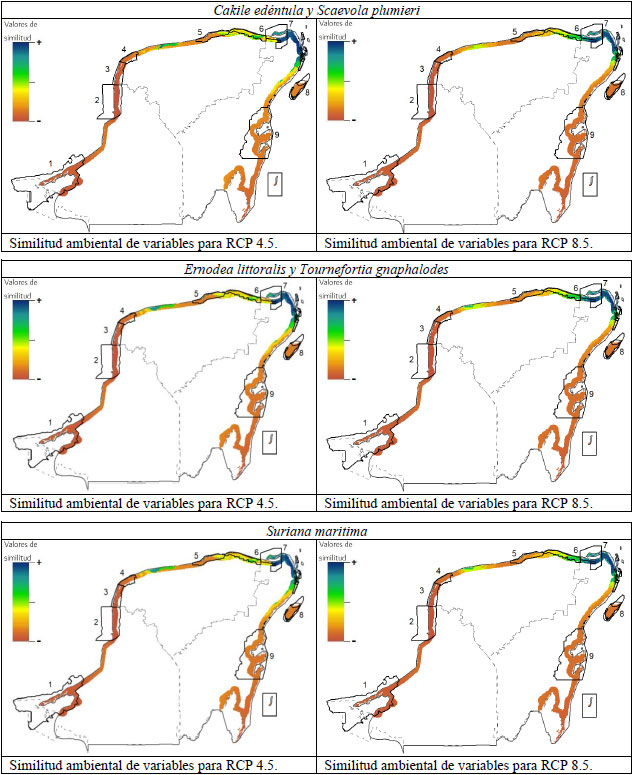
El análisis MESS sugirió que el área de mayor similitud ambiental para los escenarios de CC, se encontrarían principalmente en la porción noreste de la península (fig. 3). Por el contrario, la zona de mayor disimilitud se encontraría al oeste de la península en el área comprendida desde el norte de Celestún hasta el sur de los Petenes. Adicionalmente, se puede observar una zona de moderada similitud ubicada al norte de la península, al centro noreste de Yucatán, la cual destaca por encontrarse aislada en medio de un área de alta disimilitud ambiental (fig. 3). La explicación de esta distribución puede atribuirse a las principales variables ambientales que conformaron los modelos. La temperatura del trimestre más húmedo (BIO8) nos indica que las especies se distribuyen en el escenario actual en un intervalo de 25.7 °C a 28.4 °C. Los valores más bajos de esta variable se localizan precisamente en la zona noreste y los más altos en la zona oeste. Al realizar la proyección al RCP 4.5, la cual calcula un incremento de temperaturas de hasta 1.3 °C, las áreas al oeste incrementan sus valores de temperatura por encima de los calibrados para la especie, generando disimilitud ambiental. Mientras que al este se presentaban las temperaturas más bajas, también se ve un incremento en las mismas, pero sigue manteniéndose en el intervalo de temperatura en la que se espera que la especie pueda distribuirse. El escenario RCP 8.5 nos presenta la misma dinámica, sin embargo, al tener un mayor incremento de temperaturas, el área donde se conservaría la similitud ambiental se reduciría.
Con respecto al área aislada al centro noreste de Yucatán, su presencia puede deberse a la influencia las variables de temperatura estacional (BIO 8 y BIO 4), las cuales presentan valores bajos en esta zona. Es por ello que a pesar de que el CC ocasionaría un incremento en las temperaturas del área, el modelo MESS sigue reportando una zona de estabilidad ambiental en esta área. Los requerimientos particulares de cada especie generan que no todas ellas cuenten con áreas de distribución potencial en esta zona. Mientras en el escenario RCP 4.5 todas las especies podrían establecerse en esta zona, variando el área que ocupan según su tolerancia a las variaciones climáticas, en el escenario RCP 8.5, solo S. plumieri y T. gnaphalodes presentan áreas de distribución potencial en este punto. Esto puede atribuirse a que estas especies presentan una mayor tolerancia a variaciones de precipitación anual (BIO 12) las cual presentan sus valores más altos en la zona norte de la península.
Este análisis enfatiza la importancia de tomar acciones de preservación en la zona noreste de la península de Yucatán, así como de la zona noroeste de estado de Yucatán, ya que no solo son las áreas donde se espera que las especies puedan distribuirse en un futuro, sino que son las áreas donde los modelos arrojan una menor extrapolación de información y por ende una mayor precisión en los modelos.
Finalmente, es importante notar que en este trabajo se modeló la distribución potencial de las 5 especies tomando en cuenta únicamente el efecto de factores climáticos, sin considerar otros factores, como la presencia de infraestructura o el incremento de actividades antropogénicas sobre la zona de dunas, que podrían afectar la distribución de las especies (Guisan y Zimmermann, 2000; Jiménez-Orocio et al., 2015; Soberón y Peterson, 2005). Estos factores tienen importancia en la presencia y distribución de las especies por lo que sería relevante tenerles en cuenta en estudios futuros.
Así mismo, es importante tener en cuenta que los modelos se calibraron con base en datos de presencias, y si bien la presencia de las poblaciones en ciertas condiciones son un indicador de sus preferencias y requerimientos, las especies tienen capacidad de cambiar y adaptarse, capacidad que no se refleja en los modelos (Thuiller et al., 2011).
Agradecimientos
Al Conacyt por el apoyo financiero a través del proyecto 248406 a V.P.T.; así como el apoyo a través de una beca para la realización de los estudios de posgrado de N.O.H. A los herbarios de la Universidad Autónoma de Yucatán, del Centro de Investigación Científica de Yucatán; al herbario virtual de la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad por permitirnos el acceso a sus bases de datos y al Laboratorio de Biología de la Conservación de la UNAM, del Parque Científico y Tecnológico de Yucatán. Las sugerencias del editor asociado, así como de dos revisores anónimos a una versión previa de este trabajo, permitieron mejorar sustancialmente el mismo.
Referencias
Acosta, M. L., Carranza, C. F. e Izzi, C. F. (2009). Are there habitats that contribute best to plant species diversity in coastal dunes? Biodiversity and Conservation, 18, 1087–1098. https://doi.org/10.1007/s10531-008-9454-9
Álvarez, E. R., Mendoza-González, G., Pérez, M. C. y Chiappa, C. X. (2019). Efecto del sitio de procedencia sobre los atributos de las semillas de Cakile edentula (Brassicaceae), especie estabilizadora de duna costera. Botanical Sciences, 97, 74–81. https://doi.org/10.17129/botsci.2050
Angulo, D. F., Tun, G. J., Arceo, G. G., Munguía, R. y Parra-Tabla, V. (2018). Patterns of phylogenetic community structure of sand dune plant communities in the Yucatán Peninsula: the role of deterministic and stochastic processes in community assembly. Plant Ecology and Diversity, 11, 515–526. https://doi.org/10.1080/17550874.2018.1534289
Barve, N. (2008). Tool for partial-ROC, ver 1.0. Lawrence, K. S: Biodiversity Institute. Comisión Nacional de Áreas Naturales Protegidas (CONANP). Recuperado Junio, 2019 de: http://www.conanp.gob.mx/ Accesado May 2019.
Bergin, D. O. y Kimberley, M. O. (1997). Rehabilitation of coastal foredunes in New Zealand using indigenous sand-binding species. Science for Conservation, 122, 1173–2946.
Brown, T. J. y Charles, G. C. (1997). Reorganization of an arid ecosystem in response to recent climate change. Proceedings of the National Academy of Sciences of the United States of America, 94, 9729–9733.
Cannizzo, Z. J., Dixon, S. R. y Griffen, B. D. (2017). An anthropogenic habitat within a suboptimal colonized ecosystem provides improved conditions for a range-shifting species. Ecology and Evolution, 8, 1521–1533. https://doi.org/10.1002/ece3.3739
Castellanos, V. A. E., Bravo, L. C., Koch, G. W., Llano, J., Deladier, L. J. L., Méndez, J. C. et al. (2009). Impactos ecológicos por el uso del terreno en el funcionamiento de ecosistemas áridos y semiáridos. En F. F. E. Molina y R. T. VanDevender (Eds.), Diversidad biológica de Sonora (pp. 157–186). México: Morracantua.
Castillo, S., Popma, J. y Moreno-Casasola, P. (1991). Coastal sand dune vegetation of Tabasco and Campeche, Mexico. Journal of Vegetation Science, 2, 73–88. https://doi.org/10.2307/3235899
Castillo, S. y Moreno-Casasola, P. (1996). Sand dune vegetation: an extreme case of species invasion. Journal of Coastal Conservation, 2, 13–22. https://doi.org/10.1007/bf02743033
Castillo, S. y Moreno-Casasola, P. (1998). Análisis de la flora de dunas costeras del golfo y Caribe de México. Acta Botanica Mexicana, 45, 55–80. https://doi.org/10.21829/abm45.1998.812
Cruz, C. G., Villaseñor, J. L., López, M. L., Martínez, M. E. y Ortiz, E. (2014). Selección de predictores ambientales para el modelado de la distribución de especies en MaxEnt. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 20, 187–200. https://doi.org/10.5154/r.rchscfa.2013.09.034
D’Amen, M., Bombi, P., Pearman, P. B., Schmatz, D. R., Zimmermann, N. E. y Bologna, M. A. (2011). Will climate change reduce the efficacy of protected areas for amphibian conservation in Italy? Biological Conservation, 144, 989–997. https://doi.org/10.1016/j.biocon.2010.11.004
Davic, R. D. (2003). Linking Keystone Species and Functional Groups A New Operational Definition of the Keystone Species Concept. Conservation Ecology, 7, 1–12. https://doi.org/10.5751/es-00502-0701r11
Del Vecchio, S., Prisco I, Acosta, A. T. R. y Stanisci, A. (2015). Changes in plant species composition of coastal dune habitats over a 20-year period. AoB Plants, 5, 10–18. https://doi.org/10.1093/aobpla/plv018
Elith, J., Graham, C., Anderson, R., Dudík, M., Ferrier, S., Guisan, A. et al. (2006). Novel methods improve prediction of species distributions from occurrence data. Ecography, 29, 129–151. https://doi.org/10.1111/j.2006.0906-7590.04596.x
Elith, J. S. J., Phillips, T., Hastie, M., Dudik, Y. E. y Chee, C. J. (2011). A statistical explanation of MaxEnt for ecologists. Diversity and Distributions, 17, 43–57. https://doi.org/10.1111/j.1472-4642.2010.00725.x
Espejel, I. (1984). La vegetación de las dunas costeras de la Península de Yucatán. Análisis florístico del estado de Yucatán. Biótica, 9, 183–210.
Espejel, I. (1987). A phytogeographical analysis of coastal vegetation in the Yucatán Peninsula. Journal of Biogeography, 14, 449–519. https://doi.org/10.2307/2844877
Espejel, I., Jiménez-Orocio, O., Gonzalo, C. C., Garcillán, P. Á., Castillo, A. L., Duran, R. et al. (2017). Flora en playas y dunas costeras de México. Acta Botanica Mexicana, 121, 39–81. https://doi.org/10.21829/abm121.2017.1290
Espinosa, D. S., Ocegueda C., Aguilar, C., Flores, O. y Llorente, J. (2008). El conocimiento biogeográfico de las especies y su regionalización natural, en J. R. Acosta y S. Gutiérrez (Eds.), Capital natural de México, vol. I. Conocimiento actual de la biodiversidad (pp. 33–65). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. https://doi.org/10.32800/abc.2019.42.0187
Eskuche, U. (1992) La vegetación de las dunas marítimas de América Latina. Bosque, 13, 23–28. https://doi.org/10.4206/bosque.1992.v13n1-03
Faggi, A. y Dandon, J. (2011). Temporal and spatial changes in plant dune diversity in urban resorts. Coast Conservation, 15, 585–594. https://doi.org/10.1007/s11852-011-0148-1
Fernández, A., Zavala, J., Romero, R., Conde, A. C. y Trejo, I. (2016). Actualización de los escenarios de cambio climático para estudios impactos, vulnerabilidad y adaptación en México y Centroamérica. Mexico D.F.: Centro de Ciencias de la Atmosfera, UNAM. https://doi.org/10.7818/ecos.2016.25-1.20
Ferri, C., Flach, P., Hernández-Orallo J. y Senad, A. (2005). Modifying ROC curves to incorporate predicted probabilities. Proceedings of the Second Workshop on ROC Analysis in Machine Learning, 4140, 33–40. https://doi.org/10.1007/s10994-013-5328-9
Fielding, A. H. y Bell, J. F. (1997). A review of methods for the assessment of prediction errors in conservation presence/ absence models? Environmental Conservation, 24, 38–49. https://doi.org/10.1017/s0376892997000088
Flores, S. y Espejel, I. (1994). Tipos de vegetación de la Península de Yucatán en J. S. Flores (Eds.), Etnoflora Yucatánense (pp. 1–35). México: Universidad Autónoma de Yucatán. https://doi.org/10.22209/ic.v59n4a05
Franklin, J. (2009). Mapping species distributions: spatial inference and prediction. Cambridge: Cambridge University Press.
García, E. (2004). Modificaciones al sistema de clasificación climática Köppen. México D.F.: UNAM.
García, C. R., Cavazos, M. T., De Grau, P. y Santillán, S. N. (2014). Analysis and modeling of extreme temperatures in several cities in northwestern Mexico under climate change conditions. Theory Applied Climatology, 116, 211–225. https://doi.org/10.1007/s00704-013-0933-x
Guisan, A. y Zimmermann, N. E. (2000). Predictive habitat distribution models in ecology. Ecological Modelling, 135, 147–186. https://doi.org/10.1016/s0304-3800(00)00354-9
Gutiérrez, B. C., Avendaño, R. S. y Zamora, C. P. (2013). La familia Goodeniaceae en México. Foresta Veracruzana, 2, 1–6.
Hannah, L., Midgley, G. F. y Millar, D. (2002). Climate change-integrated conservation strategies. Global Ecology and Biogeography, 11, 485–495. https://doi.org/10.1046/j.1466-822x.2002.00306.x
Harley, C. D. G., Hughes, R. A., Hultgren, K. M., Miner, B. G., Cascade, J. B., Thornber, C S., Rodriguez, L. F., Tomanek, L. y Williams S. (2006). The impacts of climate change in coastal marine systems. Ecology Letters, 9, 228–241. https://doi.org/10.1111/j.1461-0248.2005.00871.x
Hijmans, R. J., Cameron, S. E., Parra, J. L., Jones, P. G. y Jarvis, A. (2005). Very high resolution interpolated climate surface for global land areas. Journal of Climatology, 25, 1965–1978. https://doi.org/10.1002/joc.1276
Hockings, M. (1998). Evaluating management of protected areas: integrating planning and evaluation. Environmental Management, 22, 337–345. https://doi.org/10.1007/s002679900109
Hockings, M. (2003). Systems for assessing the effectiveness of management in protected areas. Bioscience, 53, 823–832. https://doi.org/10.1641/0006-3568(2003)053[0823:sfateo]2.0.co;2
Hughes, L. (2000). Biological consequences of global warming: is the signal already apparent? Trends in Ecology and Evolution, 15, 56–61. https://doi.org/10.1016/s0169-5347(99)01764-4
IPCC. (2000) Special report on emissions scenarios. Cambridge: Cambridge University Press.
IPCC. (2013). Summary for policymakers in Climate Change 2013: The Physical science basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, RU: Cambridge University Press. https://doi.org/10.1017/cbo9781107415324.004
Jiménez-Orocio, O., Espejel. I. y Martínez, M. L. (2015). La investigación científica sobre dunas costeras de México: origen, evolución y retos. Revista Mexicana de Biodiversidad, 86, 486–507. https://doi.org/10.1016/j.rmb.2015.04.022
Koske, R., Gemma, J., Corkidi, L., Sigüenza, C. y Rincón, C. E. (2008). Arbuscular mycorrhizas. En M. L. Martínez y N. P. Psuty (Eds.), Coastal dunes (pp. 173–187). Berlín: Springer. https://doi.org/10.1007/978-3-540-74002-5_11
Kritikos, D. J., Sutherst, R. W., Brown, J. R., Adkins, S. W. y Maywald, G. F. (2003). Climate change and the potential distribution of an invasive alien plant: Acacia nilotica ssp. Indica in Australia. Journal of Applied Ecology, 40, 111–124. https://doi.org/10.1046/j.1365-2664.2003.00777.x
Lara, J. R. (2008). Los ecosistemas costeros, insulares y epicontinentales. En J. Sarukhán (Eds.), Capital natural de México (pp. 109–134). México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. https://doi.org/10.32800/abc.2019.42.0187
Lobo, J. M., Jiménez-Valverde, A. y Real, R. (2007). AUC: a misleading measure of the performance of predictive distribution models. Global Ecology and Biogeography, 17, 145–151. https://doi.org/10.1111/j.1466-8238.2007.00358.x
López-Portillo, J., Martínez, M. L., Hesp, P., Hernández, J. R., Méndez, A. P., Reyes-Vásquez, V. et al. (2011). Atlas de las costas de Veracruz: manglares y dunas. Xalapa: Universidad Veracruzana.
Martínez, M. L., Psuty, N. P. y Lubke, R. A. (2004). A perspective on coastal dunes. Coastal dunes: ecology and conservation. Ecological Studies, 171, 3–10. https://doi.org/10.1007/978-3-540-74002-5_1
Martínez, M. L., Moreno-Casasola, P., Espejel, I., Jiménez-Orocio, O., Infante, M. D., y Rodríguez, R. N. (2014). Diagnóstico de las dunas costeras de México. México D.F.: Comisión Nacional Forestal. https://doi.org/10.1016/j.rmb.2015.04.022
Mendoza-González, G., Martínez, M. L., Soto, R. O., Vázquez, G. y Gallego, F. J. (2013). Ecological niche modeling of coastal dune plants and future potential distribution in response to climate change and sea level rise. Global Change Biology, 19, 2524–2535. https://doi.org/10.1111/gcb.12236
Mendoza-González, G., Martínez, M. L, Rojas-Sotob, O. y Téllez-Valdez, A. (2016). Priority areas for conservation of beach and dune vegetation of the Mexican Atlantic coast. Journal for Nature Conservation, 33, 25–34. https://doi.org/10.1016/j.jnc.2016.04.007
Miko, U. F. K. (1999). Modelling forest growth and carbon storage in response to increasing CO2 and temperature. Chemical and Physical Meteorology, 5, 15–30.
Miller, T. E., Gornish, E. S. y Buckley, H. L. (2010). Climate and coastal dune vegetation: disturbance, recovery and succession. Plant Ecology, 206, 97–104. https://doi.org/10.1007/s11258-009-9626-z
Moreno-Casasola, P. y Espejel, I. (1986). Classification and ordination of coastal sand dune vegetation along the Gulf and Caribbean Sea of Mexico. Vegetation, 66, 147–182. https://doi.org/10.1007/bf00039908
Moreno-Casasola, P., Infante-Mata, D., Espejel, I., Jiménez-Orocio, O., Martínez, M. L., Rodríguez-Revelo, N. (2014). Yucatán. En M. L. Martínez, P. Moreno-Casasola, I. Espejel, O. Jiménez-Orocio, D. Infante-Mata y N. Rodríguez-Revelo (Eds.), Diagnóstico de las dunas costeras de México (pp. 327–338). México D.F.: Comisión Nacional Forestal. https://doi.org/10.21829/abm121.2017.1290
Morrone, J. J., Espinosa, O. y Llorente, B. J. (2002). Mexican biogeographic provinces: preliminary scheme, general characterizations, and synonymie. Acta Zoológica Mexicana, 85, 83–108.
Munguía-Rosas, M., Angulo, D. F., Arceo-Gómez, G. y Parra-Tabla, V. (2019) Variation in leaf traits across a precipitation gradient in coastal sand dunes in Yucatán Peninsula. Journal of Arid Environments, 162, 10–17. https://doi.org/10.1016/j.jaridenv.2018.12.001
Neeti, N., Rogan, J., Christman, Z., Eastman, R. J., Millones, M., Schneider, L. et al. (2012). Mapping seasonal trends in vegetation using AVHRR-NDVI time series in the Yucatán Peninsula, Mexico. Remote Sensing Letters, 3, 433–442. https://doi.org/10.1080/01431161.2011.616238
Paine, R. T. (1995). A conversation on refining the concept of keystone species. Conservation Biology, 9, 962–964. https://doi.org/10.1046/j.1523-1739.1995.09040962.x
Parra-Tabla, V., Albor, P. C., Tun G. J., Angulo, D. F., Barajas, C., Silveira, R. et al. (2018). Spatial patterns of species diversity in sand dune plant communities in Yucatán, Mexico: importance of invasive species for species dominance patterns. Plant Ecology and Diversity, 11, 157–172. https://doi.org/10.1080/17550874.2018.1455232
Pepe, M. S. (2000). Receiver operating characteristic methodology. Journal of the American Statistical Association, 95, 308–311.
Peter, C. I., Ripley, B. S. y Robertson, M. P. (2003). Environmental limits to the distribution of Scaevola plumieri along the South African coast. Journal of Vegetation Science, 14, 89–98. https://doi.org/10.1111/j.1654-1103.2003.tb02131.x
Peterson, A. T. y Nakazawa, Y. (2008). Environmental data sets matter in ecological niche modeling: an example with Solenopsis invicta and Solenopsis richteri. Global Ecology and Biogeography, 17, 135–144. https://doi.org/10.1111/j.1466-8238.2007.00347.x
Phillips, S. J., Anderson, R. P. y Schapire, R. E. (2006). Maximum entropy modeling of species geographic distributions. Ecological Modelling, 190, 231–259. https://doi.org/10.1016/j.ecolmodel.2005.03.026
Phillips, S. y Dudík, M. (2008). Modeling of species distributions with Maxent: new extensions and a comprehensive evaluation. Ecography, 31, 161–175. https://doi.org/10.1111/j.0906-7590.2008.5203.x
Ponce, R. R., Reynoso, G. V. H., Watason, J. E. M., Wandelwar J., Fuller, R. A., Pressey R. L. et al. (2012). Vulnerability of cloud forest reserves in Mexico to climate change. Nature Climate Change, 2, 448–452. https://doi.org/10.1038/nclimate1453
Prisco, I., Carboni, M. y Acosta, A. T. R. (2013). The fate of threatened coastal dune habitats in Italy under Climate Change scenarios. Plos One, 8, e68850. https://doi.org/10.1371/journal.pone.0068850
Quesada, Q. M., Acosta, V. L. M., Arias, A. D. y Rodríguez, G. A. (2017). Modelación de nichos ecológicos basado en tres escenarios de cambio climático para cinco especies de plantas en zonas altas de Costa Rica. Revista Forestal Mesoamericana Kurú, 34, 1–12. https://doi.org/10.18845/rfmk.v14i34.2991
Reckendorf, F., Leach, D., Baum, R. y Carlson, J. (1985). Stabilization of Sand Dunes in Oregon. Agricultural History, 59, 260–268.
Rodríguez-Zúñiga, M. T., Troche-Souza, C., Vázquez-Lule, A. D., Márquez-Mendoza, J. D., Vázquez-Balderas, B., Valderrama-Landeros, L. et al. (2013). Manglares de México: extensión, distribución y monitoreo. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. https://doi.org/10.5962/bhl.title.111178
Rojas, C. M. D. (2018). Áreas prioritarias de conservación de duna costera en el golfo de México y península de Yucatán (Tesis). Universidad Autónoma de Yucatán. México. Yucatán. https://doi.org/10.22209/ic.v59n4a05
Rojas, S. O., Sosa, V. y Ornelas, J. F. (2012) Forecasting cloud forest in eastern and southern Mexico: conservation insights under future climate change scenarios. Biodiversity and Conservation, 21, 2671–2690.
Rust, I. C. y Illenberg, W. K. (1996). Coastal dunes: sensitive or not? Landscape and Urban Planning, 34, 165–69. https://doi.org/10.1016/0169-2046(95)00232-4
Rzedowski, J. (1978). Vegetación de México. México: Limusa.
Rzedowski, J. y Reyna-Trujillo, T. (1990). Tópicos biogeográficos. México D.F.: Instituto de Geografía, UNAM.
Saunders, S. y Easley, T. (2007). Losing ground: western national parks endangered by climate disruption. The George Wright Forum, 24, 41–81.
Schweiger, O. y Settle, K. O. (2008). Climate change can cause spatial mismatch of trophically interacting species. Ecology, 89, 3472–3479. https://doi.org/10.1890/07-1748.1
Shcheglovitova, M. y Anderson, R. (2013). Estimating optimal complexity for ecological niche models: A jackknife approach for species with small simple sizes. Ecological Modelling, 269, 9–17. https://doi.org/10.1016/j.ecolmodel.2013.08.011
Soberón, J. y Peterson, A. (2005). Interpretation of models of fundamental ecological niches and species distributional areas. Biodiversity Informatics, 2, 1–10. https://doi.org/10.17161/bi.v2i0.4
Stys, B., Foster, T., Fuentes, M. P. B. M., Glazer, B., Karish, K., Montero N. et al.(2017). Climate Change impacts on Florida’s biodiversity and ecology. En E. P. Chassignet, J. W. Jones, V. Misra y J. Obeysekera (Eds.), Florida’s climate: changes, variations, & impacts (pp. 339–388) Florida: Florida Climate Institute. https://doi.org/10.17125/fci2017.ch12
Tabor, K., Hewson, J., Tien, H., González, R. M., Hole, D., Williams, J. W. et al. (2018). Tropical protected areas under increasing threats from Climate Change and deforestation. Land, 7, 90–104. https://doi.org/10.3390/land7030090
Thuiller, W., Lavorel, S., Araujo, M. B., Sykes, M. T. y Prentice, I. C. (2005). Climate change threats to plant diversity in Europe. Proceedings of the National Academy of Sciences, 102, 8245–8250. https://doi.org/10.1073/pnas.0409902102
Thuiller, W., S. Lavergne, C., Roquet, I. B. y Araújo, M. B. (2011). Consequences of climate change on the Tree of Life in Europe. Nature, 448, 550–552. https://doi.org/10.1038/nature09705
Torres, W., Méndez, M., Dorantes, A. y Duran, R. (2010). Estructura composición y diversidad del matorral de duna costera en el litoral Yucateco. Boletín de la Sociedad Botánica Mexicana, 86, 37–51. https://doi.org/10.17129/botsci.2319
Valiente, B. A. y Verdu, M. (2007). Facilitation can increase the phylogenetic diversity of plant communities. Ecology Letters, 10, 1029–1036. https://doi.org/10.1111/j.1461-0248.2007.01100.x
Van Vuuren, D. P., Edmonds J., Kainuma, M., Riahi, K., Thomson, A., Hibbard, K. et al. (2011). The representative concentration pathways: an overview. Climatic Change, 109, 5–31. https://doi.org/10.1007/s10584-011-0148-z
Veleva, L., Pérez, G. y Acosta, M. (1997). Statistical analysis of the temperature-humidity complex and time of wetness of a tropical climate in the Yucatán Peninsula in Mexico. Atmospheric Environment, 31, 773–776. https://doi.org/10.1016/s1352-2310(96)00232-4
Villaseñor, J. L. (2016). Catálogo de las plantas vasculares nativas de México. Revista Mexicana de Biodiversidad, 87, 559–902. https://doi.org/10.1016/j.rmb.2016.06.017



