Willy Maldonado *
Wildlife Conservation Society, Calle Chiclayo 1008, Miraflores, Lima, Perú
*Autor para correspondencia: wmaldonado@wcs.org (W. Maldonado-Chambi)
Recibido: 22 agosto 2022; aceptado: 13 octubre 2023
Resumen
El oso andino es la única especie de oso que habita Sudamérica; su población se reduce principalmente por pérdida de hábitat y cacería debido a la interacción humano-oso andino. El objetivo de este estudio fue determinar la viabilidad poblacional en el paisaje Madidi Tambopata a través de modelado computacional. Para ésto, se diseñaron varios escenarios: base, fragmentación de hábitat y cacería, y efectos combinados de la fragmentación de hábitat y cacería. Cada escenario se simuló 1,000 veces con proyecciones a 100 años con el software VORTEX 9.6. Se evaluaron: probabilidad de persistencia, tasa de crecimiento y tiempo de extinción. Los resultados señalan que la población del oso andino es viable (PP = 100%) en 100 años de simulación, creciendo en 0.04% anualmente y no hay riesgo de extinción. Sin embargo, la cacería redujo la probabilidad de persistencia a 41%, la tasa de crecimiento disminuyó a -0.03% anualmente. En un paisaje fragmentado, la tasa decrece a -0.04% por efecto de la endogamia y la probabilidad de extinción aparece a los 60 años. Es fundamental establecer estrategias de conservación que apunten al control de la cacería; al mismo tiempo, establecer mecanismo de conservación que aseguren una disponibilidad continua de hábitat adecuado.
Palabras clave: Interacción humano-oso; Mecanismo de conservación; Probabilidad de extinción; Unidades de conservación; Coexistencia; Gestión efectiva; Sitios prioritarios
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Population viability of the Andean bear (Tremarctos ornatus) in a scenario of hunting and habitat loss
Abstract
The Andean bear is the only species of bear that inhabits South America. Its population is reduced due to the loss of habitat and indiscriminate hunting due to human-Andean bear interaction. The objective was to determine the population viability of the Andean bear in the paisaje Madidi Tambopata through computer modelling. For this, several scenarios were designed: base, habitat fragmentation and hunting, and combined effects of habitat fragmentation and hunting. Each scenario was simulated 1,000 times with 100-year projections with the VORTEX 9.6 software. The following were evaluated: the probability of persistence, growth rate, and extinction time. The results indicate that the population of the Andean bear is viable (PP = 100%) in 100 years of simulation, growing by 0.04% annually, and there is no risk of extinction. However, hunting reduced the probability of persistence to 41%, and the growth rate decreased to -0.03% annually. In a fragmented landscape, the rate decreases to -0.04% due to inbreeding and the probability of extinction appears at 60 years. It is essential to establish conservation strategies that aim to control hunting and, simultaneously, establish conservation mechanisms that ensure continuous availability of suitable habitat.
Keywords: Interaction human-bear; Conservation mechanism; Probability of extinction; Conservation units; Coexistence; Effective management; Priority sites
© 2024 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
El oso andino es una especie endémica de los Andes y es el único representante de la familia Ursidae en Sudamérica. Su distribución histórica abarcó desde Venezuela hasta el sur de Bolivia. Actualmente, comprende los Andes de Venezuela, Colombia, Ecuador, Perú y Bolivia (Vela-Vargas et al., 2021; Wallace et al., 2014). En el paisaje Madidi Tambopata (PMT) se documentó su presencia desde el 2009 (Márquez y Pacheco, 2010).
El área ocupada por el oso andino se estima en aproximadamente 260,000 km2; mientras que el rango altitudinal va de 250 hasta 4,750 m snm; ocupa diversos ecosistemas, desde el bosque seco ecuatorial (< 1,500 m snm) hasta la punta altoandina (3,400-5,000 m snm). Es considerada una especie sombrilla (Figueroa y Stucchi, 2009; Ríos-Uzeda et al., 2005). El registro histórico de la población de esta especie en Perú era de 18,000 a 65,000 individuos en un hábitat contiguo (Peyton, 1980). Actualmente, la principal población del oso andino se encuentra en la unidad de conservación prioritaria UCO Andes Centrales 4 (sur de Perú y norte de Bolivia), con alrededor de 3,447 individuos (3 osos por 100 km2) en un área de 114,902.25 km2 (Wallace et al., 2014). Al norte de su área de distribución, se estima una población de 122 individuos en un área de 4,215.15 km² (Rodríguez et al., 2020); en otros países, se calcula de 4 a 12 osos por 100 km2 (Garshelis, 2011; Molina et al., 2017).
A lo largo del área de distribución del oso andino, sus principales amenazas son la pérdida y fragmentación de hábitat y la cacería indiscriminada (Figueroa, 2015; Peralvo et al., 2005), lo que puede derivar en una extinción local (Juárez-Casillas y Varas, 2011; Ruiz-García, 2003; Ruiz-García et al., 2005).
En el PMT, al sur del Perú, entre 2020 y 2021 hubo casos frecuentes de cacería de osos andinos, pero solo 4 eventos fueron reportados (Serfor, 2022). Mientras, la pérdida de hábitat por el cambio de uso de suelo es constante para ampliación de la frontera agrícola, carreteras y concesiones mineras. Por tanto, nuestra pregunta es ¿cuál es el impacto de la cacería y la pérdida de hábitat sobre la viabilidad poblacional del oso andino en el corto y largo plazo? y ¿cuál es el tiempo medio de extinción estimado para las poblaciones del PMT? Conocer ésto es fundamental ya que permitirá identificar acciones de conservación en distintas ventanas temporales que eviten la extinción de la especie. En este marco, nuestro objetivo es determinar la viabilidad de la población del oso andino en el largo plazo a través de modelos computacionales.
Materiales y métodos
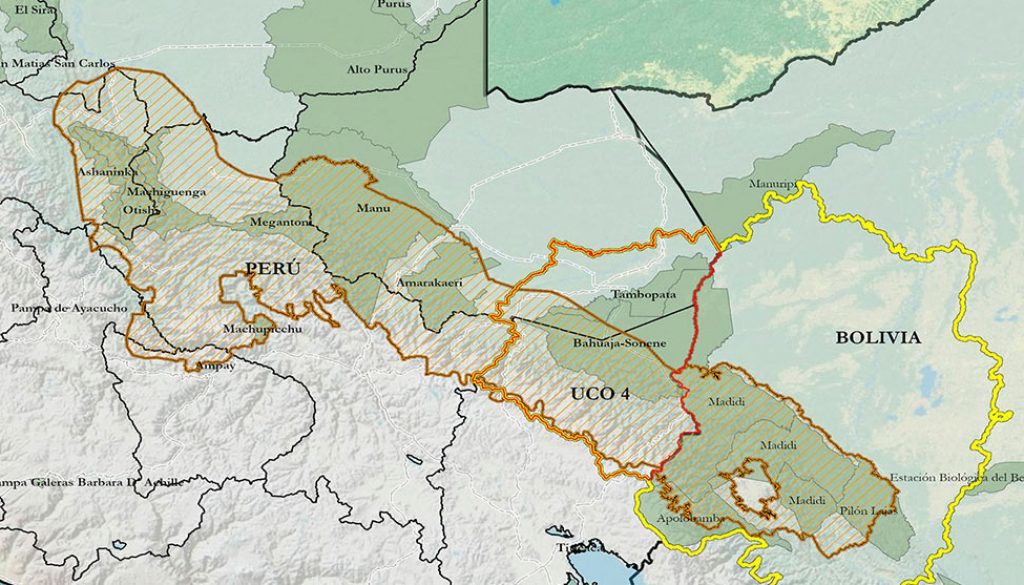
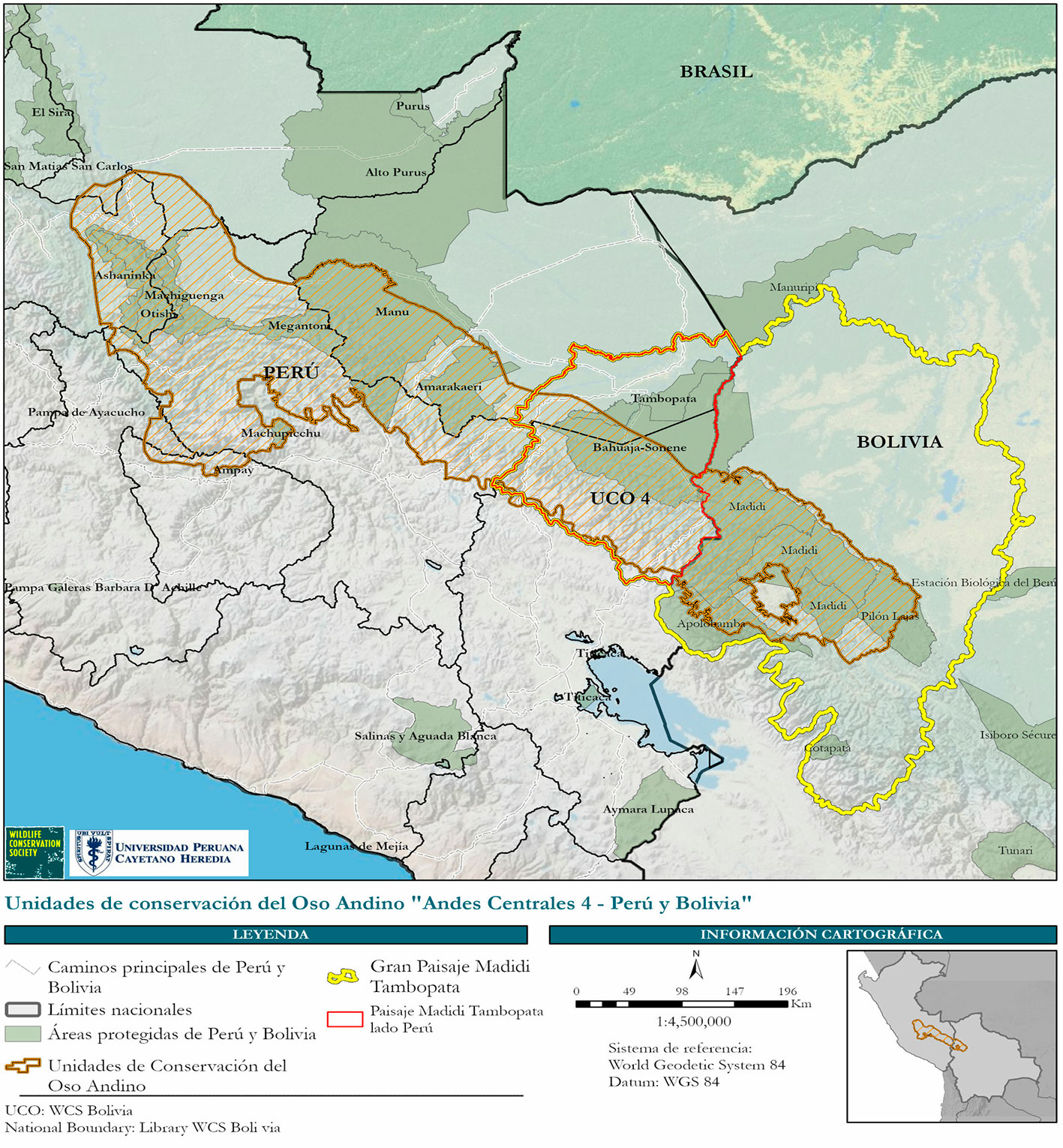
La unidad de conservación del oso andino denominada UCO 4 está ubicada en los andes centrales del sur del Perú y norte de Bolivia, es la mayor franja de extensión probada del hábitat de la especie (110,951.42 km2) en su área de distribución. Agrupa 13 áreas naturales protegidas, 10 en Perú y 3 en Bolivia. Pese a estar agrupadas, no representa un hábitat contiguo y protegido, ya que existen 10 carreteras de alto tránsito que promueven distintas actividades de desarrollo humano, afectando, reduciendo y fragmentando el hábitat del oso andino, sobre todo en los aquellos en donde no existe ninguna modalidad de conservación. El incremento de las actividades de desarrollo en la UCO 4 podrían poner en riesgo la integridad de esta unidad de conservación.
Tabla 1
Valores demográficos, genéticos y ambientales utilizados para construir los 5 escenarios de cacería y pérdida de hábitat.
| Parámetro | Valor |
| Número de poblaciones | 1 |
| Sistema de reproducción | Polígamo |
| Depresión por endogamia | Sí (3.14 equivalentes letales) |
| Edad que alcanza la madurez sexual | 4 años ♂ y 4 años ♀ |
| Edad de la primera reproducción (machos y hembras) | 5 años ♂ y 5/4 ♀ |
| Máxima edad de reproducción | 10 ♂/28 ♀ |
| Porcentaje de hembras reproduciéndose | 80 |
| Máxima camada por año | 4 |
| Mortalidad de la clase 0-2 años (osezno) | 10% |
| Mortalidad de la clase 2-4 años (subadulto) | 15% ♂/10% ♀ |
| Mortalidad de la clase más allá de los 4 años (adulto) | 10% ♂/10% ♀ |
| Porcentaje del pool de machos en reproducción | 45 |
| proporción de sexos al nacer | 1:1 |
| Reproducción dependiente de densidad | No |
| Catástrofes | 1 (sequía) |
| Tamaño inicial de la población (N) | 183 individuos |
| Capacidad de carga (K) | Igual que N |
| Número de iteraciones y años de proyección | 1,000 iteraciones a 100 años |
El estudio se realizó en el PMT, al sudeste del Perú, entre los años 2015 y 2020. En este periodo se realizaron 3 salidas de campo en el PMT (fig.1) para registrar información sobre actividades humanas que generan la interacción humano-oso andino y uso de hábitat. Para ello usamos el método de ocupación, seleccionando 9 cuadrículas de 16 km2, en cada cuadrícula se trazaron 3 transectos de 600 m, cada uno distribuido al azar, evitando su traslape. El análisis de viabilidad poblacional se realizó con el software VORTEX versión 9.6 (Lacy, 2020; Lacy, Miller et al., 2015), este programa analiza la viabilidad poblacional mediante la simulación estocástica de un proceso de extinción. El programa VORTEX realiza simulaciones tipo Monte Carlo y es utilizado para el análisis de viabilidad de poblaciones de especies usualmente amenazadas. VORTEX modela las interacciones entre parámetros poblacionales y biológicos, de manera que el modelo permite poner a prueba los efectos de diferentes escenarios en la tasa de crecimiento o en el riesgo de extinción de una población en un determinado periodo, normalmente 100 años, y de esta manera compara y determina las mejores opciones de manejo (Brightsmith y White, 2012; Lacy, Borbat et al., 2015). VORTEX es ampliamente utilizado por el grupo de especialistas en cría en cautiverio (Comisión de Supervivencia de Especies, UICN) y otras agencias de diferentes gobiernos, para estimar la viabilidad poblacional, el tamaño mínimo poblacional y de hábitat (Brito y Figueiredo, 2003). Su uso es ampliamente conocido en la planificación de acciones que conlleven a la conservación de mamíferos (Altrichter et al., 2016; Berger, 1990; Medici y Desbiez, 2012), específicamente los Carnivora (Horino y Miura, 2000), Primates (Brito y Grelle, 2006; Rodríguez-Matamoros, 2012) y Diprotodontia (Lindenmayer, 1993); así como aves (García-Antón y Traba, 2021; Maldonado, 2007) y peces (Wang et al., 2019). También ha sido utilizado para explorar la reintroducción de vertebrados (Howells y Edwards-Jones, 1997). Para una explicación detallada de VORTEX, consultar Miller y Lacy (1999), Lacy (2000) y Lacy et al. (2015b).
El modelo base se construyó a partir de información sobre factores demográficos: hábitat, población y factores genéticos (variabilidad genética de la población y variación ambiental). Para cubrir esta necesidad de información se utilizó la proveniente de las salidas de campo e información secundaria; para ésto, se realizó la búsqueda en Google Académico, utilizando palabras claves como: oso andino o (Tremarctos ornatus)* AND conflicto, oso andino o (Tremarctos ornatus)* AND interacción humano-oso, oso andino o (Tremarctos ornatus)* AND hábitat, oso andino o (Tremarctos ornatus)* AND cacería, oso andino o (Tremarctos ornatus)* AND actividades humanas. El criterio de validación de la información se basó en que fueran artículos científicos publicados en revistas indexadas en base de datos de Scopus o Web of Science, o documentos técnicos institucionales con algún nivel de competencia sobre el oso andino, como el Servicio Nacional Forestal y de Fauna Silvestre – Serfor, Ministerio del Ambiente – Minam, Ministerio de Desarrollo Agrario y Riego – Midagri y la Unión Internacional para la Conservación de la Naturaleza – UICN. Los parámetros de ingreso al modelo base se muestran en la tabla 1; mientras que los de ingreso para los escenarios se describen en la tabla 2.
Tabla 2
Diseño de escenarios y parámetros evaluados en el modelo de cacería y perdida de hábitat.
| Escenario | Parámetros evaluados |
| 1) Disminución y 2) fragmentación de hábitat | Disminución de la capacidad de carga por la pérdida de hábitat en 10%, 20% y 50%. |
| 3) Cacería por interacción humano-oso andino | Incremento de la mortalidad de adultos en edad reproductiva (15% en machos y 10% en hembras). Incremento de la mortalidad de adultos en edad reproductiva (15% en machos y 10% en hembras). Disminución del éxito reproductivo con 45% en machos y 60% en hembras, debido a la cacería. |
| 4) Catástrofe: sequía | Disminución de alimento, efecto sobre la reproducción y cría.
Presencia entre 80% a 90%, dado que ocurren cada año. |
| 5) Depresión por endogamia | Disminución de la supervivencia de los individuos en su primer año de vida (valores de 3.14 equivalentes letales con 50% debido a alelos letales recesivos). |
Parámetros poblacionales
El modelo base consideró una población cuya característica fue ser una población cerrada (sin inmigración ni emigración) para la UCO 4, debido a la separación con la UCO 3 y la UCO 5. Para el análisis se consideraron 3 tamaños iniciales teóricos de la población (Wallace et al., 2014). Para la UCO 4 una densidad razonable de 3 osos/100 km2, una segunda población con una densidad de 2 osos/100 km2 (población por fuera de las áreas protegidas en la UCO 4) y una tercera población con una densidad de 1 oso/100 km2 para el PMT. La estimación final se realizó siguiendo los resultados de Morrell et al. (2021) y Rodríguez et al. (2020) (tabla 1).
La capacidad de carga (K) es una interacción entre el área de un ambiente y el tamaño de una población; es decir, describe la capacidad que tiene un ambiente para mantener una población. Al no tener información confiable sobre este parámetro para el oso andino, se asume que el valor de K es igual al tamaño de población de la especie. Por lo tanto, si el tamaño de N excede K al final de un tiempo determinado, VORTEX impone una mortalidad en todas las clases de edad para reducir la población al límite superior de la capacidad de carga (Miller y Lacy, 2005).
Las variaciones ambientales (VA) son cambios en tiempo y espacio, provocan fluctuaciones anuales en el tamaño de las poblaciones al afectar la sobrevivencia de individuos y el número de crías que nacen (Akçakaya et al., 2000). VORTEX mide el efecto del ambiente sobre diferentes variables solicitando desviaciones estándares (DE) de los valores promedio a evaluar. Al no contar con esta información para el ambiente del oso andino, se asumió que en la zona de evaluación las condiciones ambientales son relativamente estables, por ello se estableció arbitrariamente un valor de 10% de variación ambiental y una correlación de 95% en las variaciones de supervivencia y reproducción.
VORTEX modela los efectos negativos de la endogamia al disminuir la supervivencia de los individuos de oso andino en su primer año de vida y en la reproducción sobre todo en pequeñas poblaciones. El impacto de la endogamia se modeló como 3.14 de equivalentes letales. Este valor que usa el programa VORTEX es sobre el efecto de la endogamia en 40 poblaciones de 38 especies de mamíferos en cautiverio (Ralls et al., 1988). También se utilizó el valor propuesto por el programa de 50% de carga genética debido a los equivalentes letales (Miller y Lacy, 1999). En el modelo, se define como extinción a la ausencia de uno de los sexos (macho o hembra), aunque existan individuos al final de la simulación de los escenarios, ya que no hay forma de crecimiento de la población con un solo sexo. Se consideró que la población era viable si tenía una probabilidad de extinción (PE) menor a 20% (umbral de viabilidad poblacional) en 100 años.
Parámetros reproductivos
Los osos son una especie polígama, los machos copulan con varias hembras en su área de distribución (Castellano, 2015). Pareciera que la poligamia es una estrategia para evitar la muerte de los oseznos por machos adultos (Zarzo, 2020). Está documentado que una hembra de oso andino puede parir hasta 4 oseznos por camada, pero lo común es parir 2 (García-Rangel, 2012; Figueroa y Stucchi, 2009; Nowak, 1991; Peyton, 1980). Ante la falta de presión sobre este parámetro, se asumió una proporción de 0.50:0.50 o 50/50. VORTEX define como edad de reproducción al momento en que nace la primera cría y no la edad de madurez sexual. Figueroa y Stucchi (2009) observaron que el oso andino macho alcanza su edad reproductiva entre 4 y 8 años y en la hembra entre 4 y 7 años.
Se asumió que todos los osos adultos pueden reproducirse (90 – 100%) si hay la disponibilidad de al menos 1 hembra adulta reproductiva con la que pueda aparearse. Es diferente en las hembras (80 – 85%), la gestación no es frecuente, pero cuando la hay, este periodo puede llegar a 250 días. Después de nacer los oseznos, las madres los acompañan hasta los 2 años (Rosenthal, 1989); si los oseznos mueren antes de los 2 años, las hembras pueden volver a preñarse.
La reproducción dependiente de la densidad no se incluyó en el modelo. VORTEX tiene la capacidad de modelar este parámetro con una ecuación que especifica la proporción de hembras que logran reproducirse en función de la densidad. De forma general, la proporción de hembras que se reproducen disminuye a medida que el tamaño de la población aumenta y los recursos son cada vez más limitados. No se encontró información para este parámetro, por lo que se asumió que la reproducción es independiente de la densidad poblacional.
Parámetros de supervivencia
Hay poca información de mortalidad del oso andino según clases de edad. Calculamos la tasa de mortalidad por clase de edad a partir del promedio de datos de mortalidad de osos de Norteamérica; de esta manera, la mortalidad en la primera clase de edad (osezno, hasta los 2 años) se estableció en un promedio de 25%. La tasa de mortalidad en la segundad clase de edad (subadulto, hasta los 4 años) se estableció en 15%. La tasa de mortalidad para la tercera clase de edad (adulto, a partir de los 4 años que alcanza la madurez sexual) es menor a 10% (Bunnell y Tait, 1985).
VORTEX asume que las especies pueden reproducirse a una tasa normal a lo largo de toda su vida adulta y no considera la senescencia reproductiva. Los individuos son eliminados del modelo una vez que cumplen su edad máxima de reproducción. Según García-Rangel (2012), la edad máxima de reproducción para el oso andino en machos es de 15 a 17 años y en hembras es de 28 a 30 años.
Se denominan catástrofes a las fluctuaciones ambientales anuales que tienen efectos en la reproducción y sobrevivencia (Akçakaya, 2000; Reed et al., 2003). VORTEX asigna una frecuencia anual de presencia y severidad, describiendo su impacto en la mortalidad (en todas las clases de edad y sexo) y en la proporción de hembras que se reproducen exitosamente en 1 año (Millar y Lacy, 1999). Para la sequía, se asumió una frecuencia de 10% de presencia en 1 año y el efecto en la supervivencia y reproducción, sobre todo si ocurre antes de la época de fructificación, que coincide con el apareamiento y nacimiento de los oseznos. La severidad se asumió en 15% ya que, en la zona de evaluación, a falta de alimento en las partes altas por la sequía, el oso andino se traslada al bosque. Según Ríos-Uzeda et al. (2006), el oso andino tiene recorridos estacionales, va de los bosques bajos a los pajonales altoandinos donde aprovecha la variedad y disponibilidad de alimento.
Se diseñó un modelo base para el oso andino en la UCO 4, en el que no se incluyen las actividades antropogénicas; es decir, en éste, los efectos de las actividades humanas no son determinantes para la viabilidad poblacional del oso andino. A partir del modelo base, se diseñaron 2 escenarios (principales amenazas para el oso andino), el primero denominado “disminución y fragmentación del hábitat” por el cambio de uso de suelo que se debió a las actividades humanas: agricultura, ganadería, minería y carreteras, y el segundo denominado “cacería” por la interacción humano-oso andino. Además, se hizo un análisis de sensibilidad donde se cambiaron o agregaron parámetros demográficos, genéticos y ambientales (tabla 1). Los parámetros evaluados fueron: 1) disminución de la capacidad de carga anual debido a la fragmentación, 2) disminución del éxito reproductivo en machos y hembras, 3) incremento de la mortalidad de adultos en edad reproductiva, ésto es, presencia de 50% dado que la cacería del oso andino se da luego de la mortandad de un animal doméstico y 4) inclusión de depresión por endogamia (valores de 3.14 equivalentes letales) con 50% debido a alelos letales recesivos (Nietlisbach et al., 2019).
Cada escenario se corrió 1,000 veces con proyecciones de 100 años, considerando un periodo suficientemente largo para observar los efectos de los parámetros demográficos y genéticos sobre la viabilidad poblacional a largo plazo en las zonas de evaluación. En los escenarios se evaluó: 1) la probabilidad de persistencia o de extinción de la población, y se calculó con base en la proporción de iteraciones de los escenarios donde se extingue la población en los 100 años simulaciones; 2) la tasa media de crecimiento poblacional (Stoch-r), que es un promedio de los años e iteraciones de la población que no se extingue en los 100 años de simulación; y 3) el tiempo medio de extinción, que es un cálculo promedio de los años e iteraciones de la población que ya se extinguió en los 100 años de simulación.
Resultados
El resultado principal demuestra que, sin efectos de parámetros demográficos y genéticos, el oso andino en el paisaje Madidi – Tambopata tienen una población viable (PP = 1) en los 100 años de simulación y la tasa de crecimiento es positiva (r = 0.049); es decir, la población crece a un ritmo de 0.04% anual, de esta manera, el riesgo de extinción es 0%. Sobre el modelo base, un efecto prolongado de sequía (Seq) en su hábitat (1,000 a 4,000 m snm) no tuvo efecto sobre la viabilidad poblacional ni en la tasa de crecimiento. En estas condiciones, tampoco hay un efecto de la endogamia sobre las poblaciones de oso andino que crecen hasta llegar a la capacidad de carga del hábitat, alcanzado un equilibrio poblacional (fig. 2, tabla 3). Sin embargo, la cacería del oso andino por el conflicto humano-oso andino, disminuye la probabilidad de persistencia (PP = 0.41) sobre todo en poblaciones menores a 200 individuos.
Los resultados muestran que la deriva genética impide que la población crezca (r = 0.00) dejando de ser viable antes de 100 años. La cacería disminuyó el éxito reproductivo, en estas circunstancias, la población decrece (r = -0.031) a un ritmo de -0.03% anual. En un paisaje fragmentado por el constante cambio de uso de suelo, la endogamia reduce aún más la población (r = -0.04) (fig. 3, tabla 3).
En localidades con una población menor a 200 individuos, el efecto de la cacería sobre el éxito reproductivo es notable, en aproximadamente 60 años esta población cruzará el umbral de extinción (PP = 0.20) dejando de ser viable; en este escenario, la pérdida de variabilidad genética sumado a la pérdida y fragmentación del hábitat, hace que la población se extinga localmente en 70 a 80 años (fig. 4, tabla 3).
En localidades con poblaciones mayores a 800 individuos, el efecto de la cacería en la población no es tan determinante (PP = 0.92) en 100 años de simulación, pero el efecto de la pérdida y fragmentación de hábitat conlleva a una disminución continua del hábitat del oso andino. En este escenario, la disminución del éxito reproductivo a consecuencia de la cacería sí disminuye la viabilidad poblacional, cruzando el umbral de extinción (PP = 0.23) en aproximadamente 80 años, hasta extinguirse de forma local antes de los 100 años (fig. 5, tabla 3). Estos resultados demuestran que la cacería de oso andino producto del conflicto humano-oso andino, sumado a la pérdida constante de hábitat, puede llevar a eventos de extinción de la especie, incluso en el UCO 4.
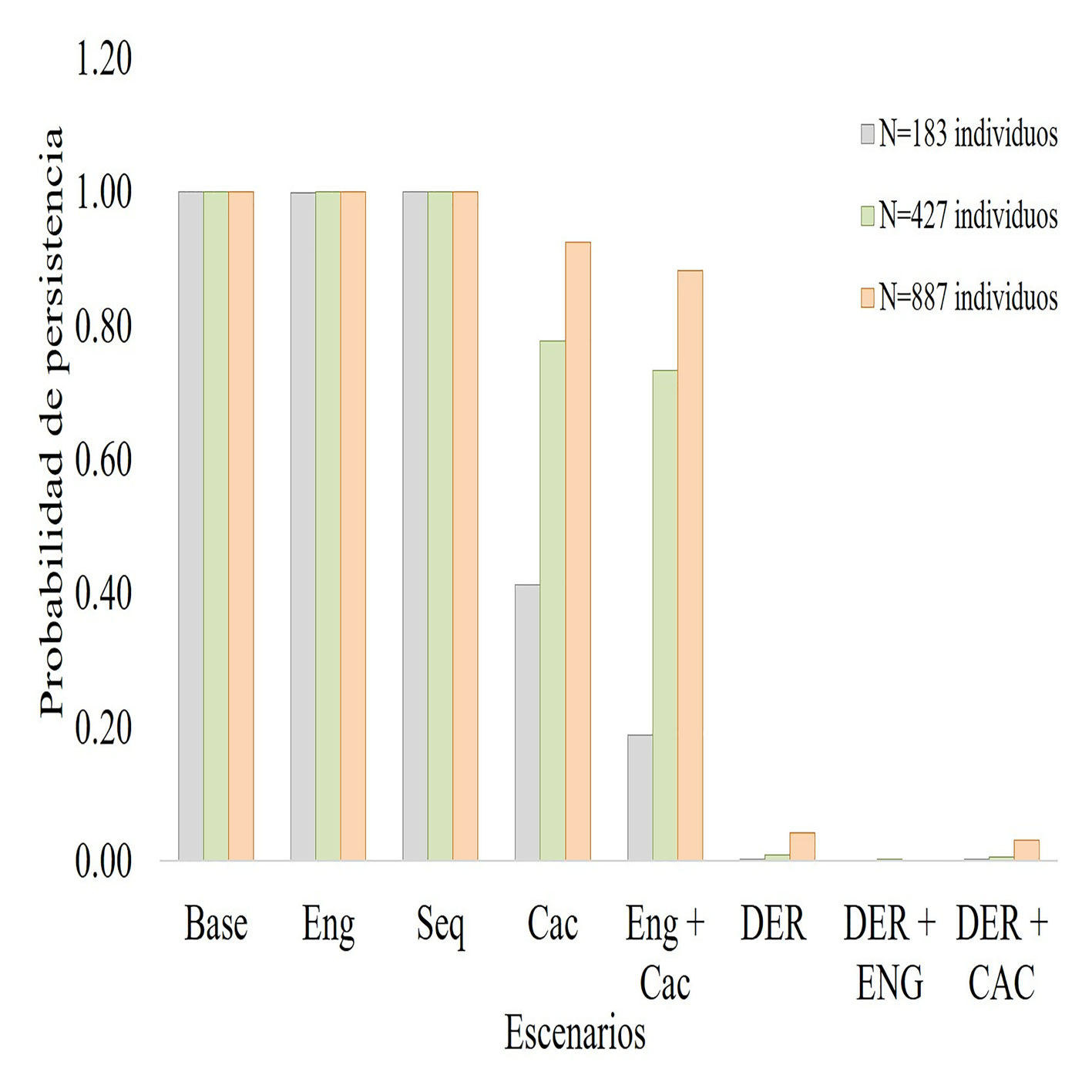
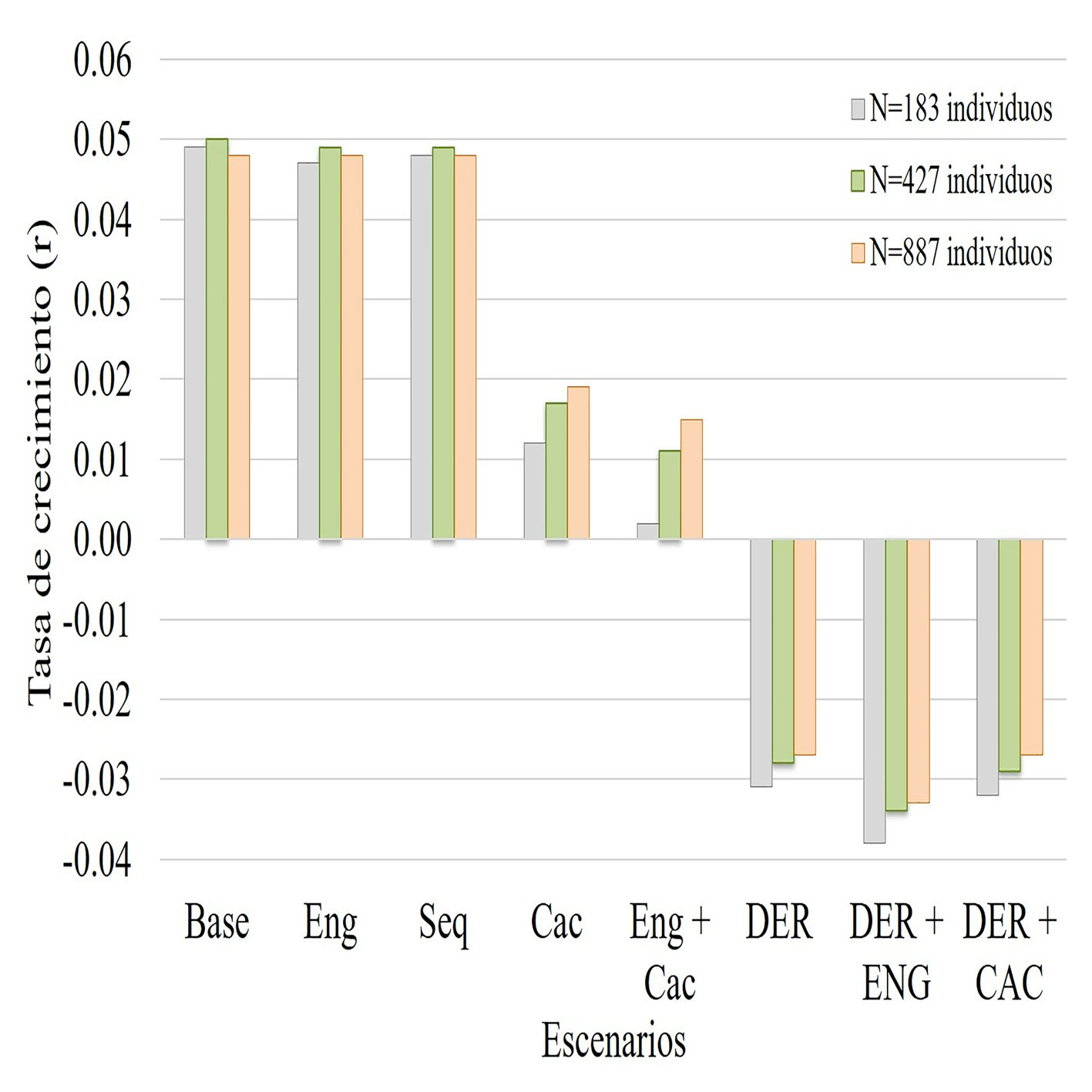
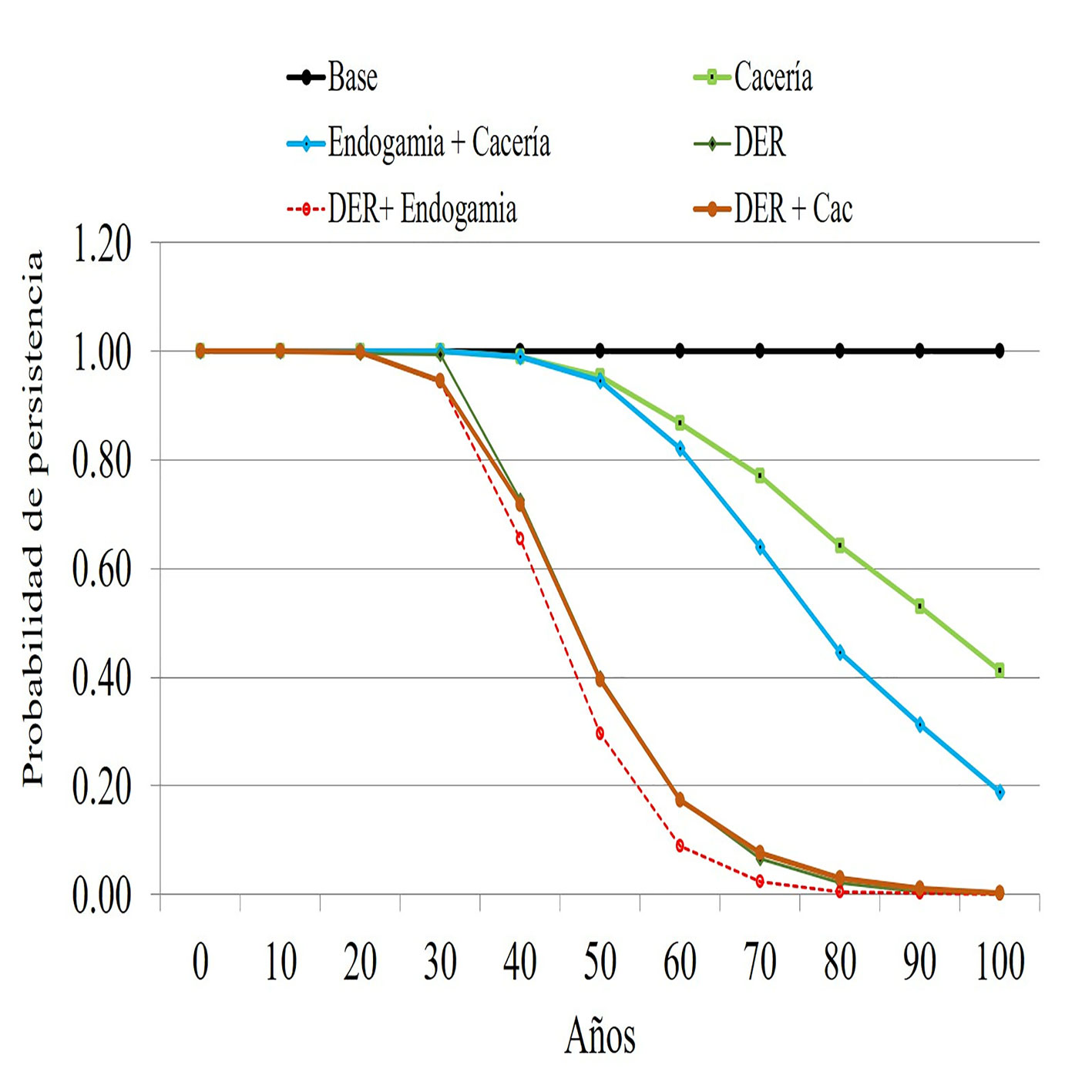
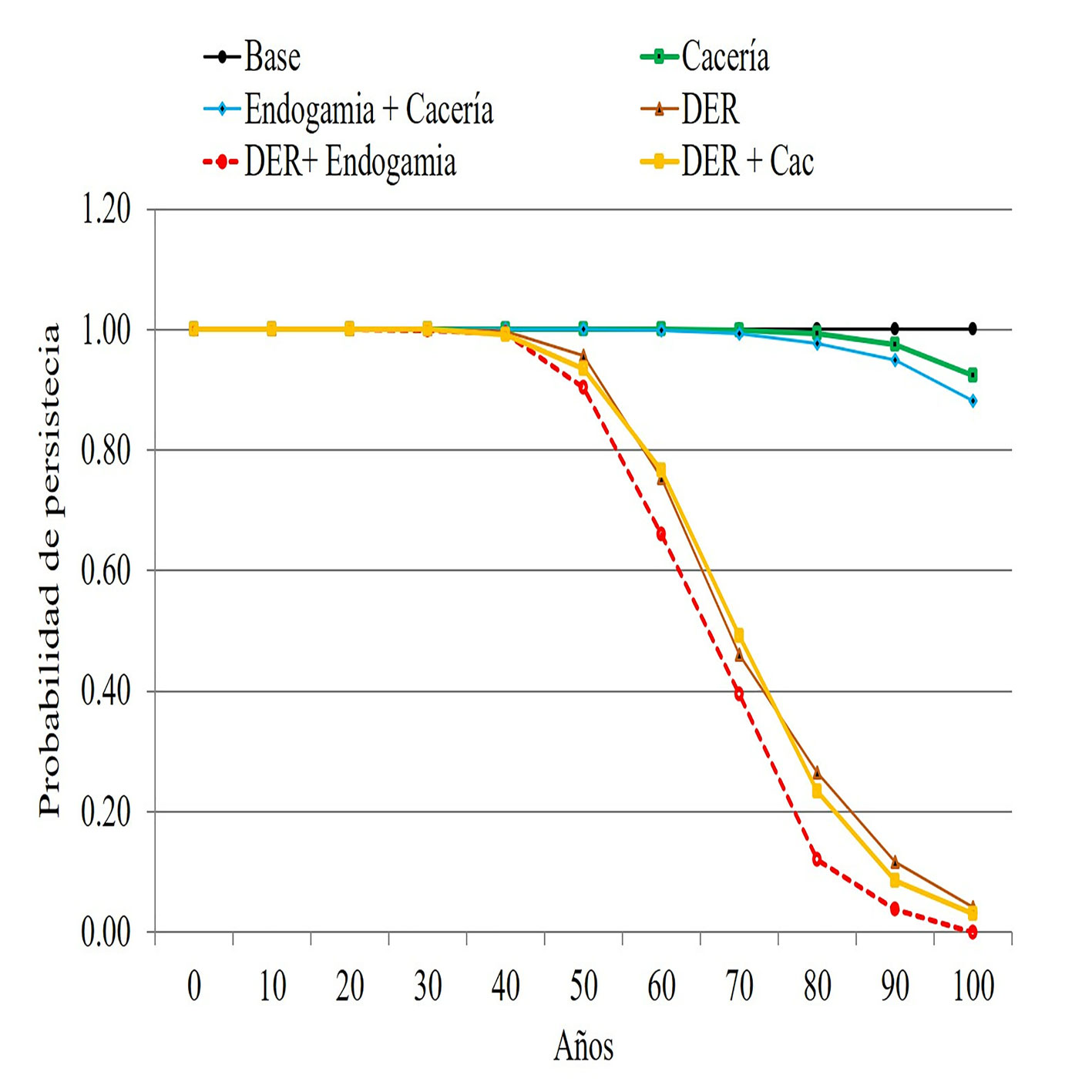
Tabla 3
Probabilidad de persistencia del oso andino en función de los escenarios: base, endogamia (Eng), sequía (Seq), sacería (Cac) y efecto combinado de endogamia más cacería (Eng + Cac), disminución del éxito reproductivo (DER) y efecto combinado de la disminución del éxito reproductivo más endogamia (DER + Eng) y efecto combinado de disminución del éxito reproductivo más cacería (DER + Cac).
| Zona de evaluación | Escenario | Probabilidad de.
persistencia |
Tasa de
crecimiento |
Probabilidad de
persistencia – PP (años) |
||||||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | ||||
| Paisaje Madidi Tambopata | Base | 1 | 0.049 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Eng | 0.998 | 0.047 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| Seq | 1 | 0.048 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| Cac | 0.412 | 0.012 | 1 | 1 | 1 | 1 | 0.99 | 0.95 | 0.87 | 0.77 | 0.64 | 0.53 | 0.41 | |
| End+ Cac | 0.188 | 0.002 | 1 | 1 | 1 | 1 | 0.99 | 0.95 | 0.82 | 0.64 | 0.45 | 0.31 | 0.19 | |
| Der | 0.002 | -0.031 | 1 | 1 | 1 | 0.99 | 0.73 | 0.40 | 0.18 | 0.07 | 0.02 | 0.00 | 0.00 | |
| Der + Eng | 0.000 | -0.038 | 1 | 1 | 1 | 0.94 | 0.65 | 0.30 | 0.09 | 0.02 | 0.00 | 0.00 | 0.00 | |
| Der + Cac | 0.002 | -0.032 | 1 | 1 | 1 | 0.95 | 0.72 | 0.39 | 0.17 | 0.08 | 0.03 | 0.01 | 0.00 | |
| Áreas por fuera de las áreas naturales protegidas del UCO 4 | Base | 1 | 0.050 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Eng | 1 | 0.049 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| Seq | 1 | 0.049 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| Cac | 0.776 | 0.017 | 1 | 1 | 1 | 1 | 1 | 1 | 0.99 | 0.96 | 0.92 | 0.85 | 0.78 | |
| Eng + Cac | 0.732 | 0.011 | 1 | 1 | 1 | 1 | 1 | 1 | 0.98 | 0.96 | 0.88 | 0.73 | 0.62 | |
| Der | 0.008 | -0.028 | 1 | 1 | 1 | 1 | 0.97 | 0.78 | 0.46 | 0.21 | 0.10 | 0.04 | 0.01 | |
| Der + Eng | 0.002 | -0.034 | 1 | 1 | 1 | 0.99 | 0.95 | 0.70 | 0.36 | 0.16 | 0.03 | 0.01 | 0.00 | |
| Der + Cac | 0.006 | -0.029 | 1 | 1 | 1 | 1 | 0.96 | 0.76 | 0.47 | 0.22 | 0.10 | 0.03 | 0.01 | |
| Unidad de conservación del oso andino: Andes centrales 4 (UCO 4) | Base | 1 | 0.048 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Eng | 1 | 0.048 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| Seq | 1 | 0.048 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| Cac | 0.924 | 0.019 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 0.99 | 0.97 | 0.92 | |
| Eng + Cac | 0.882 | 0.015 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 0.99 | 0.98 | 0.95 | 0.88 | |
| Der | 0.042 | -0.027 | 1 | 1 | 1 | 1 | 1 | 0.96 | 0.75 | 0.46 | 0.26 | 0.12 | 0.04 | |
| Der + Eng | 0.000 | -0.033 | 1 | 1 | 1 | 1 | 0.99 | 0.90 | 0.66 | 0.39 | 0.12 | 0.04 | 0.00 | |
| Der + Cac | 0.030 | -0.027 | 1 | 1 | 1 | 1 | 0.99 | 0.93 | 0.77 | 0.49 | 0.23 | 0.09 | 0.03 |
Discusión
Los modelos señalan que las poblaciones de oso andino en ecosistemas conectados en la UCO 4 son viables en el largo plazo, a pesar de los eventos de cacería. Sin embargo, cuando ocurre la reducción y fragmentación de su hábitat, disminuye la probabilidad de persistencia, al punto de ocurrir extinciones locales. El modelo de fragmentación de hábitat señala que la construcción de carreteras nuevas y la expansión de actividades humanas están fragmentando y aislando las poblaciones de oso andino (Figueroa, 2015; Bazantes-Chamorro et al., 2018; Rodríguez et al., 2019).
En una población aislada de oso andino, en el modelo de cacería se observó una importante disminución de su éxito reproductivo y en parches de hábitat fragmentado la endogamia redujo los niveles de variabilidad y flujo genéticos, aumentando de esta manera, la probabilidad de extinciones locales. Una constante preocupación es cómo resolver la cacería de oso andino cuando consume maíz y depreda al ganado doméstico (Aurich, 2020; Figueroa, 2015; Pillaca y Chamba, 2021), existe concordancia en que la cacería es un asunto prioritario por resolver. Los estudios filogenéticos del oso andino revelaron, de por sí, medios a bajos niveles de variabilidad genética, ésto ayuda a entender que en paisajes fragmentados con poblaciones aisladas de oso andino y eventos de caería, se interrumpe el flujo genético entre las poblacionales de oso andino (Ruiz-García et al., 2005). Aunque Ruiz-García et al. (2020) señalan que es posible que la pérdida de diversidad genética no sea causada por la fragmentación de hábitat, es clave resolver los eventos de cacería a escala de paisaje.
El modelo para el PMT indica que en un paisaje fragmentado y una población aislada de oso andino, el tiempo medio de extinción es de 60 años. Una población calculada de 183 individuos en un paisaje fragmentado (Wallace et al., 2014), con pérdida de bosque de 5.5% anual (periodo 2001-2018) (GeoSERFOR, 8/6/2022) y frecuentes eventos de cacería de oso andino —solo algunos son reportados (Serfor, 2020)—, validan el modelo. El oso andino en el PMT tiene un alto riesgo de extinción; sin embargo, para tener poblaciones viables a largo plazo, el modelo señala que se debe conectar el hábitat del oso andino y eliminar su cacería.
Basado en modelos ecológicos, parte del hábitat disponible del oso andino está conformado por el mosaico de ecosistemas de pajonal altoandino, vegetación secundaria y bosque montano (Meza et al., 2020). Sin embargo, solo una parte de este mosaico está dentro de áreas naturales protegidas e incluso superpuestas a tierras agrícolas (Hohbein y Nibbelink, 2021). Un panorama similar ocurre en la UCO 4, no todo el hábitat disponible del oso andino está dentro de las áreas naturales protegidas, situación que podría conducir a una mayor pérdida y fragmentación del hábitat (Vélez-Liendo et al., 2014). Como se ha visto en nuestros modelos de viabilidad, la cacería del oso andino que termina en la muerte de un adulto en edad reproductiva complica la posibilidad de encontrar pareja y, con ello, el cruzamiento entre individuos. De esta manera, ninguna población de oso andino en el PMT, ni siquiera en la UCO 4, es viable en el largo plazo. En parches de hábitat fragmentado, con poblaciones de oso andino menores a 200 individuos, ocurren procesos de extinción en aproximadamente 60 años. A una mayor escala, a lo largo de su área de distribución, parches de hábitat fragmentado podría poner en riesgo la sobrevivencia de las poblaciones del oso andino (Rodríguez et al., 2019).
Lo anterior es importante en los próximos años, el cambio climático y la degradación del hábitat reducirán aún más el hábitat disponible para el oso andino (Meza et al., 2020). Nuevos modelos señalan que, cuanto mayor es la cobertura vegetal, mejor es la conectividad entre parches de conservación (Cotrina et al., 2022). Se sabe que el oso andino utiliza corredores de áreas conectadas para movilizarse. En la Amazonía andina del PMT se establecieron 9 sitios prioritarios para la conservación de la diversidad biológica (GORE Puno, 2016), conservar estos sitios debería ser un objetivo a escala paisaje. Incluir el conocimiento e involucrar a las comunidades campesinas o nativas es clave para que las estrategias de conservación sean efectivas (Corredor et al., 2021, Cotrina et al., 2022). Por lo tanto, corresponde al estado peruano, como una alta prioridad, conservar y conectar los sitios prioritarios a las áreas naturales protegidas.
Con estos resultados, ahora sabemos que la planificación debe hacerse en el corto plazo y, sobre todo, en los ecosistemas que no cuentan con algún nivel de conservación. La mayoría de los hábitats importantes para el oso andino no está en las áreas protegidas (Mori et al., 2020). Por tanto, en la UCO 4 se deben establecer mecanismos de conservación y conectarlos a las áreas naturales protegidas (Rojas-Vera Pinto et al., 2022). En el PMT, si a los 9 sitios prioritarios se les otorga una modalidad de conservación y son gestionados efectivamente, se contará con parches grandes de hábitat conectados al Parque Nacional Bahuaja Sonene, en Perú y al Parque Nacional Madidi, en Bolivia. El modelo resalta que en hábitats contiguos y con una población estable, el efecto de la cacería no resulta determinante y las poblaciones de oso andino resultan ser viables en el lago plazo.
Los planes de conservación de oso andino en Perú y Bolivia, así como para la UCO4, resaltan la necesidad de conservar espacios grandes y conectadas entre sí. En estos espacios, implementar acciones preventivas al conflicto humano-oso andino debe dar respuestas rápidas y efectivas para eliminar la cacería del oso andino (Bazantes-Chamorro et al., 2018; Rojas-Vera Pinto et al., 2020; Ticona et al., 2006). Adicionalmente, planificar acciones que busquen mejorar la calidad, disponibilidad y conectividad del hábitat para el oso andino, incluso en paisajes agrícolas (Cotrina et al., 2022; Hohbein y Nibbelink, 2021); al mismo tiempo, generar actividades humanas compatibles con la conservación del oso andino.
Los modelos por computadora son utilizados con mayor frecuencia como herramientas para diseñar estrategias de conservación para el oso andino (Vera-Pinto et al., 2022), pero requieren información que no siempre está disponible y al incluir información sesgada, los modelos pueden hacer que las predicciones sean engañosas (Morrell et al., 2021; Velez-Liendo, 2014). Sin duda, el cambio climático es un parámetro determinante en los modelos predictivos, por ahora con datos insuficientes (Cotrina et al., 2002; Vela-Vargas et al., 2021). En nuestro caso, cuando se obtenga información más precisa sobre el efecto de la variabilidad climática en la reproducción y supervivencia del oso andino, se deberá ajustar el modelo, pues es posible que se esté subestimando la viabilidad y el tiempo medio de extinción. Por ahora, nuestros resultados apuntan a priorizar la gestión de la interacción humano-oso andino; así mismo, a conservar su hábitat y conectar las áreas naturales protegidas.
Agradecimientos
A Yudith Bellido Casas y a su padre Ubaldo Bellido Arhuire por su apoyo durante la recolección de datos en las salidas de campo. A Ariel Reinaga Colombo, por su contribución al mapa final.
Referencias
Akçakaya, H. (2000). Population viability analysis with demographically and spatially strutured models. Ecological Bulletins, 48, 23–38.
Altrichter, M., Saldívar, S., Decarre, J., Camino, M., Yanosky, A., Krauer, J. M. C. et al. (2016). Situación de conservación del pecarí del Chaco o tagua (Catagonus wagneri): distribución, aptitud de hábitat y viabilidad poblacional. Paraquaria Natural, 4, 30–39.
Aurich, A. F. (2020). Assessing the effects of cattle on Andean bear habitat use in a protected area in northern Peru (Tesis de maestría). University of British Columbia. Vancouver.
Bazantes-Chamorro, J., Revelo-Morán, N. y Moncada-Rangel, J. (2018). conflicto ser humano – oso andino (Tremarctos ornatus) en san Francisco de Sigsipamba, provincia de Imbabura, Ecuador. Revista Mexicana de Mastozoología, 8, 81–95. https://doi.org/10.22201/IE.20074484E.2018.1.2.260
Berger, J. (1990). Persistence of different-sized populations: an empirical assessment of rapid extinctions in bighorn sheep. Conservation Biology, 4, 91–98.
Brightsmith, D. y White, T. (2012). Critical parameters for psittacine conservation: a symposium overview. Ornitologia Neotropical, 23, 125–130.
Brito, D. y Grelle, C. E. V. (2006). Estimating Minimum Area of Suitable Habitat and Viable Population Size for the Northern Muriqui (Brachyteles hypoxanthus). Biodiversty and Conservation, 15, 4197–4210. https://doi.org/10.1007/s10531-005-3575-1
Brito, D. y Figueiredo, M. D. S. L. (2003). Minimum viable population and conservation status of the Atlantic Forest spiny rat Trinomys eliasi. Biological Conservation, 113, 153–158. https://doi.org/10.1016/S0006-3207(02)00344-0
Bunnell, F. L. y Tait, D. E. (1985). Tasas de mortalidad de los osos norteamericanos. Ártico, 38, 316–323.
Castellano, A. (2015). Comportamiento materno de una hembra de oso andino en el páramo de Parque Nacional Cayambe Coca, Ecuador. Spring, 24, 32–33. https://doi.org/10.13140/RG.2.1.4185.0405
Cotrina-Sánchez, A., Salazar, A., Oviedo, C., Bandopadhyay, S., Mondaca, P., Valentini, R. et al. (2022). Integrated cloud computing and cost effective modelling to delineate the ecological corridors for Spectacled bears (Tremarctos ornatus) in the rural territories of the Peruvian Amazon. Global Ecology and Conservation, 36, e02126. https://doi.org/10.1016/J.GECCO.2022.E02126
Figueroa, J. (2015). Interacciones humano-oso andino Tremarctos ornatus en el Perú: consumo de cultivos y depredación de ganado. Therya, 6, 251–278. https://doi.org/10.12933/therya-15-251
Figueroa, J. y Succhi, M. (2009). El oso andino: alcance sobre su historia natural. Lima: Asociación para la Investigación y Conservación de la Biodiversidad.
García-Antón, A. y Traba J. (2021). Population viability analysis of the endangered Dupont’s Lark Chersophilus duponti in Spain. Scientific Reports, 11, 19947. https://doi.org/10.1038/s41598-021-99125-y
García-Rangel, S. (2012). Andean bear Tremarctos ornatus natural history and conservation. Mammal Review, 42, 85–119. https://doi.org/10.1111/J.1365-2907.2011.00207.X
Garrido-Corredor, A. M., Cottyn, H., Martínez-Medina, S., Wheatley, C., Sánchez, A., Kirshner, J. (2021). Oso, osito ¿a qué venís? Andean bear conflict, conservation, and campesinos in the Colombian paramos. Sustainability, 13, 10489. https://doi.org/10.3390/SU131910489.
Garshelis, D. L. (2011). Andean bear density and abundance estimates – How reliable and useful are they? Ursus, 22, 47–64. https://doi.org/10.2192/URSUS-D-10-00030.1
GORE Puno. (2016). Sitios prioritarios para la conservación de la diversidad biológica en la Región Puno. Puno, Perú.
Hohbein, R. R. y Nibbelink, N. P. (2021). Omnidirectional connectivity for the Andean bear (Tremarctos ornatus) across the Colombian Andes. Landscape Ecology, 36, 3169–3185. https://doi.org/10.1007/S10980-021-01299-3
Hohbein, R. R., Nibbelink, N. y Cooper, R. J. (2021). Impacts of decentralized environmental governance on Andean bear conservation in Colombia. Environmental Management, 68, 882–899. https://doi.org/10.1007/S00267-021-01532-4
Horino, S. y Miura, S. (2000). Population viability analysis of a Japanese black bear population. Population Ecology, 42, 37–44. https://doi.org/10.1007/s101440050007
Howells, O. y Edwards-Jones, G. A. (1997). Feasibility study of reintroducing wild boar Sus scrofa to Scotland: are existing woodlands large enough to support minimum viable populations. Biological Conservation, 81, 77–89.
Juárez-Casillas, L. A. y Varas, C. (2011). Genética evolutiva y molecular de la familia Ursidae: una revisión bibliográfica actualizada. Therya, 2, 47–65. https://doi.org/10.12933/THERYA-11-22
Lacy, R. C. (2000). Structure of the Vortex simulation model for population viability analysis. Ecological Bulletins, 48, 191–203.
Lacy, R. C., Miller, P. S. y Traylor-Holzer, K. (2015). User’s manual. Disponible en: http://www.Vortex10.org/VortexReferences.aspx
Lacy, R. C., Borbat, M.y Pollak, J. P. (2015). Vortex: a stochastic simulation of the extinction process. Brookfield: Chicago Zoological Society.
Lindenmayer, D. B., Lacy, R. C., Thomas, V. C. y Clark, T. W. (1993). Predictions of the impacts of changes in population size and environmental variablitity on Leadbeater’s possum, Gymnobelideus leadbeateri McCoy (Marsupialia: Petauridae) using population viability analysis: an application of the computer program VORTEX. Wildlife Research, 20, 67–85.
Maldonado, W. (2007). Viabilidad poblacional de Rollandia microptera (zambullidor del Titicaca) en el lago Titicaca, Perú (Tesis de maestría). Facultad de Ciencias Biológicas, Universidad Nacional del Altiplano. Puno, Perú.
Márquez, G. y Pacheco, V. (2010). Nuevas evidencias de la presencia del Oso Andino (Tremarctos ornatus) en las Yungas de Puno, el registro más austral de Perú. Revista Peruana de Biología, 17, 377–380.
Medici, E. P. y Desbiez, A. L. J. (2012). Population viability analysis: using a modeling tool to assess the viability of tapir populations in fragmented landscapes. Integrative Zoology, 7, 356–372. https://doi:10.1111/j.1749-4877.2012.00318.x.
Meza, M. G., Barboza, C. E., Torres, G. C., Cotrina, D. A., Guzmán, B. K., Oliva, M. et al. (2020). Predictive modelling of current and future potential distribution of the spectacled bear (Tremarctos ornatus) in Amazonas, Northeast Peru. Animals, 10, 1816. https://doi.org/10.3390/ani10101816.
Miller, P. S. y Lacy, R. C. (1999). Vortex: a stochastic simulation of the extinction process. Version 8 User’s Manual. Apple Valley, MN: Conservation Breeding Specialist Group (SSC/IUCN).
Molina, S., Fuller, A. K., Morin, D. J. y Royle, J. A. (2017). Use of spatial capture-recapture to estimate density of Andean bears in northern Ecuador. Ursus, 28, 117–126. https://doi.org/10.2192/URSU-D-16-00030.1
Mori, G. M., Castillo, E. B., Guzmán, C. T., Cotrina-Sánchez, D. A., Guzmán-Valqui, B. K., Oliva, M. et al. (2020). Predictive modelling of current and future potential distribution of the spectacled bear (Tremarctos ornatus) in Amazonas, northeast Peru. Animals, 10, 18161. https://doi.org/10.3390/ANI10101816
Morrell, N., Appleton, R. D. y Arcese, P. (2021). Roads, forest cover, and topography as factors affecting the occurrence of large carnivores: the case of the Andean bear (Tremarctos ornatus). Global Ecology and Conservation, 26, e01473. https://doi.org/10.1016/J.GECCO.2021.E01473
Nowak, R. M. (1991). Walker’s mammals of the world, Vol II. 5th Eds. Baltimore: John Hopkins University Press.
Nietlisbach, P., Muff, S., Reid, J. M., Whitlock, M. C. y Keller, L. F. (2019). Nonequivalent lethal equivalents: Models and inbreeding metrics for unbiased estimation of inbreeding load. Evolutionary Applications, 12, 266–279. https://doi.org/10.1111/EVA.12713
Peralvo, M. F., Cuesta, F. y Van Manen, F. (2005). Delineating priority habitat areas for the conservation of Andean bears in northern Ecuador. Ursus, 16, 222–233. https://doi.org/10.2192/1537-6176(2005)016[0222:DPHAFT]2.0.CO;2
Peyton, B. (1980). Ecology, distribution, and food habits of spectacled bears, Tremarctos ornatus, in Peru. Journal of Mammalogy, 61, 639–652. https://doi.org/10.2307/1380309
Pillaca, K. y Chamba, Y. (2021). Conflictos socioambientales en el Perú con la especie oso andino (Tremarctos ornatus): una revisión. Revista de Ciencias Sociales, 2, 29–41.
Ralls, K., Ballou, J. D. y Templeton, A. (1988). Estimates of lethal equivalents and the cost of inbreeding in mammals. Conservation Biology, 2, 185–193.
Reed, D. H., O’Grady, J. J., Brook, B. W., Ballou, J. D. y Frankham, R. (2003). Estimates of minimum viable population sizes for vertebrates and factors influencing those estimates. Biological Conservation, 113, 23–34.
Ríos-Uzeda, B., Gómez, H. y Wallace, R. B. (2006). Habitat preferences of the Andean bear (Tremarctos ornatus) in the Bolivian Andes. Journal of Zoology, 268, 271–278. https://doi.org/10.1111/J.1469-7998.2005.00013.X.
Rodríguez, D., Reyes, A., Quiñones-Guerrero, A., Poveda-Gómez, F. E., Castillo-Navarro, Y., Duque, R. et al. (2020). Andean bear (Tremarctos ornatus) population density and relative abundance at the buffer zone of the Chingaza National Natural Park, cordillera oriental of the Colombian Andes. Papeis Avulsos de Zoologia, 60, e20206030. https://doi.org/10.11606/1807-0205/2020.60.30.
Rodríguez, D., Reyes, A., Reyes-Amaya, N., Gallegos-Sánchez, S., Gutierez, J., Suárez, R. et al. (2019). Northernmost distribution of the Andean bear (Tremarctos ornatus) in South America, and fragmentation of its associated Andean forest and Paramo ecosystems. Therya, 10, 161–170. https://doi.org/10.12933/therya-19-756
Rodríguez-Matamoros, J., Villalobos-Brenes, F. y Gutiérrez-Espeleta, G. A. (2012). Viabilidad poblacional de Alouatta palliata (Primates: Atelidae) y Cebus capucinus (Primates: Cebidae) en el Refugio de Vida Silvestre Privado Nogal, Sarapiquí, Heredia, Costa Rica. Revista de Biología Tropical, 60, 809–832.
Rojas-Vera Pinto, R. A., Butrón, R. y Martel, C. (2020). Reports of feeding incidents of cattle by Andean bear (Tremarctos ornatus) in Central Peru. Revista Mexicana de Mastozoología, 10, 25–32. https://doi.org/10.22201/ie.20074484e.2020.10.2.306
Rojas-Vera Pinto, R. A., Bautista, C. y Selva, N. (2022). Living high and at risk: predicting Andean bear occurrence and conflicts with humans in southeastern Peru. Global Ecology and Conservation, 36, e02112. https://doi.org/10.1016/J.GECCO.2022.E02112
Rosenthal, M. (1989). Spectacled bears – An overview of management practice. Proceedings of the First International Symposium on the Spectacled Bear, Lincoln Park Zoological Gardens (pp. 287–295). Chicago.
Ruiz-García, M. (2003). Molecular population genetic analysis of the spectacled bear (Tremarctos ornatus) in the northern Andean area. Hereditas, 138, 81–93. https://doi.org/10.1034/J.1601-5223.2003.01578.X
Ruiz-García, M., Castellanos, A., Arias-Vásquez, J. Y. y Shostell, J. M. (2020). Genetics of the Andean bear (Tremarctos ornatus; Ursidae, Carnivora) in Ecuador: when the Andean Cordilleras are not an obstacle. Mitochondrial DNA Part A: DNA Mapping, Sequencing, and Analysis, 31, 190–208. https://doi.org/10.1080/24701394.2020.1769088
Ruiz-García, M., Orozco-TerWengel, P., Castellanos, A. y Arias, L. (2005). Microsatellite analysis of the spectacled bear (Tremarctos ornatus) across its range distribution. Genes y Genetic Systems, 80, 57–69. https://doi.org/10.1266/GGS.80.57
Serfor (Servicio Nacional Forestal y de Fauna Silvestre). (2020). Involucrados en muerte de oso de anteojos en estado de emergencia serán sometidos a proceso sancionador. Recuperado el 03 setiembre, 2023 de: https://www.gob.pe/institucion/serfor/noticias/302904-puno-involucrados-en-muerte-de-oso-de-anteojos-en-estado-de-emergencia-seran-sometidos-a-proceso-sancionador
Ticona, H., Wallace, R., Alandia, E., Zapata, J. y Nallar, R. (2006). El Chaku como herramienta de mitigación de conflictos entre carnívoros y animales domésticos en el Área Natural de Manejo Integrado Nacional Apolobamba. En A. Llobet (Ed.), Experiencias de manejo de fauna silvestre en Bolivia (pp. 268–286). Santa Cuz de la Sierra, Bolivia: Fundación Amigos de la Naturaleza.
Vela-Vargas, I. M., Jorgenson, J. P., González-Maya, J. F. y Koprowski, J. L. (2021). Tremarctos ornatus (Carnivora: Ursidae). Mammalian Species, 53, 78–94. https://doi.org/10.1093/MSPECIES/SEAB008.
Vélez-Liendo, X., Adriaensen, F. y Matthysen, E. (2014). Landscape assessment of habitat suitability and connectivity for Andean bears in the Bolivian Tropical Andes. Ursus, 25, 172–187. https://doi.org/10.2192/URSUS-D-14-00012.1
Wallace, R., Reinaga, A., Siles, T., Baiker, J., Goldstein, I., Ríos-Uzeda, B. et al. (2014). Unidades de Conservación Prioritarias del Oso Andino en Bolivia y en Perú. La Paz, Bolivia: Wildlife Conservation Society/ Centro de Biodiversidad y Genética de la Universidad Mayor de San Simón de Bolivia/ Universidad Cayetano Heredia de Perú/ Universidad de Antwerpen.
Wang, T., Fujiwara, M., Gao, X. y Liu, H. (2019). Minimum viable population size and population growth rate of freshwater fishes and their relationships with life history traits. Scientific Reports, 9, 3612. https://doi.org/10.1038/s41598-019-40340-z.
Zarzo, A. (2020). El oso pardo (Ursus arctos) en la cordillera cantábrica como ejemplo de la coexistencia entre humanos y grandes carnívoros en ambientes humanizados (Tesis doctoral). Universidad de Oviedo, España.