Invertebrados bentónicos en diez arrecifes del Parque Nacional Sistema Arrecifal Veracruzano
Cynthia Carmona-Islas *, Alejandro Morales-García, J. Abenamar Hernández-Mendiola, Héctor Gama-Villasana, Clarissa Colmenares-Campos y Roberta Cruz-Gutiérrez
Instituto Tecnológico de Boca del Río, Tecnológico Nacional de México, Km. 12 Carretera Veracruz-Córdoba, 94290 Boca del Río, Veracruz, México
*Autor para correspondencia: ccarmona@itboca.edu.mx (C. Carmona-Islas)
Resumen
Los arrecifes son ecosistemas con alta biodiversidad, productividad y provisión de servicios que enfrentan diversas amenazas. A pesar de su relevancia, existe poca información referente a sus comunidades y los factores que las originan y moldean. Los arrecifes del Parque Nacional Sistema Arrecifal Veracruzano (PNSAV) están categorizados como en alto riesgo, y su situación podría empeorar. Por ello, es necesario conocer la composición de sus comunidades y el efecto de los factores medioambientales que las afectan para establecer medidas efectivas para su protección y manejo. En este trabajo se visitaron 10 arrecifes del PNSAV, donde fotografiamos y registramos 36 especies de invertebrados. Se comparó la similitud entre los arrecifes sobre la base de los invertebrados presentes mediante un análisis de agrupamiento basado en el índice de Sorensen y un análisis no paramétrico de escalamiento multidimensional (MDS), tratando de explicar las agrupaciones formadas mediante algunas variables ambientales reportadas. Las agrupaciones formadas coinciden con la distancia a la Costa, aparentemente esta agrupación está relacionada con la visibilidad del agua. La información de las diversas especies en varios arrecifes, como la que se presenta aquí, permite analizar la relación entre la composición de las comunidades arrecifales y los factores medioambientales que las moldean.
Palabras clave:
Comunidad arrecifal; Factores ambientales; Biodiversidad
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Benthic invertebrates in ten reefs of the Sistema Arrecifal Veracruzano National Park
Abstract
Reefs are ecosystems with high biodiversity, productivity and provision of services that face diverse threats. Despite its relevance, there is little information about the composition of their communities and the factors that originate and shape them. The reefs of the Veracruz Reef System National Park (PNSAV) are categorized as at high risk, and their situation could become critical. It is necessary to know the composition of their communities and the effect of the environmental factors on them in order to establish effective management measures. In this work, 10 reefs of the PNSAV were visited. Thirty-six invertebrate species were photographed and recorded. We analyzed the similarity between reefs based on the invertebrates species using a grouping analysis based on the Sorensen index and a nonparametric multidimensional scaling analysis (MDS), and we tried to explain the groupings through some environmental variables reported. The groups formed coincide with the distance to the coast, apparently this grouping is related to the visibility of water. Information on various species in various reefs, such as the one presented here, allows us to analyze the relationship between the composition of the reef communities and the environmental factors that shape them.
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Reef community; Environmental factors; Biodiversity
Introducción
Los ecosistemas arrecifales ofrecen una gran cantidad de bienes y servicios de importancia ecológica, económica y cultural (James-Cruz y Márquez-Calle, 2011; Maldonado y Sánchez, 2016), como protección a la línea de costa y sus pobladores, fuentes de empleo mediante la pesca y el turismo (Burke et al., 2011), zonas de crianza para diversas especies y fuente de materiales para diversos fines (Reyes-Bonilla et al., 2014; Sale et al., 2010); a pesar de su relevancia reciben diversas presiones tanto naturales como antrópicas, que combinadas pueden exacerbarse (Jones et al., 2008) y generar repercusiones sobre la reproducción y asentamiento de las poblaciones de organismos, además de aumentar la virulencia de algunos patógenos generando problemáticas que pueden resultar en eventos catastróficos de mortandades masivas y daños irreversibles para las comunidades arrecifales (Villamizar, 2000). Aunado a lo anterior, se suma recientemente la elevación en la temperatura del agua del mar, que trae como consecuencia el blanqueamiento del coral poniendo en riesgo a la comunidad arrecifal (Burke et al., 2011). De acuerdo con Burke et al. (2011), analizando las presiones que enfrentan los distintos arrecifes del mundo, el Parque Nacional Sistema Arrecifal Veracruzano (PNSAV) se encuentra categorizado como en alto riesgo y se espera que en las próximas décadas su situación sea crítica; si a esta premisa sumamos las actuales obras de ampliación del puerto de Veracruz, las cuales implican la remoción de una porción de arrecife y obras de dragado, es claro que este sistema arrecifal estará en situación crítica en corto tiempo.
Los arrecifes coralinos son sitios de alta diversidad y productividad, donde diversas especies de invertebrados, peces y algas forman parte de esta comunidad (Richmond, 1993); se estima que albergan al menos entre 4 y 5% de todas las especies descritas, pero a pesar de su elevada biodiversidad, existe poca información acerca de los factores que originan y moldean estas comunidades (Wood, 2001).
En general, se puede considerar que un arrecife con alta calidad es aquel que presenta una elevada biodiversidad tanto de corales como de organismos asociados a ellos, además de una alta capacidad de formar arrecifes; algunos factores físicos como la profundidad, la sedimentación y turbidez del agua están relacionados con la calidad de los arrecifes (De Vantier et al., 1998). A escala local, la diversidad de las comunidades arrecifales está correlacionada con la profundidad y con la heterogeneidad entre hábitats (Cornell y Karlson, 2000; Wood, 2001).
En el caso de la sedimentación, como partículas suspendidas o acumuladas, se sabe que una sedimentación excesiva puede afectar negativamente la estructura y función de los sistemas arrecifales modificando sus procesos físicos y biológicos (Erftemeijer et al., 2012; Gilmour et al., 2006; Vázquez-Domínguez, 2003); puede afectar la fijación y supervivencia de las larvas de organismos arrecifales, y matar no solo a los corales sino también a otros organismos de la cadena alimenticia de peces y moluscos de importancia comercial; es pertinente aclarar que aparentemente los sedimentos pueden llegar a causar menos problemas en las comunidades arrecifales cuando hay corrientes intensas presentes (Rogers, 1990).
Las características básicas que se requieren conocer de una comunidad son su riqueza, abundancia, diversidad y distribución (Vázquez-Domínguez, 2003), las cuales se complementan con información acerca de los factores que la moldean; información importante para poder establecer planes de manejo de la misma.
En el caso del PNSAV, el grupo del que existe más información disponible es el de los corales pétreos, sin embrago se tiene poca información sobre los demás grupos de invertebrados de estas comunidades.
De la información disponible acerca de los invertebrados no coralinos del PNSAV, varios son de tipo puntual, abarcando un solo grupo en un solo arrecife (como ejemplos: Aguilar-Estrada et al., 2014; González-Muñoz, 2005), otros más estudian un grupo de invertebrados en más de un arrecife (Gómez, 2007; González-Muñoz et al., 2013, 2015), pero pocos analizan más de un grupo de invertebrados en más de un arrecife (Horta-Puga, 2016), existiendo además literatura gris que no se encuentra disponible para la comunidad científica en general. Todo lo anterior trae como consecuencia carencia de información y de trabajos integrales que comprendan varios grupos de invertebrados en varios arrecifes, así como de series de tiempo que muestren los cambios en las distintas poblaciones.
En el presente trabajo se registraron los invertebrados bentónicos no coralinos en 10 arrecifes del PNSAV y se realizó un análisis de similitud de los arrecifes con base en las especies presentes de noviembre de 2014 a octubre de 2015.
Materiales y métodos
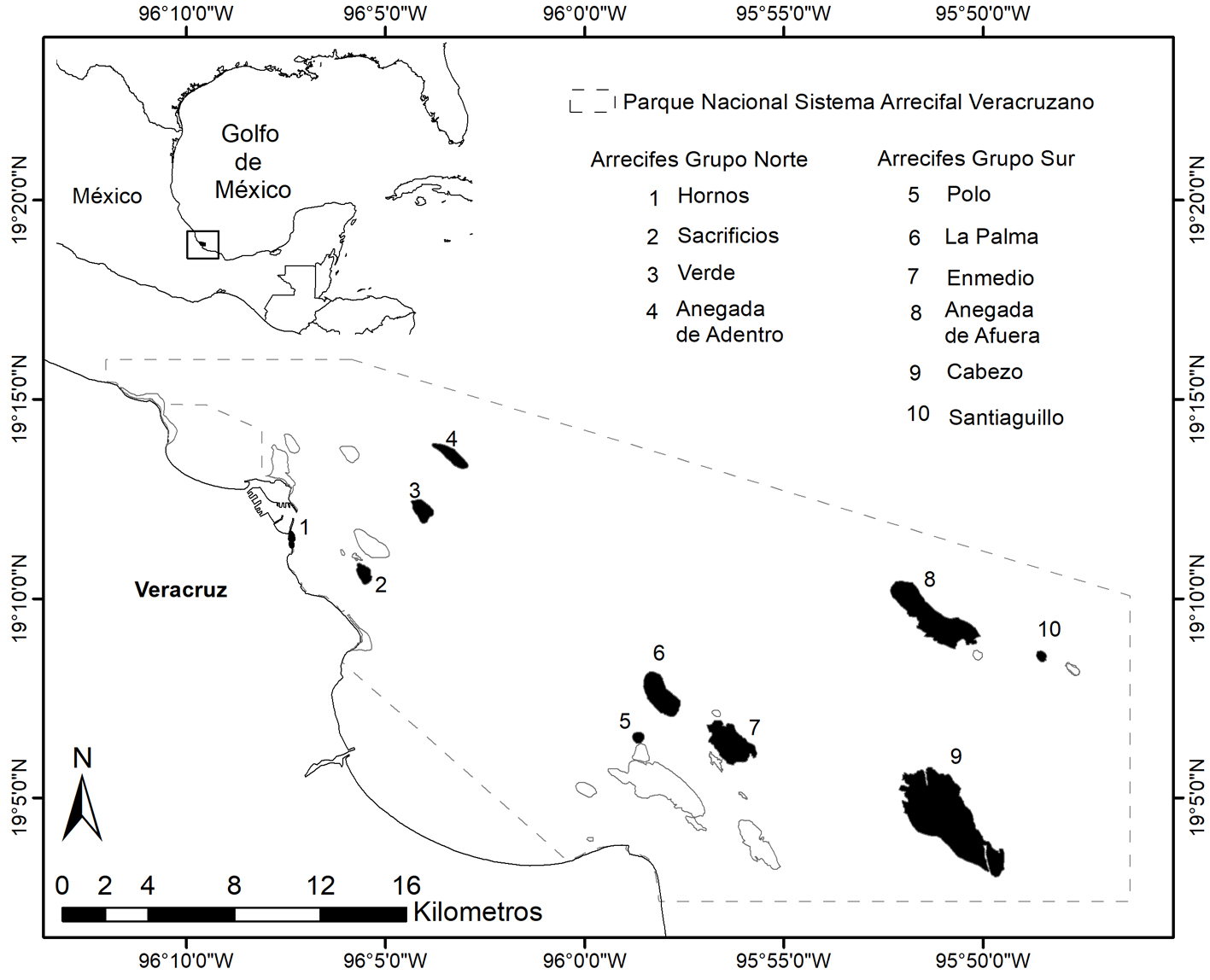
El PNSAV está conformado por 28 formaciones arrecifales cuya poligonal abarca actualmente 65,516 ha (DOF, 2012). Los arrecifes de este Sistema están separados en 2 grupos por la desembocadura del Río Jamapa; el grupo más norteño se encuentra frente a las costas de la zona conurbada Veracruz-Boca del Río, mientras que el grupo ubicado al Sur se localiza frente a las costas del poblado de Antón Lizardo (fig. 1). El PNSAV fue decretado Parque Marino Nacional en 1992 (DOF, 1992), sitio Ramsar en 2004 (Ramsar, 2004) y Reserva de la Biosfera en 2006 (UNESCO, 2006).
A pesar de su relevancia y de las distintas categorías de protección que tiene, recientemente se ha modificado su poligonal (DOF, 2012) con lo que, entre otros aspectos, se desincorpora el arrecife de Punta Gorda ubicado en el extremo noroeste del sistema; en esta zona se realizan obras de ampliación del puerto, sin saber a ciencia cierta qué afectaciones traerá en el patrón de corrientes, así como para los organismos que conforman las comunidades arrecifales.
Entre noviembre de 2014 y octubre de 2015, se visitaron los arrecifes Hornos, Verde, Sacrificios y Anegada de Adentro, de la parte norte del PNSAV y Palma, Polo, Anegada de Afuera, En medio, Santiaguillo y la zona norte de Cabezo, situados en la parte sur. Se realizaron 2 visitas por arrecife en la que se fotografiaron e identificaron anémonas (phylum Cnidaria, clase Anthozoa, subclase: Hexacorallia), moluscos (phylum Mollusca, clase Gastropoda), erizos (phylum Echinodermata, clase Echinoidea), estrellas de mar (phylum Echinodermata, clase Asteroidea, orden Valvatida), esponjas (phylum Porifera, clase Demospongiae) y poliquetos (phylum Annelida, clase Polychaeta).
En cada arrecife, se fotografiaron los organismos mediante buceo libre realizando trayectos perpendiculares a la costa en la laguna arrecifal hasta una profundidad máxima de 3 m, y en la pendiente arrecifal mediante buceo Scuba a 5 m de profundidad.
Se fotografió a los organismos pertenecientes a los grupos taxonómicos de interés, utilizando cámaras fotográficas digitales: Canon de 10-12 megapixeles, JVC modelo GC-XA1, JVC modelo WR-GX001, Nikon Coolpix L30 modelo 6280.32, Olympus modelo Stylus Tough-6020µ de14 megapixeles y FUJIFILM FinePix modelo XP50, y se registró a las especies que se identificaban. Posteriormente, en el laboratorio se corroboró la identificación realizada en campo, utilizando guías especializadas (Boxshall et al., 2014; Collin et al., 2005; De León-González et al., 2009; Gómez, 2002; Gosner, 1978; Humann y Deloach, 1999; Kaplan, 1999; Solís-Weiss, 1998; Zea et al., 2014); en el caso de las esponjas, se tomaron fotos de diversos ángulos de cada individuo para obtener todas las características visuales posibles. Con respecto a la identificación de especies de esponjas, moluscos y anemonas se contó con el apoyo de expertos para corroborar las identificaciones.
Con la información de las especies identificadas y corroboradas, se elaboró una tabla de presencia-ausencia para cada arrecife; las especies cuya identificación fue dudosa se excluyeron de la lista. Una vez obtenida dicha información se analizó la riqueza de especies y la similitud entre arrecifes mediante un análisis de agrupamiento basado en UPGMA (Unweighted Pair Group Method using Arithmetic averages) y el índice de Sorensen. Aunado a lo anterior, se llevó a cabo un análisis no paramétrico de escalamiento multidimensional (MDS) en 3 dimensiones, utilizando el índice de Sorensen. Ambos análisis se llevaron a cabo utilizando el programa Past (Versión 3.16; Hammer et al., 2001)
Se revisaron los agrupamientos formados mediante los análisis mencionados tratando de explicarlos con base en variables ambientales reportadas para algunos de los arrecifes estudiados, como la distancia a la costa, la tasa de sedimentación y la visibilidad.
Resultados
Se corroboró la identificación de un total de 36 especies de invertebrados. Seis de las especies correspondieron a anémonas, 6 a moluscos, 7 a erizos, 2 a estrellas de mar, 12 a esponjas y 3 a poliquetos (tabla 1). El arrecife con mayor riqueza de especies fue Polo (30 especies) y el de menor riqueza Hornos (11 especies).
Tabla 1
Presencia de especies por arrecife (1 = presencia).
|
Tabla 1 Continuación |
||||||||||
|
Grupo arrecife |
Hornos |
Verde |
Sacrificios |
Polo |
A. Adentro |
Santiaguillo |
La Palma |
A. Afuera |
Cabezo |
En medio |
|
Grupo arrecife |
Hornos |
Verde |
Sacrificios |
Polo |
A. Adentro |
Santiaguillo |
La Palma |
A. Afuera |
Cabezo |
En medio |
|
Esponjas (phylwum Porifera / clase Demospongiae) |
||||||||||
|
Familia Niphatidae |
||||||||||
|
Amphimedon compressa |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|||
|
Amphimedon viridis |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
|
Familia Callispongiidae |
||||||||||
|
Callyspongia armigera |
1 |
1 |
1 |
1 |
1 |
1 |
||||
|
Familia Dictyonellidae |
||||||||||
|
Scopalina rüetzleri |
1 |
1 |
1 |
1 |
1 |
|||||
|
Familia Mycalidae |
||||||||||
|
Mycale laevis |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|||
|
Familia Raspailiidae |
||||||||||
|
Ectyoplasia ferox |
1 |
1 |
1 |
1 |
1 |
1 |
||||
|
Familia Desmacididae |
|
|||||||||
|
Desmapsamma anchorata |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
|
Familia Clionaidae |
||||||||||
|
Cliona delitrix |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
||
|
Familia Irciniidae |
|
|||||||||
|
Ircinia felix |
1 |
1 |
1 |
1 |
1 |
|||||
|
Ircinia strobilina |
1 |
1 |
1 |
1 |
||||||
|
Familia Agelasidae |
|
|||||||||
|
Agelas clathrodes |
1 |
1 |
1 |
1 |
1 |
|||||
|
Familia Aplysinidae |
||||||||||
|
Aiolochroia crassa |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
|
Anémonas (phylum Cnidaria/ clase Anthozoa/ subclase Hexacorallia |
||||||||||
|
Familia Zoanthidae |
||||||||||
|
Palythoa caribaeorum |
1 |
1 |
1 |
|||||||
|
Zoanthus pulchellus |
1 |
1 |
||||||||
|
Familia Corallimorphidae |
||||||||||
|
Rhodactis osculifera |
1 |
1 |
||||||||
|
Familia Phymanthidae |
||||||||||
|
Phymanthus crucifer |
1 |
1 |
1 |
1 |
||||||
|
Familia Stichodactylidae |
||||||||||
|
Stichodactyla helianthus |
1 |
1 |
1 |
1 |
1 |
|||||
|
Familia Aliciidae |
||||||||||
|
Lebrunia coralligens |
1 |
1 |
1 |
1 |
1 |
|||||
|
Poliquetos (phylum Annelida / clase Polychaeta) |
||||||||||
|
Familia Serpulidae |
||||||||||
|
Spirobranchus giganteus |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
|
Familia Sabellidae |
||||||||||
|
Sabellastarte magnifica |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
|
Familia Amphinomidae |
||||||||||
|
Hermodice carunculata |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|||
|
Moluscos(phylum Mollusca) |
||||||||||
|
Familia Fasciolariidae |
||||||||||
|
Fasciolaria tulipa |
1 |
1 |
1 |
|||||||
|
Familia Plakobranchidae |
||||||||||
|
Elysia crispata |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
||
|
Familia Cerithiidae |
||||||||||
|
Cerithium litteratum |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
|
Familia Ovulidae |
||||||||||
|
Cyphoma gibbosum |
1 |
|||||||||
|
Familia Naticidae |
||||||||||
|
Polinices lacteus |
1 |
1 |
1 |
|||||||
|
Familia Limidae |
||||||||||
|
Ctenoides scabra |
1 |
1 |
1 |
|||||||
|
Estrellas (phylum Echinodermata / subphylum Asterozoa / clase Asteroidea) |
||||||||||
|
Familia Ophidiasteridae |
||||||||||
|
Linckia guildingii |
1 |
1 |
1 |
1 |
1 |
1 |
||||
|
Familia Oreasteridae |
||||||||||
|
Oreaster reticulatus |
1 |
1 |
1 |
1 |
||||||
|
Erizos (phylum Echinodermata / clase Asteroidea) |
||||||||||
|
Familia Diadematidae |
||||||||||
|
Diadema antillarum |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
|
Familia Toxopneustidae |
||||||||||
|
Lytechinus variegatus |
1 |
1 |
1 |
1 |
1 |
1 |
||||
|
Lytechinus williamsi |
1 |
1 |
||||||||
|
Tripneustes ventricosus |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
|
Familia Echinometridae |
||||||||||
|
Echinometra lucunter |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
Echinometra viridis |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
||
|
Familia Cidaroidae |
||||||||||
|
Eucidaris tribuloides |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|||
|
Total |
9 |
12 |
13 |
21 |
13 |
13 |
11 |
11 |
16 |
15 |
En el análisis de similitud, cortando a un 80% de similitud se obtuvo un grupo formado por los arrecifes Verde, En medio y Sacrificios, los cuales son arrecifes de relativa cercanía a la costa (5, 6 y 1 km, respectivamente; Tunnell Jr., 2010). El arrecife con menor similitud con respecto a los demás arrecifes es el arrecife Hornos, que es un arrecife bordeante, a diferencia de los demás arrecifes analizados, que son de tipo plataforma (fig. 2).

Con escalado multidimensional (EMD) se obtuvo un Stress de 0.16 y analizando los agrupamientos formados en los ejes 1 y 2, se pueden identificar 3 agrupaciones: uno formado por los arrecifes Santiaguillo y Anegada de Afuera, que son, de los arrecifes analizados, los más alejados de la costa (20 y 16 km, respectivamente; Tunnell Jr., 2010); la segunda agrupación la forma el arrecife Hornos, que se ubica pegado a la costa, y la tercera, formada por todos los demás arrecifes, cuyas distancias a la costa van de 1 km (Sacrificios) a 15 km (Cabezo; fig. 3).
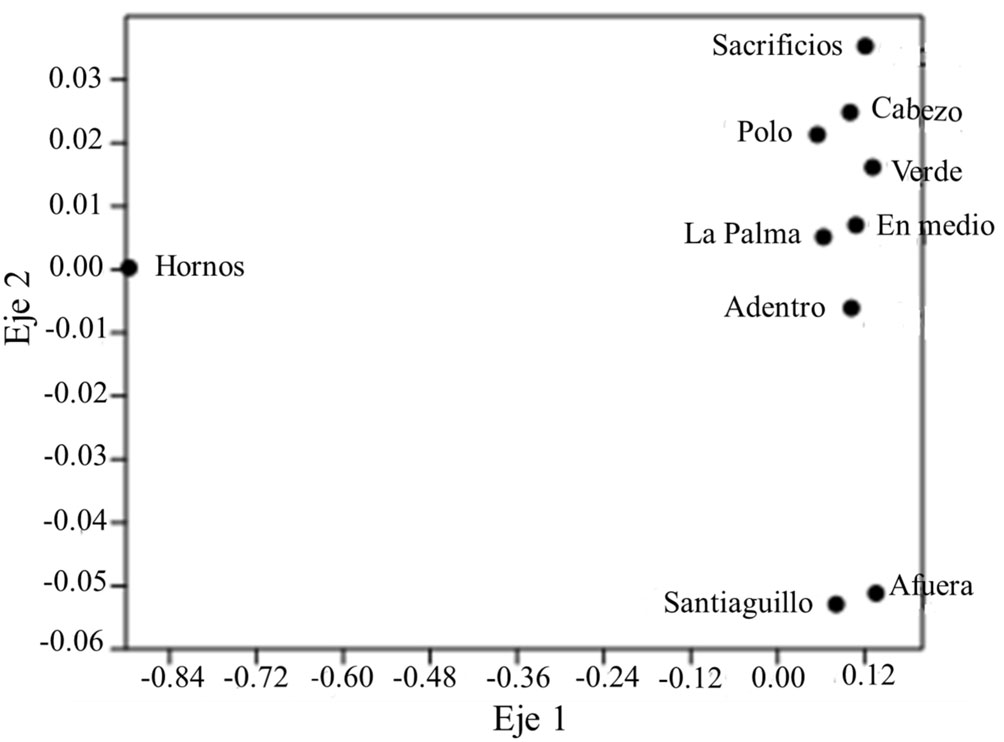
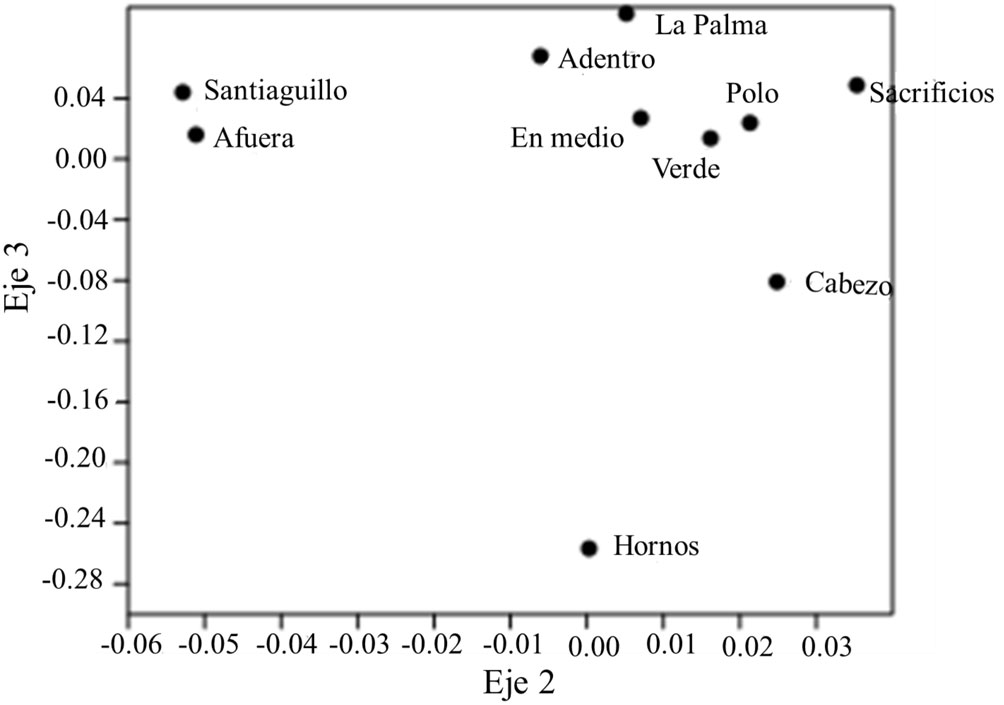
En el caso de los agrupamientos formados en los ejes 2 y 3, continúan separados, Hornos por un extremo, y Santiaguillo y Afuera por otro, pero el grupo formado por los demás arrecifes muestra ya ciertas distancias entre arrecifes, como son: Sacrificios y Cabezo, que son, de los arrecifes de este grupo, el más cercano (1 km) y el más lejano (15 km), respectivamente (fig. 4).
Discusión
De los arrecifes estudiados, el arrecife Polo presentó un mayor número de erizos, anémonas y moluscos identificados (7, 4 y 6 especies, respectivamente), lo cual contribuyó a que éste fuera el arrecife con mayor riqueza de especies. Esta elevada diversidad sería reflejo de una buena salud del ecosistema si también tuviera una elevada diversidad de corales; sin embargo, este arrecife está por debajo del promedio de los del grupo sur, tanto en diversidad como en cobertura coralina, y muy por encima del promedio en cobertura algal (López-Padierna, 2017). De acuerdo con Connell (1978) una elevada diversidad puede ser reflejo de que existen disturbios que provocan cierta cantidad de mortandad compensatoria, con la cual se presentan reemplazos continuos en la comunidad, así como poblaciones pequeñas, y por consiguiente, frágiles por su mayor probabilidad de extinción. El arrecife Polo es, de los estudiados, el más cercano de los del grupo sur a la desembocadura del río Jamapa. En el caso del arrecife Hornos, otros autores lo han reportado como altamente impactado y con un incremento en la cobertura de sustrato desnudo debido probablemente a su cercanía a la costa, lo cual conlleva a un mayor efecto antrópico (Godínez-Ortega et al., 2009; Ramírez-García et al., 2007). Sería recomendable el realizar estudios de las comunidades de invertebrados en varios arrecifes del SAV que incluyan la densidad y abundancia de cada grupo a fin de comprender mejor la estructura de sus comunidades.
En el dendrograma de similitud, la agrupación formada entre los arrecifes Verde, En medio y Sacrificios podría obedecer a variables abióticas relacionadas con la distancia a la costa como sería la visibilidad. Analizando los datos disponibles de sedimentación y visibilidad horizontal a 2 profundidades (3 a 5 y de 10 a 15 m) de Pérez-España et al. (2015), y calculando la sedimentación y la visibilidad promedio de julio de 2008 a mayo de 2014, para los arrecifes Anegada de Adentro, En medio, Sacrificios, Santiaguillo y Verde, puede observarse que los arrecifes Verde, En medio y Sacrificios presentan una visibilidad promedio similar (8.24, 6.40 y 5.45 m, respectivamente), a pesar de que la tasa de sedimentación difiera marcadamente entre ellos. El arrecife Anegada de Adentro presenta mayor visibilidad que los 3 arrecifes antes mencionados (10.23 m) y tanto en el dendrograma de similitud como en el escalamiento multidimensional, se separa ligeramente del grupo de arrecifes de plataforma de mediana distancia a la costa. El arrecife Santiaguillo presenta la mayor visibilidad (17. 08 m.), se encuentra separado tanto en el dendrograma de similitud como en el escalamiento multidimensional, y es, de los arrecifes analizados, el de mayor distancia a la costa (fig. 5).
De acuerdo con la información analizada y en concordancia con otros autores (De Vantier et al., 1998; Díaz-Pulido et al., 2004), pareciera que la transparencia del agua es un factor importante que determina la composición de las comunidades de invertebrados bentónicos en los arrecifes y pareciera ser mayor en los arrecifes más alejados de la costa, igual a lo observado por otros autores (Díaz-Pulido et al., 2004), y es reflejo de la concentración y tipo de partículas en suspensión. Se sabe que en décadas recientes, la tasa de sedimentación ha ido en aumento debido principalmente al crecimiento de zonas urbanas y portuarias y al mayor aporte de sedimentos finos (Lozano-Aburto, 2009), tomando en consideración que el aumento en el aporte de sedimentos frecuentemente disminuye la transparencia del agua.
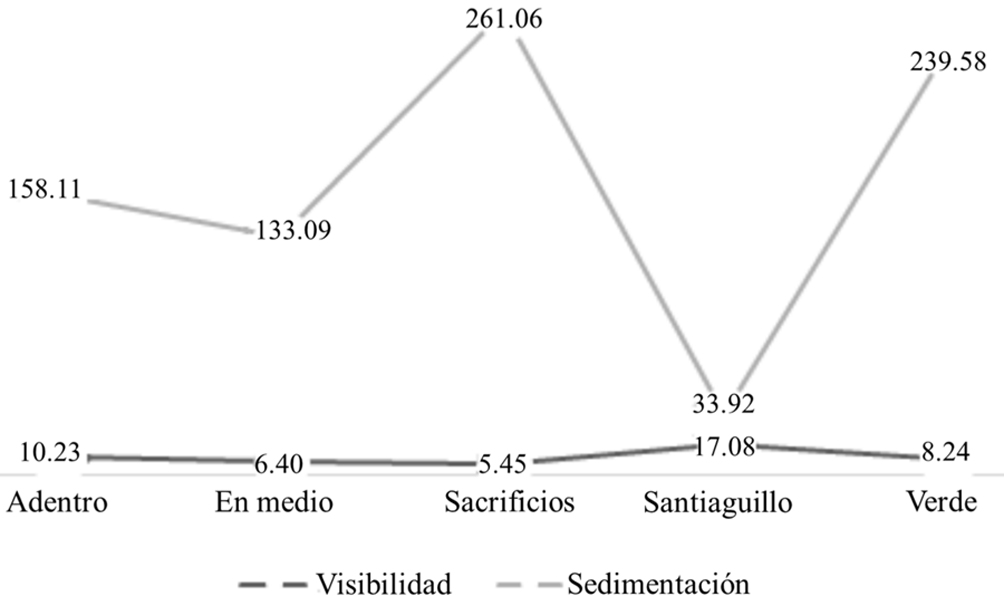
Cabe mencionar el caso del arrecife Isla Verde, que de acuerdo con los datos de Pérez-España et al. (2015), presenta una elevada tasa de sedimentación y a pesar de esto, la transparencia del agua es similar a la de otros arrecifes que reciben una menor cantidad de sedimentos; ésto podría deberse probablemente al tipo y tamaño de las partículas o bien como efecto de los giros ciclónicos que se han reportado para la región (Salas-Pérez et al., 2012), que de acuerdo con Lacombe et al. (1995), ayudan a que exista un recambio de agua llevándose mar adentro el agua con sedimentos y reemplazándola con agua limpia.
De acuerdo con Díaz-Pulido et al. (2004), las variaciones de la transparencia del agua pueden limitar a algunos organismos y beneficiar a otros, por ejemplo, en la mayoría de especies de coral, los sedimentos acumulados en sus tejidos provoca la muerte de los mismos (Gilmour, 2006), y la disminución en la transparencia debida al incremento de partículas suspendidas, evita el paso de luz afectando a organismos fotosintetizadores (Erftemeijer et al., 2012) . Por otra parte, el incremento de partículas suspendidas principalmente provenientes de ríos, favorece a organismos suspensívoros que no tienen endosimbiontes fotosintéticos, como algunas especies de coral y de esponjas (Gilmour, 2006; Sánchez, 1999; Valderrama y Zea, 2003), o bien, a organismos que por sus requerimientos de hábitat, viven en sitios con elevada sedimentación (Vázquez-Domínguez, 2003).
No hay información publicada referente a la transparencia del agua en los otros arrecifes estudiados, recomendándose ampliar la gama de trabajos enfocados a los factores fisicoquímicos y ecológicos presentes en los arrecifes del PNSAV. El presente trabajo tiene limitaciones debido a que se excluyeron varias especies en las que hubo alguna confusión referente a la identificación, además de no incluir abundancias estimadas para las especies determinadas; sin embargo, se aporta nueva información al incluir varias especies halladas en distintos arrecifes, además de mostrar un panorama general de estas comunidades en el PNSAV, permitiendo la comparación entre los arrecifes a fin de identificar los factores que definen la composición de sus comunidades.
Agradecimientos
Al Tecnológico Nacional de México por el apoyo al proyecto 5248.14_P; a Pánfilo Lagunes Rivera, Rubén Valencia Sosa y Alejandro Salgado Ruíz, jefe de embarcaciones e instructores a bordo, del Instituto Tecnológico de Boca del Río; a Horacio Pérez España del ICIMAP, Universidad Veracruzana, por el apoyo con la información bibliográfica y equipo. Agradecemos el apoyo en la identificación de especies a Patricia Gómez López, curadora y encargada de la colección de esponjas “Dr. Gerardo Green” de la UNAM, a Angélica Vázquez Machorro, del Posgrado en Ciencias del Mar y Limnología de la UNAM y a Felipe de Jesús Cruz López, de la ENEP Iztacala de la UNAM. A autoridades y personal de las oficinas del PNSAV (Conanp), por los permisos otorgados y por darnos acceso a parte de su información sobre tasas de sedimentación. A los alumnos Omar Oslet Rivera, Gregorio J. Aguirre, Perla Montero y Eduardo Palacio por su invaluable apoyo en campo.
Referencias
Aguilar-Estrada, L. G., Ortigosa, D., Urbano, B. y Reguero, M. (2014). Análisis histórico de los gasterópodos de la laguna arrecifal de isla Verde, Veracruz, México. Revista Mexicana de Biodiversidad, 85, 502–512.
Boxshall, G. A., Mees, J., Costello, M. J., Hernández, F., Gofas, S., Hoeksema, B. W. et al. (2014). World register of marine species (WoRMS). Recuperado el 07 noviembre, 2014 de: http://www.marinespecies.org
Burke, L., Reytar, K., Spalding, M. y Perry, A. (2011). Reefs at risk. Revisited. Washington, D.C.: Word Resources Institute.
Collin, R., Díaz, M. C., Norenburg, J., Rocha, R. M., Sánchez, J. A., Schulze, A. et al. (2005). Photographic identification guide to some common marine invertebrates of Bocas del Toro, Panama. Caribbean Journal of Science, 41, 638–707 Recuperado el 29 octubre, 2014 de: https://repository.si.edu/bitstream/handle/10088/11180/iz_collin_etal2005.pdf?sequence=1yisAllowed=y
Connell, J. H. (1978). Diversity in Tropical Rain Forest and coral Reefs. Science, 199, 1302–1310.
Cornell, H. V. y Karlson, R. H. (2000). Coral species richness: ecological versus biogeographical influences. Coral Reefs, 19, 37–49.
De León-González, J. A., Bastida-Zavala, J. R., Carrera-Parra, L. F., García-Garza, M. E., Peña-Rivera, A., Salazar-Vallejo, S. I. et al. (2009). Poliquetos (Annelida: Polychaeta) de México y América tropical. Monterrey: Universidad Autónoma de Nuevo León.
De Vantier, L. M., De’Ath, G., Done, T. J. y Turak, E. (1998). Ecological assessment of a complex natural system: a case study from the great barrier reef. Ecological Applications, 8, 480–496.
Díaz-Pulido, G., Sánchez, J. A., Zea, S., Díaz, J. M. y Garzón, J. (2004). Esquemas de distribución espacial en la comunidad bentónica de arrecifes coralinos continentales y oceánicos del Caribe colombiano. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 28, 337–347.
DOF (Diario Oficial de la Federación) (1992). 25 de agosto de 1992. Recuperado el 04 noviembre, 2016 de: http://www.dof.gob.mx/nota_detalle.php?codigo=4683791yfecha=25/08/1992
DOF (Diario Oficial de la Federación) (2012). 29 de noviembre de 2012. Recuperado el 04 noviembre, 2016 de: http://www.dof.gob.mx/nota_detalle.php?codigo=5280548yfecha=29/11/2012
Erftemeijer, P. L. A., Riegl, B., Hoeksema, B. W. y Todd, P. A. (2012). Environmental impacts of dredging and other sediment disturbances on corals: a review. Marine Pollution Bulletin, 64, 1737–1765.
Gilmour, J. P., Cooper, T. F., Fabricius, K. E. y Smith, L. D. (2006). Early warning indicators of change in the condition of corals and coral communities in response to key anthropogenic stressors in the Pilbara, Western Australia. Technical report. Perth, Western Australia: Australian Institute of Marine Science.
Godínez-Ortega, J. L., Ramírez-García, P. y Pedraza-Venegas, K. (2009). Cambios en la flora béntica de arrecife Hornos (Veracruz, México). Revista especializada en Ciencias Químico-Biológicas, 12, 59–65.
Gómez, P. (2002). Esponjas marinas del golfo de México y el Caribe. México D.F.: AGT Editor, S.A.
Gómez, P. (2007). Inventario de las esponjas del Parque Nacional Sistema Arrecifal Veracruzano, con nuevos registros de especies (Porifera: Demospongiae). En A. Granados-Barba, A., L. G. Abarca-Arenas y J. M. Vargas-Hernández (Eds.), Investigaciones científicas en el Sistema Arrecifal Veracruzano (pp. 51–72). Campeche: Universidad Autónoma de Campeche.
González-Muñoz, R. (2005). Estructura de la comunidad de anémonas del arrecife La Galleguilla, Veracruz. México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. México D.F.
González-Muñoz, R., Simoes, N., Tello-Musi, J. y Rodríguez, E. (2013). Sea anemones (Cnidaria, Anthozoa, Actiniaria) from coral reefs in the southern Gulf of Mexico. Zookeys, 341, 77–106.
González-Muñoz, R., Tello-Musi, J. L. y Simões, N. (2015). Las anémonas del Sistema Arrecifal Veracruzano. En A. Granados-Barba, L. Ortíz-Lozano, D. Salas-Monreal y C. González-Gándara (Eds.), Aportes al conocimiento del Sistema Arrecifal Veracruzano: hacia el corredor arrecifal del suroeste del golfo de México (pp. 101–118). Campeche: Universidad Autónoma de Campeche.
Gosner, K. L. (1978). Peterson field guides: Atlantic seashore. Boston: Houton Mifflin Company.
Hammer, Ø., Harper, D. A. T. y Ryan, P. D. (2001). PAST: Paleontological Statistics Software Package for Education and Data Analysis. Paleontología Electrónica, 4, 9.
Horta-Puga, G. (2016). Condition of selected reef sites in the Veracruz Reef System (stony corals and algae). Atoll Research Bulletin, 496, 360–369.
Humann, P. y Deloach, N. (1999). Reef creature identification. Florida Caribbean Bahamas. Jacksonville, Florida: New World Publications, Inc.
James-Cruz, J. L. y Márquez-Calle, G. (2011). Valoración económica del buceo como estrategia de uso sostenible de la biodiversidad marina, archipiélago de San Andrés y Providencia, Caribe colombiano. Gestión y Ambiente, 14, 37–54.
Jones, J., Withers, K. y Tunell Jr., J. W. (2008). Comparison of benthic communities on six coral reefs in the Veracruz Reef System (México). Proceedings of the 11th International Coral Reef Symposium, Ft. Lauderdale, Florida, 7-11 July 2008. Mini symposium number 18.
Kaplan, E. H. (1999). A field guide to Southeastern and Caribbean seashores: Cape Hatteras to the Gulf coast, Florida, and the Caribbean (Vol. 36). Boston: Houghton Mifflin Harcourt.
Lacombe, P., Ridd, P. V., Prytz, A. y Wilson, B. (1995). Factors controlling suspended sediment on inner-shelf coral reefs, Townsville, Australia. Coral Reefs, 14, 163–171.
López-Padierna, M. (2017). Distribution and condition of stony corals in the Veracruz Reef System National Park: a management perspective (Tesis de maestría). Nova Southeastern University. Davie, Florida, EUA.
Lozano-Aburto, M. A. (2009). Taxocenosis de octocorales del Parque Nacional Sistema Arrecifal Veracruzano (Tesis de maestría). Instituto de Ciencias Marinas y Pesquerías, Universidad Veracruzana. Boca del Río, Veracruz, México.
Maldonado, J. H. y Sánchez, R. C. (2016). Valoración económica del parque nacional natural corales de profundidad. Boletín de Investigaciones Marinas y Costeras, 45, 99–121.
Pérez-España, H., Bello-Pineda, J., Ávila-Santiago, P., Berumen-Solorzano, P., Pelo-Merino, S., Flores-Arévalo, R. et al. (2015). Monitoreo del Parque Nacional Sistema Arrecifal Veracruzano: segunda etapa. México D.F.: Universidad Veracruzana, Instituto de Ciencias Marinas y Pesquerías. Hoja de cálculo SNIB-Conabio. Proyecto GM004.
Ramírez-García, P., Terrados, J., Hernández-Martínez, O., Pedraza, K. y Quiroz, A. (2007). La vegetación de Thalassia testidinum en los arrecifes de Hornos, Sacrificios y En medio: biomasa, productividad y dinámica de crecimiento. En A. Granados-Barba, L. G. Abarca-Arenas y J. M. Vargas-Hernández (Eds.), Investigaciones científicas en el Sistema Arrecifal Veracruzano (pp. 173–184). Campeche: Universidad Autónoma de Campeche.
Ramsar. (2004). Convención Ramsar. Recuperado el 04 noviembre, 2016 de: http://www.ramsar.org/es/parque-nacional-sistema-arrecifal-veracruzano
Reyes-Bonilla, H., del Castillo-Cárdenas, A., Calderón-Aguilera, L. E., Erosa-Ricárdez, C. E., Fernández-Rivera, F. J., Frausto, T. C. et al. (2014). Servicios ambientales de arrecifes coralinos: el caso del Parque Nacional Cabo Pulmo, Baja California Sur. Capítulo 3. En J. I. Urciaga-García (Eds.), Desarrollo regional en Baja California Sur: una perspectiva de los servicios ecosistémicos (pp. 38–63). La Paz, Baja California Sur: Universidad Autónoma de Baja California Sur.
Richmond, R. H. (1993). Coral reefs: present problems and future concerns resulting from anthropogenic disturbances. American Zoologist, 33, 524–536.
Rogers, C. (1990). Responses of coral reefs and reef organisms to sedimentation. Marine Ecology Progress Series, 62, 185–202.
Salas-Pérez, J. J., Salas-Monreal, D., Monreal-Gómez, M. A., Riverón-Enzastiga, M. L. y Llasat, C. (2012). Seasonal absolute acoustic intensity, atmospheric forcing and currents in a tropical coral reef system. Estuarine, Coastal and Shelf Science, 100, 102–112.
Sale, P. F., Van-Lavieren, H., Ablan-Lagman, M. C., Atema, J., Butler, M., Fauvelot, C. et al. (2010). Conservando la conectividad de los arrecifes: guía para los administradores de las áreas marinas protegidas. Melbourne, Australia. Grupo de Trabajo de Conectividad, Programa de Investigación Dirigido a los Arrecifes de Coral y a la Creación de Capacidades para la Gestión, UNU-INWEH.
Sánchez, J. A. (1999). Black coral-octocoral distribution patterns on Imelda bank, a deep-water reef, Colombia, Caribbean Sea. Bulletin of Marine Science, 65, 215–225.
Solís-Weiss, V. (1998). Atlas de anélidos poliquetos de la plataforma continental del Golfo de México. Informe final SNIBCONABIO proyecto Núm. P052. México D.F.: Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México.
Tunnel, Jr. J. W. (2010). Distribución de los arrecifes. En J. W. Tunnell Jr., E. A. Chávez y K. Withers (Eds.), Arrecifes coralinos del sur del Golfo de México (pp. 17–29). México D.F.: Centro Interdisciplinario de Ciencias Marinas, I.P.N.
UNESCO (Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura). (2006). UNESCO/ Ciencias Naturales/ Medio Ambiente/ Ciencias ecológicas/ Reservas de la Biosfera/ México. Recuperado el 01 Noviembre, 2016 de: http://www.unesco.org/new/en/natural-sciences/environment/ecological-sciences/biosphere-reserves/latin-america-and-the-caribbean/mexico/sistema-arrecifal-veracruzano/
Valderrama, D. y Zea, S. (2003). Esquemas de distribución de esponjas arrecifales (Porifera) del noroccidente del Golfo de Urabá, Caribe Sur, Colombia. Boletín de Investigaciones Marinas y Costeras, 32, 37–56.
Vázquez-Domínguez, E. (2003). Diversidad y distribución de crustáceos y equinodermos y su relación con niveles de sedimentación en arrecifes coralinos. Revista de Biología Tropical, 51, 183–194.
Villamizar, E. (2000). Estructura de una comunidad arrecifal en Falcón, Venezuela, antes y después de una mortalidad masiva. Revista de Biología Tropical, 48, 19–30
Wood, R. (2001). Biodiversidad y la historia de los arrecifes. Geological Journal, 36, 251–263.
Zea, S., Henkel, T. P. y Pawlik, J. R. (2014). The sponge guide: a picture guide to Caribbean sponges. 3rd Edition. Universidad Nacional de Colombia. Recuperado el 05 noviembre 2016, de: http://www.spongeguide.org