María Fernanda Vázquez-Ochoa a, Lázaro Rafael Sánchez-Velásquez a, Guadalupe Hernández-Vargas a, Sara Patricia Ibarra-Zavaleta a, Cesar Ruiz-Montiel b y María del Rosario Pineda-López a, *
a Universidad Veracruzana, Instituto de Biotecnología y Ecología Aplicada, Av. de las Culturas Veracruzanas 101, Col. Emiliano Zapata, 91090 Xalapa, Veracruz, México
b Universidad Veracruzana, Instituto de Investigaciones Forestales, Parque Ecológico “El Haya”, Carretera Antigua a Coatepec, Coapexpan, 91070 Xalapa, Veracruz, México
*Autor para correspondencia: rosariorosariop@gmail.com (M.R. Pineda-López)
Recibido: 19 mayo 2021; aceptado: 3 noviembre 2021
Resumen
México tiene la mayor diversidad global de especies de pinos y poco se sabe sobre la interacción Pinus–Dendroctonus. Nuestras preguntas fueron: 1) ¿Qué especies de Dendroctonus se pueden recolectar en trampas con atrayentes generalistas en un bosque mixto de pinos? 2) ¿Es diferente la presencia de Dendroctonus entre especies de pinos y sus clases de tamaño diamétrico? 3) ¿Cuáles son los valores de importancia ecológica relativos (VIE) de las especies de pinos? A través de un muestreo con punto cuadrante, se registraron 4 especies de pinos (Pinus montezumae, P. patula, P. pseudostrobus y P. strobus) y con el uso de trampas, 4 de Dendroctonus (D. adjunctus, D. aproximatus, D. mexicanus y D. valens). Hubo diferencias significativas en el número de Dendroctonus entre categorías diamétricas y especies de pinos. La presencia de Dendroctonus fue mayor en diámetros más grandes, con excepción de P. strobus. Pinus montezumae tuvo la mayor cantidad de individuos con presencia de Dendroctonus, pero a nivel de población, P. patula tuvo la mayor proporción de individuos con Dendroctonus (29.4%). El VIE más alto fue para P. montezumae. Sugerimos, mantener monitoreo de Dendroctonus en P. montezumae y P. patula, debido a su valor económico en la región de estudio.
Palabras clave: Descortezadores; Interacciones ecológicas; México; Parque Nacional; Pinus; Valor de importancia ecológica
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
The presence of Dendroctonus is different among pine species and their diameters in the Cofre de Perote National Park region, Mexico
Abstract
Mexico has the highest global diversity of pine species, little is known about the Pinus–Dendroctonus interaction. Our questions were: 1) Which species of Dendroctonus can be collected in traps with generalist attractants in a mixed pine forest? 2) Is the presence of Dendroctonus different between pine species and their diameter size classes? 3) What are the relative ecological importance values (VIE) of the pine species? Through quadrant point sampling, 4 species of pines (Pinus montezumae, P. patula, P. pseudostrobus and P. strobus) were recorded, and with the use of traps, 4 species of Dendroctonus (D. adjunctus, D. aproximatus, D. mexicanus and D. valens). There were significant differences in the number of Dendroctonus between diameter categories and pine species. The presence of Dendroctonus was higher in larger diameters, with the exception of P. strobus. Pinus montezumae had the highest number of individuals with Dendroctonus presence, but at the population level, P. patula had the highest proportion of individuals with Dendroctonus (29.4%). The highest VIE was for P. montezumae. We suggest maintaining monitoring of Dendroctonus in P. montezumae and P. patula, due to its economic value in the study region.
Keywords: Bark beetle; Ecological interactions; Mexico; National Park; Pinus; Ecological importance value
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Los pinos, con aproximadamente 120 especies, son uno de los géneros que aportan más madera en el mundo (FAO, 2020). En México se encuentra la mayor diversidad global de especies de pinos (n = 49) (Gernandt y Pérez-de la Rosa, 2014), distribuidos desde 200 m snm (Pinus caribaea) hasta más de 4,000 m snm (P. hartwegii) y bajo un rango de precipitación promedio anual de 200 mm (e.g., P. lambertiana) a 2,500 mm (e.g., P. patula) (sensu Sánchez-Velásquez et al., 2009). México es considerado como un centro secundario de diversificación de este género (Aljos-Farjon, 1996). En los bosques de pinos se encuentran una gran cantidad de interacciones, entre ellas la herviboría a través de los descortezadores. Los descortezadores pueden funcionar como promotores en la sucesión vegetal y pueden mantener la sanidad de los bosques templados (Christiansen y Bakke, 1988). Sin embargo, ciertos factores abióticos y bióticos pueden aumentar sus poblaciones y convertirse en plagas forestales (Raffa et al., 2008). El género Dendroctronus Erichson es un grupo de escarabajos descortezadores asociados, naturalmente, a los bosques de coníferas (Wood, 1982). Diversos estudios observacionales relacionan el aumento de la presencia de especies del género Dendroctonus con diferentes factores ambientales, como temperaturas cálidas (Bentz et al., 2010), sequías (Hart et al., 2014; Six y Bracewell, 2015), incendios forestales (Kulakowski y Jarvis, 2013), así como con las características del arbolado y del rodal donde se encuentran (Windmuller-Campione, 2018; Vázquez-Ochoa et al., 2020). Se ha documentado cómo estos insectos han ocasionado un importante desequilibrio ecosistémico en los bosques donde aumentan sus poblaciones y cómo éstos han aumentado en años recientes, afectando áreas que históricamente no habían sido afectadas (Gillete et al., 2001; Macías-Sámano et al., 2004; Raffa et al., 2008).
En México, 40.5% de los reportes con fitopatógenos en bosques de coníferas están asociados con descortezadores del género Dendroctonus (Pérez-Camacho et al., 2013), los cuales han causado daños en 69,000 ha entre 1990 y 2014 (Sosa Díaz et al., 2018). De esta manera, se considera que los brotes de estos insectos se han incrementado en el país, especialmente en la zona norte y centro (López-Gómez et al., 2017). En este género se han sumado 21 especies, distribuidas en el norte y centro de América (Armendáriz-Toledano et al., 2015; Armendáriz-Toledano, Torres-Banda et al., 2017; Armendáriz-Toledano, García-Román et al., 2017). De éstas, se ha registrado la presencia de 14 en los bosques de México (Armendáriz-Toledano y Zúñiga, 2017; Armendáriz-Toledano et al., 2015; Salinas-Moreno et al., 2004; Sullivan et al., 2021). A pesar de que México es el país con más especies de pinos y una amplia diversidad de especies del género Dendroctonus, se conoce poco sobre esta interacción ecológica, en particular lo relacionados con sus preferencias de colonización de Dendroctonus sobre el tamaño de sus hospedantes del género Pinus (Castorena-Pérez et al., 2020; Salinas-Moreno et al., 2010; Vázquez-Ochoa et al., 2020). Se ha reportado una asociación positiva entre la presencia de Dendroctonus y árboles de pinos mayores a 40 cm de diámetro, aunque no se exenta su presencia en arboles más delgados (Bajak et al., 2016; Hart et al., 2014; Windmuller-Campione, 2018). Se sabe poco si hay preferencia de estos insectos sobre alguna especie y tamaño de pinos en bosques mixtos de pinos, en particular en la región del Cofre de Perote (Salinas-Moreno et al., 2010).
En la región del Cofre de Perote, Veracruz, se reporta la presencia de las especies Dendroctonus mexicanus, D. adjunctus (Cibrián et al., 1995), D. approximatus (Suárez-Hernández et al., 2017) y D. vitei (Armendáriz-Toledano et al., 2014), sin que éstos causen aún alertas como plagas forestales. Una forma de defensa química y física de los pinos a la colonización de los escarabajos es la formación de resina (Christiansen et al., 1987). Sin embargo, al combinarse la resina con las heces de Dendroctonus se forma una visible secreción resinosa llamada grumo que puede funcionar como atrayente del sexo opuesto y otros conspecíficos, provocando una colonización masiva en el árbol (Weed et al., 2015).
Debido a que se sabe poco sobre la asociación o preferencia de Dendroctonus y la estructura de tamaños de las poblaciones de pinos en bosques mixtos, y con la ayuda de que los grumos resinosos son evidencia externa de la colonización de Dendroctonus spp. (Stevens y Flakes, 1974), en este estudio nos planteamos las siguientes preguntas: 1) ¿qué especies de Dendroctonus se pueden recolectar en trampas con atrayentes generalistas en un bosque mixto de pinos? 2) ¿es diferente la presencia de grumos (Dendroctonus), entre las especies de pinos y sus clases de tamaño diamétrico? 3) ¿cuáles son los valores de importancia ecológica relativa de cada una de las especies de pinos?
Materiales y métodos
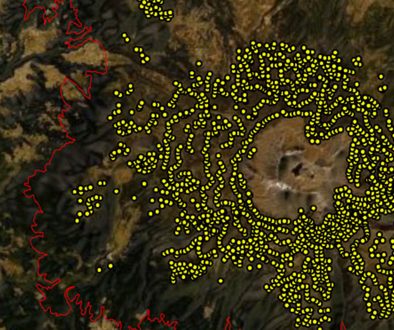
El área de estudio se ubica al NO de la montaña del Parque Nacional Cofre de Perote, que pertenece al ejido Agua de Los Pescados (19°31’54” N, 97°07’22” O), municipio de Perote, Veracruz, México (fig. 1a). El sitio corresponde a un bosque mixto de pinos de 330 ha. El suelo es de tipo Andosol ócrico, es de tipo volcánico de color oscuro con alta capacidad de retención de humedad (INEGI, 2014). El clima es semifrío, húmedo con verano fresco largo (INEGI, 2021). La temperatura del mes más frío oscila entre -3 y 18 °C y la del mes más caliente es de 22 °C, la precipitación anual en la parte más húmeda de la montaña, donde se ubica el área de estudio es de 1,500 mm (Soto y Angulo, 1990).
El área de estudio corresponde a un sitio de monitoreo implementado por los autores de esta investigación desde el año 2014. A través de este monitoreo se determinó que el bosque del ejido Los Pescados, presenta el mayor número de capturas de individuos del género Dendroctonus spp., comparado con el resto de los bosques monitoreados en la misma ladera. Para conocer las especies de Dendroctonus, se colocaron 15 trampas en total en grupos de 3 trampas Lindgren, 2 cebadas con un atrayente generalista alfa-beta pineno, endo-brevicomina y frontalina (Sistema Injecthor de México, S. A de C. V.) y una sin cebar por sitio de colecta, separadas dentro de cada grupo, por 100 m una de otra, durante el período de junio 2014 hasta julio de 2016. Los sitios fueron distribuidos equidistantemente cada 250 m de altitud, en una franja altitudinal desde los 2,000 a los 3,000 m (5 sitios). Los insectos contenidos en las trampas fueron recolectados quincenalmente, almacenando los individuos en alcohol al 70%. Los especímenes fueron identificados a nivel de género usando la guía de Wood (1982). La identificación de especies fue realizada por Tomas Atkinson (University of Texas, Austin, TX), a través de submuestras de todos los ejemplares colectados (previamente agrupados por su similitud morfológica), se usaron 15 individuos de cada grupo para su identificación. Posteriormente, se corroboró cada uno de los insectos capturados. Para la identificación, se utilizó el tamaño promedio de los ejemplares, las setas y el montículo del declive elitral, además de las antenas. Para el caso de D. approximatus se utilizaron los caracteres de la genitalia, como lo recomiendan Armendáriz-Toledano et al. (2018). Los ejemplares de cada especie de Dendroctonus se encuentran en la colección de insectos del Instituto de Investigaciones Forestales de la Universidad Veracruzana en Xalapa, Ver., México.
Para el registro del arbolado se establecieron 67 puntos de muestreo, mediante la ecuación de poblaciones infinitas con 90% de intervalo de confianza, distribuidos al azar y a una distancia mínima de 100 m entre cada punto (Arias, 2012). Su ubicación se realizó utilizando un GPS Garmin Map 64sx y a partir de cada punto cuadrante aleatorio se localizaron y midieron 4 árboles de pino más cercano a éste (diámetro ≥ 5 cm) (Cottam y Curtis, 1956). A cada individuo se le midió la altura total (clinómetro digital Haglöf Sweden®) y el diámetro a la altura de pecho con cinta diamétrica (1.30 m arriba del nivel del suelo); en este último se definieron 3 categorías de tamaño: ≥ 5-20, > 20-40 y > 40 cm. Para la identificación de las especies, se recolectó material vegetativo y reproductivo, y se revisó utilizando claves taxonómicas como la de Narave y Taylor (1997), además de corroborar las identificaciones con un taxónomo especialista de pinos.
En cada uno de los árboles se registró la presencia-ausencia de Dendroctonus a través de observaciones de las perforaciones y la presencia de grumos en los troncos de los árboles de pino (fig. 1b) (Stevens y Flakes, 1974), dichas estructuras, provocadas por Dendroctonus spp., son secreciones de resina blanquecina o rojiza visibles en la corteza y son fácilmente identificables (Cibrián et al., 1995). Se registró la presencia de grumos (fig. 2) sin importar su ubicación a lo largo del tronco de cada árbol, ya que es sabido que tanto D. valens como D. approximatus colonizan desde su base, este último también a árboles pequeños (Armendáriz-Toledano et al., 2018; Cibrián et al., 1995). Es sabido que las especies de Dendroctonus producen el grumo donde hacen un orificio visible, los grumos viejos toman una coloración cremosa o rojiza, en contraste con los grumos recién formados que son blancos y de consistencias suave. Por otro lado, los grumos del grupo de Ips presentan aserrín, los orificios son muy pequeños y son colonizadores secundarios (Cibrián et al., 1995).
Para reconocer la importancia ecológica relativa de las especies de árboles en el bosque mixto de pinos, se calculó el valor de importancia ecológica relativa, el cual indica la dominancia relativa de cada especie en el bosque. El valor de importancia se determina en función de atributos estructurales dentro de la comunidad vegetal (Curtis y McIntosh, 1950). En este estudio, para estimar el valor de importancia ecológica relativa se utilizó la siguiente ecuación:
VIEi = ∑I = 1 FRi + Bri
dónde VIEi es el valor de importancia ecológica relativa de la especie i-ésima, Fri es la frecuencia relativa, de la especie i-ésima, la cual se obtiene a través de la división del número de veces en la que aparece una especie en cada punto cuadrante, dividida entre la sumatoria del total de presencia en los puntos cuadrantes de todas las especies de pinos. Bri es la biomasa relativa, se obtiene a través de la división de la biomasa de una especie entre la sumatoria total de la biomasa de todas las especies de pinos. La biomasa se estimó a través de la ecuación siguiente:
B = (v) (Db) (Fe)
dónde B es la biomasa, v es el volumen (m3), Db es la densidad de la madera (Tm-3) y Fe es el factor expansión del tronco. Los valores utilizados fueron de 0.3874 gcm-3 para la densidad de madera y de 1.3 para el factor de expansión (Rojas-García y Villers-Ruíz, 2008). El volumen de cada individuo se estimó con la siguiente ecuación:
V = (dap2) (π/4) (h) (CM)
dónde V es el volumen (m3), dap el diámetro a la altura del pecho (m), h altura total del árbol (m) y CM el coeficiente morfométrico (0.7), el cual se usa para corregir el volumen calculado para sistemas que involucran formas irregulares para pinos (Rojas-García y Villers-Ruíz, 2008). En nuestro caso, la suma total de los VI de todas las especies es 200.
Con los datos colectados y ordenados por especie de pino, tamaño diamétrico y presencia-ausencia de grumos de Dendroctonus spp., se seleccionaron al azar 10,000 individuos con reemplazo a través del método de bootstrap (Manly, 2001). Con lo anterior y para saber si la presencia de Dendroctonus es significativamente diferente entre especies de pinos y los diámetros (≥ 5-20; > 20-40 y > 40 cm), se realizó un análisis usando un modelo lineal generalizado anidado, considerando como variable respuesta la presencia o ausencia de grumos de Dendroctonus spp. Las variables independientes fueron, las especies (4) y la variable tamaño diamétrico (3 clases de tamaño) la cual se anidó dentro de las especies. Para ello se utilizó la distribución binomial, link logit y las comparaciones múltiples por ajuste de Tukey-Kramer, todo ésto con del proceso GENMO de SAS (SAS, 2016). Las comparaciones múltiples de hicieron tanto entre especies como entre las categorías de tamaño. Por otro lado, se compararon entre especies de pinos los VIE, el número de individuos y la biomasa con un análisis no paramétrico (Kruskal-Wallis), (Zar 1999). Posteriromente, se realizó una prueba de comparación por pares T de Wilcoxon con valor de ajuste de P de Holm (función KruskalWalls test de R 2017), esta prueba es adecuada cuando la muestra no presenta una distribución normal (Zar, 1999).

Resultados
Los ejemplares colectados en las trampas fueron D. adjunctus (n = 433), D. aproximatus (n = 32), D. mexicanus (n = 75) y D. valens (n = 40). En el bosque mixto de pinos se identificaron la coexistencia de Pinus montezumae Lamb. (n = 1604), P. pseudostrobus Lindl. (n = 422), P. strobus Lindl. (n = 98) y P. patula Sch. et Cham (n = 198).
La presencia de grumos fue diferente entre especies de pinos (c2 = 173.75, df = 3, p < 0.0001) y entre clases de tamaño anidadas en la especie (c2 = 1005.33, df = 8, p < 0.0001) (tabla 1). En la mayoría de los casos, las comparaciones múltiples entre clases de tamaño dentro de las especies, la presencia de Dendroctonus spp., fueron significativamente diferentes (tabla 1). Para 3 especies de pinos, la clase de tamaño de diámetro > 40 cm registró la mayor cantidad de individuos con presencia de Dendroctonus spp., con excepción de Pinus strobus, el cual su clase de tamaño diamétrico ≥ 5-20 cm fue mayor que la clase de tamaño > 40 cm. La presencia de Dendroctonus para P. pseudostrobus y P. patula en diámetros ≥ 5-20 cm fue escasa (tabla 1).
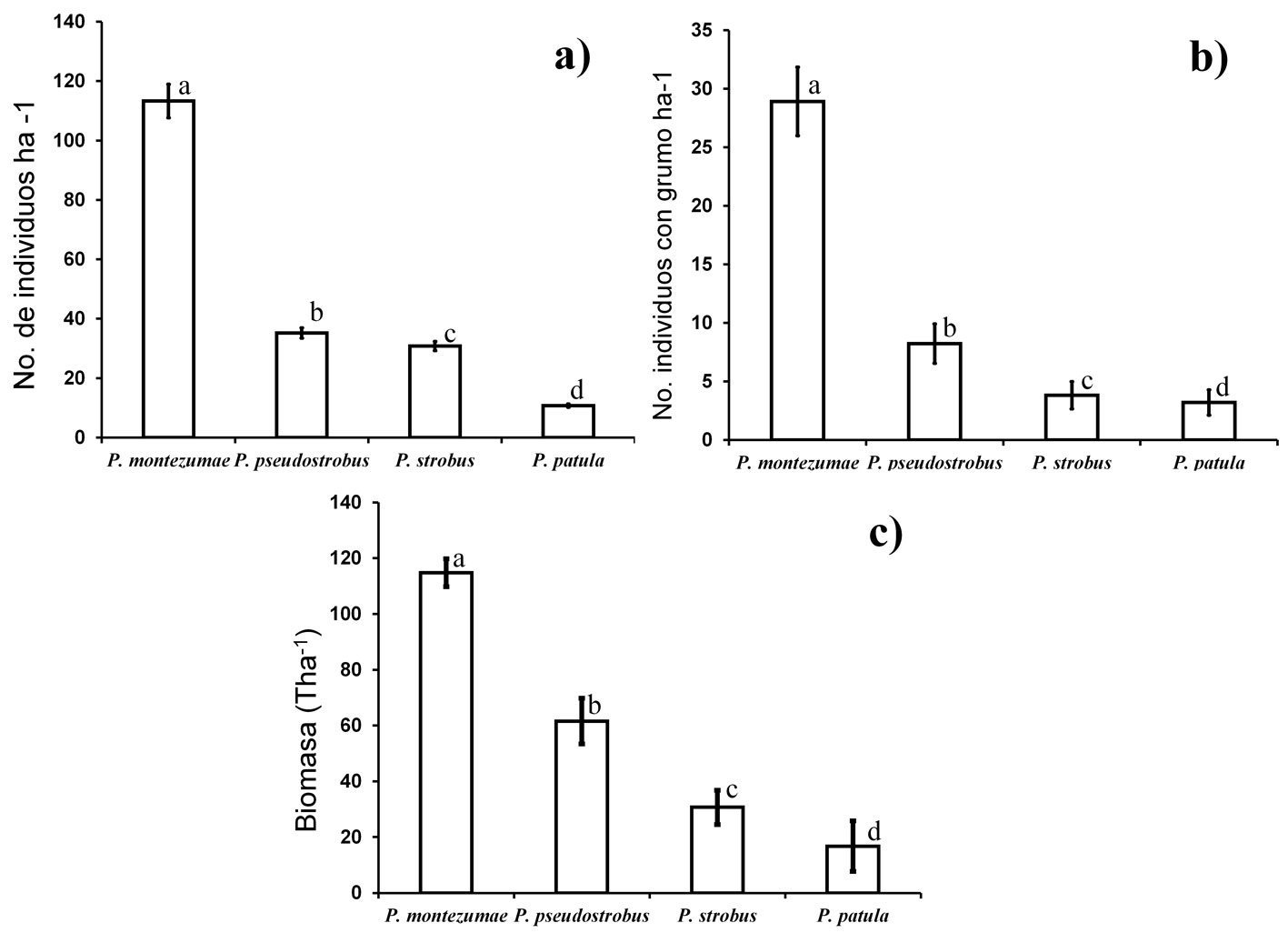
La especie de pino con el mayor número de individuos y mayor biomasa por hectárea fue P. montezumae (115 ind./ha-1, 114.8 T/ha–1, respectivamente) (fig. 2a, c). La especie de pino con el menor número de individuos y menor biomasa por hectárea fue P. patula (17 ind./ha-1, 16.7 T/ha-1, respectivamente) (fig. 2a, c). El contenido de biomasa y número de individuos de pino totales entre especies fueron significativamente diferentes entre especies (c2 = 3705.9, gl = 3, p < 0.0001; c2 = 9, gl = 3 p < 0.029). Además, todos los contrastes entre especies para cada VIE fueron significativamente diferentes (p < 0.05). El valor de importancia ecológica relativo más alto fue para P. montezumae con un 110.64%, seguido por P. pseudostrobus con 46.25% y P. strobus con 30.02%, el valor más bajo fue para P. patula con 13.09%.
Tabla 1
Comparaciones múltiples entre 4 especies de pinos y 3 clases de tamaños diamétricos (las clases de tamaño anidadas dentro de las especies). El porcentaje de individuos de cada especie en cada clase de tamaño con presencia de Dendroctonus spp fue: Pinus montezumae ≥ 5-20 (18.62%), > 20-40 (25.22%), > 40 (56.16%); P. pseudostrobus ≥ 5-20 (0.58%), > 20-40 (36.84%), > 40 (62.57%); P. strobus ≥ 5-20 (32.46%), 20-40 (31.75%), > 40 (35.78%); P. patula ≥ 5-20 (0.51%), > 20-40 (39.39%), > 40 (60.10%); n = 10,000.
| Especie | Clase de tamaño cm | Especie | Clase de tamaño cm | p | |
| P. montezumae | (≥ 5-20) | vs. | P. montezumae | (> 20-40) | < 0.0001 |
| P. montezumae | (≥ 5-20) | vs. | P. montezumae | (> 40) | < 0.0001 |
| P. montezumae | (> 20-40) | vs. | P. montezumae | (> 40) | < 0.0001 |
| P. pseudostrobus | (≥ 5-20) | vs. | P. pseudostrobus | (> 20-40) | 0.0061 |
| P. pseudostrobus | (≥ 5-20) | vs. | P. pseudostrobus | (> 40) | < 0.0001 |
| P. pseudostrobus | (> 20-40) | vs. | P. pseudostrobus | (> 40) | < 0.0001 |
| P. strobus | (≥ 5-20) | vs. | P. strobus | (> 20-40) | 0.0322 |
| P. strobus | (≥ 5-20) | vs. | P. strobus | (> 40) | 0.990 |
| P. strobus | (> 20-40) | vs. | P. strobus | (> 40) | 0.0002 |
| P. patula | (≥ 5-20) | vs. | P. patula | (> 20-40) | < 0.0001 |
| P. patula | (≥ 5-20) | vs. | P. patula | (> 40) | < 0.0001 |
| P. patula | (> 20-40) | vs. | P. patula | (> 40) | < 0.0001 |
Discusión
La presencia de Dendroctonus adjunctus, D. aproximatus, D. mexicanus y D. valens en la región, nos indica una alta riqueza de especies del género Dendroctonus, la cual representa 19% de las especies de Dendroctonus conocidas globalmente (n = 21) y 28.6% de las especies registradas para México (n = 14) (Armendáriz-Toledano y Zúñiga, 2017; Armendáriz-Toledano et al., 2015; Armendáriz-Toledano, Torres-Banda et al., 2017; Armendáriz-Toledano, García-Román et al., 2017; Sullivan et al., 2021). Es importante tomar estos resultados con precaución, ya que por el tipo de cebos generalistas usados, se puede atraer a una especie más que a otra y la cantidad de insectos puede estar sesgada. Sin embargo, es un hecho que las especies registradas están presente en la región y muy probablemente en el bosque mixto. Dendroctonus adjunctus fue la especie más frecuentemente capturada en el sitio de estudio y se presentó durante todo el periodo de captura, junto con D. mexicanus (junio 2014-julio 2016). Este último presenta de 3 a 5 generaciones por año, en cambio, para D. adjunctus se ha reportado solo una (Cibrián et al., 1995). La frecuencia con la que fue capturado D. adjunctus, probablemente se deba a las fechas en las que se presentan los diferentes estados de desarrollo en el gradiente altitudinal, asociado a la temperatura y a la época del año en que las que aparecen los distintos estados de vida. Así mismo, se ha registrado colonización a nuevos hospedantes entre agosto y marzo, y de hembras reemergentes de mayo a junio (Cibrián et al. 1995), esto sugiere la presencia de poblaciones superpuestas. La presencia de D. adjunctus durante todo el año también ha sido reportada por Rodríguez-Ortega et al. (2010) en Pinus hartwegii. De igual manera, es posible que el tipo y concentración del atrayente generalista haya contribuido a la presencia (captura) de D. adjuntus durante todo el año. Se ha registrado que D. adjunctus y D. mexicanus responden a la frontalina y alfa-beta pineno, en tanto que D. valens responde al alfa-beta pineno (Villa-Castillo, 1992; Zhang y Sun, 2006), lo que sugiere que el uso de los diferentes compuestos usados en este trabajo, influyera en la captura de las diferentes especies, y que además, haya funcionado como cebo para su registro. Así mismo, la riqueza de especies de pinos también es relativamente alta, representa 3.3% global (n = 120) y 8.2% para México (n = 49) (Gernandt y Pérez-de la Rosa, 2014; Price et al., 1998). Considerando la hipótesis de Janzen-Connell (Zahra et al., 2021), con relación a que las especies dominantes tienen el potencial de generar un bosque monoespecífico, pero debido a sus enemigos naturales pueden controlar su dominancia y permitir la coexistencia de otras especies de árboles, quizá la presencia de Dendroctonus y su diversidad expliquen parte de la alta riqueza de especies de pinos, fungiendo como agentes sanadores naturales del bosque (Burley, 2002; Christeansen y Bakke, 1988). Sin embargo, no se debe olvidar el impacto del cambio climático global sobre los bosques templados, que al aumentar la temperatura, las poblaciones de los descortezadores pueden incrementan su número y, por lo tanto, también su capacidad de infestación (Anderegg et al., 2015).
De acuerdo con Cibrián et al. (1995), las 4 especies de pinos registradas en este estudio son hospederos de las especies de Dendroctonus capturados en nuestras trampas. Pinus montezumae fue la especie dominante, con mayor número de individuos y biomasa, así como con mayor presencia de grumos de Dendroctonus spp. Lo anterior coincide con lo mencionado por Conafor (2017), indicando que P. montezumae es una de las principales especies atacada por Dendroctonus spp. Asimismo, observamos una tendencia positiva en la presencia de Dendroctonus spp., con el aumento de diámetro, (≥ 5-20) > (20-40) > (> 40) cm, para P. pseudostrobus, P. strobus y P. patula, con excepción de P. strobus. En el caso de D. mexicanus, se ha documentado su presencia en pinos > 40 cm de diámetro a partir de los 3 m de altura hasta donde inicia la copa del árbol (Cibrián et al.,1995; Suárez-Hernández et al., 2017). La preferencia del escarabajo por árboles de diámetros grandes (≥ 40 cm) es consistente con otros trabajos y se asocia a una corteza más gruesa que ofrece protección al estado larval de Dendroctonus durante el periodo invernal, además de proporcionar un mayor volumen de floema nutricional, lo que aumenta su supervivencia (Cibrián et al., 1995; Hart et al., 2014; Windmuller-Campione, 2018). Sin embargo, para P. strobus los resultados señalan que Dendroctonus está presente indistintamente entre los tamaños diamétricos (≥ 5 – > 40 cm) (tabla 1). Esto sugiere una mayor vulnerabilidad para P. strobus en relación a las otras especies de pinos, debido a que al ser atacados por Dendroctonus, el reclutamiento de los individuos de diámetro pequeño a categorías más grandes a través del tiempo, se verá reducido en el futuro y, consecuentemente, su tasa de crecimiento poblacional. Por otro lado, la población de P. patula (29.4%) es, proporcionalmente, más atacada por Dendroctonus que las otras especies de pinos (13-25%).
En general, nuestros resultados señalan que la colonización de Dendroctonus dependerá de su preferencia para seleccionar la especie de hospedante junto con su tamaño de diámetro. Otro aspecto para tomar en cuenta es el monitoreo permanente de la actividad de los descortezadores, aunque por el momento no sean considerados un problema de plaga para la zona. Es importante conocer por qué no actúan como insectos plaga en la región de estudio y sí en otras regiones del país y en otras áreas del mundo (por ejemplo, en EUA; Kurz et al., 2008).
Pinus patula es una de las especies más ampliamente utilizadas en los programas de reforestación a nivel mundial y en México (Dvorak, 1997), la población del área de estudio habita donde se han colectado semillas para los programas de reforestación (obs. pers.). De continuar con la colecta exclusiva de semillas de una especie, como P. patula, se corre el riesgo potencial de la susceptibilidad de las plantaciones a la colonización de los Dendroctonus, por lo que se sugiere precaución para utilizarla en programas de reforestación en esta región (Aparicio-Rentería et al., 2013).
Se han reportado otras interacciones relacionas con Dendroctonus spp. en los bosques mixtos de la región del Cofre de Perote. Por ejemplo, la alta presencia de Dendroctonus en Pinus montezumae se asocia a la baja riqueza biológica (diversidad funcional de bacterias) y al bajo contenido de Ca, Fe and NH4+ del suelo (Vázquez-Ochoa et al., 2020). Además, se ha reportado que la estructura de los bosques mixtos depende mucho de la preferencia de los removedores de semillas (depredadores y dispersores) como los roedores, aves e insectos, lo cual ocurre tanto de día como de noche (Flores-Peredo et al., 2011, 2016). Las semillas de Pinus montezumae y P. patula son las especies más preferidas por roedores, lo cual permite la dominancia de otras especies de pinos en otras áreas de la región (Flores-Peredo et al., 2011).
Lo anterior nos señala una diversidad de interacciones y otros procesos ecológicos, por lo tanto, para mantener la funcionalidad de los bosques mixtos de la región del Cofre de Perote, nuestro estudio sugiere que el manejo forestal mantenga la diversidad de especies de pinos, ya que aún no se ha reportado un problema fitosanitario a pesar de la presencia de varias especies de Dendroctonus. De igual manera, se sugiere que no se utilice únicamente P. patula (población con mayores incidencias proporcional de Dendroctonus) en plantaciones con fines productivos o de restauración ecológica, sino que se recurra a las plantaciones de pinos mixtos, preferibles para conservar la diversidad y resiliencia de los rodales.
Se registraron en las trampas con el atrayente generalista 4 especies de Dendroctonus (D. adjunctus, D. aproximatus, D. mexicanus y D. valens). Sin embargo, una de las limitaciones de este trabajo es que no se identificó qué especie de Dentroctonus coloniza a qué especie de pino; tema de otro trabajo de investigación. La presencia de Dendroctonus es diferente entre las 4 especies de pinos registradas y entre clases de tamaño diamétrico, la tendencia es a mayor diámetro mayor presencia, con excepción de P. strobus, cuyos diámetros pequeños tienen también alta presencia de Dendroctonus. Pinus montezumae es la especie dominante (valor de importancia ecológica relativo) debido al mayor número de individuos y biomasa por hectárea. Poblacionalmente, Pinus patula tuvo la mayor presencia de Dendroctonus. Sugerimos la inclusión de diferentes especies de pinos en actividades de reforestación y conservación debido a que favorecen la diversidad y, posiblemente, su resistencia y resiliencia a Dendroctonus.
Agradecimientos
A Rogelio Lara González, Hugo Suárez Hernández y Rodolfo Sánchez González por su apoyo en campo. Gracias a Héctor Narave Flores de la Universidad Veracruzana por la identificación de las especies de pinos. El proyecto fue financiado por el INBIOTECA – UV y la familia Sánchez-Pineda. De la misma manera agradecemos a 2 revisores anónimos por sus acertadas observaciones y sugerencias las cuales mejoraron la versión final de manuscrito.
Referencias
Aljos-Farjon, F. L. S. (1996). Biodiversity of Pinus (Pinaceae) in Mexico: speciation and palaeo-endemism. Botanical Journal of the Linnean Society, 121, 365-384. https://doi.org/10.1111/j.1095-8339.1996.tb00762.x
Anderegg, W. R. L., Hicke, J. A., Fisher, R. A., Allen, C. D., Aukema, J., Bentz, B. J. et al. (2015). Tree mortality from drought, insects, and their interactions in a changing climate. New Phytologist, 208, 674–683. https://doi.org/10.1111/nph.13477
Aparicio-Rentería, A., Viveros-Viveros, H. y Rebolledo-Camacho, V. (2013). Huertos semilleros clonales: una alternativa para los programas de reforestación en Veracruz. Revista Mexicana de Ciencias Agrícolas, 4, 90–97.
Arias, F. G. (2012). El proyecto de investigación. Introducción a la metodología científica. Caracas, República Bolivariana de Venezuela: Episteme, C.A.
Armendáriz-Toledano, F., Niño, A., Macía-Sámaro, J. E. y Zúñiga, G. (2014). Review of the geographical distribution of Dendroctonus vitei (Curculionidae: Scolytinae) based on geometric morphometrics of the seminal rod. Annals of Entomological Society of America, 107, 748–755.
Armendáriz-Toledano, F., Niño, A., Sullivan, B. T., Kirkendall, L. R. y Zúñiga, G. (2015). A new species of bark beetle, Dendroctonus mesoamericanus sp. nov. (Curculionidae: Scolytinae) in southern Mexico and Central America. Annals of the Entomology Society of America, 108, 403–414. https://doi.org/10.1093/aesa/sav020
Armendáriz-Toledano, F. y Zúñiga, G. (2017). Illustrated key to species of genus Dendroctonus (Curculionidae Scolytinae) occurring in Mexico and Central America. Journal of Insect Science, 17, 1–15. https://doi.org/10.1093/jisesa/iex009
Armendáriz-Toledano, F., Torres-Banda, V. y Zúñiga, G. (2017). The current status of Dendroctonus ponderosae Hopkins (Coleoptera: Curculionidae: Scolytinae) in Mexico. The Coleopterist Bulletin, 71, 565–570. https://doi.org/10.1649/0010-065X-71.3.565
Armendáriz-Toledano, F., García-Román, J., López, M. F., Sullivan, B. T. y Zúñiga, G. (2017). New characters and redescription of Dendroctonus vitei (Curculionidae: Scolytinae). The Canadian Entomologist, 149, 413–433. https://doi.org/10.4039/tce.2017.10
Armendáriz-Toledano, F., Zúñiga, G., García-Román, L. J., Valerio-Mendoza, O. y García-Navarrete, P. G. (2018). Guía ilustrada para identificar a las especies del género Dendroctonus presentes en México y Centroamérica. Ciudad de México: Instituto Politécnico Nacional.
Bajak, F., Mietkiewicz, N., Veblen, T. T. y Kulakowski, D. (2016). The relative importance of tree and stand properties in susceptibility to spruce beetle outbreak in the mid-20th century. Ecosphere, 7, 1–17. https://doi.org/10.1002/ecs2.1485
Bentz, B. J., Régnière, J., Fetting, C. J., Hansen, E. M., Hayes, J. L., Hicke, J. A. et al. (2010). Climate change and bark beetles of the Western United States and Canada: direct and indirect effects. BioScience, 60, 602–613. https://doi.org/10.1525/bio.2010.60.8.6
Burley, J. (2002). Panorámica de la diversidad biológica forestal. Revista Internacional de Silvicultura e Industrias Forestales, 53. Disponible en: http://www.fao.org/3/y3582s/y3582s02.html
Castorena-Pérez, A. E, Equihua-Martínez, A., Jardel-Peláez, E. J., Rivera-Cervantes, L. E. y Cuevas-Guzmán, R. (2020). Scolytinae y Platypodinae (Coleoptera: Curculionidae) de un bosque mixto de pino-latifoliadas de la Sierra de Manantlán, Jalisco, México. Dugesiana, 27, 83–90.
Christiansen, E., Waring, R. H. y Berryman, A. A. (1987). Resistance of conifers to bark beetle attack: searching for general relationship. Forest Ecology and Management, 22, 89–106. https://doi.org/10.1016/0378-1127(87)90098-3
Chirstiansen, E. y Bakke, A. (1988). The spruce bark beetle of Eurasia. En A. A. Berryman (Ed.), Dynamics of forest insect populations: patterns, causes, implications (pp. 497–503). New York: Plenum.
Cibrián, T. D., Méndez-Montiel, J. T., Campos-Bolaños, R., Yates, III H. O. y Flores-Lara, J. (1995). Insectos forestales de México/ Forest Insects of Mexico. Texcoco: Universidad Autónoma de Chapingo/ Comisión Forestal de América del Norte, FAO.
Conafor (Comisión Nacional Forestal). (2017). Foro de Transferencia de Tecnología de Sanidad Forestal . Xalapa, Veracruz: Conafor.
Curtis, J. T. y McIntosh, R. P. (1950). The interrelations of certain analytic and synthetic phytosociological characters. Ecology, 31, 434–45. https://doi.org/10.2307/1931497
Dvorak, W. S. (1997). The improvement and breeding of Pinus patula. 24th Southern Forest Tree Improvement Conference. Orlando, Florida, EUA. https://rngr.net/publications/tree-improvement-proceedings/southern/1997
FAO (Food and Agriculture Organization). (2020). El sector forestal en 2020. Recuperado el 24 abril de 2021: http://www.fao.org/3/j2807s/j2807s07.html
Flores-Peredo, R., Sánchez-Velásquez, L. R., Galindo-González, J. y Morales-Mávil, J. (2011). Post-dispersed pine seed removal and its effect on seedling establishment in a Mexican Temperate Forest. Plant Ecology, 212, 1037–1046. https://doi.org/10.1007/s11258-010-9884-9
Flores-Peredo, R., Bolivar-Cimé B. S. y Sánchez-Velásquez, L. R. (2016). Pine seed removal in three temperate plant communities. Botanical Sciences, 94, 737–744. https://doi.org/10.17129/botsci.750
Gernandt, D. S. y Pérez-de la Rosa, J. A. (2014). Biodiversidad de Pinophyta (coníferas) en México, Revista Mexicana de Biodiversidad, 85 (Suplem.), 126–133. https://doi.org/10.7550/rmb.32195
Gillete, N., Owen, D. R. y Stein, J. H. (2001). Interruption of semiochemical mediated attraction of Dendroctonus valens (Coleoptera: Scolytidae) and selected nontarget insects by vebenone. Environmental Entomology, 30, 837–841. https://doi.org/10.1603/0046-225X-30.5.837
Hart, S. J., Veblen, T. T, Eisenhart, K. S., Jarvis, D. y Kulakowski, D. (2014). Drought induces spruce beetle (Dendroctonus rufipennis) outbreaks across northwestern Colorado. Ecology, 95, 930–939.
INEGI (Instituto Nacional de Estadística y Geografía). (2014). Conjunto de datos vectoriales perfiles de suelos. Escala 1:1 000 000. Instituto Nacional de Estadística, Geografía e Informática. Aguascalientes, México. Recuperado el 15 de mayo de 2021: http://www.conabio.gob.mx/informacion/metadata/gis/eda250s2gw.xml?_httpcache=yes&_xsl=/db/metadata/xsl/fgdc_html.xsl&_indent=no
INEGI (Instituto Nacional de Estadística y Geografía). (2021). Portal de geoinformación. Recuperado 24 abrill, 2021: http://www.conabio.gob.mx/informacion/gis
Kulakowski, D. y Jarvis, D. (2013). Low-severity fires increase susceptibility of lodgepole pine to mountain pine beetle outbreaks in Colorado. Forest Ecology and Management, 289, 544–550. https://doi.org/10.1016/j.foreco.2012.10.020
Kurz, W., Dymond, C., Stinson, G., Rampley, G., Neilson, E., Carroll, A. et al. (2008). Mountain pine beetle and forest carbon feedback to climate change. Nature, 452, 987–990. https://doi.org/10.1038/nature06777
López-Gómez, V., Torres-Huerta, B., Reséndiz-Martínez, J. F., Sánchez-Martínez, G. y Gijón-Hernández, A. (2017). Influencia de parámetros climáticos sobre las fluctuaciones poblacionales del complejo Dendroctonus frontalis Zimmerman, 1868 y Dendroctonus mexicanus Hopkins, 1909. Revista Mexicana de Ciencias Forestales, 8, 7–29. https://doi.org/10.29298/rmcf.v8i41.24
Macías-Sámano, J. E., Domínguez, A. N., Cruz López, J. A. y Altúzar-Mérida, R. (2004). Monitoreo de descortezadores y sus depredadores mediante el uso de semioquímicos: manual operativo. Tuxtla Gutiérrez: El Colegio de la Frontera Sur. Chiapas
Manly, B. F. J. (2001). Randomization, bootstrap and Monte Carlo methods in Biology. Texts in Statistical Science. Boca Raton: Chapman & Hall/CRC. Florida, USA.
Narave, H. y Taylor, K. (1997). Flora de Veracruz. Pinaceae. Fascículo 98. Xalapa: INECOL A.C., México.
Pérez-Camacho, M., López-López, M. A., Equihua-Martínez, A., Cetina-Alacalá, V. M. y Méndez-Montiel, J. T. (2013). Relationships between site factors and bark beetle attack on pine trees. Journal of Biological Sciences, 13, 621–627. https://doi.org/10.3923/jbs.2013.621.627
Price, R. A., Liston, A. y Strauss, S. H. (1998). Phylogeny and systematics of Pinus. En M. D. Richardson (Ed.). Ecology and Bbiogeography of Pinus (pp. 49-68. Cambridge, UK: Cambridge University Press.
Raffa, K. F., Aukema, B. H., Bentz, B. J., Carroll, A. L., Hicke, J. A., Turner, M. G. et al. (2008). Cross-scale drivers of natural disturbances prone to antropogenic amplification: the dynamics of bark beetle eruptions. Bioscience, 58, 501–517. https://doi.org/10.1641/B580607
Rodríguez-Ortega, A., Equihua-Martínez, A., Cibrián-Tovar, J. y Estrada-Venegas, E. G. (2010). Fluctuación de Dendroctonus adjunctus Blandford (Curculioniade: Scolytinae) y sus depredadores atraídos por Frontalina+Alfa-Pineno, la Estación Experimental de Zoquiapan, Edo. De México. Boletín del Museo de Entomología de la Universidad del Valle, 11, 20–17.
Rojas-García, F. y Villers-Ruíz, L. (2008). Estimación de la biomasa forestal del Parque Nacional Malinche Tlaxcala-Puebla. Ciencia Forestal en México, 33, 59–86.
Salinas-Moreno, Y. G., Mendoza-Correa, M. A., Barrios-Cisneros, R., Macías-Sámano, J. y Zúñiga, G. (2004). Areography of the genus Dendroctonus (Coleoptera: Curculionidae) in Mexico. Journal of Biogeography, 31, 1163–1177. https://doi.org/10.1111/j.1365-2699.2004.01110.x
Salinas-Moreno, Y., Ager, A., Vargas, C. F., Hayes, J. L. y Zúñiga, G. (2010). Determining the vulnerability of Mexican pine forests to bark beetles of the genus Dendroctonus Erichson (Coleoptera: Curculionidae: Scolytinae). Forest Ecology Management, 260, 52–61. https://doi.org/10.1016/j.foreco.2010.03.029
Sánchez-Velásquez, L. R., Pineda-López, M. R., Galindo-González, J., Zúñiga-González, J. L. y Díaz-Fleischer, F. (2009). Opportunity for the study of critical successional processes for the restoration and conservation of mountain forest: the case of Mexican pine plantations. Interciencia, 34, 518-522.
SAS Institute Inc. (2016). SAS® University Edition: Installation Guide for OS X. Cary, NC: SAS Institute Inc.
Six, D. L. y Bracewell, R. (2015). Dendroctonus. En F. E. Vega y R. W. Hofstetter (Eds.), Bark beetles. Biology and Ecology of native and invasive species (pp. 305–350). Beltsville, MD: Academic Press.
Sosa-Díaz, L., Méndez, G., García, A. M. A., Cambrón, S. V. H., Villareal, Q. J. A., Ruiz, G. C. G. et al. (2018). Distribución potencial de barrenadores, defoliadores, descortezadores y muérdagos en bosques de coníferas de México. Revista Mexicana de Ciencias Forestales, 9,187–208. https://doi.org/10.29298/rmcf.v9i47.159
Soto, M. y Angulo, M. J. (1990). Estudio climático de la región del Cofre y Valle de Perote. Xalapa: Instituto de Ecología.
Stevens, R. E. y Flakes, H. W. Jr. (1974). A roundheaded pine beetle outbreak in New Mexico: associated stand conditions and impact. Research Note RM-259. Fort Collins, CO: U.S. Department of Agriculture, Forest Service, Rocky. Mountain Forest and Range Experiment Station.
Suárez-Hernández, H. J., Pineda-López, M. R., Sánchez-Velásquez, L. R., Noa-Carrazana, J. C. y Ruíz-Montiel, C. (2017). Altitudinal record of Dendroctonus approximatus Dietz (Coleoptera: Curculionidae) in Veracruz, Mexico. The Coleopterists Bulletin, 71, 652–654. https://doi.org/10.1649/0010-065X-71.4.652
Sullivan, B. T., Grady, A. M., Hofstetter, R. W., Pureswaran, D. S., Brownie. C., Cluck, D. et al. (2021). Evidence for semiochemical divergence between sibling bark beetle species: Dendroctonus brevicomis and Dendroctonus barberi. Journal of Chemical Ecology, 47, 10–27. https://doi.org/10.1007/s10886-020-01233-y
Vázquez-Ochoa, F., Reverchon, F., Sánchez-Velásquez, L. R., Ruíz-Montiel, C. y Pineda-López, M. R. (2020). Soil chemical properties and biological processes under pine trees with and without Dendroctonus bark beetle infestation. Journal of Sustainable Forestry, 40, 371–384. https://doi.org/10.1080/10549811.2020.1759103
Villa-Castillo, J. (1992). Atrayentes químicos en escarabajos descortezadores Dendroctonus mexicanus y D. adjuntus (Col: Scolytidae). Ciencia Forestal, 17, 103–121. http://cienciasforestales.inifap.gob.mx/index.php/forestales/article/view/1100/2438
Weed, A. S., Ayres, M. P. y Bentz, B. J. (2015). Population dynamics of bark beetles. En F. E. Vega y R. W. Hofstetter (Eds.), Bark beetles (pp. 157–176). Londres, Oxford, Boston Nueva York y San Diego: Academic Press. https://doi.org/10.1016/B978-0-12-417156-5.00004-6
Windmuller-Campione, M. A. (2018). Assessing the future susceptibility of mountain pine beetle (Dendroctonus ponderosae) in the Great Lakes Region using forest composition and structural attributes. Canadian Journal of Forest Research, 48, 451–459. https://doi.org/10.1139/cjfr-2017-0135
Wood, S. L. (1982). The bark ambrosia beetles of Northland Central America (Coleoptera: Scolytidae), a taxonomic monograph. Great Basin Naturalist Memories, 6, 1–1359.
Zahra, D., Novotny, V. y Fayle, T. M. (2021). Do reverse Janzen-Connell effects reduce species diversity? Trends in Ecology & Evolution, 36, 387–390. https://doi.org/10.1016/j.tree.2021.02.002
Zar, J. H. (1999). Biostatistical analysis. London: Ed. Prentice-Hall.
Zhang, L. W. y Sun, J. H. (2006). Electrophysiological and behavioral responses of Dendroctonus valens (Coleoptera: Curculionidae: Scolytinae) to candidate pheromone components identified in hindgut extracts. Environmental Entomology, 35, 1232–1237. https://doi.org/10.1093/ee/35.5.1232