Ecología térmica de dos especies de lagartijas del género Xenosaurus (Squamata: Xenosauridae) en México
Victoria E. Cardona-Botero a, *, Guillermo A. Woolrich-Piña b y Héctor Gadsden c
a Instituto de Ecología, A.C., Carretera antigua a Coatepec 351, El Haya, 91070 Xalapa, Veracruz, México
b Instituto Tecnológico Superior de Zacapoaxtla, Carretera Acuaco Zacapoaxtla Km. 8, Totoltepec, 73680 Zacapoaxtla, Puebla, México
c Instituto de Ecología, A.C., Av. Lázaro Cárdenas 253, 61600 Pátzcuaro, Michoacán, México
*Autor para correspondencia: victoriaecardonab@gmail.com (V.E. Cardona-Botero)
Resumen
La temperatura es uno de los factores abióticos más importantes que afectan a los ectotermos, por lo que el estudio de la ecología térmica se ha convertido en un aspecto relevante en el conocimiento acerca de la fisiología y ecología de estos organismos. En el presente trabajo se analizaron aspectos básicos de la ecología térmica de 2 especies del género Xenosaurus (X. grandis y X. fractus) y su relación con variables ambientales como la temperatura del aire y del sustrato, en la región centro-oriente de México. Para ello, se realizaron salidas de campo en época cálida seca y de lluvia. A cada organismo se le registró la temperatura corporal (Tc), temperatura del aire (Ta) y temperatura del sustrato (Ts). Se encontró que la Tc de las 2 especies estuvo relacionada con la Ta y Ts. También se observaron diferencias en la Tc de las 2 especies entre épocas. Además, se encontró una Tc mayor en las hembras preñadas comparadas con las no preñadas de X. fractus. Las 2 especies son termoconformes y presentan diferencias en su ecología térmica debido a la relación con el hábitat contrastante.
Palabras clave: Termoconforme; Termorregulación; Estado reproductivo; Lagartijas de escamas tuberculares; Puebla; Veracruz
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Thermal ecology of two species of lizards genus Xenosaurus (Squamata: Xenosauridae) in Mexico
Abstract
Temperature is an important abiotic factor that affect ectotherms, so the study of thermal ecology has become a relevant aspect in the knowledge about the physiology and ecology of these organisms. Basic aspects on the thermal ecology for 2 species of the genus Xenosaurus (X. grandis and X. fractus) and their relationship with environmental variables such as air and substrate temperature in the central-eastern region of Mexico were analyzed. Field trips were made in the dry-warm and rainy season. Body temperature (Tb), air temperature (Ta) and substrate temperature (Ts) were recorded for each organism. Both Tb was correlated to the Ta and Ts. Differences in Tb of the 2 species between seasons were observed. A higher Tb was found in pregnant females compared with non-pregnant females of X. fractus. Both species are thermoconformers and present differences in their thermal ecology related to the contrasting habitat.
Keywords: Thermoconformer; Thermoregulation; Reproductive stage; Knob-scaled lizard; Puebla; Veracruz
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
La temperatura es uno de los factores abióticos más importantes que afectan a las especies y quizá sea el más agudo de todos (Allee y Park, 1939; Angilletta et al., 2002; Huey et al., 2010; Hutchinson, 1976; Hutchinson y Maness, 1979; Sinervo et al., 2010) debido a que afecta todos los aspectos de su rendimiento fisiológico (Hutchison y Dupré, 1992). La temperatura puede influir en la distribución y ecología de los ectotermos, ya que ciertas especies durante su actividad regulan su temperatura dentro de un intervalo relativamente estrecho que corresponde al óptimo para su metabolismo, locomoción y otras funciones fisiológicas (Angilletta et al., 2002; Bowker y Johnson, 1980). Los ectotermos obtienen el control de la temperatura corporal combinando tanto el comportamiento como la fisiología (Bowker, 1984; Hertz et al., 1982; Huey, 1982). Por ello, los impactos de la variabilidad de temperatura ambiental sobre los individuos, dependen de la aclimatación, comportamiento termorregulador, selección del hábitat, cambio en los patrones de actividad diaria, cambios en reproducción y fenología (Deutsch et al., 2008; Huey y Slatkin, 1976; Huey et al., 2009; Kearney et al., 2009), y de su capacidad de dispersión para migrar debido a los cambios de su nicho térmico (Lara-Reséndiz et al., 2015). Por ésto, el estudio de la ecología térmica se ha convertido en un aspecto notable en el conocimiento sobre la fisiología y ecología de los ectotermos (Angilletta, 2009; Avery, 1982; Bartholomew, 1982; Sinervo et al., 2010).
Las estrategias de termorregulación en los reptiles van en un continuo desde el termoconformismo hasta la termorregulación activa (Huey y Slatkin, 1976). Algunas especies de lagartijas son predominantemente termoconformes, es decir, que mantienen temperaturas corporales similares a las del ambiente (Hertz et al., 1993; Huey y Slatkin, 1976), y otras son termorreguladoras precisas, las cuales pueden mantener sus temperaturas corporales por encima de la temperatura ambiental y cercanas a su temperatura preferida (Huey 1982). Incluso dentro de los géneros de lagartijas Anolis y Liolaemus, se presenta variación intragenérica en el comportamiento de termorregulación, con algunas especies termorreguladoras y otras termoconformes (Piantoni et al., 2016). De esta forma, se ha observado un patrón de distribución de la termorregulación, en el que cerca del ecuador y en altitudes bajas aumenta el termoconformismo, que lleva a una capacidad limitada de adaptación a los cambios climáticos (Huey et al., 2009, 2012).
Los reptiles son uno de los grupos que ha sido afectado por el calentamiento global con cambios de distribución y desaparición de poblaciones locales (Barrows, 2011; Sinervo et al., 2010). Muchos reptiles tienen límites de tolerancia al calor más bajos que las temperaturas ambientales máximas en el sol y por lo tanto deben usar la termorregulación conductual para evitar el sobrecalentamiento en las horas o épocas más cálidas (Helmuth et al., 2005; Sunday et al., 2014). La mayoría de estos organismos dependerán cada vez más de la termorregulación conductual y disponibilidad de hábitats frescos para evitar el estrés por calor (Sunday et al., 2014). Aunque los refugios pueden favorecer la aclimatación en corto tiempo, comprometen el tiempo de actividad y la condición a largo tiempo de las especies (Piantoni et al., 2016). Los impactos del cambio climático, dependerán no solo del grado de calentamiento, sino también del número de especies en riesgo, su sensibilidad fisiológica y sus opciones para compensar por medio de comportamiento (Helmuth et al., 2005; Huey et al., 2003; Kearney et al., 2009). Conocer la ecología térmica de las especies y sus estrategias de termorregulación es de gran importancia para predecir las respuestas de los organismos al cambio climático (Lara et al., 2015; Williams et al., 2008).
En este proyecto, se estudiaron 2 especies de Xenosaurus, que es un género de lagartijas que habita en grietas u oquedades, principalmente de rocas sedimentarias, distribuido en montañas del este y sur de México en elevaciones de 200 a 2,600 m y presenta una estrategia de termorregulación termoconforme (Ballinger et al., 2000). Estas lagartijas tienen distribución fragmentada o insular, microendemismo, temperatura corporal que tiende a ser significativamente baja (con respecto a otras lagartijas), maduración sexual tardía, tamaño de camada pequeño, baja vagilidad (capacidad reducida para dispersarse) (Ballinger et al., 2000; Lemos-Espinal et al., 2012; Woolrich-Piña y Smith, 2012), áreas de actividad puntuales y son vulnerables ante la deforestación y cambio de uso de suelo, por lo que algunas de las especies y poblaciones han sido clasificadas por el gobierno mexicano como en peligro de extinción o amenazadas (Zúñiga-Vega et al., 2007).
En los últimos 20 años, el conocimiento sobre Xenosaurus en México se ha incrementado, especialmente sobre su ecología (Lemos-Espinal et al., 2003b, 2004; Woolrich-Piña et al., 2012), demografía (Lemos-Espinal et al., 2003a; Rojas-González, Jones et al., 2008; Zamora-Ábrego et al., 2010), historia natural (Lemos-Espinal y Smith, 2005), crecimiento (Zúñiga-Vega et al., 2005), reproducción (Rojas-González, Zúñiga-Vega et al., 2008; Zamora-Ábrego et al., 2007; Zúñiga-Vega, 2011), dieta, dimorfismo sexual (García-Rico et al., 2015), ecología térmica (Gadsden y Woolrich-Piña, 2017; García-Rico et al., 2015) y evolución (Bhullar, 2010, 2011; Canseco-Márquez, 2005; Nieto-Montes de Oca et al., 2017, 2018). Sin embargo, las poblaciones tienen una distribución fragmentada y se requiere con premura más información de la ecofisiología de las especies de este género, que permita el mejor entendimiento de las estrategias de termorregulación que presentan distintas especies en diferentes hábitats y épocas del año, de manera que este conocimiento oriente los planes sobre la conservación de poblaciones potencialmente vulnerables (Ballinger et al., 2000). Por lo anterior, el objetivo del presente trabajo fue analizar la temperatura corporal y su relación con variables ambientales, como la temperatura del aire y del sustrato de 2 especies de lagartijas vivíparas del género Xenosaurus (Xenosaurus grandis y Xenosaurus fractus) en la región oriente de México, teniendo en cuenta que se encuentran en diferentes hábitats y elevaciones. Además, para cada especie se evaluó si existe diferencia en las temperaturas corporales entre las épocas cálida seca y de lluvia, entre sexos y estados reproductivos.
Materiales y métodos
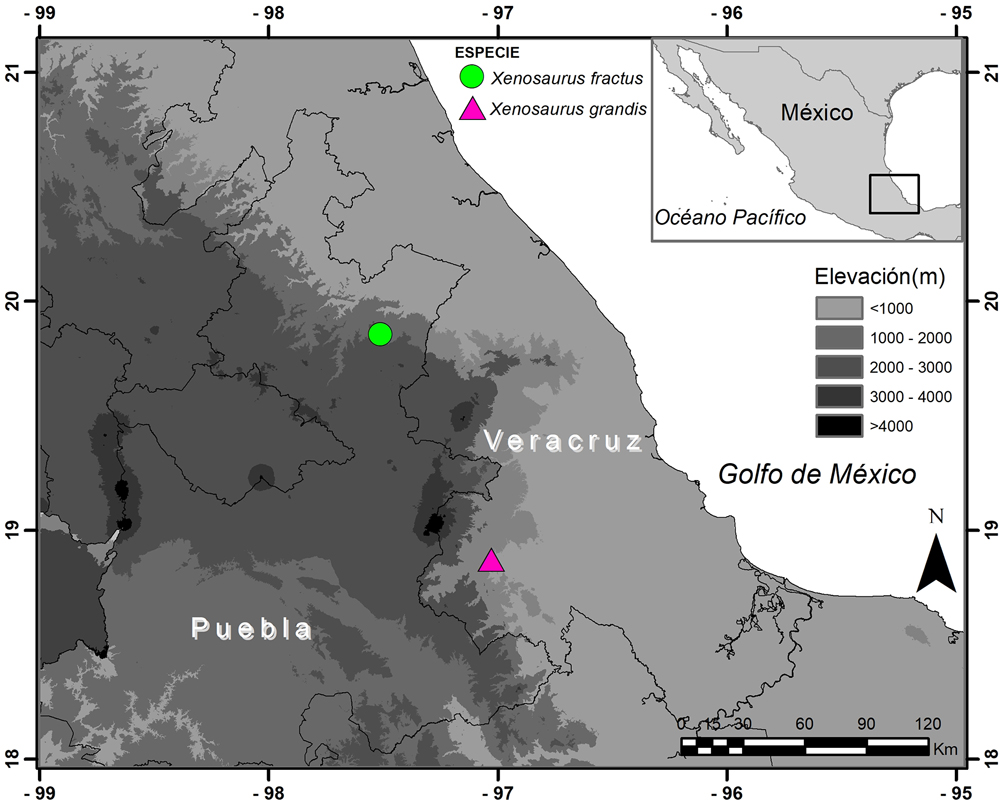
Xenosaurus grandis es una lagartija mediana (120 mm, longitud hocico-cloaca máxima (LHC)), distribuida en las zonas altas de Veracruz, Puebla y en Oaxaca al oeste del istmo de Tehuantepec (Nieto-Montes de Oca et al., 2017). Por otra parte, X. fractus (94.2-122.9 mm LHC) se distribuye en los municipios de Huehuetla y Xochitlán en las laderas de la sierra Madre Oriental, en la sierra Norte de Puebla, y se sugiere que su distribución se extiende más al sur hasta el municipio de Tlatlauquitepec, Puebla (Nieto-Montes de Oca et al., 2018). Las áreas de estudio para las especies fueron, para X. grandis, la localidad de Cuautlapan, en el municipio de Ixtaczoquitlan, Veracruz entre 1,050 y 1,150 m de elevación en bosque mesófilo secundario con relictos de cafetales; y para X. fractus fue en la localidad del Cerro Cabezón en Tlatlauquitepec, Puebla, entre los 1,900 y 2,170 m de elevación en un bosque de pino-encino. La figura 1 muestra la ubicación de los 2 sitios de muestreo.
De abril de 2016 a septiembre de 2017 se realizaron 4 salidas de campo, 2 en época cálida seca (marzo-mayo) y 2 en lluvias (junio-octubre). Se capturaron a mano un total de 54 individuos de X. grandis y 54 de X. fractus, todas las lagartijas fueron liberadas después del registro de datos. A cada organismo se le registró la temperatura corporal (Tc) durante los primeros 20 segundos después de su captura, con un termómetro digital Fluke modelo 51-II con un sensor tipo K (± 0.1 °C) insertado 1 cm dentro de la cloaca. También se midió la temperatura del aire (Ta) a la sombra (1 cm arriba del sustrato donde el individuo fue observado por primera vez), la temperatura del sustrato (Ts) a la sombra (donde el individuo fue visto por primera vez), hora, LHC (mm), peso (g), sexo (macho o hembra adultos), estado reproductivo (hembra no preñada o hembra preñada), condición climática (nublado o soleado) y coordenadas geográficas con un sistema de posicionamiento global GPSmap 60CSx GARMIN.
Para analizar la relación de la Tc con la LHC y la masa corporal, así como la relación entre la Ts y Ta con la Tc se usaron regresiones lineales simples. Para comprobar las tendencias termorreguladoras o termoconformistas, se aplicó el criterio de Huey y Slatkin (1976), en el que una especie es termorreguladora cuando el valor de la pendiente de la regresión lineal de la Tc sobre la temperatura ambiental (Ta o Ts) es = 0 o cercano a éste; por otro lado, cuando una especie es termoconformista, el valor de la pendiente es 1 o cercano a este valor. Además, si la correlación de Tc vs. Ta es mayor en comparación con la correlación de Tc vs. Ts, entonces se asume que hay una tendencia del organismo a ser heliotermo, es decir, que captan el calor ambiental mediante la radiación solar directa. Si ocurre lo contrario, la tendencia es una estrategia de tigmotermia, captan el calor ambiental por contacto con el sustrato (conducción).
Las diferencias significativas de Tc entre los factores se probaron con un análisis de covarianza (Ancova). Se hicieron 3 modelos lineales: el primero incluyó a la especie como factor de efecto fijo y la Ta como covariable continua, para analizar diferencia entre especies; los otros 2 modelos incluyeron la época, sexo, estado reproductivo y condiciones climáticas como factores de efectos fijos y la Ta como covariable continua. Los resultados muestran los promedios ± error estándar (EE), tamaño de muestra (n) y el intervalo entre el valor mínimo y máximo. Los supuestos de normalidad y homogeneidad de varianza se probaron gráficamente con los residuales de los modelos. Todos los análisis fueron realizados usando el software R (R Development Core Team, 2017).
Resultados
El promedio de Tc de X. grandis en general fue de 21.4 ± 0.19 °C (intervalo 19.2-26 °C, n = 52), en lluvias fue de 21.0 ± 0.11°C (intervalo 20.1-22.6 °C, n = 29) y en época de seca fue de 21.8 ± 0.42 °C (intervalo 19.2-26.0 °C, n = 23). Por otro lado, la Tc promedio de X. fractus en general fue de 19.12 ± 0.53 °C (intervalo 11.70-30 °C, n = 52), en época de lluvia fue de 16.9 ± 0.50 °C (intervalo 11.7-23 °C, n = 30) y en época de seca fue de 22.2 ± 0.62 °C (intervalo 19-30 °C, n = 22) (fig. 2).
La Tc de X. grandis fue significativamente mayor que la Tc de X. fractus (F1,100 = 79.87, p < 0.0001). Además, se encontraron diferencias significativas de las Tc entre las 2 épocas, para X. grandis (F1,44 = 8.93, p = 0.005) y X. fractus (F1,46 = 122.14, p < 0.0001). En X. grandis no se encontraron diferencias significativas de la Tc entre sexos (F1,41 = 0.94, p = 0.34) ni en la condición climática (F1,44 = 2.09, p = 0.15). En X. fractus no se encontraron diferencias significativas de la Tc entre sexos (F1,36 = 0.58, p = 0.45), pero si entre las hembras no preñadas y las hembras preñadas (F1,21 = 73.03, p < 0.0001) y en condición climática (F1,46 = 63.46, p < 0.0001). La tabla 1 muestra los promedios de Tc de los sexos y estados reproductivos de las 2 especies.
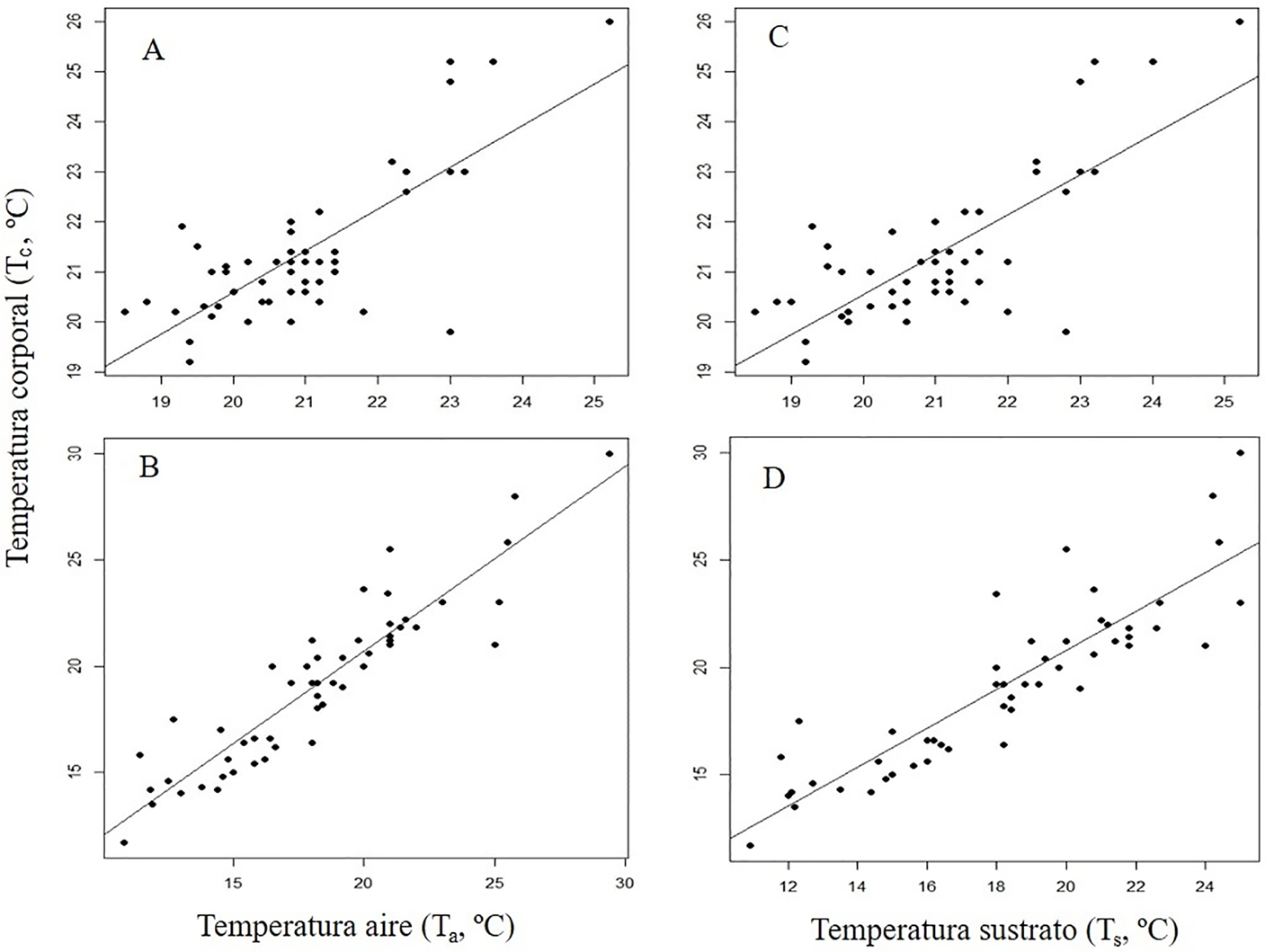
No se encontró una relación de Tc con LHC en ninguna de las especies (X. grandis: Tc = 21.77 – 0.004LHC, R2 = 0.0012, p = 0.81; X. fractus: Tc = 12.53 + 0.07LHC, R2 = 0.05, p = 0.11) o peso (X. grandis: Tc = 21.41 – 0.002peso, R2 = 0.0003, p = 0.91; X. fractus: Tc = 19.22 – 0.0005peso, R2 = 0.0013, p = 0.99). La Tc de X. grandis presentó una relación positiva y significativa con la Ta (Tc = 3.88 + 0.83Ta, R2 = 0.58, p < 0.0001, fig. 3A) y con la Ts (Tc = 4.52 + 0.80Ts, R2 = 0.58, p < 0.0001, fig.3C) del microhábitat ocupado por las lagartijas. De igual manera, se encontró una relación positiva y significativa de la Tc de X. fractus con la Ta (Tc = 3.33 + 0.87Ta, R2 = 0.84, p < 0.0001, fig.3B) y con la Ts (Tc = 2.63 + 0.91Ts, R2 = 0.78, p < 0.0001, fig.3D).
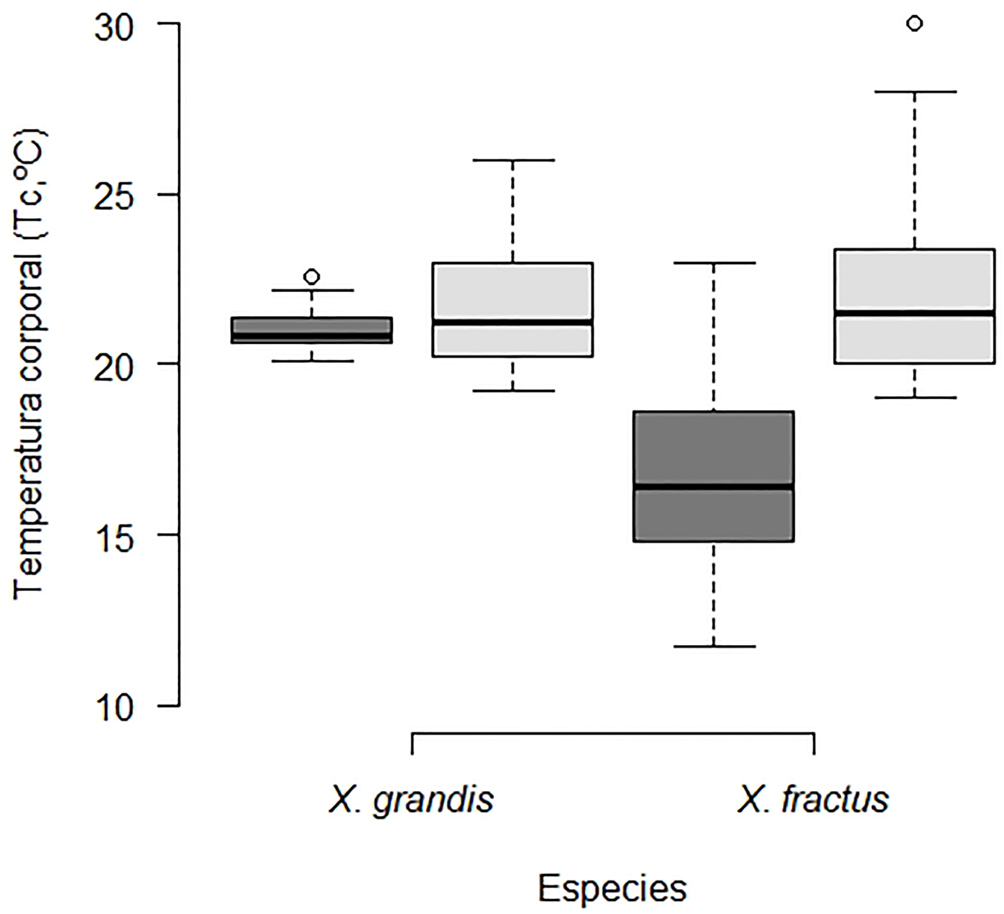
Tabla 1
Promedios de Tc de los sexos y estados reproductivos de X. grandis y X. fractus. Se presentan los promedios ± error estándar.
|
Especie |
X. grandis |
X. fractus |
||||||
|
Temperatura (°C) |
Tc |
Intervalo Tc |
Ta |
Ts |
Tc |
Intervalo Tc |
Ta |
Ts |
|
Macho |
21.1 ± 0.29 |
(19.2-25.2) |
20.9 ± 0.24 |
21.1 ± 0.23 |
19.2 ± 0.78 |
(14.2-23.6) |
17.9 ± 0.87 |
17.9 ± 0.86 |
|
Hembra no preñada |
21.5 ± 0.34 |
(20-26) |
20.9 ± 0.31 |
21.0 ± 0.34 |
18.8 ± 0.8 |
(11.7-28) |
18.3 ± 0.89 |
18.5 ± 0.83 |
|
Hembra preñada |
– |
– |
– |
– |
27.1 ± 1.45 |
(25.5-30) |
25.3 ± 2.43 |
23.1 ± 1.58 |
Discusión
De acuerdo con lo encontrado en este trabajo, Xenosaurus grandis y X. fractus se comportan como especies termoconformes, con una marcada relación en la Tc de las 2 especies con las temperaturas ambientales (Ta y Ts), como ha sido reportado para este género (Ballinger et al., 2000; Lemos-Espinal et al., 2012; Woolrich-Piña y Smith, 2012). La Tc promedio de X. grandis en las 2 épocas fue similar a la Tc reportada para X. platyceps (Lemos-Espinal et al., 2004) y X. rectocollaris (Alvarado-Hernández, 2017; Woolrich-Piña et al., 2012). El promedio de Tc de X. fractus en época de lluvia (16.9 °C) es uno de los más bajos que se han reportado para el género, junto con X. tzacualtipantecus (García-Rico et al., 2015) y X. phalaroanthereon (Lemos-Espinal y Smith, 2005) (tabla 2).
Las 2 especies ganan calor tanto por tigmotermia como por heliotermia, ya que tienen una relación significativa de la Tc con la Ta y Ts (Huey y Slatkin, 1976). Esto se puede deber a que la Ta y Ts son muy similares en el microhábitat de estos reptiles, debido a que las condiciones de temperatura en la grieta se mantienen estables por las características físicas, como el ancho (entre 1-2cm) (Lemos-Espinal et al., 2004). Además, la Tc de Xenosaurus parece estar limitada por el sol que llega a la grieta y por la posición del cuerpo de la lagartija en la grieta (completamente adentro, cabeza afuera, extremidades anteriores afuera) (Lemos-Espinal et al., 1997, 2003b).
Tabla 2
Promedios e intervalos de temperatura corporal(Tc) de 4 especies de Xenosaurus.
|
Especie |
Temperatura corporal Tc (°C) |
Referencia |
|
X. platyceps |
20.6 (16.2-26.4) |
Lemos-Espinal et al. (2004) |
|
X. rectocollaris |
23.2 (11.8-33.6). |
Woolrich-Piña et al. (2012) |
|
X. tzacualtipantecus |
18.1 (14.6-26.8) |
García-Rico et al. (2015) |
|
X. phalaroanthereon |
20.3 (14.6-32.8) |
Lemos-Espinal y Smith (2005) |
La Tc de X. grandis fue mayor que la de X. fractus en las 2 épocas, lo que se relaciona con las temperaturas microclimáticas (Ta y Ts) más baja en el hábitat de X. fractus. Sin embargo, X. fractus tiene un intervalo mayor de Tc de actividad que X. grandis que es más estrecho y estable. Esta diferencia se puede explicar por las condiciones del hábitat de cada especie debido a que la cobertura vegetal en las grietas del área de estudio de X. fractus es menor que el de X. grandis, por lo que el microclima en las grietas es más inestable y cambiante. Lo anterior se evidencia también por las diferencias significativas presentadas en las Tc de X. fractus según la condición climática (nublado, soleado). Se ha registrado que la altitud, la composición y estructura de la vegetación son determinantes en la calidad térmica del hábitat de las lagartijas y aunque la heterogeneidad térmica podría beneficiar la termorregulación de las lagartijas, en el caso de X. fractus, se debe tener en cuenta que esta variación de la temperatura también puede ser perjudicial, pues la Tc está influenciada en gran medida por la cobertura vegetal y estas lagartijas son menos comunes en grietas donde el bosque se ha perdido (Ballinger et al., 1995; Huey y Slatkin, 1976; Lara-Reséndiz et al., 2014; Lemos et al., 2003b).
Las diferencias significativas de la Tc entre épocas se pueden explicar porque los cambios estacionales en la temperatura ambiente influyen directamente en la temperatura corporal (Huey y Slatkin, 1976) y pueden influir en la eficiencia de la termorregulación (Piantoni et al., 2016). Además, debido al comportamiento termoconforme, las 2 especies cambian su Tc conforme cambia la temperatura del ambiente.
No se encontraron diferencias significativas entre las Tc de machos y hembras en ninguna de las especies. Solo se encontraron hembras preñadas de X. fractus, en donde se registraron diferencias significativas entre las Tc de hembras preñadas y no preñadas, presentando mayor Tc las hembras preñadas, como ha sido reportado para X. rectocollaris (Woolrich-Piña et al., 2012). Estos resultados sugieren que las hembras preñadas buscan microhábitats más cálidos y estables. En otras especies de lagartijas vivíparas, también ha sido reportado que las hembras preñadas mantienen Tc diferente a las hembras no preñadas, posiblemente para mejorar el ambiente de incubación, aumentar la sobrevivencia de su descendencia y evitar temperaturas críticas que conduzcan a anormalidades en el desarrollo de la progenie (Beuchat, 1986; Ji et al., 2007; Mathies y Andrews, 1997; Rock y Cree, 2003; Shine, 2006; Smith y Ballinger, 1994; Wapstra, 2000; Woolrich-Piña et al., 2012).
La termoconformidad mostrada por estas especies puede estar relacionada con su hábito de vivir en grietas, pues el entorno térmico es homogéneo (García-Rico et al., 2015) y la Tc puede estar limitada por los rayos solares que llegan a la grieta (Lemos-Espinal et al., 1997, Woolrich-Piña et al., 2012). Esta característica de ser termoconformes y vivíparos, sugiere que pueden ser susceptibles al incremento de la temperatura por el cambio climático (Berriozábal-Islas et al., 2018; Huey et al., 2009; Piantoni et al., 2016; Sinervo et al., 2010). Debido a que altas Tc pueden comprometer el desarrollo del embrión causando muerte y deformidad, las hembras preñadas deben garantizar que los embriones estén expuestos a un intervalo adecuado de temperaturas durante el desarrollo, en ambientes térmicos ideales o manteniendo conductualmente la temperatura corporal, que depende de la disponibilidad de refugios (Andrews et al., 1997; Beuchat, 1988). Es importante considerar que estos organismos muestran un intervalo amplio de Tc, por lo que posiblemente están respondiendo al cambio de temperatura, siempre y cuando se conserve su hábitat con la cobertura vegetal adecuada. En este sentido, Berriozábal-Islas et al. (2018), en un análisis del nicho térmico para algunas especies del género Xenosaurus, en el presente y en escenarios futuros de cambio climático, sugieren que ocurrirá una disminución sustancial del hábitat adecuado para todas las especies hacia el año 2070.
En conclusión, las 2 especies son termoconformes y presentan diferencias en su ecología térmica que están relacionadas con el hábitat contrastante. La Tc fue diferente entre especies, épocas y estados reproductivos. Además, se encontró una Tc mayor en las hembras preñadas comparadas con las no preñadas de X. fractus. El intervalo de Tc presentado por las 2 especies y la variación de Tc entre los hábitats y épocas, es una evidencia de cómo responden las especies a los cambios en la temperatura ambiental y sugiere que estos organismos soportan un amplio intervalo de temperaturas, lo que podría ser positivo desde el punto de vista de la conservación de las especies, ante el cambio climático. Sin embargo, es necesario realizar más estudios fisiológicos y proyecciones de modelos de distribución de especies en los que se incluyan las temperaturas preferidas y críticas, para entender mejor cómo estos organismos pueden responder al calentamiento global. También es indispensable considerar el cambio del uso del suelo como una de las mayores amenazas para este grupo debido a que son organismos térmicamente especializados.
Agradecimientos
Al Conacyt por la beca otorgada a V. Cardona-Botero, por el proyecto 270547, TecNM proyecto 5293.19-P, y a los proyectos internos del ITSZacapoaxtla PI-LB concedido a GAWP. Al Instituto de Ecología, A.C. y al Instituto Tecnológico Superior de Zacapoaxtla por su apoyo para la realización del proyecto. A Eduardo Pineda, Gamaliel Castañeda y Roger Guevara por sus aportes a este trabajo. A Rafael Lara y a los dos revisores anónimos por la revisión del artículo. Finalmente, al grupo de trabajo del laboratorio de herpetología y ecofisiología del Instituto Tecnológico Superior de Zacapoaxtla, en especial a Adán Alvarado, Jonathan Olvera y Sonia Márquez, y a la familia Cerón por su apoyo en el campo.
Referencias
Allee, W. C. y Park, T. (1939). Concerning ecological principles. Science, 89, 166–169. https://doi.org/10.1126/science.89.2304.166
Alvarado-Hernández, A. (2017). Estudio comparativo sobre la ecología y eficiencia térmica de Xenosaurus. cf. tzacualtipantecus y Xenosaurus rectocollaris (Squamata: Xenosauridae) en el estado de Puebla, México (Tesis). Instituto Tecnológico Superior de Zacapoaxtla. Puebla, México.
Andrews R. M., Méndez-de la Cruz, F. R. y Villagrán-Santa Cruz, M. (1997). Body temperatures of female Sceloporus grammicus: Thermal stress or impaired mobility?. Copeia, 1997, 108–115. https://doi.org/10.2307/1447845
Angilletta, M. J. (2009): Thermal adaptation: a theoretical and empirical synthesis. Oxford University Press, USA.
Angilletta, M. J., Jr., Niewiarowski, P. H. y Navas, C. A. (2002). The evolution of thermal physiology in ectotherms. Journal of Thermal Biology, 27, 249–268. https://doi.org/10.1016/s0306-4565(01)00094-8
Avery, R. A. (1982). Field studies of body temperatures and thermoregulation. En C. Gans y F. H. Pough (Eds). Biology of the Reptilia (pp. 93–166). New York: Academic press.
Ballinger, R. E., Lemos-Espinal, J. A., Sanoja-Sarabia, S. y Coady, N. A. (1995). Ecological observations of the lizard, Xenosaurus grandis in Cuautlapan, Veracruz, Mexico. Biotropica, 27, 128–132. https://doi.org/10.2307/2388910
Ballinger, R. E., Smith, G.R. y Lemos-Espinal, J. A. (2000). Xenosaurus (Gray). Catalogue of American Amphibians and Reptiles, 712, 1–3.
Barrows, C. W. (2011). Sensitivity to climate change for two reptiles at the Mojave-Sonoran Desert interface. Journal of Arid Environments, 75, 629–635. https://doi.org/10.1016/j.jaridenv.2011.01.018
Bartholomew, G. A. (1982). Physiological control of temperature. En C. Gans y F. H. Pough (Eds.), Biology of the Reptilia (pp. 167–211). New York: Academic press.
Berriozábal-Islas, C., Mota-Rodrígues, J. F., Ramírez-Bautista, A., Becerra-López, J. L. y Nieto-Montes de Oca, A. (2018). Effect of climate change in lizards of the genus Xenosaurus (Xenosauridae) based on projected changes in climatic suitability and climatic niche conservatism. Ecology and Evolution, 2018, 1–12. https://doi.org/10.1002/ece3.4200
Beuchat, C. A. (1986). Reproductive influences on the thermoregulatory behavior of a live-bearing lizard. Copeia, 1986, 971–979. https://doi.org/10.2307/1445294
Beuchat, C. A. (1988). Temperature effects during gestation in a viviparous lizard. Journal of Thermal Biology, 13, 135–142. https://doi.org/10.1016/0306-4565(88)90024-1
Bhullar, B. A. S. (2010). Cranial osteology of Exostinus serratus (Squamata: Anguimorpha), fossil sister taxon to the enigmatic clade Xenosaurus. Zoological Journal of the Linnean Society, 159, 921–953. https://doi.org/10.1111/j.1096-3642.2009.00573.x
Bhullar, B. A. S. (2011). The power and utility of morphological characters in systematics: a fully resolved phylogeny of Xenosaurus and its fossil relatives (Squamata: Anguimorpha). Bulletin of the Museum of Comparative Zoology, 160, 65–181. https://doi.org/10.3099/0027-4100-160.3.65
Bowker, R. G. (1984). Precision of thermoregulation of some African lizards. Physiological Zoology, 57, 401–412. https://doi.org/10.1086/physzool.57.4.30163342
Bowker, R. G. y Johnson, O. W. (1980). Thermoregulatory precision in three species of whiptail lizards (Lacertilia: Teiidae). Physiological Zoology, 53, 176–185. https://doi.org/10.1086/physzool.53.2.30152581
Canseco-Márquez, L. (2005). Filogenia de las lagartijas del género Xenosaurus Peters (Sauria: Xenosauridae) basada en morfología externa (Tesis de maestría). Facultad de Ciencias, Universidad Nacional Autónoma de México. México D.F.
Deutsch, C. A., Tewksbur, J. J., Huey, R.B., Sheldon, K. S., Ghalambor, C. K., Haak, D. C. y Martin, P. R. (2008). Impacts of climate warming on terrestrial ectotherms across latitude. Proceedings of the National Academy of Sciences, 105, 6668–6672. https://doi.org/10.1073/pnas.0709472105
Gadsden, H. y Woolrich-Piña, G. (2017). Xenosaurus (Knob-scaled lizards). Preferred body temperature. Herpetological Review, 48, 792–793.
García-Rico, J., Díaz de la Vega-Pérez, A. H., Smith, G. R., Lemos-Espinal, J. A. y Woolrich-Piña, G. A. (2015). Thermal ecology, sexual dimorphism, and diet of Xenosaurus tzacualtipantecus from Hidalgo, Mexico. Western North American Naturalist, 75, 209–217. https://doi.org/10.3398/064.075.0209
Helmuth, B., Kingsolver, J. G. y Carrington, E. (2005). Biophysics, physiological ecology, and climate change: does mechanism matter? Annual Review of Physiology, 67, 177–201. https://doi.org/10.1146/annurev.physiol.67.040403.105027
Hertz, P. E., Huey, R. B. y Nevo, E. (1982). Fight versus flight-body-temperature influences defensive responses of lizards. Animal Behaviour, 30, 676–679. https://doi.org/10.1016/s0003-3472(82)80137-1
Hertz, P. E., Huey, R. B. y Stevenson, R. D. (1993). Evaluating temperature regulation by field-active ectotherms: the fallacy of the inappropiate question. The American Naturalist, 142, 796–818. https://doi.org/10.1086/285573
Huey, R. B. (1982). Temperature, physiology, and ecology of reptiles. En C. Gans y F. H. Pough (Eds.), Biology of the Reptilia (pp. 25–91). New York: Academic press.
Huey, R. B., Deutsch, C. A., Tewksbury, J. J., Vitt, L. J., Hertz, P. E., Perez, H. J. A. et al. (2009). Why tropical forest lizards are vulnerable to climate warming? Proceedings of the Royal Society of London B: Biological Sciences, 276, 1939–1948. https://doi.org/10.1098/rspb.2008.1957
Huey, R. B., Hertz, P. E. y Sinervo, B. (2003). Behavioral drive versus behavioral inertia in evolution: a null model approach. The American Naturalist, 161, 357–366. https://doi.org/10.1086/346135
Huey, R. B., Kearney, M. R., Krockenberger, A., Holtum, J. A. M, Jess, M., Williams, S. E. et al. (2012). Predicting organismal vulnerability to climate warming: roles of behaviour, physiology and adaptation. Philosophical Transactions of the Royal Society B: Biological Sciences, 367, 1665–1679. https://doi.org/10.1098/rstb.2012.0005
Huey, R. B., Losos, J. B. y Moritz, C. (2010). Are lizards toast? Science, 328, 832–833. https://doi.org/10.1126/science.1190374
Huey, R. B. y Slatkin, M. (1976). Costs and benefits of lizard thermoregulation. The Quarterly Review of Biology, 51, 363–384. https://doi.org/10.1086/409470
Hutchinson, V. H. (1976). Factors influencing thermal tolerance of individual organisms. En G. W. Esch y R. W. McFarlane (Eds.), Thermal ecology (pp. 10–26). Georgia: U.S. National Technical Information Service.
Hutchinson, V. H. y Dupré, R. K. (1992). Thermoregulation. En M. E. Feder y W. W. Burggren. Environmental physiology of the amphibians (pp. 206–249). Chicago: University of Chicago Press.
Hutchinson, V. H. y Maness, J. D. (1979). The role of behavior in temperature acclimation and tolerance in ecthoterms. American Zoologist, 19, 367–384.
Ji, X., Lin, C. X., Lin, L. H., Qiu, Q. B. y Du, Y. (2007). Evolution of viviparity in warm-climate lizards: an experimental test of the maternal manipulation hypothesis. Journal of Evolutionary Biology, 20, 1037–1045. https://doi.org/10.1111/j.1420-9101.2006.01296.x
Kearney, M., Shine, R. y Porter, W. P. (2009). The potential for behavioral thermoregulation to buffer «cold-blooded» animals against climate warming. Proceedings of the National Academy of Sciences, 106, 3835–3840. https://doi.org/10.1073/pnas.0808913106
Lara-Reséndiz, R. A., Gadsden, H., Rosen, P. C., Sinervo, B. y Méndez-De La Cruz, F. (2015). Thermoregulation of two sympatric species of horned lizards in the Chihuahuan Desert and their local extinction risk. Journal of Thermal Biology, 48, 1–10. https://doi.org/10.1016/j.jtherbio.2014.11.010
Lara-Reséndiz, R. A., Larraín-Barrios, B. C., Díaz de la Vega-Pérez, A. H. y Méndez-de la Cruz, F. R. (2014). Calidad térmica a través de un gradiente altitudinal para una comunidad de lagartijas en la sierra del Ajusco y el Pedregal de San Ángel, México. Revista Mexicana de Biodiversidad, 85, 885–897. https://doi.org/10.7550/rmb.42249
Lemos-Espinal, J. A. y Smith, G. R. (2005). Natural history of Xenosaurus phalaroanthereon (Squamata: Xenosauridae), a knob-scaled lizard from Oaxaca, Mexico. Phyllomedusa, 4, 133–137. https://doi.org/10.11606/issn.2316-9079.v4i2p133-137
Lemos-Espinal, J. A., Smith G. R. y Ballinger, R. E. (1997). Natural history of Xenosaurus platyceps, a crevice-dwelling lizard from Tamaulipas, México. Herpetological Natural History, 5, 181–186
Lemos-Espinal, J. A., Smith, G. R. y Ballinger, R. E. (2003a). Variation in growth and demography of a knobscaled lizard (Xenosaurus newmanorum: Xenosauridae) from a seasonal tropical environment in Mexico. Biotropica, 35, 240–249. https://doi.org/10.1646/02090
Lemos-Espinal, J. A., Smith, G. R. y Ballinger, R. E. (2003b). Ecology of Xenosaurus grandis agrenon, a knob-scaled lizard from Oaxaca, México. Journal of Herpetology, 37, 192–196. https://doi.org/10.1670/0022-1511(2003)037[0192:eoxgaa]2.0.co;2
Lemos-Espinal, J. A., Smith, G. R. y Ballinger, R. E. (2004). Aspects of the ecology of a distinct population of Xenosaurus platyceps from Querétaro, México. Amphibia-Reptilia, 25, 204–210. https://doi.org/10.1163/1568538041231166
Lemos-Espinal, J. A., Smith, G. R. y Woolrich-Piña, G. A. (2012). The family Xenosauridae in Mexico. Rodeo, New Mexico: ECO Herpetological Publishing and Distribution.
Mathies, T. y Andrews, R. M. (1997). Influence of pregnancy on the thermal biology of the lizard, Sceloporus jarrovi: why do pregnant females exhibit low body temperatures? Functional Ecology, 11, 498–507. https://doi.org/10.1046/j.1365-2435.1997.00119.x
Nieto-Montes de Oca, A., Barley, A. J., Meza-Lázaro, R. N. y García-Vázquez, U. O. (2017). Phylogenomics and species delimitation in the knob-scaled lizards of the genus Xenosaurus (Squamata: Xenosauridae) using ddRADseq data reveal a substantial underestimation of diversity. Molecular Phylogenetics and Evolution, 106, 241–253. https://doi.org/10.1016/j.ympev.2016.11.002
Nieto-Montes de Oca, A., Sánchez-Vega, H. y Durán-Fuentes, I. (2018). A new species of knob-scaled lizard (Xenosauridae, Xenosaurus) from the Sierra Madre Oriental of Puebla, Mexico. Zookeys, 737, 141–160. https://doi.org/10.3897/zookeys.737.15095
Piantoni, C., Navas, C. A. e Ibargüengoytía, N. R. (2016). Vulnerability to climate warming of four genera of New World iguanians based on their thermal ecology. Animal Conservation, 19, 391–400. https://doi.org/10.1111/acv.12255
R Core Team. (2017). R: a language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria. Disponible en https://cran.r-project.org/bin/windows/base
Rock, J. y Cree, A. (2003). Intraspecific variation in the effect of temperature on pregnancy in the viviparous gecko Hoplodactylus maculatus. Herpetologica, 59, 8–22. https://doi.org/10.1655/0018-0831(2003)059[0008:iviteo]2.0.co;2
Rojas-González, R. I., Jones, C. P., Zúñiga-Vega, J. J. y Lemos-Espinal, J. A. (2008). Demography of Xenosaurus platyceps (Squatnata: Xenosauridae): a comparison between tropical and temperate populations. Amphibia-Reptilia, 29, 245–256. https://doi.org/10.1163/156853808784124992
Rojas-González, R. I., Zúñiga-Vega, J. J. y Lemos-Espinal, J. A. (2008). Reproductive variation of the lizard Xenosaurus platyceps: comparing two populations of contrasting environments. Journal of Herpetology, 42, 332–336. https://doi.org/10.1670/07-258.1
Shine, R. (2006). Is increased maternal basking an adapatation or a pre-adaptation to viviparity in lizards? Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 305, 524–535. https://doi.org/10.1002/jez.a.291
Sinervo, B., Méndez-de la Cruz, F., Miles, D. B., Heulin, B., Bastiaans, E., Villagrán-Santa Cruz, M. et al. (2010). Erosion of lizard diversity by climate change and altered thermal niches. Science, 328, 894–899. https://doi.org/10.1126/science.1184695
Smith, G. R. y Ballinger, R. E. (1994). Temperature relationships in the high-altitude viviparous lizard, Sceloporus jarrovi. American Midland Naturalist, 131, 181–189. https://doi.org/10.2307/2426621
Sunday, J. M., Bates, A. E., Kearney, M. R., Colwell, R. K., Dulvy, N. K., Longino, J. T. et al. (2014). Thermalsafety margins and the necessity of thermoregulatory behavior across latitude and elevation. Proceedings of National Academy of Sciences USA, 111, 5610–5615. https://doi.org/10.1073/pnas.1316145111
Wapstra, E. (2000). Maternal basking opportunity affects juvenile phenotype in a viviparous lizard. Functional Ecology, 14, 345–352. https://doi.org/10.1046/j.1365-2435.2000.00428.x
Williams, S. E., Shoo, L. P., Isaac, J. L., Hoffmann, A. A. y Langham, G. (2008). Towards an integrated framework for assessing the vulnerability of species to climate change. Plos Biology, 6, 2621–2626. https://doi.org/10.1371/journal.pbio.0060325
Woolrich-Piña, G. A., Lemos-Espinal, J. A., Oliver-López, L. y Smith, G. R. (2012). Ecology of Xenosaurus rectocollaris in Tehuacan Valley, Puebla, Mexico. The Southwestern Naturalist, 57, 157–161. https://doi.org/10.1894/0038-4909-57.2.157
Woolrich-Piña, G. A. y Smith, G. R. (2012). A new species of Xenosaurus from the Sierra Madre Oriental, Mexico. Herpetologica, 68, 551–559. https://doi.org/10.1655/herpetologica-d-12-00018
Zamora-Ábrego, J. G., Ghang, Y. M., Zúñiga-Vega, J. J., Nieto-Montes de Oca, A. y Johnson, J. B. (2010). Demography of a knob-scaled lizard in nortlieastern Queretaro, Mexico. Herpetologica 66, 39–51. https://doi.org/10.1655/09-005.1
Zamora-Ábrego, J. G., Zúñiga-Vega, J. J. y Nieto-Montes de Oca, A. (2007). Variation in reproductive traits within the lizard genus Xenosaurus. Journal of Herpetology, 41, 630–637. https://doi.org/10.1670/06-266.1
Zúñiga-Vega, J. J. (2011). Estimating potential reproductive costs in the survival of a xenosaurid lizard. Herpetological Journal, 21, 117–129.
Zúñiga-Vega, J. J., Rojas-González, R. I., Lemos-Espinal, J.A. y Pérez-Trejo, M. E. (2005). Growth ecology of the lizard Xenosaurus grandis in Veracruz, Mexico. Journal of Herpetology, 39, 433–443. https://doi.org/10.1670/202-04a.1
Zúñiga-Vega, J. J., Valverde, T., Rojas-González, R. I. y Lemos-Espinal, J. A. (2007). Analysis of the population dynamics of an endangered lizard (Xenosaurus grandis) through the use of projection matrices. Copeia, 2007, 324–335. https://doi.org/10.1643/0045-8511(2007)7[324:aotpdo]2.0.co;2



