Lista faunística comentada de gusanos poliquetos en la bahía de La Paz, Baja California Sur, México (Annelida: Polychaeta) y nuevos registros
María Ana Tovar-Hernández a, *, Patricia Salazar-Silva b y Jesús Ángel de León-González a
a Laboratorio de Biosistemática, Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, Av. Pedro de Alba esq. Manuel L. Barragán, 66455 San Nicolás de los Garza, Nuevo León, México
b Instituto Tecnológico de Bahía de Banderas, Crucero a Punta de Mita s/n, 63734 La Cruz de Huanacaxtle, Bahía de Banderas, Nayarit, México
*Autor para correspondencia: maria_ana_tovar@yahoo.com (M.A. Tovar-Hernández)
Resumen
La bahía de La Paz (golfo de California) es un sitio prioritario para su conservación, por lo que contar con una obra que documente la biodiversidad que alberga es una necesidad apremiante. El propósito de este trabajo es proporcionar un inventario actualizado de anélidos poliquetos de la bahía de La Paz, validado taxonómica y geográficamente. Se realizó una búsqueda y recopilación de literatura existente hasta el 2019 y se incluyen nuevos registros. En esta bahía se han registrado 287 especies, 156 géneros y 37 familias. Acrocirrus incisa Kudenov, 1975, Parasabella pallida Moore, 1923, Pseudopotamilla socialis Hartman, 1944 y Serpula sp., son nuevos registros. Las familias Sabellidae (25 spp.), Syllidae (23 spp.), Serpulidae (22 spp.), Nereididae (22 spp.), Polynoidae (18 spp.), Capitellidae (17 spp.) y Eunicidae (16 spp.) cuentan con el mayor número de especies, que constituyen 49.8% de los registros. Veinte especies de poliquetos fueron descritos para la bahía de La Paz como localidad tipo; pero solo 17 son válidos. En la dicha bahía, 5 especies de poliquetos son exóticos: Branchiomma bairdi (McIntosh, 1885), Ficopomatus miamiensis (Treadwell, 1934), Hydroides diramphus (Mörch, 1863), H. elegans (Haswell, 1883) e H. sanctaecrucis Krøyer en Mörch, 1863.
Palabras clave: Anélidos; Diversidad; Especies introducidas; Golfo de California; Inventario
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Commented list of polychaete worms in La Paz Bay, Baja California Sur, Mexico (Annelida: Polychaeta) and new records
Abstract
La Paz Bay (Gulf of California) is a priority site for their conservation. Having a contribution that documents its biodiversity is an imperative necessity. The purpose of this contribution is to provide an update inventory of polychaete annelids to La Paz Bay, taxonomically and geographically validated. A search and compilation of literature existing until 2019 about polychaete records was conducted and new records are included. In La Paz Bay, 37 families, 156 genera and 287 species have been recorded. Acrocirrus incisa Kudenov, 1975, Parasabella pallida Moore, 1923, Pseudopotamilla socialis Hartman, 1944, and Serpula sp., are new records. Sabellidae (25 spp.), Syllidae (23 spp.), Serpulidae (22 spp.), Nereididae (22 spp.), Polynoidae (18 spp.), Capitellidae (17 spp.) and Eunicidae (16 spp.) have the highest number of species recorded in La Paz Bay, which together constitutes 49.8% of the total records. Twenty species of polychaete were described originally in La Paz Bay as type locality; however, only 17 of these are currently valid. Five species of introduced worms in La Paz Bay have been recorded: Branchiomma bairdi (McIntosh, 1885), Ficopomatus miamiensis (Treadwell, 1934), Hydroides diramphus (Mörch, 1863), H. elegans (Haswell, 1883) and H. sanctaecrucis Krøyer in Mörch, 1863.
Keywords: Annelids; Diversity; Introduced species; Gulf of California; Inventory
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
México es un país con una riqueza natural extraordinaria, considerado como uno de los 17 países megadiversos (Llorente-Bousquets y Ocegueda, 2008). Ese reconocimiento tiene su sustento en las 94,412 especies que han sido registradas en el territorio nacional (Martínez-Meyer et al., 2014). De ellas, 1,500 especies corresponden a un grupo de invertebrados: los anélidos poliquetos, gusanos que se distribuyen prácticamente en todos los ecosistemas bénticos marinos, donde a menudo son el componente dominante en términos de número de individuos y especies (Tovar-Hernández et al., 2014a). No obstante, los poliquetos han logrado invadir con éxito el ambiente pelágico, cuerpos de agua dulce e inclusive el medio terrestre: en el plancton 9 familias son consideradas holopláncticas exclusivas de ecosistemas pelágicos de mar abierto (Suárez-Morales et al., 2005); aproximadamente 168 de las 15,000 especies de poliquetos conocidas en el mundo son dulceacuícolas o semiterrestres y arbóreas, propias de los bosques húmedos tropicales (Glasby y Timm, 2008; Glasby et al., 2009). El éxito del grupo se atribuye a su plan corporal metamérico, el cual es responsable de su gran variabilidad morfológica y alta diversidad funcional.
La bahía de La Paz representa el cuerpo de agua más grande dentro de la fisiografía del golfo de California, con alta diversidad de peces, mamíferos y aves marinas e invertebrados, así como gran heterogeneidad de hábitats. De acuerdo con Conabio-Conanp-TNC-Pronatura (2007), la bahía de La Paz está clasificada como un área de extrema importancia entre los 21 sitios prioritarios costeros y de margen continental no cubiertos por ningún área protegida federal, además está dentro de la Región Prioritaria Marina Complejo Insular de Baja California Sur. Contar con inventarios actualizados y validados taxonómica y geográficamente para la bahía de La Paz, contribuye al conocimiento de su biodiversidad y gestión de planes de manejo y programas de desarrollo, y con ello es posible reorientar las políticas de manejo y conservación de la biodiversidad.
El objetivo de esta contribución es conocer los poliquetos en la bahía de La Paz con base en registros históricos y registros nuevos, destacando aquellas especies que han sido descritas para la zona como localidad tipo y las registradas como introducidas.
Materiales y métodos
La bahía de La Paz se encuentra en la parte meridional de la península de Baja California, en el estado de Baja California Sur y su litoral corresponde al margen occidental dentro del golfo de California. La zona costera de la bahía se ubica dentro de las coordenadas 24°23’31.64” N, 110°29’22.3” O (fig. 1). Su borde litoral se extiende desde Punta Mechudo, al norte, hasta Punta Las Pilitas, en el sureste. Además, está protegida al noreste por las islas Partida y Espíritu Santo, y hacia el norte por la isla San Francisquito. Su profundidad máxima es de 400-450 m (Velasco-García, 2009).
Los nuevos registros de poliquetos aquí presentados, corresponden a gusanos recolectados en el 2011 en muelles, en el casco de una embarcación y en compuertas de una granja camaronícola: Marina La Paz, Club de Yates Palmira, canal de navegación del puerto de La Paz y Granja “Acuacultores de La Paz, S.A. de C.V.” (tabla 1). La figuras 2 y 3 contienen fotografías de esos poliquetos en vivo, a excepción de los opérculos de un serpúlido (fig. 2F, G) y los radiolos de sabélidos (fig. 3B, C) que se fotografiaron después de la fijación. Para su identificación taxonómica se revisaron las descripciones originales (Hartman, 1944b; Kudenov, 1975; Tovar-Hernández y Dean, 2014) y los trabajos de Kupriyanova (1999), Bastida-Zavala (2008), Tovar-Hernández et al. (2009b), Tovar-Hernández y Carrera-Parra (2011). Las muestras fueron depositadas en la Colección Poliquetológica de la Universidad Autónoma de Nuevo León (NL-INV-0002-05-09).
Para el Pacífico mexicano se cuenta hoy en día con 3 compilaciones relevantes sobre gusanos poliquetos: Salazar-Vallejo y Londoño-Mesa (2004), Hernández-Alcántara et al. (2008) y de León-González et al. (2009), así como un catálogo de autoridades taxonómicas de las especies de poliquetos del Pacífico mexicano y otras localidades del Pacífico oriental tropical (Salazar-Silva, 2015). A partir de esos trabajos y de la contribución de Bastida-Zavala (1993), se realizó una búsqueda, recopilación y análisis de la literatura existente hasta el 2019 sobre la poliquetofauna en la bahía de La Paz, excluyendo literatura gris (tesis, informes técnicos). Los nombres de especies válidos hoy en día, las autoridades taxonómicas y fechas, y la localidad tipo de cada especie fueron corroborados por 2 vías: en una primera aproximación usando la plataforma digital WoRMS (2019) y después cotejando las fuentes originales y revisiones taxonómicas. Los registros que cuentan con coordenadas geográficas, éstas se verificaron usando Google Earth Pro 7.3. La tabla 3 contiene el número de géneros y especies por familia.
En el apéndice 1 se incluyen las especies de poliquetos registradas en la bahía de La Paz, agrupadas en familias y en géneros. El orden no sigue una clasificación en particular, sino que es estrictamente alfabético. Las especies marcadas con un asterisco son aquellas cuya localidad tipo se ubica en la bahía de La Paz; es decir, que fueron originalmente descritas para esa zona. Las especies denotadas con un Q son registros dudosos; las denotadas como NIS indican especies no nativas para el golfo de California. Se indica la localidad tipo (LT) de forma general para todas las especies, excepto en el caso de las especies descritas para La Paz, pues en ellas se indica el nombre de la localidad, el sustrato y la profundidad a la que fueron encontradas, tan completo como la fuente original así lo indica. Para cada una de las especies se indican las fuentes (s) de los registros (autor, año y páginas donde se reporta la especie). Aunque en algunos estudios los espirórbidos se consideran una familia independiente, se incluyen dentro de Serpulidae de acuerdo con Bastida-Zavala (2009). En algunos casos se indican comentarios particulares y sus respectivas citas fueron incluidas en la sección de referencias.
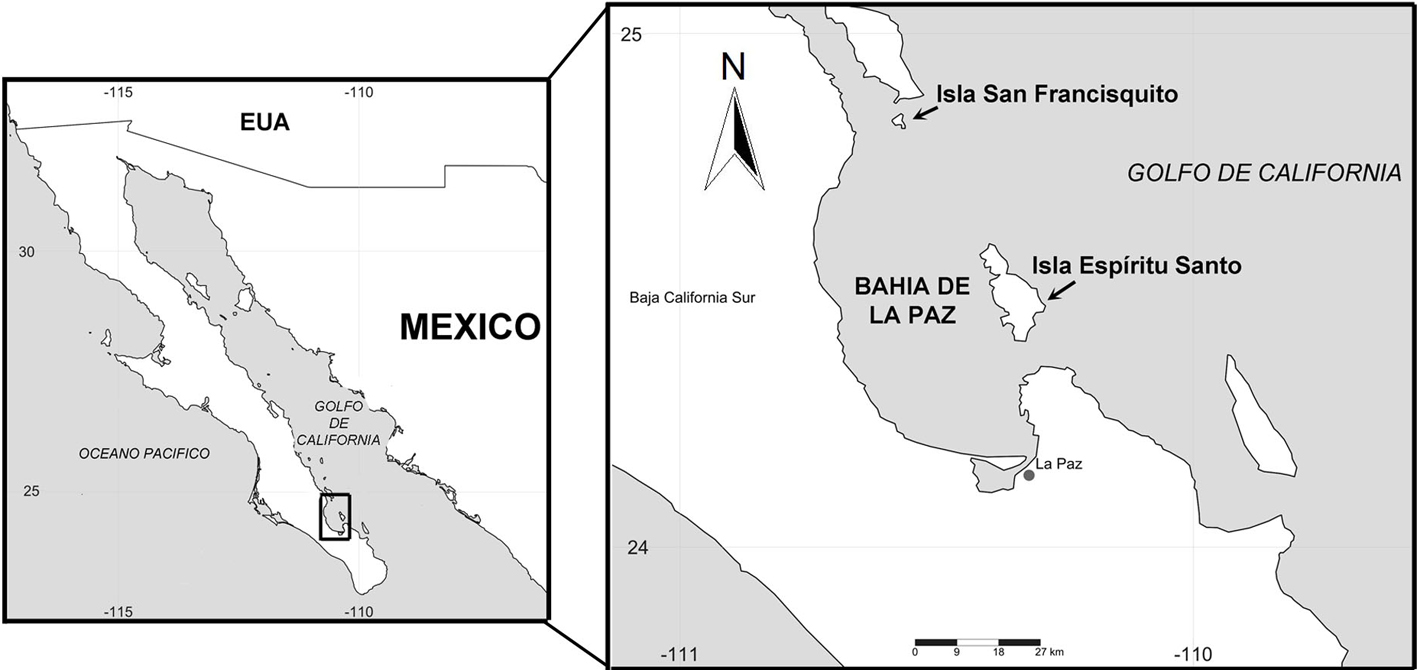
Tabla 1
Sitios de recolecta recientes en la bahía de La Paz. Abreviaturas: IRS, Irving Ramírez Santana; JMAC, José María Aguilar Camacho; TFVG, Tulio Fabio Villalobos Guerrero.
|
Sitio |
Localidad |
Sustrato |
Latitud N |
Longitud O |
Salinidad |
Recolectores |
Fecha |
|
1 |
API La Paz |
Casco de embarcación |
24°16.447’’ |
110°19.852’’ |
32 |
IRS, JMAC |
13/VIII/2011 |
|
2 |
Marina La Paz |
Muelles |
24°09.318’’ |
110°19.630’’ |
35 |
IRS, JMAC |
14/VIII/2011 |
|
3 |
Club de Yates Palmira La Paz |
Muelles |
24°10.992’’ |
110°18.185’’ |
35 |
JMAC, TFVG |
15/VIII/2011 |
|
4 |
Granja camaronícola Acuacultores de La Paz, S. A. de C. V. |
Compuertas |
24°14.519’ |
110°18.321’’ |
35-40 |
TFVG |
16/VIII/2011 |
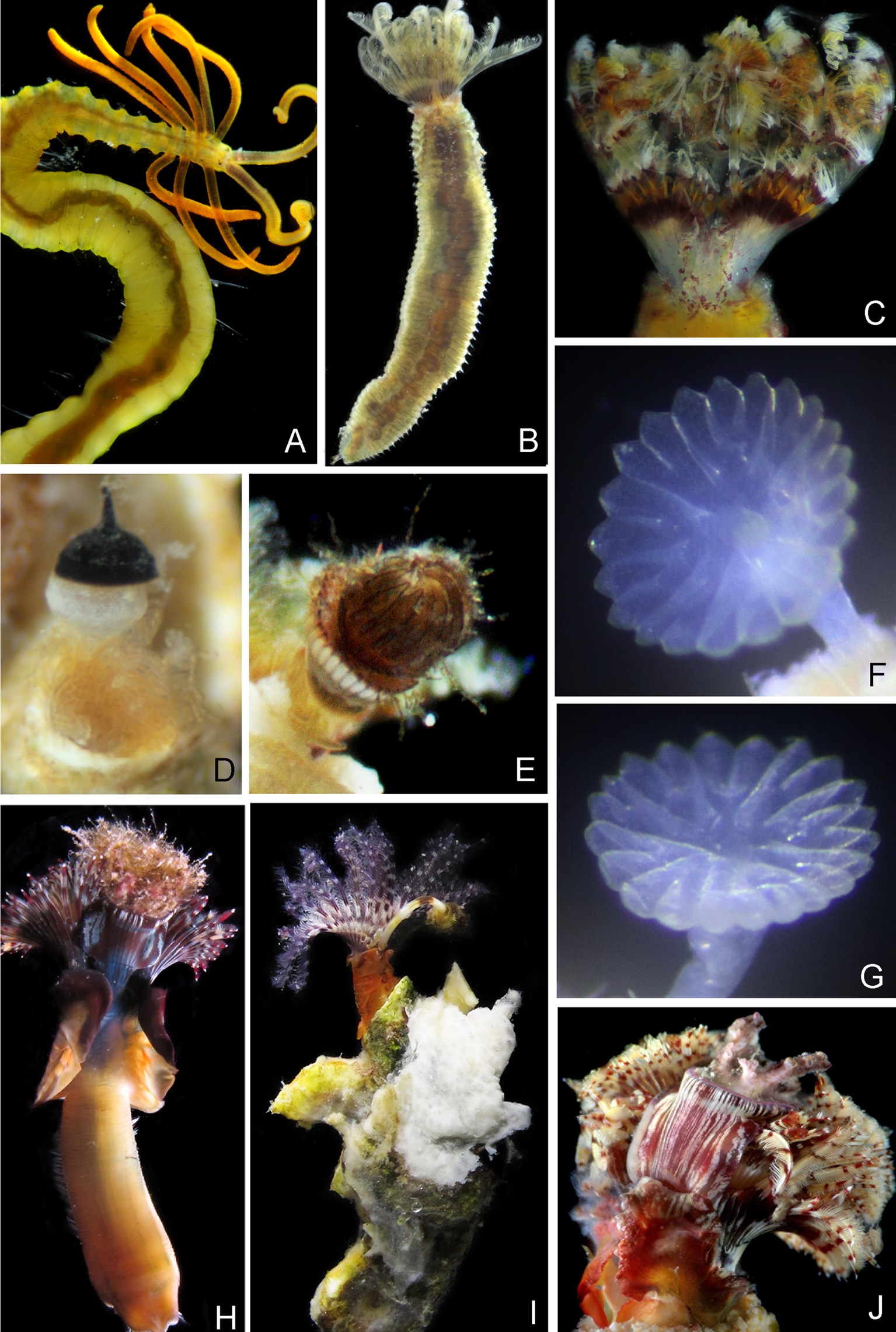
Tabla 2
Especies de poliquetos registradas a partir de muestreos recientes en este estudio, para la bahía de La Paz. Nota: las familias y/o especies marcadas con un asterisco constituyen nuevos registros para la zona.
|
Especies de poliquetos |
|
*Familia Acrocirridae Banse, 1969 |
|
*Acrocirrus incisa Kudenov, 1975: sitio 1, embarcación, R1, 2 ej. sitio 3, muelle 6, R1, 1 ej. sitio 3, muelle 6, R2, 5 ej. |
|
Familia Sabellidae Latreille, 1825 |
|
Acromegalomma circumspectum (Moore, 1923): sitio 3, muelle 3, R1, 1 ej. sitio 3, muelle 6, R1, 1 ej. |
|
*Parasabella pallida Moore, 1923: sitio 1, embarcación, R1, 2 ej. sitio 1, embarcación, R2, 1 ej. sitio 2, muelle 3, R1, 1 ej, sitio 4, granja camaronícola, 1 ej. |
|
Pseudobranchiomma schizogenica Tovar-Hernández y Dean, 2014: sitio 1, embarcación, R1, 83 ej. sitio 1, embarcación, R2, 106 ej. sitio 2, muelle 2, R1, 16 ej. sitio 2, muelle 2, R2, 43 ej. sitio 3, muelle 3, R2, 126 ej. sitio 3, muelle 6, R1, 628 ej. |
|
*Pseudopotamilla socialis Hartman, 1944: sitio 1, embarcación, R1, 2 ej. sitio 1, embarcación, R2, 9 ej. sitio 2, muelle 3, R1, 1 ej. |
|
Familia Serpulidae Rafinesque, 1815 |
|
*Serpula sp. : sitio 3, muelle 6, R1, 25 ej. |
|
Spirobranchus incrassatus Krøyer in Mörch, 1863: sitio 1, embarcación, R1, 2 ej. sitio 2, muelle 3, R1, 1 ej. sitio 2, muelle 3, R2, 1 ej. sitio 2, muelle 3, R2, 10 ej. |
|
Hydroides similis (Treadwell, 1929): sitio 2, muelle 3, R1, 1 ej. sitio 2, muelle 3, R2, 1 ej. sitio 3, muelle 6, R1, 1 ej. |
|
Pseudovermilia occidentalis (McIntosh, 1885): sitio 2, muelle 2, R2, 1 ej. sitio 3, muelle 6, R1, 8 ej. |

Resultados
En este estudio se revisaron 1,079 ejemplares asociados a sustratos de origen antropogénico en la bahía de La Paz (muelles, casco de embarcación y compuertas de una granja camaronícola) (tablas 1, 2). Dichos ejemplares pertenecen a 9 especies de poliquetos agrupadas en 3 familias: Acrocirrus incisa Kudenov, 1975 (fig. 2A), Acromegalomma circumspectum (Moore, 1923) (fig. 3A-B), Parasabella pallida Moore, 1923 (fig. 2B), Pseudobranchiomma schizogenica Tovar-Hernández y Dean, 2014 (fig. 2C), Pseudopotamilla socialis Hartman, 1944b (fig. 3C), Serpula sp. (fig. 2F, G), Spirobranchus incrassatus Krøyer en Mörch, 1863 (fig. 2H, J), Hydroides similis (Treadwell, 1929) (fig. 2E, I) y Pseudovermilia occidentalis (McIntosh, 1885) (fig. 2D).
De esas especies, 4 constituyen nuevos registros: A. incisa, P. pallida, P. socialis y Serpula sp. Este último serpúlido no pudo identificarse a especie, pues presenta caracteres que no se ajustan del todo a las especies conocidas para el Pacífico oriental y reportadas por Bastida-Zavala (2008): S. columbiana Johnson, 1901, S. cf. hartmanae Reish, 1968 y S. cf. watsoni Willey, 1905. Los ejemplares de La Paz presentan 16-26 radios; 18-21 radios en S. cf. hartmanae; 37-47 radios en S. cf. watsoni; 16-26 en material tipo de S. columbiana reportado por Kupriyanova (1999: 55-160) o 114-145 en ejemplares reportados por Bastida-Zavala (2008). Sin embargo, ya Kupriyanova (1999) y ten Hove y Kupriyanova (2009) han alertado sobre la alta variabilidad del número de radios operculares en Serpula, debida probablemente, a la ontogenia o a las diferencias poblacionales de las especies. Los ejemplares de La Paz se asemejarían más a S. cf. hartmanae Reish, 1968 que a las otras 2 especies con base en el número de radios. No obstante, la profundidad del embudo es mayor en S. cf. hartmanae (tan profundo como 2 veces el diámetro del opérculo), mientras que en los ejemplares de La Paz el embudo es más corto (tan profundo como el diámetro del opérculo). Por lo anterior, no se puede determinar fehacientemente la identidad de la especie, pues podría tratarse de alguna especie no descrita.
Para bahía de La Paz se han registrado 287 especies de gusanos poliquetos pertenecientes a 156 géneros y 37 familias (tabla 3). Las 6 familias con el mayor número de especies registradas para la bahía de La Paz son: Sabellidae (25), Syllidae (23), Serpulidae (22), Nereididae (22), Polynoidae (18) y Capitellidae (17), que en conjunto constituyen 49.8% de las especies (tabla 3).
Tabla 3
Familias, géneros y especies registrados en la bahía de La Paz.
|
Géneros |
Especies |
|
|
Acoetidae |
1 |
2 |
|
Acrociriidae |
1 |
1 |
|
Amphinomidae |
5 |
7 |
|
Aphroditidae |
1 |
1 |
|
Capitellidae |
8 |
17 |
|
Chaetopteridae |
3 |
3 |
|
Chrysopetalidae |
2 |
4 |
|
Cirratulidae |
6 |
8 |
|
Ctenodrilidae |
1 |
1 |
|
Dorvilleidae |
2 |
6 |
|
Eunicidae |
5 |
16 |
|
Euphrosinidae |
1 |
2 |
|
Flabelligeridae |
4 |
9 |
|
Glyceridae |
1 |
4 |
|
Goniadidae |
1 |
1 |
|
Hesionidae |
3 |
7 |
|
Lumbrineridae |
3 |
11 |
|
Maldanidae |
2 |
2 |
|
Nepthyidae |
3 |
8 |
|
Nereididae |
11 |
22 |
|
Oenonidae |
3 |
5 |
|
Onuphidae |
7 |
14 |
|
Opheliidae |
3 |
4 |
|
Orbiniidae |
3 |
3 |
|
Oweniidae |
1 |
1 |
|
Paraonidae |
3 |
5 |
|
Pectinariidae |
1 |
1 |
|
Phyllodocidae |
4 |
4 |
|
Pilargidae |
1 |
1 |
|
Polynoidae |
10 |
18 |
|
Sabellariidae |
1 |
1 |
|
Sabellidae |
11 |
25 |
|
Serpulidae |
12 |
22 |
|
Sigalionidae |
5 |
8 |
|
Spionidae |
5 |
5 |
|
Syllidae |
9 |
23 |
|
Terebellidae |
13 |
15 |
|
Totales |
156 |
287 |
La primera especie reportada y descrita para La Paz fue el gusano escamoso Lepidasthenia digueti Gravier, 1905. Después, Berkeley y Berkeley (1939), Hartman (1939, 1940), Steinbeck y Ricketts (1941), Fauvel (1943) y Rioja (1947a, b) reportaron varias especies de poliquetos para la región.
En la segunda mitad del siglo XX se publicaron la mayoría de los registros de especies de poliquetos conocidas para la bahía de La Paz: Rioja (1963) registró varias especies para La Paz y Knight-Jones (1978) 2 espirórbidos. En la década de 1980, los trabajos de Salazar-Vallejo (1987b) y Salazar-Vallejo et al. (1987) registraron una especie de pilárgido y un neréidido, respectivamente. La década de 1990 cuenta con los trabajos de Bastida-Zavala (1991, 1993, 1994), Hernández-Alcántara y Solís-Weiss (1991) y de León-González y Solís-Weiss (1998).
El inicio del siglo XXI se caracterizó por la publicación de revisiones taxonómicas en varias familias o géneros y sus respectivos registros en las islas Espíritu Santo, Partida y San Francisquito (Hernández-Alcántara et al., 2003) y en la bahía de La Paz. Bastida-Zavala y ten Hove (2003) revisaron las especies del género Hydroides (Serpulidae) registradas previamente por Bastida-Zavala (1993); Tovar-Hernández (2007) registró un sabélido cónido; Bastida-Zavala (2008) registró especies de Hydroides, Pomatoceros y Pseudovermilia (Serpulidae). La familia Capitellidae ha sido muy bien estudiada en la región por García-Garza (2011) y García-Garza y de León-González (2009, 2011, 2015), quienes informaron de 12 especies pertenecientes a varios géneros. Góngora-Garza et al. (2011) registraron un sílido Branchiosyllis; Salazar-Vallejo (2011, 2012) informó de 4 especies de flabeligéridos (Flabelligeridae); Tovar-Hernández y Carrera-Parra (2011) registraron 2 especies de Acromegalomma (Sabellidae); Tovar-Hernández y Dean (2014) divulgaron sobre una especie de Pseudobranchiomma (Sabellidae) que se reproduce por esquizogamia; Bastida-Zavala et al. (2016) registraron 3 especies de sabélidos y 11 de serpúlidos en marinas de la bahía de La Paz, y Salazar-Vallejo (2018) en su revisión mundial de Hesione, reporta H. panamena Chamberlin, 1919 (apéndice 1).
En un estudio ecológico sobre poliquetos de la península de Baja California en fondos blandos, Hernández-Alcántara et al. (2017) mencionan que una de las estaciones de muestreo ubicada en la bahía de La Paz presentó el valor más alto de densidad, representado por 22 especies. Aunque en la publicación no se enlistan los nombres de dichas especies por la naturaleza propia del artículo, en el texto indican las más representativas de la zona: el glicérido Glycera lapidum de Quatrefages, 1866, el capitélido Notomastus magnus Hartman, 1947, el néftido Aglaophamus verrilli (McIntosh, 1855), el lumbrinérido Scoletoma zonata (Johnson, 1901) y el paraónido Cirrophorus furcatus (Hartman, 1957).
En un estudio reciente, Cuéllar-Mercado et al. (2019) estudiaron la composición, riqueza y diversidad de poliquetos en la bahía de La Paz recolectados entre los 46 y 208 metros de profundidad. Dicho trabajo reporta la presencia de 26 especies en bahía de la Paz (más 2 especies determinadas solo a nivel de género).
Se describieron 20 especies de poliquetos para la bahía de La Paz (apéndice 1); sin embargo, hoy en día, 3 de ellas no se consideran válidas: 1) Euclymene papillata isocirra Rioja, 1962, descrito para la isla de la Gaviota y en el Mogote, sinonimizado con Isocirrus papillatus (Berkeley y Berkeley, 1939) fide Salazar-Vallejo (1991: 273). 2) Eunoe exoculata Treadwell, 1923, descrito para Pichilingue a 855 m fue sinonimizado con Harmothoe tenebricosa Moore, 1910 fide Pettibone (1969: 37). 3) Vermiliopsis cornuta Rioja, 1947b: descrito para Coromuel, fue sinonimizado con Pseudovermilia occidentalis (McIntosh, 1855) fide Zibrowius (1971: 1374).
De las especies descritas para La Paz, 11 no cuentan con registros posteriores. De ellas, 5 fueron establecidas en la última década (Perinereis bajacalifornica de León-González y Solís-Weiss, 1998; Branchiosyllis sanmartini Góngora-Garza, García-Garza y de León-González, 2011; Semiodera tovarae Salazar-Vallejo, 2012, Notomastus fauchaldi García-Garza y de León-González, 2015 y Websterinereis pettiboneae de León-González y Balart, 2016), por lo que es probable que la falta de registros obedezca a falta de identificación de muestras acumuladas en los laboratorios y colecciones, lo cual es un fenómeno común en el estudio de los poliquetos y otros invertebrados.
Paleanotus purpurea Rioja, 1947a, no ha sido reportada para La Paz después de su establecimiento, pero fue reportada recientemente en Oaxaca y Guerrero (Cruz-Gómez y Bastida-Zavala, 2018). Existen 2 especies de espirórbidos que desde su nominación en 1978 no se han vuelto a reportar (Pileolaria lateralis Knight-Jones, 1978 y Pileolaria spinifer Knight-Jones, 1978). La razón quizá tenga que ver con que en México no hay un taxónomo especialista en esa subfamilia, pues los espirórbidos, aunque muy pequeños, son muy frecuentes en La Paz y de fácil muestreo, pues se encuentran adheridos a diferentes superficies bióticas o abióticas en la zona de intermarea.
Además de esas especies, hay 3 más que fueron descritas para bahía de La Paz en la primera mitad del siglo XX y desde entonces no se han vuelto a reportar. De ellas, el gusano escamoso Lepidasthenia digueti presenta una asociación ecológica interesante, es un comensal de un balanogloso y junto con el camarón mantis Alachosquilla digueti, son inquilinos de las galerías del hemicordado (Coutière, 1905). La relación simbiótica y la falta de registros del polinoido en otras provincias biogeográficas podrían sugerir la presencia de endemismo en el sur del golfo de California. Por su parte, el espiónido Aonides californiensis Rioja, 1947b fue encontrado entre fragmentos de coral muerto Porites. Bastida-Zavala (1995) trabajó los poliquetos asociados a coral muerto Pocillopora en Cabo Pulmo-Los Frailes sin reportar la presencia de A. californiensis, por lo que el espiónido podría ser habitante específico de Porites o endémico. Finalmente, el terebélido Polycirrus mexicanus Rioja, 1947b hallado sobre conchas de moluscos no ha sido reportado de nuevo, esto obedece a que no ha habido revisiones taxonómicas de Terebellidae para el Pacífico mexicano, pues una buena cantidad de muestras de ejemplares para La Paz, están a la espera de análisis y estudio.
En la bahía de La Paz se encuentran 2 de las principales vías de entrada de especies exóticas en el medio acuático: el tráfico de embarcaciones (agua de lastre y bioincrustantes o “fouling”) y la acuicultura (Tovar-Hernández et al. 2014b). Por su relevancia ecológica, resultan de gran interés los registros de 5 especies de poliquetos introducidos en bahía de La Paz de los que a continuación se informa:
Branchiomma bairdi (McIntosh, 1885). El plumero verde B. bairdi, es un poliqueto sabélido tubícola exótico invasor en varias localidades del golfo de California (Tovar-Hernández et al., 2009a, b, 2012, 2014b). Para la bahía de La Paz se registró en un sitio natural asociado a rocas en la playa Balandra y en sitios perturbados sobre sustratos de origen antropogénico: en la API La Paz la especie se encuentra adherida a boyas de señalización marítima y en cascos de embarcaciones; en Marina La Paz y Club de Yates Palmira se encuentra adherida a los muelles y estructuras sumergidas; en las granjas camaronícolas “Camarón sureño” y “Acuacultores de La Paz” la especie se encuentra adherida a compuertas y pilotes de madera (Tovar-Hernández et al., 2012, 2014b). Las imágenes e información detallada de la especie (generalidades, distribución, ambiente, historia natural, antecedentes de la introducción e impactos), así como un análisis de riesgo, se encuentran en Tovar-Hernández y Yáñez-Rivera (2012a) y Tovar-Hernández et al. (2012). Este sabélido invasor es probablemente el más registrado en los últimos años para varias localidades del mundo, incluyendo el Pacífico mexicano, todas las áreas del mar Mediterráneo, las islas Canarias y Madeira y Australia (Bastida-Zavala et al., 2016; del Pasqua et al., 2018; Keppel et al., 2015). A pesar de su potencial invasor, no fue incluido en el acuerdo por el que se determina la lista de las especies exóticas invasoras para México (DOF-2016), pero al ser éste un instrumento que debe ser actualizado frecuentemente en la medida que se genere nuevo conocimiento, se espera que esta contribución sirva para ello.
Ficopomatus miamiensis (Treadwell, 1934), es un serpúlido exótico invasor en varias localidades de Mazatlán (Salgado-Barragán et al., 2004; Tovar-Hernández et al., 2009b) pero no fue incluido en el acuerdo por el que se determina la lista de las especies exóticas invasoras para México (DOF-2016). Para la bahía de La Paz, se registró en la granja camaronícola “Camarón sureño” en el 2011, pero de acuerdo con información del gerente de producción y del Comité Estatal de Sanidad Acuícola de Baja California Sur, la especie de detectó por primera vez en 2009, observando la mayor densidad de este gusano en abril (Tovar-Hernández et al., 2012, 2014b). Las imágenes e información detallada de la especie, así como un análisis de riesgo se encuentran en Tovar-Hernández y Yáñez-Rivera (2012b) y Tovar-Hernández et al. (2012).
Hydroides diramphus (Mörch, 1863). Es un serpúlido exótico en Guaymas, Sonora (Tovar-Hernández et al., 2014b) y en varias localidades de la bahía de La Paz: en sustratos mixtos de las playas Caimancito (Bastida-Zavala, 1993) y Coromuel (Bastida-Zavala y ten Hove, 2003), y en el Club de Yates Palmira asociado a muelles (Tovar-Hernández et al., 2014b). No cuenta con un análisis de riesgo pero está incluido en el acuerdo por el que se determina la lista de las especies exóticas invasoras para México (DOF-2016). En Tovar-Hernández et al. (2012) se encuentran imágenes e información detallada de la especie.
Hydroides elegans (Haswell, 1883). Es un serpúlido exótico potencialmente invasor en varias localidades del golfo de California: Mazatlán, Topolobampo y Guaymas (Tovar-Hernández et al., 2009b, 2012, 2014b). En la bahía de La Paz fue registrada en una placa de PVC sumergida en Pichilingue (Bastida-Zavala, 2008), durante un mes con una cobertura de 85-90%, +1,000 individuos (Bastida-Zavala, 2008); en la API La Paz (en boyas de señalización marítima, densidad promedio 48 ind/m2) y en muelles del Club de Yates Palmira (152 ind/m2) (Tovar-Hernández et al., 2014b). No cuenta con un análisis de riesgo pero está incluido en el acuerdo por el que se determina la lista de las especies exóticas invasoras para México (DOF-2016). En Tovar-Hernández et al. (2012) se encuentran imágenes e información detallada de la especie.
Hydroides sanctaecrucis Krøyer en Mörch, 1863. Esta especie se registró como exótica en Guaymas y Topolobampo (Tovar-Hernández et al., 2012, 2014b) y en una marina de la bahía de La Paz (Marina La Paz asociado a muelles en una densidad de 4 ind/m2) (Tovar-Hernández et al., 2014b). No cuenta con un análisis de riesgo ni fue incluido en el acuerdo por el que se determina la lista de las especies exóticas invasoras para México (DOF-2016). En Tovar-Hernández et al. (2012) se encuentran imágenes e información detallada de la especie.
Además de esas 5 especies no nativas (NIS), 2 capitélidos (Notomastus hemipodus Hartman, 1945 y N. polyodon Gallardo, 1968), 4 sabélidos [Branchiomma cingulatum (Grube, 1870), B. nigromaculatum (Baird, 1865), Pseudobranchiomma punctata (Treadwell, 1906) y Sabellastarte spectabilis (Grube, 1878)], 1 serpúlido (Pseudovermilia occidentalis [McIntosh, 1885)] y 1 sílido (Myrianida pachycera Augener, 1913) fueron catalogados como NIS? en el apéndice 1.
Discusion
La bahía de La Paz es un destino turístico de gran importancia económica para el estado de Baja California Sur, que cuenta con una amplia diversidad de ambientes marinos idóneos para el establecimiento de diversas poblaciones de invertebrados marinos. De acuerdo con Bastida-Zavala (1993), la bahía de La Paz está relativamente bien estudiada en términos de poliquetos, debido por un lado, al trabajo de investigación sobre estos organismos y por el otro, a la gran variedad de ambientes que existen en ella y que incluyen playas arenosas, rocosas, manglares y formaciones coralinas.
En comparación con otro destino portuario y turístico como lo es Mazatlán, donde 320 especies de gusanos han sido registradas (Villalobos-Guerrero y Molina-Acevedo, 2014), la bahía de La Paz presenta una riqueza de poliquetos de 287 especies. No obstante, de las 287 especies, 132 (46%) son especies cuyos registros se consideran cuestionables (apéndice 1), debido a que en los años en que se registraron, la literatura disponible incorporaba nombres de especies del Ártico, del Índico, del Mediterráneo, o del Polo Sur, y de localidades tan remotas como Groenlandia o el estrecho de Magallanes, por decir solo algunos ejemplos. Esto provocaba que muchas de las especies de poliquetos fueran consideradas “cosmopolitas” o de amplia distribución, sin serlo.
Por ejemplo, el eunícido Marphysa sanguinea Montagu, 1815, descrito para el sur de Inglaterra y registrado en la bahía de La Paz, fue por muchos años considerado una especie cosmopolita. En el 2003, Hutchings y Karageorgopoulus designaron un neotipo de M. sanguinea, proporcionando una descripción completa de la especie, además de información detallada sobre su biología reproductiva. Comprobaron que la especie registrada como M. sanguinea en Australia en realidad se trataba de una nueva especie, sugiriendo que todos los registros de M. sanguinea fuera de su localidad tipo deberían re-examinarse, pues podrían ser incorrectos. Siguiendo este razonamiento y con la finalidad de resolver los problemas taxonómicos en el género, el uso de nuevas estructuras para diferenciar especies, tales como el aparato maxilar, los lóbulos parapodiales, los cirros ventrales y las setas en forma de pectinas, fueron incorporados por Molina-Acevedo y Carrera-Parra (2015), quienes reestablecieron 3 especies del Caribe que habían sido sinonimizadas con M. sanguinea y enfatizaron, también, que los registros de M. sanguinea en el Caribe son dudosos y corresponderían a otras especies, como se comprobó más tarde (Molina-Acevedo y Carrera-Parra, 2017). Bajo este contexto, los registros de M. marphysa para la bahía de la Paz podrían corresponder a una especie no descrita.
Este ejemplo resume la tendencia que hay en el estudio taxonómico de los poliquetos en las últimas 2 décadas en todo el mundo, misma que consiste en hacer revisiones meticulosas de familias o géneros de poliquetos, incorporando además, el uso de herramientas moleculares. Este tipo de estudios en cualquier familia de poliquetos permitirán corregir identificaciones erróneas del pasado e identificando discriminadores morfológicos de mayor validez, lo que resultará en una reidentificación de las especies y actualización de los nombres. Se espera que esa tendencia permita corroborar o corregir los registros de los poliquetos en la bahía de La Paz, pues las herramientas taxonómicas están en constante evolución.
De hecho, algunos nombres específicos han sido corregidos, como el caso de Hydroides brachyacanthus y Pseudovermilia conchata, registradas con estos nombres para la bahía de La Paz por Bastida-Zavala (1993), pero revisados y corregidos como H. similis y P. occidentalis, respectivamente (Bastida-Zavala y ten Hove, 2003; Bastida-Zavala, 2008).
La bahía de La Paz, como todos los destinos portuarios de México, se enfrenta a la problemática de las especies invasoras. La Paz es uno de los puertos más importantes del Pacífico mexicano debido a su actividad comercial, pesquera y turística nacional e internacional, y la probabilidad de que la biota marina exótica ingrese al puerto vía las incrustaciones de embarcaciones, en el agua de lastre o asociada a las prácticas de acuicultura, es sumamente alta. Hasta la fecha, se ha reportado la presencia de por lo menos 20 especies introducidas en la bahía de la Paz: 7 especies de poliquetos (Tovar-Hernández et al., 2014b; Bastida-Zavala et al., 2016), 1 macroalga (Riosmena et al., 2014), 2 briozoos, 1 crustáceo, 4 esponjas y 5 ascidias (Tovar-Hernández et al., 2014b). En contraste, en los puertos de Mazatlán y Topolobampo (Sinaloa) se han reportado en conjunto 30 especies de invertebrados introducidos (Tovar-Hernández et al. 2012). No obstante, para fines de manejo y conservación, no basta con la detección de dichas especies. Es urgente estimar los descriptores ecológicos de las especies introducidas, establecer su monitoreo ecológico y determinar su comportamiento e impactos en la comunidad nativa.
A excepción de los registros de Hernández-Alcántara et al. (2017) y Cuéllar-Mercado et al. (2019) provenientes de dragados, los poliquetos registrados para la bahía de La Paz provienen de las zonas intermareal y sublitoral somera; asimismo, no existen registros de poliquetos pelágicos. La mayoría de las especies fueron recolectadas en fondos arenosos o rocosos, en raíces de mangle, asociados a conchas de moluscos, algas coralinas y recientemente, en sustratos de origen antrópico como muelles, cascos de embarcaciones, boyas de señalamiento marítimo y otro tipo de estructuras sumergidas en la zona portuaria, en marinas y en granjas de producción camaronícola (Tovar-Hernández et al., 2014b; este estudio).
Por todo lo anterior, resulta fundamental fortalecer el trabajo de las instituciones que están dedicadas a descubrir y describir la riqueza y la biodiversidad de la bahía de La Paz, en hábitats como los arrecifes coralinos, pastos marinos y manglares, los cuales son muy vulnerables y presentan menos resiliencia ante el cambio climático, la contaminación, las enfermedades, las especies invasoras y los efectos en cascada producidos por la sobrexplotación de los recursos marinos; asimismo, los estudios futuros deben incluir poliquetos pelágicos y de zonas profundas. De esta manera, se tendrá una mejor representación de la biodiversidad de poliquetos en la bahía de La Paz. Finalmente, se espera que esta información sirva para estimular el estudio detallado de los poliquetos nativos en la región y alertar a ecólogos y tomadores de decisiones sobre la presencia de especies introducidas en la bahía de La Paz, para con ello, contribuir con la generación de conocimiento útil que sirva para el manejo y conservación de su biodiversidad.
Agradecimientos
El Dr. Rafael Riosmena Rodríguez nos invitó a participar con esta contribución en una obra que, desafortunadamente, no alcanzó a culminar. Este trabajo está dedicado a su memoria. Las fotografías contenidas en la figura 2 fueron tomadas por Humberto Bahena-Basave (ECOSUR-Chetumal). Los resultados de esta publicación fueron obtenidos parcialmente de los Proyectos KT004 (Conabio) e INEC/ADE-013/2011 (INECC). Tulio Villalobos, José María Aguilar e Irving Ramírez participaron en la toma de muestras recientes. Agradecimiento especial merecen Pablo Hernández-Alcántara (ICML) y Rolando Bastida-Zavala (UMAR), pues su minuciosa revisión y sugerencias permitieron transformar y mejorar el artículo.
Apéndice 1. Especies de poliquetos registradas para la bahía de La Paz. Q = registros dudosos; NIS = especies no nativas para el golfo de California.
Clase Polychaeta Grube, 1850
Familia Acoetidae Kinberg, 1856
Género Polyodontes Renier, 1828
Q Polyodontes oculea (Treadwell, 1901). LT: Puerto Rico. Registros: Hartman (1939: 7).
Polyodontes panamensis (Chamberlin, 1919). LT: Panamá, Pacífico. Registros: Cuéllar-Mercado et al. (2019: 4).
Familia Acrocirridae Banse, 1969
Género Acrocirrus Grube, 1873
Acrocirrus incisa Kudenov, 1975, LT: Puerto Peñasco, golfo de California. Registros: este estudio.
Familia Amphinomidae Savigny, 1818
Género Chloeia Lamarck, 1818
Chloeia entypa Chamberlin, 1919. LT: Pacífico mexicano. Registros: Rioja (1947b: 201; 1963: 158).
Chloeia pinnata Moore, 1911. LT: Monterey Bay, California. Registros: Berkeley y Berkeley (1939: 323); Hernández-Alcántara et al. (2003: 4).
Q Chloeia viridis Schmarda, 1861. LT: Carolina del Norte y norte del golfo de México. Registros: Berkeley y Berkeley (1939: 322-323); Hartman (1940: 205-206); Rioja (1963: 157-158); Hernández-Alcántara et al. (2003: 4). Comentario: Barroso et al. (2010) y Yáñez-Rivera y Carrera-Parra (2012) han delimitado el reconocimiento y la distribución de supuestas especies anfiamericanas de anfinómidos con el uso del ADN. Puede ser el caso de C. viridis.
Género Eurythoe Kinberg, 1857
Q Eurythoe complanata (Pallas, 1766). LT: Caribe. Registros: Berkeley y Berkeley (1939: 323-324); Hartman (1940: 183-184, 186, 202-203); Rioja (1947b: 201; 1963: 157); Bastida-Zavala (1993: 30); Hernández-Alcántara et al. (2003: 4). Comentario: Barroso et al. (2010) evidenciaron altos niveles de divergencia genética entre poblaciones atribuidas a E. complanata del Caribe, Sudamérica y el Pacífico, mostrando la presencia de tres especies crípticas, aunque la morfología solo reconoce una.
Género Linopherus Quatrefages, 1866
Linopherus kristiani Salazar-Vallejo, 1987. LT: bahía de Manzanillo, Colima, México. Registros: Cuéllar-Mercado et al. (2019: 4).
Género Notopygos Grube, 1855
Notopygos ornata Grube, 1856. LT: Puntarenas, Costa Rica. Registros: Berkeley y Berkeley (1939: 323); Hartman (1940: 184, 207); Steinbeck y Ricketts (1941: 358).
Género Pareurythoe Gustafson, 1930
Pareurythoe californica (Johnson, 1897). LT: San Pedro y Pacific Groove, California. Registros: Rioja (1963: 157); Bastida-Zavala (1993: 30).
Familia Aphroditidae Malmgren, 1867
Género Aphrodita Linnaeus, 1758
Q Aphrodita japonica von Marenzeller, 1879. LT: Japón. Registros: Hartman (1939: 8-9).
Familia Capitellidae Grube, 1862
Género Amastigos Piltz, 1977
Amastigos acutus Piltz, 1977. LT: Hope Ranch, California. Registros: García-Garza y de León-González (2011: 19).
Género Capitella de Blainville, 1828
Q Capitella capitata (Fabricius, 1780). LT: Groenlandia, occidente. Registros: Bastida-Zavala (1993: 22); García-Garza y de León-González (2011: 21). Comentario: Blake (2009) la restringe al Ártico y Subártico.
Género Dasybranchus Grube, 1850
Q Dasybranchus caducus (Grube, 1846). LT: Mediterráneo. Registros: Steinbeck y Ricketts (1941: 364); Rioja (1947a: 523).
Dasybranchus glabrus Moore, 1909. LT: San Diego, California. Registros: García-Garza y de León-González (2011: 23).
Dasybranchus parplatyceps Kudenov, 1975, LT: Puerto Peñasco, golfo de California. Registros: García-Garza (2011: 24-25).
Género Leiocapitella Hartman, 1947
Leiocapitella glabra Hartman, 1947. LT: isla Cedros, Baja California. Registros: Hernández-Alcántara et al. (2003: 4).
Género Mediomastus Hartman, 1944
Mediomastus californiensis Hartman, 1944. LT: California. Registros: García-Garza y de León-González (2011: 31-32).
Género Notodasus Fauchald, 1972
*Notodasus harrisae García-Garza, Hernández-Valdez y de León-González, 2009. LT: playa El Tesoro, 1 m. Registros: García-Garza y de León-González (2011: 35-36).
Género Notomastus Sars, 1851
*Notomastus fauchaldi García-Garza y de León-González, 2015. LT: ensenada de la Paz (24º07’37.7” N, 110º25’10.6” O), sustrato blando, 20 m. Registros: no.
NIS? Notomastus hemipodus Hartman, 1945. LT: Beaufort, Carolina del Norte. Registros: García-Garza y de León-González (2011: 40-41). Comentario: García-Garza y de León-González (2011) revisaron el holotipo y los ejemplares de La Paz son morfológicamente similares a N. hemipodus. Debido a la simplicidad del cuerpo de los capitélidos, es difícil reconocer los límites de las especies. El uso de herramientas moleculares en Capitellidae está ayudando a aclarar la distribución de las especies, ver Silva et al. (2017).
Notomastus landini García-Garza y de León-González, 2015. LT: bahía Concepción, golfo de California. Registros: García-Garza y de León-González (2015: 178-181).
Q Notomastus lineatus Claparède, 1870. LT: golfo de Nápoles. Registros: Bastida-Zavala (1993: 22).
*Notomastus lobatus Hartman, 1947. LT: isla Espíritu Santo, 29 m. Registros: Hernández-Alcántara et al. (2003: 4).
Notomastus magnus Hartman, 1947. LT: Tomales Bay, California. Registros: Hernández-Alcántara et al. (2017: 1042).
NIS? Notomastus polyodon Gallardo, 1968. LT: Vietnam. Registros: García-Garza y de León-González (2011: 43). Comentario: García-Garza y de León-González (2011) revisaron el holotipo y los ejemplares de La Paz son morfológicamente similares a N. polyodon.
Notomastus tenuis Moore, 1909. LT: San Diego, California. Registros: Rioja (1963: 195-196).
Género Scyphoproctus Gravier, 1904
Scyphoproctus oculatus Reish, 1959. LT: California. Registros: García-Garza y de León-González (2011: 46).
Familia Chaetopteridae Audouin y Milne-Edwards, 1833
Género Chaetopterus Cuvier, 1830
Q Chaetopterus variopedatus (Renier, 1804). LT: Mediterráneo. Registros: Rioja (1947a: 523); Bastida-Zavala (1993: 21).
Género Phyllochaetopterus Grube, 1863
Phyllochaetopterus prolifica Potts, 1914. LT: Washington State. Registros: Rioja (1963: 189).
Género Spiochaetopterus Sars, 1853
Q Spiochaetopterum costarum (Claparède, 1869). LT: golfo de Nápoles. Registros: Rioja (1963: 188-189, como Telepsavus).
Familia Chrysopetalidae Ehlers, 1864
Género Bhawania Schmarda, 1861
Q Bhawania goodei Webster, 1884. LT: Bermuda. Registros: Bastida-Zavala (1993: 25). Comentario: ver Cruz-Gómez y Bastida-Zavala (2018).
Bhawania riveti (Gravier, 1908). LT: Payta, Perú. Registros: Steinbeck y Ricketts (1941: 357-358).
Género Paleanotus Schmarda, 1861
Q Paleanotus chrysolepis Schmarda, 1861. LT: Sudáfrica. Registros: Rioja (1947b: 201).
*Paleanotus purpurea Rioja, 1947a. LT: El Mogote, en conchas de Pinna. Registros: no.
Familia Cirratulidae Ryckholt, 1851
Género Aphelochaeta Blake, 1991
Aphelochaeta williamsae Blake, 1996. LT: puerto de San Luis, Santa Maria, California. Registros: Cuéllar-Mercado et al. (2019: 4).
Género Caulleriella Chamberlin, 1919
Q Caulleriella hamata (Hartman, 1948). LT: Alaska. Registros: Bastida-Zavala (1993: 21). Comentario: Dean y Blake (2007) describieron 5 nuevas species de Caulleriella para el Pacífico de Costa Rica. Es probable que el taxón reportado en La Paz corresponda a una de las especies de estos autores más que a la de Alaska.
Género Cirratulus Lamarck, 1818
Cirratulus cingulatus Johnson, 1901. LT: Puget Sound, Washington. Registros: Rioja (1963: 189); Hernández-Alcántara et al. (2003: 10).
Q Cirratulus cirratus (O. F. Müller, 1776). LT: Groenlandia. Registros: Rioja (1963: 189); Bastida-Zavala (1993: 21).
Género Cirriformia Hartman, 1936
Cirriformia spirabranchia (Moore, 1904). LT: Puget Sound, Washington. Registros: Rioja (1963: 190, como spirobrancha (sic)); Bastida-Zavala (1993: 21).
Q Cirriformia tentaculata (Montagu, 1808). LT: Inglaterra. Registros: Bastida-Zavala (1993: 21).
Género Dodecaceria Örsted, 1843
Q Dodecaceria concharum Örsted, 1843. LT: Dinamarca. Registros: Bastida-Zavala (1993: 22).
Género Timarete Kinberg, 1866
Timarete luxuriosa (Moore, 1904). LT: San Diego, California. Registros: Rioja (1963: 190, como Cirriformia).
Familia Ctenodrilidae Kennel, 1882
Género Ctenodrilus Claparède, 1863
Q Ctenodrilus serratus (Schmidt, 1857). LT: Mediterráneo. Registros: Bastida-Zavala (1994: 738-739).
Familia Dorvilleidae Chamberlin, 1919
Género Dorvillea Parfitt, 1866
Q Dorvillea cerasina (Ehlers, 1901). LT: San Juan Fernández, Chile. Registros: Hernández-Alcántara et al. (2003: 5).
Dorvillea moniloceras (Moore, 1909). LT: Monterey Bay, California. Registros: Bastida-Zavala (1993: 31-32).
Q Dorvillea pseudorubrovittata Berkeley, 1927. LT: Vancouver. Registros: Rioja (1963: 182).
Dorvillea vittata (Grube, 1856). LT: Puntarenas, Costa Rica. Registros: Bastida-Zavala (1993: 32).
Género Schistomeringos Jumars, 1974
Q Schistomeringos longicornis (Ehlers, 1901). LT: estrecho de Magallanes. Registros: Rioja (1963: 181, como Dorvillea articulata).
Q Schistomeringos rudolphi (Delle Chiaje, 1828). LT: golfo de Nápoles. Registros: Rioja (1947: 205, como Dorvillea articulata).
Familia Eunicidae Berthold, 1827
Género Eunice Cuvier, 1817
Q Eunice aphroditois (Pallas, 1788). LT: Sri Lanka. Registros: Hernández-Alcántara et al. (2003: 5, como Eunice).
Eunice biannulata Moore, 1904. LT: San Diego, California. Registros: Hernández-Alcántara et al. (2003: 5).
Eunice cedroensis Fauchald, 1970. LT: Pacífico mexicano. Registros: Cuéllar-Mercado et al. (2019: 4).
Q Eunice petersi Fauchald, 1992. LT: Mozambique. Registros: Rioja (1963: 174, como Eunice afra).
Eunice reducta Fauchald, 1970. LT: bahía de los Frailes, golfo de California. Registros: Hernández-Alcántara et al. (2003: 5).
Q Eunice vittata (Delle Chiaje, 1828). LT: golfo de Nápoles. Registros: Rioja (1947b: 204).
Eunice vittatopsis Fauchald, 1970. LT: Pacífico mexicano. Registros: Cuéllar-Mercado et al. (2019: 4).
Q Eunice websteri Fauchald, 1969. LT: Bermuda. Registros: Berkeley y Berkeley (1939: 335-336, como E. longocirrata); Hartman (1944a: 14-15, 104-107, como E. longocirrata); Rioja (1963: 172-173, como E. longocirrata).
Género Leodice Lamarck, 1818
Q Leodice antennata Savigny en Lamarck, 1818. LT: Egipto. Registros: Hartman (1944a: 115-117, como Eunice); Rioja (1963: 174-175, como Eunice); Bastida-Zavala (1993: 30, como Eunice); Hernández-Alcántara et al. (2003: 5, como Eunice).
Género Marphysa de Quatrefages, 1865
Q Marphysa aenea (Blanchard en Gay, 1849). LT: Chiloé, Chile. Registros: Steinbeck y Ricketts (1941: 362); Hernández-Alcántara et al. (2003: 5).
Marphysa mortenseni Monro, 1928. LT: Panamá, Pacífico. Registros: Berkeley y Berkeley (1939: 339); Hernández-Alcántara et al. (2003: 5).
Q Marphysa sanguinea (Montagu, 1815). LT: Inglaterra. Registros: Rioja (1947a: 519-521); Rioja (1963: 179); Hernández-Alcántara et al. (2003: 5). Comentario: Ver Hutchings y Karageorgopoulus (2003), Molina-Acevedo y Carrera-Parra (2015, 2017)
Marphysa stylobranchiata Moore, 1909. LT: Monterey Bay, California. Registros: Rioja (1947b: 204).
Género Nicidion Kinberg, 1865
Q Nicidion cariboea (Grube, 1856). LT: Caribe. Registros: Rioja (1963: 178, como Eunice); Bastida-Zavala (1993: 30-31, como Eunice); Hernández-Alcántara et al. (2003: 5, como Eunice).
Género Palola Gray, 1847
Palola paloloides (Moore, 1909). LT: San Diego, California. Registros: Rioja (1947b: 204).
Q Palola siciliensis Grube, 1840. LT: Mediterráneo. Registros: Bastida-Zavala (1993: 31).
Familia Euphrosinidae Williams, 1851
Género Euphrosine Lamarck, 1818
Euphrosine aurantiaca Johnson, 1897. LT: San Pedro, California. Registros: Rioja (1947b: 202, como Euphrosyne (sic)).
Q Euphrosine bicirrata Moore, 1905, LT: Columbia Británica y Alaska. Registros: Hartman (1940: 185, 210-211); Hernández-Alcántara et al. (2003: 5).
Familia Flabelligeridae de Saint-Joseph, 1894
Género Pherusa Oken, 1807
Pherusa neopapillata Hartman, 1961. LT: California. Registros: Rioja (1963: 190-191).
Q Pherusa papillata (Johnson, 1901). LT: Puget Sound, Washington. Registros: Steinbeck y Ricketts (1941: 364); Rioja (1947b: 208-209, como Stylarioides). Comentario: Salazar-Vallejo (2015) revisó el material tipo. La especie se distribuye desde la Columbia Británica hasta California.
Q Pherusa plumosa (Müller, 1776). LT: Groenlandia. Registros: Rioja (1947a: 523, como Stylarioides Delle Chiaje, 1831). Comentario: Salazar-Vallejo (2015) establece un neotipo y la restringe al Ártico.
Género Piromis Kinberg, 1867
Piromis brisegnoi Salazar-Vallejo, 2011. LT: puerto Refugio, golfo de California. Registros: Salazar-Vallejo (2011: 12-14).
Q Piromis eruca (Claparède, 1869). LT: golfo de Nápoles. Registros: Rioja (1947a: 523, como Stylarioides). Comentario: Salazar-Vallejo (2011) designó un neotipo y paraneotipo y menciona que los registros de la especie fuera del Mediterráneo son cuestionables.
Género Semiodera Chamberlin, 1919
Semiodera glynni Salazar-Vallejo, 2012. LT: Panamá, Pacífico. Registros: Salazar-Vallejo (2012: 21-23).
Semiodera inflata (Treadwell, 1914). LT: California. Registros: Bastida-Zavala (1993: 32, como Pherusa).
*Semiodera tovarae Salazar-Vallejo, 2012. LT: El Caimancito, 24º08’32” N, 110º18’39” O, 1.5 m. Registros: no.
Género Throphoniella Hartman, 1959
Trophoniella americana (Monro, 1928). LT: Panamá, Pacífico. Registros: Salazar-Vallejo (2012: 464-467).
Familia Glyceridae Grube, 1850
Género Glycera Lamarck, 1818
Q Glycera americana Leidy, 1855. LT: Rhode Island. Registros: Hernández-Alcántara et al. (2003: 7).
Q Glycera dibranchiata Ehlers, 1868. LT: Massachussetts. Registros: Steinbeck y Ricketts (1940: 361); Fauvel (1943: 16-17).
Q Glycera lapidum de Quatrefages, 1866. LT: Inglaterra. Registros: Hernández-Alcántara et al. (2017: 1042).
Q Glycera tesselata Grube, 1863. LT: Mediterráneo. Registros: Hartman (1940: 184, 247); Rioja (1947b: 204); Bastida-Zavala (1993: 30); Hernández-Alcántara et al. (2003: 7).
Familia Goniadidae Kinberg, 1866
Género Goniada Audouin y Milne-Edwards, 1833
Goniada acicula Hartman, 1940. LT: isla Angel de la Guarda, golfo de California. Registros: Hernández-Alcántara et al. (2003: 7, como aciculata (sic)).
Familia Hesionidae Grube, 1850
Género Hesione Savigny, 1818
Q Hesione genetta Grube, 1866. LT: Samoa. Registros: Fauvel (1943: 9).
Hesione hartmanae Salazar-Vallejo, 2018. LT: Galápagos. Registros: Hartman (1940: 183, 212, como Hesione intertexta).
Q Hesione intertexta Grube, 1878. LT: Filipinas. Registros: Berkeley y Berkeley (1939: 333); Rioja (1947b: 202, como Hesiones); Bastida-Zavala (1993: 25-26); Hernández-Alcántara et al. (2003: 7). Comentario: Pudiera ser Hesione panamena, ver Salazar-Vallejo (2018).
Hesione panamena Chamberlin, 1919. LT: Panamá, isla Perico. Registros: Salazar-Vallejo (2018: 279-283).
Género Leocrates Kinberg, 1866
Q Leocrates chinensis Kinberg, 1866. LT: China. Registros: Hartman (1940: 183, 212-213); Rioja (1963: 162); Hernández-Alcántara et al. (2003: 7).
Género Oxydromus Grube, 1855
Oxydromus minutus (Hartmann-Schröder, 1959). LT: El Salvador. Registros: Cuéllar-Mercado et al. (2019: 4).
Oxydromus pugettensis (Johnson, 1901). LT: Puget Sound, Washington. Registros: Rioja (1963: 161, como Ophiodromus); Hernández-Alcántara et al. (2003: 7, como Ophiodromus).
Familia Lumbrineridae Schmarda, 1861
Género Lumbrineris de Blainville, 1828
Q Lumbrineris bifilaris (Ehlers, 1901). LT: sur de Chile. Registros: Rioja (1967b: 205).
Lumbrineris cruzensis Hartman, 1944a. LT: Santa Cruz, California. Registros: Rioja (1963: 180-181, como crucensis (sic)); Hernández-Alcántara et al. (2003: 5).
Lumbrineris erecta (Moore, 1904). LT: California. Registros: Hartman (1944a); Rioja (1963: 179-180, como Lumbrinereis (sic)); Hernández-Alcántara et al. (2003: 5).
Lumbrineris inflata Moore, 1911. LT: Monterey Bay, California. Registros: Bastida-Zavala (1993: 31).
Q Lumbrineris japonica von Marenzeller, 1879. LT: Japón. Registros: Bastida-Zavala (1993: 31).
Q Lumbrineris latreilli Audouin y Milne Edwards, 1834. LT: Frisian Fort, Mar del Norte. Registros: Rioja (1947a: 521).
Lumbrineris limicola Hartman, 1944a. LT: Point Fermin, California. Registros: Bastida-Zavala (1993: 31).
Género Ninoe Kinberg, 1865
Ninoe marthae Hernández-Alcántara, Pérez-Mendoza y Solís-Weiss, 2006. LT: sur del golfo de California. Registros: Cuéllar-Mercado et al. (2019: 4).
Género Scoletoma de Blainville, 1828
Scoletoma crassidentata LT: golfo de California. Registros: Cuéllar-Mercado et al. (2019: 4).
Q Scoletoma tetraura (Schmarda, 1861). LT: Saint Lawrence Gulf, Canadá. Registros: Hernández-Alcántara et al. (2003: 5).
Scoletoma zonata (Johnson, 1901). LT: Washington State. Registros: Bastida-Zavala (1993: 31, como Lumbrineris); Hernández-Alcántara et al. (2017: 1043).
Familia Maldanidae Malmgren, 1867
Género Heteroclymene Arwidsson, 1907
Heteroclymene glabra Moore, 1923. LT: San Diego, California. Registros: Bastida-Zavala (1993: 22).
Género Isocirrus Arwidsson, 1907
Isocirrus papillatus (Berkeley y Berkeley, 1939). LT: Puerto Peñasco, golfo de California. Registros: Rioja (1947b: 209, como Clymene), Bastida-Zavala (1993: 23).
Familia Nephtyidae Grube, 1850
Género Aglaophamus Kinberg, 1866
Q Aglaophamus dibranchis (Grube, 1877). LT: Filipinas. Registros: Hartman (1940: 183, 237); Hernández-Alcántara et al. (2003: 7).
Q Aglaophamus verrilli (McIntosh, 1855). LT: Nueva Zelanda. Registros: Hernández-Alcántara et al. (2003: 7, 2017); Cuéllar-Mercado et al. (2019: 4).
Género Inermonephtys Fauchald, 1968
Q Inermonephtys inermis (Ehlers, 1887). LT: Florida. Registros: Hartman (1940: 186, 234); Rioja (1963: 167-169, como Aglaophamus); Hernández-Alcántara et al. (2003: 7).
Género Nephtys Cuvier, 1817
Nephtys californiensis Hartman, 1938. LT: California. Registros: Bastida-Zavala (1993: 30).
Q Nephtys magellanica Augener, 1912. LT: estrecho de Magallanes. Registros: Hartman (1940: 184, 238).
Nephtys panamensis Monro, 1928. LT: islas Rey y Perlas, Panamá. Registros: Hernández-Alcántara et al. (2003: 7).
Q Nephtys simoni Perkins, 1980. LT: Florida. Registros: Hernández-Alcántara et al. (2003: 7, como sioni ((sic)).
Q Nephtys squamosa Ehlers, 1887. LT: Florida y Caribe. Registros: Hartman (1940: 186, 237-238); Hernández-Alcántara et al. (2003: 8).
Familia Nereididae de Blainville, 1818
Género Alitta Kinberg, 1866
Q Alitta succinea (Leuckart, 1847). LT: Helgoland, Alemania. Registros: Bastida-Zavala (1993: 29, como Neanthes). Comentario: Podría ser Alitta acutifolia, ver Villalobos-Guerrero y Carrera-Parra (2015).
Género Ceratocephale Malmgren, 1867
Ceratocephale papillata de León-González y Góngora-Garza, 1992. LT: costa oeste de Baja California Sur. Registros: Cuéllar-Mercado et al. (2019: 4).
Género Ceratonereis Kinberg, 1866
Ceratonereis singularis Treadwell, 1929. LT: isla San José, golfo de California. Registros: Bastida-Zavala (1993: 29).
Ceratonereis tentaculata Kinberg, 1866. LT: Hawaii. Registros: Hartman (1940: 184-186, 218); Rioja (1947b: 203); Hernández-Alcántara et al. (2003: 8).
Género Cheilonereis Benham, 1916
Cheilonereis cyclurus (Harrington, 1897). LT: Puget Sound, Washington. Registros: Salazar-Vallejo et al. (1987: 33).
Género Namanereis Chamberlin, 1919
*Namanereis riojai (Bastida-Zavala, 1991). LT: isla El Pardito, en playa arenosa. Registros: Bastida-Zavala (1991: 417, como Lycastopsis riojai).
Género Neanthes Kinberg, 1866
Q Neanthes acuminata (Ehlers, 1868). LT: golfo de Nápoles. Registros: Rioja (1963: 166, como Neanthes caudata (Delle Chiaje)); Bastida-Zavala (1993: 29, como Neanthes caudata (Delle Chiaje)); Hernández-Alcántara et al. (2003: 8, como Neanthes caudata (Delle Chiaje)).
Q Neanthes unifasciata Willey, 1905. LT: Gulf of Mannar. Registros: Bastida-Zavala (1993: 29).
Género Nereis Linnaeus, 1758
Nereis callaona Grube y Krøyer, 1858. LT: Perú. Registros: Hernández-Alcántara et al. (2003: 8).
Q Nereis grubei (Kinberg, 1866). LT: Chile, sur. Registros: Rioja (1963: 164-165).
Q Nereis occidentalis Hartman, 1945. LT: Carolina del Norte. Registros: Bastida-Zavala (1993: 29-30).
Q Nereis oligohalina (Rioja, 1946). LT: Veracruz, golfo de México. Registros: Berkeley y Berkeley (1960: 359); Rioja (1963: 165-166, como Neanthes). Comentario: ver Conde-Vela y Salazar-Vallejo (2015).
Q Nereis rava Ehlers, 1864. LT: Mediterráneo, Italia. Registros: Berkeley y Berkeley (1939: 333); Hernández-Alcántara et al. (2003: 8).
Q Nereis riisei Grube, 1857. LT: Caribe. Registros: Hartman (1940: 186, 221-222).
Género Perinereis Kinberg, 1866
*Perinereis bajacalifornica de León-González y Solís-Weiss, 1998. LT: bahía Falsa, en mangle. Registros: no.
Perinereis elenacasoae Rioja, 1947. LT: Mazatlán, golfo de California. Registros: de León-González y Solís-Weiss (1998: 680).
Género Platynereis Kinberg, 1866
Platynereis bicanaliculata (Baird, 1863). LT: Canadá, Pacífico. Registros: Rioja (1963: 167); Hernández-Alcántara et al. (2003: 8).
Q Platynereis dumerilii (Audouin y Milne-Edwards, 1833). LT: La Rochelle, Francia. Registros: Bastida-Zavala (1993: 30).
Q Platynereis polyscalma Chamberlin, 1919. LT: islas Ellice, Polinesia. Registros: Hartman (1940: 183, 186, 229-231); Rioja (1963: 167); Bastida-Zavala (1993: 30); Hernández-Alcántara et al. (2003: 8).
Género Pseudonereis Kinberg, 1866
Pseudonereis gallapagensis Kinberg, 1866. LT: Galápagos. Registros: Bastida-Zavala (1993: 30).
Pseudonereis variegata (Grube, 1857). LT: Callao, Perú. Registros: Bastida-Zavala (1993: 30).
Género Websterinereis Pettibone, 1971
*Websterinereis pettiboneae de León-González y Balart (2016: 17-21). LT: canal de San Lorenzo. Registros: no.
Familia Oenonidae Kinberg, 1865
Género Arabella Grube, 1850
Q Arabella iricolor (Montagu, 1804). LT: Inglaterra. Registros: Rioja (1947b: 205); Bastida-Zavala (1993: 31).
Q Arabella mutans (Chamberlin, 1919). LT: isla de Pascua, Chile. Registros: Bastida-Zavala (1993: 31).
Arabella semimaculata (Moore, 1911). LT: Monterey Bay, California. Registros: Rioja (1947a: 521).
Género Drilonereis Claparède, 1870
Drilonereis falcata Moore, 1911. LT: California. Registros: Hernández-Alcántara et al. (2003: 5).
Género Oenone Lamarck, 1818
Q Oenone fulgida (Savigny en Lamarck, 1818). LT: Mar Rojo. Registros: Hernández-Alcántara et al. (2003: 5).
Familia Onuphidae Kinberg, 1865
Género Diopatra Audouin y Milne Edwards, 1833
Diopatra farallonensis Fauchald, 1968. LT: golfo de California. Registros: Cuéllar-Mercado et al. (2019: 4).
Diopatra neotridens Hartman, 1944a. LT: Baja California. Registros: Cuéllar-Mercado et al. (2019: 4).
Diopatra papillata Fauchald, 1968. LT: golfo de California. Registros: Cuéllar-Mercado et al. (2019: 4).
Diopatra splendidissima Kinberg, 1865. LT: Ecuador. Registros: Rioja (1947b: 204); Cuéllar-Mercado et al. (2019: 4).
Diopatra tridentata Hartman, 1944a. LT: Huntington Beach, California. Registros: Rioja (1947a: 519).
Género Kinbergonuphis Fauchald, 1982
Kinbergonuphis cedroensis (Fauchald, 1968). LT: isla Cedros, golfo de California. Registros: Cuéllar-Mercado et al. (2019: 4).
Kinbergonuphis pigmentata (Fauchald, 1968). LT: bahía San Quintin. Registros: Cuéllar-Mercado et al. (2019: 4).
Género Hirsutonuphis Paxton, 1986
Hirsutonuphis zebra (Berkeley y Berkeley, 1939). LT: Baja California. Registros: Rioja (1947b: 204).
Género Hyalinoecia Malmgren, 1867
Hyalinoecia juvenalis Moore, 1911. LT: Santa Rosa, California. Registros: Rioja (1947a: 519; 1963: 171-172); Hernández-Alcántara et al. (2003: 6).
Género Mooreonuphis Fauchald, 1982
Mooreonuphis cirrata (Hartman, 1944a). LT: La Plata, Ecuador. Registros: Rioja (1963: 171, como Onuphis (Nothria) stigmatis cirrata).
Mooreonuphis nebulosa (Moore, 1911). LT: Monterey Bay, California. Registros: Rioja (1963: 169-171, como Onuphis).
Género Nothria Malmgren, 1866
Q Nothria conchylega (Sars, 1865). LT: Zona Económica Exclusiva de Noruega. Registros: Cuéllar-Mercado et al. (2019: 4). Comentario: Podría tratarse de Nothria conchylega occidentalis Fauchald, 1968, descrita para el Pacífico mexicano.
Nothria occidentalis Fauchald, 1968. LT: Pacífico mexicano. Registros: Cuéllar-Mercado et al. (2019: 4).
Género Paradiopatra Ehlers, 1887
Q Paradiopatra abyssalis (Imajima, 1999). LT: Tosa Bay, Japón. Registros: Cuéllar-Mercado et al. (2019: 4).
Familia Opheliidae Malmgren, 1867
Género Armandia Filippi, 1861
Q Armandia brevis (Moore, 1906). LT: Chukchi Sea, Alaska. Registros: Bastida-Zavala (1993: 23).
Género Ophelina Örsted, 1843
Q Ophelina acuminata Örsted, 1843. LT: Dinamarca. Rioja (1947b: 208, como Ammotrypane aulogaster).
Q Ophelina cylindricaudata (Hansen, 1879). LT: Noruega. Registros: Bastida-Zavala (1993: 23).
Género Polyophthalmus de Quatrefages, 1850
Q Polyophthalmus pictus (Dujardin, 1839). LT: Francia. Registros: Rioja (1947b: 208; 1963: 195); Bastida-Zavala (1993: 23).
Familia Orbiniidae Hartman, 1942
Género Naineris de Blainville, 1828
Q Naineris laevigata (Grube 1855). LT: Mediterráneo. Registros: Rioja (1947a: 521; 1963: 184).
Género Phylo Kinberg, 1866
Q Phylo felix Kinberg, 1866. LT: Brasil. Registros: Hartman (1957: 263-265).
Género Scoloplos de Blainville, 1828
Scoloplos mazatlanensis Fauchald, 1972. LT: Mazatlán, golfo de California. Registros: Bastida-Zavala (1993: 21).
Familia Oweniidae Rioja, 1917
Género Owenia Delle Chiaje, 1844
Q Owenia fusiformis Delle Chiaje 1844. LT: Sicilia, Mediterráneo. Registros: Steinbeck y Ricketts (1941: 365).
Familia Paraonidae Cerruti, 1909
Género Aricidea Webster, 1879
Q Aricidea cf. suecica Elliason, 1920. LT: Öresund, Mar Báltico. Registros: Hartman (1957: 319-320).
Q Aricidea (Acmira) simplex Day, 1963. LT: Cape Town, Sudáfrica. Registros: Cuéllar-Mercado et al. (2019: 4).
Género Cirrophorus Ehlers, 1908
Cirrophorus furcatus (Hartman, 1957). LT: California. Registros: Hernández-Alcántara et al. (2017: 1043); Cuéllar-Mercado et al. (2019: 4).
Género Levinsenia Mesnil, 1897
Q Levinsenia gracilis (Tauber, 1879). LT: Zona Económica Exclusiva Danesa. Registros: Cuéllar-Mercado et al. (2019: 4).
Levinsenia oculata (Hartman, 1957). LT: sur del golfo de California. Registros: Cuéllar-Mercado et al. (2019: 4).
Familia Pectinariidae de Quatrefages, 1866
Género Amphictene Savigny, 1822
Q Amphictene auricoma (O. F. Müller, 1776). LT: Dinamarca. Registros: Rioja (1947a: 523, 1963: 202, como Pectinaria); Hernández-Alcántara et al. (2003: 10).
Familia Phyllodocidae Örsted, 1843
Género Eulalia Savigny, 1822
Q Eulalia myriacyclum (Schmarda, 1861). LT: Antillas. Registros: Rioja (1963: 159).
Género Eumida Malmgren, 1865
Q Eumida sanguinea (Örsted, 1843). LT: Dinamarca. Registros: Rioja (1947b: 202; 1963: 160); Bastida-Zavala (1993: 23).
Género Nereiphylla de Blainville, 1828
Q Nereiphylla castanea (von Marenzeller, 1879). LT: Japón. Registros: Bastida-Zavala (1993: 23-24, como Genetyllis).
Género Phyllodoce Savigny, 1818
Q Phyllodoce madeirensis Langerhans, 1880. LT: Madeira. Registros: Rioja (1963: 159); Bastida-Zavala (1993: 23, como Anaitides).
Familia Pilargidae de Saint-Joseph, 1899
Género Sigambra Müller, 1858
Q Sigambra bassi (Hartman, 1945). LT: Carolina del Norte. Registros: Salazar-Vallejo (1987: 200).
Familia Polynoidae Kinberg, 1856
Género Chaetacanthus Seidler, 1922
Q Chaetacanthus magnificus (Grube, 1875). LT: Trinidad y Tobago. Registros: Hernández-Alcántara et al. (2003: 6).
Chaetacanthus pilosus (Treadwell, 1937). LT: banco Arena, Pacífico mexicano. Registros: Berkeley y Berkeley (1939: 325-326, como Lepidonotus).
Género Halosydna Kinberg, 1856
Halosydna hartmanae (Kudenov, 1975). LT: Puerto Peñasco, golfo de California. Registros: Bastida-Zavala (1993: 24-25, como Malmgrenia).
Q Halodsydna johnsoni (Darboux, 1899). LT: Pacific Grove, California. Registros: Rioja (1963: 146, como Hatosydna johnstoni (sic sic)). Comentario: Polynoe reticulata Johnson, 1897, era un nombre pre-ocupado, que fue renombrado como Lepidonotus johnsoni por Darboux (1899). Ver Salazar-Silva (2013), quien revisó el material tipo.
Género Harmothoe Kinberg, 1856
Harmothoe exanthema (Grube, 1856). LT: Valparaíso, Chile. Registros: Hernández-Alcántara et al. (2003: 6).
Harmothoe hirsuta Johnson, 1897. LT: San Pedro, California. Registros: Rioja (1947b, 200-201); Bastida-Zavala (1993: 24).
Q Harmothoe imbricata (Linnaeus, 1767). LT: Islandia. Registros: Bastida-Zavala (1993: 24).
Género Hololepida Moore, 1905
Hololepida veleronis Hartman, 1939. LT: isla Angel de la Guarda, golfo de California. Registros: Hartman (1939: 8).
Género Iphione Kinberg, 1856
Iphione ovata Kinberg, 1856. LT: Hawaii. Registros: Hartman (1939: 7-8); Rioja (1963: 137-141); Hernández-Alcántara et al. (2003: 6).
Género Lepidasthenia Malmgren, 1867
*Lepidasthenia digueti Gravier, 1905. LT: La Paz, comensal de balanogloso. Registros: no.
Género Lepidonotus Leach, 1816
Q Lepidonotus caelorus Moore, 1903. LT: Sagami Bay, Japón. Registros: Rioja (1947b: 199-200).
Q Lepidonotus hupferi Augener, 1918. LT: África occidental. Registros: Rioja (1963: 141); Bastida-Zavala (1993: 24); Hernández-Alcántara et al. (2003: 6).
Lepidonotus nesophilus Chamberlin, 1919. LT: Galápagos. Registros: Rioja (1963: 141).
Q Lepidonotus squamatus (Linnaeus, 1758). LT: Europa occidental. Registros: Bastida-Zavala (1993: 24).
Género Malmgrenia McIntosh, 1875
Q Malmgrenia lunulata (delle Chiaje, 1830). LT: golfo de Nápoles. Registros: Bastida-Zavala (1993: 24, como Harmothoe).
Género Malmgreniella Hartman, 1967
Malmgreniella pacifica (Monro, 1928). LT: Galápagos. Registros: Bastida-Zavala (1993: 24, como Harmothoe lunulata).
Género Thormora Baird, 1865
Thormora johnstoni (Kinberg, 1856). LT: Panamá, Pacífico. Registros: Hartman (1939: 8-9); Rioja (1947b: 199-200); Bastida-Zavala (1993: 25); Hernández-Alcántara et al. (2003: 6).
Q Thormora versicolor (Ehlers, 1901). LT: Juan Fernández, Chile. Registros: Hartman (1939: 8).
Familia Sabellariidae Johnston, 1865
Género Idanthyrsus Kinberg, 1867
Q Idanthyrsus pennatus (Peters, 1854). LT: Mozambique. Registros: Bastida-Zavala (1993: 32).
Familia Sabellidae Latreille, 1825
Género Acromegalomma Gil y Nishi, 2017
Acromegalomma carunculatum (Tovar-Hernández y Salazar-Vallejo, 2008). LT: Acapulco, Guerrero. Registros: Bastida-Zavala et al. (2016: 407, como Megalomma).
Acromegalomma circumspectum (Moore, 1923). LT: San Rosa, California. Registros: Rioja (1963: 213-216, como Megalomma); Tovar-Hernández y Carrera-Parra (2011); este estudio.
Acromegalomma coloratum (Chamberlin, 1919). LT: Laguna Beach, California. Registros: Tovar-Hernández y Carrera-Parra (2011).
Q Acromegalomma mushaense (Gravier, 1906). LT: golfos de Tadjoura y Aden. Registros: Steinbeck y Ricketts (1941: 366); Rioja (1947b: 214-215, como Megalomma); Bastida-Zavala (1993: 34, como Megalomma). Comentario: Podría tratarse de A. coloratum, ver Tovar-Hernández y Carrera-Parra (2011).
Q Acromegalomma splendidum (Moore, 1905). LT: Alexander Archipelago, Alaska. Registros: Rioja (1963: 212-213, como Megalomma); Bastida-Zavala (1993: 34, como Megalomma).
Género Amphicorina Claparède, 1864
Q Amphicorina armandi (Claparède, 1864). TL: Port-Vendres, Francia. Registros: Rioja (1947b: 213, como Oridia).
Género Branchiomma Kölliker, 1859
NIS Branchiomma bairdi (McIntosh, 1885). LT: Bermuda. Registros: Tovar-Hernández et al. (2012: 10-11; 2014b: 390); Bastida-Zavala et al. (2016: 406-407).
NIS? Branchiomma cingulatum (Grube, 1870). LT: Filipinas. Registros: Bastida-Zavala (1993: 34). Comentario: El género Branchiomma tiene varias representantes invasoras (Keppel et al. 2015), aparentemente la especie es una de ellas. Actualmente se hace un estudio molecular a nivel mundial (Capa et al. en proceso) que podría confirmar su estatus.
Branchiomma coheni Tovar-Hernández y Knight-Jones, 2006. LT: Naos, Panamá. Registros: Keppel et al. (2015: 5-7).
NIS? Branchiomma nigromaculatum (Baird, 1865). LT: Saint Vincent, Antillas. Registros: Salazar-Vallejo et al. (1987: 34); Bastida-Zavala (1993: 34). Comentario: El género Branchiomma tiene varias representantes invasoras (Keppel et al. 2015), aparentemente la especie es una de ellas. Actualmente se hace un estudio molecular a nivel mundial (Capa et al. en proceso) que podría confirmar su estatus.
Género Chone Krøyer, 1856
Chone ecaudata (Moore, 1923). LT: Santa Cruz, California. Registros: Rioja (1963: 218-220; 1967b: 213, en ambos como Chone minuta).
Q Chone fauveli McIntosh, 1916. LT: Inglaterra. Registros: Berkeley y Berkeley (1939: 343, como Chone infundibuliformis var. fauveli).
Q Chone infundibuliformis Krøyer, 1856. LT: Groenlandia. Registros: Rioja (1963: 216-217); Hernández-Alcántara et al. (2003: 9). Comentario: Tovar-Hernández y Sosa-Rodríguez (2006) restringieron su distribución para el Ártico.
Chone mollis (Bush en Moore, 1905). LT: California. Registros: Rioja (1963: 217-218); Hernández-Alcántara et al. (2003: 9).
Género Eudistylia Bush, 1905
Eudistylia polymorpha (Johnson, 1901). LT: Pacific Grove, California. Registros: Bastida-Zavala (1993: 34).
Género Notaulax Tauber, 1879
Q Notaulax occidentalis (Baird, 1865). LT: Saint Vincent, Caribe. Registros: Hernández-Alcántara et al. (2003: 9).
Q Notaulax phaeotaenia (Schmarda, 1861). LT: Sri Lanka. Registros: Rioja (1947b: 215; 1963: 211-212, en ambos como Hypsicomus).
Género Parasabella Bush, 1905
Parasabella pallida Moore, 1923. LT: Santa Cruz, California. Registros: este estudio.
Género Paradialychone Tovar-Hernández, 2008
Paradialychone paramollis (Tovar-Hernández, 2007). LT: Tomales Bay, California. Registros: Tovar-Hernández (2007: 542-545, como Chone).
Género Pseudobranchiomma Jones, 1962
*Pseudobranchiomma schizogenica Tovar-Hernández y Dean, 2014. LT: Club de Yates Palmira, 24º10.992’ N, 110º18.185’ O, incrustante en muelles flotantes, 50 cm. Registros: este estudio.
NIS? Pseudobranchiomma punctata (Treadwell, 1906). LT: Hawaii. Registros: Bastida-Zavala et al. (2016: 408). Comentario: 2 posibilidades: el registro pudiera ser erróneo y corresponder a Pseudobranchiomma schizogenica, una especie descrita 3 años antes por Tovar-Hernández y Dean (2014) para la misma marina. Capa y Murray (2016) con estudios de ADN demostraron la presencia de una especie introducida en Australia y en Hawaii, referida como “P. cf. P. schizogenica”, que quizá pueda tratarse de P. punctata y tal vez el registro de La Paz sea correcto.
Género Pseudopotamilla Bush, 1905
Q Pseudopotamilla intermedia Moore, 1905. LT: Sitka Sound, Alaska. Registros: Bastida-Zavala (1993: 34-35).
Q Pseudopotamilla occelata Moore, 1905. LT: Afognak Island, Alaska. Registros: Rioja (1947a: 524-525).
Pseudopotamilla socialis Hartman, 1944b. LT: Tomales Point, California. Registros: este estudio.
Género Sabellastarte Krøyer, 1856
NIS? Sabellastarte spectabilis (Grube, 1878). LT: Filipinas y Singapur. Registros: Bastida-Zavala (1993: 35, como S. indica). Comentario: Capa et al. (2010) con base en ADN determinaron que S. spectabilis, una especie de ornato, se distribuye en Saipan, Malasia y Hawaii. El registro de la especie en la Paz podría ser correcto.
Familia Serpulidae Rafinesque, 1815
Género Circeis de Saint-Joseph, 1894
Q Circeis spirillum (Linnaeus, 1758). LT: Europa. Registros: Rioja (1963: 225, como Spirorbis (Dexiospira)).
Género Ficopomatus Southern, 1921
NIS Ficopomatus miamiensis (Treadwell, 1934). LT: Florida. Registros: Tovar-Hernández et al. (2012: 12-13; 2014b: 394).
Género Hydroides Gunnerus, 1768
Hydroides crucigera Mörch, 1863. LT: Puntarenas, Costa Rica. Registros: Rioja (1967b: 215); Bastida-Zavala (1993: 35); Bastida-Zavala et al. (2016: 415-416).
Hydroides deleoni Bastida-Zavala y ten Hove, 2003. LT: San Juanico, Baja California Sur. Registros: Bastida-Zavala et al. (2016: 417).
NIS Hydroides dirampha Mörch, 1863. LT: Saint Thomas, Antillas. Registros: Bastida-Zavala (1993: 35); Tovar-Hernández et al. (2014b: 390); Bastida-Zavala et al. (2016: 418-419).
NIS Hydroides elegans (Haswell, 1883). LT: Port Jackson, Australia. Registros: Bastida-Zavala (2008: 25-26); Tovar-Hernández et al. (2014b: 390); Bastida-Zavala et al. (2016: 419-420).
Hydroides recurvispina Rioja, 1941. LT: Acapulco, Pacífico mexicano. Registros: Bastida-Zavala (2008: 28).
NIS Hydroides sanctaecrucis Krøyer en Mörch, 1863. LT: Saint Croix, Antillas. Registros: Tovar-Hernández et al. (2014b: 390); Bastida-Zavala et al. (2016: 426).
Hydroides similis (Treadwell, 1929). LT: Baja California. Registros: Bastida-Zavala (1993: 35, como H. brachyacantha; 2008: 29); Bastida-Zavala y ten Hove (2003: 102-104); Bastida-Zavala et al. (2016: 427); este estudio.
Hydroides trompi Bastida-Zavala y ten Hove, 2003. LT: Miraflores, Panamá. Registros: Bastida-Zavala y ten Hove (2003: 104-108).
Género Leospira Caullery y Mesnil, 1897
Q Leospira moerchi (Levinsen, 1883). LT: Mar del Norte. Registros: Rioja (1963: 222, como Spirorbis (Laeospira) mörchi).
Género Pileolaria Claparéde, 1868
*Pileolaria lateralis Knight-Jones, 1978. LT: Este de La Paz. Registros: no.
*Pileolaria spinifer Knight-Jones, 1978. LT: Este de La Paz. Registros: no.
Género Pomatostegus Schmarda, 1861
Pomatostegus kroyeri Mörch, 1863. LT: Puntarenas, Costa Rica. Registros: Bastida-Zavala et al. (2016: 428-429).
Género Pseudovermilia Bush, 1907
NIS? Pseudovermilia occidentalis (McIntosh, 1885). LT: Bermuda. Registros: Bastida-Zavala (1993: 36; 2008: 40-42); Bastida-Zavala et al. (2016: 431-432); este estudio. Comentario: Se ha reportado en el golfo de México, Caribe, Georgia (EUA), Brasil, Golfo de Guinea, Cabo Verde, Islas Santa Helena, California (EUA), Galápagos, Hawaii y golfo de California (ten Hove, 1975; Bastida-Zavala et al. 2016). Sin embargo, ten Hove (1975) enfatizó que las poblaciones del Atlántico y del Pacífico difieren sutilmente en la forma del tubo, pedúnculo y opérculo, por lo que es necesita una revisión detallada e incluso apoyada con estudios moleculares para confirmar su estado como NIS en el golfo de California.
Género Salmacina Claparède, 1870
Q Salmacina dysteri (Huxley, 1855). LT: Gales, Inglaterra. Registros: Steinbeck y Ricketts (1941: 367).
Género Serpula Linnaeus, 1758
Serpula sp.: este estudio.
Género Simplaria Knight-Jones, 1984
Q Simplaria pseudomilitaris (Thiriot-Quievreux, 1965). LT: Francia. Registros: Hernández-Alcántara et al. (2003: 9).
Género Spirobranchus de Blainville, 1818
Q Spirobranchus giganteus (Pallas, 1766). LT: Antillas occidentales. Registros: Rioja (1963: 220).
Spirobranchus incrassatus Krøyer en Mörch, 1863. LT: Colombia, Pacífico. Registros: Bastida-Zavala et al. (2016: 434-435); este estudio.
Spirobranchus minutus (Rioja, 1941). LT: Acapulco, Pacífico mexicano. Registros: Bastida-Zavala (1993: 35; 2008: 31-33, en ambos como Pomatoceros minutus); Bastida-Zavala et al. (2016: 435-437).
Género Vermiliopsis Saint-Joseph, 1894
Vermiliopsis multiannulata (Moore, 1923). LT: California. Registros: Bastida-Zavala et al. (2016: 437-438).
Familia Sigalionidae Kinberg, 1856
Género Neopsammolyce Pettibone, 1997
Neopsammolyce spinosa (Hartman, 1939). LT: Pacífico mexicano. Registros: Rioja (1963: 155-156, como Psamolyce (sic)).
Género Pelogenia Schmarda, 1861
*Pelogenia myops (Hartman, 1939). LT: isla Espíritu Santo, entre arena y algas coralinas, 5.4-9.1 m. Registros: Hernández-Alcántara et al. (2003: 7, como Psammolyce).
Q Pelogenia philippinensis (McIntosh, 1885). LT: Filipinas. Registros: Berkeley y Berkeley (1939: 332, como Eupholoe philippinensis); Hernández-Alcántara et al. (2003: 6, como Eupholoe).
Género Sigalion Audouin y Milne-Edwards, 1830
*Sigalion lewissii Berkeley y Berkeley, 1939. LT: isla Espíritu Santo, 19. 8 m. Registros: Hernández-Alcántara et al. (2003: 7).
Género Sthenelais Kinberg, 1856
Q Sthenelais articulata Kinberg, 1856. LT: Río de Janeiro. Registros: Rioja (1963: 153-155); Hernández-Alcántara et al. (2003: 7).
Sthenelais berkeleyi Pettibone, 1971. LT: Columbia Británica, Canadá. Registros: Bastida-Zavala (1993: 25).
Sthenelais helenae Kinberg, 1856. LT: Valparaíso, Chile. Registros: Hartman (1939: 64-65, como maculata); Bastida-Zavala (1993: 25); Hernández-Alcántara et al. (2003: 7).
Género Sthenolepis Willey, 1905
Sthenolepis fimbriarum (Hartman, 1939). LT: isla Carmen, golfo de California. Registros: Hernández-Alcántara et al. (2003: 7).
Familia Spionidae Grube, 1850
Género Aonides Claparède, 1864
*Aonides californiensis Rioja, 1947b. LT: Coromuel, asociada a Porites. Registros: no.
Género Dipolydora Verrill, 1881
NIS? Dipolydora socialis (Schmarda, 1861). LT: sur de Chile. Registros: Rioja (1947b: 207-208, como Polydora). Comentario: Especies de Spionidae son bien conocidas como plagas de moluscos de interés comercial. En el golfo de California se han reportado varios casos (Tovar-Hernández et al. 2018), puede ser la situación de D. socialis.
Género Minuspio Foster, 1971
Q Minuspio cirrifera (Wirén, 1883). LT: Gaspé, Quebéc. Registros: Bastida-Zavala (1993: 21).
Género Paraprionospio Caullery, 1914
Q Paraprionospio pinnata (Ehlers, 1901). LT: sur de Chile. Registros: Cuéllar-Mercado et al. (2019: 4).
Género Prionospio Malmgren, 1867
Q Prionospio ehlersi Fauvel, 1928. LT: Marruecos. Registros: Cuéllar-Mercado et al. (2019: 4).
Familia Syllidae Grube, 1850
Género Branchiosyllis Ehlers, 1887
Q Branchiosyllis exilis (Gravier, 1900). LT: Djibouti, Mar Rojo. Registros: Bastida-Zavala (1993: 26).
*Branchiosyllis sanmartini Góngora-Garza, García-Garza y de León-González, 2011. LT: Malecón, 24º10’06.6” N, 110º18’38.6” O, entre algas incrustadas en rocas, intermarea. Registros: no.
Género Eusyllis Malmgren, 1867
Q Eusyllis assimilis von Marenzeller, 1875. LT: Mediterráneo. Registros: Rioja (1963: 164).
Q Eusyllis blomstrandi Malmgren, 1867. LT: Noruega. Registros: Bastida-Zavala (1993: 27).
Género Exogone Örsted, 1845
Exogone occidentalis Westheide, 1974. LT: Galápagos. Registros: Bastida-Zavala (1993: 27).
Género Haplosyllis Langerhans, 1879
Q Haplosyllis spongicola (Grube, 1855). LT: Mediterráneo. Registros: Bastida-Zavala (1993: 27). Comentario: Lattig y Martin (2009) sugieren que todos los registros de la especie fuera del Mediterráneo deben revisarse, pues corresponderían a otras especies.
Género Myrianida Milne-Edwards, 1845
NIS? Myrianida cf. pachycera (Augener, 1913). LT: Australia occidental. Registros: Tovar-Hernández et al. (2014b: 390).
Myrianida varius (Treadwell, 1914). LT: San Francisco, California. Registros: Rioja (1947b: 203, como Autolytus).
Género Odontosyllis Claparède, 1863
Odontosyllis phosphorea Moore, 1909. LT: Santa Catalina, California, Sudáfrica. Registros: Rioja (1947b: 203).
Q Odontosyllis polycera (Schmarda, 1861). LT: Table Bay, Sudáfrica. Registros: Bastida-Zavala (1993: 27).
Q Odontosyllis undecimdonta Imajima y Hartman, 1964. LT: Japón. Registros: Bastida-Zavala (1993: 27).
Género Opisthosyllis Langerhans, 1879
Q Opisthosyllis brunnea Langerhans, 1879. LT: Madeira. Registros: Bastida-Zavala (1993: 27).
Q Opisthosyllis japonica Imajima, 1966. LT: Japón. Registros: Bastida-Zavala (1993: 27-28).
Género Syllis Lamarck, 1818
Q Syllis alternata Moore, 1908. LT: Alaska. Registros: Bastida-Zavala (1993: 28, como Typosyllis).
Q Syllis cornuta Rathke, 1843. LT: Noruega. Registros: Bastida-Zavala (1993: 24, como Ehlersia).
Syllis elongata (Johnson, 1901). LT: Puget Sound, Washington. Registros: Rioja (1947b: 202).
Q Syllis hyalina Grube, 1863. LT: Croacia. Registros: Rioja (1947b: 203).
Q Syllis prolifera (Krohn, 1852). LT: Mediterráneo. Registros: Bastida-Zavala (1993: 28, como Typosyllis).
Q Syllis rosea (Langerhans, 1879). LT: Madeira. Registros: Bastida-Zavala (1993: 26, como Ehlersia).
Q Syllis setoensis (Imajima, 1966). LT: Japón. Registros: Bastida-Zavala (1993: 29, como Typosyllis).
Q Syllis variegata Grube, 1860. LT: Croacia. Registros: Rioja (1963: 163, como Typosyllis).
Género Typosyllis Langerhans, 1879
Q Typosyllis okadai (Fauvel, 1934). LT: Japón. Registros: Bastida-Zavala (1993: 28).
Q Typosyllis regulata Imajima, 1966: LT: Japón. Registros: Bastida-Zavala (1993: 28-29).
Familia Terebellidae Johnston 1846
Género Amphitrite Müller, 1771
Q Amphitrite cirrata Müller, 1776. LT: Inglaterra. Registros: Bastida-Zavala (1993: 32).
Género Eupolymnia Verrill, 1900
Eupolymnia heterobranchia (Johnson, 1901). LT: Puget Sound, Washington. Registros: Rioja (1947b: 210, como Lanice); Bastida-Zavala (1993: 32-33, como Eupolymnia crescentis).
Q Eupolymnia nebulosa (Montagu, 1818). LT: Devon, Inglaterra. Registros: Bastida-Zavala (1993: 33).
Género Leaena Malmgren, 1865
Leaena caeca Hartman, 1960. LT: Santa Catalina, California. Registros: Bastida-Zavala (1993: 33).
Género Lanice Malmgren, 1866
Q Lanice conchilega (Pallas, 1766). LT: Zona económica exclusiva Alemana. Registros: Bastida-Zavala (1993: 33).
Género Loimia Malmgren, 1866
Q Loimia montagui (Grube, 1878). LT: Filipinas. Registros: Rioja (1947b: 210). Comentario: Nomen dubium (recombinación de un homónimo primario no reubicado).
Género Neoamphitrite Hessle, 1917
Neoamphitrite robusta (Johnson, 1901). LT: Washington State. Registros: Rioja (1947b: 209-210, como Amphitrite).
Género Neoleprea Hessle, 1917
Neoleprea californica (Moore, 1904). LT: San Diego, California. Registros: Bastida-Zavala (1993: 33, como Terebella).
Género Pista Malmgren, 1866
Pista elongata Moore, 1909: LT: San Diego, California. Registros: Steinbeck y Ricketts (1941: 366).
Género Polycirrus Grube, 1850
*Polycirrus mexicanus (Rioja, 1947b: 210-212, como Anisocirrus). LT: Punta Colorada, en conchas de moluscos. Registros: no.
Género Scionella Moore, 1903
Q Scionella japonica Moore, 1903. LT: Honshu Island y Sugura Bay, Japón. Registros: Cuéllar-Mercado et al. (2019: 4).
Género Spinosphaera Hessle, 1919
Spinosphaera oculata Hartman, 1944b. LT: Tomales Point, California. Registros: Rioja (1947a: 524-525); Bastida-Zavala (1993: 33).
Género Streblosoma Sars, 1872
Streblosoma longifilis Rioja, 1962. LT: Pacífico mexicano. Registros: Bastida-Zavala (1993: 33).
Género Thelepus Leuckart, 1849
Thelepus crispus Johnson, 1901. LT: Puget Sound, Washington. Registros: Bastida-Zavala (1993: 33-34).
Q Thelepus setosus (de Quatrefages, 1866). LT: Saint-Vaast-la-Hougue, Francia. Registros: Bastida-Zavala (1993: 34).
Referencias
Barroso, R., Klautau, M., Solé-Cava, A. M. y Paiva, P. C. (2010). Eurythoe complanata (Polychaeta: Amphinomidae), the ‘cosmopolitan’ fireworm, consists of at least three cryptic species. Marine Biology, 157, 69–80. https://doi.org/10.1007/s00227-009-1296-9
Bastida-Zavala, J. R. (1991). Lycastopsis riojai, a new species of polychaete (Polychaeta: Nereidae) from the Gulf of California. Revista de Biología Tropical, 38, 415–420.
Bastida-Zavala, J. R. (1993). Taxonomía y composición biogeográfica de los poliquetos (Annelida: Polychaeta) de la bahía de La Paz, B.C.S., México. Revista de Investigación Científica, 4, 11–39.
Bastida-Zavala, J. R. (1994). Hermafroditismo simultáneo y extensión de ámbito de Ctenodrilus serratus (Polychaeta: Ctenodrilidae) en Baja California Sur, México. Revista de Biología Tropical, 42, 737–741.
Bastida-Zavala, J. R. (1995). Poliquetos (Annelida: Polychaeta) del arrecife coralino de Cabo Pulmo-Los Frailes, B.C.S., Mexico. Revista de Zoología, 6, 9–29.
Bastida-Zavala, J. R. (2008). Serpulids (Annelida: Polychaeta) from the Eastern Pacific, including a brief mention of Hawaiian serpulids. Zootaxa, 1722, 1–61.
Bastida-Zavala, J. R. (2009). 43 Serpulidae Rafinesque, 1815. En J. A. de León-González, J. R. Bastida-Zavala, L. F. Carrera-Parra, M. E. García-Garza, A. Peña-Rivera, S. I. Salazar-Vallejo et al. (Eds.), Poliquetos (Annelida: Polychaeta) de México y América Tropical (pp. 521–554). Monterrey: Universidad Autónoma de Nuevo León.
Bastida-Zavala, J. R., Rodríguez-Buelna, A. S., de León-González, J. A., Camacho-Cruz, K. A. y Carmona, I. (2016). New records of sabellids and serpulids (Polychaeta: Sabellidae, Serpulidae) from the Tropical Eastern Pacific. Zootaxa, 4148, 401–457. https://doi.org/10.11646/zootaxa.4184.3.1
Bastida-Zavala, J. R. y ten Hove, H. A. (2003). Revision of Hydroides Gunnerus, 1768 (Polychaeta: Serpulidae) from the Eastern Pacific Region and Hawaii. Beaufortia, 53, 67–110.
Berkeley, E. y Berkeley, C. (1939). On a collection of Polychaeta, chiefly from the West Coast of Mexico. Annals and Magazine of Natural History Series, 11, 321–346. https://doi.org/10.1080/03745481.1939.9723608
Berkeley, E. y Berkeley, C. (1960). Notes on some Polychaeta from the West Coast of Mexico, Panama, and California. Canadian Journal of Zoology, 38, 357–362. https://doi.org/10.1139/z60-040
Blake, J. A. (2009). Redescription of Capitella capitata (Fabricius) from West Greenland and designation of a neotype (Polychaeta, Capitellidae). Zoosymposia, 2, 55–80.
Capa, M., Bybee, D. R. y Bybee, S. M. (2010). Establishing species and species boundaries in Sabellastarte Krøyer, 1856 (Annelida: Sabellidae): an integrative approach. Organisms Diversity & Evolution, 10, 351–371. https://doi.org/10.1007/s13127-010-0033-z
Capa, M. y Murray, A. (2016). Combined morphological and molecular data unveils relationships of Pseudobranchiomma (Sabellidae, Annelida) and reveals higher diversity of this intriguing group of fan worms in Australia, including potentially introduced species. Zookeys, 622, 1–36. https://doi.org/10.3897/zookeys.622.9420
Conabio-Conanp-TNC-Pronatura. (2007). Análisis de vacíos y omisiones en conservación de la biodiversidad marina de México: océanos, costas e islas. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Comisión Nacional de Áreas Naturales Protegidas/ The Nature Conservancy-Programa México/ Pronatura, A.C.
Conde-Vela, V. M. y Salazar-Vallejo, S. I. (2015). Redescriptions of Nereis oligohalina (Rioja, 1946) and N. garwoodi González-Escalante & Salazar-Vallejo, 2003 and description of N. confusa sp. n. (Annelida, Nereididae). Zookeys, 518, 15–49. https://doi.org/10.3897/zookeys.518.9564
Coutière, H. (1905). Notes sur Lysiosquilla digueti n. sp. commensale d’un Polynoïden et d’un Balanoglosse de Basse Californie. Bulletin du Société Française de Philosophie, Paris, 9, 174–179.
Cruz-Gómez, C. y Bastida-Zavala, J. R. (2018). Chrysopetalids (Phyllodocida: Chrysopetalidae) from the southern Mexican Pacific, including a new species. Zootaxa, 4521, 61–88. https://doi.org/10.11646/zootaxa.4521.1.3
Cuéllar-Mercado, D. M., Hernández-Alcántara, P. y Solís-Weiss, V. (2019). Composition, richness and taxonomic diversity of Polychaete assemblages from La Paz and adjacent oceanic areas of the Southern Gulf of California. Regional Studies in Marine Science, 28, 100576. https://doi.org/10.1016/j.rsma.2019.100576
de León-González, J. A. y Balart, E. F. (2016). A new species of Websterinereis from the Gulf of California and redescription of Websterinereis foli (Fauvel, 1930) (Annelida, Nereididae). Zookeys, 614, 15–26. https://doi.org/10.3897/zookeys.614.8843
de León-González, J. A., Bastida-Zavala, J. R., Carrera-Parra, L. F., García-Garza, M. E., Peña-Rivera, A., Salazar-Vallejo, S. I. et al. (Eds.). (2009). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Monterrey: Universidad Autónoma de Nuevo León.
de León-González, J. A. y Solís-Weiss, V. (1998). The genus Perinereis (Polychaeta: Nereididae) from Mexican littorals with the redescription of P. anderssoni and P. elenacasoae. Proceedings of the Biological Society of Washington, 111, 823–828.
Dean, H. K. y Blake, J. A. (2007). Chaetozone and Caulleriella (Polychaeta : Cirratulidae) from the Pacific coast of Costa Rica, with description of eight new species. Zootaxa, 1451, 41–68. https://doi.org/10.11646/zootaxa.1451.1.2
del Pasqua, M. D., Schulze, A., Tovar-Hernández, M. A., Keppel, E., Lezzi, M., Gambi, M. C. et al. (2018). Clarifying the taxonomic status of the alien species Branchiomma bairdi and Branchiomma boholense (Annelida: Sabellidae) using molecular and morphological evidence. Plos One, 13, e0197104. https://doi.org/10.1371/journal.pone.0197104
DOF (Diario Oficial de la Federación). (2016). Acuerdo por el que se determina la lista de las especies exóticas invasoras para México. 07 de diciembre de 2016.
Fauvel, P. (1943). Annélides polychètes de Californie Recueillies par L. Diguet. Mémoires du Muséum National D’histoire Naturelle, 18, 1–32.
García-Garza, M. E. (2011). Biodiversidad de poliquetos capitélidos (Annelida: Polychaeta) de las costas mexicanas. Revista Iberoamericana para la Investigación y el Desarrollo Educativo, 2. Versión en línea. https://doi.org/10.23913/ride.v2i3.30
García-Garza, M. E. y de León-González, J. A. (2009). A new species of Dasybranchethus (Annelida: Capitellidae) from Mexican Pacific, with are description of Dasybranchethus fauveli. Journal of the Marine Biological Association of the United Kingdom, 89, 1437–1441. https://doi.org/10.1017/s0025315409000241
García-Garza, M. E. y de León-González, J. A. (2011). Review of the Capitellidae (Annelida, Polychaeta) from the Eastern Tropical Pacific region, with notes on selected species. Zookeys, 151, 17–52. https://doi.org/10.3897/zookeys.151.1964
García-Garza, M. E. y de León-González, J. A. (2015). The genus Notomastus (Polychaeta: Capitellidae) in the Gulf of California, Mexico, with the description of three new species. Proceedings of the Biological Society of Washington, 128, 176–189. https://doi.org/10.2988/0006-324x-128.2.176
Glasby, C. J. y Timm, T. (2008). Global diversity of Polychaeta (Polychaeta; Annelida) in freshwater. Hydrobiologica, 595, 107–115. https://doi.org/10.1007/978-1-4020-8259-7_13
Glasby, C. J., Timm, T., Muir, A. I. y Gil, J. (2009). Catalogue of non-marine Polychaeta (Annelida) of the World. Zootaxa, 2070, 1–52. https://doi.org/10.11646/zootaxa.2070.1.1
Góngora-Garza, G., García-Garza, M. E. y de León-González, J. A. (2011). Two new species of Branchiosyllis (Polychaeta: Syllidae) from Western Mexico. Proceedings of the Biological Society of Washington, 124, 378–385. https://doi.org/10.2988/11-22.1
Gravier, C. (1905). Sur un Polynoidien (Lepidasthenia digueti nov. sp.) commensal d’ un Balano glosse de Basse-Californie. Bulletin du Muséum d’ Histoire Naturelle, Paris, 11, 177–184.
Hartman, O. (1939). Polychaetous annelids. Part I. Aphroditidae to Pisionidae. Allan Hancock Pacific Expeditions, 7, 1–156.
Hartman, O. (1940). Polychaetous annelids. Part II. Chrysopetalidae to Goniadidae. Allan Hancock Pacific Expeditions, 7, 173–287.
Hartman, O. (1944a). Polychaetous annelids. Part V. Eunicea. Allan Hancock Pacific Expeditions, 10, 1–237.
Hartman, O. (1944b). Polychaetous annelids from California, including the descriptions of two new genera and nine new species. Allan Hancock Pacific Expeditions, 10, 239–307.
Hernández-Alcántara, P., Cuéllar-Mercado, D. M. Barbosa-López, A. y Solís-Weiss, V. (2017). Spatial patterns of species richness and taxonomic composition of polychaetes along the Baja California Peninsula, Eastern Pacific. Journal of the Marine Biological Association of the United Kingdom, 97, 1037–1049. https://doi.org/10.1017/s0025315417000893
Hernández-Alcántara, P., Frontana-Uribe, S. C. y Solís-Weiss, V. (2003). Commented checklist of the polychaetes (Annelida: Polychaeta) from areas adjacent to islands of the Mexican Pacific and Gulf of California. Bulletin of Southern California Association, 102, 1–16.
Hernández-Alcántara, P. y Solís-Weiss, V. (1991). New records of Errantiate Polychaetous Annelids from the Gulf of California. Bulletin of Marine Science, 48, 251–260.
Hernández-Alcántara, P., Tovar-Hernández, M. A. y Solís-Weiss, V. (2008). Polychaetes (Annelida: Polychaeta) described from the Mexican Pacific: an historical review and an updated checklist. Latin American Journal of Aquatic Research, 36, 37–61.
Hutchings, P. y Karageorgopoulus, P. (2003). Designation of a neotype of Marphysa sanguinea (Montagu, 1813) and a description of a new species of Marphysa from eastern Australia. Hydrobiologia, 496, 87–94. https://doi.org/10.1007/978-94-017-0655-1_9
Keppel, E., Tovar-Hernández, M. A. y Ruiz, G. (2015). First record of Branchiomma coheni (Polychaeta: Sabellidae) along the US East coast and update of non indigenous species. Zootaxa, 4058, 499–518. https://doi.org/10.11646/zootaxa.4058.4.3
Knight-Jones, P. (1978). New Spirorbidae (Polychaeta: Sedentaria) from the East Pacific, Atlantic, Indian and Southern Oceans. Zoological Journal of the Linnean Society, 64, 201–240. https://doi.org/10.1111/j.1096-3642.1978.tb01070.x
Kudenov, J. D. (1975). Sedentary polychaetes from the Gulf of California, Mexico. Journal of Natural History, 9, 205–231. https://doi.org/10.1080/00222937500770131
Kupriyanova, E. K. (1999). The taxonomic status of Serpula cf. columbiana Johnson 1901 from the American and Asian coasts of the North Pacific Ocean. Ophelia, 50, 21–34. https://doi.org/10.1080/00785326.1999.10409386
Lattig, P. y Martin, D. (2009). A taxonomic revision of the genus Haplosyllis Langerhans, 1887 (Polychaeta: Syllidae: Syllinae). Zootaxa, 2220, 1–40. https://doi.org/10.11646/zootaxa.2220.1.1
Llorente-Bousquets, J. y Ocegueda, S. (2008). Estado del conocimiento de la biota. En T.R. Ramamoorthy, R. Bye, A. Lot y J. Fa (Eds.), Capital natural de México, Vol. I: Conocimiento actual de la biodiversidad (pp. 283–322). México D.F.: Conabio.
Martínez-Meyer, E., Sosa-Escalante, J. E. y Álvarez, F. (2014). El estudio de la biodiversidad en México: ¿una ruta o con dirección? Revista Mexicana de Biodiversidad, Suplemento 85, S1–S9. https://doi.org/10.7550/rmb.43248
Molina-Acevedo, I. C. y Carrera-Parra, L. F. (2015). Reinstatement of three species of the Marphysa sanguinea complex (Polychaeta: Eunicidae) from the Grand Caribbean Region. Zootaxa, 3925, 37–55. https://doi.org/10.11646/zootaxa.3925.1.3
Molina-Acevedo, I. C. y Carrera-Parra, L. F. (2017). Revision of Marphysa de Quatrefages, 1865 and some species of Nicidion Kinberg, 1865 with the erection of a new genus (Polychaeta: Eunicidae) from the Grand Caribbean. Zootaxa, 4241, 1–62. https://doi.org/10.11646/zootaxa.4241.1.1
Pettibone, M. H. (1969). Remarks on the north Pacific Harmothoe tenebricosa Moore (Polychaeta, Polynoidae) and its association with asteroids (Echinodermata, Asteroidea). Proceedings of the Biological Society of Washington, 82, 31–42.
Rioja, E. (1947a). Estudios Anelidológicos. XVIII. Observaciones y datos sobre algunos anélidos poliquetos del golfo de California y costas de Baja California. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, 18, 517–526.
Rioja, E. (1947b). Estudios Anelidológicos. XVII. Contribución al conocimiento de los anélidos poliquetos de Baja California y Mar de Cortés. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, 18, 197–224.
Rioja, E. (1963). Estudios Anelidológicos. XXVI. Algunos anélidos poliquetos de las costas del Pacífico de México. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, 33, 131–229.
Riosmena-Rodríguez, R., López-Vivas, J. M., Lara Uc, M. M. y López-Calderón, J. M. (2014). Invasión de plantas marinas exóticas en el Pacífico Mexicano: Amenaza para el ambiente y la economía. Bioma, 16, 54–65.
Salazar-Silva, P. (2013). Revision of Halosydna Kinberg, (Annelida: Polychaeta: Polynoidae) from the Tropical Eastern Pacific and Grand Caribbean with descriptions of new species. Journal of Natural History, 47, 1177–1242. https://doi.org/10.1080/00222933.2012.752934
Salazar-Silva, P. (2015). Catálogo de autoridad taxonómica de las especies de poliquetos (Annelida: Polychaeta) del Pacífico mexicano y localidades del Pacífico oriental tropical. Base de datos SNIB-CONABIO KT004. Recuperado el 17 septiembre, 2018 de: http://www.conabio.gob.mx/institucion/cgi-bin/datos.cgi?Letras=KT&Numero=4
Salazar-Vallejo, S. I. (1987a). A new amphinomid polychaete (Annelida: Polychaeta) from Western Mexico. Revista de Biología Tropical, 35, 77–82.
Salazar-Vallejo, S. I. (1987b). Pilargidae (Annelida: Polychaeta) de México: lista de especies, nueva especie y biografía. Cahiers de Biologie Marine, 27, 192–210.
Salazar-Vallejo, S. I. (1991). Revisión de algunos eucliméninos (Polychaeta: Maldanidae) del golfo de California, Florida, Panamá y estrecho de Magallanes. Revista de Biología Tropical, 39, 269–278.
Salazar-Vallejo, S. I. (2011). Revision of Piromis Kinberg, 1867 and Pycnoderma Grube, 1877 (Polychaeta: Flabelligeridae). Zootaxa, 2819, 1–50. https://doi.org/10.11646/zootaxa.2819.1.1
Salazar-Vallejo, S. I. (2012). Revision of Semiodera Chamberlin, 1919 (Polychaeta: Flabelligeridae). Zootaxa, 3562, 1–62. https://doi.org/10.11646/zootaxa.3562.1.1
Salazar-Vallejo, S. I. (2015). Revision of Pherusa Oken, 1807(Polychaeta: Flabelligeridae). Zootaxa, 3886, 1–61. https://doi.org/10.11646/zootaxa.3886.1.1
Salazar-Vallejo, S. I. (2018). Revision of Hesione Savigny in Lamarck, 1818 (Annelida, Errantia, Hesionidae). Zoosystema, 40, 227–325. https://doi.org/10.5252/zoosystema2018v40a12
Salazar-Vallejo, S. I., de León-González, J. A., Góngora-Garza, G. y Salaices Polanco, H. (1986-1987). Nuevos registros y extensiones del ámbito de poliquetos (Annelida:Polychaeta) de México. Investigaciones Marinas, 3, 29–38.
Salazar-Vallejo, S. I. y Londoño-Mesa, M. H. (2004). Lista de especies y bibliografía de poliquetos del Pacífico Oriental Tropical. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, Serie Zoología, 75, 9–97.
Salgado-Barragán, J., Méndez, N. y Toledano-Granados, A. (2004). Ficopomatus miamiensis (Polychaeta: Serpulidae) and Styela canopus (Ascidiacea: Stylidae), non-native species in Urías estuary, SE Gulf of California, México. Cahiers de Biologie Marine, 45, 167–173.
Silva, C. F., Seixas, V. C., Barroso, R., Di Domenico, M, Amaral, A. C. Z. y Paiva, P. C. (2017) Demystifying the Capitella capitata complex (Annelida, Capitellidae) diversity by morphological and molecular data along the Brazilian coast. Plos One, 12, e0177760. https://doi.org/10.1371/journal.pone.0177760
Steinbeck, J. y Ricketts, E. F. (1941). Sea of Cortez. A leisurely journal of travel and research. New York: Viking Press.
Suárez-Morales, E., Jiménez-Cueto, S. y Salazar-Vallejo, S. I. (2005). Catálogo de los poliquetos pelágicos (Polychaeta) del golfo de México y mar Caribe mexicano. México D.F.: Conacyt/ Semarnat/ ECOSUR.
ten Hove, H. A. (1975). Serpulinae (Polychaeta) from the Caribbean: III. The genus Pseudovermilia. Studies of the Fauna of Curaçao and other Caribbean Islands, 47, 46–110.
ten Hove, H. A. y Kupriyanova, E. K. (2009). Taxonomy of Serpulidae (Annelida: Polychaeta): the state of affairs. Zootaxa, 2036, 1–126. ttps://doi.org/10.11646/zootaxa.2036.1.1
Tovar-Hernández, M. A. (2007). Revision of Chone Krøyer, 1856 (Polychaeta: Sabellidae) from North America and descriptions of four new species. Journal of Natural History, 41, 511–566. https://doi.org/10.1080/00222930701250912
Tovar-Hernández, M. A. y Carrera-Parra, L. F. (2011). Megalomma Johansson, 1925 (Polychaeta: Sabellidae) from America and other world-wide localities, and phylogenetic relationships within the genus. Zootaxa, 2861, 1–71. https://doi.org/10.11646/zootaxa.2861.1.1
Tovar-Hernández, M. A., de León-González, J. A. y García-Garza, M. E. (2018). Gusanos perforadores de conchas marinas y exóticos invasores. Biología y Sociedad, 1, 47–64.
Tovar-Hernández, M. A. y Dean, H. (2014). A new gregarious sabellid worm from the Gulf of California reproduced by spontaneous fission (Polychaeta, Sabellidae). Journal of the Marine Biological Association o f the United Kingdom, 94, 935–946. https://doi.org/10.1017/s0025315414000186
Tovar-Hernández, M. A., Méndez, N. y Salgado-Barragán, J. (2009a). Branchiomma bairdi (McIntosh, 1885): a Caribbean hermaphrodite fan worm in the south-eastern Gulf of California (Polychaeta: Sabellidae). Marine Biological Association of the United Kingdom, Marine Biodiversity Records, 2, e43. https://doi.org/10.1017/s1755267209000463
Tovar-Hernández, M. A., Méndez, N. y Villalobos-Guerrero, T. F. (2009b). Fouling tubicolous polychaetes worms from the south-eastern Gulf of California: Sabellidae and Serpulidae. Systematics and Biodiversity, 7, 1–18. https://doi.org/10.1017/s1477200009990041
Tovar-Hernández, M. A., Salazar-Silva, P., de León-González, J. A., Carrera-Parra, L. F. y Salazar-Vallejo, S. I. (2014a). Biodiversidad de Polychaeta (Annelida) en México. Revista Mexicana de Biodiversidad, 85 (Suplemento), S190–S196. https://doi.org/10.7550/rmb.32625
Tovar-Hernández, M. A. y Sosa-Rodríguez, T. (2006). Redescription of Chone infundibuliformis Krøyer, 1856 (Polychaeta: Sabellidae) and histology of the branchial crown appendages, collar and glandular ridge. Zootaxa, 1115, 31–59. https://doi.org/10.11646/zootaxa.1115.1.2
Tovar-Hernández, M. A., Villalobos-Guerrero, T. F., Yáñez-Rivera, B., Aguilar-Camacho, J. M. y Ramírez-Santana, I. D. (2012). Guía de invertebrados acuáticos exóticos en Sinaloa. Mazatlán, Sinaloa: Geomare, A.C./ USFWS/ INE-Semarnat.
Tovar-Hernández, M. A. y Yáñez-Rivera, Y. (2012a). Ficha técnica y análisis de riesgo de Branchiomma bairdi (McIntosh, 1885) (Polychaeta: Sabellidae). Capítulo IX. En A. M. Low-Pfeng y E. M. Peters-Recagno (Eds.), Invertebrados marinos exóticos en el Pacífico mexicano (pp. 167–190). México D.F.: Geomare, A.C./ INE-Semarnat.
Tovar-Hernández, M. A. y Yáñez–Rivera, B. (2012b). Ficha técnica y análisis de riesgo de Ficopomatus miamiensis (Treadwell, 1934) (Polychaeta: Serpulidae). Capítulo X. En A. M. Low Pfeng y E. M. Peters Recagno (Eds.), Invertebrados marinos exóticos en el Pacífico mexicano (pp. 193–212). México D.F.: Geomare, A.C./ INE-Semarnat.
Tovar-Hernández, M. A., Yáñez-Rivera, B., Villalobos-Guerrero, T. F., Aguilar-Camacho, J. M. y Ramírez-Santana, I. D. (2014b). Detección de invertebrados exóticos en el golfo de California. En A. M. Low Pfeng, P. Quijón y E. Peters (Eds.), Especies invasoras acuáticas: casos de estudio en ecosistemas de México (pp. 381–409). Segunda parte, distribución de especies invasoras: casos de estudio. Ciudad de México: Secretaría de Medio Ambiente y Recursos Naturales/ Instituto Nacional de Ecología y Cambio Climático/ University of Prince Edward Island.
Velasco-García, J. A. (2009). Ambientes geológicos costeros del litoral de Bahía de La Paz, Baja California Sur, México (Tesis de maestría). CICIMAR-IPN. La Paz, BCS.
Villalobos-Guerrero, T. F. y Carrera-Parra, L. F. (2015). Redescription of Alitta succinea (Leuckart, 1847) and reinstatement of A. acutifolia (Ehlers, 1901) n. comb. based upon morphological and molecular data (Polychaeta: Nereididae). Zootaxa, 3919, 157–178. https://doi.org/10.11646/zootaxa.3919.1.7
Villalobos-Guerrero, T. F. y Molina-Acevedo, I. (2014). Lista de especies y estado de conocimiento de los poliquetos (Annelida: Polychaeta) de Sinaloa, golfo de California. Boletín del Instituto Oceanográfico de Venezuela, 53, 79–109.
WoRMS (2019). Polychaeta. Recuperado el 27 de marzo, 2019 de: http://www.marinespecies.org/aphia.php?p=taxdetails&id=883
Yáñez-Rivera, B. y Carrera-Parra, L. F. (2012). Reestablishment of Notopygos megalops McIntosh, description of N. caribea sp. n. from the Greater Caribbean and barcoding of “amphiamerican” Notopygos species (Annelida, Amphinomidae). Zookeys, 223, 69–84. https://doi.org/10.3897/zookeys.223.3561
Zibrowius, H. (1971). Revision of Metavermilia Bush (Polychaeta, Serpulidae), with descriptions of three new species from off Portugal, Gulf of Guinea, and Western Indian Ocean. Journal of the Fisheries Research Board of Canada, 28, 1373–1383.



