Fernando Ruiz-Gutiérrez a, Cuauhtémoc Chávez b, Gerardo Sánchez-Rojas a, *, Claudia Elizabeth Moreno a, Constantino González-Salazar b, Beida Odalis Ruiz-Gutiérrez c y Rubí Torres-Bernal c
a Centro de Investigaciones Biológicas, Instituto de Ciencias Básicas e Ingeniería, Universidad Autónoma del Estado de Hidalgo. Carretera Pachuca-Tulancingo Km 4.5 Ciudad del Conocimiento, Col. Carboneras, 42184 Mineral de la Reforma, Hidalgo, México
b Departamento de Ciencias Ambientales, División de Ciencias Biológicas y de la Salud, Universidad Autónoma Metropolitana-Unidad Lerma, Av. Hidalgo poniente 46, Col. La Estación, 52006 Lerma de Villada, Estado de México, México
c Facultad de Ciencias Químico-Biológicas, Universidad Autónoma de Guerrero, Av. Lázaro Cárdenas s/n, Ciudad Universitaria, Col. La Haciendita, 39087 Chilpancingo, Guerrero, México
*Autor para correspondencia: gsanchez@uaeh.edu.mx (G. Sánchez-Rojas)
Recibido: 8 agosto 2019; Aceptado: 10 marzo 2020
Resumen
La Sierra Madre del Sur de Guerrero, México, cuenta con paisajes variados y heterogéneos, que favorecen la presencia de una importante diversidad biológica. El objetivo de este trabajo es comparar diferentes atributos de la diversidad regional de mamíferos medianos y grandes en 8 paisajes con el uso de datos de fototrampeo, así como evaluar si las características ambientales influyen en estos parámetros y si este grupo biológico puede ser considerado como un subrogado para la toma de decisiones sobre conservación de la biodiversidad. Se analizó la riqueza de especies, la diversidad taxonómica, la riqueza funcional y la diversidad beta entre paisajes, así como las relaciones entre estos atributos y las características ambientales. Instalamos 325 estaciones de trampas-cámaras, cubriendo 1,134 km2 y 24,974 días trampas, detectando 22 especies de mamíferos silvestres. Encontramos diferencias significativas en los atributos de diversidad medidos entre los paisajes, aunque con una magnitud de cambio pequeña, que puede relacionarse con la amplia movilidad natural de las especies. Se observó que los atributos taxonómicos y funcionales no son necesariamente complementarios para categorizar y seleccionar sitios prioritarios, pero que evaluarlos simultáneamente con datos robustos puede ser una herramienta valiosa para la toma de decisiones de manejo y conservación.
Palabras clave: Diversidad alfa; Diversidad beta; Diversidad funcional; Trampas cámaras
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Medium and large mammals of the Sierra Madre del Sur de Guerrero, Mexico: comprehensive assessment of diversity and its relationship with environmental characteristics
Abstract
The Sierra Madre del Sur de Guerrero, Mexico, has varied and heterogeneous landscapes, which favor the presence of an important biological diversity. The objective of this study is to compare different attributes of the regional diversity of medium and large mammals in 8 landscapes with the use of camera trap data; as well as to assess whether environmental characteristics influence these parameters, and if this biological group can be considered as a surrogate for decision-making in biodiversity conservation. Species richness, taxonomic diversity, functional richness and beta diversity between landscapes were analyzed, as well as the relationships between these attributes and the environmental characteristics. We installed 325 camera-trap stations, covering 1,134 km2 and 24,974 trap days, detecting 22 species of wild mammals. We found significant differences in the diversity attributes measured between the landscapes, although with a small magnitude of change, which can be related to the wide natural mobility of the species. It was noted that taxonomic and functional attributes are not necessarily complementary to categorize and select priority sites, but that simultaneously assessing the different attributes of diversity with robust data can be a valuable tool for management and conservation decision making.
Keywords: Alfa diversity; Beta diversity; Functional diversity; Camera trapping
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
La pérdida de biodiversidad es uno de los problemas ambientales actuales más críticos que amenazan los servicios de los ecosistemas y el bienestar humano (Ceballos et al., 2015). Una de las preocupaciones más importantes para conocer las dimensiones del daño de las actividades humanas a los paisajes naturales es como medir las diferentes dimensiones de la biodiversidad a nivel de especies, filogenética, funcional y sus cambios a lo largo diferentes escalas geográficas y temporales. Por lo que esto ha sido uno de los campos más activos y desarrollados en los últimos años (Moreno et al., 2017, 2018). Sin embargo, en la mayoría de los casos solo se evalúan las métricas tradicionales como la riqueza, la diversidad taxonómica o bien se analizan por separado otros aspectos como la diversidad funcional o filogenética y rara vez se realiza un análisis completo o integral que permita visualizar si estas dimensiones pueden ser complementarias en la evaluación y toma de decisiones de manejo y conservación de las especies (Briones-Salas et al., 2016; Calderón-Patrón, Briones-Salas et al., 2013; Coronel-Arellano et al., 2018; Gómez-Ortiz et al., 2017; Muench y Martínez-Ramos, 2016).
Uno de los principales grupos usados como subrogados en la evaluación de la biodiversidad suelen ser los mamíferos, esta condición los hace muy deseables como modelos para programas de monitoreo a largo plazo y para establecer patrones de diversidad (Monroy-Gamboa et al., 2019; Sato et al., 2019). En los últimos años el uso de tecnologías modernas como las trampas-cámara, el desarrollo de métodos estandarizados de muestreo y el uso de modelos y herramientas para su análisis, han permitido que este grupo taxonómico sea utilizado para evaluar algunas métricas de diversidad taxonómica o funcional a diferentes escalas espaciales y temporales (Brum et al., 2017; Chávez et al., 2007, 2013; Gómez-Ortiz et al., 2017; González-Maya et al., 2016; Koleff y Soberón, 2008; Mandujano, 2017; Oliveira et al., 2016; Porras-Murillo et al., 2011; Rodríguez et al., 2003; Rovero y Zimmermann, 2016; Rovero et al., 2014).
En términos generales, los mamíferos medianos y grandes se caracterizan por tener una gran movilidad y amplio ámbito hogareño, que en nuestra área de estudio promedia los 14 km2 (estimación generada a partir de datos de PanTheria, Jones et al., 2009), lo que se traduce en una distribución geográfica amplia que favorece la utilización de hábitats variados, por lo cual su diversidad regional debería tener poca variabilidad. Sin embargo, este tópico que incluye evaluar si las características ambientales funcionan como un “filtro” que favorece o limita la presencia de especies con ciertos rasgos biológicos, que pueden repercutir en la composición poblacional y por consiguiente en la diversidad de las especies, ha sido poco explorado en los mamíferos (Zobel, 1997), a pesar de que el uso del fototrampeo, que puede aportar información robusta al respecto, se ha incrementado mucho en la literatura (Mandujano, 2019). Este método empleado de manera sistemática puede dar información para evaluar si las características ambientales de los paisajes, las modificaciones antropogénicas, o la historia natural de las especies, influyen en su presencia y dinámica poblacional, favoreciendo la caracterización y priorización de paisajes o regiones para su conservación.
El presente estudio se realizó en la subprovincia de la Sierra Madre del Sur Oriental (SMS de Guerrero sensu Morrone, 2017), la cual cuenta con una amplia variedad de paisajes de naturaleza heterogénea, conformada por parches homogéneos en sus características edáficas, litológicas, topográficas y biológicas (Durán et al., 2002). Esta subprovincia se encuentra en la zona de influencia de la transición neártica-neotropical, lo cual favorece la presencia de una gran diversidad de especies (Luna-Vega et al., 2016; Morrone, 2017), destacando varios vertebrados microendémicos como la ranita jaguar (Charadrahyla tecuani; Campbell et al., 2009), la cascabel de cola larga (Crotalus ericsmithi; Campbell y Flores-Villela, 2008), el colibrí coqueta de Atoyac (Lophornis brachylophus; Moore, 1949), la musaraña de Goldman (Cryptotis goldmani goldmani; Merriam, 1895), el ratón de Baker (Reithrodontomys bakeri; Bradley et al., 2014) y el conejo de Omiltemi (Sylvilagus insonus; Nelson, 1904), entre otros. Por lo tanto, la presencia de estas y otras especies endémicas, incrementan el valor de la SMS de Guerrero, como un sitio prioritario para la conservación de la biodiversidad.
Los objetivos de este trabajo fueron: evaluar diferentes atributos de la diversidad regional de los mamíferos medianos y grandes, identificar si las características ambientales influyen en la composición poblacional, así como valorar si las diferentes métricas de la diversidad pueden ser complementarias para identificar sitios prioritarios para la conservación en la SMS de Guerrero. Para ello, se utilizaron datos de fototrampeo recopilados en 9 años, en 8 paisajes, con diferentes características ambientales. Se analizaron 4 atributos principales: 1) la riqueza de especies, 2) la diversidad taxonómica, 3) la riqueza funcional y 4) la diversidad beta entre unidades de paisaje, con sus componentes de recambio y diferencias en riqueza. Se hipotetiza que no habrá una congruencia espacial en los valores de las dimensiones de la diversidad de los mamíferos mediano y grandes, por lo que la evaluación integral de estos parámetros permite categorizar y jerarquizar en orden de importancia a los paisajes, e identificar si las características ambientales influyen sobre la diversidad local y regional.
Materiales y métodos
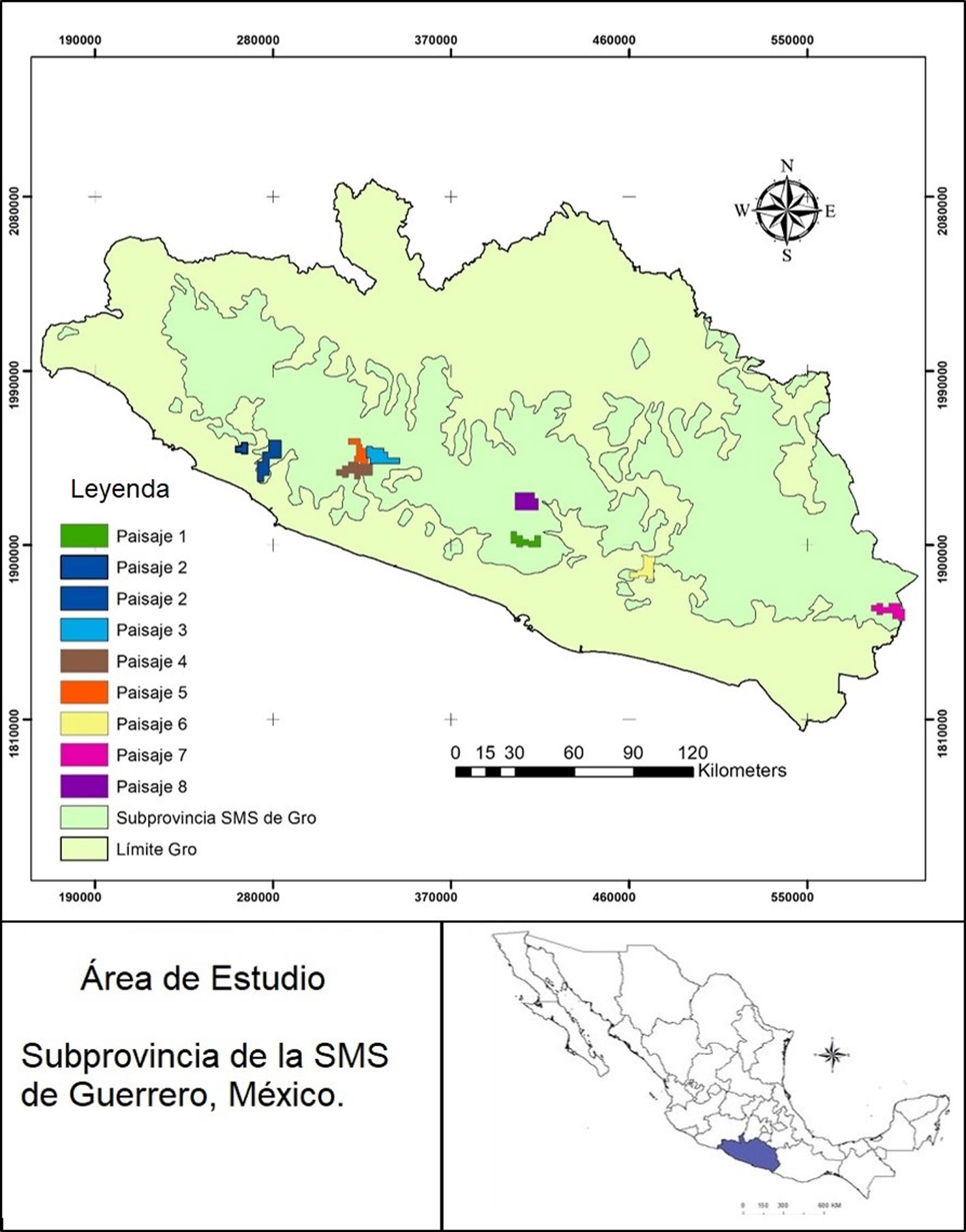
Los paisajes muestreados en la SMS de Guerrero corresponden a 8 bloques de muestreo que cubren diferentes áreas, todas mayores a 81 km2. Se eligieron por contar con extensiones amplias de bosques primarios, carecer de estudios y porque se contaba con el interés y colaboración de los pobladores locales. Estos muestreos son parte de la evaluación estatal del Censo Nacional del Jaguar (Chávez et al., 2007).
Los paisajes están ubicados en los municipios de Ajuchitlán del Progreso, Chilpancingo de los Bravo, Coyuca de Benítez, Petatlán, Técpan de Galeana, Tecoanapa, Tlacoachistlahuaca y Xochistlahuaca (fig. 1). Los muestreos cubrieron una extensión total de 1,134 km2, que cuentan con una amplia variedad de tipos de vegetación, tanto tropicales como templados, conformados por selva baja subcaducifolia, bosques de Quercus, bosques de Quercus–Pinus, bosques de Pinus–Quercus, bosques de Pinus y bosques mesófilos de montaña. Incluyen además áreas con vegetación secundaria de las diferentes asociaciones vegetales, así como áreas de pastizales y de uso agropecuario (INEGI, 2017). El intervalo altitudinal va de los 350 a más de 2,800 m snm (tabla 1).
Tabla 1
Características generales de los paisajes e información sobre los muestreos realizados
|
Núm. paisaje |
Municipio/nombre del paisaje |
Núm. Cámaras/estaciones |
Área (km2) |
Meses / año de muestreo |
EM (días- trampas) |
Núm. Fotografías tot/ind |
Intervalo altitudinal |
Tipos de vegetación |
|
1 |
Chilpancingo-Coyuca/Pueblos Santos |
79/65 |
117 |
Abril-mayo/2009 |
2370 |
384 (321) |
900-1,900 |
SBC, BPQ, BP |
|
2 |
Petatlán |
80/67 |
198 |
Abril-mayo/2011 |
3486 |
584 (453) |
408-1,479 |
SBC SMS, SMS -C, BQ, BQP, BPQ, BMM. |
|
3 |
Técpan/ Cordón |
38/32 |
108 |
Enero-abril/2014 |
2438 |
372 (276) |
1,299-2,810 |
BP, BPQ, BMM |
|
4 |
Técpan/ Humedades |
31/27 |
126 |
Marzo-junio/2015 |
1380 |
425 (247) |
514-1,417 |
SBC, BQ, VRQ, BQ, BP, BPQ |
|
5 |
Técpan/ Regional |
58/53 |
270 |
Nov-mayo/2016-2017 |
6314 |
1652 (1008) |
648-2,317 |
SBC, BQ, VRQ, BPQ, BP, BQP, BMM |
|
6 |
Tecoanapa |
20/20 |
81 |
Nov-enero/2016-2017 |
1700 |
791 (312) |
358-1,103 |
SBC, BQ, VRQ, BPQ, BBC |
|
7 |
Tlacoachistlahuaca y Xochistlahuaca |
30/25 |
117 |
Abril-jun/2016 |
2618 |
431 (288) |
522-1,498 |
SBC, BQ, BQP, BP, BPQ, |
|
8 |
Chilpancingo/Jaleaca |
46/36 |
117 |
Nov-Marzo/2017-2018 |
4668 |
778 (654) |
649-1,500 |
SBC, BQ, BQP, VRQ-BPQ |
Abreviaturas: EM = esfuerzo de muestreo, SBC = selva baja caducifolio, SMS = selva mediana subcaducifolio, SMS-C = selva mediana subcaducifolio y cafeto, BQ = bosque de Quercus, BP = bosque de Pinus, BP = bosque de Pinus, BBC = bosque de Byrsonima y Curatella, VRQ = vegetación ribereña de bosque de Quercus (Rzedowski, 2006). IE: Índice de integridad ecológica (Equihua, 2014; García-Alaniz, 2017). Se observa variación entre el número de estaciones y de las cámaras instaladas, debido a que algunas estaciones fueron dobles.
Para generar una medida de la heterogeneidad ambiental de los paisajes que pueda relacionarse con las métricas de diversidad evaluadas se cuantificó el área de muestreo (km2), el porcentaje de la cobertura forestal (cobertura primaria y vegetación secundaria arbórea) y el número de tipos de vegetación obtenidos del mapa de uso de suelo y vegetación serie VI (INEGI, 2017). Se incluyó también el promedio, el intervalo y la desviación estándar de la altitud, así como el promedio del índice de integridad ecológica de cada paisaje, el cual representa su capacidad de resiliencia estimada (Conabio: https://monitoreo.conabio.gob.mx/indicadores.html/; Equihua et al., 2014; tabla 2). La información fue procesada con el programa ArcMap 10.5 (ESRI, 2016).
Los valores obtenidos de estas variables ambientales fueron estandarizados a valores de Z y con ellos se realizó un análisis de componentes principales (PCA por sus siglas en inglés) para reducir la dimensionalidad de las variables de los 8 paisajes estudiados. Utilizando el primer componente del PCA (PC1) y las estimaciones de riqueza, riqueza funcional y diversidad taxonómica, se realizó una prueba de correlación lineal de Pearson, para determinar si están o no correlacionados (Zar, 2010). Con los 2 componentes principales del PCA (PC1 y PC2), se generó una matriz de distancia ambiental que mide de manera adimensional la disimilitud ambiental, calculando la distancia euclidiana entre cada paisaje. Con las coordenadas geográficas del centroide de cada paisaje se generó una matriz de distancia geográfica; ambas matrices se utilizaron para realizar análisis de correlación con los valores de las diferentes métricas de diversidad evaluadas.
Entre 2009 y 2018 se realizaron muestreos no simultáneos que abarcaron 8 áreas de muestreo o paisajes, utilizando el método de fototrampeo. Cada uno de los paisajes tuvo esfuerzos de muestreo diferentes (entre 1,380 y 6,314 días-trampas), variando el número de cámaras utilizadas de 20 hasta 80. En total, se instalaron 382 cámaras en 325 estaciones de foto-colecta (57 estaciones fueron dobles; tabla 1, fig. 1). Los muestreos se realizaron con trampas cámaras de diferentes marcas, principalmente Cuddeback Digital®, complementadas con algunas Scoutguard®, LT Acorn®, Moultrie® y Deercam® análogas.
El esfuerzo de muestreo en cada paisaje no fue idéntico debido a las diferentes condiciones ambientales y sociales, sin embargo, se siguió en cada caso el método estandarizado del Censo Nacional del Jaguar (CENJAGUAR, Chávez et al., 2007). En los paisajes muestreados se establecieron entre 9 y 21 cuadrantes de 9 km2 cubriendo áreas de entre 81 y 270 km2. En cada cuadrante se instalaron de 2 a 3 estaciones de fototrampeo separadas por una distancia de entre 1 y 3 km lineales. No se utilizaron atrayentes para las especies, por tanto, se eligieron los sitios con la mayor probabilidad de fotografiarlas (brechas, caminos, senderos naturales, cuerpos de agua, etc.), considerando la presencia de rastros u otras evidencias de que usan el lugar (Chávez et al., 2013).
La instalación del primer bloque de muestreo inició el 16 de abril de 2009 y el último concluyó a finales de marzo de 2018. Las cámaras se sujetaron a troncos de árboles a una altura de entre 30 y 50 cm sobre el suelo, con un ángulo que permitiera la captura de los costados de los organismos (Chávez et al., 2013). Las cámaras fueron programadas con los datos de fecha y hora, para tomar un evento por minuto durante las 24 h. La duración de los muestreos varió entre 30 y 165 días consecutivos (tabla 1).
Las fotografías tomadas fueron revisadas para determinar el número de individuos, las especies registradas, la fecha y hora de recolecta, así como los eventos independientes obtenidos en cada uno de los paisajes muestreados. Se consideró eventos independientes cuando se obtuvieron fotografías consecutivas de diferentes individuos, o fotografías consecutivas de individuos de la misma especie, separadas por al menos 24 h. Para cada estación de recolecta se registró la información referente a la ubicación geográfica, altitud y el tipo de vegetación presente. Las especies fueron determinadas con las monografías de los mamíferos de México (Ceballos, 2014) y la lista taxonómica de especies (tabla 3), sigue la propuesta para México de Ramírez-Pulido et al. (2014).
A partir de los datos del fototrampeo, se estimó la riqueza (número de especies) y la diversidad taxonómica (diversidad de orden 1, 1D sensu Jost, medida como el exponencial del índice de Shannon-Wiener), con un intervalo de confianza de 95%. Los valores se estimaron en función de la cobertura de la muestra, para ello se realizó una interpolación de los paisajes que presentaron valores altos, y una extrapolación de los paisajes con baja cobertura de muestra, no sobrepasando el doble de la riqueza observada en el análisis, hasta tener un mismo porcentaje de cobertura de la muestra de 96.6% (Chao y Jost, 2012; Chao y Shen, 2003; López-Mejía et al., 2017).
Tabla 2
Datos ambientales de los paisajes muestreados, utilizados para el análisis de PCA.
|
Núm. Paisajes |
Área (km2) |
% cobertura |
Variación alt. (m snm) |
Prom-alti |
Var-alt |
DS-Alt |
Núm. T-veg |
Ie |
PC 1 |
PC 2 |
|
1 |
117 |
87.5 |
1,000 |
1,409.5 |
45,225.4 |
212.7 |
4 |
0.74 |
-0.46 |
-1.62 |
|
2 |
198 |
74.3 |
1,071 |
914.4 |
67,037.5 |
258.9 |
6 |
0.64 |
-0.50 |
1.42 |
|
3 |
108 |
93.8 |
1,511 |
2,207.7 |
85,566.1 |
292.5 |
4 |
0.84 |
2.01 |
-2.46 |
|
4 |
126 |
86.1 |
903 |
984.1 |
72,090.4 |
268.5 |
6 |
0.75 |
-0.33 |
0.27 |
|
5 |
270 |
85.4 |
1,669 |
1,309.1 |
208,030 |
456.1 |
6 |
0.78 |
3.96 |
2.02 |
|
6 |
81 |
68.9 |
745 |
811 |
40,350.8 |
200.9 |
6 |
0.51 |
-2.83 |
1.09 |
|
7 |
117 |
61.8 |
976 |
896.8 |
67,445.8 |
259.7 |
5 |
0.68 |
-1.19 |
0.69 |
|
8 |
117 |
92.7 |
851 |
1,088.4 |
51,566.8 |
227.1 |
4 |
0.73 |
-0.66 |
-1.41 |
Abreviaturas: Prom-alti = promedio de la altitud en metros, Var-alt = varianza del promedio de la altitud, DS-alt = desviación estándar del promedio de la altitud, Núm. T-veg = número de tipos de vegetación, Ie = índice de integridad ecológica (Equihua et al., 2014; García-Alaniz et al., 2017). PC1 y PC2, corresponden a los resultados obtenidos del análisis de componentes principales.
Para realizar el análisis se utilizó la información de las frecuencias de captura de cada una de las especies para cada paisaje, así como el paquete iNEXT y el programa R 3.5.1 (Hsieh et al., 2016; R Development Core Team, 2018).
Otro de los atributos evaluados fue la riqueza funcional, considerada como la magnitud de las diferencias funcionales entre las especies a partir de sus rasgos funcionales, los cuales se relacionan directa o indirectamente con su desarrollo y adecuación, o con la estructura y el funcionamiento del ecosistema (Gómez-Ortiz y Moreno, 2017). Se utilizó el índice FRic, que representa la cantidad de espacio funcional ocupado por las especies de una comunidad, independientemente de sus abundancias (Córdova-Tapia y Zambrano, 2015; Villéger et al., 2008). Una baja riqueza funcional indica que algunos de los recursos potencialmente disponibles no están siendo explotados y podría tener como consecuencia una reducción en la productividad del ecosistema (Córdova-Tapia y Zambrano, 2015; Mason et al., 2005).
Para calcular el índice FRic se utilizaron los siguientes rasgos funcionales: a) dieta, b) el estrato de locomoción vertical, c) patrón de actividad, d) promedio de la longitud total en mm, e) el promedio del peso en gramos, f) la longevidad de la especie en años, y g) la organización social (tabla 4). Estos rasgos se obtuvieron de la literatura y de la base de datos de PanTheria (Aranda, 2012; Ceballos, 2014; Gómez-Ortiz et al., 2017; Jones et al., 2009); mientras que el patrón de actividad de las especies fue generado con los datos de recolecta.
Tabla 3
Lista taxonómica de especies registradas, basada en la propuesta de Ramírez-Pulido et al. (2014).
|
Orden |
Familia |
Especie |
NOM-059 |
IUCN |
|
Didelphimorphia |
Didelphidae |
Didelphis virginiana Kerr, 1793 |
LC |
|
|
Cingulata |
Dasypodidae |
Dasypus novemcinctus Linnaeus, 1758 |
LC |
|
|
Pilosa |
Myrmecophagidae |
Tamandua mexicana (Saussure, 1860) |
P |
LC |
|
Lagomorpha |
Leporidae |
*Sylvilagus cunicularius (Waterhouse, 1848) |
LC |
|
|
Rodentia |
Sciuridae |
Sciurus aureogaster F. Cuvier, 1829 |
LC |
|
|
Erethizontidae |
Sphiggurus mexicanus (Kerr, 1792) |
A |
LC |
|
|
Carnivora |
Felidae |
Leopardus pardalis (Linnaeus, 1758) |
P |
LC |
|
Leopardus wiedii (Schinz, 1821) |
P |
NT |
||
|
Puma concolor (Linnaeus, 1771) |
LC |
|||
|
Herpailurus yagouaroundi (Lacépède, 1809) |
A |
LC |
||
|
Panthera onca (Linnaeus, 1758) |
P |
NT |
||
|
Canidae |
Canis latrans Say, 1823 |
LC |
||
|
Urocyon cinereoargenteus (Schreber, 1775) |
LC |
|||
|
Mustelidae |
Eira barbara (Linnaeus, 1758) |
P |
LC |
|
|
Mustela frenata Lichtenstein, 1831 |
LC |
|||
|
Mephitidae |
Conepatus leuconotus (Lichtenstein, 1832) |
LC |
||
|
Mephitis macroura Lichtenstein, 1832 |
LC |
|||
|
Procyonidae |
Potos flavus (Schreber, 1774) |
Pr |
LC |
|
|
Nasua narica (Linnaeus, 1766) |
LC |
|||
|
Procyon lotor (Linnaeus, 1758) |
LC |
|||
|
Artiodactyla |
Tayassuidae |
Dicotyles angulatus Cope, 1889 |
LC |
|
|
Cervidae |
Odocoileus virginianus (Zimmermann, 1780) |
LC |
Abreviaturas: * = endémico de México; A = amenazada; P = en peligro de extinción; LC = preocupación menor; NT = cerca de amenazado.
Debido a que el índice FRic está relacionado de manera lineal con la riqueza de especies se generó un modelo nulo mediante 100 iteraciones, con el cual se obtuvieron los valores de tamaño del efecto estandarizado (SES por sus siglas en inglés) del índice FRic. Los SES eliminan los sesgos asociados con las diferencias en riqueza de especies en el índice FRic y comparan de manera efectiva la riqueza funcional de las comunidades (Swenson, 2014). Los valores positivos de SES FRic indican que la diversidad funcional es alta (sobredispersión funcional), mientras que los valores negativos representan una diversidad funcional baja (agrupamiento funcional; Swenson, 2014). Suponiendo una distribución normal para considerar un nivel de confianza de 95%, los valores de SES deben estar entre -1.96 y 1.96, por lo que los valores observados fuera de este intervalo se consideran estadísticamente distintos a lo esperado por azar (Fontanilla et al., 2019; Liu y Wang, 2018). El análisis se realizó con los paquetes FD y Picante en el programa R 3.5.1 (Kembel et al., 2019; Laliberté et al., 2010; R Development Core Team, 2018).
Se evaluó la diversidad beta entre los paisajes, considerando sus 2 componentes aditivos: la disimilitud debida al recambio y la disimilitud debida a las diferencias en riqueza (Baselga, 2010). Se siguió el método de Baselga y Orme que calcula las disimilitudes de sitios múltiples, teniendo en cuenta el recambio espacial, las diferencias en riqueza debidas al anidamiento y la suma de ambos valores (Baselga et al., 2018). Se utilizó el índice de Sorensen y el paquete betapart (beta. multi) para R 3.5.1 (Baselga et al., 2018).
Con los valores de los componentes de la diversidad beta (recambio, diferencias en riqueza y beta total) y los valores de distancia ambiental y geográfica de los 8 paisajes muestreados se realizó una prueba de Mantel para evaluar si existe alguna correlación entre estos atributos. Los análisis se realizaron con el programa Past versión 3.18 (Hammer et al. 2001).
Con los valores obtenidos de riqueza, riqueza funcional y la diversidad taxonómica de cada paisaje, se realizó un análisis de agrupación jerárquica utilizando distancias euclidianas como métricas de similitud y UPGMA como método de encadenamiento. Esto permitió categorizar a los paisajes en función de su similitud en los diferentes atributos de diversidad. El análisis se realizó en el programa Past versión 3.18 (Hammer et al., 2001).
Tabla 4
Rasgos funcionales utilizados para estimar la riqueza funcional (FRic)
|
Especie |
Dieta |
LVS |
Actividad |
Promedio LT (mm) |
Promedio peso (gr) |
Longevidad (yr) |
Rasgo social |
|
D. virginiana |
Omnívoro |
Semiarborícola |
Nocturno |
831 |
1,750 |
1.75 |
Solitario |
|
D. novemcinctus |
Omnívoro |
Terrestre |
Nocturno |
707.5 |
4,800 |
13.5 |
Solitario |
|
T. mexicana |
Insectívoro |
Arborícola |
Nocturno |
1,107.5 |
5,600 |
9.5 |
Solitario |
|
S. cunicularius |
Herbívoro |
Terrestre |
Catemeral |
500 |
2,000 |
6.4 |
Solitario |
|
S. aureogaster |
Granívoro |
Arborícola |
Diurno |
521.5 |
500 |
0.7 |
Solitario |
|
S. mexicanus |
Herbívoro |
Arborícola |
Nocturno |
762.5 |
2,800 |
15 |
Solitario |
|
L. pardalis |
Carnívoro |
Terrestre |
Nocturno |
1,143.5 |
9,000 |
8.5 |
Solitario |
|
L. wiedii |
Carnívoro |
Terrestre |
Nocturno |
1,052.5 |
5,000 |
16.5 |
Solitario |
|
P. concolor |
Carnívoro |
Terrestre |
Catemeral |
1,650 |
51,000 |
19 |
Solitario |
|
H. yagoauroundi |
Carnívoro |
Terrestre |
Diurno |
1,130 |
5,700 |
15 |
Solitario |
|
P. onca |
Carnívoro |
Terrestre |
Catemeral |
1,996.5 |
50,300 |
11.5 |
Solitario |
|
C. latrans |
Omnívoro |
Terrestre |
Catemeral |
1,112.5 |
10,000 |
10 |
Gregario |
|
U. cinereoargenteus |
Omnívoro |
Terrestre |
Nocturno |
550 |
3,300 |
8 |
Solitario |
|
E. barbara |
Carnívoro |
Terrestre |
Diurno |
1,062 |
4,200 |
18 |
Solitario |
|
M. frenata |
Carnívoro |
Terrestre |
Nocturno |
282.5 |
200 |
8.5 |
Solitario |
|
C. leuconotus |
Omnívoro |
Terrestre |
Nocturno |
521.5 |
2,100 |
7.5 |
Solitario |
|
M. macroura |
Omnívoro |
Terrestre |
Nocturno |
674 |
1,600 |
3 |
Solitario |
|
P. flavus |
Omnívoro |
Arborícola |
Nocturno |
1,075 |
2,500 |
29 |
Solitario |
|
N. narica |
Omnívoro |
Semiarborícola |
Catemeral |
1,095 |
4,300 |
14 |
Gregario |
|
P. lotor |
Omnívoro |
Terrestre |
Catemeral |
776.5 |
5,000 |
16 |
Solitario |
|
O. virginianus |
Herbívoro |
Terrestre |
Catemeral |
1,700 |
38,000 |
10 |
Solitario |
|
D. angulatus |
Omnívoro |
Terrestre |
Catemeral |
890 |
16,700 |
13.3 |
Gregario |
Abreviaturas: LVS = estrato de locomoción vertical, LT = longitud Total.
Resultados
Con un esfuerzo de muestreo de 24,974 días-trampas se obtuvieron 5,351 registros fotográficos, de los cuales 3,559 corresponden a eventos independientes (tabla 1). Se registró un total de 22 especies de mamíferos medianos y grandes, de los cuales 8 se encuentran dentro de alguna categoría de la Norma Oficial ECOL-059 (Semarnat, 2010) y 2 en la categoría de “casi amenazada” en la lista roja de la UICN (2019).
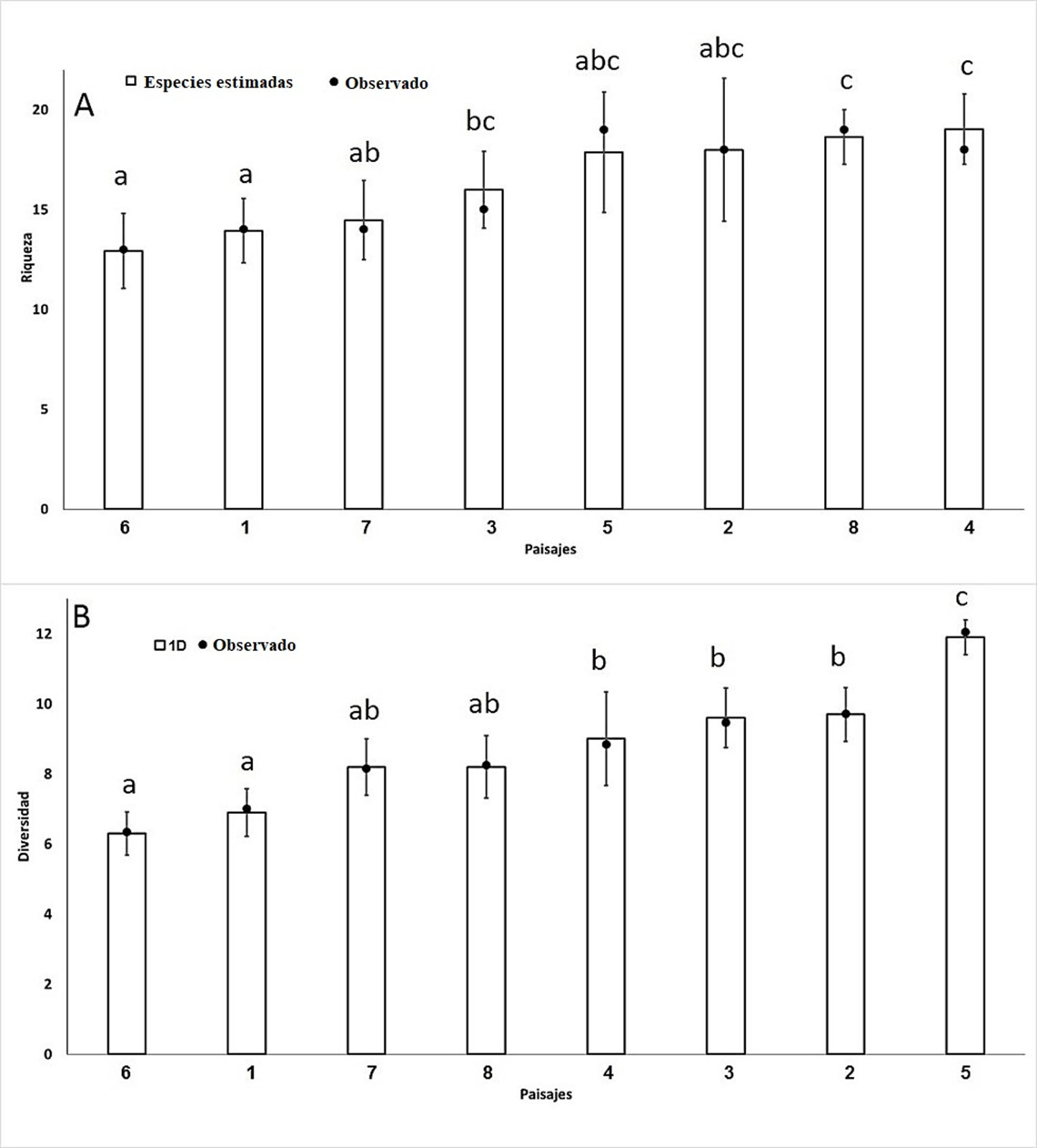
La riqueza de especies registrada en los paisajes varió entre 13 y 19 especies, con 16 especies en promedio. La riqueza y sus intervalos de confianza (95%) obtenidos del análisis, muestra 3 grupos generales: en el grupo “a”, con la riqueza más baja (13 y 14 spp.), están los paisajes 1, 6 y 7 (ver los nombres de los paisajes en la tabla 1); en los grupos “bc y abc”, con riqueza intermedia (entre 16 y 18 spp.), están los paisajes 2, 3, 5, y el grupo “c”, de mayor riqueza (19 spp.), está conformado por los paisajes 4 y 8 (fig. 2A).
Los valores de diversidad taxonómica (1D) de los paisajes 1 y 6 son significativamente menores al del resto de los paisajes, el paisaje 5 cuenta con la mayor diversidad (11.9 especies efectivas) y el resto no muestran diferencias significativas (fig. 2B).
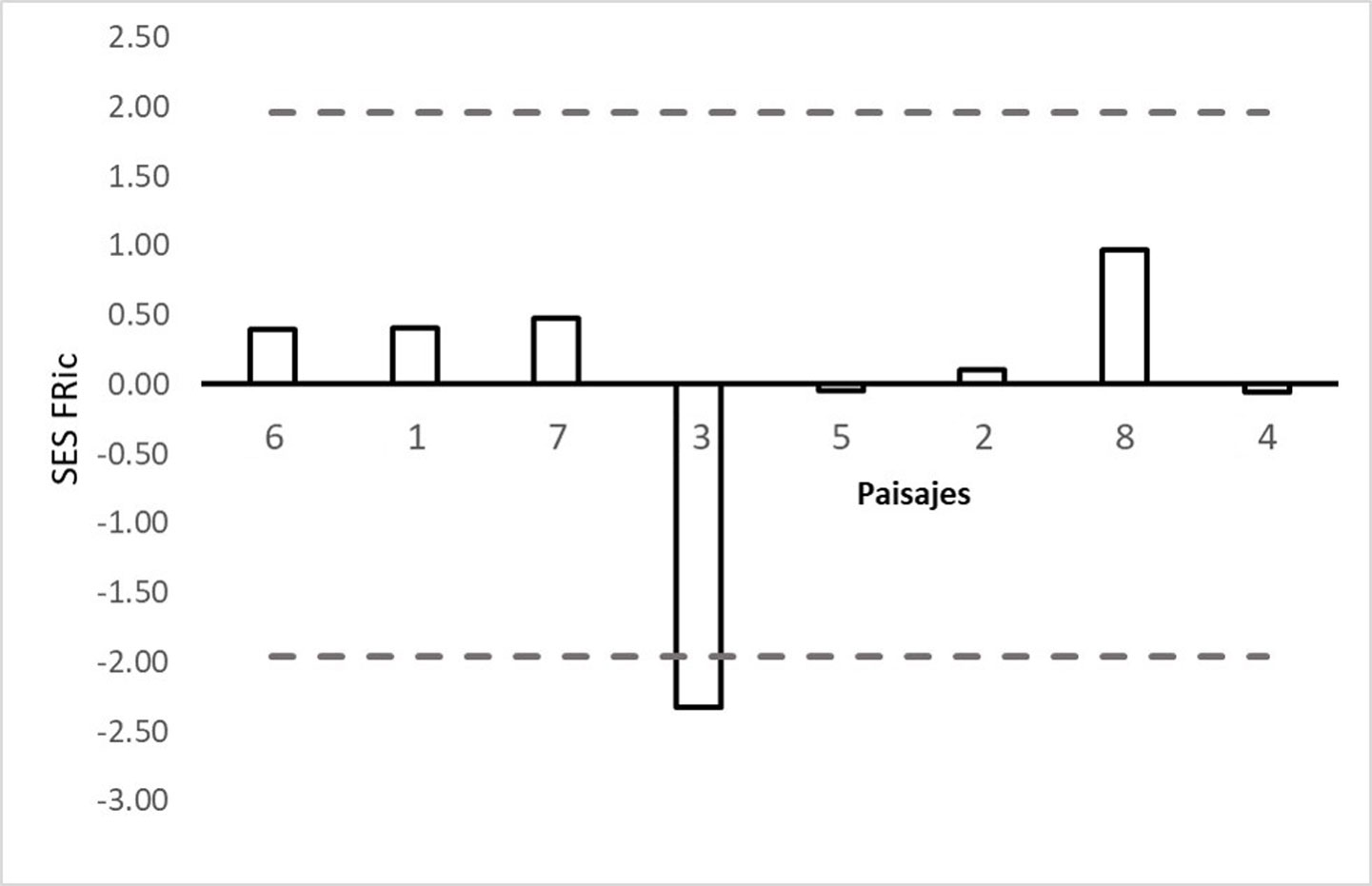
En el caso de la riqueza funcional (SES FRic), los paisajes 1, 2, 6-8, muestran valores positivos, mientras que el resto presentan valores negativos (fig. 3). Sin embargo, solo el paisaje 3 tuvo una riqueza funcional menor a la esperada por azar de acuerdo con el modelo nulo.
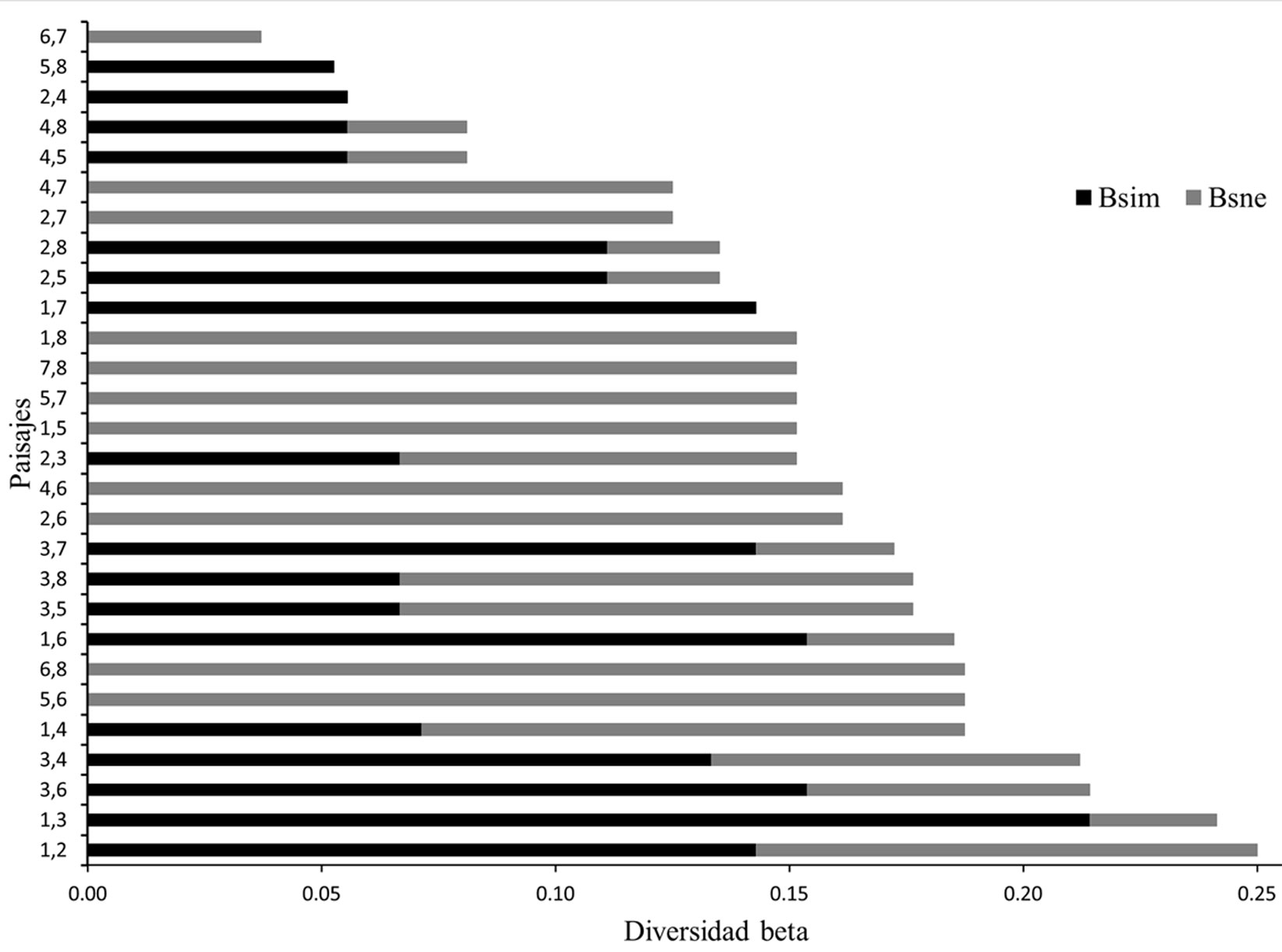
Respecto a la diversidad beta, entre los 8 paisajes analizados, la disimilitud promedio de beta total es de 15%, donde 6% corresponde a las diferencias en riqueza (Bsim) y 9% al recambio de especies (Bsne). Los paisajes que muestran mayores valores de disimilitud son el 1 y 2 con un 5% y el 1 y 3 con 24%; en el caso contrario, los paisajes 6 y 7 mostraron solo 4% de disimilitud, es decir, no hay grandes diferencias en su composición de especies (fig. 4).
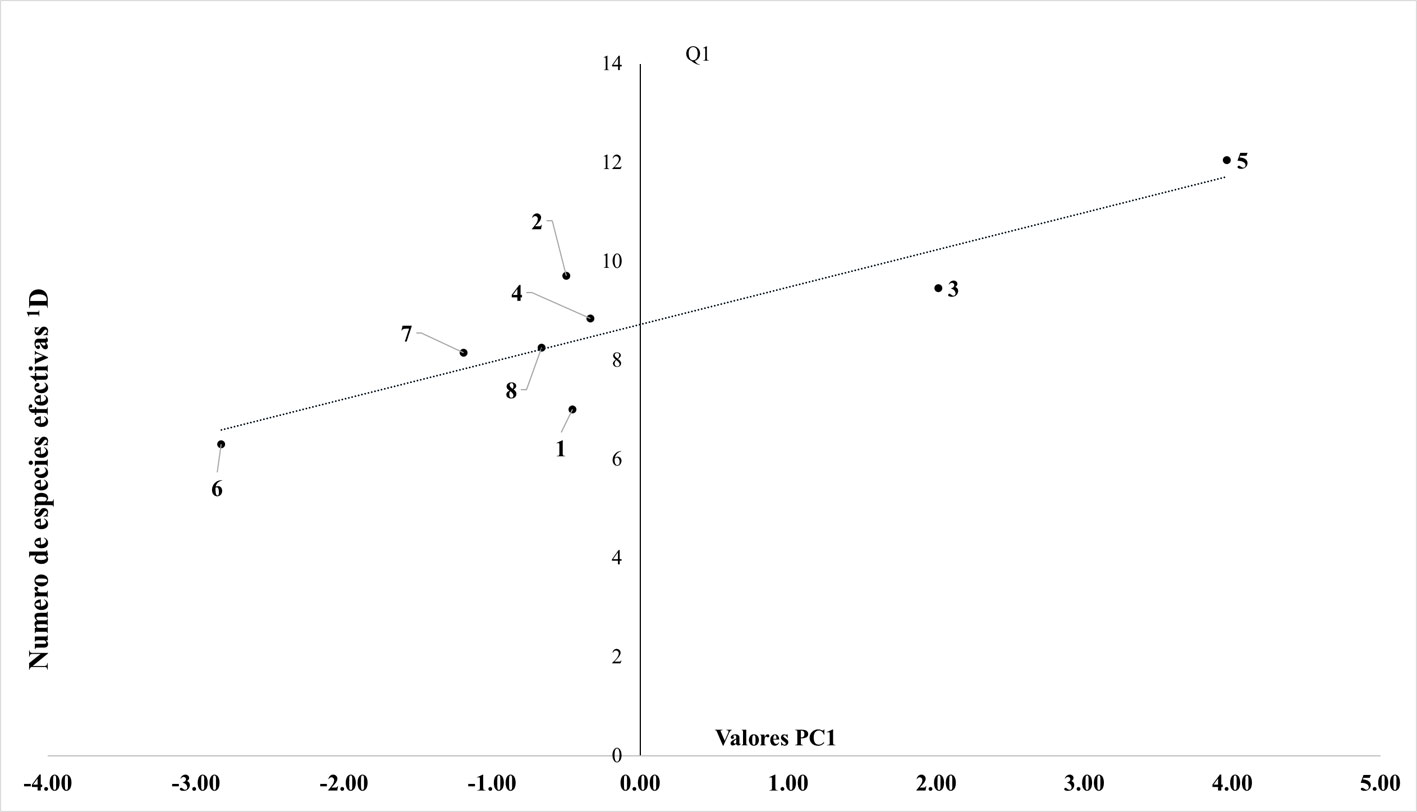
El análisis ambiental (PCA) determinó que el componente PC1 con un 53.9% de varianza, corresponde a la variabilidad de la altitud y el índice de integridad ecológica en los paisajes, mientras que el componente 2 (PC2) con 33.06% de varianza, corresponde al número de tipos de vegetación, el área en km2 de los paisajes, así como a la desviación estándar del promedio de la altitud de los paisajes. Al analizar si existe influencia del componente PC1 sobre la riqueza de especies y la riqueza funcional, las correlaciones no fueron significativas (p > 0.05 en ambos casos); mientras que si se evalúa con la diversidad de especies (1D), se obtiene una correlación significativa (r = 0.88, p = 0.004; fig. 5).
La evaluación de la distancia ambiental de los paisajes, respecto a los valores de diversidad beta total obtenidos, muestran una correlación negativa, pero no significativa r = -0.39, p = 0.93), mientras que, los valores de la distancia geográfica presentan valores positivos, pero tampoco son significativos (r = 0.07, p = 0.38).
Al considerar los 3 atributos de la diversidad de los mamíferos medianos y grandes (riqueza de especies, diversidad taxonómica y riqueza funcional), el análisis de agrupación permitió diferenciar 4 grupos generales: El primero corresponde a los paisajes 1, 6 y 7 que cuentan con los valores más bajos de riqueza y diversidad de especies y valores positivos de riqueza funcional. Un segundo grupo (2, 4 y 8) con valores altos de riqueza y diversidad, con valores tanto positivos como negativos de SES FRic. El tercero corresponde al paisaje 5, caracterizado por una alta riqueza y diversidad, con valores negativos de riqueza funcional. Por último, el cuarto grupo corresponde al paisaje 3 con valores altos de riqueza y diversidad, pero con un valor negativo de riqueza funcional (fig. 6).
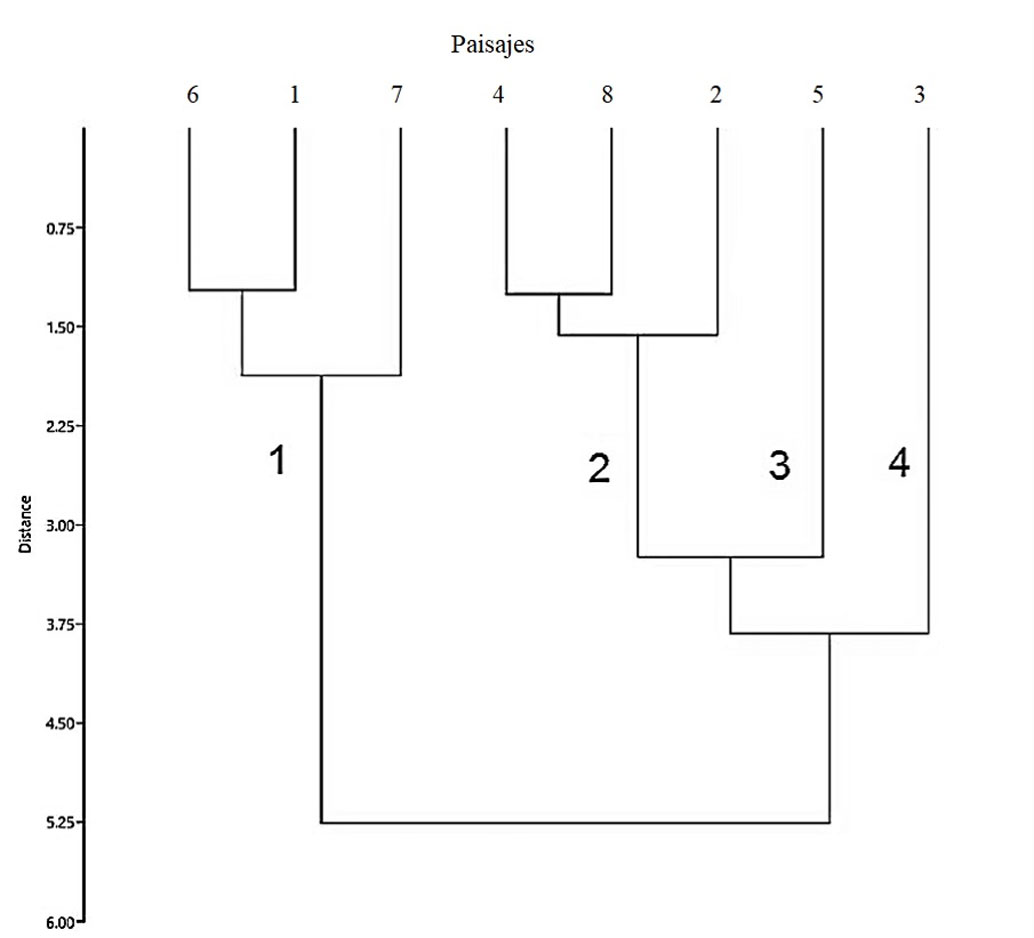
Discusión
El reconocer que la biodiversidad tiene múltiples componentes (taxonómicos, genéticos y evolutivos), y que cada uno de estos ofrecen información y valores potencialmente diferentes, plantea la necesidad de que la toma de las decisiones en conservación de manera preferente utilice varios de estos componentes de la diversidad, ya que la preservación de algunos de ellos no necesariamente garantiza la preservación de otros (Cadotte y Tucker, 2018; Martin-Regalado et al., 2019).
Este trabajo propone un planteamiento para evaluar la diversidad de los mamíferos medianos y grandes con diferentes métricas, utilizando un método de muestreo estandarizado en toda una subprovincia fisiográfica y donde ninguno de los paisajes estudiados cuenta con algún estatus de protección, de manera que se pueda contribuir a resaltar su importancia. En México han existido trabajos regionales sobre este grupo de mamíferos, sin embargo, el enfoque ha sido diferente, además que las áreas cubiertas y los esfuerzos de muestreo realizados son menores a los aquí presentados, por ejemplo, Monroy-Vilchis et al. (2011) en la sierra de Nanchititla, Estado de México; Coronel-Arellano et al. (2018) para el noreste de México; Muench y Martínez-Ramos (2016) y Porras-Murillo et al. (2011) en el suroeste del país (tabla 5). La riqueza registrada (22 especies) cae dentro del intervalo de 16 a 25 especies reportadas para estudios con trampas cámaras en México y Centroamérica (Coronel-Arellano et al., 2018; Davis et al., 2010; Monroy-Vilchis et al., 2011; Muench y Martínez-Ramos, 2016; Porras-Murillo et al., 2011). A nivel de paisajes, 3 de los 8 analizados muestran un valor de riqueza inferior a las 16 especies, de los cuales 2 (paisajes 6 y 7) corresponden a los paisajes con bajos porcentajes de cobertura forestal, de altitud y del índice de integridad ecológica (tabla 2).
De estas especies, 8 fueron registradas en muy pocas ocasiones (Eira barbara, Canis latrans, Mustela frenata, Mephitis macroura, Panthera onca, Sphiggurus mexicanus, Tamandua mexicana y Potos flavus), por lo que son raras en los paisajes evaluados, lo cual puede obedecer al efecto individual o combinado de 3 factores principales: 1) sus bajas densidades poblacionales en la naturaleza, por lo que no pudieron ser registradas en todos los paisajes, a pesar del amplio esfuerzo realizado (> 93% de completitud); 2) especies de hábitos arborícolas con poca detectabilidad con las trampas cámaras y por último, 3) la presión sobre las poblaciones por cacería directa y por represalias por depredación de ganado, algo similar a lo reportado por Muench y Martínez-Ramos (2016) en Chiapas. La presencia o ausencia de estas especies son las que marcan los cambios en las diferentes métricas de la diversidad taxonómica de nuestros paisajes.
De las 28 especies de mamíferos terrestres que potencialmente se pueden registrar con la técnica de fototrampeo en la SMS de Guerrero, en este estudio no se registraron 6. De estas, S. angustifron ha sido recolectada en Acahuizotla, municipio de Chilpancingo (Ávila-Nájera, 2006), mientras que L. rufus y S. insonus fueron registradas por Leopold y Hernández (1944) y Cervantes-Reza et al. (2003), respectivamente. El resto (Lepus callotis, S. pygmaea y B. astutus) han sido fotocolectadas u observadas por F. Ruiz-Gutiérrez en muestreos independientes a los aquí analizados o en el caso de L. rufus, que ha sido fotocolectado en otra subprovincia de Guerrero (datos no publicados).
Solo el paisaje 3 presentó un valor negativo y significativo de riqueza funcional, lo cual indica que existe un agrupamiento funcional, es decir, que las especies que coexisten en este paisaje son más parecidas en sus rasgos funcionales de lo esperado por azar, lo cual podría sugerir que hay redundancia funcional entre estas especies. Esto coincide con lo mencionado por Oliveira et al. (2016), que sitios con altos valores de riqueza de especies y amplia disponibilidad de recursos albergan especies que son funcionalmente redundantes, favoreciendo su resiliencia.
La riqueza funcional no parece tener relación con las otras métricas de diversidad taxonómica evaluadas; ésto puede deberse a que varias de las especies de mamíferos medianos y grandes aquí analizados pueden tener redundancia funcional. Sin embargo, ésto no aplica para especies especialistas de tamaño grande como el jaguar, que tiende a desaparecer de sitios con altos niveles de fragmentación (Muench y Martínez-Ramos, 2016).
La diversidad taxonómica (1D) es la única métrica que muestra una relación positiva con las características ambientales, esto confirma que la calidad del ambiente influye sobre la estructura de la comunidad de mamíferos medianos y sobre todo de los grandes especialistas.
Tabla 5
Comparación de características ambientales y esfuerzos de muestreo en estudios con trampas cámaras en México.
|
Sitio o región |
Núm. de estaciones |
Núm. de especies/EM |
Área de muestreo (km2) |
Núm. de paisajes |
Tipos de vegetación |
Autores |
|
Nanchititla, Edo. de México |
17 |
19/4,305 |
663 |
1 |
SBC BQ, BMM, BPQ, AA, PZ |
Monroy-Vilchis et al. (2011) |
|
RB-Montes Azules, Chiapas |
94 |
18/6,922 |
107 |
2 |
BTLL |
Porras-Murillo et al. (2011) |
|
NE Sonora |
196 |
25/6,668 |
357 |
7 |
MEW, PGBG, SG, ST |
Coronel-Arellano et al. (2018) |
|
SMS de Guerrero |
300 |
22/24,974 |
1,134 |
8 |
SMS, BQ, BQP, BP, BPQ, BMM, PZ, AA y P |
Este trabajo |
AA = Áreas agrícolas, AA-P = áreas agrícolas y pastizales, BTC = bosque tropical caducifolio, BTS = bosque tropical subcaducifolio, BQ = bosque de Quercus, BMM = bosque mesófilo de montaña, BPQ = bosque de Pinus- Quercus, BTLL = bosque tropical lluvioso, MEW = bosque siempre verde de la Sierra Madre; PGBG = llanuras y pastizales de la Gran Cuenca; PMCF = bosque de coníferas de montañas rocosas; SG = pastizales semidesérticos; ST = matorral espinoso sinaloense.
EM = Esfuerzo de muestreo.
Respecto a la diversidad beta, la estimación de beta total es baja, dentro de la cual se observa una mayor influencia del recambio de especies, lo cual está influenciado por las especies exclusivas a ciertos paisajes, como E. barbara, P. flavus y P. onca (fig. 4). Los valores bajos de beta pueden atribuirse a que la mayoría de las especies aquí analizadas, son de gran movilidad, y salvo algunas excepciones, podrían encontrarse en gran parte de la SMS de Guerrero, algo similar a lo reportado para el sureste del país (Porras-Murillo et al., 2011).
En el área estudiada, ni la distancia ambiental ni la distancia geográfica están relacionadas con la diversidad beta de los mamíferos. Esto puede estar deberse a que: 1) son especies generalistas, con la capacidad de sobrevivir en cualquiera de los ambientes presente en la subprovincia, 2) algunas especies tienen amplia distribución y gran movilidad como L. pardalis, P. concolor, P. onca, C. latrans, que suelen tener ámbitos hogareños que pueden sobrepasar los 100 km2 (Chávez y Ceballos, 2014a, b; Moreno y Aranda, 2014; Servín et al., 2014), y 3) el área estudiada en la SMS de Guerrero es pequeña para un grupo biológico con alta capacidad de movilidad.
Tampoco se encontró relación significativa entre la distancia geográfica y los valores de la diversidad beta entre los paisajes; lo que implica que la distancia (km lineales entre paisajes) no influye de manera importante en las diferencias de la diversidad beta. Sin embargo, Calderón-Patrón, Moreno et al. (2013) sí reportan una relación significativa entre la distancia geográfica y la diversidad beta de vertebrados en el istmo de Tehuantepec, que concuerda con la relación de decaimiento de la similitud con la distancia, probablemente porque el Istmo es una región más extensa que el área de estudio del presente trabajo.
El análisis de agregados permitió agrupar a los paisajes en función de3dimensiones de la diversidad alfa: riqueza de especies, diversidad taxonómica y diversidad funcional. Esta síntesis de información nos permite plantear, en el caso de los mamíferos medianos y grandes de la SMS de Guerrero, que la dimensiones diversidad taxonómica es la más informativa y con base en ella se debería implementar la priorización de la conservación, fundamentalmente porque nuestros resultados muestran un valor bajo de diversidad beta.
Si bien el método de fototrampeo y el diseño de muestreo utilizado pueden presentar cierto sesgo respecto a las especies que pueden ser registradas, en términos generales generan datos robustos sobre las características de la comunidad de mamíferos. Por ello, este método puede constituir una herramienta importante para evaluar las diferentes métricas de la diversidad a diferentes escalas geográficas. En términos generales, la SMS de Guerrero cuenta con una diversidad moderada de mamíferos medianos y grandes, con una distribución relativamente homogénea. Sin embargo, este grupo biológico puede ser considerado como un valioso subrogado para la toma de decisiones de manejo y conservación debido a su valor ecológico como integrantes de distintos niveles dentro de las redes tróficas de los ecosistemas, por su valor de uso por las comunidades locales, así como por su importancia cultural.
Agradecimientos
Este trabajo fue gestionado y realizado por el Proyecto Guerrero Jaguar, el cual ha favorecido la colaboración de varias personas e instituciones, a quienes se les agradece ampliamente su participación, entre ellos a la Alianza Nacional para la Conservación del Jaguar A C., a la Universidad Autónoma Metropolitana, a la Universidad Nacional Autónoma de México, a la Universidad Autónoma del Estado de Hidalgo y a la Universidad Autónoma de Guerrero, quienes brindaron apoyo técnico, económico y con equipo para la realización de los muestreos. Agradecemos ampliamente a las autoridades y habitantes de los ejidos y comunidades involucradas en el presente trabajo, por su anuencia y por todo el apoyo brindado. Agradecemos también a nuestros colaboradores: Adriana Guevara, Adriana J. Pascual, Cesar Gamboa, Diego Woolrich, Elizabeth Beltrán, Enrique Vázquez, Guadalupe López, Gerardo Ceballos, Heliot Zarza, Jatziri Peralta, Joe Figel, Katia Zuñiga, Leonardo López, Luis Flores, Lineht Romero, Miguel A. Villalva, Oscar Aguirre y Yorllet Jiménez, por el apoyo brindado en campo y en diversas actividades del proyecto. La Comisión Nacional de Áreas Naturales Protegidas, la Secretaría de Medio Ambiente del Estado de Guerrero y la Comisión Nacional Forestal contribuyeron de manera directa o indirecta en el financiamiento de algunos de los muestreos. Este trabajo es parte de los resultados de los estudios del Doctorado en Biodiversidad en Conservación de Fernando Ruiz-Gutiérrez, quien contó con el apoyo del Conacyt con la beca número 247529.
Referencias
Aranda, M. (2012). Manual para el rastreo de mamíferos silvestres de México. México D.F.: Conabio.
Ávila-Nájera, D. M. (2006). Patrones de diversidad de la mastofauna del estado de Guerrero, México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. Mexico D.F.
Baselga, A. (2010). Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography, 19, 134−43. https://doi.org/10.1111/j.1466-
8238.2009.00490.x
Baselga, A., Orme, D., Villeguer, S., Bortoli, J., Leprieur, F., Logez, M. y Henriques-Silva, R. (2018). Packge betapart. Partitioning beta Diversity in Turnover and Nestedness Components. Ver 1.5. 1. CRAN.
Briones-Salas, M., Lira-Torres, I., Carrera-Treviño, R. y Sánchez-Rojas, G. (2016). Relative abundance and activity patterns of wild felids in Chimalapas rainforest, Oaxaca, México. Therya, 7, 123−134. https://doi.org/10.12933/therya-16-320
Brum, F. T., Graham, C. H., Costa, G. C., Hedges, S. B., Penone, C., Radeloff, V. C. et al. (2017). Global priorities for conservation across multiple dimensions of mammalian diversity. Proceedings of the National Academy of Sciences, 114, 7641−7646. https://doi.org/10.1073/pnas.1706461114
Cadotte, M. C. y Tucker, C. M. (2018). Difficult decisions: Strategies for conservation prioritization when taxonomic, phylogenetic, and functional diversity are not spatially congruent. Biological Conservation, 222, 128−133. https://doi.org/10.1016/j.biocon.2018.06.014
Calderón-Patrón, J., Briones-Salas, M. y Moreno, C. E. (2013). Diversidad de murciélagos en cuatro tipos de bosque de la Sierra Norte de Oaxaca, México, Therya, 4, 121−137. https://doi.org/10.12933/therya-13-90
Calderón-Patrón, J. M., Moreno, C. E., Pineda-López, R., Sánchez-Rojas, G. y Zuria, I. (2013). Vertebrate dissimilarity due to turnover and richness differences in a highly beta-diverse region: the role of spatial grain size, dispersal ability and distance. Plos One, 8, e82905. https://doi.org/10.1371/journal.pone.0082905
Ceballos, G. (Ed). (2014). Mammals of Mexico. Baltimore: Johns Hopkins University Press.
Ceballos, G., Ehrlich, P. R., Barnosky, A. D., García, A., Pringle, R. M. y Palmer, T. M. (2015). Accelerated modern human-induced species losses: entering the sixth mass extinction. Science Advances, 1, e1400253. https://doi.org/10.1126/sciadv.1400253
Cervantes-Reza, F. A., Lorenzo, C. y González-Cózatl, F. X. (2003). The Omiltemi rabbit (Sylvilagus insonus) is not extinct. Mammalian Biology, 68, 1−4. https://doi.org/10.1078/1616-5047-117
Chao, A. y Jost, L. (2012). Coverage-based rarefaction and extrapolation: standardizing simples by completeness rather than size. Ecology, 93, 2533−2547. https://doi.org/10.1890/11-1952.1
Chao, A. y Shen, T. J. (2003). Nonparametric estimation of Shannon’s index of diversity when there are unseen species in sample. Environmental and Ecological Statistics, 10, 429−443. https://doi.org/10.1023/a:1026096204727
Chávez, C. y Ceballos, G. (2014a). Puma concolor. En G. Ceballos (Ed.), Mammals of Mexico. (pp. 505−507). Baltimore: Johns Hopkins University Press.
Chávez, C. y Ceballos, G. (2014b). Panthera onca. En G. Ceballos (Ed.), Mammals of Mexico. (pp. 507−509). Baltimore: Johns Hopkins University Press.
Chávez, C., de la Torre, A., Bárcenas, H., Medellín, R., Zarza, H. y Ceballos, G. (2013). Manual de fototrampeo para estudio de fauna silvestre. El jaguar en México como caso de estudio. México D.F.: Alianza WWF-Telcel/ Universidad Nacional Autónoma de México.
Chávez, C., Ceballos, G., Medellín, R. A. y Zarza, H. (2007). Primer censo nacional de jaguar. En G. Ceballos, C. Chávez, R. List y H. Zarza (Eds). Conservación y manejo del jaguar en México: estudios de caso y perspectivas (pp. 133−141). México D.F.: Conabio/ Alianza WWF/Telcel/Universidad Nacional Autónoma de México.
Córdova-Tapia, L. y Zambrano, L. (2015). La diversidad funcional en la ecología de comunidades. Ecosistemas, 24, 78−87. https://doi.org/10.7818/ecos.2015.24-3.10
Coronel-Arellano, H., Lara-Díaz, N., Moreno, C. E., Gutiérrez-González, E. y López-González, C. (2018). Biodiversity conservation in the Madrean sky island: community homogenity of medium and large mammals in nortwestern Mexico. Journal of Mammalogy, 99, 465–477. https://doi.org/10.1093/jmammal/gyx151
Davis, M. L., Kelly, M. J. y Stauffer, D. F. (2010). Carnivore co-existence and habitat use in the Mountain Pine Ridge Forest Reserve, Belize. Animal Conservation, Zoological Society of London, 14, 56–65. https://doi.org/10.1111/j.1469-1795.2010.00389.x
Durán, E., Galicia, L., Pérez-García, E. y Zambrano, L. (2002). El paisaje en ecología. Ciencias, Universidad Nacional Autónoma de México, 67, 44–50.
Equihua, J. A., Equihua, M., Pérez-Maqueo, O., Kolb, M., Schmidt, M. F., Munguía, M. et al. (2014). Integridad ecosistémica. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, México D.F. Recuperado el 12/08/2019: https://monitoreo.conabio.gob.mx/indicadores.html
ESRI. (2016). ArcGIS desktop: Release 10.5. Redlands, CA: Environmental Systems Research Institute.
Fontanilla, A. M., Nakamura. A., Xu, Z., Cao, M., Kitching, R. L., Tang, Y. et al. (2019). Taxonomic and functional ant diversity along tropical, subtropical, and subalpine elevational transects in Southwest China, Insects, 10, 128. https://doi.org/10.3390/insects10050128
García-Alaniz, N., Equihua, M., Pérez-Maqueo, O., Equihua, J., Meada, P., Pardo, F. et al. (2017). The Mexican National Biodiversity and Ecosystem Degradation Monitoring System. Current Opinion in Environmental Sustainability, 26, 62−68. https://doi.org/10.1016/j.cosust.2017.01.001
Gómez-Ortiz, Y. y Moreno, C. E. (2017). La diversidad funcional en comunidades animales: una revisión que hace énfasis en los vertebrados. Animal Biodiversity and Conservation, 40, 165−174. https://doi.org/10.32800/abc.2017.40.0165
Gómez-Ortiz, Y., Domínguez-Vega, H. y Moreno, C. E. (2017). Spatial variation of mammal richness, functional and phylogenetic diversity in the Mexican Transition Zone. Community Ecology, 18, 121−127. https://doi.org/10.1556/168.2017.18.2.1
González-Maya, J. F., Víquez, R. L. R., Arias-Alzate, A., Belant, J. L. y Ceballos, G. (2016). Spatial patterns of species richness and functional diversity in Costa Rican terrestrial mammals: implications for conservation. Diversity and Distributions, 22, 43−56. https://doi.org/10.1111/ddi.12373
Hammer, Ø., Harper, D. A.T. y Ryan, P. D. (2001). PAST: Paleontological Statistics Software Package for Education and Data Analysis. Paleontología Electrónica, 4, 9. http://folk.uio.no/ohammer/past/
Hsieh, T. C., Ma, K. H. y Chao, A. (2016). iNEXT: an R package for interpolation and extrapolation of species diversity (Hill numbers). Methods Ecology Evolution, 7, 1451−1456. https://doi.org/10.1111/2041-210x.12613
INEGI (Instituto Nacional de Estadística y Geografía). (2017). Uso de suelo y vegetación de México Serie VI. 2014-2017. Recuperado 13 agosto, 2018. https://www.inegi.org.mx/temas/usosuelo/default.html#Descargas
Jones, K. E., Bielby, J., Cardillo, M., Fritz, S. A., O’Dell, J., Orme, C. D. et al. (2009). PanTHERIA: a species-level database of life history, ecology, and geography of extant and recently extinct mammals. Ecology, 90, 2648. https://doi.org/10.1890/08-1494.1
Kembel, S. W., Ackerly, D., Blomberg, S., Cornwell, W. K., Cowan, P. D., Helmus, M. R. et al. (2019). Package “picante”. Integrating phylogenies and ecology. Ver. 1.8. Bioinformatics, 26, 1463−1464. https://doi.org/10.1093/bioinformatics/btq166
Koleff, P. y Soberón, J. (2008). Patrones de diversidad espacial en grupos selectos de especies. En J. Soberón, G. Halffter y J. Llorente-Bousquets (Comps.), Capital natural de México, vol. I. Conocimiento actual de la biodiversidad (pp. 323-364). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Laliberte, E. y Legendre, P. (2010). A distance-based framework for measuring functional diversity from multiple traits. Ecology, 91, 299−305. https://doi.org/10.1890/08-2244.1
Leopold, A. S. y Hernández, L. (1944). Los recursos biológicos de Guerrero con referencia especial a los mamíferos y aves de caza. México D.F.: Anuario. Unión Panamericana de Washington/ Comisión Impulsora y Coordinadora de la Investigación Científica.
Liu, X. y Wang, H. (2018). Contrasting patterns and drivers in taxonomic versus functional diversity, and community assembly of aquatic plants in tropical lakes. Biodiversity and Conservation, 27, 3103−3118. https://doi.org/10.1007/s10531-018-1590-2
López-Mejía, M., Moreno, C. E., Zuria, I., Sánchez-Rojas, G. y Rojas-Martínez, A. (2017). Comparación de dos métodos para analizar la proporción de riqueza de especies entre comunidades: un ejemplo con murciélagos de selvas y hábitats modificados. Revista Mexicana de Biodiversidad, 88, 183−191. https://doi.org/10.1016/j.rmb.2017.01.008
Luna-Vega, I., Espinoza, D. y Contreras-Medina, R. (Eds.). (2016). Biodiversidad de la Sierra Madre del Sur. Ciudad de México: UNAM.
Mandujano, S. (2017). Monitoreo de la biodiversidad de mamíferos en áreas naturales protegidas empleando cámaras-trampa: sugerencias de herramientas para la gestión y el análisis numérico de las fotos. Paracuaria Natural, 5, 24-33.
Mandujano, S. (2019). Analysis and trends of photo-trapping in Mexico: text mining in R. Therya, 10, 25−32. https://doi.org/10.12933/therya-19-666
Martín-Regalado, C. N., Briones-Salas, M., Lavariega, M. y Moreno, C. E. (2019). Spatial incongruence in the species richness and functional diversity of cricetid rodents. Plos One, 14, e0217154. https://doi.org/10.1371/journal.pone.0217154
Mason, N. W. H., Mouillot, D., Lee, W. G. y Wilson, J. B. (2005). Functional richness, functional evenness, and functional divergence: the primary components of functional diversity. Oikos, 111, 112−118. https://doi.org/10.1111/j.0030-1299.2005.13886.x
Monroy-Gamboa, A. G., Briones-Salas, M. Á., Sarkar, S. y Sánchez-Cordero, V. (2019). Terrestrial vertebrates as surrogates for selecting conservation areas in a biodiversity hotspot in Mexico. Conservation Science and Practice, 1, e12. https://doi.org/10.1111/csp2.12
Monroy-Vilchis, O., Zarco-González, M., Rodríguez-Soto, C., Soria-Díaz, L. y Urios, V. (2011). Fototrampeo de mamíferos en la sierra de Nanchititla, México: abundancia relativa y patrón de actividad. Revista de Biología Tropical, 59, 373−383. https://doi.org/10.15517/rbt.v59i1.3206
Moreno, R. y Aranda, M. (2014). Leopardus pardalis. En G. Ceballos (Ed.), Mammals of Mexico (pp. 499−501) Baltimore: Johns Hopkins University Press.
Moreno, C. E., Calderón-Patrón, J. M., Arroyo-Rodríguez, V., Barragán, F., Escobar, F., Gómez-Ortiz, Y. et al. (2017). Measuring biodiversity in the Anthropocene: a simple guide to helpful methods. Biodiversity and Conservation, 26, 2993−2998. https://doi.org/10.1007/s10531-017-1401-1
Moreno, C. E., Calderón-Patrón, J. M., Martín-Regalado, N., Martínez-Falcón, A. P., Ortega-Martínez, I. J., Ríos-Díaz, C. L. et al. (2018). Measuring species diversity in the tropics: a review of methodological approaches and framework for future studies. Biotropica, 50, 929−941. https://doi.org/10.1111/btp.12607
Morrone, J. J. (2017). Biogeographic regionalization of the Sierra Madre del Sur province, México. Revista Mexicana de Biodiversidad, 88, 710−714. https://doi.org/10.1016/j.rmb.2017.07.012
Muench, C. y Martínez-Ramos, M. (2016). Can community-protected áreas conserve biodiversity in human-modified tropical landscapes? The case of terrestrial mammals in southern Mexico. Tropical Conservation Science, 9, 178−202.
Oliveira, B. F., Machac, A., Costa, G. C., Brook, T. M., Davidson, A. D., Rondinini, C. et al. (2016). Species and functional diversity accumulate differently in mammals. Global Ecology and Biogeography, 25, 1119–1130. https://doi.org/10.1111/geb.12471
Porras-Murillo, L. P., Sarmiento-Aguilar, R., Naranjo, E. y Vázquez, L. B. (2011). Conservation effectiveness of protected areas in Mexico: effects on medium and large mammals at local and regional scales. International Journal of Biodiversity and Conservation, 3, 487-496.
R Core Team. (2018). R: a language and environment for statistical computing. Vienna, Austria. Retrieved from https://www.R-project.org/
Ramírez-Pulido, J., González-Ruiz, N., Gardner, A. y Arroyo-Cabrales, J. (2014). List of recent land Mammals of Mexico. Special Publications. Museum of Texas Tech University, 63, 1−69. https://doi.org/10.5962/bhl.title.142891
Rodríguez, P., Soberón, J. y Arita, H. T. (2003). El componente beta de la diversidad de mamíferos de México. Acta Zoológica Mexicana, 89, 241−259.
Rovero, F., Martin, E., Rosa, M., Ahumada J. A. y Spitale, D. (2014) Estimating species richness and modelling habitat preferences of tropical forest mammals from camera trap data. Plos One, 9, e103300. https://doi.org/10.1371/journal.pone.0103300
Rovero, F. y Zimmermann, F. (2016). Camera trapping for wildlife research. London: Pelagic Publishing.
Rzedowski, J. (2006). Vegetación de México. Edición digital. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Disponible en: https://www.biodiversidad.gob.mx/publicaciones/librosDig/pdf/VegetacionMxPort.pdf
Sato, C. F., Westgate, M. J., Barton, P. S., Foster, C. N., O’Loughlin, L. S., Pierson, J. C. et al. (2019). The use and utility of surrogates in biodiversity monitoring programmers. Journal of Applied Ecology, 56, 1304−1310. https://doi.org/10.1111/1365-2664.13366
SEMARNAT. (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010. Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Federación 30 diciembre, 2010.
Servín, J., Chacón, E. y List, R. (2014). Canis latrans. En G. Ceballos (Ed.), Mammals of Mexico (pp. 510−511). Baltimore: Johns Hopkins University Press.
Swenson, N. G. (2014). Functional and Phylogenetic Ecology. New York: Springer.
UICN (Unión Internacional para la Conservación de la Naturaleza). (2019). Lista roja de especies amenazadas. Recuperado el 21 de marzo de 2019. http://www.iucnredlist.org
Villéger, S., Mason, N. W. H. y Mouillot, D. (2008). New multidimensional functional diversity indices for a multifaceted framework in functional ecology. Ecology, 89, 2290−2301. https://doi.org/10.1890/07-1206.1
Zar, J. H. (2010). Bioestatistical analysis. New Jersey: Person Prentice Hall.
Zobel, M. (1997). The relative role of species pools in determining plant species richness. An alternative explanation if species coexistence? Trends in Ecology Evolution, 12, 266−269. https://doi.org/10.1016/s0169-5347(97)01096-3