La conservación de mamíferos medianos en dos reservas ecológicas privadas de Veracruz, México
Sonia Gallina* y Alberto González-Romero
Red de Biología y Conservación de Vertebrados, Instituto de Ecología, A.C., Carretera Antigua a Coatepec #351, El Haya, 91070 Xalapa, Veracruz, México
*Autor para correspondencia: sonia.gallina@inecol.mx (S. Gallina)
Abstract
La fauna es un elemento particularmente distintivo y carismático de la biodiversidad tropical que está siendo sometido a una amenaza sin precedentes por la cacería furtiva y la pérdida de su hábitat. Este fenómeno denominado defaunación impacta de manera directa la biodiversidad tropical al extirpar poblaciones de animales, reducir su variabilidad genética y en el extremo llevar a la extinción completa de especies. Las Reservas privadas como Santa Gertrudis (SG) en Vega de Alatorre y La Otra Opción (LOO) en Los Tuxtlas, Veracruz, están haciendo esfuerzos por conservar la biodiversidad de la fauna. En 2014 y 2015 se utilizaron cámaras-trampa para registrar la fauna de mamíferos con un esfuerzo de muestreo en SG de 531 días/cámara en 2014 y 1,093 en 2015, mientras que en LOO en 2014 fueron 1,090 d/c, y en 2015, 1,081. En SG las especies más comunes fueron: Dasypus novemcinctus, Didelphis marsupialis y Cuniculus paca, y en LOO, Dasypus novemcinctus, Sciurus aureogaster y Dasyprocta mexicana. Se registraron especies en riesgo de extinción como Galictis vittata (SG); mientras que en LOO: Leopardus wiedii, Herpailurus yagouaroundi y Eira barbara.
Keywords:
Armadillo; Cámaras-trampa; Defaunación; Tepezcuintle; Tigrillo; Veracruz
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
The conservation of medium-sized mammals in two private ecological reserves of Veracruz, Mexico
Abstract
Wildlife is a distinctive and charismatic element of the tropical biodiversity that is under severe threat without precedent due to hunting and habitat loss. This phenomenon known as defaunation impacts directly into tropical biodiversity as animal populations are eradicated, reduced their genetic variability, and at the end the extinction of species. Particular reserves like Santa Gertrudis (SG) in Vega de Alatorre and La Otra Opción (LOO) at los Tuxtlas, Veracruz, are doing efforts to conserve wildlife biodiversity. During 2014 and 2015 we used camera traps to record mammal species with a total effort at SG of 531 camera/day in 2014 and 1,093 in 2015, while at LOO during 2014 we had 1,090 c/d and in 2015, 1,081 c/d. In SG the common species registered were Dasypus novemcinctus, Didelphis marsupialis and Cuniculus paca, and at the LOO: Dasypus novemcinctus, Sciurus aureogaster and Dasyprocta mexicana. We recorded species under risk of extinction like Galictis vittata (in SG); also Leopardus wiedii, Herpailurus yagouaroundi and Eira barbara (in LOO).
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Palabras clave:
Armadillo; Camera-trapping; Defaunation; Margay; Paca; Veracruz
Introducción
La fauna, y en particular los mamíferos medianos son un elemento distintivo y carismático de la biodiversidad tropical que está siendo sometido a una amenaza sin precedentes por la cacería furtiva y la pérdida de su hábitat. Las áreas protegidas pretenden la conservación de los ecosistemas que aún quedan con vegetación original, sin embargo, en muchas de ellas faltan estudios acerca de la conservación de su fauna (Ortega-Rubio et al., 2015). Se ha comprobado que debido a la pérdida de la biodiversidad por defaunación, se reduce la estabilidad del ecosistema con efectos de cascada (Seddon et al., 2014). Estos efectos se magnifican cuando no existe el reemplazo de las funciones ecológicas que llevaban a cabo las especies extirpadas, tales como polinización, dispersión, depredación, herbivoría, y reciclaje de nutrientes entre otras. Como lo señalan Galetti y Dirzo (2013), Seddon et al. (2014) y Vidal et al. (2013) la defaunación representa una seria amenaza a los ecosistemas tropicales, con consecuencias biológicas sobre la estructura y funcionamiento de los ecosistemas, así como los servicios ambientales y se han dado en llamar “bosques vacíos”. Cuando son extirpados del ecosistema los frugívoros grandes y medianos, se ha visto que llegan a afectar a las especies de plantas cuyos frutos consumen y dispersan las semillas, ya que no pueden ser sustituidos por frugívoros pequeños (Vidal et al., 2013). Existen evidencias que sugieren que, aunque los grandes frugívoros a menudo ocurren en bajas densidades en comparación con los pequeños, su papel en la dispersión de semillas en los bosques tropicales es relevante para las plantas que producen frutos con semillas grandes (Vidal et al., 2013). Más aún la defaunación tiene consecuencias en toda la comunidad de plantas y en la estructura y función de los ecosistemas a través de efectos indirectos (Estes et al., 2011).
Veracruz es uno de los estados del país que más transformaciones ha sufrido en sus ecosistemas, quedando menos del 10 % de vegetación original, en parches y en algunas áreas protegidas (Williams-Linera et al., 2002), además de ser uno de los que tiene una de las tasas de deforestación más alta del país, cerca del 1-2% anual (Aguilar et al., 2000). Aunado a la transformación de sus ecosistemas, el estado de Veracruz se enfrenta a un efecto de pérdida de fauna o defaunación ocasionado por distintos factores, entre ellos el aprovechamiento indiscriminado de la fauna. Esto ha sido señalado reiteradamente en sitios muy estudiados como los remanentes de selva en Los Tuxtlas, donde se aprecia la ausencia de algunas especies de fauna, principalmente de los herbívoros y frugívoros (Dirzo y García, 1992), que desempeñan un papel importante como dispersores de semillas y favorecedores de la germinación de muchas plantas y la regeneración de los bosques.
Una de las alternativas para realizar conservación son las reservas privadas, en este caso presentaremos resultados de 2 de ellas en el estado de Veracruz, México, como Santa Gertrudis (SG) en Vega de Alatorre y La Otra Opción (LOO) en Los Tuxtlas, que están haciendo serios esfuerzos por conservar la biodiversidad de la fauna que aún persiste en ellas.
El objetivo del estudio fue conocer la diversidad del ensamble de especies de mamíferos medianos en 2 reservas privadas, estimar sus abundancias relativas, el grado de defaunación y saber si aún se conservan especies en peligro de extinción.
Materiales y métodos
Reserva Ecológica Santa Gertrudis. Se localiza en el municipio de Vega de Alatorre en el centro del estado de Veracruz, es una zona de protección de flora y fauna con una superficie de 930 ha y se ubica a una altitud de 400 a 900 m snm (fig. 1). Fue decretada el 16 de agosto de 1982 y desde entonces se están protegiendo especies de flora y fauna, muchas de ellas endémicas, otras catalogadas en riesgo o con algún grado de protección. La precipitación promedio anual es de 2,275 mm y alrededor del 68% de ésta ocurre de junio a noviembre (García, 1988). La vegetación dominante es selva mediana subperennifolia (Miranda y Hernández, 1963) y de diciembre a abril, entre el 25 y 50% de los árboles pierden su follaje (Pennington y Sarukhán, 1998). Esta zona de conservación de flora y fauna representa uno de los límites más al norte para la distribución de especies que habitaron más al norte de Los Tuxtlas (Winker, 1997).
Reserva Ecológica La Otra Opción. Se localiza en la zona de amortiguamiento de la Reserva de la Biosfera Los Tuxtlas y tiene 136 ha (fig. 1). En ella se lleva a cabo restauración y recuperación de ecosistemas, así como también programas de reproducción y reintroducción de vida silvestre (venado temazate, tucanes, hocofaisanes, serete o agutí, tepezcuintle o paca). Hasta el 2007, la Otra Opción era un rancho ganadero y es a partir del 2008 que se comienza a realizar restauración activa de los potreros (aprox. 70 ha) con 55 especies nativas de árboles. Cabe señalar que algunas especies son endémicas y se encuentran en alguna categoría de riesgo, por lo que las acciones de restauración y conservación de un fragmento de bosque mesófilo de montaña original representan estrategias integrales de conservación de suma importancia, además de ser reservorio como banco de germoplasma.
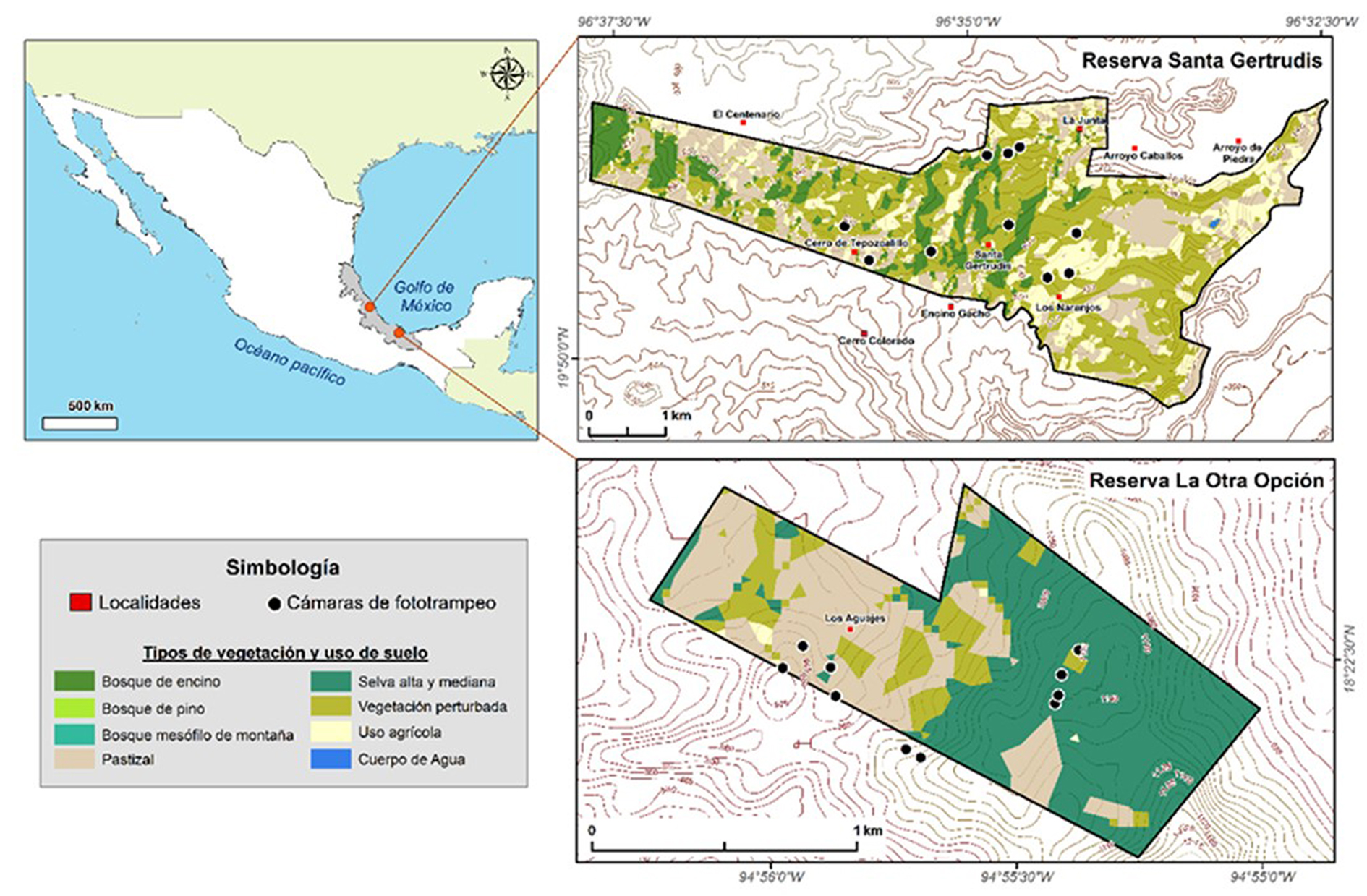
Se realizaron 5 salidas al campo a cada reserva durante mediados de 2014 y 2015, utilizando 10 cámaras-trampa (LTL ACORN modelo 5210A) en cada sitio para registrar la fauna de mamíferos, procurando una distancia entre ellas de 300 a 500 m, cerca de veredas, tomando en cuenta la topografía de las áreas. El esfuerzo de muestreo se calculó sumando todos los días en que las cámaras permanecieron activas por el número de cámaras.
Para obtener el índice de abundancia relativa de cada especie, se utilizó la fórmula IAR = (C/EM) × 100 días trampa (unidad estándar). Dónde: C = número de capturas o eventos fotográficos de la misma especie separados 24 horas, (cuando aparecían 2 individuos de la especie en la misma foto se consideraron como eventos independientes), EM = esfuerzo de muestreo (número de cámaras por días de monitoreo) por época o total. Se obtuvieron las curvas rango abundancia para las 2 áreas protegidas, así como también se obtuvieron los índices de diversidad verdadera o números equivalentes: 0D es la diversidad de orden 0 (riqueza de especies y es sensible a especies raras), 1D es diversidad de orden 1 y es la exponencial de Shannon (considera además las abundancias de todas las especies y no favorece ni las especies comunes ni las raras) y 2D es la diversidad de orden 2 o inverso de Simpson (toma en cuenta las especies dominantes, es decir es más sensible a especies más comunes) (Hernández et al., 2014; Jost, 2006, 2007; Moreno et al., 2011). También se estimó el coeficiente de similitud de Sorensen (S = 2c/a+b), donde a son las especies en el sitio A y b son las del sitio B, y c = son las compartidas) siendo el inverso la complementariedad o la diversidad beta. Con EstimateS 9.1.0. se obtuvo la curva de acumulación de especies con el estimador chao 2 (Colwell, 2016).
Se obtuvo la matriz ecológica utilizando el tipo de locomoción (terrestres, escansoriales, arborícolas, fosoriales) en los renglones y el tipo de forrajeo (H-P = herbívoro-pastador, H-R = herbívoro-ramoneador, F-G = frugívoro-granívoro, F-O = frugívoro-omnívoro, I-O = insectívoro-omnívoro, M = mirmecófago, C = carnívoro, en las columnas de acuerdo a Robinson y Redford (1986), para definir gremios y poder comparar con una matriz ecológica esperada con las especies que han sido registradas en otros trabajos (tabla 1) y con la obtenida en ambas reservas que permitan analizar cuales gremios han desaparecido. Para ello se utilizó la fórmula siguiente:
H’ecol = -Σ (Cij/ΣΣ) ln (Cij/Σ)
donde H’ es la diversidad ecológica, Cij es el total de especies de cada celda de la matriz, dividido en la ΣΣ que es el gran total de la suma de columnas y renglones de la matriz y ln es el logaritmo natural de Cij dividido por la suma de columnas.
También se obtuvo el índice de defaunación propuesto por Giacomini y Galetti (2013):
ID= Σsk=1 w(Nk,r – Nk,a)/ Σsk=1 w(Nk,r + Nk,a)
donde la Σ es la sumatoria de s = total de especies que componen el ensamble de referencia y el del área de estudio, k= identificación de una especie (k =1,2,3… s), w es la importancia de la especie dada por el peso del individuo de la especie elevado a la potencia ¾ o sea 0.75, y Nk,r y Nk,a son iguales a 1 (presencia de la especie) o 0 (ausencia de la especie) en el ensamble. El índice es 1 cuando todas las especies están ausentes en el área en comparación con el ensamble de referencia (es decir el área está completamente defaunada) y 0 (cero) cuando no hay diferencia entre el ensamble del área y el de referencia (no hay defaunación).
El peso corporal de una especie es una aproximación de la vulnerabilidad de la misma a la extinción y por lo tanto, a lo concerniente a su conservación. Es un rasgo que tiene efectos en la historia de vida y las interacciones ecológicas (Brown et al., 2004; Woodward et al., 2005) con implicaciones de conservación (Hansen y Galetti, 2009). El atributo de importancia de la especie (w) basado en el peso o masa corporal elevado a la ¾ (0.75) es una función alométrica que refleja muchas de las funciones de la especie (Brown et al., 2004) y también es un buen predictor del riesgo de extinción (Polishchuk, 2010).
Tabla 1
Lista de mamíferos según el tipo de locomoción: A = arborícola, E = escansorial, T = terrestre, SA = semiacuático, F = Fosorial. Tipo de forrajeo: H-P = herbívoro-pastador, H-R = herbívoro-ramoneador, F-G = frugívoro-granívoro, F-O = frugívoro-omnívoro, I-O = insectívoro-omnívoro, M = mirmecófago, C = carnívoro (Robinson y Redford, 1986). Los nombres científicos siguen el trabajo de Ramírez-Pulido et al. (2014). Reserva SG = Santa Gertrudis, LOO = La Otra Opción.
|
Tabla 1 Continuación. |
|||||
|
Nombre común |
Locomoción |
Forrajeo |
Peso (g) |
Reserva |
|
|
Nombre común |
Locomoción |
Forrajeo |
Peso (g) |
Reserva |
|
|
Orden Didelphimorphia |
|||||
|
Marmosa mexicana |
Ratón tlacuache |
A |
I-O |
31 |
|
|
Didelphis marsupialis |
Tlacuache |
E |
F-O |
1,500 |
SG-LOO |
|
Didelphis virginiana |
Tlacuache |
E |
F-O |
1,800 |
|
|
Philander opossum |
Chipe |
T |
I-O |
400 |
|
|
Orden Pilosa |
|||||
|
Dasypus novemcinctus |
Tochi o armadillo |
T |
I-O |
3,544 |
SG-LOO |
|
Tamandua mexicana |
Chupamiel o brazofuerte |
A |
M |
4,210 |
|
|
Orden Rodentia |
|||||
|
Tylomys nudicaudus |
Rata trepadora del norte |
A |
F-G |
360 |
LOO |
|
Sciurus aureogaster |
Ardilla |
A |
F-G |
338 |
SG-LOO |
|
Sciurus deppei |
Ardilla |
A |
F-G |
220 |
|
|
Orthogeomys hispidus |
Tuza |
F |
H-P |
||
|
Coendou mexicanus |
Viztlacuache o puerco espín |
A |
F-G |
1,000 |
|
|
Dasyprocta mexicana |
Serete o aguti |
T |
F-G |
3,600 |
LOO |
|
Cuniculus paca |
Tepezcuintle o paca |
T |
F-G |
8,227 |
SSG-LOO |
|
Orden Lagomorpha |
|||||
|
Sylvilagus floridanus |
Conejo |
T |
H-P |
1,025 |
LOO |
|
Orden Carnivora |
|||||
|
Canis latrans |
Coyote |
T |
C |
12,500 |
SG |
|
Urocyon cinereoargenteus |
Zorra |
T |
F-O |
5,500 |
|
|
Herpailurus yagouaroundi |
Yaguarundi u onza real |
T |
C |
5,000 |
LOO |
|
Leopardus pardalis |
Ocelote |
T |
C |
10,750 |
|
|
Leopardus wiedii |
Tigrillo o margay |
A |
C |
3,500 |
LOO |
|
Mephitis macroura |
Zorrillo |
T |
I-O |
2,500 |
|
|
Eira barbara |
Cabeza de viejo |
T |
F-O |
4,500 |
LOO |
|
Galictis vittata |
Grisón |
T |
C |
2,910 |
SG |
|
Mustela frenata |
Comadreja u onzita |
T |
C |
450 |
LOO |
|
Lontra longicaudis |
Nutria o perro de agua |
SA |
C |
7,250 |
|
|
Potos flavus |
Martucha |
A |
F-O |
2,490 |
|
|
Bassariscus sumichrasti |
Sietillo o cacomixtle |
E |
F-O |
1,400 |
SG |
|
Bassariscus astutus |
Sietillo o cacomixtle |
E |
F-O |
1,200 |
|
|
Nasua narica |
Tejón |
E |
F-O |
3,880 |
SG-LOO |
|
Procyon lotor |
Mapache |
E |
F-O |
8,850 |
SG |
|
Orden Artiodactyla |
|||||
|
Mazama temama |
Temazate |
T |
H-R |
20,000 |
LOO |
|
Odocoileus virginianus |
Venado cola blanca |
T |
H-R |
34,000 |
|
|
Dicotyles crassus |
Pecarí de collar |
T |
F-O |
19,000 |
LOO |
Resultados
El esfuerzo de muestreo en SG fue de 531 días-cámara en 2014 y 1,093 en 2015, con 235 registros totales, mientras que en LOO en 2014 fueron 1,090 días-cámara y en 2015 fueron 1,081, con 236 registros totales. En la figura 2 se muestran los resultados en las diferentes salidas de muestreo que se efectuaron en cada una de las reservas: a) Santa Gertrudis y b) La Otra Opción.
En SG se registraron 9 especies de mamíferos siendo las más comunes el tlacuache (Didelphis marsupialis, IAR = 5.29), el armadillo (Dasypus novemcinctus, IAR = 2.28), y el tepezcuintle o paca (Cuniculus paca, IAR = 2.09), y en LOO se registraron 14 especies en donde las más comunes fueron el armadillo (IAR = 4.36), la ardilla (Sciurus aureogaster, IAR = 1.84), tepezcuintle (IAR = 1.23), y el serete o agutí (Dasyprocta mexicana, IAR = 1.12) (fig. 2).
Las especies registradas en las reservas así como el listado de las especies potenciales que se podrían encontrar de acuerdo a registros históricos se muestran en la tabla 1, donde se indica el tipo de locomoción y forrajero, así como el peso promedio de las especies.
De acuerdo a las matrices de diversidad ecológica, los valores obtenidos fueron: de los mamíferos registrados históricamente H’ ecol = 1.16803866, con 14 gremios de los cuales los escansoriales con hábitos frugívoro-omnívoros y los terrestres carnívoros fueron los mejor representados, mientras que en la reserva SG, el H’ ecol = 0.79633754, con 5 gremios siendo los escansoriales frugívoro-omnívoros los más representativos y en LOO la H’ ecol = 0.80154921, con 9 gremios siendo los terrestres con frugívoro-omnívoros y frugívoro-granívoros los más representativos.

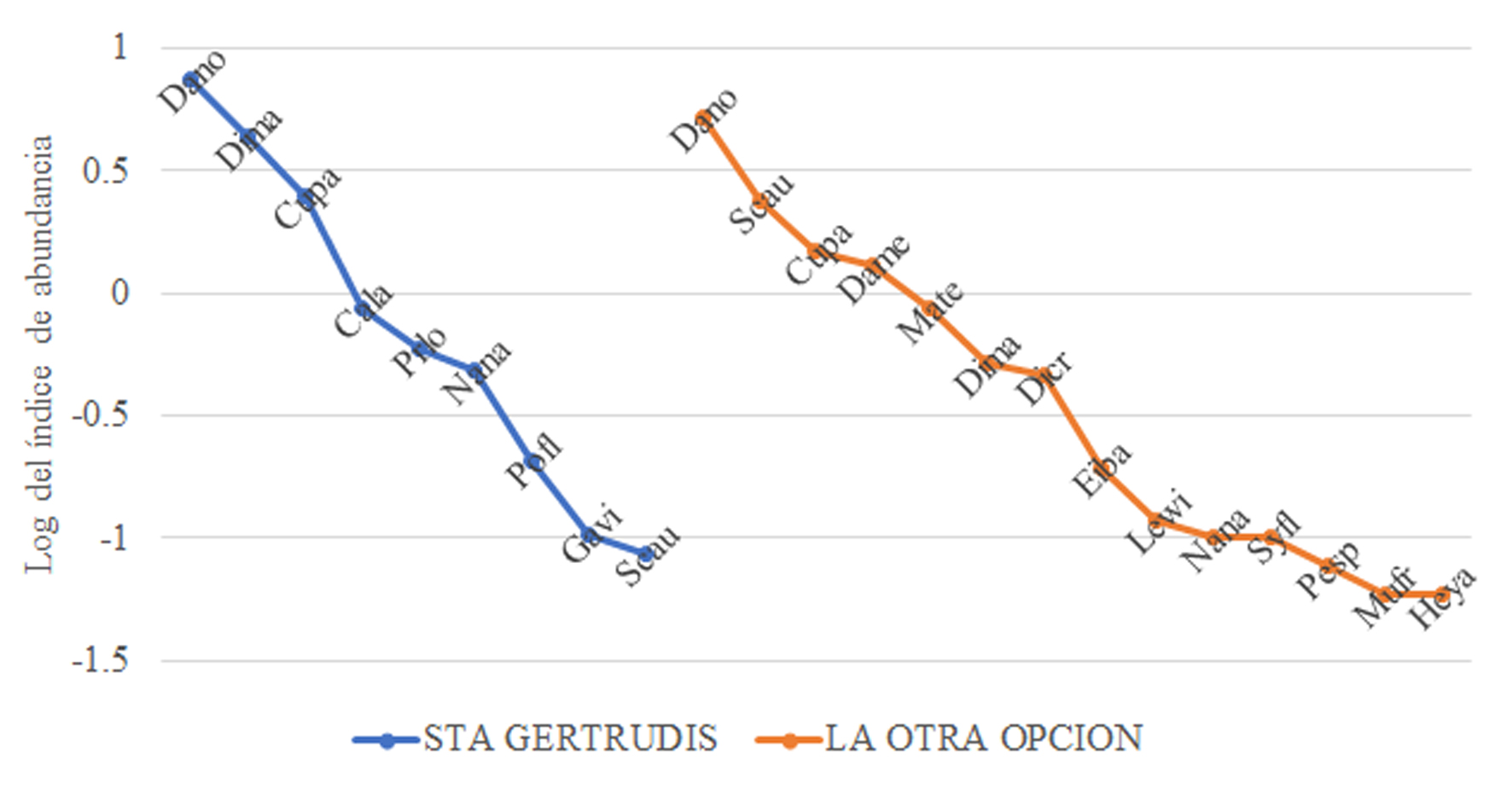
En la figura 3 se muestran las curvas de rango abundancia que indican la estructura del ensamble en ambas reservas. Al analizar los 2 ensambles, en cuanto a la riqueza de especies se encontró una diferencia de 5 especies más en La Otra Opción (0D = 14) que en SG (0D = 9). El exponencial de Shannon que toma en consideración las abundancias en este caso los IAR, en LOO (1D = 6.32) que representa el 45.14% si se tomaran en consideración el valor de la diversidad máxima esperada si todas las especies tuvieran la misma abundancia y en SG (1D = 4.39) que representa el 48.88% de la diversidad máxima esperada. En relación al inverso de Simpson (2D) que refleja las especies dominantes, fue en SG = 3.35 y en LOO = 4.37 y los tlacuaches, armadillos y tepezcuintles, fueron los más importantes en cada uno de los ensambles en SG; y en LOO, los armadillos, ardillas, tepezcuintles y seretes.
En cuanto al coeficiente de similitud de Sorensen, éste fue de 0.22, lo que indica que solo comparten un 22% de las especies, que resultaría importante desde el punto de vista de la conservación siendo que un 72% se complementa con las 2 áreas protegidas (diversidad beta).
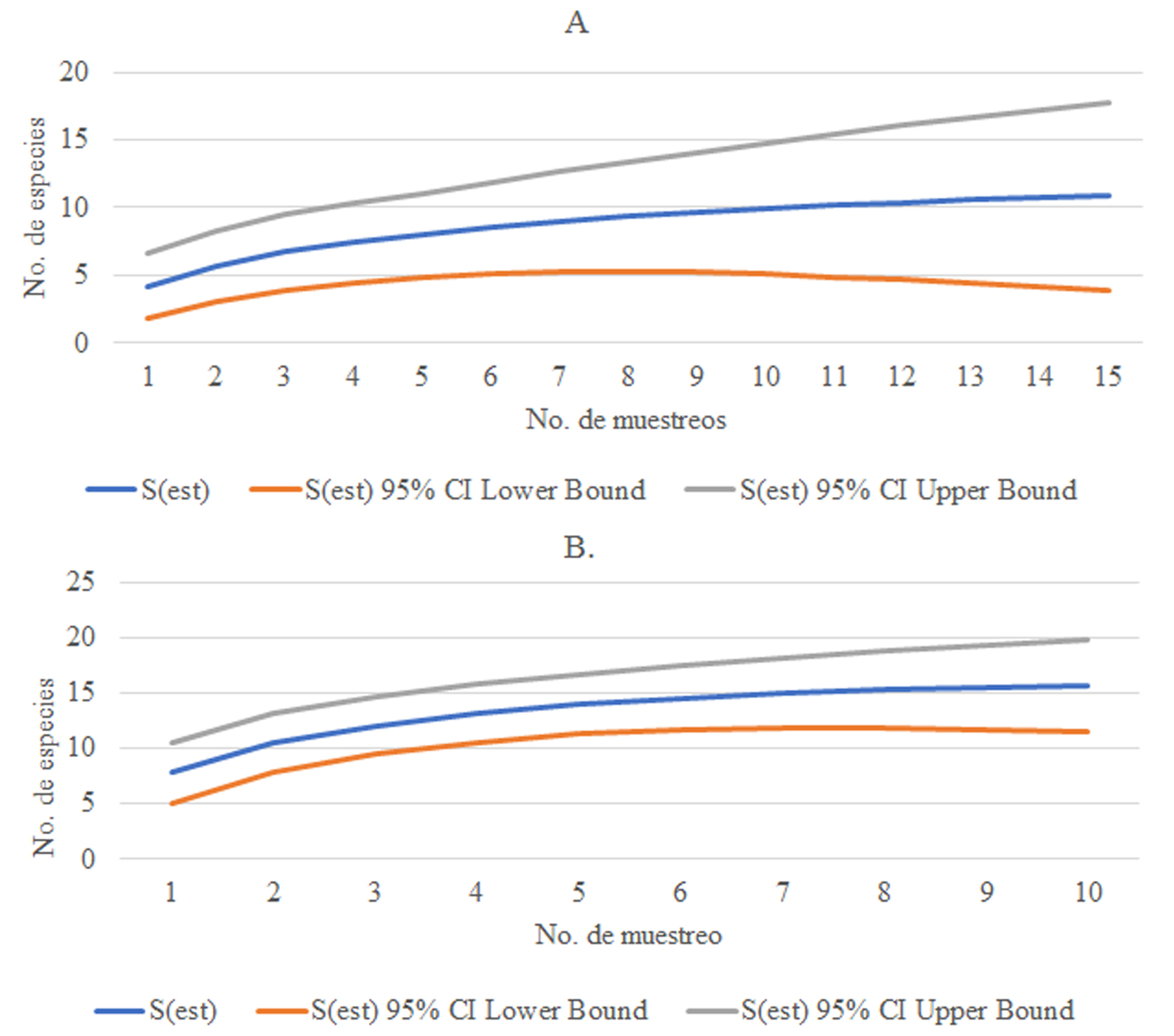
Tomando en consideración la curva de acumulación de especies (fig. 4), en SG se necesitarían 10 muestreos para alcanzar la asíntota en 10 especies (fig. 4A) y en LOO, prácticamente en el muestreo 8 se alcanza la asíntota con 15 especies, aunque podría llegar a 20 en el límite superior (fig. 4B), siendo LOO la que representa el ensamble de especies de mamíferos más completo con este muestreo.
La diversidad ecológica esperada (H’ esp) fue de 0.605 (14 gremios con 31 especies) mientras que la de SG fue de 0.154 (5 gremios con 9 especies) lo que equivale al 25.45% de la esperada; mientras que en LOO, fue de 0.532 (9 gremios con 14 especies) lo que equivale al 87.93% de la esperada.
En este estudio el índice de defaunación en Santa Gertrudis fue de 0.51, que indica que ya desapareció cerca de la mitad de las especies que teóricamente debería haber en el sitio según la tabla 1, mientras que en La Otra Opción fue de 0.32, valor que revela que se están conservando más especies en el ensamble.
Discusión
Antes de discutir nuestros resultados, debemos aclarar que durante el estudio tuvimos un serio problema con la lluvia, la neblina y humedad que afectaron las cámaras y por lo mismo el buen registro de fotos, por lo que el esfuerzo de muestreo no fue igual para los sitios o los años, sin embargo para obtener el índice de abundancia relativa se utiliza el esfuerzo de muestreo de cada salida, que es una forma de homogeneizar los resultados. Se encontró una mayor riqueza de especies en LOO que representa un bosque mesófilo de montaña y un área regenerada, a pesar de que presenta una superficie mucho menor, pero se encuentra dentro de un área protegida más amplia que es la Reserva de la Biosfera Los Tuxtlas, mientras que en SG la vegetación dominante es la selva mediana subperennifolia, y puede considerarse defaunada en cuanto a la riqueza de especies de mamíferos medianos, ya que ésta se encuentra como una isla de vegetación original rodeada de potreros, además de tener un “camino real” que la cruza y que es el paso a rancherías, lo que facilita la cacería furtiva.
Como lo señalan Galetti y Dirzo (2013), Seddon et al. (2014) y Vidal et al. (2013), la defaunación representa una seria amenaza a los ecosistemas tropicales, como lo demuestra este estudio, donde varias especies han desaparecido; aunque también habría que analizar en estudios posteriores que efecto está teniendo en cuanto al papel que desempeñan en el ecosistema, como ha sido señalado en otros estudios Dirzo et al. (2014) y Galetti y Dirzo (2013), ya que no todos los gremios se encuentran representados.
Las especies más comunes en ambas reservas fueron Dasypus novemcinctus y Cuniculus paca. Esta última se sabe que es importante en la depredación y dispersión de semillas en zonas tropicales. En la selva Lacandona, Camargo-Sanabria y Mendoza (2016) encontraron que esta especie, junto con el pecarí de collar y el tapir Tapirus bairdi fueron las especies más importantes en cuanto al consumo de frutos y la dispersión de semillas.
Hasta el segundo año de muestreo fue que se registraron especies en riesgo de extinción en las 2 áreas protegidas: como el grisón (Galictis vittata) y la martucha (Potos flavus) en SG; mientras que en LOO: el tigrillo (Leopardus wiedii), jaguarundi (Herpailurus yagouaroundi) y cabeza de viejo (Eira barbara). En ninguna de las reservas estudiadas se registraron grandes depredadores como ocurre en la Reserva de Calakmul (Briseño-Méndez et al., 2017). Entre los herbívoros que se registraron en LOO tenemos al venado temazate (Mazama temama) y al pecarí de collar (Dicotyles crassus); en Santa Gertrudis no se encontraron especies de herbívoros de talla mediana posiblemente por efectos de la cacería más que por la deforestación cercana. En el estudio realizado por Briseño-Méndez et al. (2017) acerca de la riqueza de especies y composición de los gremios tróficos del ensamblaje del orden Carnívora en un área adyacente de la Reserva de la Biosfera de Calakmul, Campeche, México, utilizando cámaras-trampa, se encuentran 11 especies distribuidas en 4 gremios: carnívoros (5 spp.), omnívoro (4), insectívoro (una especie) y frugívoro (una especie), registrando 2 especies de depredadores de talla grande (el jaguar, Panthera onca y el puma Puma concolor) y 3 especies generalistas como la zorra (Urocyon cinereoargenteus), el jaguarundi (Herpailurus yagouaroundi) y el mapache (Procyon lotor), por lo que concluyen que son selvas tropicales bien conservadas.
La diversidad fue mayor en LOO considerando los diversos índices, pero la similitud de los ensambles (22%) indica que si deseamos resaltar el papel de las áreas protegidas, ambas estarían conservando especies diferentes de mamíferos y se complementan un 78%, de ahí la importancia de ambas reservas privadas en cuanto a la conservación.
En cuanto a la diversidad ecológica vemos que en SG solo está representado el 25%, lo que significa que la mayoría de gremios se han perdido, quedando solamente 5, siendo el dominante el de los escansoriales frugívoro-omnívoros y que muchas de las funciones que ejercen en el ecosistema se han perdido, sobre todo la de los herbívoros y carnívoros (solo se registraron 2 especies de 7 esperadas). En LOO la diversidad ecológica representó el 87.93% siendo la reducción de especies (de 31 a 14) y no la de gremios (de 14 a 9), y ahí, aun se registran los herbívoros como se indicó anteriormente . Las especies terrestres frugívoras fueron las mejor representadas, por lo que se puede decir que aún se mantiene la funcionalidad del ecosistema. En otro estudio de varios años realizado en distintos sistemas cafetaleros de sombra del centro de Veracruz (Gallina et al., 2008) se pudieron registrar 24 especies de mamíferos medianos, lo que demuestra que estas áreas protegidas, tal vez por el tiempo que duró este trabajo no pudieron registrarse más especies, lo que se comprobaría extendiendo el esfuerzo de muestreo.
Si analizamos los resultados obtenidos del índice de defaunación, efectivamente SG está más defaunada (0.51) tal vez por una mayor actividad humana, mientras que LOO fue menor (0.32) por encontrarse formando parte de una reserva de la biosfera. Con estos resultados, podemos señalar que las reservas privadas en su conjunto, sí podrían jugar un papel en la conservación de mamíferos medianos (sobre todo de especies que se encuentran en riesgo) y que aun sobreviven en esos sitios y se complementan en cuanto a especies, a pesar de la severa transformación que ha sufrido el estado de Veracruz.
Agradecimientos
Este estudio fue realizado con fondos del Proyecto Estratégico “Refaunación de Áreas Protegidas en el Estado de Veracruz” Núm. 2003530908 del Instituto de Ecología, A.C. Agradecemos a los propietarios de las Reservas Ecológicas: Santa Gertrudis, a la familia Hernández Ochoa (la Sra. Elvira, y sus hijos Karina, Bernardo y Alejandra) y La Otra Opción, a Arturo Miguel Knopflmacher Basañez. A Edith Carrera (LOO), Rolando González (INECOL) y Mariano Avendaño Díaz (Universidad Veracruzana) y para el trabajo de campo Federico Agapito Galindo y Bernardino Romero Vivanco.
Referencias
Aguilar, C., Martínez, E. y Arriaga, L. (2000). Deforestación y fragmentación de ecosistemas: ¿Qué tan grave es el problema en México? Conabio. Biodiversitas, 30, 7–11.
Briceño-Méndez, M., Naranjo, E., Pérez-Irineo, G., Contreras-Perera, Y., Sandoval-Serés, E. y Hidalgo-Mihart, M. G. (2017). Richness and trophic guilds of carnivorous mammals in ejido Nuevo Becal, Calakmul, Campeche, Mexico. Therya, 8, 145–150.
Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M. y West, G. B. (2004). Toward a metabolic theory of ecology. Ecology, 85, 1771–1789.
Camargo-Sanabria, A. A. y Mendoza, E. (2016). Interactions between terrestrial mammals and the fruits of two neotropical rainforest tree species. Acta Oecologica, 63, 45–52.
Colwell, R. K. (2016). EstimateS (Version 9.1.0); http://purl.oclc.org/estimates
Dirzo, R. y García, M. C. (1992). Rates of deforestation in Los Tuxtlas, a Neotropical area in southeast Mexico. Conservation Biology, 6, 84–90.
Dirzo, R., Young, H. S., Galetti, M., Ceballos, G., Isaac, N. J. B. y Collen, B. (2014). Defaunation in the Anthropocene. Science, 345, 40–406.
Estes, J. A., Terborgh, J., Brashares, J. S., Power, M. E., Berger, J., Bond, W. J. et al. (2011). Trophic downgrading of planet earth. Science, 333, 301–306.
Galetti, M. y Dirzo, R. (2013). Ecological and evolutionary consequences of living in a defaunated world. Biological Conservation, 163, 1–6.
Gallina, S., González-Romero, A. y Manson, R. (2008). Mamíferos pequeños y medianos. En R. Manson, V. Hernández-Ortíz, S. Gallina y K. Mehltreter (Eds.), Agroecosistemas cafetaleros de Veracruz: biodiversidad, manejo y conservación (pp. 161–180). México D.F.: INECOL/ INE-Semarnat.
García, E. (1988). Modificaciones al sistema de clasificación climática de Köppen. México, D.F.: Offset Larios.
Giacomini, H. C. y Galetti, M. (2013). An index for defaunation. Biological Conservation, 163, 33–41.
Hansen, D. M. y Galetti, M. (2009).The forgotten megafauna. Science, 324, 42–43.
Hernández, M. I. M., Barreto, P. S. C. S., Costa, V. H., Creão-Duarte, A. J. y Favila, M. E. (2014). Response of a dung beetle assemblage along a reforestation gradient in Restinga forest. Journal of Insect Conservation, 18, 539–546.
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363–375.
Jost, L. (2007). Patitioning diversity into independent alpha and beta components. Ecology, 88, 2427–2439.
Miranda, F. y Hernández, X. E. (1963). Los tipos de vegetación de México y su clasificación. Boletin Sociedad Botánica, México, 28, 29–179.
Moreno, C. E., Barragán, F., Pineda, E. y Pavón, N. P. (2011). Reanalyzing alpha diversity: alternatives to understand and compare information about ecological communities. Revista Mexicana de Biodiversidad, 82, 1249–1261.
Ortega-Rubio, A., Pinkus-Rendón, M. J. y Espitia-Moreno, I. C. (Eds.). (2015). Las áreas naturales protegidas y la investigación científica en México. México D.F.: Centro de Investigaciones Biológicas del Noroeste, S.C./ Universidad Autónoma de Yucatán/ Universidad Michoacana de San Nicolás de Hidalgo.
Pennington, T. D. y Sarukhán, J. (1998). Árboles tropicales de México. México D.F.: INIF-SAG.
Polishchuk, L. V. (2010). The three-quarter-power scaling of extinction risk in Late Pleistocene mammals, and a new theory of the size selectivity of extinction. Evolutionary Ecology Research, 12, 1–22.
Ramírez-Pulido, J., González-Ruiz, N., Gardner, A. L. y Arroyo-Cabrales, J. (2014). List of recent mammals of Mexico. Special Publications. Museum Texas Tech University, 63, 1–69.
Robinson, J. G. y Redford, K. H. (1986). Body size, diet and population density of Neotropical forest mammals. American Naturalist, 128, 665–680.
Seddon, P. J., Griffiths, C. J., Soorae, P. S. y Armstrong, D. P. (2014). Reversing defaunation: Restoring species in a changing world. Science, 345, 406–412.
Vidal, M. M., Pires, M. M. y Guimarães, P. R. Jr. (2013). Large vertebrates as the missing components of seed-dispersal networks. Biological Conservation, 163, 42–48.
Williams-Linera, G., Manson, R. H. e Isunza-Vera, E. (2002). La fragmentación del bosque mesófilo de montaña y patrones de uso del suelo en la región oeste de Xalapa, Veracruz, México. Maderas y Bosques, 8, 73–89.
Winker, E. (1997). Introducción a las aves de Los Tuxtlas. En E. González-Soriano, R. Dirzo y R. C. Vogt (Eds.), Historia natural de Los Tuxtlas, México (pp. 535540). Ciudad de México: IB-UNAM/ IE-UNAM/ Conabio.
Woodward, G., Ebenman, B., Emmerson, M. C., Montoya, J. M., Olesen, J. M., Valido, A. et al. (2005). Body size in ecological networks. Trends Ecology & Evolution, 20, 402–409.