Microbiota bacteriana oral de la tortuga del bolsón Gopherus flavomarginatus en la Reserva de la Biosfera Mapimí, México
Cristina García-De la Peña a, *, Mirsha Rojas-Domínguez b, Aurelio Ramírez-Bautista b, Felipe Vaca-Paniagua c, Clara Díaz-Velásquez c, Verónica Ávila-Rodríguez a, Luis Manuel Valenzuela-Núñez a y César Alberto Meza-Herrera d
a Facultad de Ciencias Biológicas, Universidad Juárez del Estado de Durango, Av. Universidad s/n, Fracc. Filadelfia, 35010 Gómez Palacio, Durango, México
b Laboratorio de Ecología de Poblaciones, Centro de Investigaciones Biológicas, Instituto de Ciencias Básicas e Ingeniería, Universidad Autónoma del Estado de Hidalgo, Carretera Pachuca-Tulancingo Km. 4.5, Col. Carboneras, 42184 Mineral de La Reforma, Hidalgo, México
c Laboratorio Nacional en Salud: Diagnóstico Molecular y Efecto Ambiental en Enfermedades Crónico-Degenerativas, Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México, Av. De Los Barrios 1, Los Reyes Iztacala, 54090 Tlalnepantla, Estado de México, México
d Universidad Autónoma Chapingo-URUZA, Carretera Gómez Palacio-Ciudad Juárez Km. 40, s/n, 35230 Bermejillo, Durango, México
*Autor para correspondencia: cristina.g.delapena@gmail.com (C. García-De la Peña)
Resumen
Se determinó la comunidad bacteriana oral de tortugas del Bolsón Gopherus flavomarginatus de la Reserva de la Biosfera Mapimí, México, mediante secuenciación masiva. En 2015 se tomaron muestras a 5 machos y 5 hembras adultos aparentemente sanos; se extrajo el ADN, se amplificaron las regiones V3-V4 16S r ARN, se realizó secuenciación con Illumina y se usó EzBioCloud como base taxonómica de referencia. No se observó diferencia significativa en la microbiota oral entre sexos. Proteobacteria, Actinobacteria y Firmicutes fueron los phyla dominantes, así como la clase Gammaproteobacteria y el orden Pasteurellales. Pasteurellaceae, Moraxellaceae y Micrococcaceae fueron las familias más abundantes. De entre los taxones potencialmente patógenos para tortugas, se registra molecularmente la presencia de Mycoplasma y Pasteurella testudinis en G. flavomarginatus; ambas son consideradas posibles participantes en causar enfermedad respiratoria superior en otras especies de Gopherus. Se reporta por primera vez el género Bergeyella en la cavidad oral de un reptil; esta bacteria zoonótica solo había sido reportada como parte de la microbiota oral de caninos y felinos. Esta información integra una línea base de diversidad bacteriana oral para esta especie que puede contribuir a mejorar los planes actuales de su conservación y manejo.
Palabras clave:
Gen 16S rARN; EzBioCloud; Proteobacteria; Mycoplasma; Pasteurella testudinis
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Oral bacterial microbiome of the bolson tortoise Gopherus flavomarginatus at the Reserva de la Biosfera Mapimí, Mexico
Abstract
The community of oral bacteria of the Bolson tortoise, Gopherus flavomarginatus, was determined at the Reserva de la Biosfera Mapimí, México by massive sequencing. During 2015, samples of 5 males and 5 females apparently healthy were collected; DNA was extracted, V3-V4 16S rRNA regions were amplified, sequencing was carried out with Illumina, and EzBioCloud was used as the reference taxonomic base. No significant difference was observed in the oral microbiota between sexes. Proteobacteria, Actinobacteria, and Firmicutes were the dominant phyla, as well as the class Gammaproteobacteria, and the order Pasteurellales. Pasteurellaceae, Moraxellaceae, and Micrococcaceae were the most abundant families. Among taxa potentially pathogenic for tortoises, we documented molecularly the presence of Mycoplasma, and Pasteurella testudinis in G. flavomarginatus; both are considered as possible participants in causing upper respiratory disease in other Gopherus species. Genus Bergeyella is reported for the first time in the oral cavity of a reptile; this zoonotic bacteria had only been reported as part of the oral microbiome of canines and felines. This information provides an oral bacterial diversity baseline for this species that will contribute to and improve current conservation and management plans.
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
16S rRNA gene; EzBioCloud; Proteobacteria; Mycoplasma; Pasteurella testudinis
Introducción
La microbiota bacteriana ha coevolucionado con los vertebrados durante millones de años (Kilian et al., 2016). En particular, la cavidad oral se considera un gran ecosistema bacteriano debido a su contacto directo con el medio ambiente (Marsh y Martin, 2009). Esta composición bacteriana oral puede cambiar según la especie, el sexo, la edad, la nutrición, las condiciones climáticas y la estación del año (Carter y Cole, 1990). Entre los beneficios que ofrece la microbiota oral a su hospedero, se encuentra la formación de capas bacterianas organizadas en estructura y función (biofilm) que regulan la colonización, defensa y adaptación a cambios del medio ambiente (Li y Tian, 2012).
La microbiota oral de los reptiles sanos está compuesta por una gran diversidad de bacterias (Straub, 2002), entre las que se encuentran microorganismos comensales o mutualistas, así como algunos potencialmente patógenos para el hospedero (Santoro et al., 2006). Cuando el equilibrio entre los microorganismos y los tejidos se rompe, algunas bacterias se vuelven oportunistas provocando enfermedades infecciosas que pueden alterar la salud y repercutir en el crecimiento, reproducción y supervivencia (Ávila et al., 2009; Cleveland et al., 2002; Pérez-Heydrich et al., 2011). En algunos estudios se determinó la flora bacteriana oral en tortugas sanas de las especies Testudo hermanni, T. marginata, T. horsfieldii, Emys orbicularis, Mauremys rivulata, Sternotherus odoratus y Pelusios castaneus; se registraron bacterias comensales y potencialmente patógenas, como: Acinetobacter, Actinobacillus, Aeromonas, Alcaligenes, Bacillus, Chryseobacterium, Citrobacter, Elizabethkingia, Enterobacter, Escherichia, Haemophilus, Klebsiella, Kluyvera, Moraxella, Proteus, Pseudomonas, Salmonella, Serratia, Staphylococcus y Vibrio (Hacioglu et al. 2012; Heynol et al., 2015; Santoro et al., 2006; Straub, 2002). Para las tortugas del género Gopherus en Norteamérica se han registrado bacterias en la región oral pertenecientes a los géneros Citrobacter, Corynebacterium, Enterococcus, Flavobacterium, Kytococcus, Micrococcus, Pseudomonas, Staphylococcus y Stenotrophomonas (Dickinson et al., 2001; García-De la Peña et al., 2016; Ordorica et al., 2008). Sin embargo, Mycoplasma agassizii, M. testudineum y Pasteurella testudinis, en conjunto con un iridovirus y el herpesvirus 2, se han reportado como algunos de los posibles causantes de la enfermedad de las vías respiratorias superiores (URTD, por sus siglas en inglés) en tortugas, provocando disminución de las poblaciones de G. agassizii y G. polyphemus en EUA (Brown et al., 1999, 2001, 2004; Guthrie et al., 2013; Jacobson, 1994; Jacobson et al., 2012; Westhouse et al., 1996). La mayoría de estos estudios se han llevado a cabo utilizando técnicas tradicionales de aislamiento de bacterias mediante cultivos, pero debido a que gran parte de estos microorganismos depende de un microambiente específico que no puede ser reproducido en laboratorio, se vuelve limitado el conocimiento de su diversidad. Actualmente, la secuenciación masiva de regiones del gen 16S rARN ha permitido análisis de las comunidades microbianas a partir de cualquier tipo de muestra sin necesidad de realizar cultivos, aumentando significativamente el conocimiento de los géneros y especies que conforman la microbiota (Abusleme et al., 2017; Dewhirst et al., 2015; Hyde et al., 2016).
En México, la tortuga del Bolsón (Gopherus flavomarginatus) es endémica, se encuentra en estatus de peligro de extinción por la Norma Oficial Mexicana 059 (Semarnat, 2010) y como en peligro crítico según la Lista Roja de la UICN (Kiester et al., 2018). Su distribución geográfica está restringida al Bolsón de Mapimí en el desierto chihuahuense mexicano, donde actualmente se encuentra protegida en la Reserva de la Biosfera Mapimí (Conanp, 2006). Al igual que otras especies del género, G. flavomarginatus puede ser susceptible a enfermedades bacterianas, por lo que, en el presente estudio se determinó la microbiota bacteriana oral de machos y hembras de G. flavomarginatus aparentemente sanas mediante secuenciación masiva 16S rARN en la Reserva de la Biosfera Mapimí; con esta información se identificaron aquellas especies de bacterias potencialmente patógenas para las vías respiratorias. Se espera que esta información contribuya a mejorar los planes actuales de conservación y manejo para apoyar la sobrevivencia de esta especie.
Materiales y métodos
La Reserva de la Biosfera Mapimí abarca una superficie de 342,388 ha y comprende parte de Chihuahua, Coahuila y Durango en México (26°00’ y 26°10’ N, 104°10’ y 103°20’ O; 1,250 m snm). El clima es muy árido, semicálido BWhw(e), con una temperatura media anual de 25.5 °C y lluvias en verano (García, 2004). La vegetación predominante son los matorrales rosetófilo y micrófilo, así como la vegetación halófila y gipsófila (Rzedowski, 2006).
Para llevar a cabo la toma de datos y muestras de individuos G. flavomarginatus, se contó con el permiso DGVS07305/14 expedido por la Semarnat. Durante mayo del 2015, 5 personas recorrieron las áreas de colonias donde se distribuyen las tortugas G. flavomarginatus, establecidas previamente en el protocolo de monitoreo de esta especie (Conanp, 2017). Las tortugas se capturaron manualmente mientras estaban en actividad. Para cada individuo se registró el sexo (hembra: plastrón plano, cola corta, ausencia de glándulas bajo el mentón; macho: plastrón cóncavo, cola más larga que la hembra, presencia de glándulas bajo el mentón) de acuerdo con Adest et al. (1989) y el peso utilizando una red de tela y una balanza digital (0.01 gr). El estado físico de cada tortuga se determinó siguiendo los protocolos de observación de Homer et al. (1998), Jacobson (2014), USFWS (2016) y Wendland et al. (2009).
Para la toma de muestras orales, se abrió la boca de cada tortuga con ambas manos siguiendo el protocolo de manejo de la USFWS (2016); se introdujo un par de hisopos estériles y se llevó a cabo un ligero raspado en paladar, lengua y área sublingual durante aproximadamente 30 segundos. El par de hisopos fueron depositados en un tubo cónico estéril conteniendo 5 ml de solución salina fisiológica; estas muestras se conservaron en hielera a 4 °C. En seguida la tortuga fue liberada en el mismo sitio de su captura y se realizaron observaciones durante varios minutos para asegurar que el individuo mostrara una conducta normal.
El trabajo de laboratorio se llevó a cabo en el Laboratorio Nacional en Salud: Diagnóstico Molecular y Efecto Ambiental en Enfermedades Crónico-Degenerativas, Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México. Los hisopos de cada muestra se agitaron en la solución fisiológica y posteriormente se presionaron contra las paredes del tubo y se retiraron. Los tubos se centrifugaron a 12,000 g × 10 min para formar una pastilla bacteriana; se desechó el líquido sobrante dejando únicamente 250 µl que fueron depositados en un tubo para lisis BashingBead™; en seguida se agregaron 750 µl de buffer lisante/estabilizador Xpedition™ Zymo Research™. Cada tubo se colocó en un disruptor celular (TerraLyzer™) durante 30 segundos para su conservación.
El ADN de las muestras se extrajo utilizando el kit Fungal/Bacteria ADN MiniPrep de Zymo Research™. El ADN extraído se corrió en geles de agarosa al 1.2% a 80V durante 45 minutos en cámara de electroforesis BIO-RAD para visualizar la presencia de ADN de alto peso molecular. La visualización se llevó a cabo en un fotodocumentador GelMaxTM (UVP®). La cantidad de ADN por muestra se midió en un fluorómetro marca Qubit®. Se llevó a cabo la amplificación de las regiones V3 y V4 del gen 16S rARN empleando los primers sugeridos por Klindworth et al. (2013): S-D-Bact-0341-b-S-17, 5´-CCTACGGGNGGCWGCAG-3´ y S-D-Bact-0785-a-A-21, 5´-GACTACHVGGGTATCTAATCC-3´, que producen un amplicón de ~460 pb. Estas secuencias se mandaron sintetizar con los adaptadores “overhang” del protocolo de Illumina (2017a) quedando de la siguiente manera:
5´-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG-3´ y
5´-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC-3´ (amplicón de ~550 pb). Se utilizó el protocolo de PCR Illumina (2017a) empleando 12.5 µl de MyTaqTM Ready Mix 1X (Bioline®), 1 µl de cada primer (10 uM), 5 µl de ADN (50 ng totales) y 5.5 µl de H2O grado molecular; se utilizó el siguiente ciclo: 95 °C por 3 minutos; 25 ciclos de 95 °C por 30 segundos, 55 °C por 30 segundos, 72 °C por 30 segundos; 72 °C por 5 minutos en un termociclador Labnet MultigeneTM Gradient PCR. Se colocó 1 μl de los productos de PCR en un chip de Bioanalyzer ADN 1000 para verificar el tamaño del amplicón (~550 pb). Se realizó la purificación de los amplicones con perlas Agentcourt® AMPure® XP al 0.8%. Posteriormente, los amplicones se etiquetaron utilizando el Nextera XT Index KitTM para la creación de las bibliotecas, siguiendo el protocolo de Illumina (2017b), empleando 25 µl de MyTaqTM Ready Mix 1X (Bioline®), 5 µl de cada primer (N7xx y S5xx), 5 µl de ADN y 10 µl de H2O grado molecular; se utilizó el siguiente ciclo: 95 °C por 3 minutos; 10 ciclos de 95 °C por 30 segundos, 55 °C por 30 segundos, 72 °C por 30 segundos; 72 °C por 5 minutos. Se realizó la purificación de las bibliotecas con perlas Agencourt® AMPure® XP al 1.2%. Se colocó 1 μl de la biblioteca final de algunos productos de PCR seleccionados al azar en un chip de Bioanalyzer ADN 1000 para verificar el tamaño del amplicón esperando un tamaño de ~630 pb. Finalmente, se realizó la cuantificación, normalización (equimolaridad), la agrupación de las bibliotecas y la secuenciación masiva de siguiente generación (MiSeq Illumina® de 2 × 250 lecturas de final pareado) siguiendo el protocolo para metagenómica 16S (Illumina, 2017a).
El análisis de las secuencias se realizó en máquina virtual Oracle VM VirtualBox 5.1.14 en la plataforma MGLinux mediante el software bioinformático Quantitative Insights Into Microbial Ecology (QIIME) v.1.9.0 (Caporaso et al., 2010). El proceso se inició ensamblando las secuencias forward y reverse de las muestras utilizando el programa PEAR (Zhang et al., 2014) con un traslape de 50 pb, una longitud mínima por lectura de 430 pb y máxima de 470 pb, un criterio de calidad Q30 (una base errónea por cada 1,000 bases) y un valor de p < 0.0001. Enseguida, los archivos fueron convertidos a formato FASTA y se llevó a cabo la eliminación de secuencias quiméricas de las muestras con USEARCH (Edgar, 2010). La selección de OTUs se realizó con el método UCLUST (Edgar, 2010) al 97% de similitud; se obtuvo una secuencia representativa para cada OTU y se asignó la taxonomía tomando como referencia la bases de datos EzBioCloud (Yoon et al., 2017). Se construyó la tabla de OTUs en formato biom (Biological observation matrix; McDonald et al., 2012), se separaron los dominios y se filtraron los singletons (OTUs que solo tuvieron una observación), esto último de acuerdo con Navas-Molina et al. (2013). Se obtuvieron las tablas de abundancia absoluta de OTUs y se graficó el número de secuencias por el número de taxones, categoría género, para observar si se logró una profundidad de cobertura adecuada (curvas de tendencia asíntota); esta gráfica se realizó en PAST ver 3.15 (Hammer et al., 2001). Al observar que el número de secuencias alcanzado de manera simultánea por todas las muestras fue 100,000, se llevó a cabo un proceso de rarefacción aleatoria simple (Weiss et al., 2017) tomando este valor como el número de secuencias a generarse. De esta forma se obtuvo un archivo biom estandarizado para todas las muestras. Con este archivo se calculó la diversidad beta utilizando el índice de Bray-Curtis (Beals, 1984); esta matriz de diversidad beta se utilizó para llevar a cabo una prueba Permanova (p < 0.05) para probar diferencia significativa de la microbiota oral entre sexos. La diversidad alfa se calculó con los índices de Shannon y Simpson; para probar la diferencia significativa entre sexos se utilizaron pruebas no paramétricas de t student con 999 permutaciones Monte Carlo para calcular el valor de significancia.
Se obtuvieron las abundancias relativas para phylum, clase, orden y familia, y se graficaron en Excel. Los géneros cuya abundancia relativa fue superior al 0.01% fueron representados en un mapa de calor; se utilizó el método de conglomerados jerárquicos con medida euclidiana para el dendrograma de las muestras; esta visualización se realizó con el software Morpheus (https://software.broadinstitute.org/GENE-E/). La determinación de la microbiota núcleo (OTUs presentes en todas las muestras) se llevó a cabo con los géneros y con el comando compute_core_microbiome.py.
Cada género y/o especie de bacteria registrada para G. flavomarginatus fue consultada en la literatura disponible para indicar su posible potencial patógeno en tortugas (Brown et al., 1999; Gregersen et al., 2009; Martínez-Silvestre y Soler-Massana, 2008; Martínez-Silvestre et al., 1999; McArthur, 2004; McArthur et al., 2004; Muro et al., 1998; Paré et al., 2006).
Resultados
Se presentan resultados obtenidos para muestras orales de 10 individuos adultos (5 hembras y 5 machos) físicamente sanos. Los machos presentaron una talla promedio de caparazón de 31.2 cm de largo, 26.8 cm de ancho y 9.4 kg de peso, mientras que las hembras presentaron valores de 28.8 cm, 23.8 cm y 9.3 kg, respectivamente.
La media del número total de secuencias obtenidas para ambos sexos antes del ensamblaje fue 295,811, la media de secuencias ensambladas fue 220,854 y la media de secuencias desechadas fue 74,957; en promedio se eliminaron 1,513 quimeras, dejando una media de secuencias de calidad de 219,341. Tras la asignación taxonómica, se obtuvo una media de secuencias bacterianas de 202,017 que después de eliminar los singletons fue de 157,272 (tabla 1).
Se registró una profundidad de cobertura adecuada en cuanto al número de OTUs bacterianos de las muestras, ya que todas las curvas alcanzaron la asíntota cerca de las 100,000 secuencias (fig. 1). Utilizando la matriz de diversidad beta de Bray-Curtis generada con el archivo estandarizado a 100,000 secuencias aleatorias, no se registró diferencia significativa entre la microbiota oral de machos y hembras de G. flavomarginatus (Permanova: pseudo-F = 0.942, p = 0.461). La media del índice de diversidad de Shannon fue 6.98 y con Simpson fue 0.91. No se observó diferencia significativa entre sexos en ninguno de los índices de diversidad alfa (Shannon: t = 0.83, p = 0.418; Simpson: t = 0.72, p = 0.434).
Tabla 1. Número de secuencias orales obtenidas para cada individuo de Gopherus flavomarginatus. M = Macho, H = hembra, QE = quimeras eliminadas, SC = secuencias de calidad después de la eliminación de quimeras, SB = secuencias bacterianas después de la asignación taxonómica, SBSS = secuencias bacterianas después de la eliminación de los singletons.
|
Individuo |
Totales |
Ensambladas |
Desechadas |
QE |
SC |
SB |
SBSS |
|
M1 |
340,740 |
256,062 |
84,678 |
1,785 |
254,277 |
246,210 |
194,769 |
|
M2 |
287,584 |
229,153 |
58,431 |
798 |
228,355 |
221,586 |
170,019 |
|
M3 |
328,799 |
270,616 |
58,183 |
1,214 |
269,402 |
265,229 |
207,505 |
|
M4 |
301,889 |
188,996 |
112,893 |
1,299 |
187,697 |
131,325 |
104,378 |
|
M5 |
282,872 |
214,263 |
68,609 |
3,832 |
210,431 |
195,911 |
143,540 |
|
H1 |
306,617 |
253,611 |
53,006 |
1,215 |
252,396 |
245,541 |
191,708 |
|
H2 |
229,638 |
181,434 |
48,204 |
371 |
181,063 |
141,369 |
109,133 |
|
H3 |
260,181 |
184,527 |
75,654 |
1,870 |
182,657 |
163,767 |
133,544 |
|
H4 |
324,940 |
239,091 |
85,849 |
1,604 |
237,487 |
228,880 |
177,905 |
|
H5 |
294,854 |
190,790 |
104,064 |
1,142 |
189,648 |
180,350 |
140,222 |
|
Media |
295,811 |
220,854 |
74,957 |
1,513 |
219,341 |
202,017 |
157,272 |
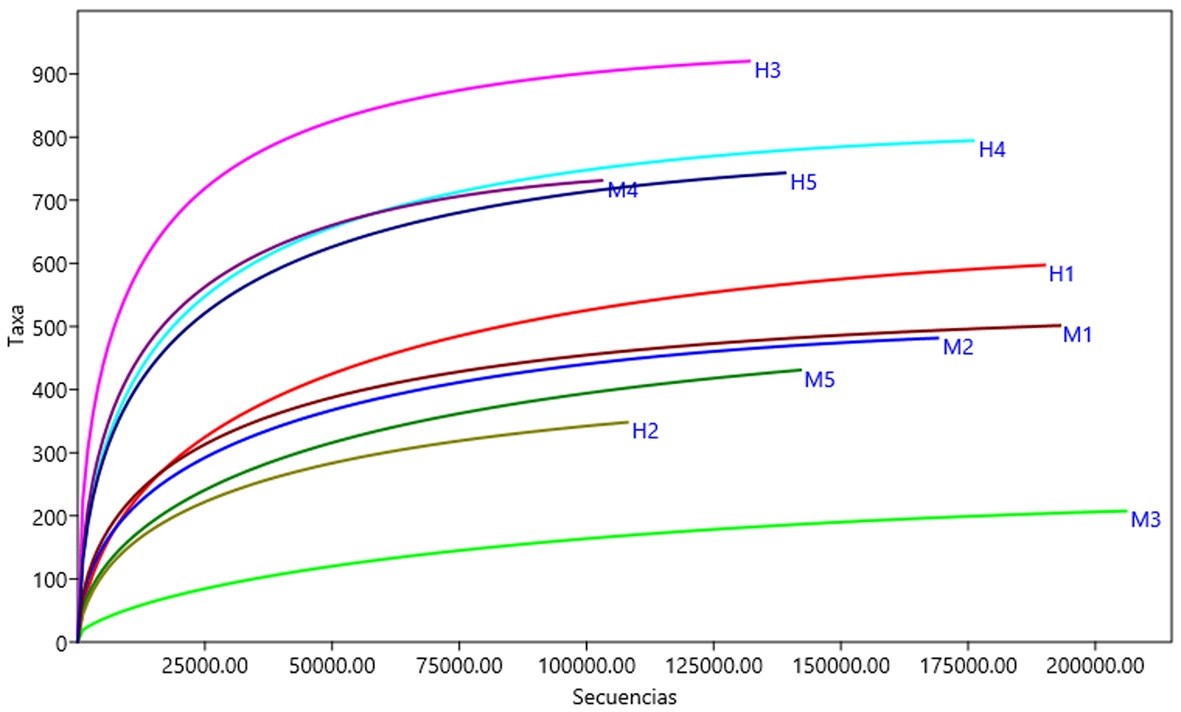
Se registraron 34 phyla, de los cuales Proteobacteria (x = 59%), Actinobacteria (x = 15%), Firmicutes (x = 10%) y Bacteroidetes (x = 7%) fueron los más abundantes (fig. 2). Se determinaron 98 clases, entre las que Gammaproteobacteria (x = 43%), Alphaproteobacteria (x = 11%), Bacilli (x = 8%) y Flavobacteria (x = 5%) mostraron los porcentajes más altos (fig. 3). Se obtuvieron 175 órdenes de los cuales Pasteurellales fue el más abundante (x = 30%), seguido por Pseudomonadales (x = 11%) y Micrococcales (x = 10%) (fig. 4). De las 434 familias registradas predominaron Pasteurellaceae (x = 30%), Moraxellaceae (x = 11%), Micrococcaceae (x = 9%) y Rhodobacteraceae (x = 8%) (fig. 5). Se reportaron 1,387 géneros y los más abundantes fueron Chelonobacter (x = 30%), Acinetobacter (x = 11%) y Paracoccus (x = 7%). El mapa de calor de los géneros cuya abundancia relativa fue mayor a 0.01% se muestra en la figura 6. El género Mycoplasma_g13 se determinó en 3 individuos (2 machos y 1 hembra) con una abundancia relativa de 9.82E-06, 7.17E-05 y 3.34E-05, respectivamente. Se contabilizaron 1,527 especies, de las cuales 235 se encuentran identificadas en esta base de datos taxonómica. La especie Pasteurella testudinis se determinó en 5 individuos (2 machos y 3 hembras) con las siguientes abundancias relativas: 3.92E-05, 1.53E-05, 1.52E-05, 3.94E-05 y 6.61E-06. Los géneros que se registraron como microbiota núcleo se muestran en la tabla 2.
Con base en los resultados obtenidos, se determinaron 44 géneros y/o especies de bacterias que, según la literatura disponible, han causado enfermedades orales, nasales, oculares o respiratorias en tortugas (tabla 3).
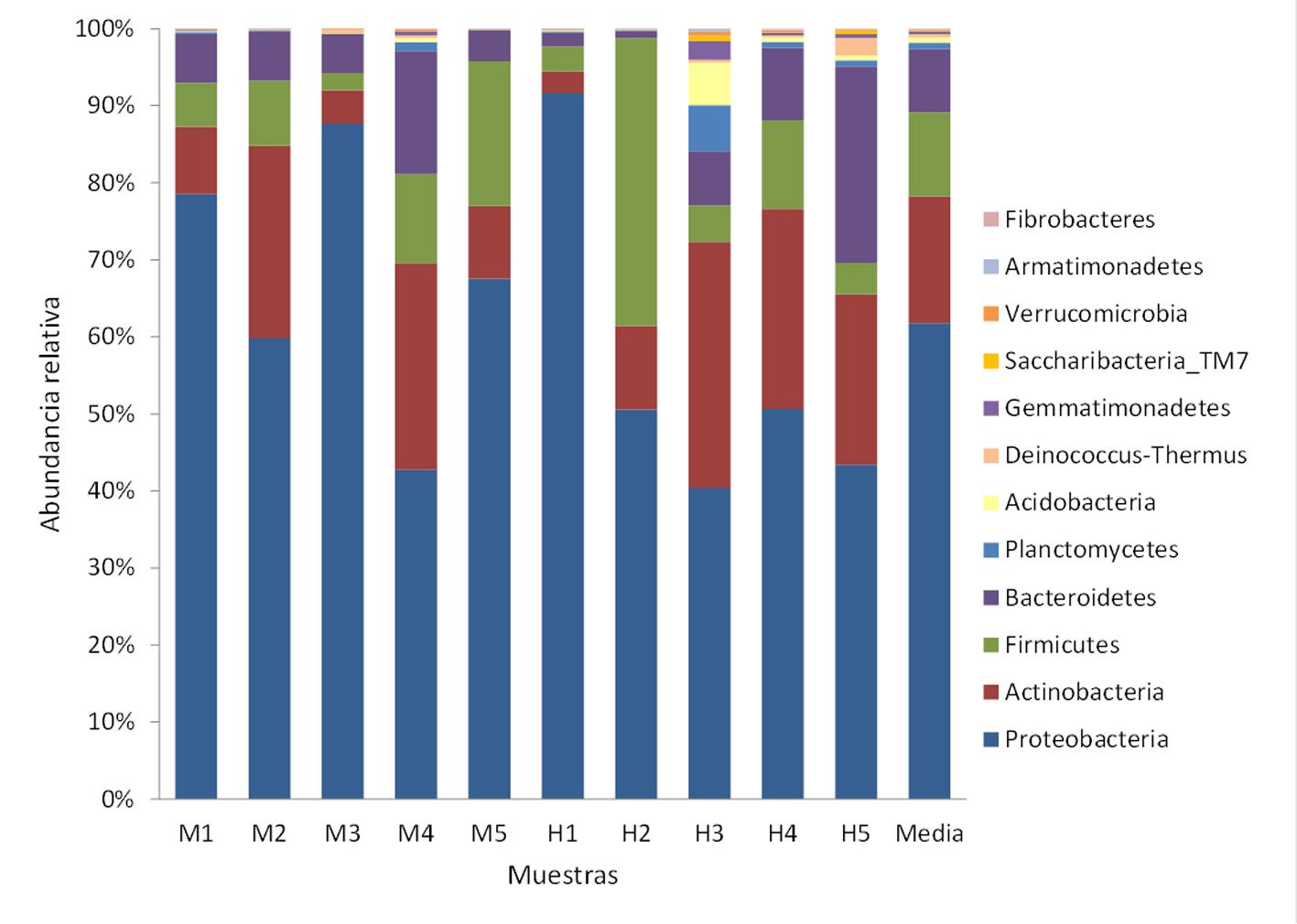
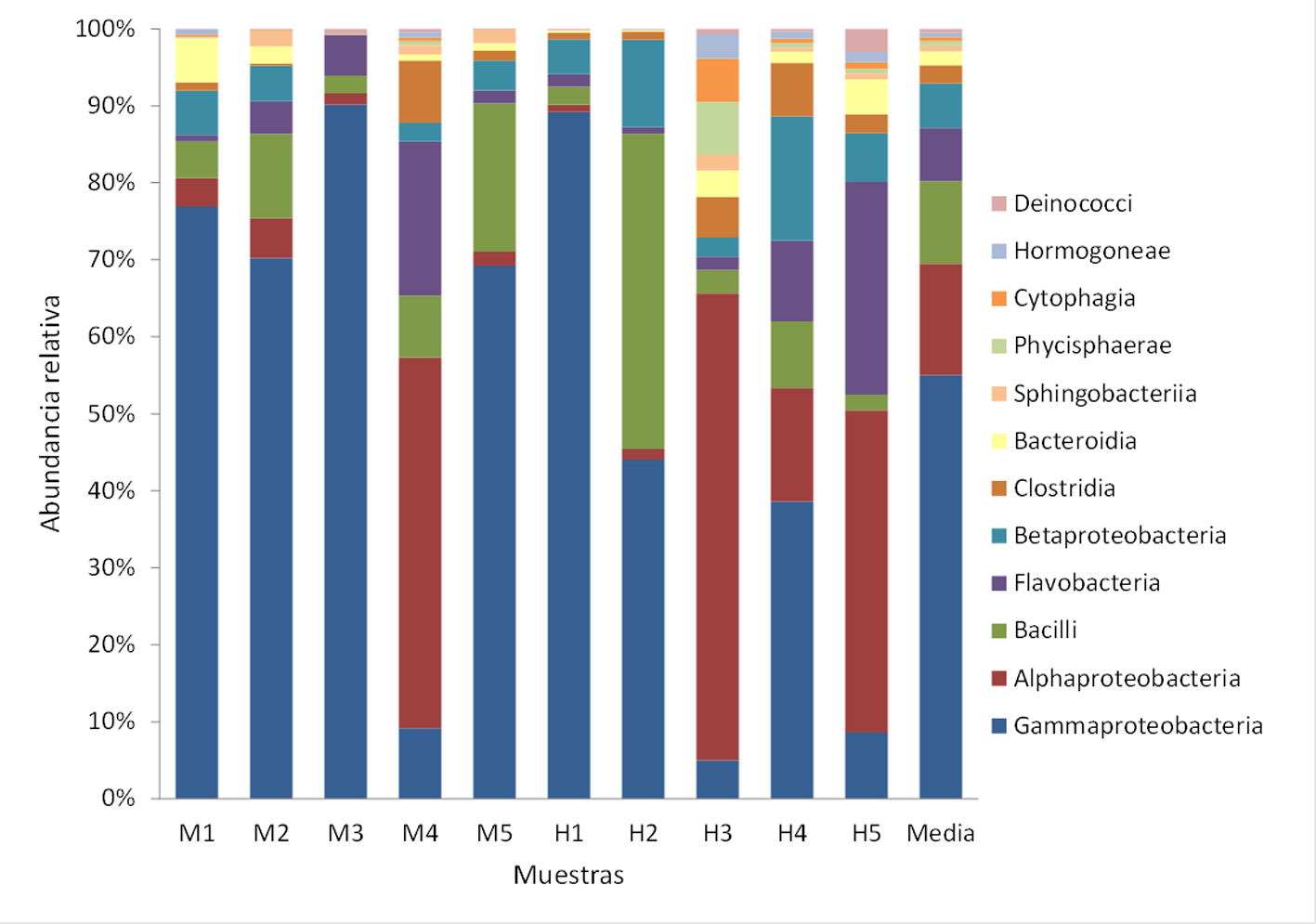
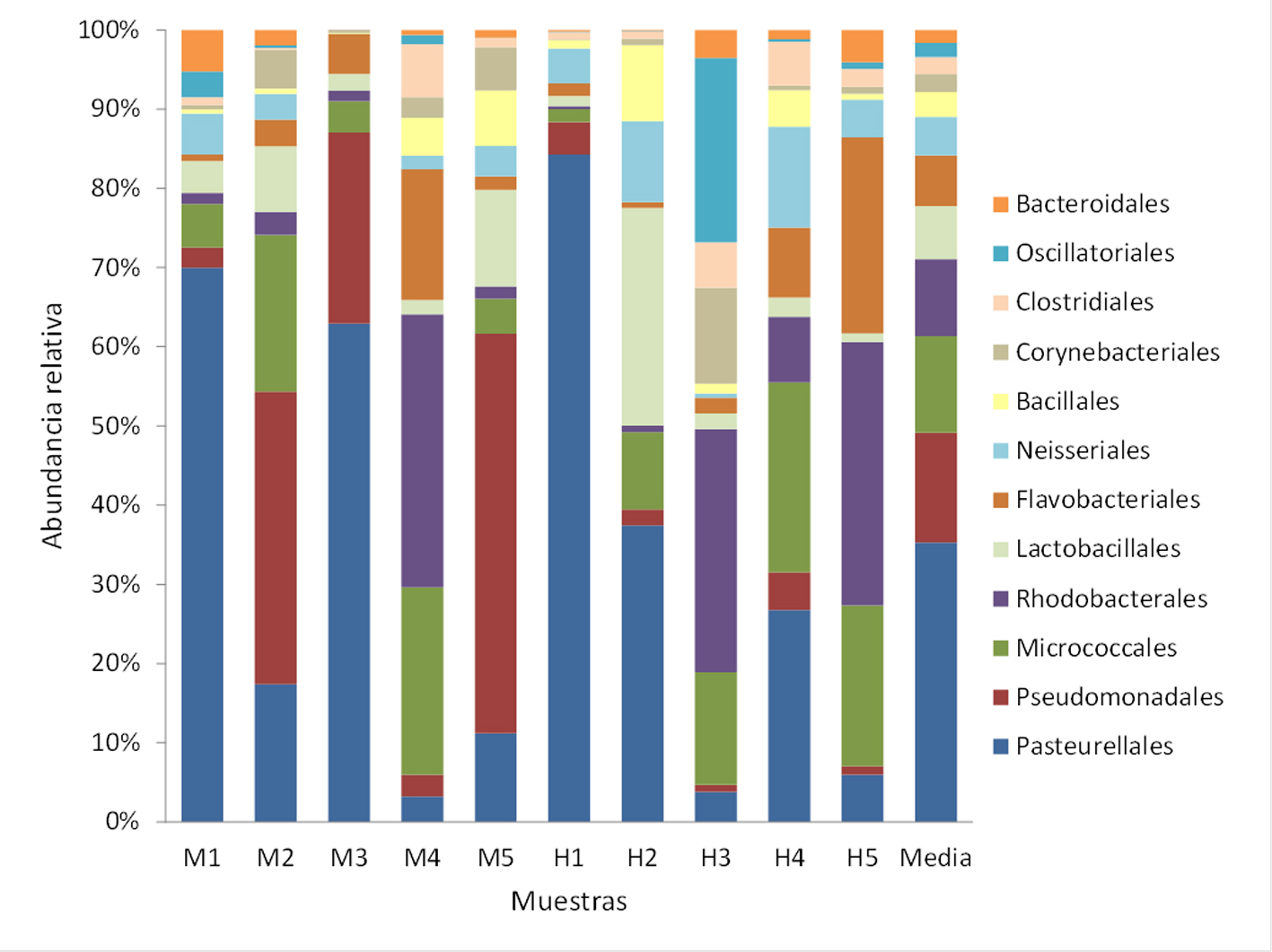
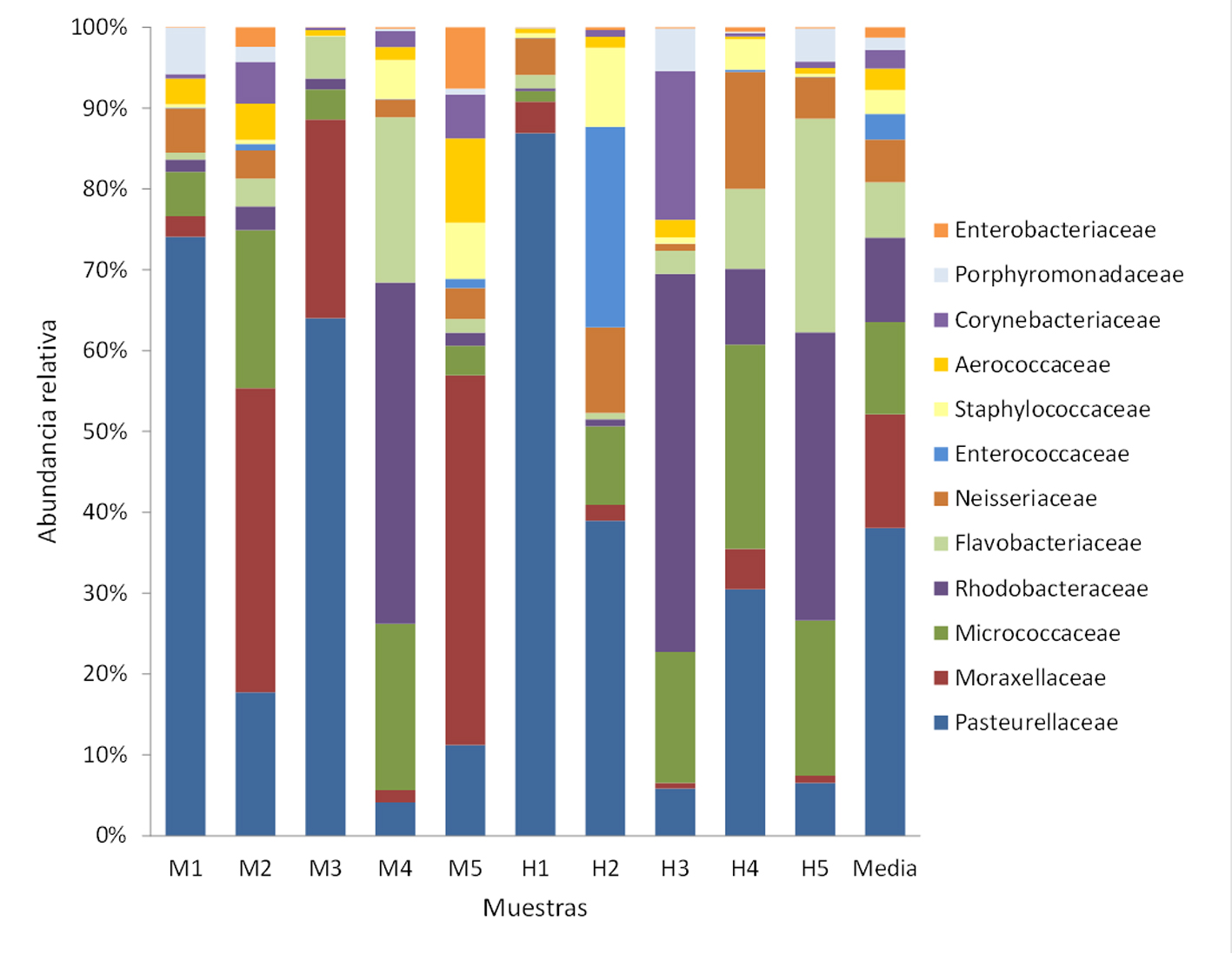

Tabla 2. Géneros de bacterias orales que conformaron la microbiota núcleo de Gopherus flavomarginatus.
|
Géneros |
|
|
Acinetobacter |
Kytococcus |
|
Arthrobacter |
Massilia |
|
Bacillus |
Methylobacterium |
|
Bergeyella |
Microcoleus |
|
Blastococcus |
Microvirga |
|
Brachybacterium |
Modestobacter |
|
Brevundimonas |
Nesterenkonia |
|
Cellulosilyticum |
Novihesbarpirillum |
|
Chelonobacter |
Paracoccus |
|
Clostridium |
Phenylobacterium |
|
Corynebacterium |
Pseudarthrobacter |
|
Cryobacterium |
Pseudomonas |
|
Chryseobacterium |
Pseudonocardia |
|
Deinococcus |
Rubellimicrobium |
|
Diaphorobacter |
Rubrobacter |
|
Enterococcus |
Rothia |
|
Facklamia |
Skermanella |
|
Geodermatophilus |
Sphingomonas |
|
Glutamicibacter |
Staphylococcus |
|
Halomonas |
Streptococcus |
|
Janibacter |
Streptomyces |
|
Kineococcus |
Terrisporobacter |
|
Kocuria |
Testudinibacter |
Discusión
Los phyla Proteobacteria, Actinobacteria, Firmicutes y Bacteroidetes representaron en conjunto del 86% al 91% de las bacterias orales de G. flavomarginatus; el mismo patrón lo reporta Weitzman (2017), quien registró que estos 4 phyla conforman del 84% al 94% de la microbiota oronasal de G. agassizii, G. morafkai, G. berlandieri y G. polyphemus. La clase Gammaproteobacteria fue la más abundante para G. flavomarginatus (x = 42.5%) situación similar observada por Weitzman (2017) en G. agassizii, G. morafkai y G. polyphemus con más del 25% de los OTUs pertenecientes a esta clase. El género bacteriano más abundante en las muestras de G. flavomarginatus fue Chelonobacter (x = 29.5%), perteneciente al phylum Proteobacteria. Se trata de una bacteria que anteriormente se consideraba una cepa de Pasteurella testudinis; sin embargo al analizar su genoma se clasificó como un género distinto (Gregersen et al., 2009). Al respecto, Weitzman (2017) registró gran abundancia del género Chelonobacter en muestras del tracto respiratorio superior de G. agassizii, G. morafkai, G. berlandieri y G. polyphemus (> 98% de las secuencias bacterianas por muestra) utilizando pirosecuenciación 454 y la base de datos taxonómica de Greengenes (McDonald et al., 2012). En el presente estudio, se utilizó la base taxonómica EzBioCloud, la cual se encuentra actualizada al 2017 y cuenta con un alto nivel de curación, lo cual proporciona una mejor clasificación a nivel de género, especie y subespecie (Yoon et al. 2017). Aunque no se determinó la especie de Chelonobacter presente en G. flavomarginatus, Gregersen et al. (2009) mencionan que este género presenta baja diversidad genética, lo cual indica que puede estar conformado por una sola especie a la que denominaron Chelonobacter oris. Esta especie ha sido reportada en las coanas de tortugas Testudo hermanni causando infección respiratoria (Kudirkiene et al., 2014).
La prevalencia de P. testudinis en las muestras de G. flavomarginatus fue de 50%, similar al reportado en G. agassizii de 62% (Christopher et al., 2003). Por su parte, Weitzman (com. pers.) observó a P. testudinis en 50-92% de las muestras de G. agassizii, G. morafkai, G. berlandieri y G. polyphemus y argumenta que se trata de una especie de bacteria común, abundante y diversa en tortugas Gopherus. Sin embargo, ésta es una bacteria que en conjunto con el herpesvirus 2 se han reportado como causantes de enfermedades respiratorias en tortugas (Dickinson et al., 2001; Jacobson et al., 1995, 2012; Snipes y Biberstein, 1982; Snipes et al., 1980).
Tabla 3. Prevalencia (%) de géneros y especies potencialmente patógenas registradas en la cavidad oral de Gopherus flavomarginatus según la literatura disponible (ver citas en Materiales y métodos).
|
Géneros y especies |
(%) |
Gram |
Géneros y especies |
(%) |
Gram |
|
|
Acinetobacter |
100 |
– |
Micrococcus |
90 |
+ |
|
|
Acinetobacter indicus |
10 |
– |
Moraxella |
10 |
– |
|
|
Achromobacter |
60 |
– |
Morganella |
30 |
– |
|
|
Aerococcus |
80 |
+ |
Morganella morganii |
30 |
– |
|
|
Aeromonas |
30 |
– |
Mycobacterium |
100 |
+ |
|
|
Alcaligenes faecalis |
10 |
– |
Mycoplasma |
30 |
– |
|
|
Bacillus |
100 |
+ |
Neisseria |
100 |
– |
|
|
Bacteroides |
100 |
– |
Neisseria elongata |
60 |
– |
|
|
Campylobacter |
40 |
– |
Neisseria wadsworthii |
30 |
– |
|
|
Campylobacter fetus |
10 |
– |
Pasteurella testudinis |
50 |
– |
|
|
Chelonobacter |
100 |
– |
Peptostreptococcus |
10 |
+ |
|
|
Citrobacter |
100 |
– |
Prevotella |
60 |
– |
|
|
Clostridium |
100 |
+ |
Pseudomonas |
100 |
– |
|
|
Corynebacterium |
100 |
+ |
Rhodococcus |
50 |
+ |
|
|
Enterobacter |
80 |
– |
Salmonella |
80 |
– |
|
|
Enterococcus |
100 |
+ |
Salmonella enterica |
80 |
– |
|
|
Escherichia |
80 |
– |
Serratia |
30 |
– |
|
|
Flavobacterium |
70 |
– |
Staphylococcus |
100 |
+ |
|
|
Fusobacterium |
80 |
– |
Staphylococcus aureus |
90 |
+ |
|
|
Klebsiella |
40 |
– |
Streptococcus |
100 |
+ |
|
|
Klebsiella pneumoniae |
10 |
– |
Streptococcus gallolyticus |
10 |
+ |
|
|
Klebsiella quasipneumoniae |
10 |
– |
Vibrio |
50 |
– |
El género Acinetobacter fue el segundo más abundante en cavidad oral de G. flavomarginatus; pertenece al phylum Proteobacteria y es un habitante natural de tierra y agua que puede colonizar diversos sitios corporales y sobrevivir a la desecación ambiental durante semanas (Munoz-Price y Weinstein, 2008). Es un género que provoca infecciones oportunistas en animales y fue reportado previamente en estudios de salud del tracto respiratorio de tortugas (McArthur et al., 2004). La presencia del género Bergeyella en G. flavomarginatus es el primer reporte en cavidad oral de un reptil. La única especie de este género es B. zoohelcum, que previamente solo ha sido reportada como parte de la flora oral de caninos y felinos, además de ser una bacteria zoonótica de gran importancia médica por su infección tras la mordida de este tipo de animales (Shukla et al., 2004). Del phylum Firmicutes se encontraron con relativa abundancia los géneros Enterococcus y Staphylococcus. Enterococcus es habitante del suelo, agua, plantas y es parte de la normal de la flora intestinal de animales, sin embargo, puede actuar como patógeno cuando se encuentra en otras partes del cuerpo (Devriese et al., 2006). Innis et al. (2014), reportaron bacteremia, septicemia y osteomielitis necrosante en tortugas marinas Lepidochelys kempii con letargia y anorexia, de las cuales aislaron especies de Enterococcus a partir de sangre, hueso, tracto respiratorio y lesiones cutáneas. Por su parte, Staphylococcus ha sido reportado en cavidades nasales de G. agassizii y G. morafkai (Dickinson et al., 2001; Ordorica et al., 2008) y en la conjuntiva de varias especies de los géneros Testudo y Trachemys tanto en individuos sanos como en aquellos con conjuntivitis (Di Ianni et al., 2015). Otros géneros bacterianos registrados en la cavidad oral de G. flavomarginatus en el presente estudio han sido mencionadas como patógenos oportunistas en tortugas G. agassizii y G. polyphemus (Dickinson et al., 2001; McLaughlin et al., 2000; Ordorica et al., 2008), como Pseudomonas, Salmonella, Citrobacter, Corynebacterium, Klebsiella, Flavobacterium, Strepto-coccus y Campylobacter.
La posible relación entre Mycoplasma agassizii y M. testudineum con la enfermedad respiratoria superior en G. agassizii y G. polyphemus ha sido reportada en varios estudios (Jacobson y Berry, 2012; Jacobson et al., 2014). Sin embargo, investigaciones recientes indican que no necesariamente estas bacterias podrían ser las únicas causantes de esta enfermedad, incluso, se postula que pueden presentarse signos de la enfermedad sin la presencia de Mycoplasma spp. (Weitzman et al., 2017). En el presente estudio se determinó la presencia de Mycoplasma_g13 en G. flavomarginatus, que según la base de datos EzBioCloud, su secuencia de ADN es similar a la de 7 especies de Mycoplasma, entre ellas testudineum; sin embargo, es necesario realizar pruebas de PCR específicas para determinar la especie de Mycoplasma que porta esta especie de tortuga. Su prevalencia en individuos sanos de G. flavomarginatus fue de 30%, lo cual coindice con Weitzman et al. (2017) al indicar que las tortugas pueden ser portadoras de esta bacteria aunque no muestren signos visibles de enfermedad.
En general, la infección por un patógeno depende de sus interacciones con otros microorganismos infectivos, de la comunidad microbiana en que se encuentre y del sistema inmune del hospedero (Maslo et al., 2017; Rizzetto et al., 2013; Weitzman, 2017). Con relación a este último factor, Lederle et al. (1997) y Peterson (1994) han propuesto que para G. agassizii los estresantes más importantes son la sequía, el aumento de temperatura ambiental y la falta de alimento, lo cual puede desencadenar estrés fisiológico que disminuye la resistencia a las infecciones en estas tortugas. Algunos estudios de larga duración realizados en G. morafkai y G. agassizii (1987-2008 y 1991-2012, respectivamente) han demostrado que la sequía ejerce impactos negativos en la cobertura vegetal, lo cual reduce la disponibilidad de alimento, y por ende, la sobrevivencia de las poblaciones de tortugas (Lovich et al., 2014; Medica et al., 2012). De hecho, el modelaje de un escenario de cambio climático con un incremento de 2 °C y una disminución de 5 mm de precipitación sugiere que algunos sitios donde actualmente se localiza G. agassizii serán inhabitables para esta especie (Barrows, 2011; Loarie et al., 2009; Lovich et al., 2014). Para G. flavomarginatus también se ha establecido que la precipitación se relaciona directamente con la disponibilidad de alimento (Aguirre et al., 1979). Al respecto, Becerra-López et al. (2017) llevaron a cabo un estudio en que muestran que la abundancia del alimento principal de esta tortuga (Hilaria mutica) se ha perdido en un 63.7% en la Reserva de la Biosfera Mapimí en un periodo de 30 años, debido principalmente al cambio climático, el manejo ganadero y la agricultura. Otro aspecto que podría influir de manera negativa en la resistencia del sistema inmune de G. flavomarginatus es la baja diversidad genética que se ha detectado en individuos del Bolsón de Mapimí (Ureña-Aranda y Espinosa-de los Monteros, 2012), ya que la endogamia favorece la susceptibilidad a los patógenos (Smallbone et al., 2016).
Los análisis bacteriológicos como los que se llevaron a cabo en el presente estudio, deberían formar parte de cualquier programa de conservación y monitoreo en poblaciones animales vulnerables, ya que estas referencias pueden ser utilizadas a corto plazo en la implementación de estrategias de manejo epidemiológicas, como las que menciona Boarman (2002): el aislamiento de individuos o poblaciones enfermas de las no enfermas, el tratamiento veterinario de individuos con signos de infecciones, la inmunización de individuos sanos y el mejoramiento en la calidad del hábitat para elevar la respuesta inmunitaria de la especie de tortuga en cuestión. Asimismo, McCoy et al. (2007) y Perez-Heydrich et al. (2011) proponen la implementación de programas educativos que informen a la población sobre los riesgos infecciosos que pueden ser provocados por la liberación no autorizada de tortugas que estuvieron en cautiverio hacia los hábitats de vida libre. Por lo tanto, es importante que las estrategias de manejo y conservación de G. flavomarginatus sean dinámicas y se vayan adaptando a las distintas situaciones climáticas, antropogénicas y epidemiológicas que se presenten en su área de distribución, con el fin de asegurar la conservación de esta especie de tortuga a largo plazo.
Agradecimientos
Este proyecto fue apoyado por el Fondo Sectorial de Investigación para la Educación SEP-Conacyt Ciencia Básica (220658). Se agradece a Estefanía Garduño-Niño, Magdalena Rivas-García, Romario Martínez-Saldívar, Jesús Martínez-Luna, Ricardo Zapata-Ramírez, Irene Pacheco-Torres, Nohemí Villa-Vázquez y Sergio Barraza-Guerrero, por su ayuda en el trabajo de campo. A Cristino Villarreal-Wislar y al personal de la Administración de la Reserva de la Biosfera Mapimí por el apoyo logístico durante la realización del presente estudio. A Cameron W. Barrows (Universidad de California, Riverside) por la revisión del Abstract.
Referencias
Abusleme, L., Hong, B. Y., Hoare, A., Konkel, J. E., Diaz, P. I. y Moutsopoulos, N. M. (2017). Oral microbiome characterization in murine models. BioProtocol, 7, e2655.
Adest, G. A., Aguirre-León, G., Morafka, D. J. y Jarchow, J. V. (1989). Bolsón tortoise (Gopherus flavomarginatus) conservation: I. Life history. Vida Silvestre Neotropical, 2, 7–13.
Aguirre, G., Adest, G. A., Recht, M. y Morafka, D. J. (1979). Preliminary investigations of the movements, thermoregulation, population structure and diet of the Bolson tortoise (Gopherus flavomarginatus) in the Mapimí Biosphere Reserve, Durango, México. Proceedings Desert Tortoise Council, 1, 149–165.
Ávila, M., Ojcius, D. M. y Yilmaz, Ö. (2009). The oral microbiota: Living with a permanent guest. DNA and Cell Biology, 28, 405–411.
Barrows, C. W. (2011). Sensitivity to climate change for two reptiles at the Mojave Sonoran Desert interface. Journal of Arid Environments, 75, 629–635.
Beals, E. W. (1984). Bray-Curtis ordination: an effective strategy for analysis of multivariate ecological data. Advances in Ecological Research, 14, 1–55.
Becerra-López, J. L., Ramírez-Bautista, A., Romero-Méndez, U., Pavón, N. P. y Sánchez-Rojas, G. (2017). Effect of climate change on halophytic grasslands loss and its impact in the viability of Gopherus flavomarginatus. Nature Conservation, 21, 39–55.
Boarman, W. I. (2002). Threats to desert tortoise populations: a critical review of the literature. U.S. Geological survey, Western Ecological Research Center, Sacramento, California, USA. Recuperado el 20 abril, 2018 de: https://www.fws.gov/nevada/desert_tortoise/documents/misc/tortoise_threats_boarman_usgs_2002.pdf
Brown, M. B., Brown, D. R., Klein, P. A., McLaughlin, G. S., Schumacher, I. M., Jacobson, E. R. et al. (2001). Mycoplasma agassizii sp. nov., isolated from the upper respiratory tract of the desert tortoise (Gopherus agassizii) and the gopher tortoise (Gopherus polyphemus). International Journal of Systematic and Evolutionary Microbiology, 51, 413–418.
Brown, M. B., McLaughlin, G. S., Klein, P. A., Crenshaw, B. C., Schumacher, I. M., Brown, D. R. et al. (1999). Upper respiratory tract disease in the Gopher tortoise is caused by Mycoplasma agassizii. Journal of Clinical Microbiology, 37, 2262–2269.
Brown, D. R., Merritt, J. L., Jacobson, E. R., Klein, P. A., Tully, J. G. y Brown, M. B. (2004). Mycoplasma testudineum sp. nov., from a desert tortoise (Gopherus agassizii) with upper respiratory tract disease. International Journal of Systematic and Evolutionary Microbiology, 54, 1527–1529.
Caporaso, J. G., Kuczynski, J., Stombaugh, J., Bittinger, K., Bushman, F. D., Costello, E. K. et al. (2010). QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 7, 335–336.
Carter, G. R. y Cole, J. R. (1990). Classification, normal flora, and laboratory safety. En G. R. Carter y J. R. Cole (Eds.), Diagnostic procedures in veterinary bacteriology and mycology (pp. 1–10). 5th ed. San Diego: Academic Press.
Christopher, M. M., Berry, H. K., Henen, T. B. y Nagy, A. K. (2003). Clinical disease and laboratory abnormalities in free-ranging desert tortoises in California (1990-1995). Journal of Wildlife Diseases, 39, 35–56.
Cleaveland, S., Hess, G. R., Dobson, A. P., Laurenson, M. K., McCallum, H. I., Roberts, M. G. et al. (2002). The role of pathogens in biological conservation. En P. J. Hudson (Ed.), The ecology of wildlife diseases (pp. 139–150). New York: Oxford University Press.
Conanp (Comisión Nacional de Áreas Naturales Protegidas). (2006). Programa de conservación y manejo Reserva de la Biosfera Mapimí México. México D.F.: Conanp-Semarnat.
Conanp (Comisión Nacional de Áreas Naturales Protegidas). (2017). Anexo 2. Protocolo de Monitoreo No. 6: Monitoreo de la tortuga del Bolsón (Gopherus flavomarginatus) en la Reserva de Biosfera Mapimí, en los Estados de Durango, Chihuahua y Coahuila. Recuperado el 15 marzo, 2015 de: http://www.conanp.gob.mx/programas/pdf/Anexo%202%20Protocolo%206%20RB%20Mapimi.pdf
Devriese, L., Baele, M. y Butaye, P. (2006). The genus Enterococcus: taxonomy. En M. Dworkin, S. Falkow, E. Rosenberg, K. H. Schleifer y E. Stackebrandt (Eds.), The Prokaryotes: a handbook on the biology of bacteria (pp. 163–174). New York: Springer.
Dewhirst, F. E., Klein, E. A., Bennett, M. L., Croft, J. M., Harris, S. J. y Marshall-Jones, Z. V. (2015). The feline oral microbiome: a provisional 16S rRNA gene based taxonomy with full-length reference sequences. Veterinary Microbiology, 175, 294–303.
Dickinson, V. M., Duck, T., Schwalbe, C. R., Jarchow, J. L. y Trueblood, M. H. (2001). Nasal and cloacal bacteria in free-ranging desert tortoises from the western United States. Journal of Wildlife Diseases, 37, 252–257.
Di Ianni, F., Dodi, P. L., Cabassi, C. S., Pelizzone, I., Sala, A., Cavirani, S. et al. (2015). Conjunctival flora of clinically normal and diseased turtles and tortoises. BMC Veterinary Research, 11, 91.
Edgar, R. C. (2010). Search and clustering orders of magnitude faster than BLAST. Bioinformatics, 26, 2460–2461.
García, E. (2004). Modificaciones al sistema de clasificación climática de Köppen. Serie Libros Número 6. México D.F.: Instituto de Geografía-Universidad Nacional Autónoma de México.
García-De la Peña, C., Quezada-Rivera, C. A., Martínez-Luna, J., González- Durán, A. y Castro-Franco, R. (2016). Sensibilidad a antibióticos en bacterias aerobias de la tortuga del Bolsón Gopherus flavomarginatus en cautiverio en Durango, México. Aridociencia, 1, 13–18.
Gregersen, R. H., Neubauer, C., Christensen, H., Miki-Bojesen, A., Hess, M. y Bisgaard, M. (2009). Comparative studies on [Pasteurella] testudinis and [P.] testudinis-like bacteria and proposal of Chelonobacter oris gen. nov., sp. nov. as a new member of the family Pasteurellaceae. International Journal of Systematic and Evolutionary Microbiology, 59, 1583–1588.
Guthrie, A. L., White, C. L., Brown, M. B. y deMaar, T. W. (2013). Detection of Mycoplasma agassizii in the Texas tortoise (Gopherus berlandieri). Journal of Wildlife Diseases, 49, 704–708.
Hacioglu, N., Dulger, B., Caprazli, T. y Tosunoglu, M. (2012). A study on microflora in oral and cloacal of freshwater turtles (Emys orbicularis Linnaeus, 1758 and Mauremys rivulata Valenciennes, 1833) from Kavak delta (Canakkale). Fresenius Environmental Bulletin, 21, 3365–3369.
Hammer, Ř., Harper, D. A. T. y Ryan, P. D. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 4, Recuperado el 05 mayo, 2015 de: http://palaeo-electronica.org/2001_1/past/issue1_01.html
Heynol, V., Heckers, K. O., Behncke, H., Heusinger, A. y Marschang, R. D. (2015). Detection of bacteria in oral swabs from healthy common musk turtles (Sternotherus odoratus) and West African mud turtles (Pelusios castaneus). Journal of Herpetological Medicine and Surgery, 25, 33–39.
Homer, B. L., Berry, K. H., Brown, M. B., Ellis, G. y Jacobson, E. R. (1998). Pathology of diseases in wild desert tortoises from California. Journal of Wildlife Diseases, 34, 508–523.
Hyde, E. R., Navas-Molina, J. A., Song, S. J., Kueneman, J. G., Ackermann, G., Cardona, C. et al. (2016). The oral and skin microbiomes of captive Komodo dragons are significantly shared with their habitat. mSystems, 1, e00046-16.
Illumina. (2017a). 16S Metagenomic sequencing library preparation, Preparing 16S ribosomal RNA gene amplicons for the Illumina MiSeq system. Recuperado el 10 agosto, 2017 de: https://support.illumina.com/content/dam/illumina- support/documents/documentation/chemistry_documentation/16s/16s-metagenomic-library-prep-guide- 15044223-b.pdf
Illumina. (2017b). Nextera XT DNA library prep kit reference guide. Recuperado el 10 agosto, 2017 de: https://support.illumina.com/content/dam/illumina- support/documents/documentation/chemistry_documentation/samplepreps_nextera/nextera-xt/nextera-xt- library-prep-reference-guide-15031942-02.pdf
Innis, C. J., Braverman, H., Cavin, J. M., Ceresia, M. L., Baden, L. R., Kuhn, D. M. et al. (2014). Diagnosis and management of Enterococcus spp. infections during rehabilitation of cold-stunned Kemp’s ridley turtles (Lepidochelys kempii): 50 cases (2006-2012). Journal of the American Veterinary Medical Association, 245, 315–23.
Jacobson, E. R. (1994). Causes of mortality and disease in tortoises: a review. Journal Zoo Wildlife Medicine, 25, 2–17.
Jacobson, E. R. (2014). Health issues of North American tortoises. En D. C. Rostal, E. D. McCoy y H. R. Mushinsky (Eds.), Biology and conservation of North American tortoises (pp. 60–76). Baltimore: Johns Hopkins University Press.
Jacobson, E. R. y Berry, K. H. (2012). Mycoplasma testudineum in free-ranging desert tortoises, Gopherus agassizii. Journal of Wildlife Diseases, 48, 1063–1068.
Jacobson, E. R., Berry, K. H.,Wellehan, Jr., J. F. X., Origgi, F., Childress, A. L., Braun, J. et al. (2012). Serologic and molecular evidence for Testudinid herpesvirus 2 infection in wild Agassiz’s desert tortoises, Gopherus agassizii. Journal of Wildlife Diseases, 48, 747–757.
Jacobson, E. R., Brown, M. B., Schumacher, I. M., Collins, B. R., Harris, R. K. y Klein, P. A. (1995). Mycoplasmosis and the desert tortoise (Gopherus polyphemus) in Las Vegas Valley, Nevada. Chelonian Conservation and Biology, 1, 280–284.
Jacobson, E. R., Brown, M. B., Wendland, L. D., Brown, D. R., Klein, P. A., Christopher, M. M. et al. (2014). Mycoplasmosis and upper respiratory tract disease of tortoises: a review and update. The Veterinary Journal, 201, 257–264.
Kiester, A. R., Palomo-Ramos, R., Ríos-Arana, J. y Goode, E.V. (2018). Gopherus flavomarginatus. The IUCN Red List of threatened species 2018: Recuperado el 10 enero, 2019 de: http://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T9402A112660985.en
Kilian, M., Chapple, I. L. C., Hannig, M., Marsh, P. D., Meuric, V., Pedersen, A. M. L. et al. (2016). The oral microbiome – an update for oral healthcare professionals. British Dental Journal, 221, 657–666.
Klindworth, A., Pruesse, E., Schweer, T., Peplies, J., Quast, C., Horn, M. et al. (2013). Evaluation of general 16S ribosomal RNA gene PCR primers for classical and next-generation sequencing-based diversity studies. Nucleic Acids Research, 41, e1.
Kudirkiene, E., Hansen, M. J. y Bojesen, A. M. (2014). Draft genome sequence of Chelonobacter oris Strain 1662T, associated with respiratory disease in Hermann’s tortoises. Genome Announcements, 2, e01322-14.
Lederle, P. E., Rautenstrauch, K. R., Rakestraw, D. L., Zander, K. K. y Boone, J. L. (1997). Upper respiratory tract disease and mycoplasmosis in desert tortoises from Nevada. Journal of Wildlife Diseases, 33, 759–765.
Li, Y. H. y Tian, X. (2012). Quorum sensing and bacterial social interactions in biofilms. Sensors (Basel), 12, 2519–2538.
Loarie, S. R., Duffy, P. B., Hamilton, H., Asner, G. P., Field, C. B. y Ackerly, D. D. (2009). The velocity of climate change. Nature, 462, 1052–1055.
Lovich, J. E., Yackulic, C. B., Freilich, J., Agha, M., Austin, M., Meyer, K. P. et al. (2014). Climatic variation and tortoise survival: Has a desert species met its match? Biological Conservation, 169, 214–224.
Marsh, P. D. y Martin, M. V. (2009). Oral microbiology. Londres: Elsevier.
Martínez-Silvestre, A., Mateu de Antonio, E., Ramis, A. y Majó, N. (1999). Etiología y descripción clínica de la rinitis crónica en tortuga mora (Testudo graeca). Revista Española de Herpetología, 13, 27–36.
Martínez-Silvestre, A. y Soler-Massana, J. (2008). Enfermedades infecciosas y parasitarias en tortugas. Consulta de Difusión Veterinaria, 150, 43–54.
Maslo, B., Gignoux-Wolfsohn, S. A. y Fefferman, N. H. (2017). Success of wildlife disease treatment depends on host immune response. Frontiers in Ecology and Evolution, 5, doi: 10.3389/fevo.2017.00028.
McArthur, S. (2004). Infectious agents. En S. McArthur, R. Wilkinson y J. Meyer (Eds.), Medicine and surgery of tortoises and turtles (pp. 31–34). Oxford: Blackwell Publishing Ltd.
McArthur, S., Meyer, J. y Innis, C. (2004). Anatomy and physiology. En S. McArthur, R. Wilkinson y J. Meyer (Eds.), Medicine and surgery of tortoises and turtles (pp. 35–72). Oxford: Blackwell Publishing Ltd.
McCoy, E. D., Mushinsky, H. R. y Lindzey, J. (2007). Conservation strategies and emergent diseases: the case of upper respiratory tract disease in the Gopher tortoise. Chelonian Conservation and Biology, 6, 170–176.
McDonald, D., Price, M. N., Goodrich, J., Nawrocki, E. P., DeSantis, T. Z., Probst, A. et al. (2012). An improved greengenes taxonomy with explicit ranks for ecological and evolutionary analyses of bacteria and archaea. The ISME Journal, 6, 610–618.
McLaughlin, G. S., Jacobson, E. R., Brown, D. R., McKenna, C. E., Schumacker, I. M., Adams, H. P. et al. (2000). Pathology of upper respiratory tract disease of gopher tortoises in Florida. Journal of Wildlife Diseases, 36, 272–283.
Medica, P. A., Nussear, K. E., Esque, T. C. y Saethre, M. B. (2012). Long-term growth of desert tortoises (Gopherus agassizii) in a Southern Nevada population. Journal of Herpetology, 46, 213–220.
Munoz-Price, L. S. y Weinstein, R. A. (2008). Acinetobacter infection. The New England Journal of Medicine, 358, 1271–81.
Muro, J., Ramis, A., Velarde, R., Pastor, J. y Lavín, S. (1998). Rinitis crónica en tortugas terrestres mediterráneas. Clínica Veterinaria de Pequeños Animales (Avepa), 18, 70–84.
Navas-Molina, J. A., Peralta-Sánchez, J. M., González, A., McMurdie, P. J., Vázquez-Baeza, Y., Xu, Z. et al. (2013). Advancing our understanding of the human microbiome using QIIME. Methods in Enzymology, 531, 371–444.
Ordorica A. M., Harvey, P., Cate, S. y Deutch, C. (2008). Seasonal variations in microbial communities in the nasal passages of captive desert tortoises. Journal of the Arizona-Nevada Academy of Science, 40, 121–127.
Paré, J., Sigler, L., Rosenthal, K. y Mader, D. (2006). Microbiology: fungal and bacterial diseases of reptiles. En D. Mader (Eds.), Reptile medicine and surgery, 2nd Ed. (pp. 229–235). St. Louis: Saunders.
Pérez-Heydrich, C., Oli, M. K. y Brown, M. B. (2011). Population-level influence of a recurring disease on a long-lived wildlife host. Oikos, 121, 377–388.
Peterson, C. C. (1994). Different rates and causes of high mortality in two populations of the threatened desert tortoise Gopherus agassizii. Biological Conservation, 70, 101–108.
Rizzetto, L., De Filippo, C., Rivero, D., Riccadonna, S., Beltrame, L. y Cavalieri, D. (2013). Systems biology of host–mycobiota interactions: dissecting Dectin-1 and Dectin-2 signalling in immune cells with DC-ATLAS. Immunobiology, 218, 1428–1437.
Rzedowski, J. (2006). Vegetación de México. Edición digital, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Disponible en: https://www.biodiversidad.gob.mx/publicaciones/librosDig/pdf/VegetacionMx_Cont.pdf
Santoro, M., Hernández, G., Caballero, M. y García, F. (2006). Aerobic bacterial flora of nesting green turtles (Chelonia mydas) from Tortuguero National Park, Costa Rica. Journal of Zoo and Wildlife Medicine, 37, 549–552.
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Federación. 30 diciembre 2010, Segunda Sección. México D.F.
Shukla, S. K., Paustian, D. L., Stockwell, P. J., Morey, R. E., Jordan, J. G., Levett, P. N. et al. (2004). Isolation of a fastidious Bergeyella species associated with cellulitis after a cat bite and a phylogenetic comparison with Bergeyella zoohelcum strains. Journal of Clinical Microbiology, 42, 290–293.
Smallbone, W., van-Oosterhout, C. y Cable, J. (2016). The effects of inbreeding on disease susceptibility: Gyrodactylus turnbulli infection of guppies, Poecilia reticulate. Experimental Parasitology, 167, 32–37.
Snipes, K. P. y Biberstein, E. L. (1982). Pasteurella testudinis sp. nov.: a parasite of desert tortoises (Gopherus agassizi). International Journal of Systematic Bacteriology, 32, 201–210.
Snipes, K. P., Biberstein, E. L. y Fowler, M. E. (1980). A Pasteurella sp. associated with respiratory disease in captive desert tortoises. Journal of the American Veterinary Medical Association, 177, 804–807.
Straub, J. (2002). Zur aeroben Bakterienflora von Kornea, Rachen und Kloake vor und nach der Winterruhe von Landschild- kröten der Arten Testudo (T.) hermanni, T. graeca, T. marginata und T. horsfieldii (Tesis). Universität Leipzig, Germany.
Ureña-Aranda, C. A. y Espinosa-de los Monteros, A. (2012). The genetic crisis of the Mexican Bolson tortoise (Gopherus flavomarginatus: Testudinidae). Amphibia-Reptilia, 33, 45–53.
USFWS (U.S. Fish and Wildlife Service). (2016). Health assessment procedures for the Mojave Desert tortoise (Gopherus agassizii): a handbook pertinent to translocation. Reno, Nevada: Desert Tortoise Recovery Office, U.S. Fish and Wildlife Service, USA.
Weiss, S., Xu, Z. Z., Peddada, S., Amir, A., Bittinger, K., González, A. et al. (2017). Normalization and microbial differential abundance strategies depend upon data characteristics. Microbiome, 5, 27.
Weitzman, C. L. (2017). Upper respiratory microbes in North American tortoises (Genus Gopherus) (Tesis doctoral). University of Nevada. Reno, Nevada, USA.
Weitzman, C. L., Gov, R., Sandmeier, F. C., Snyder, S. J. y Tracy, C. R. (2017). Co-infection does not predict disease signs in Gopherus tortoises. Royal Society Open Science, 4, 171003.
Wendland, L., Balbach, H., Brown, M., Berish, J. D., Littell, R. y Clark, M. (2009). Handbook on Gopher Tortoise (Gopherus polyphemus) health evaluation procedures for use by land managers and researchers. Champaign, Illinois: U.S. Army Engineer Research and Development Center.
Westhouse, R. A., Jacobson, E. R., Harris, R. K., Winter, K. R. y Homer, B. L. (1996). Respiratory and pharyngo-esophageal iridovirus infection in a gopher tortoise (Gopherus polyphemus). Journal of Wildlife Diseases, 32, 682–686.
Yoon, S. H., Ha, S. M., Kwon, S., Lim, J., Kim, Y., Seo, H. et al. (2017). Introducing EzBioCloud: a taxonomically united database of 16S rRNA gene sequences and whole-genome assemblies. International Journal of Systematic and Evolutionary Microbiology, 67, 1613–1617.
Zhang J., Kobert, K., Flouri, T. y Stamatakis, A. (2014). PEAR: a fast and accurate Illumina Paired-End read merger. Bioinformatics, 30, 614–620.



