Serguei Santamaria-Ruiz a, Angela P. Cuervo-Robayo a, Erick A. García-Trejo b y Lázaro Guevara a, *
a Universidad Nacional Autónoma de México, Instituto de Biología, Tercer Circuito s/n, Ciudad Universitaria, 04510 Ciudad de México, México
b Universidad Nacional Autónoma de México, Facultad de Ciencias, Av. Universidad 3000, Circuito Exterior s/n, Ciudad Universitaria, 04510 Ciudad de México, México
*Autor para correspondencia: llg@ib.unam.mx (L. Guevara)
Recibido: 23 noviembre 2022; aceptado: 9 mayo 2023
Resumen
El murciélago mastín azteca (Molossus aztecus) es una especie que habita desde México hasta Brasil. A pesar de su amplia distribución, sorprende la aparente escasez de registros en Norteamérica. Aquí revisamos la información disponible en bases de datos públicas para conocer la distribución espacio-temporal de sus registros y estimamos su distribución potencial actual para facilitar esfuerzos de colecta futuros. Después de la selección de datos con criterios que disminuyen la incertidumbre en la identidad y la localización geográfica, obtuvimos 411 registros de este murciélago, los cuales se concentran en México (207), Nicaragua (77) y Guatemala (74). La mayor cantidad de registros proviene de meses lluviosos como julio (85) y agosto (84), y de los años 1966 (74) y 1969 (70). En las últimas 2 décadas, los registros en bases de datos son nulos, lo que podría deberse al rezago en la digitalización de ejemplares ya colectados. La distribución potencial indica condiciones altamente idóneas para M. aztecus en la vertiente del Pacífico, en donde aún hay zonas poco exploradas por mastozoólogos. Para mejorar el conocimiento de su distribución, es necesario incluir otros métodos de muestreo y fomentar la digitalización de colecciones científicas.
Palabras clave: Bases de datos; Inventarios biológicos; Mamíferos; Modelos de nicho ecológico
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Historical knowledge and potential geographic distribution of the Aztec mastiff bat (Molossidae: Molossus aztecus) in North America
Abstract
The Aztec mastiff bat (Molossus aztecus) is a species that inhabits from Mexico to Brazil. Despite its wide distribution, the apparent scarcity of records in North America is surprising. Here we review the information available in public databases to know their records’ spatiotemporal distribution and estimate their current potential distribution to facilitate future collecting efforts. After selecting data with criteria that reduce uncertainty in identity and geographic location, we obtained 411 records of this bat, which are concentrated in Mexico (207), Nicaragua (77), and Guatemala (74). The most significant number of records comes from rainy months such as July (85) and August (84) and from the years 1966 (74) and 1969 (70). In the last 2 decades, the records in databases are null, which could be due to the lag in the digitization of specimens already collected. The potential distribution indicates highly suitable conditions for M. aztecus on the Pacific slope, where there are still areas little explored by mammalogists. It is necessary to include other sampling methods and encourage the digitization of scientific collections to improve knowledge of its distribution.
Keywords: Databases; Biological inventories; Mammals; Ecological niche models
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Los murciélagos (Mammalia, Chiroptera) son el segundo orden de mamíferos con más diversidad, con cerca de 1,400 especies a nivel mundial (Burgin et al., 2018). Juegan un papel esencial en los ecosistemas que habitan, ya que pueden contribuir en procesos de polinización, dispersión de semillas, además de ser controladores de poblaciones de insectos que podrían convertirse en plagas en hábitats naturales y cosechas. Dentro de los murciélagos controladores de plagas se encuentran los murciélagos insectívoros aéreos, que pertenecen a las familias Molossidae, Vespertilionidae, Natalidae, Mormoopidae y Emballonuridae (Williams-Guillén et al., 2008). La importancia económica de estos murciélagos puede reflejarse en millones de dólares ahorrados en productos y recursos humanos para combatir plagas (Boyles y Willis, 2010). Por ejemplo, se estima que algunos individuos de la especie Eptesicus fuscus pueden consumir hasta 8 g. de insectos cada noche (Anthony y Kunz, 1977; Kurta et al., 1989), lo que implica que un millón de murciélagos podría consumir más de 1,000 toneladas de insectos cada año (Boyles y Willis, 2010). En el caso del murciélago Tadarida brasiliensis, es posible ahorrar 26.7 mil millones de dólares anuales para la industria algodonera (Boyles et al., 2011; Cleveland et al., 2006). Este tipo de evidencias son cada vez más valiosas para generar estrategias de conservación para los murciélagos y las funciones que cumplen en los ecosistemas.
A pesar de la contribución directa o indirecta que aportan los murciélagos insectívoros al bienestar humano, el conocimiento acerca de la distribución y abundancia de muchas especies es escaso, sesgado o incluso inexistente, sobre todo en regiones tropicales en donde aún existen notables vacíos de información básica sobre la biodiversidad (Hughes et al., 2021). Esto dificulta el diseño de estrategias sólidas para la conservación de biodiversidad, obstaculizando también la comprensión de los patrones y procesos biológicos y ecológicos que originan y mantienen a la biodiversidad (Hortal et al., 2015). Ante ésto, es fundamental conocer y analizar la información actual de las especies, con la intención de detectar los vacíos de información y delinear estrategias de investigación futura, tal como la planeación de inventarios biológicos que incluyan esfuerzos de muestreo dirigido a especies aun poco conocidas.
En el caso de los murciélagos insectívoros aéreos, un factor que podría hacernos sospechar sobre la falta de conocimiento sobre su distribución es su forma de forrajeo, ya que se alimentan, principalmente, en espacios semiabiertos en el bosque, sobre el dosel de la vegetación y cerca de los riscos (Kalko y Schnitzler, 2001); por lo tanto, ésto puede representar una dificultad para ser registrados mediante métodos tradicionales de colecta de murciélagos, tal como las redes de niebla, las trampas de arpa o la colecta manual en sus áreas de refugio (Hourigan et al., 2008; MacSwiney et al., 2008). Además, los murciélagos insectívoros suelen tener una ecolocación precisa, lo que les facilita la detección de las redes de niebla en comparación con otras especies de murciélagos (Meyer et al., 2011). Los métodos indirectos como las fototrampas y equipos de registro acústico han enriquecido el conocimiento de aquellas especies más elusivas (Chaves-Ramírez et al., 2021; Tremlett et al., 2020).
El murciélago mastín azteca (Molossidae, Molossus aztecus), una especie relativamente pequeña dentro de su género, habita en México, Guatemala, Honduras, Nicaragua, Costa Rica, Venezuela y Brasil (Simmons, 2005). Está fuertemente asociada con hábitats húmedos, incluyendo los bosques semideciduos, pino, pino-encino y bosques mesófilos de montaña (Handley, 1978). Se distribuye en altitudes que van desde tierras bajas hasta los 1,800 m snm (Mora, 2016). A la fecha, esta especie se encuentra en preocupación menor de acuerdo con la lista roja de la IUCN, aunque al sur de México, las poblaciones se han reducido en 45% (Solari, 2019). En general, la información sobre la biología, ecología e historia natural de esta especie aún es escasa.
Una herramienta que puede contribuir a incrementar el conocimiento ecológico y geográfico de las especies son los modelos de nicho ecológico (MNE). Los MNE utilizan los registros de presencia y variables ambientales para encontrar una asociación entre ambos y obtener una aproximación a los requerimientos del nicho Grinneliano de la especie (Soberón y Nakamura, 2009). A partir de las delimitaciones de los factores ambientales que limitan al nicho de la especie, es posible proyectar estas características en un mapa para estimar las áreas en donde éstas condiciones existen y, por lo tanto, favorecen la presencia de la especie, lo cual se traduce en su distribución geográfica potencial (Peterson y Soberón, 2012). Esta aproximación ha demostrado ser útil para guiar esfuerzos de muestreo en especies con distribuciones restringidas, o con baja detectabilidad (Raxworthy et al., 2003).
En el presente estudio se realizó una recopilación de la información geográfica disponible sobre Molossus aztecus en Norteamérica, con la finalidad de conocer el estado actual de su distribución y detectar posibles vacíos de información. Además, con base en la información disponible y el uso de modelos del nicho ecológico, se proponen las regiones prioritarias para dirigir esfuerzos de colecta futuros que permitan incrementar el conocimiento de esta especie.
Materiales y métodos
En este estudio, nos referimos como Norteamérica al área que se extiende desde Canadá hasta Panamá. Los datos de presencia de Molossus aztecus se obtuvieron de 3 bases de datos: VertNet (Constable et al., 2010), GBIF (https://doi.org/10.15468/dl.basdms) y el Sistema Nacional de Información sobre la Biodiversidad (SNIB-Conabio, 2022). En el caso de VerNet y GBIF, los datos se descargaron usando el nombre científico de la especie “Molossus aztecus”. Los registros provenientes del SNIB-Conabio fueron descargados junto con todas las especies del género Molossus para, posteriormente, eliminar los registros diferentes a Molossus aztecus. Las descargas se realizaron en diciembre de 2020. También se realizó una revisión de literatura referente al género Molossus, en busca de registros que pudieran pertenecer a M. aztezus (hasta marzo de 2023). Finalmente, se realizó una revisión de los datos descargados provenientes de las 3 fuentes de información para evitar identificaciones erróneas, registros repetidos y obtener los datos de localidad y fecha de colecta lo más precisa posible.
Con la finalidad de corroborar la identificación taxonómica de algunos registros de Molossus aztecus que podrían confundirse con Molossus molossus, una especie morfológicamente similar, se revisaron ejemplares en la Colección Nacional de Mamíferos de la Universidad Nacional Autónoma de México (CNMA 1939, 5658, 6403, 12203, 15202,17468-17469, 19320, 28869-28870, 30129-30130) y se siguieron claves taxonómicas especializadas (Álvarez-Castañeda et al., 2015; Gregorin et al., 2011).
Para comprender cómo se ha acumulado el conocimiento sobre la distribución de Molossus aztecus en Norteamérica y detectar posibles vacíos de información a través del espacio y el tiempo, se obtuvieron los años y meses de colecta, el número de registros por país y el número de registros por colección científica. Se utilizó el Continuo de Elevaciones Mexicano 3.0 (INEGI, 2013) para obtener un estimado de la elevación a la que fue colectado cada ejemplar. Los datos por elevación se dividieron en registros de tierras bajas (0-500 m), tierras medias (501-1,000 m) y tierras altas (> 1,500 m). Los análisis espaciales se realizaron en el programa QGIS 3.26.3 (QGIS.org) y los gráficos para visualizar la información, en el programa Statistica 7.1 (StatSoft, Inc. 2005).
Para estimar la distribución potencial actual de Molossus aztecus, se generaron modelos de nicho ecológico con el algoritmo de MaxEnt 3.3.4 (Phillips et al., 2006). Los datos climáticos fueron obtenidos de WorldClim 2.1 (Fick y Hijmans, 2017), descargando 19 variables bioclimáticas con una resolución de 2.5 minutos. Estos datos representan valores promedio, estacionales y extremos de temperatura y precipitación.
Para generar diferentes modelos candidatos, las variables climáticas se dividieron en 3 conjuntos. El primer conjunto de variables climáticas (set_01) incluyó aquellas que mostraron relativamente menor correlación de Pearson con otras variables (< 0.80); el segundo conjunto (set_02), aquellas que mostraron relativamente menor correlación de Spearman con otras variables (< 0.80), y finalmente, el tercer conjunto (set_03), aquellas con el menor factor de inflación de varianza.
Los modelos para cada uno de los 3 conjuntos de datos fueron realizados en el paquete de R KUENM (Cobos et al., 2019; R Core Team, 2022). Los parámetros fueron 70% de datos para entrenar los modelos y el restante 30% para la validación. Se evaluaron los multiplicadores de regularización 0.5, 1, 2 y 3, además de las “feature class”: lineal (l), cuadratic (q), product (p), hinge (h), linear-cuadratic (lq), linear-product (lp), cuadratic-product (qp) y linear-cuadratic-product (lqp), linear-cuadratic-product-hinge (lqph). La evaluación se realizó con un umbral de omisión menor a 5%, 500 iteraciones y 50% de los datos para realizar el método de remuestreo por bootstrap. Se tomó como referencia el área bajo la curva (AUC por sus siglas en inglés) y el menor valor de AICc (Akaike Information Criterion) para seleccionar los modelos óptimos.
El mapa de predicción continua fue convertido en uno binario de condiciones idóneas (1) y no idóneas (0) usando el umbral de “equal training”, ya que con este umbral la distribución potencial se ajustó de mejor manera a la distribución reportada por Simmons (2005). Adicionalmente, para distinguir de una mejor manera las zonas climáticamente más idóneas, se realizó un mapa con categorías de idoneidad a partir del umbral de corte y hasta el valor más alto: baja (0.252-0.5), media (0.5-0.75), alta (0.75-0.90) y muy alta (0.90-1.0). Finalmente, se obtuvieron los municipios con muy alta idoneidad para identificar los lugares con mayor probabilidad de albergar registros aún no conocidos de la especie y, de este modo, facilitar la planeación de esfuerzos de muestreo futuros.
Resultados
Se recopilaron inicialmente 697 registros históricos de Molossus aztecus, pero después de realizar una limpieza de datos, se obtuvo una base final de 411 registros. El Museo de Historia Natural de la Universidad de Kansas es el que tiene más registros (148) y en México, la Colección Nacional de Mamíferos del Instituto de Biología de la Universidad Nacional Autónoma de México (IBUNAM), es la que cuenta con más registros (12).
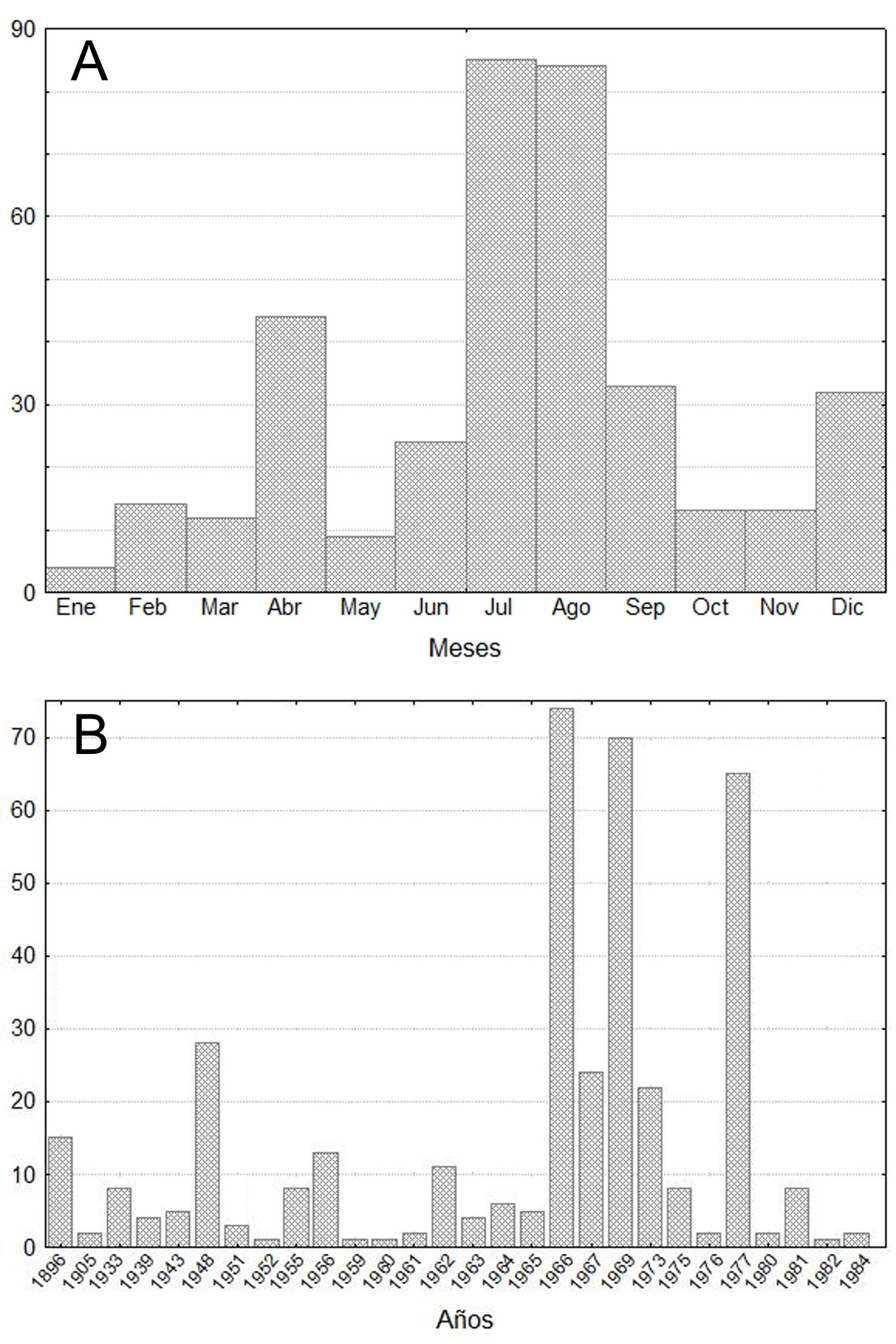
Con respecto al registro de especímenes a lo largo de los meses (fig. 1A), el mes con más ejemplares fue julio (85), seguido por agosto (84) y abril (44). El mes con menor número de registros fue enero (4). El intervalo de los años en los que han sido colectados los ejemplares de M. aztecus comprende 100, desde 1896 a 1995 (fig. 1B), por lo que hace más de 25 años no existe un registro en una colección biológica o por lo menos éstos no han sido digitalizados. El año con mayor número de ejemplares fue 1966 (74), seguido por 1969 (70). Existen 6 años con únicamente 1 ejemplar de M. aztecus (1946, 1952, 1959, 1960, 1982 y 1955); sin embargo, existen varios años en los cuales no se registró la presencia de M. aztecus, por ejemplo, de 1905 a 1933.
En Norteamérica, el país con más registros es México (207), seguido de Nicaragua (77) y Guatemala (68); mientras que los países con menos registros son Honduras (8) y Costa Rica (6). Con respecto a la elevación, se obtuvo un mayor número de registros de M. aztecus en tierras bajas (397), seguido de tierras medias (126) y con un número menor en tierras altas (21).
Modelado de nicho ecológico y distribución potencial. El primer conjunto de variables contiene a las variables bioclimáticas 1, 2, 3, 12, 14, 18 y 19. El segundo conjunto contiene a las variables 1, 2, 3, 4, 5, 12, 13, 14, 18 y 19. Por último, el tercer conjunto contiene a las variables 2, 3, 8, 13, 15, 18 y 19. De los 336 modelos generados, el modelo óptimo fue realizado con el “regularization multiplier” de 0.75, las “feature classes” lineal, cuadrática y de producto, usando el tercer conjunto de variables ambientales. Para éste, se obtuvo un AUC de 0.887 y las variables que más contribuyeron fueron la isotermalidad (bio 3; 50.6%), la precipitación estacional (bio 15; 15.1%) y el intervalo medio diurno de temperatura (bio 2; 14.6%).
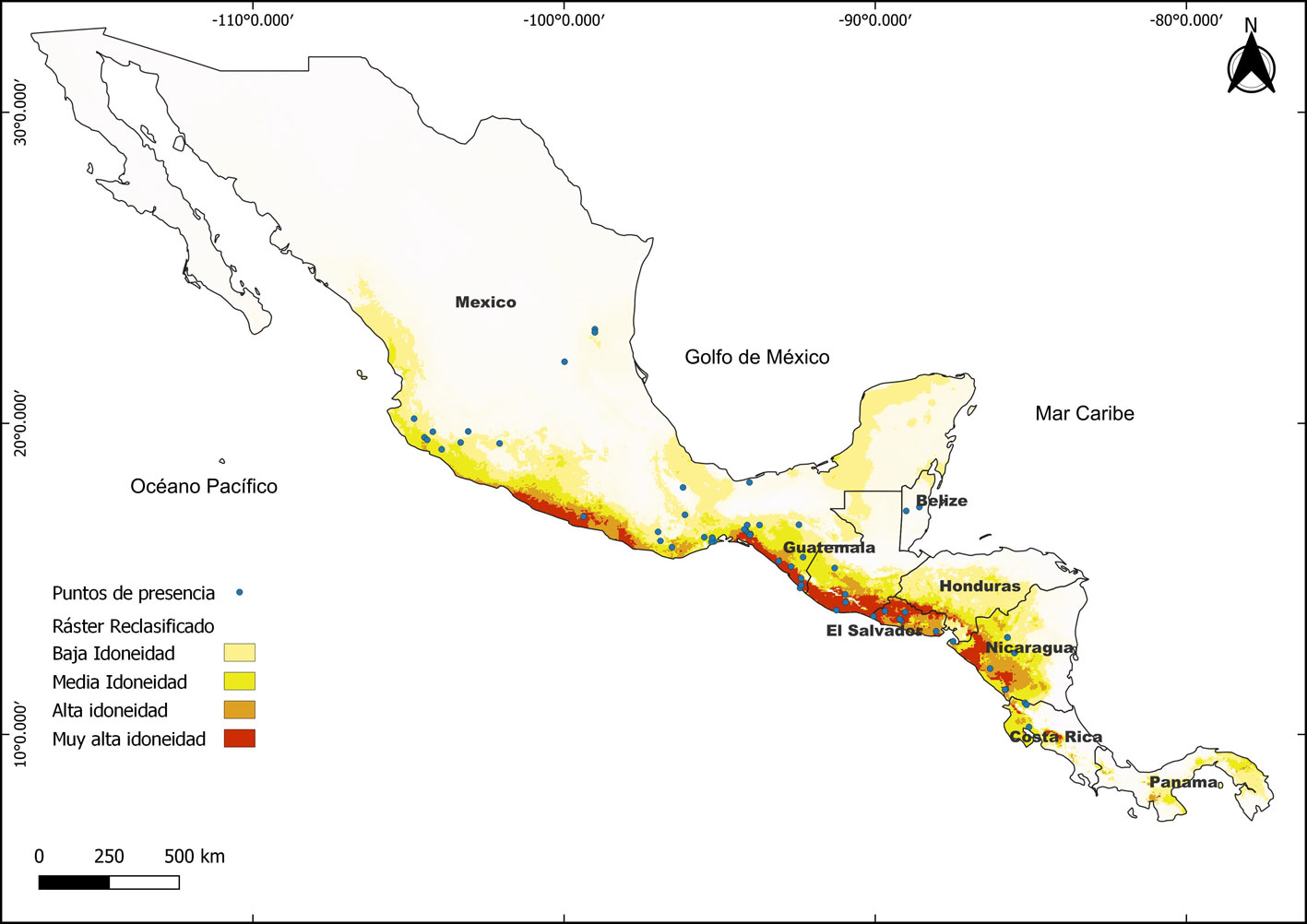
La distribución potencial estimada a partir de los parámetros anteriores muestra condiciones climáticas favorables para la especie desde México hasta Panamá (fig. 2). En México, la distribución en el centro y sur del país colinda con el océano Pacífico, extendiéndose por los estados de Sinaloa, Nayarit, Colima, Jalisco, Michoacán, Guerrero y abarcando parte del territorio de Oaxaca y Chiapas. Por la vertiente del golfo de México, la idoneidad climática se extiende hasta la península de Yucatán. Más al sur, la idoneidad se extiende a los países de Centroamérica, desde Guatemala hasta Panamá, en donde se presenta una alta idoneidad climática en la región de tierras medias y bajas cercanas al océano Pacífico, principalmente en Guatemala y El Salvador (fig. 2).
El municipio con mayor idoneidad es La Democracia, en el departamento de Escuintla, Guatemala, seguido por el municipio de San Francisco Méndez en el departamento de Ahuachapán, El Salvador y La Gomera en el departamento de Escuintla, Guatemala. El país que cuenta con mayor número de municipios por encima del 0.90 de idoneidad es México (7), seguido por El Salvador (4) y Guatemala (3) (tabla 1).
Al observar las categorías a partir del umbral de corte, la idoneidad climática más alta se ubica en la parte cercana al océano Pacífico, con relación a su tamaño, El Salvador es el país con mayor cantidad de zonas de idoneidad. La idoneidad decrece hasta media y baja conforme se aleja de la vertiente del Pacífico, tal como en Honduras y los estados de México, cercanos a la Planicie costera del golfo de México (fig. 2).
Discusión
La revisión en bases de datos públicas mostró que, a pesar de su amplia distribución, M. aztecus es una especie con aún escaso conocimiento sobre su distribución geográfica en Norteamérica. El número relativamente pequeño y espaciado de los registros a lo largo de su distribución y en el tiempo puede deberse a distintas razones. Una de ellas puede estar relacionada al esfuerzo de muestreo y a las técnicas comúnmente empleadas para registrar murciélagos. El uso de redes de niebla o redes a baja altura, podrían ser poco eficaces para la colecta de murciélagos aéreos insectívoros (Flaquer et al., 2007).
Los murciélagos insectívoros tienen habilidad de vuelo y ecolocalización altamente especializada, incluso utilizando el efecto Doppler para capturar a sus presas, como mosquitos o lepidópteros. Para el caso de M. aztecus, éste puede volar a más de 10 m de altura, realizando círculos de más de 30 o 60 m de diámetro (Dalquest y Werner, 1951), lo que haría que esta especie fuera difícil de capturar con los métodos tradicionales. Hasta el momento, no se conocen grabaciones provenientes del uso de detectores ultrasónicos que permitan corroborar registros nuevos de M. aztecus en Norteamérica (Zamora-Gutiérrez et al., 2020). No podemos descartar que el uso cada vez más frecuente de estos dispositivos, así como fototrampas aéreas y cámaras térmicas, permitan la obtención de registros de la especie en el futuro cercano (Krivek et al., 2022; Zamora-Gutiérrez et al., 2021).
Por otro lado, la dificultad en la identificación taxonómica también podría explicar la escasez de registros de M. aztecus. La taxonomía de varias especies del género aún está incompleta, debido a la falta de especialistas y al vacío de información sobre la distribución en diversas regiones del continente (Eger, 2007; Simmons y Voss, 1998). Molossus aztecus no es la excepción, ya que probablemente la escasez de registros en bases de datos se deba a que algunos ejemplares se encuentren identificados en colecciones científicas bajo otro nombre o permanezcan sin identificar. Como ejemplo, Álvarez-Castañeda y Álvarez (1991) habían descrito a la subespecie M. aztecus lambdi, que ahora está incluida dentro de la especie M. coibensis, una especie morfológicamente muy similar a M. aztecus. El muestreo más amplio de taxones y la obtención de datos genéticos de los murciélagos del género Molossus será clave para poder resolver la incertidumbre que aún existe sobre la taxonomía de algunas de sus especies (Loureiro et al., 2018).
Tabla 1
Municipios que poseen sitios con mayor idoneidad climática (> 0.9) para el murciélago mastín azteca (Molossus aztecus).
| Valor de idoneidad | País | Estado/ Departamento | Municipio |
| 0.999 | Guatemala | Escuintla | La Democracia |
| 0.998 | El Salvador | Ahuachapán | San Francisco Méndez |
| 0.994 | Guatemala | Escuintla | La Gomera |
| 0.991 | México | Chiapas | Huehuetán |
| 0.986 | México | Chiapas | Pijijiapan |
| 0.971 | México | Chiapas | Tapachula |
| 0.970 | El Salvador | San Salvador | San Salvador |
| 0.956 | México | Chiapas | Acacoyagua |
| 0.952 | El Salvador | San Salvador | San Marcos |
| 0.944 | México | Guerrero | Tecoanapa |
| 0.943 | Guatemala | Chimaltenango | Yepocapa |
| 0.942 | México | Chiapas | Tapachula |
| 0.938 | Nicaragua | Rivas | San Jorge |
| 0.909 | Nicaragua | Rivas | Municipio de Rivas |
| 0.909 | México | Chiapas | Cintalapa |
| 0.908 | El Salvador | Chiapas | Cintalapa |
En cuanto a la temporalidad, es destacable que los registros son principalmente antiguos (fig. 1B). Algunos registros relativamente recientes se encuentran publicados en tesis y artículos científicos, pero aún no se encuentran almacenados o disponibles en las bases de datos públicas examinadas aquí. Tal es el caso de registros adicionales en Tabasco (Rodríguez, 1992), Oaxaca (Briones-Salas et al., 2001), Jalisco (Guerrero y Cervantes, 2003) y San Luis Potosí (García-Morales y Gordillo-Chávez, 2011). Esto demuestra la importancia de continuar y redoblar esfuerzos para digitalizar la información resguardada en colecciones mastozoológicas. Lamentablemente, la digitalización de datos se ve afectada por falta de financiamiento y recursos humanos (Wieczorek et al., 2012).
Por otro lado, la mayor cantidad de registros de la época lluviosa de esa parte de Norteamérica (julio-agosto) llama la atención (fig. 1A), ya que puede deberse a la cantidad de recursos alimenticios disponibles para este gremio de murciélagos, los cuales se alimentan de insectos y a su vez, los insectos tienen mayor disponibilidad de alimento debido a la proliferación de especies vegetales por la época lluviosa (Kunz y Parsons, 2009). No obstante, también se considera posible que este aumento esté asociado con un mayor esfuerzo de muestreo durante estos meses o con la fase reproductiva activa de los murciélagos, como ocurre en otros molósidos (Soares et al., 2020).
Por otra parte, la distribución de M. aztecus desde las zonas costeras hasta el interior del continente coincide con lo mencionado por Taylor y Tuttle (2019), quienes mencionan que su distribución altitudinal va desde el nivel del mar, hasta los 1,500 m. Sin embargo, Handley (1976) destacó que la distribución altitudinal podría estar por encima de los 1,400 m, lo cual también coincide con el presente trabajo, ya que 10 registros se encuentran por encima de esta elevación, teniendo el registro con mayor altitud a los 2,239 m en Chiapas, México.
La distribución potencial actual de M. aztecus se concentra hacia la vertiente del océano Pacífico (tabla 1). Esta región se caracteriza por un clima predominantemente Aw (Köppen, 1900), el cual presenta una marcada y más extensa época seca, con un clima isotérmico con variaciones entre 2 y 6 °C; ésto se ve reflejado en que la variable climática que más aportó al modelo de nicho ecológico fue la de isotermalidad (bio 3). Además de este tipo de clima, también se observan regiones con clima Cw, con mayor humedad y temperaturas relativamente más bajas, principalmente en sitios a mayor elevación en Guerrero, Oaxaca y Chiapas, en México y hacia Guatemala y Honduras. Hasta la fecha, se ha reportado que este murciélago prefiere sitios de abundante humedad (Handley, 1976), tal como regiones a menor latitud, en donde la cantidad de humedad es mayor que en la zona neártica. Sin embargo, Handley (1976) también menciona ambientes con bajas temperaturas, mientras que Mora (2016) menciona que incluso puede habitar en bosques tropicales o pantanos, donde las temperaturas medias no son muy bajas, lo cual apoya nuestros modelos cercanos a la costa del océano Pacífico (fig. 2).
A pesar de su amplia distribución geográfica, el conocimiento ecológico y biogeográfico sobre Molossus aztecus sigue siendo escaso. Es probable que aún existan poblaciones desconocidas de ésta y otras especies del género Molossus debido a la falta de inventarios faunísticos en muchas áreas remotas de Norte y Sudamérica, así como a la falta de revisión crítica del material de las colecciones científicas y el análisis de datos genéticos (Gregorin et al., 2011; Loureiro et al., 2020). Ésto puede ocurrir en muchas otras especies de mamíferos neotropicales, por lo que el trabajo de campo es necesario, así como las revisiones taxonómicas y la digitalización de información, que permita conocer de mejor manera su riqueza y distribución (Patterson, 2002). Esperamos que el presente trabajo contribuya a comprender el estado actual del conocimiento de M. aztecus e identificar sitios en donde es posible encontrar la especie y así, además, poder obtener más conocimiento biológico.
Agradecimientos
A F. A. Cervantes, Y. Hortelano y J. Vargas por su apoyo en la consulta de ejemplares en la Colección Nacional de Mamíferos, UNAM. Este trabajo fue realizado gracias al apoyo del Posgrado en Ciencias Biológicas de la Universidad Nacional Autónoma de México y a la beca CEP (1085310), mediante el programa de Becas de la CGEP otorgada por el Posgrado en Ciencias Biológicas de la UNAM para cursar los estudios de maestría en los semestres 2021-1 al 2022-2. APC-R agradece al Conacyt por la beca posdoctoral para realizar el proyecto “Colecciones IBUNAM en movimiento: descubrir, estudiar y conservar la biodiversidad en el Antropoceno”. Este artículo es parte de los requerimientos para la obtención del título de Maestro en Ciencias Biológicas de SSR, con número de cuenta 310198075.
Referencias
Álvarez-Castañeda, S. T. y Álvarez, T. (1991). Los murciélagos de Chiapas. Escuela Nacional de Ciencias Biológicas. Ciudad de México.
Álvarez -Castañeda, S. T., Álvarez, T. y González-Ruiz, N. (2017). Guía para la identificación de los mamíferos de México. Baltimore, Maryland: Johns Hopkins University Press.
Anthony, E. L. y Kunz, T. H. (1977). Feeding strategies of the little brown bat, Myotis lucifugus, in southern New Hampshire. Ecology, 58, 775–786. https://doi.org/10.2307/1936213
Boyles, J. G., Cryan, P. M., McCracken, G. F. y Kunz, T. H. (2011). Economic importance of bats in agriculture. Science, 332, 41–42. https://doi.org/10.1126/science.1201366
Boyles, J. G. y Willis, C. K. (2010). Could localized warm areas inside cold caves reduce mortality of hibernating bats affected by white-nose syndrome? Frontiers in Ecology and the Environment, 8, 92–98. https://doi.org/10.1890/080187
Briones-Salas, M. A., Sánchez-Cordero, V. y Quintero, A. G. (2001). Lista de mamíferos terrestres del norte del estado de Oaxaca, México. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, Serie Zoología, 72, 125–161.
Burgin, C. J., Colella, J. P., Kahn, P. L. y Upham, N. S. (2018). How many species of mammals are there? Journal of Mammalogy, 99, 1–14. https://doi.org/10.1093/jmammal/gyx147
Chaves-Ramírez, S., Castillo-Salazar, C., Sánchez-Chavarría, M., Solís-Hernández, H. y Chaverri, G. (2021). Comparing the efficiency of monofilament and regular nets for capturing bats. Royal Society Open Science, 8, 211404. https://doi.org/10.1098/rsos.211404
Cleveland, C. J., Betke, M., Federico, P., Frank, J. D., Hallam, T. G., Horn, J. et al. (2006). Economic value of the pest control service provided by Brazilian free-tailed bats in south-central Texas. Frontiers in Ecology and the Environment, 4, 238–243. https://doi.org/10.1890/1540-9295(2006)004[0238:EVOTPC]2.0.CO;2
Cobos, M. E., Peterson, A. T., Barve, N. y Osorio-Olvera, L. (2019). kuenm: an R package for detailed development of ecological niche models using Maxent. PeerJ, 7, e6281. https://doi.org/10.7717/peerj.6281
Constable, H., Guralnick, R., Wieczorek, J., Spencer, C., Peterson, A. T. y VertNet Steering Committee. (2010). VertNet: a new model for biodiversity data sharing. Plos Biology, 8, e1000309. https://doi.org/10.1371/journal.pbio.1000309
Dalquest, W. W. y Werner, H. J. (1951). The interscapular gland of a tropical fruit bat. The Anatomical Record, 111, 345–353. https://doi.org/10.1002/ar.1091110306
Eger, J. L. (2008). Family Molossidae. En A. L. Gardner (Ed.), Mammals of South America, Volume 1. Marsupials, xenarthans, shrews and bats (pp. 399–439). Chicago: The University of Chicago Press.
Fick, S. E. y Hijmans, R. J. (2017). WorldClim 2: new 1-km spatial resolution climate surfaces for global land areas. International Journal of Climatology, 37, 4302–4315. https://doi.org/10.1002/joc.5086
Flaquer, C., Torre, I. y Arrizabalaga, A. (2007). Comparison of sampling methods for inventory of bat communities. Journal of Mammalogy, 88, 526–533. https://doi.org/10.1644/06-MAMM-A-135R1.1
García-Morales, R. y Gordillo-Chávez, E. J. (2011). Murciélagos del estado de San Luis Potosí, México: revisión de su conocimiento actual. Therya, 2, 183–192.
Gregorin, R., Tahara, A. S. y Buzzato, D. F. (2011). Molossus aztecus and other small Molossus (Chiroptera: Molossidae) in Brazil. Acta Chiropterologica, 13, 311–317. https://doi.org/10.3161/150811011X624794
Guerrero, S. y Cervantes, F. A. (2003). Lista comentada de los mamíferos terrestres del estado de Jalisco, México. Acta Zoológica Mexicana, 89, 93–110. https://doi.org/10.21829/azm.2003.89891777
Handley. C. O., Jr., (1976). Mammals of the Smithsonian Venezuelan project. Brigham Young University Science Bulletin, Biological Series, 20, 1–91. https://doi.org/10.5962/bhl.part.5667
Hortal, J., de Bello, F., Diniz-Filho, J. A. F., Lewinsohn, T. M., Lobo, J. M. y Ladle, R. J. (2015). Seven shortfalls that beset large-scale knowledge of biodiversity. Annual Review of Ecology, Evolution, and Systematics, 46, 523–549. https://doi.org/10.1146/annurev-ecolsys-112414-054400
Hourigan, C. L., Catterall, C. P., Jones, D. y Rhodes, M. (2008). A comparison of the effectiveness of bat detectors and harp traps for surveying bats in an urban landscape. Wildlife Research, 35, 768–774. https://doi.org/10.1071/WR07154
Hughes, A. C., Orr, M. C., Ma, K., Costello, M. J., Waller, J., Provoost, P. et al. (2021). Sampling biases shape our view of the natural world. Ecography, 44, 1259–1269. https://doi.org/10.1111/ecog.05926
INEGI (Instituto Nacional de Estadística y Geografía). (2013). Continuo de elevaciones mexicano 3.0, CEM 3.0. México. (https://www.inegi.org.mx/app/geo2/elevacionesmex/)
Kalko, E. K., Estrada-Villegas, S., Schmidt, M., Wegmann, M. y Meyer, C. F. (2008). Flying high-assessing the use of the aerosphere by bats. Integrative and Comparative Biology, 48, 60–73. https://doi.org/10.1093/icb/icn030
Köppen, W. (1900). Versuch einer Klassifikation der Klimate, vorzugsweise nach ihren Beziehungen zur Pflanzenwelt. Geographische Zeitschrift, 6, 593–611.
Krivek, G., Schulze, B., Poloskei, P. Z., Frankowski, K., Mathgen, X., Douwes, A. et al. (2022). Camera traps with white flash are a minimally invasive method for long-term bat monitoring. Remote Sensing in Ecology and Conservation, 8, 284-296. https://doi.org/10.1002/rse2.243
Kunz, T. H. y Parsons, S. (Eds.). (2009). Ecological and behavioral methods for the study of bats. Segunda edición. Maryland: Johns Hopkins University Press.
Kurta, A., Bell, G. P., Nagy, K. A. y Kunz, T. H. (1989). Energetics of pregnancy and lactation in free ranging little brown bats (Myotis lucifugus). Physiological Zoology, 62, 804–818. https://doi.org/10.1086/physzool.62.3.30157928
Loureiro, L. O., Engstrom, M. D. y Lim, B. K. (2020). Next generation sequencing data in the phylogenetic relationships of the genus Molossus (Chiroptera, Molossidae). Data in Brief, 29, 1– 7. https://doi.org/10.1016/j.dib.2020.105276
Loureiro, L. O., Lim, B. K. y Engstrom, M. D. (2018). A new species of mastiff bat (Chiroptera, Molossidae, Molossus) from Guyana and Ecuador. Mammalian Biology, 90, 10-21. https://doi.org/10.1016/j.mambio.2018.01.008
MacSwiney, G. M. C., Clarke, F. M. y Racey, P. A. (2008). What you see is not what you get: the role of ultrasonic detectors in increasing inventory completeness in Neotropical bat assemblages. Journal of Applied Ecology, 45, 1364–1371. https://doi.org/10.1111/j.1365-2664.2008.01531.x
Mora, J. M. (2016). Clave para la identificación de las especies de murciélagos de Honduras. Ceiba, 54, 93–117. https://doi.org/10.5377/ceiba.v54i2.3283
Ortega, J., MacSwiney, C y G. Zamora. (2022). Compendio de los llamados de ecolocalización de los murciélagos insectívoros mexicanos. Ciudad de México: Asociación Mexicana de Mastozoología, A.C./ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Patterson, B. D. (2002). On the continuing need for scientific collecting of mammals. Mastozoologia Neotropical, 9, 253–262.
Peterson, A. T. y Soberón, J. (2012). Species distribution modeling and ecological niche modeling: getting the concepts right. Natureza & Conservação, 10, 102-107. http://dx.doi.org/10.4322/natcon.2012.019
Phillips, S. J., Anderson, R. P. y Schapire, R. E. (2006). Maximum entropy modeling of species geographic distributions. Ecological Modelling, 190, 231–259. https://doi.org/10.1016/j.ecolmodel.2005.03.026
QGIS Development Team (2022). QGIS Geographic Information System. Open Source Geospatial Fundation Project. http://qgis.osgeo.org
Raxworthy, C. J., Martínez-Meyer, E., Horning, N., Nussbaum, R. A., Schneider, G. E., Ortega-Huerta, M. A. et al. (2003). Predicting distributions of known and unknown reptile species in Madagascar. Nature, 426, 837–841. https://doi.org/10.1038/nature02205
R Core Team, A. (2022). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. 2012. https://www.R-project.org
Rodríguez, E. A. M. (1992). Estudio museográfico y bibliográfico de la mastofauna de Tabasco (Tesis doctoral). División Académica de Ciencias Biológicas. Universidad Juárez Autónoma de Tabasco. Villahermosa, Tabasco.
Schnitzler, H. U. y Kalko, E. K. (2001). Echolocation by insect-eating bats: we define four distinct functional groups of bats and find differences in signal structure that correlate with the typical echolocation tasks faced by each group. Bioscience, 51, 557–569. https://doi.org/10.1641/0006-3568(2001)051[0557:EBIEB]2.0.CO;2
Simmons, N. B. (2005). Order Chiroptera. En D. E. Wilson y D. M. Reeder (Eds.), Mammal species of the World: a taxonomic and geographic reference, 3era. Edición (pp. 312–529). Baltimore: The Johns Hopkins University Press.
Simmons, N. B. y Voss, R. S. (1998). The mammals of Paracou, French Guiana, a Neotropical lowland rainforest fauna. Part 1, Bats. Bulletin of the American Museum of Natural History, 237, 1–219.
SNIB-Conabio (Sistema Nacional de Información sobre Biodiversidad-Comisión Nacional para el Conocimiento y Uso de la Biodiversidad). (2022). Registros de ejemplares. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Ciudad de México, México. https://snib.mx/dev/ejemplares/descarga/
Soares, E. M., Ferraz, J. F., Oliveira, R. S., Dias, L. I., Morielle-Versute, E., Taboga, S. R. et al. (2020). Annual reproductive cycle of males of the bat Molossus molossus: seasonal bimodal polyestry, testicular regression, and some aspects of the hormonal control. Theriogenology, 158, 297–308. https://doi.org/10.1016/j.theriogenology.2020.09.025
Soberón, J. y Nakamura, M. (2009). Niches and distributional areas: concepts, methods, and assumptions. Proceedings of the National Academy of Sciences, 106, 19644–19650. https://doi.org/10.1073/pnas.0901637106
Solari, S. 2019. Molossus aztecus. The IUCN Red List of Threatened Species 2019: e.T13645A22107522. https://dx.doi.org/10.2305/IUCN.UK.2019-1.RLTS.T13645A22107522.en. Recuperado el 18 octubre, 2022.
Taylor, M. y Tuttle, M. (2019). Bats: an illustrated guide to all species. Brighton: Ivy Press.
Tremlett, C. J., Moore, M., Chapman, M. A., Zamora-Gutierrez, V. y Peh, K. S. H. (2020). Pollination by bats enhances both quality and yield of a major cash crop in Mexico. Journal of Applied Ecology, 57, 450–459. https://doi.org/10.1111/1365-2664.13545
Wieczorek, J., Bloom, D., Guralnick, R., Blum, S., Döring, M., Giovanni, R. et al. (2012). Darwin Core: an evolving community-developed biodiversity data standard. Plos One, 7, e29715. https://doi.org/10.1371/journal.pone.0029715
Williams-Guillén, K., Perfecto, I. y Vandermeer, J. (2008). Bats limit insects in a neotropical agroforestry system. Science, 320, 70–70. https://doi.org/10.1126/science.1152944
Zamora-Gutiérrez, V., MacSwiney, G, M. C., Martínez-Balvanera, S. y Robredo-Esquivelzeta, E. (2021). The evolution of acoustic methods for the study of bats. En B. K. Lim, M. B. Fenton, R. M. Brigham, S. Mistry, A. Kurta, E. H. Gillam et al. (Eds.), 50 years of bat research: foundations and new frontiers (pp 43–60). Berlín: Springer.
Zamora-Gutiérrez, V., Ortega, J., Avila-Flores, R., Aguilar-Rodríguez, P. A., Alarcón-Montano, M., Avila-Torresagatón L. G., et al. (2020). The Sonozotz project: assembling an echolocation call library for bats in a megadiverse country. Ecology and Evolution, 10, 4928–4943. https://doi.org/10.1002/ece3.6245