Edgar Abraham Aragón-Flores a, *, Rocío Rodiles-Hernándeza, Miriam Soria-Barreto b, Carmen G. Montaña c y María M. Castillo d
a El Colegio de la Frontera Sur-Unidad San Cristóbal, Carretera Panamericana y Periférico Sur s/n, Barrio María Auxiliadora, 29290 San Cristóbal de Las Casas, Chiapas, México
b Universidad Autónoma del Carmen, Facultad de Ciencias Naturales, Centro de Investigación de Ciencias Ambientales, Calle Laguna de Términos s/n, Col. Renovación 2ª Sección, 24115 Ciudad del Carmen, Campeche, México
c Stephen F. Austin State University, Department of Biology, 2111 Raguet St. Nacogdoches, 75962, Texas, TX, USA
d El Colegio de la Frontera Sur-Unidad Villahermosa, Carretera Villahermosa-Reforma Km 15.5 Ranchería Guineo, Sección II, 86280 Villahermosa, Tabasco, México
*Autor para correspondencia: aragonfla89@gmail.com (E.A. Aragón-Flores)
Recibido: 28 mayo 2019; aceptado: 19 octubre 2020
Resumen
Los estuarios son ambientes dinámicos que manifiestan cambios espacio-temporales en sus características ambientales y biológicas. En el presente trabajo, se analizó la estructura de la comunidad íctica en el delta del río Usumacinta: riqueza, diversidad, equidad, abundancia de especies y de sus gremios tróficos, durante las temporadas de lluvias, nortes y estiaje. Un total de 603 individuos pertenecientes a 23 familias, 31 géneros y 40 especies fueron registrados. Las especies más abundantes fueron: Dorosoma petenense, Cathorops aguadulce, Bairdiella ronchus, Bagre marinus, Thorichthys helleri y Megalops atlanticus, que comprendieron 58.53% de la abundancia total. Se presentaron 6 gremios tróficos, los más abundantes fueron los zooplanctívoros y zoobentívoros con 50.2%. La riqueza, diversidad, equidad y abundancia de los gremios tróficos no variaron de manera significativa entre las temporadas y los sistemas. La abundancia de especies fue significativamente mayor en nortes. El modelo lineal general mixto indicó que la salinidad, temperatura, transparencia, oxígeno disuelto y pH fueron las variables que mejor predijeron los cambios temporales de la abundancia de peces. De este modo, la temporalidad de la zona modifica las características ambientales y la ictiofauna responde de manera semejante a las condiciones contrastantes.
Palabras clave: Golfo de México; Sistemas fluvio-lagunares estuarinos; Abundancia de especies; Gremios tróficos
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Temporal variation of the fish community abundance from the delta of the Usumacinta River, Mexico
Abstract
Estuaries are dynamics systems, with great spatiotemporal variation in their environmental and biological characteristics. In this study, we analyzed the community attributes such as richness, diversity, evenness, species and trophic guild abundance, of the ichthyofauna in the delta of the Usumacinta River during rain, dry and north wind seasons. A total of 603 individuals belonging to 15 orders, 23 families, 31 genera and 40 species were obtained. Dorosoma petenense, Cathorops aguadulce, Bairdiella ronchus, Bagre marinus, Thorichthys helleri and Megalops atlanticus, were the most abundant species, comprising 58.53% of the total abundance. Six trophic guilds were observed with zooplantivorous and zoobentivorous species having the most abundant number of individuals (50.20%). Species richness, diversity, equitability and trophic guilds abundance did not vary significantly between seasons and systems. Species abundance were significantly higher during “nortes” season. The general linear mixed model identified salinity, temperature, transparency, dissolved oxygen and pH as the variables that best predicted the temporal changes of fish abundance. In this way, the region’s seasonality modifies the environmental characteristics and the fish assemblage reacts similarly to the contrasting conditions.
Keywords: Gulf of Mexico; Fluvio-lagoon estuarine systems; Species abundance; Trophic guilds
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Los estuarios son sistemas altamente productivos y dinámicos, constituyen zonas de transición entre los ambientes marinos y dulceacuícolas (Ayala-Pérez, Terán-González, Flores-Hernández et al., 2012; Ayala-Pérez, Terán-González, Ramos-Miranda et al., 2012). En las zonas tropicales, las características ambientales y el funcionamiento de estos ecosistemas varían en el espacio como resultado de la geomorfología, la distancia de la parte superior a la desembocadura del estuario y la heterogeneidad del hábitat (Barletta et al., 2005; Peralta-Meixueiro y Vega-Cendejas, 2011; Simier et al., 2004), así como a la marcada temporalidad entre lluvias y estiaje, la cual influye en la descarga y la inundación en los estuarios tropicales (Akin et al., 2003; Ayala-Pérez, Terán-González, Ramos-Miranda et al., 2012; Winemiller et al., 2008).
Como resultado de esta variación espacial y temporal se modifican las características fisicoquímicas del agua, que a su vez tienen influencia en la riqueza, abundancia y distribución de peces en los estuarios. Los principales efectos son atribuidos a la variación de la salinidad y la temperatura, debido a que ejercen una fuerte presión fisiológica en los peces, su efecto depende de la capacidad osmorreguladora y termorreguladora de cada especie (Ayala-Pérez, Terán-González, Flores-Hernández et al., 2012; Molina et al., 2020; Sosa-López et al., 2007; Vilar et al., 2011). Otras variables ambientales como el oxígeno disuelto, la transparencia, la profundidad y los sólidos totales disueltos afectan la distribución dentro del estuario, la visibilidad de los organismos y la relación depredador-presa (Akin et al., 2003; Barletta et al., 2005; Paperno y Brodie, 2004; Simier et al., 2004; Whitfield, 1999). De este modo, la respuesta de la ictiofauna ante las variaciones ambientales depende de las características biológicas y ecológicas de cada especie (Molina et al., 2020; Sosa-López et al., 2007).
El ciclo de vida de diversas especies depende de los estuarios. Los peces estuarinos desarrollan todo su ciclo de vida en el sistema y los hay tanto especies dulceacuícolas, que toleran condiciones eurihalinas, como peces marinos (Elliot et al., 2007). Las especies marinas son las más diversas, los organismos adultos ingresan de manera temporal o esporádica a los estuarios con fines reproductivos o alimentarios, mientras que los juveniles utilizan estos sistemas como sitios de protección, para reducir su riesgo de depredación (Arceo-Carranza y Vega-Cendejas, 2009; Ayala-Pérez, Terán-González, Flores-Hernández et al., 2012), y como sitios de alimentación y crianza (Beck et al., 2001). Debido a la gran diversidad y disponibilidad de recursos alimentarios, en los estuarios se establecen peces con diferentes gremios tróficos y se desarrollan redes tróficas dinámicas que dependen de recursos alóctonos y autóctonos (Sepúlveda-Lozada et al., 2015, 2017).
La dinámica de la ictiofauna del delta del río Usumacinta responde a la variación temporal y espacial. Se ha detectado que la abundancia de peces de la zona marina y estuarina incrementa durante la temporada de lluvias (Ayala-Pérez, Terán-González, Flores-Hernández et al., 2012; Ayala-Pérez, Terán-González, Ramos-Miranda et al., 2012). En cambio, la ictiofauna en la laguna de Términos muestra cambios en la abundancia y en la riqueza de manera espacial, como resultado del efecto de la descarga de ríos y la disminución de la salinidad (Ramos-Miranda et al., 2008; Sosa-López et al., 2007). Los sistemas fluvio-lagunares estuarinos Palizada y Pom-Atasta muestran variaciones temporales en la salinidad, temperatura y oxígeno disuelto, las cuales pueden verse influenciadas por la dinámica de la laguna de Términos (Medina-Gómez et al., 2015). Sin embargo, se desconoce su efecto en la composición y abundancia de la ictiofauna (Amezcua-Linares y Yáñez-Arancibia, 1980; Ayala-Pérez et al., 1993; Vera-Herrera et al., 1988).
Es necesario evaluar el efecto espacio temporal en la ictiofauna de los sistemas fluvio-lagunares, debido a que constituyen una fuente de energía para la biota de laguna de Términos y la Sonda de Campeche (Amezcua-Linares y Yáñez-Arancibia, 1980). Esta información será útil para comprender el funcionamiento de estos ecosistemas y servirá como herramienta para proponer medidas de conservación y aprovechamiento (Simier et al., 2004; Sosa-López et al., 2007). El objetivo de este trabajo fue analizar la variación espacial y temporal de la estructura de la comunidad de peces, definida por la riqueza, diversidad, equidad y abundancia y de sus gremios tróficos en 2 sistemas fluvio-lagunares estuarinos del delta del río Usumacinta. Se espera que la comunidad íctica cambie como resultado de la temporalidad ambiental y la dinámica espacial de estos sistemas estuarinos.
Materiales y métodos
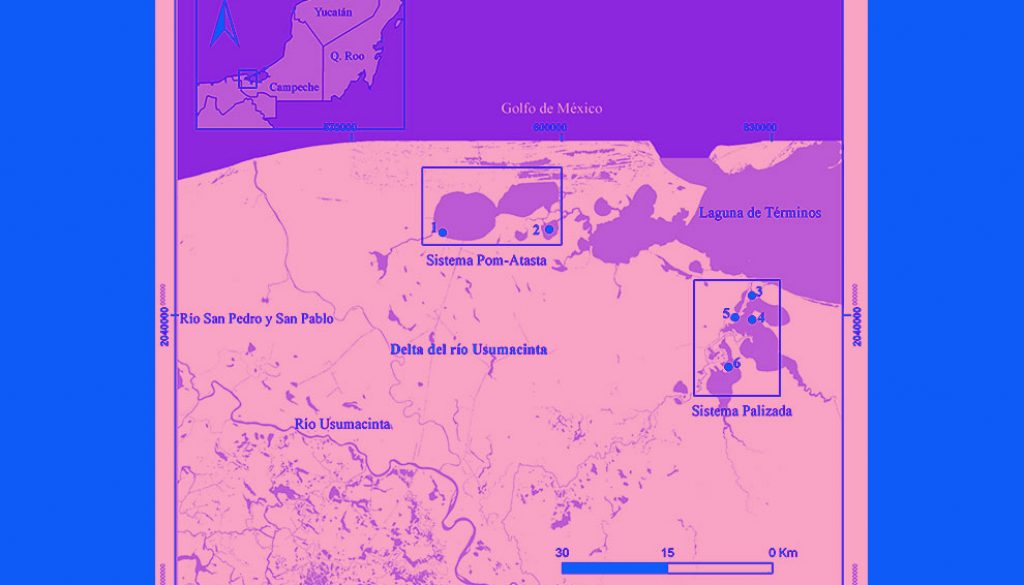
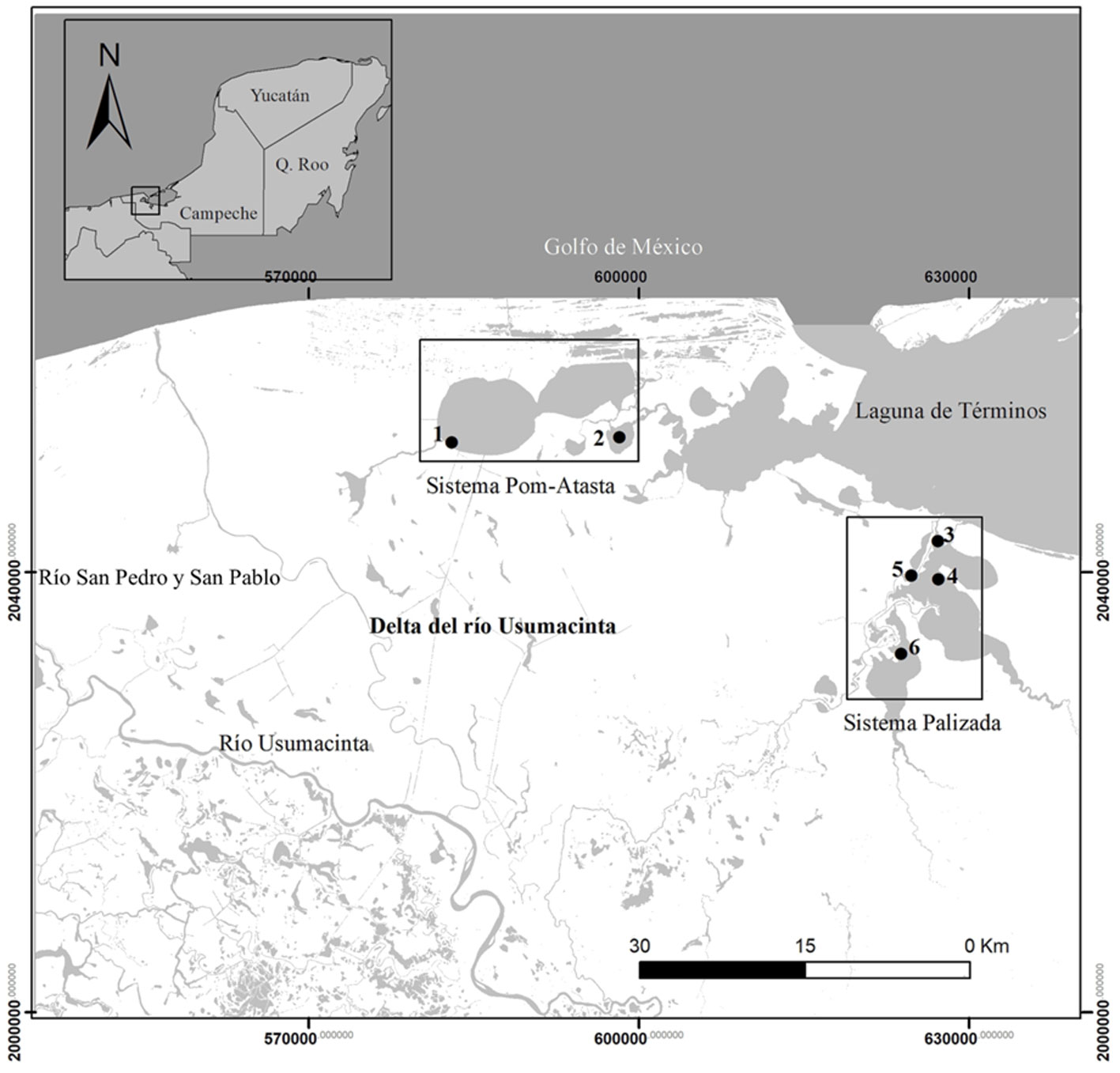
Los sistemas fluvio-lagunares estuarinos Palizada y Pom-Atasta se localizan en el estado de Campeche, México. Ambos sistemas tienen aporte de agua dulce de efluentes del río Usumacinta. En su desembocadura forman parte del Área de Protección de Flora y Fauna Laguna de Términos y del delta del río Usumacinta (fig. 1). La zona presenta 3 temporadas definidas: estiaje de marzo a mayo, lluvias de junio a octubre, temporada en que se registra la mayor descarga de agua (Conagua, 2018) (fig. 2), y nortes, de noviembre a febrero, caracterizada por la presencia de lluvias invernales (Yánez-Arancibia et al., 2013).
El sistema Pom-Atasta (SPA) recibe la influencia del río San Pedro y San Pablo, efluente del río Usumacinta. Presenta un gradiente de salinidad de oeste a este de 0-28 ups (Muciño-Márquez et al., 2017). En la laguna Pom predominan las condiciones dulceacuícolas provenientes de arroyos naturales y canales artificiales; mientras que la laguna Atasta presenta condiciones más salinas, debido a su cercanía y conexión con la laguna de Términos, mediante un sistema de lagunas más pequeñas. La vegetación predominante es el manglar (Rhizophora mangle y Avicennia germinans) (Barreiro-Güemes, 1999; Barreiro-Güemes y Aguirre-León, 1999).
El sistema Palizada (SP) está formado por el río Palizada, efluente del río Usumacinta. Presenta 2 lagunas El Vapor y del Este, ambas con importancia pesquera, donde drenan 4 ríos perenes (Fuentes-Yaco et al., 2001). El sistema Palizada desemboca en la laguna de Términos a través de 2 bocas, siendo boca chica la principal. La distribución del sistema genera un gradiente de salinidad de sur a norte de 0-10 ups. La vegetación cambia de carrizo (Phragmites australis) a manglar (R. mangle y A. germinans) en la misma orientación (Fuentes-Yaco et al., 2001; Muciño-Márquez et al., 2017). Este sistema recibe mayores volúmenes de descarga dulceacuícola proveniente del río Palizada (Medina-Gómez et al., 2015), así como el aporte de agua salobre por su conexión directa con la laguna de Términos (Fuentes-Yaco et al., 2001).
Las recolectas se realizaron en 2 sitios en el sistema SPA y 4 sitios en el sistema SP, durante la temporada lluvias (septiembre 2017), nortes (enero 2018) y estiaje (mayo 2018). En cada sitio se registró por triplicado la temperatura del agua (°C), salinidad (ups), oxígeno disuelto (OD, mg/l), pH y sólidos totales disueltos (STD, mg/l) mediante una sonda multiparamétrica HANNA modelo HI 9829. La transparencia del agua (cm) se midió con un disco de Secchi, la profundidad (cm) con un ecosonda Speedtech modelo 1170 y la velocidad del flujo de agua (millas por hora, MPH) con un flujómetro Global Water modelo FP101. Se obtuvieron las concentraciones de clorofila a, 3 réplicas por sitio: 2 en la orilla del canal del río o laguna y una en la parte media del canal del río o laguna, se utilizó el método de extracción por etanol y se midió con un espectrofotómetro (Nusch, 1980).
La recolecta de peces se realizó con diversas artes de pesca de acuerdo con las características de cada sitio: redes agalleras multi-malla de 55 metros (m) de largo, con caída de 2.5 m y luz de malla de 1 a 3.5 pulgadas; atarrayas de 2 m de altura y 1 cm de luz de malla; así como palangres de 50 m de largo con anzuelos del número 6. Por cada sitio se obtuvieron al menos 2 muestras, una procedente de la orilla del canal o laguna y otra de la parte media del canal o laguna. En todos los sitios, las capturas se realizaron en la mañana durante 4 horas, con la finalidad de obtener muestras comparables y tener la mayor representatividad de la ictiofauna.
Los peces capturados fueron fijados con una solución de formaldehído al 10%. En el laboratorio, los ejemplares se lavaron en agua y se preservaron en alcohol etílico al 70%. La identidad taxonómica de los ejemplares se determinó con las claves de Armbruster y Lawrence (2006), Betancur y Willink (2007), Orrell (2002), Castro-Aguirre et al. (1999), Marceniuk y Betancur (2008), Miller (2009) y Schultz y Miller (1971). Todo el material íctico se catalogó e incorporó a la Colección de Peces de ECOSUR-San Cristóbal (ECOSC), con los números de catálogo 12825, 12846, 12848-12901, 14339-14492.
Los gremios tróficos de las especies se asignaron con base en Elliott et al. (2007) y se determinaron con la información de la dieta reportada en Castro-Aguirre et al. (1999), Froese y Pauly (2018), Miller (2009) y Orrell (2002). Se definieron 6 gremios: piscívoros (PV), especies que se alimentan principalmente de peces; herbívoros (HV), especies con preferencia por el consumo de material macrófito, macro algas o fitoplancton; zoobentívoros (ZB), especies que se alimentan predominantemente de invertebrados que habitan sobre o en el sedimento; detritívoros (DV), especies que consumen detrito; zooplanctívoros (ZP), especies que se alimentan de zooplancton; omnívoros (OV), especies que se alimentan de algas filamentosas, macrófitas, perifiton, epifauna e infauna.
Las variables ambientales fueron transformadas con logaritmo (x + 1), después de no cumplir los supuestos de normalidad (Kolmogov-Smirnoff) y homoscedasticidad (Barlett). Las comparaciones se realizaron entre sistemas y temporadas con el fin de evaluar la variación espacial y temporal. Se utilizó un análisis de varianza de permutaciones de 2 vías (Permanova, 9,999 permutaciones) para comparar las variables ambientales entre sistemas, temporadas y conocer el efecto de la interacción de ambos (Anderson, 2001).
La abundancia relativa de cada especie y de los gremios tróficos se obtuvo por sistema y temporada, dividiendo el número total de individuos por especie o gremio entre el número total de individuos colectados, el resultado se multiplicó por 100 (Moreno, 2001). La frecuencia de aparición se estimó por sistema y temporada, dividiendo el número de sitios de aparición de la especie entre el número total de sitios, el resultado se multiplicó por 100 (Moreno, 2001). Se determinaron los siguientes atributos de la comunidad por sistema y temporada: abundancia específica de cada especie y de los gremios tróficos (n), riqueza (S), diversidad (Shannon-Wiener H’) y equidad (E) (Simpson 1-D), los cuales fueron transformados con logaritmo (x + 1) después de no cumplir los supuestos de normalidad (Kolmogov-Smirnoff) y homoscedasticidad (Barlett) (Quinn y Keough, 2002). Los atributos se compararon con un análisis Permanova de 2 vías (9,999 permutaciones), para determinar las diferencias espaciales, temporales y la interacción de ambos (Anderson, 2001).
Se aplicó un análisis de porcentaje de similitud (Simper) para conocer la contribución de las especies por sistema y temporada. Esta prueba determina el porcentaje de contribución de cada especie a la similitud entre sistemas o temporadas y permite discriminar las especies entre los grupos (disimilitud) (Clarke y Warwick, 1994).
Para evaluar la influencia de las variables ambientales en la ictiofauna, primero se realizó una selección de variables ambientales, con la finalidad de minimizar la multicolinealidad entre variables y maximizar la correlación con la abundancia y riqueza de especies (modificado de Mellín et al., 2010). Se realizó un análisis de componentes principales (ACP) de las variables ambientales usando una matriz de correlación, los eigenvalores definieron las variables más importantes (Davis, 1986) (apéndice). Estas variables se usaron en un análisis de correlación de Pearson (Press et al., 1992), se identificaron las variables altamente correlacionadas y redundantes (p > 0.05) (apéndice) que fueron removidas del análisis. Utilizando las variables ambientales no correlacionadas y la abundancia de especies por temporada, se realizó un modelo lineal general mixto (MLGM) asumiendo una matriz de Poisson (McCullagh y Neider, 1989). El modelo fue seleccionado con base en el criterio de información de Akiake, el criterio de información Bayesiano y el porcentaje de devianza. El modelo predijo las variables más importantes relacionadas con los cambios en la abundancia de peces.
Todos los análisis estadísticos se realizaron con el programa PAST 3.17 (Hammer et al., 2001), excepto el análisis MGLM, que se efectuó con el programa R 3.5.1 (R Core Team, 2018), usando las funciones “Ime4”, “sjPlot” y “MuMIn”.
Resultados
Las variables ambientales variaron entre los sistemas y las temporadas (tabla 1) y mostraron diferencias significativas (tabla 2). La transparencia tuvo diferencias entre los sistemas (F = 7.628, p = 0.005), con valores significativamente mayores en SPA. Se evidenciaron diferencias significativas entre temporadas en la salinidad (F = 7.628, p = 0.006) y los STD (F = 8.7587, p < 0.001), los cuales tuvieron valores mayores en estiaje y nortes; para el OD (F = 13.156, p < 0.001) que tuvo mayor concentración en nortes y lluvias, y para la temperatura (F = 323.04, p = 0.001) que incrementó en lluvias y estiaje.
La concentración de clorofila a mostró diferencias entre sistemas (F = 10.999, p < 0.001), con valores más altos en SPA, y varío entre temporadas (F = 29.995, p < 0.001) con valores más altos en nortes y lluvias. Se evidenció el efecto significativo de la interacción espacio-temporal para el OD (F = 7.071, p <0.001), temperatura (F = -0.309, p = 0.042), salinidad (F = 5.273, p < 0.001), STD (F = 5.698, p <0.001), pH (F = 4.857, p = 0.001) y clorofila a (F = 1.827, p = 0.004). La profundidad y la velocidad de corriente no presentaron diferencias significativas.
Tabla 1
Variables ambientales registradas en los sistemas Pom-Atasta (SPA) y Palizada (SP) durante 3 temporadas en el delta del río Usumacinta. Promedio ± error estándar.
|
Variable |
SP |
SPA |
Lluvias |
Nortes |
Estiaje |
|
Transparencia (cm) |
39.61 ± 2.72 |
62.91 ± 8.73 |
40.39 ± 4.13 |
51.42 ± 5.50 |
47 ± 8 |
|
Profundidad (m) |
121.78 ± 10.29 |
158.88 ± 35.02 |
152.85 ± 19.08 |
119 ± 14.16 |
125.3 ± 29.08 |
|
Oxígeno disuelto (mg/l) |
7.36 ± 0.19 |
7.11 ± 0.30 |
7.33 ± 0.20 |
8.03 ± 0.25 |
6.51 ± 0.22 |
|
Temperatura (°C) |
28.11 ± 0.65 |
27.72 ± 1.21 |
30.91 ± 0.27 |
23.02 ± 0.19 |
30.08 ± 0.29 |
|
Salinidad (ups) |
0.78 ± 0.11 |
1.07 ± 0.26 |
0.61 ± 0.20 |
0.86 ± 0.16 |
1.13 ± 0.21 |
|
Sólidos totales disueltos (mg/l) |
750 ± 112.60 |
956.75 ± 259.65 |
506.42 ± 189.79 |
820.92 ± 151.71 |
1099.85 ± 197.28 |
|
pH |
8.24 ± 0.04 |
8.36 ± 0.13 |
8.41 ± 0.10 |
8.16 ± 0.09 |
8.27 ± 0.06 |
|
Velocidad de corriente (MPH) |
11.42 ± 2.40 |
11.74 ± 3.71 |
16.46 ± 3.99 |
10.87 ± 3.34 |
7.20 ± 2.69 |
|
Clorofila a (µg/l) |
2.84 ± 0.36 |
5.16 ± 0.95 |
3.42 ± 0.34 |
5.51 ± 0.74 |
1.58 ± 0.54 |
Tabla 2
Análisis Permanova de 2 vías del efecto de los sistemas Pom-Atasta y Sistema Palizada, las temporadas o su interacción sobre las variables ambientales. SC: Suma de cuadrados; gl: grados de libertad. Valores significativos (p < 0.05) en negritas, obtenidos de 9,999 permutaciones.
|
Variable |
Factor |
SC |
gl |
F |
p |
|
Transparencia (cm) |
Sistema temporada interacción |
0.026 0.007 -0.020 |
1 2 |
7.628 1.118 2.861 |
0.005 0.269 0.624 |
|
Profundidad (m) |
Sistema temporada interacción |
0.001 0.009 0.003 |
1 2 2 |
0.740 1.725 0.717 |
0.352 0.140 0.061 |
|
Oxígeno disuelto (mg/l) |
Sistema temporada interacción |
0.001 0.013 0.007 |
1 2 2 |
0.970 |
0.290 |
|
Temperatura (°C) |
Sistema temporada interacción |
> 0.001 0.015 – 0.001 |
1 2 2 |
2.367 |
0.089 |
|
Salinidad (ups) |
Sistema temporada interacción |
0.005 0.592 0.070 |
1 2 2 |
0.788 |
0.341 |
|
Sólidos totales disueltos (mg/l) |
Sistema temporada interacción |
> 0.001 0.053 0.003 |
1 2 2 |
0.546 8.758 5.698 |
0.421 |
|
pH |
Sistema temporada interacción |
> 0.001 > 0.001 > 0.001 |
1 2 2 |
1.013 |
0.275 |
|
Velocidad de corriente (MPH) |
Sistema temporada interacción |
0.008 0.922 -1.140 |
1 2 2 |
0.295 1.642 -2.037 |
0.718 0.110 0.361 |
|
Clorofila a (µg/l) |
Sistema temporada interacción |
0.024 1.340 0.008 |
1 2 2 |
10.999 |
> 0.001 |
Se capturaron un total de 603 individuos pertenecientes a 15 órdenes, 23 familias, 31 géneros y 40 especies (tabla 3). Las familias con mayor número de especies fueron Cichlidae (6 especies), Ariidae (4 especies), Carangidae y Gerreidae (3 especies, respectivamente). Las especies con mayor abundancia relativa fueron Dorosoma petenense (24.87%), Poecilia mexicana (11.69%) y Cathorops aguadulce (10.11%) (tabla 3). Las especies con mayor frecuencia de aparición fueron Thorichthys helleri (8.67%), D. petenense (8%), C. aguadulce (8%), Bagre marinus (6.67%), Centropomus undecimalis (5.33%), Bairdiella ronchus (5.33%) y Megalops atlanticus (5.33%) (tabla 3).
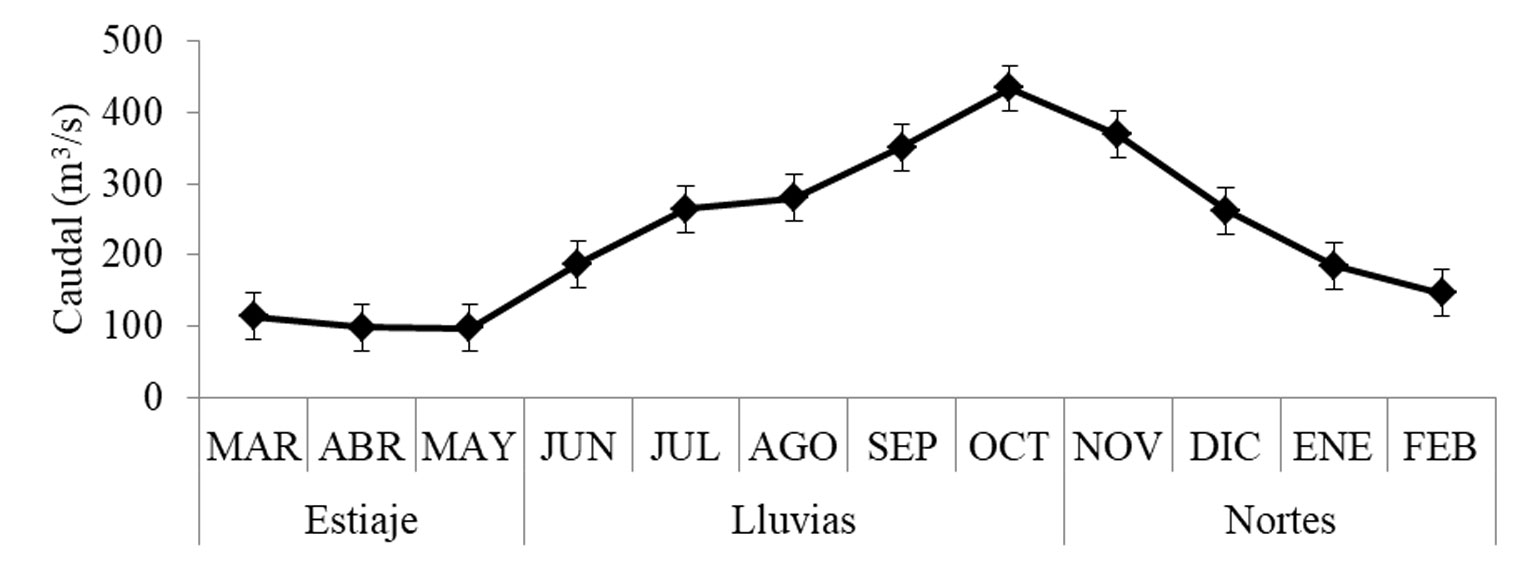
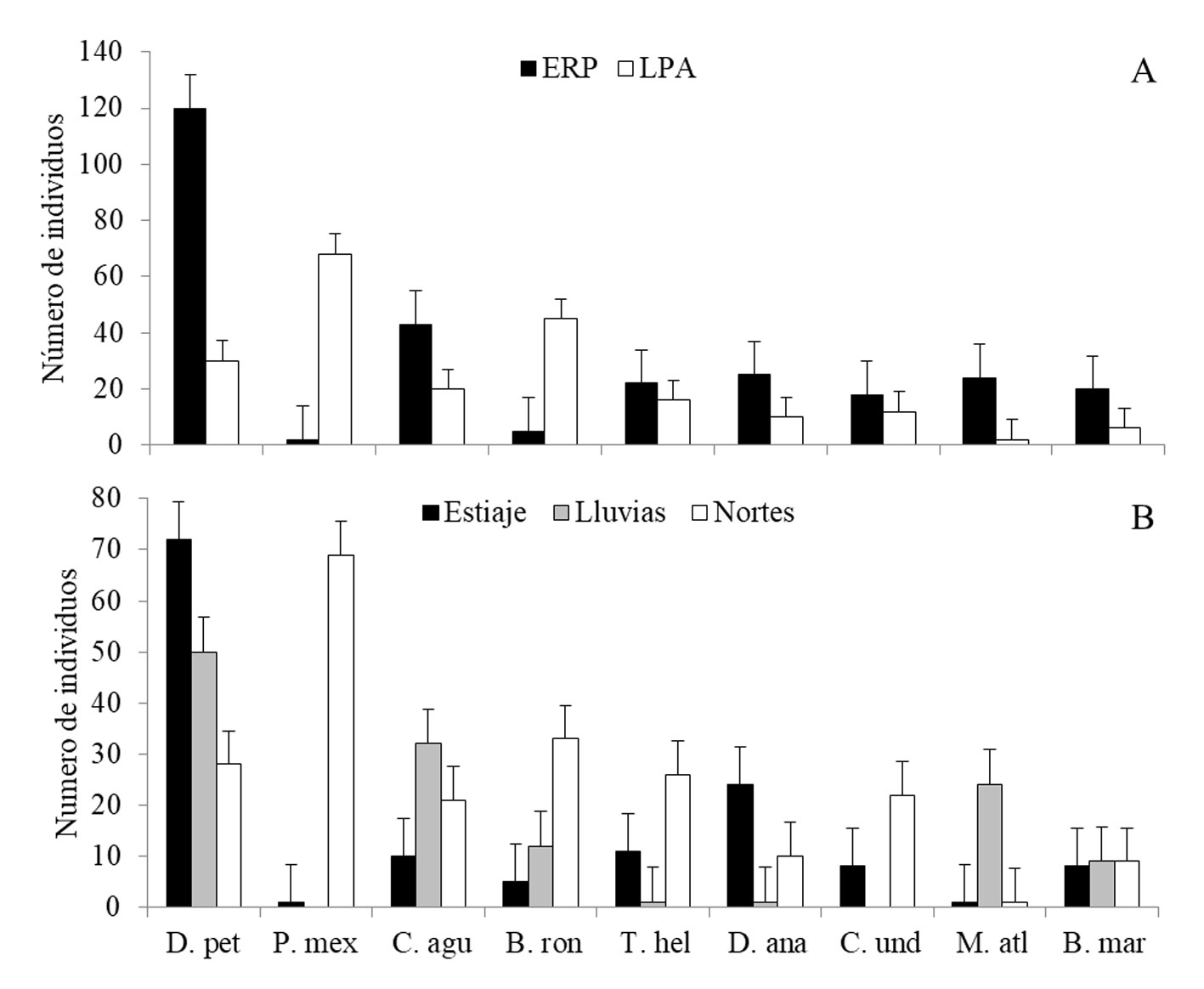
Las especies más abundantes en el SP fueron D. petenense y C. aguadulce, mientras que en el SPA fueron P. mexicana y B. ronchus (fig. 3). La comparación temporal reveló que la abundancia de D. petenense fue mayor durante el estiaje, mientras que P. mexicana fue más abundante en nortes. Megalops atlanticus y C. undecimalis mostraron un incremento en la abundancia durante las temporadas de lluvias y nortes, respectivamente (fig. 3).
La abundancia específica varió de manera significativa entre temporadas (F = 1.771, p = 0.005) y espacio-temporalmente (F = -0.583, p = 0.021), pero no entre los sistemas (tabla 4). Las mayores abundancias se presentaron en la temporada de nortes (268 individuos), seguido de la temporada de estiaje (183 individuos) y lluvias (152 individuos). La abundancia en el SP fue mayor en nortes, mientras que en el SPA se incrementó en estiaje (fig. 4). Los valores de riqueza, diversidad y equidad fueron mayores durante la temporada de nortes y estiaje, respecto a lluvias (fig. 4), sin embargo, estos resultados no fueron estadísticamente significativos.
Se identificaron 6 gremios tróficos (tabla 2). Los zooplanctívoros, gremio integrado por 2 especies fueron los más abundantes (30.67%), seguido por los zoobentívoros con 17 especies (28.52%), los piscívoros se representaron por 11 especies (22.55%) y los detritívoros con 6 especies (15.58%). Los omnívoros (2.48%) y herbívoros (0.16%) fueron los gremios menos abundantes presentados por 3 y una especie, respectivamente.
Durante la temporada de lluvias, el gremio de los piscívoros y zoobentívoros fueron más abundantes en el SPA, mientras que los zooplanctívoros en el SP (fig. 5). Durante nortes, los detritívoros, piscívoros y zoobentívoros fueron los gremios más abundantes en el SPA, mientras que en el SP dominaron los zoobentívoros (fig. 5). En estiaje, los zooplanctívoros fueron más abundantes en ambos sistemas (fig. 5). A pesar de estas diferencias, la abundancia de los gremios tróficos no varió significativamente entre sistemas (F = 0.311, p = 0.329), temporadas (F = 0.958, p = 0.790) o en la interacción entre ambos factores (F = -1.066, p = 0.072) (tabla 5).
De acuerdo con el análisis SIMPER, los sistemas mostraron una disimilitud de 80.9% en la abundancia de especies, 55.95% fue contribuido por D. petenense, C. aguadulce, B. ronchus, B. marinus, T. helleri y M. atlanticus. El análisis entre temporadas indicó que nortes y estiaje tuvieron menor porcentaje de disimilitud con 79.7%; D. petenense, C. aguadulce, T. helleri, B. marinus, B. ronchus y D. anale contribuyeron con un 51.95%. Estiaje y lluvias presentaron una disimilitud de 81.09%, 55.69% fue por la abundancia de D. petenense, M. atlanticus, C. aguadulce, B. marinus, B. ronchus. Entre nortes y lluvias se obtuvo 82.09% de disimilitud, las abundancias de M. atlanticus, C. aguadulce, D. petenense, T. helleri y B. ronchus contribuyeron con 52.04%.
El análisis del MLGM se realizó con las abundancias específicas, debido a que fue la única característica de la comunidad que mostró diferencias significativas entre temporadas. Los resultados revelaron que la transparencia, la temperatura, la salinidad, el oxígeno disuelto y el pH fueron las variables ambientales con mejor predicción de la variación temporal de la abundancia de especies (tabla 6).
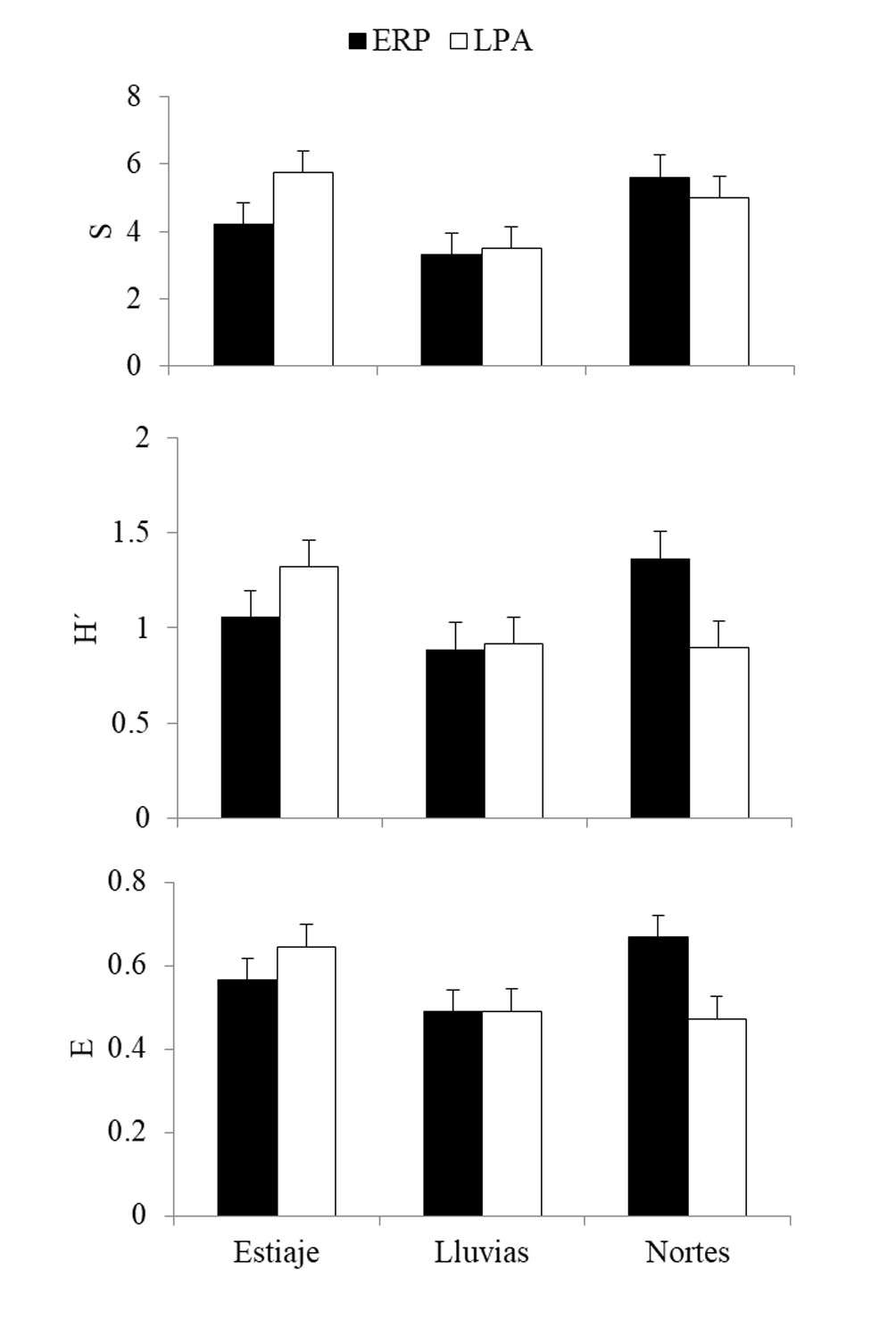
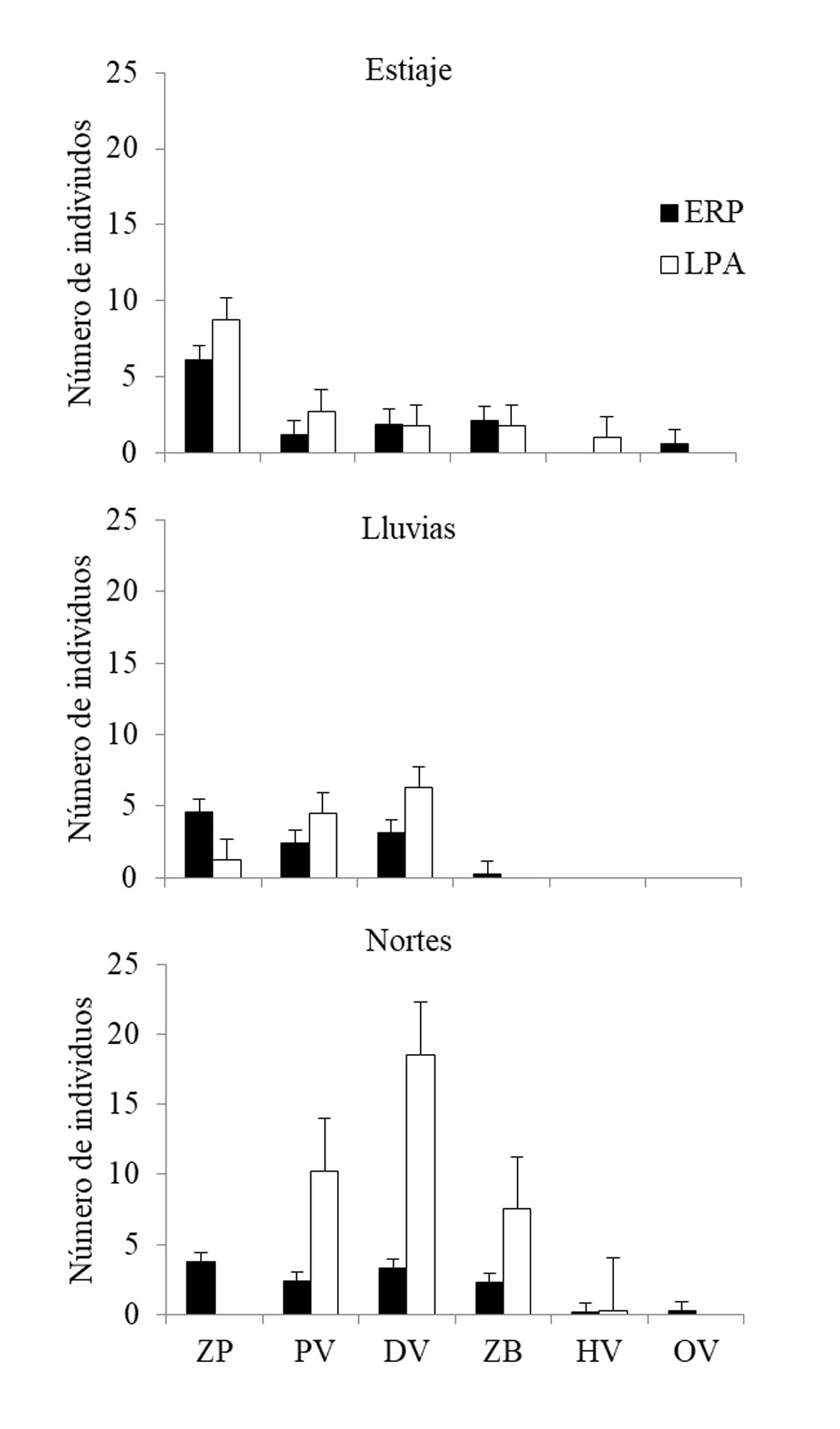
Tabla 3
Ictiofauna registrada en sistemas fluvio lagunares estuarinos Pom-Atasta y Palizada. Abundancia (n), abundancia relativa (A.R.), frecuencia de aparición (F.A.). Gremios tróficos (G. T.): piscívoro (PV), zooplanctívoros (ZP), omnívoros (OV), herbívoros (HV), zoobentívoros (ZB), detritívoro (DV). Aparición por temporadas (A. T.): lluvias (Ll), nortes (N), estiaje (E). *Especies introducidas.
|
Familia |
Especie |
n |
A.R. (%) |
F.A. (%) |
G.T. |
A. T. |
|
Lepisosteidae |
Atractosteus tropicus |
4 |
0.66 |
1.33 |
PV |
N |
|
Elopidae |
Elops saurus |
6 |
0.99 |
4.00 |
PV |
Ll N E |
|
Megalopidae |
Megalops atlanticus |
26 |
4.31 |
5.33 |
PV |
Ll N |
|
Engraulidae |
Cetengraulis edentulus |
1 |
0.16 |
0.66 |
HV |
N |
|
Clupeidae |
Dorosoma anale |
35 |
5.80 |
4.66 |
ZP |
Ll N E |
|
Clupeidae |
Dorosoma petenense |
150 |
24.87 |
8.00 |
ZP |
Ll N E |
|
Cyprinidae |
*Cyprinus carpio |
7 |
1.16 |
1.33 |
OV |
N E |
|
Catostomidae |
Ictiobus meridionalis |
3 |
0.50 |
0.67 |
ZB |
N |
|
Characidae |
Astyanax sp. |
6 |
1.00 |
1.33 |
OV |
N E |
|
Loricariidae |
*Pterygoplichthys disjunctivus |
2 |
0.33 |
1.33 |
DV |
N |
|
Loricariidae |
*Pterygoplichthys pardalis |
7 |
1.16 |
4.67 |
DV |
Ll N E |
|
Ariidae |
Bagre marinus |
26 |
4.31 |
6.67 |
ZB |
Ll N E |
|
Ariidae |
Cathorops aguadulce |
61 |
10.11 |
8.00 |
ZB |
Ll N E |
|
Ariidae |
Cathorops kailolae |
1 |
0.17 |
0.67 |
ZB |
E |
|
Ariidae |
Ariopsis felis |
7 |
1.11 |
3.33 |
ZB |
Ll N E |
|
Batrachoididae |
Opsanus betta |
2 |
0.33 |
1.33 |
ZB |
N |
|
Eleotridae |
Gobiomorus dormitor |
3 |
0.50 |
1.33 |
ZB |
N |
|
Gobiidae |
Lophogobius cyprinoides |
1 |
0.17 |
0.67 |
ZB |
N |
|
Mugilidae |
Mugil curema |
13 |
2.16 |
4.00 |
DV |
Ll N E |
|
Mugilidae |
Mugil sp. |
1 |
0.17 |
0.67 |
DV |
Ll |
|
Cichlidae |
Mayaheros urophthalmus |
3 |
0.50 |
2.00 |
ZB |
N E |
|
Cichlidae |
*Oreochromis niloticus |
2 |
0.33 |
1.33 |
OV |
N E |
|
Cichlidae |
Oscura heterospila |
2 |
0.33 |
1.33 |
ZB |
N E |
|
Cichlidae |
*Parachromis managuensis |
1 |
0.17 |
0.67 |
PV |
N |
|
Cichlidae |
Petenia splendida |
1 |
0.17 |
0.67 |
PV |
E |
|
Cichlidae |
Thorichthys helleri |
38 |
6.30 |
8.67 |
ZB |
Ll N E |
|
Poeciliidae |
Poecilia kykesis |
1 |
0.17 |
0.67 |
DV |
N |
|
Poeciliidae |
Poecilia mexicana |
70 |
11.61 |
2.00 |
DV |
N E |
|
Carangidae |
Caranx hipos |
1 |
0.17 |
0.67 |
ZB |
E |
|
Carangidae |
Caranx latus |
2 |
0.33 |
1.33 |
PV |
N E |
|
Carangidae |
Oligoplites saurus |
13 |
2.16 |
2.67 |
PV |
Ll E |
|
Achiridae |
Trinectes maculatus |
6 |
1.00 |
1.33 |
ZB |
N E |
|
Centropomidae |
Centropomus poeyi |
2 |
0.33 |
1.33 |
PV |
N |
|
Centropomidae |
Centropomus undecimalis |
30 |
4.98 |
5.33 |
PV |
N E |
|
Gerreidae |
Diapterus auratus |
2 |
0.33 |
0.67 |
ZB |
N |
|
Gerreidae |
Eugerres mexicanus |
1 |
0.17 |
0.67 |
ZB |
N |
|
Gerreidae |
Eugerres plumieri |
13 |
2.16 |
1.33 |
ZB |
N E |
|
Tabla 3. Continúa |
||||||
|
Familia |
Especie |
n |
A.R. (%) |
F.A. (%) |
G.T. |
A. T. |
|
Haemulidae |
Rhonciscus crocro |
2 |
0.33 |
1.33 |
ZB |
E |
|
Sciaenidae |
Bairdiella chrysoura |
1 |
0.17 |
0.67 |
PV |
N |
|
Sciaenidae |
Bairdiella ronchus |
50 |
8.29 |
5.33 |
PV |
Ll N E |
|
Total |
603 |
100 |
100 |
Tabla 4
Análisis Permanova de 2 vías del efecto de sistemas, temporadas o su interacción sobre la abundancia de especies. SC: Suma de cuadrados; gl: grados de libertad. Valores significativos (p < 0.05) en negritas, obtenidos de 9,999 permutaciones
|
SC |
gl |
F |
p |
|
|
Sistema |
0.393 |
1 |
1.067 |
0.235 |
|
Temporadas |
1.306 |
2 |
1.771 |
0.005 |
|
Interacción |
-1.168 |
2 |
-1.583 |
0.021 |
|
Residuales |
13.282 |
36 |
||
|
Total |
13.814 |
41 |
Tabla 5
Análisis Permanova de 2 vías del efecto de los sistemas, temporadas o su interacción sobre la abundancia de los gremios tróficos. SC: Suma de cuadrados; gl: grados de libertad. Valores obtenidos de 9,999 permutaciones.
|
SC |
gl |
F |
p |
|
|
Sistemas |
0.058 |
1 |
0.311 |
0.790 |
|
Temporadas |
0.360 |
2. |
0.958 |
0.329 |
|
Interacción |
0.401 |
2 |
-1.066 |
0.074 |
|
Residuales |
6.779 |
36 |
||
|
Total |
6.797 |
41 |
|
Tabla 6
Resultados del modelo mixto lineal generalizado para la abundancia de peces por temporada. EE: Error estándar. Valores significativos en negritas (p < 0.05). Criterio de información de Akaike = 607.7; criterio de información bayesiano = 619.9; devianza = 593.7.
|
Estimación |
E.E. |
z |
p |
|
|
Intersección |
-3.136 |
1.110 |
-2.823 |
0.004 |
|
Transparencia (cm) |
0.004 |
0.001 |
2.674 |
0.007 |
|
Temperatura (°C) |
-0.136 |
0.014 |
-9.612 |
< 0.001 |
|
Salinidad (ups) |
-0.418 |
0.078 |
-5.335 |
< 0.001 |
|
pH |
1.490 |
0.177 |
8.379 |
< 0.001 |
|
Oxígeno disuelto (mg/l) |
-0.378 |
0.053 |
-7.094 |
< 0.001 |
Discusión
Los sistemas fluvio-lagunares del delta del río Usumacinta, Pom-Atasta y Palizada, mostraron cambios significativos en la abundancia de peces entre las temporadas. Esta variación se explica por los cambios temporales de la transparencia, temperatura, salinidad, OD y pH. Contrario a la hipótesis planteada, en el presente estudio no se registraron variaciones espaciales significativas en la riqueza, diversidad, equidad, abundancia de especies y de sus gremios tróficos, lo cual indica que la estructura de la comunidad íctica es homogénea entre los sistemas analizados.
La escasa diferenciación en la composición y diversidad íctica del SP y SPA, puede explicarse por la semejanza en las condiciones ambientales que favorece el establecimiento de comunidades con especies afines. Ambos sistemas están alimentados por efluentes del río Usumacinta (Fuentes-Yaco et al., 2001; Muciño-Márquez et al., 2017), desembocan en la misma zona dentro de la laguna de Términos, caracterizada por la presencia de agua salobre y con un patrón de circulación que dificulta el ingreso de agua marina (Medina-Gómez et al., 2015; Ramos-Miranda et al., 2005; Yáñez-Arancibia et al., 2013). En otros sistemas estuarinos tropicales, la falta de diferencias espaciales en la composición de peces se atribuye al alto grado de mezcla entre sistemas (Marval-Rodríguez et al., 2019).
En el presente estudio, la salinidad fue un factor que se relacionó con la variación temporal de la abundancia de peces. Durante el estiaje se registró mayor salinidad e incrementó la abundancia de D. petenense, mientras que durante lluvias la salinidad disminuyó y la especie más abundante fue C. aguadulce. La salinidad se considera esencial en la organización de ictiofauna en los sistemas estuarinos ya que determina la presencia de especies dominantes (Barletta et al., 2005; Molina et al., 2020; Peralta-Meixueiro y Vega-Cendejas, 2011; Sosa-López et al., 2007; Vilar et al., 2011), debido a la presión osmótica que ejerce sobre los peces y a los intervalos de tolerancia de las especies (Sosa-López et al., 2007; Whitfield, 1999). A diferencia de otros sistemas estuarinos, los sitios de colecta en los sistemas fluvio-lagunares son ambientes oligohalinos, esta condición limita la presencia de especies de origen marino (Muciño-Márquez et al., 2014). En cambio, favoreció la presencia de D. petenense, especie de origen vicario con capacidad de soportar ambientes salinos (Castro-Aguirre et al., 1999), así como de C. aguadulce, especie que se ha adaptado a los ambientes estuarinos, su ciclo de vida y sus migraciones se asocian con la temporalidad, mostrando un incremento en su abundancia en la temporada de lluvias (Ayala-Pérez et al., 2008; Ayala-Pérez, Terán-González, Flores-Hernández et al., 2012).
La temperatura y el OD también se relacionaron con las variaciones temporales de la abundancia de peces. La temporada de nortes registró la menor temperatura y mayor concentración de OD, así como mayor abundancia de las especies de las familias Poeciliidae, Gerridae y Atherinopsidae. La temperatura es una variable que se correlaciona con la salinidad y el OD, actúan de manera sinérgica afectando la distribución y abundancia de los peces dulceacuícolas y marinos en los estuarios (Arceo-Carranza y Vega-Cendejas, 2009; Whitfield, 1999). En el sureste de México, el OD incrementa como resultado de las lluvias y los fuertes vientos producidos durante la temporada de nortes (Arceo-Carranza y Vega-Cendejas, 2009; Peralta-Meixueiro y Vega-Cendejas, 2011; Vega-Cendejas y Hernández-de Santilla, 2004). Esta condición se ha relacionado con la presencia y abundancia de los pecílidos, gérridos y aterinópsidos en estuarios de la península de Yucatán (Arceo-Carranza y Vega-Cendejas, 2009; Peralta-Meixueiro y Vega-Cendejas, 2011; Vega-Cendejas y Hernández-de Santilla, 2004).
La transparencia fue otra variable que se relacionó con los cambios temporales de la abundancia de peces. En los estuarios de Florida y el norte de Brasil, la transparencia es un factor que ha condicionado la aparición y abundancia de especies de manera temporal (Barletta et al., 2005; Maes et al., 1998; Paperno y Brodie, 2004; Whitfield, 1999). En la zona de estudio, se registró un incremento en la abundancia de los bagres (familia Ariidae) en lluvias y estiaje, las temporadas con menor transparencia. Los bagres son especies marinas tolerantes a las variaciones en la salinidad, temperatura y turbidez, dependen de los estuarios debido a que realizan migraciones asociadas a la temporada de lluvias para reproducirse y alimentarse en ambientes marinos (Ariopsis felis, B. marinus) y dulceacuícolas (Cathorops spp.) (Mendoza-Carranza, 2003; Reyes-Ramírez et al., 2017; Yáñez-Arancibia y Lara-Domínguez, 1988).
El incremento de la abundancia de peces durante la temporada de nortes puede explicarse por el ciclo de vida de las especies y la migración hacia el estuario en búsqueda de refugio, o con fines reproductivos y alimentarios (Arceo-Carranza y Vega-Cendejas, 2009; Ayala-Pérez, Terán-González, Flores-Hernández et al., 2012). Por ejemplo, P. mexicana es una especie dulceacuícola que coloniza nuevos hábitats con fines reproductivos al incrementar el volumen de agua por las lluvias (Miller, 2009). Centropomus undecimalis es una especie catádroma, cuyos organismos juveniles (LP < 30 cm) ingresan a los ambientes estuarinos en la temporada de nortes para obtener protección y alimentación (Hernández-Vidal, et al., 2014; Perera-García et al., 2011). Bairdiella ronchus y B. chrysoura son especies marinas que ingresan a los sistemas fluvio-lagunares estuarinos adyacentes a laguna de Términos, incluido el SP, en búsqueda de alimento y refugio durante estas temporadas (Ayala-Pérez et al., 1995).
Aunque los gremios tróficos no presentaron diferencias significativas espaciales y temporales, los resultados evidencian tendencias en la abundancia de algunos gremios. Por ejemplo, durante la temporada de nortes fueron abundantes los detritívoros, zoobentívoros y piscívoros en el SPA. La abundancia de estos grupos puede explicarse por la disponibilidad de recursos en el sistema. Durante la temporada de lluvias aumenta el aporte de material orgánico proveniente de la descarga de agua y los escurrimientos (Barreiro-Güemes, 1999; Barreiro-Güemes y Aguirre-León, 1999), incrementando la abundancia de los crustáceos y peces detritívoros (Sepúlveda-Lozada et al., 2015; Trinidad-Ocaña et al., 2018). Ambos grupos constituyen un recurso disponible para peces zoobentívoros y piscívoros, como los bagres y el robalo C. undecimalis, respectivamente, que ingresan al sistema para alimentarse (Hernández-Vidal, et al., 2014; Yáñez-Arancibia y Lara-Domínguez, 1988). Un efecto en cascada similar se ha reportado en estuarios del centro de Brasil y África (Ferreira et al., 2019; Figueiredo y Pessanha, 2016; Gnohossou et al., 2013).
El análisis realizado indica que la estructura de la comunidad de peces en los sistemas fluvio-lagunares estuarinos del delta del río Usumacinta cambia de manera temporal y no espacial, como en otros estuarios (Akin et al., 2003; Barletta et al., 2008; Molina et al., 2020; Peralta-Meixueiro y Vega-Cendejas, 2011). Los cambios temporales en la abundancia pueden relacionarse con la tolerancia fisiológica de las especies, con el ciclo de vida y las migraciones realizadas en los sistemas estuarinos. La falta de variaciones espaciales en la estructura de la comunidad, sugiere que la comunidad íctica en los sistemas estuarinos del delta del río Usumacinta es homogénea. En futuros estudios se recomienda analizar al ecosistema desde una perspectiva trófica, esta información permitirá entender la dinámica funcional, determinar los recursos alimentarios, las interacciones y la estructura trófica en los sistemas fluvio-lagunares estuarinos del delta del río Usumacinta.
Agradecimientos
Esta investigación se realizó gracias al financiamiento de los convenios FID-ECOSUR (10004) y ECOSUR-Universidad de San Houston. Edgar Abraham Aragón Flores agradece al Conacyt por la beca otorgada con el número 507741 y al ECOSUR por las instalaciones y material bibliográfico facilitado. Las recolectas se realizaron bajo el permiso de pesca DGOPA.04543.060711. A Luis Enrique Amador del Ángel por su apoyo en campo y experiencia en la zona de estudio, a Mayra Flores, Limber Sigarroa, Alberto Macossay y Jazmín Terán por su apoyo en los muestreos de campo, a Carmen Xochitla por la elaboración del mapa. A José Hernández Nava, director del Área de Protección de Flora y Fauna Laguna de Términos; a Zenón Hernández, Rafael Figueroa, Alma Prieto y Rodolfo García, por su apoyo en la logística en campo y hospitalidad. Los autores agradecen a los revisores anónimos por las sugerencias y comentarios para mejorar la calidad del manuscrito.
Apéndice. Eigeenvalores obtenidos para los 2 primeros ejes en el análisis de componentes principales de las variables ambientales de los sistemas fluvio-lagunares estuarinos del delta del río Usumacinta. En negritas se indican las variables utilizadas en los análisis de correlación. Las variables que presentaron un valor de correlación mayor de 0.95, no fueron consideradas en el modelo lineal.
|
Eje 1 |
Eje 2 |
|
|
Eigeenvalores |
3.156 |
1.882 |
|
Varianza explicada (%) |
31.567 |
18.927 |
|
Variable ambiental |
||
|
Transparencia (cm) |
0.074 |
0.443 |
|
Profundidad (cm) |
0.077 |
0.297 |
|
Oxígeno disuelto (mg/l) |
-0.005 |
0.402 |
|
Temperatura (°C) |
-0.011 |
-0.511 |
|
Conductividad (mS/cm) |
0.545 |
-0.023 |
|
Salinidad (ups) |
0.534 |
-0.013 |
|
Sólidos totales disueltos (mg/l) |
0.545 |
-0.028 |
|
pH |
0.284 |
0.048 |
|
Velocidad de corriente (mph) |
-0.148 |
0.019 |
|
Clorofila a (µg/l) |
-0.065 |
0.536 |
Referencias
Akin, S., Winemiller, K. O. y Gelwick, F. P. (2003). Seasonal and spatial variations in fish and macrocrustacean assemblage structure in Mad Island Marsh estuary, Texas. Estuarine, Coastal and Shelf Science, 57, 269–282. https://doi.org/10.1016/S0272-7714(02)00354-2
Amezcua-Linares, F. y Yáñez-Arancibia A. (1980). Ecología de los sistemas fluvio-lagunares asociados a la laguna de términos. El hábitat y estructura de las comunidades de peces. Anales del Centro de Ciencias del Mar y Limnología-UNAM, 7, 69–117.
Anderson, M. J. (2001). A new method for non-parametric multivariate analysis of variance. Australian Ecology, 26, 32–46. https://doi.org/10.1111/j.1442-9993.2001.01070.pp.x
Arceo-Carranza, D. y Vega-Cendejas, M. E. (2009). Spatial and temporal characterization of fish assemblages in a tropical coastal system influenced by freshwater inputs: Northwestern Yucatan peninsula. Revista de Biología Tropical, 57, 89–103.
Armbruster, J. W. y Lawrence, M. P. (2006). Redescription of Pterygoplichthys punctatus and description of a new species of Pterygoplichthys (Siluriformes: Loricariidae). Neotropical Ichthyology, 4, 401–409. https://doi.org/10.1590/S1679-62252006000400003
Ayala-Pérez, L. A., Aguirre-León A., Avilés-Alatriste, M. T., Barreiro-Güemes, M. T. y Rojas-Galaviz, J. L. (1993). Peces de sistemas fluvio-lagunares, laguna de Términos, Campeche. En S. I. Salazar-Vallejo y N. E. Gonzales (Eds.), Biodiversidad marina y costera de México (pp. 596–608). México D.F.: Conabio y CIQRO.
Ayala-Pérez, L. A., Pérez-Vázquez A. y Aguirre-León A. (1995). Abundancia nictemareal de corvinas (Pisces: Sciaenidae) en un sistema costero del sur del golfo de México. Hidrobiológica, 5, 37–44.
Ayala-Pérez, L. A., Ramos-Miranda, J., Flores-Hernández, D., Vega-Rodríguez, B. I. y Moreno-Medina, U. C. (2008). Biological and ecological characterization of the catfish Cathorops melanopus off the west coast of Campeche, Mexico. Ciencias Marinas, 34, 453–465.
Ayala-Pérez, L. A., Terán-González, G. J., Flores-Hernández, D., Ramos-Miranda, J. y Sosa-López, A. (2012). Variabilidad espacial y temporal de la abundancia y diversidad de la comunidad de peces en la costa de Campeche, México. Latin American Journal of Aquatic Research, 40, 63–78.
Ayala-Pérez, L. A., Terán-González, G. J., Ramos-Miranda, J. y Flores-Hernández, D. (2012). Interannual changes in the fish community abundance on the west coast of Campeche, Mexico. Ciencias Marinas, 38, 395–410.
Barletta, M., Amaral, C. S., Corrêa, M. F. M., Guebert, F., Dantas, D. V., Lorenzi, L. et al. (2008). Factors affecting seasonal variations in demersal fish assemblages at an ecocline in a tropical-subtropical estuary. Journal of Fish Biology, 73, 1314–1336. https://doi.org/10.1111/j.1095-8649.2008.02005.x
Barletta, M., Barletta-Bergan, A., Saint-Paul, U. y Hubold, G. (2005). The role of salinity in structuring the fish assemblages in a tropical estuary. Journal of Fish Biology, 66, 45–72. https://doi.org/10.1111/j.0022-1112.2005.00582.x
Barreiro-Güemes, M. T. (1999). Aporte de hojarasca y renovación foliar del manglar en un sistema estuarino del Sureste de México. Revista de Biología Tropical, 47, 729–737.
Barreiro-Güemes, M. T. y Aguirre-León, A. (1999). Distribución espacio-temporal de la biomasa fitoplanctonica en el sistema lagunar Pom-Atasta, Campeche, México. Revista de Biología Tropical, 47, 27–35.
Beck, M. W., Heck Jr., K. L., Able, K. W., Childers, D. L., Eggleston, D. B., Gillanders, B. M. et al. (2001). The identification, conservation, and management of estuarine and marine nurseries for fish and invertebrates. BioScience, 51, 633–641. https://doi.org/10.1641/0006-3568(2001)051[0633:TICAMO]2.0.CO;2
Betancur, R. R. y Willink, P. W. (2007). A new freshwater ariid (Otophysi: Siluriformes) from the Río Usumacinta Basin. Copeia, 4, 818–828.
Castro-Aguirre, J. L., Espinosa-Pérez, H. y Schmitter-Soto J. J. (1999). Ictiofauna estuarino-lagunar y vicaria de México. Ciudad de México: Limusa-Noriega.
Clarke, K. R. y Warwick, R. M. (1994). Change in marine communities: an approach to statistical analysis and interpretation. Londres: Natural Environment Research Council.
Conagua (Comisión Nacional del Agua). (2018). Banco Nacional de Datos (BANDAS). Recuperado en noviembre 16 2018. http://www.conagua.gob.mx/CONAGUA07/Contenido/Documentos/Portada%20BANDAS.htm
Davis, J. C. (1986). Statistics and data analysis in Geology. New York: John Wiley & Sons.
Elliot, M., Whitefield, A. K., Potter, I. C., Blaber, S. J. M., Cyrus, D. P., Nordlie. F. G. et al. (2007). The guild approch to categorizing estuarine fish assamblages: a global review. Fish and Fisheries, 8, 241–268. https://doi.org/10.1111/j.1467-2679.2007.00253.x
Ferreira, V., Le, F., Ménard, F. y Frédou, T. (2019). Composition of the fish fauna in a tropical estuary: the ecological guild approach. Scientia Marina, 83, 133–142. https://doi.org/10.3989/scimar.04855.25A
Figueiredo, G. G. A. A. y Pessanha, A. L. M. (2016). Comparative study of trophic organization of juvenile fish assemblages of three tidal creeks in a tropical semi-arid estuary. Journal of Fish Biology, 89, 680–695. https://doi.org/10.1111/jfb.12844
Froese, R. y D. Pauly (Eds.). (2018). FishBase. World Wide Web electronic publication. Recuperado en agosto 15 de 2018. www.fishbase.org
Fuentes-Yaco, C., Salas-de Léon, D. A., Monreal-Gómez, M. A. y Vera-Herrera, F. (2001). Environmental forcing in a tropical estuarine ecosystem: the Palizada river in the southern Gulf of Mexico. Marine and Freshwater Research, 53, 735–744. https://doi.org/10.1071/MF00077
Gnohossou, P., Lalèyè, P., Atachi, P., Magali, G., Villanueva, M. C. y Moreau, J. (2013). Temporal variations in the food habits of some fish species in Lake Nokoué, Benin. African Journal of Aquatic Science, 38, 43–47. https://doi.org/10.2989/16085914.2013.792768
Hammer, Ø., Harper, D. A. T. y Ryan, P. D. (2001). PAST: Paleontological Statistics software package for education and data analysis. Palaeontologia Electronica, 4.
Hernández-Vidal, U., Chiappa-Carrara, X. y Contreras-Sánchez, W. (2014). Reproductive variability of the common snook, Centropomus undecimalis, in environments of contrasting salinities interconnected by the Grijalva-Usumacinta fluvial system. Ciencias Marinas, 40, 173–185. https://doi.org/10.7773/cm.v40i3.2381
Maes, J., Taillieu, A., Van Damme P. A., Cottenie, K. y Olliver, F. (1998). Seasonal patterns in the fish and crustacean community of a turbid temperate estuary (Zeeschelde estuary, Belgium). Estuarine, Coastal and Shelf Science, 47, 143–151. https://doi.org/10.1006/ecss.1998.0350
Marceniuk, A. P. y Betancur, R. R. (2008). Revision of the species of the genus Cathorops (Siluriformes: Ariidae) from Mesoamerica and the Central American Caribbean, with description of three new species. Neotropical Ichthyology, 6, 25–44. https://doi.org/10.1590/S1679-62252008000100004
Marval-Rodríguez, Á., Alió-Mingo, J., Carvajal, Y., Altuve, D. y Vizcaíno, G. (2019). Spatio-temporal variation of the ichthyofauna in the estuary from Manamo Channel, Orinoco River Delta, Venezuela. Biología Ciencia y Tecnología, 12, 881–894. http://dx.doi.org/10.22201/fesi.20072082.2019.12.70409
McCullagh, P. y Neider, J. A. (1989). Generalized linear models. 2nd Ed. London: Chapman and Hall.
Medina-Gómez, I., Villalobos-Zapata, G. J. y Herrera-Silveira, J. A. (2015). Spatial and temporal hydrological variations in the inner estuaries of a large coastal lagoon of the southern Gulf of Mexico. Journal of Coastal Research, 316, 1429–1438.
Mellín, C., Bradshaw, C. J. A., Meekan, M. G. y Caley, M. (2010). Environmental and spatial predictors of species richness and abundance in coral reef fishes. Global Ecology and Biogeography, 19, 212–222. https://doi.org/10.1111/j.1466-8238.2009.00513.x
Mendoza-Carranza, M. (2003). The feeding habits of gafftopsail catfish Bagre marinus (Ariidae). Hidrobiológica, 13, 119–126.
Miller, R. R. (2009). Peces dulceacuícolas de México. México D.F.: Conabio/ SIMAC/ ECOSUR/ Consejo de los peces del Desierto, México-Estados Unidos.
Molina, A., Duque, G. y Cogua, P. (2020). Influences of environmental conditions in the fish assemblage structure of a tropical estuary. Marine Biodiversity, 50, 1–13. https://doi.org/10.1007/s12526-019-01023-0
Moreno, C. E. (2001). Métodos para medir la biodiversidad, Vol. 1. Zaragoza, España: M&T-Manuales y Tesis SEA.
Muciño-Márquez, R. E., Figueroa-Torres, M. G. y Aguirre-León, A. (2014). Composición fitoplanctónica en los sistemas fluvio-lagunares Pom-Atasta y Palizada del Este, adyacentes a la laguna de Términos Campeche, México. Acta Biológica Colombiana, 19, 63–84. https://doi.org/10.15446/abc.v19n1.38032
Muciño-Márquez, R. E., Aguirre-León, A. y Figueroa-Torres, M. G. (2017). Evaluación del estado trófico en los sistemas fluvio-lagunares Pom-Atasta y Palizada del Este, Campeche, México. Hidrobiológica, 27, 281–291.
Nusch, E. (1980). Comparison of different methods for chlorophyll and phaeopigment determination. Archiv für Hydrobiologie, 14, 14–36.
Orrell, T. M. (2002). Perciformes. En K. E. Carpenter (Ed.), The living marine resources of the Western Central Atlantic. Volume 2. Bony fishes. Part 1 (Acipenseridae to Grammatidae) (pp. 601–1374). Rome: Food and Agriculture Organization of the United States.
Paperno, R. y Brodie, R. (2004). Effects of environmental variables upon the spatial and temporal structure of fish community in a small, freshwater tributary of the Indian River lagoon, Florida. Estuarine, Coastal and Shelf Science, 61, 229–241. https://doi.org/10.1016/j.ecss.2004.05.002
Peralta-Meixueiro, M. A. y Vega-Cendejas, M. E. (2011). Spatial and temporal structure of fish assemblages in a hyperhaline coastal system: Ría Lagartos, Mexico. Neotropical Ichthyology, 9, 673–682. https://doi.org/10.1590/S1679-62252011005000033
Perera-García, M. A., Mendoza-Carranza, M., Contreras-Sánchez, W. M., Huerta-Ortíz, M. y Pérez-Sánchez, E. (2011). Reproductive biology of common snook Centropomus undecimalis (Perciformes : Centropomidae) in two tropical habitats. Revista de Biología Tropical, 59, 669–681.
Press, W. H., Teukolsky, S.A., Vetterling, W. T. y Flannery, B. P. (1992). Numerical recipes. New York: Cambridge University Press.
Quinn, G. P. y Keough, M. J. (2002). Experimental design and data analysis for biologists. New York: Cambridge University Press. https://doi.org/10.1017/CBO9780511806384
R Core Team. (2018). R: a language and environment for statistical computing. Vienna, Austria: R Foundation for Statistical Computing. https://www.R-project.org/
Ramos-Miranda, J., Quiniou, L., Flores-Hernández, D., Do-Chi, T., Ayala-Pérez, L. y Sosa-López, A. (2005). Spatial and temporal changes in the nekton of the Terminos Lagoon, Campeche, Mexico. Journal of Fish Biology, 66, 513–530. https://doi.org/10.1111/j.0022-1112.2005.00619.x
Ramos-Miranda, J., Mouillot, D., Sosa-López, A., Do Chi, T. y Flores-Hernández, D. (2008). How much variation can be explained by seasonal, spatial and environmental effects in nekton assemblages of the Términos Lagoon? Aquatic Conservation: Marine and Freshwater Ecosystems, 18, 508–517. https://doi.org/10.1002/aqc.873
Reyes-Ramírez, H., Florido, R., Álvarez-Pliego, N., Sánchez, A. J. y Salcedo, M. Á., (2017). Hábitos alimenticios de Cathorops aguadulce (Siluriformes: Ariidae) en un ecosistema estuarino al sur del golfo de México. Hidrobiológica, 27, 163–173. https://doi.org/10.24275/uam/izt/dcbs/hidro/2017v27n2/Florido
Schultz, R. J. y Miller R. R. (1971). Species of the Poecilia sphenops complex (Pisces: Poeciliidae) in Mexico. Copeia, 2, 282–290. https://doi.org/10.2307/1442828
Sepúlveda-Lozada, A., Mendoza-Carranza, M., Wolff, M., Saint-Paul, U. y Ponce-Mendoza, A. (2015). Differences in food web structure of mangroves and freshwater marshes: evidence from stable isotope studies in the Southern Gulf of Mexico. Wetlands Ecology and Management, 23, 293–314. https://doi.org/10.1007/s11273-014-9382-2
Sepúlveda-Lozada, A., Saint-Paul, U., Mendoza-Carranza, M., Wolff, M. y Yánez-Arancibia, A. (2017). Flood pulse induced changes in isotopic niche and resource utilization of consumers in a Mexican floodplain system. Aquatic Sicience, 79, 587–616. https://doi.org/10.1007/s00027-017-0520-9
Simier, M., Blanc, L., Aliaume, C., Diouf, P. S. y Albaret, J. J. (2004). Spatial and temporal structure of fish assemblages in an “inverse estuary”, the Sine Saloum system (Senegal). Estuarine, Coastal and Shelf Science, 59, 69–86. https://doi.org/10.1016/j.ecss.2003.08.002
Sosa-López, A., Mouillot, D., Ramos-Miranda, J., Flores-Hernández, D. y Chi, T. D. (2007). Fish species richness decreases with salinity in tropical coastal lagoons. Journal of Biogeography, 34, 52–61. https://doi.org/10.1111/j.1365-2699.2006.01588.x
Trinidad-Ocaña, C., Juárez-Flores, J., Sánchez, A. L. y Barba-Macías, E. (2018). Diversidad de moluscos y crustáceos acuáticos en tres zonas en la cuenca del río Usumacinta, México. Revista Mexicana de Biodiversidad, 89, 65–78. http://dx.doi.org/10.22201/ib.20078706e.2018.0.2387
Vega-Cendejas, M. E. y Hernández-de Santillana, M. (2004). Fish community structure and dynamics in a coastal hypersaline lagoon: Rio Lagartos, Yucatan, Mexico. Estuarine, Coastal and Shelf Science, 60, 285–299. https://doi.org/10.1016/j.ecss.2004.01.005
Vera-Herrera, F., Rojas-Galaviz, J. L., Fuentes-Yaco, C., Ayala-Pérez, L., Álvarez-Guillen, H. y Coronado-Molina, C. (1988). Descripción ecológica del sistema fluvio-lagunar-deltáico del río Palizada. En A. Yáñez-Arancibia y J. W. Day (Ed.). Ecología de los ecosistemas costeros en el sur del golfo de México: la región de la laguna de Términos (pp. 1–27). México D.F.: Universidad Nacional Autónoma de México/ Organización de Estados Americanos.
Vilar, C. C., Spach, H. L. y Joyeux, J. C. (2011). Spatial and temporal changes in the fish assemblage of a subtropical estuary in Brazil: environmental effects. Journal of the Marine Biological Association of the United Kingdom, 91, 655–648. https://doi.org/10.1017/S0025315410001943
Whitfield, A. K. (1999). Ichthyofaunal assemblages in estuaries: a South African case study. Reviews in Fish Biology and Fisheries, 9, 151–186. https://doi.org/10.1023/A:1008994405375
Winemiller, K. O., Agostinho, A. A. y Caramaschi, E. P. (2008). Fish ecology in tropical streams. En D. Dudgeon (Ed.), Tropical stream ecology (pp.107–146). Burlington Massachusetts: Academic Press. https://doi.org/10.1016/B978-012088449-0.50007-8
Yáñez-Arancibia, A. y Lara-Domínguez, A. (1988). Ecology of three sea catfishes (Ariidae) in a tropical coastal ecosystem – Southern Gulf of Mexico. Marine Ecology Progress Series, 49, 215–230.
Yáñez-Arancibia, A., Day, J. W., Lara-Domínguez, A. L., Sánchez-Gil, P., Villalobos-Zapata, G. J. y Herrrera-Silveira, J. A. (2013). Ecosystem functioning: the baisis for sistainable management of Términos Lagoon, Campeche, Mexico. En J. W. Day y A. Yáñez-Arancibia (Eds.), The Gulf of Mexico origin, water and biota. Vol. 4. Ecosystem-based managament (pp. 167–199). Collage Station, Texas: Texas A&M University Press.