Edwin Bedoya-Roqueme a, b, *, Juan Vergara-Negrete b y Jorge Quirós-Rodríguez c
a Laboratório de Ecologia Comportamental de Aracnídeos, Programa de Pós-Graduação em Recursos Naturais do Cerrado,Universidade Estadual de Goiás, Campus de Ciências Exatas e Tecnológicas Henrique Santillo, BR-153 3105 Fazenda Barreiro do Meio, CEP 75132-903 Anápolis, Goiás, Brasil
b Grupo de estudio en Aracnología (PALPATORES), Semillero de Investigación Marinos, Departamento de Biología, Facultad de Ciencias Básicas, Universidad de Córdoba, Cra. 6 # 77-305, Montería, Colombia
c Grupo de Investigación Química de los Productos Naturales, Facultad de Ciencias Básicas, Departamento de Biología, Universidad de Córdoba, Cra.6 # 77-305, Montería, Colombia
*Autor para correspondencia: roquemeedj@gmail.com (E. Bedoya-Roqueme)
Recibido: 8 febrero 2020; aceptado: 27 julio 2020
Resumen
Los pseudoescorpiones son arácnidos que pueden ocupar diferentes microhábitats, algunos especializados. Durante una investigación de pseudoescorpiones, se evaluó la preferencia de microhábitat en bosques de mangle costeros de Córdoba, Caribe colombiano. Un total de 1,063 individuos fueron recolectados, distribuidos en 4 familias y 8 especies. Las especies más frecuentes en cada microhábitat fueron Pachyolpium isolatum (n = 720) y Lechytia chthoniiformis (n =190) y la menos frecuente Parachernes aff. setosus (n = 6). Los estimadores no paramétricos jackknife 1, jackknife 2 y bootstrap indicaron una buena representatividad; se registró 98.9% de la fauna y se estimó un potencial de 11 especies para los fragmentos de bosque de mangle. La hojarasca fue el microhábitat que presentó el mayor promedio de individuos 56 ± 6.7 ind/mes, y el cascajo de coral presentó el menor promedio 1.8 ± 0.9 ind/mes. La salinidad del suelo, su humedad y la humedad de la hojarasca, son las variables que pueden influir significativamente el ensamblaje de pseudoescorpiones en los bosques de mangle. Las medidas de selectividad y/o preferencias establecieron una alta especificidad con cada microhábitat, contando el suelo, la hojarasca y la corteza de árboles, con mayor frecuencia de uso. Estos resultados destacan la importancia de comprender el papel de estos arácnidos en bosques de mangle y permiten incrementar el conocimiento de su ecología, ofreciendo un potencial uso como bioindicadores.
Palabras clave: Ecología; Microhábitat; Distribución; San Antero; Córdoba
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Microhabitat preference of Pseudoscorpiones (Arachnida) in mangrove forests from southern Gulf of Morrosquillo, Colombian Caribbean
Abstract
Pseudoscorpions are arachnids that can occupy different microhabitats, some specialized. During an investigation of pseudoscorpions, the microhabitat preference was evaluated in coastal mangrove forests from Córdoba, Colombian Caribbean. A total of 1,063 individuals were collected, distributed in 4 families and 8 species. The most frequent species in each microhabitat were: Pachyolpium isolatum (n = 720) and Lechytia chthoniiformis (n = 190) and the less frequent one was: Parachernes aff. setosus (n = 6). The non-parametric estimators Jackknife 1, Jackknife 2 and bootstrap indicated good representativeness; 98.9% of the fauna was recorded, and a potential of 11 species was estimated for the mangrove forest fragments. The litter was the microhabitat that presented the highest average of individuals 56 ± 6.7 ind / month, and the coral remains presented the lowest average 1.8 ± 0.9 ind / month. The salinity of the soil, its humidity and the humidity of the litter, are the variables that can significantly influence the assembly of pseudoscorpions in mangrove forests. The measures of selectivity and / or preferences established a high specificity with each microhabitat, counting the soil, the litter and the bark of trees, with the highest frequency of use. These results highlight the importance of understanding the role of these arachnids in mangrove forests and allow increasing knowledge of their ecology, offering potential use as bioindicators.
Keywords: Ecology; Microhabitat; Distribution; San Antero, Córdoba
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
El hábitat es definido como el lugar donde se combinan recursos, condiciones físicas y bióticas, las cuales permiten o fomentan la presencia, la sobrevivencia y reproducción de un organismo (Batzli y Lesieutre, 1991; Garshelis, 2000; Lubin et al., 1993; Morrison et al., 1998, 2008). La preferencia de hábitat puede ser entendida como una consecuencia del uso asimétrico de unos recursos sobre otros, de forma no aleatoria, por parte de cada individuo de una población entre los hábitats potenciales (Krausman, 1999; Morris, 2003; Montenegro y Acosta, 2008). De igual forma, la preferencia de microhábitat puede ser inferida de manera indirecta por medio del uso que hace el organismo de algunos recursos físicos y biológicos (Litvaitis et al., 1994). Asimismo, algunos autores como Montenegro y Acosta (2008) sugieren que la preferencia de hábitat debe ser evaluada como la diferencia entre la proporción relativa de todos los recursos usados y la disponibilidad de los mismos (Underwood et al., 2004).
Los pseudoescorpiones son arácnidos de tamaño reducido presentes en todos los ecosistemas terrestres, excepto en las regiones polares (Harvey, 2013; Weygoldt, 1969). Comúnmente pueden ser encontrados habitando la hojarasca, bajo rocas y piedras, en la corteza de árboles vivos, troncos caídos, en descomposición, y ocupando diferentes zonas en cavernas (Del-Claro y Tizo-Pedroso, 2009; Harvey, 2013; Judson, 2005; Weygoldt, 1969). Este grupo de arácnidos, usualmente son depredadores solitarios, excepto algunas especies que presentan un comportamiento gregario y una especie que se considera cooperativamente social (Del-Claro y Tizo-Pedroso, 2009; Tizo-Pedroso y Del-Claro, 2011).
Estos arácnidos pueden estar asociados con una gran variedad de microhábitat especializados como guano de murciélagos, nidos de hormigas, colmenas de abejas, cuerpos de insectos, aves y mamíferos, partes de plantas y presentando un comportamiento forético con diferentes grupos de invertebrados y vertebrados (Aguiar y Bührnheim, 2003; Andrade y Gnaspini 2002; Cole et al., 1995; Francke y Villegas, 2006; González et al., 2007; Poinar et al., 1998; Weygoldt, 1969; Zeh y Zeh, 1992a, b, 1997). Asimismo, algunos géneros de pseudoescorpiones se consideran exclusivos y han sido reportados de microhábitats halófilos (Gabbutt, 1962; Harvey, 2009; Weygoldt, 1969) y de la vegetación de las costas (Bedoya-Roqueme, 2015; Bedoya-Roqueme y Quirós-Rodríguez, 2018; Bedoya-Roqueme et al., 2016, 2017; Félix-Angulo, 2018; Hoff, 1959; Lee, 1979; Mahnert, 2014; Mahnert y Schuster, 1981).
Los pseudoescorpiones, forman parte de la cadena alimentaria de los suelos y tienen un papel importante como depredadores activos, ofreciendo un uso potencial en el control de plagas (Donovan y Paul, 2005; Read et al., 2014; Weygoldt, 1969). Por lo tanto, es necesario comprender su función dentro de estos ecosistemas (Briano et al., 2010). Sin embargo, los mecanismos por los cuales pueden sobrevivir en estos entornos no se conocen completamente (Harvey, 2009; Harvey et al., 2007; Weygoldt, 1969). Los datos ecológicos son muy escasos a pesar de las investigaciones realizadas sobre estos arácnidos en las zonas costeras (Gabbutt, 1962, 1970; Harvey, 2009; Lee, 1979; Mahnert y Schuster, 1981). Los bosques de manglar, son ambientes poco mencionado en la literatura científica sobre el grupo y son escasos los conocimientos ecológicos que se tienen sobre pseudoescorpiones en estos microhábitats (Bedoya-Roqueme et al., 2016; Judson, 2016; Mahnert, 2014). Se deben considerar los altos valores de riqueza y productividad que tienen los manglares, a pesar de la pobreza de sus suelos (INVEMAR, 2012). Además, debe tenerse en cuenta que los manglares del sur del golfo de Morrosquillo son los terceros más grandes y uno de los mejor conservados de la región (CVS-INVEMAR, 2010; Quirós-Rodríguez y Arias, 2013). Asimismo, para la fauna de pseudoescorpiones de bosques de mangle en el sur del golfo de Morrosquillo solo se han abordados aspectos ecológicos relacionados con su estructura y composición, proporción sexual, estableciendo marcos de referencia para posteriores investigaciones (Bedoya-Roqueme y Quirós-Rodríguez, 2019; Bedoya-Roqueme et al., 2016, 2017).
Los invertebrados, frecuentemente se han considerado como bioindicadores ambientales y ecológicos particularmente buenos, debido a su pequeño tamaño pueden ser sensibles a las condiciones locales, mientras que su movilidad les permite moverse en respuesta a las condiciones cambiantes (Gerlach et al., 2013). Adicionalmente, constituyen una cantidad sustancial de biodiversidad de especies y son un componente funcionalmente significativo de la biodiversidad, y en las últimas décadas se han convertido en un activo importante en la ecología del paisaje y herramientas de conservación (Gerlach et al., 2013; McGeoch et al., 2011). Dentro de los arácnidos diferentes grupos han sido usados para evaluar las condiciones del ambiente (e.g., arañas, ácaros, escorpiones, opiliones y pseudoescorpiones), siendo utilizados como indicadores de características específicas del hábitat o sus cambios (Gerlach et al., 2013). De igual forma, los considerados ordenes menores (e.g., Uropygi, Schizomida, Amblypygi) se han empleado en el monitoreo de recuperación posterior a incendios en ambientes naturales (Broza et al., 1993; Gerlach et al., 2013). Sin embargo, los pseudoescorpiones debido a su pequeño tamaño corporal, han sido utilizados escasamente en la literatura para evaluar su preferencia de microhábitat o su potencial uso como bioindicadores, debido a que son generalmente escasos y difíciles de identificar a nivel especifico (Gerlach et al., 2013). A pesar de lo anterior, algunos autores han reportado cierta sensibilidad a los cambios por actividades antrópicas, con mayores valores de abundancia en ambientes con mayor equilibrio ecológico y buena calidad del suelo (Barros et al., 2010; Lencinas et al., 2015; Ranius et al., 2011; Yamamoto et al., 2001). Por lo tanto, en este estudio se evaluó la preferencia de microhábitat de pseudoescorpiones en ambientes marinos costeros como los bosques de mangle en el sur del golfo de Morrosquillo del Caribe colombiano, esperando establecer como diferentes variables fisicoquímicas pueden influir en la ocurrencia de ciertas especies en cada microhábitat y encontrar cierta especificidad de las especies en cada microhábitat registrado.
Materiales y métodos
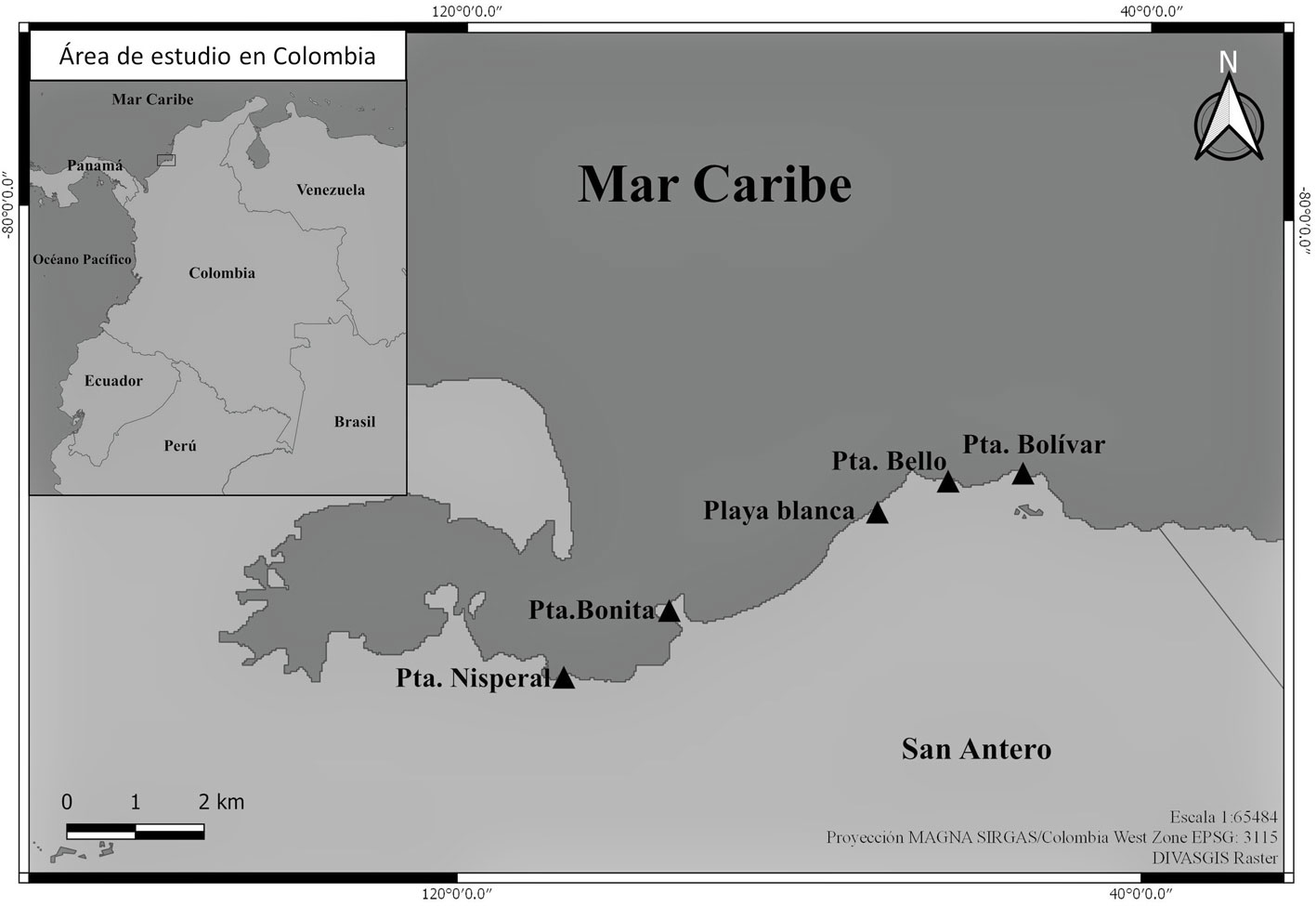
El estudio se llevó a cabo entre los meses de marzo de 2014 y octubre de 2017, en 5 fragmentos de bosque de mangle sobre la línea de costa del municipio de San Antero (9°24’34,29” N, 75°45’20,95” O), departamento de Córdoba, Caribe colombiano (fig. 1). El régimen de lluvias de la zona se ajusta a un patrón unimodal biestacional, presentando una estación seca (diciembre a marzo) y una estación lluviosa (abril a noviembre), siendo el mes de julio donde hay una disminución de las precipitaciones, con un promedio temperatura anual que varía entre 28 y 32.9 °C y la precipitación anual promedio es de 1,337.4 mm (Cortes y Rangel, 2011; CVS-INVEMAR 2010).
La selección de los sitios obedece a su fácil acceso, a la estructura vegetal y al estado de conservación, como se describe a continuación: fragmento de Punta Bolívar, constituido por un monoespecífico bosque de Rhizophora mangle Linneo, localizado frente al mar, ocupa la cuenca posterior de la barra de arena de la costa, altura máxima del dosel de 12 m y DAP (diámetro altura del pecho) máximo de 35 cm (Bedoya-Roqueme et al., 2016; CVS-INVEMAR, 2010). Fragmento de Punta Bello, está compuesto por un bosque, entre joven y maduro, de R. mangle, Laguncularia racemosa, Gaetner y en menor proporción de Conocarpus erectus Linneo; altura máxima del dosel de 7 m y con algunos arbustos y enredaderas (Bedoya-Roqueme et al., 2016; CVS-INVEMAR, 2010). Fragmento de Playa Blanca, conformado por un bosque maduro, de borde, frente al mar y ocupando la cuenca detrás de la barra de arena, con estructura vegetal más compleja y heterogénea, apertura vegetal grande, entre la línea de borde y las zonas inundables con dominio de Avicennia germinans Linneo y presencia de R. mangle, L. racemosa y C. erectus; máxima altura del dosel de 8 m (Bedoya-Roqueme et al., 2016; CVS-INVEMAR, 2010). Fragmento de Punta Bonita, presenta un bosque maduro, compuesto por R. mangle ubicado en la barra de arena frente al mar y L. racemosa en la parte posterior (Bedoya-Roqueme et al., 2016; CVS-INVEMAR, 2010). Fragmento de Punta Nisperal, está constituido por un bosque maduro, limita con el sistema estuarino de la bahía de Cispatá, presenta algunos remanentes de R. mangle en la línea de costa y un área de regeneración de L. racemosa; esta zona ha sufrido procesos de fragmentación (Bedoya-Roqueme et al., 2016; CVS-INVEMAR, 2010).
En cada fragmento de bosque de mangle, se definieron 4 tipos de microhábitat (fig. 2): restos de coral, corteza, hojarasca y suelo (Adis et al., 1988; Gabbutt, 1970). Utilizando la búsqueda libre sin restricciones, 3 colectores con un tiempo efectivo de 60 min/colector, a través de la colecta manual realizaron el muestreo directo de los individuos, los cuales, fueron depositados en frascos y conservados en alcohol 70% (Mahnert y Adis, 2002). Se utilizó un cuadrante de 1 m2 como unidad de muestreo para la recolección de la hojarasca y del suelo, para este último se consideró una profundidad de 0-10 cm, método replicado 3 veces para cada sector de estudio, para un total de 15 unidades muestrales por mes, con un rango de 97.01-195 g de hojarasca y 445-610 g de suelo; posteriormente, los pseudoescorpiones se extrajeron utilizando el embudo Berlese (Gabbutt, 1970). Como método complementario, se examinó al azar la corteza de 20 árboles por sector, asimismo, se realizaron anotaciones ecológicas de la fauna asociada en cada microhábitat para la disponibilidad de recursos (Bedoya-Roqueme et al., 2016).
Se analizaron 4 variables fisicoquímicas: humedad de la hojarasca, humedad de la corteza, humedad del suelo y salinidad del suelo, las cuales, se consideraron las más importantes y que podrían influir en la comunidad de pseudoescorpiones en cada uno de los fragmentos de bosque de mangle evaluados (Weygodlt, 1969). Para determinar la humedad del suelo se utilizó un nucleador o cilindro de 50 mm de diámetro y 100 mm de longitud, a una profundidad de 0-10 cm para la obtención de las muestras de cada monolito donde se colectó la hojarasca (Sánchez et al., 2010). Las muestras fueron llevadas y procesadas en el laboratorio, donde se sometieron a procesos de secado en un horno a 115 °C por un tiempo de 24 horas. Posteriormente, se procedió a pesar la muestra seca y para obtener el porcentaje de humedad, expresada como porcentaje entre el peso del agua en una determinada masa de suelo y el peso seco, se utilizó la diferencia entre peso seco y peso húmedo (Bastienne et al., 2001). Asimismo, para determinar la humedad de la hojarasca, se obtuvo una muestra aproximadamente de 50cm2 empleando un cuadrante de igual dimensión, las muestras fueron depositadas en bolsas selladas, cubiertas en papel y depositadas en bolsas oscuras para evitar la pérdida de humedad, posteriormente, se llevaron a laboratorio y se procesaron siguiendo el protocolo empleado en el secado del suelo. Para realizar la medición de la salinidad de suelo, se midió la conductividad eléctrica, debido a que, determinar la conductividad eléctrica es por tanto una forma de medir indirectamente la salinidad; para ésto, la muestra se diluyó en agua destilada proporción 1:1 y se analizó en el laboratorio utilizando un conductímetro marca SCHOTT (Etchevers, 1998; Muñoz et al., 2000; Topp, 1993; Willard et al., 1974).
Para la identificación taxonómica, los especímenes se sometieron a procesos de aclaramiento por difusión lenta en ácido láctico al 70% durante aproximadamente 24 horas (disección previa de los apéndices), donde se separaron las patas I y IV, un quelícero y un pedipalpo izquierdo, del cual fue separada la pinza (Judson 1992). Posteriormente, para su estudio, se realizó un montaje temporal en glicerina utilizando un microscopio Carl Zeiss, plus Axiostar, Alemania. Para la identificación a nivel familiar y de género, se utilizaron las claves taxonómicas propuestas por Harvey (1992), Mahnert y Adis (2002), Buddle (2010), Bedoya-Roqueme et al. (2017) y Bedoya-Roqueme (2019). Se siguió principalmente la propuesta taxonómica de Benavides et al. (2019), la cual, relegó a las familias Tridenchthoniidae y Lechytiidae como subfamilias de Chthoniidae, y reunió a la familia Garypinidae con los Larcidae en la superfamilia Garypinoidea. Asimismo, a pesar de presentar algunas inconsistencias con el arreglo taxonómico propuesto por Tooren (2011), con Apolpium Chamberlin, 1930 como miembro de Olpiinae, los resultados moleculares apoyan la colocación de este género junto con Pachyolpium Beier, 1931 en Hesperolpiinae. Por lo tanto, aceptamos la creación de la familia Hesperolpiidae Chamberlin, 1930 como una hermana del grupo de las familias Garypidae y Olpiidae. La principal diferencia son los conductos de veneno cortos de Olpiidae y los largos conductos de veneno de Hesperolpiidae, que generalmente son extremadamente largos (Benavides et al., 2019). Después del estudio, las muestras se enjuagaron con agua destilada y se conservaron en alcohol al 70%; los apéndices disecados se almacenaron en un microvial, en el mismo vial que el resto del animal. Los especímenes identificados fueron depositados en la colección del Laboratorio de Entomología de la Universidad de Córdoba, Montería, Colombia (LEUC) y del Instituto de Ciencias Naturales, Universidad Nacional, Bogotá, Colombia (ICN-UNAL).
Se estimó el número total de individuos (N) y la riqueza (S) para cada microhábitat evaluado. Se construyó una curva de acumulación considerando la cantidad y abundancia de especies observadas en los 40 muestreos realizados en los 5 fragmentos de bosque mangle, para evaluar el esfuerzo de muestreo y la riqueza esperada con los estimadores no paramétricos bootstrap, jackknife 1, jackknife 2 a través del programa EstimateS 9.1.0 (Colwell, 2013). Para establecer el grado de asociación entre los microhábitats en cada época climática, se utilizó el método de pares no ponderados (UPGMA) utilizando la matriz de similitud transformada con la cuarta raíz de Bray y Curtis (1957). Se realizó un análisis de similitud porcentual (SIMPER) para establecer el grado de contribución de cada especie en cada microhábitat para cada época climática utilizando el software PRIMER-E v6 (Clarke y Gorley, 2005).

Para la validación estadística de los valores registrados para cada una de las variables fisicoquímicas, se aplicó aplicaron las pruebas Anova F-Fisher (para distribuciones normales), Kruskall-Wallis (para distribuciones no normales) y la prueba de múltiple rango de Tukey-HSD para evaluar las diferencias entre los sectores, utilizando el software R v.4.0.2 (R Core Team, 2020). Para relacionar la presencia de los pseudoescorpiones en cada microhábitat evaluado con las variables fisicoquímicas (humedad de la hojarasca, humedad de la corteza, humedad del suelo y salinidad del suelo), se realizó un análisis de redundancia (RDA) utilizando el software R v.4.0.2. (R Core Team, 2020). Para inferir el rango de tolerancia de cada especie para cada una de las variables fisicoquímicas evaluadas en cada microhábitat, se construyó un árbol de decisión con un intervalo de confianza de 95%, inicialmente, se creó un modelo de clasificación; seguidamente, para evaluar el modelo se construyó una matriz de confusión, se obtuvo la accuracy, el coeficiente Kappa y fue evaluada con un análisis de McNemar utilizando el software R v.4.0.2. (R Core Team, 2020).
Finalmente, para inferir la preferencia de microhábitat por parte de cada especie de pseudoescorpión en cada microhábitat, se calculó la medida de selectividad utilizando el índice de selectividad de Manly (1974), el cual permite estimar las proporciones de selección, es decir, la misma disponibilidad para todas las especies, pero el uso es medido independientemente para cada especie, asimismo, calcula el uso y la disponibilidad cada especie con un uso y disponibilidad únicos para los movimientos de cada individuo y el uso del hábitat (Manly et al., 2003). El índice de Manly (1974) maneja valores entre 0 y 1, donde, valores iguales a 0 indican que el pseudoescorpión evita y valores próximos a 1 indica preferencia del pseudoescorpión por ese microhábitat. Para establecer la independencia de las especies en cada microhábitat, el índice calcula el Chi-cuadrado (χ2) de Pearson; de igual forma, para evaluar la selección general de microhábitat se calculó la prueba de Chi-cuadrado (χ2); asimismo, el índice, permite realizar una prueba de hipótesis para evaluar si los individuos usan en promedio los recursos en proporción a la disponibilidad, se calculó la prueba de Chi-Cuadrado (χ2) basado en el logaritmo de máxima verosimilitud utilizando el paquete adehabitatHR (Calenge, 2006), en el software R v.4.0.2. (R Core Team, 2020).
Resultados
Un total de 1,063 individuos fueron recolectados, distribuidos en 4 familias y 8 especies; Chernetidae fue la familia más representativa con 3 especies, seguida de Hesperolpiidae con 2 y las restantes familias estuvieron representadas por 1 especie. La especie más abundante fue Pachyolpium isolatum Beier, 1937 (67.7%), seguida de Lechytia chthoniiformis Balzan, 1890 (17.4%), Serianus gratus Hoff, 1964 (6.2%), Planctolpium arboreum Hoff, 1964 (5,3%) y Americhernes reductus Muchmore, 1976 (2.3%), mientras que las especies Paraliochthonius quirosi Bedoya-Roqueme, 2015 (0.5%), Parachernes aff. setosus Beier, 1948 (0.5 %) y Epactiochernes insularum Muchmore, 1974 (0.4%) fueron las menos abundantes.
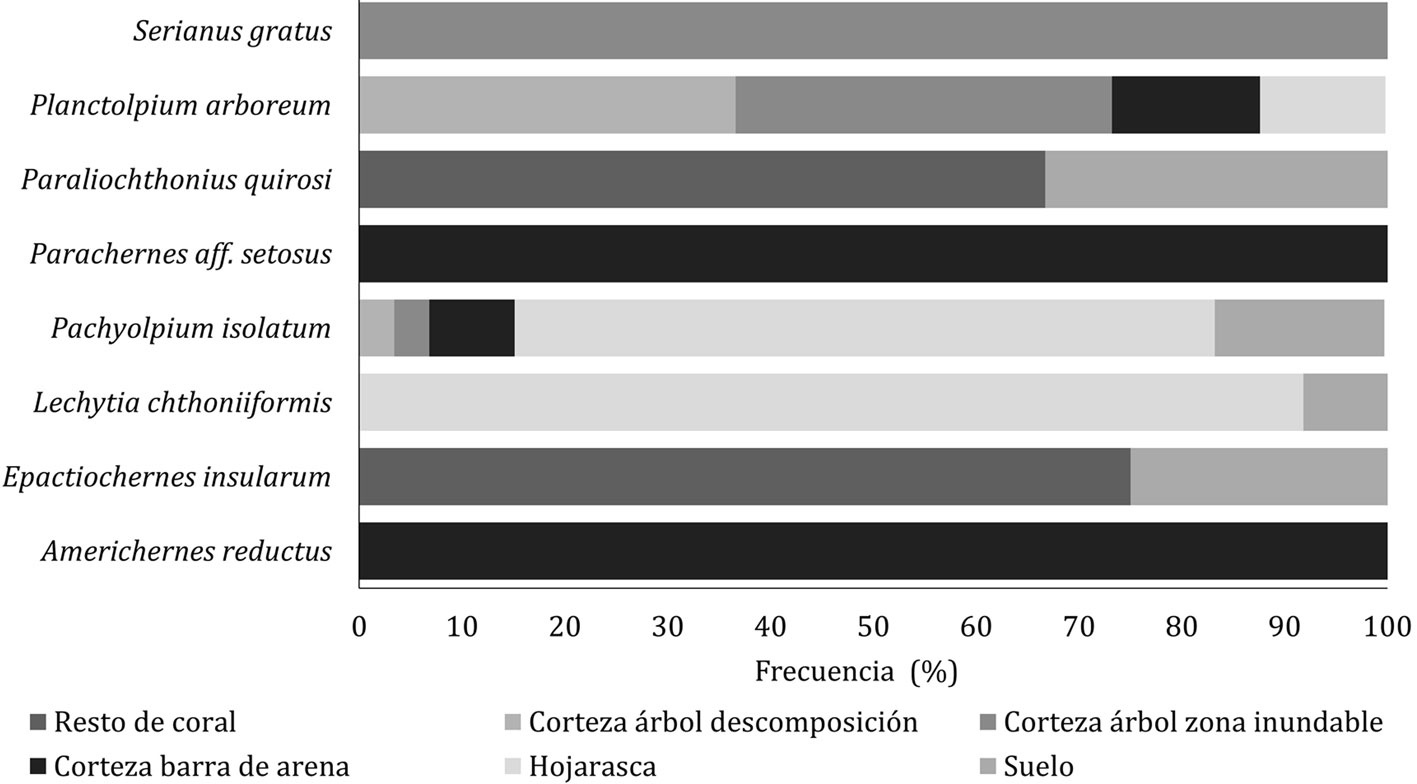
Los valores de abundancia más altos se registraron en la hojarasca (66.4%) con un promedio de 56 ± 6.7
ind./mes, seguido de la corteza (19.2%) con un promedio de 33.3 ± 3.8 ind./mes, suelo (1.2%) con un promedio de 22.8% ± 4.9 ind./mes y el microhábitat de cascajo de coral menos abundante (1.1%) con un promedio de 1.8 ± 0.8 ind./mes (fig. 3). El fragmento de bosque de mangle de Playa Blanca, registró los valores más altos de abundancia en la hojarasca con 379 individuos (36.5%) y 61 individuos en el suelo (5.8%), sin embargo, el fragmento de Punta Bolívar, presentó los valores más altos de abundancia en el microhábitat de corteza 101 individuos (9.7%), siendo Punta Nisperal, quien registró los valores de abundancia más bajos para todos los microhábitats evaluados (tabla 1).
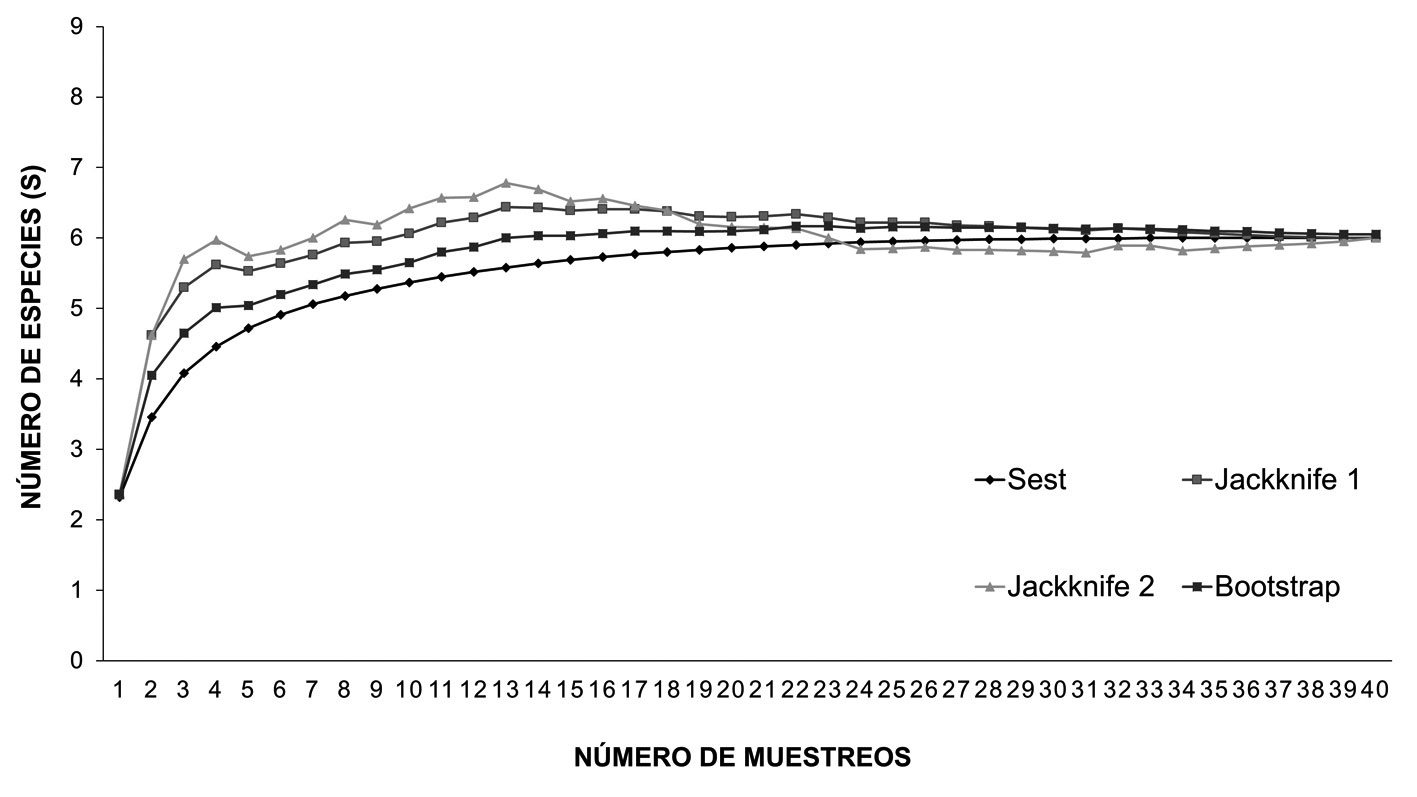
El esfuerzo de muestreo realizado en los 5 fragmentos de manglar evaluados, permitió registrar 98.9% de las especies de pseudoescorpiones, la curva de acumulación de especies presentó una tendencia asintótica, que alcanzó el valor máximo de 8 especies según los estimadores no paramétricos jackknife 1, jackknife 2 y bootstrap respectivamente (fig. 4). Con base en estos estimadores, el valor de riqueza observado es cercano al valor esperado, lo que indica una buena representatividad del muestreo de la comunidad de pseudoescorpiones en los 5 fragmentos de mangle durante los meses de muestreo (fig. 4).
La combinación de 2 métodos de muestreo permitió obtener una riqueza de 8 especies, 6 géneros y 4 familias de pseudoescorpiones (tabla 2). El mayor número de individuos se recolectó a través del procesamiento de embudo Berlese, proporcionando 700 ind./m2 que representan 67.5% de las muestras con un promedio de 5.3 ± 7.3 ind./m2/mes; seguido de la recolección manual con 337 que representa 22.5% con un promedio de 3.5 ± 2.9 ind./mes, 67.5% de los individuos se registraron en la hojarasca y 32.5% en la colecta manual, siendo P. isolatum la especie más dominante recolectada a través de la combinación de las 2 técnicas de colecta, con una representatividad entre 62.3% y 72.6%, respectivamente (tabla 2).
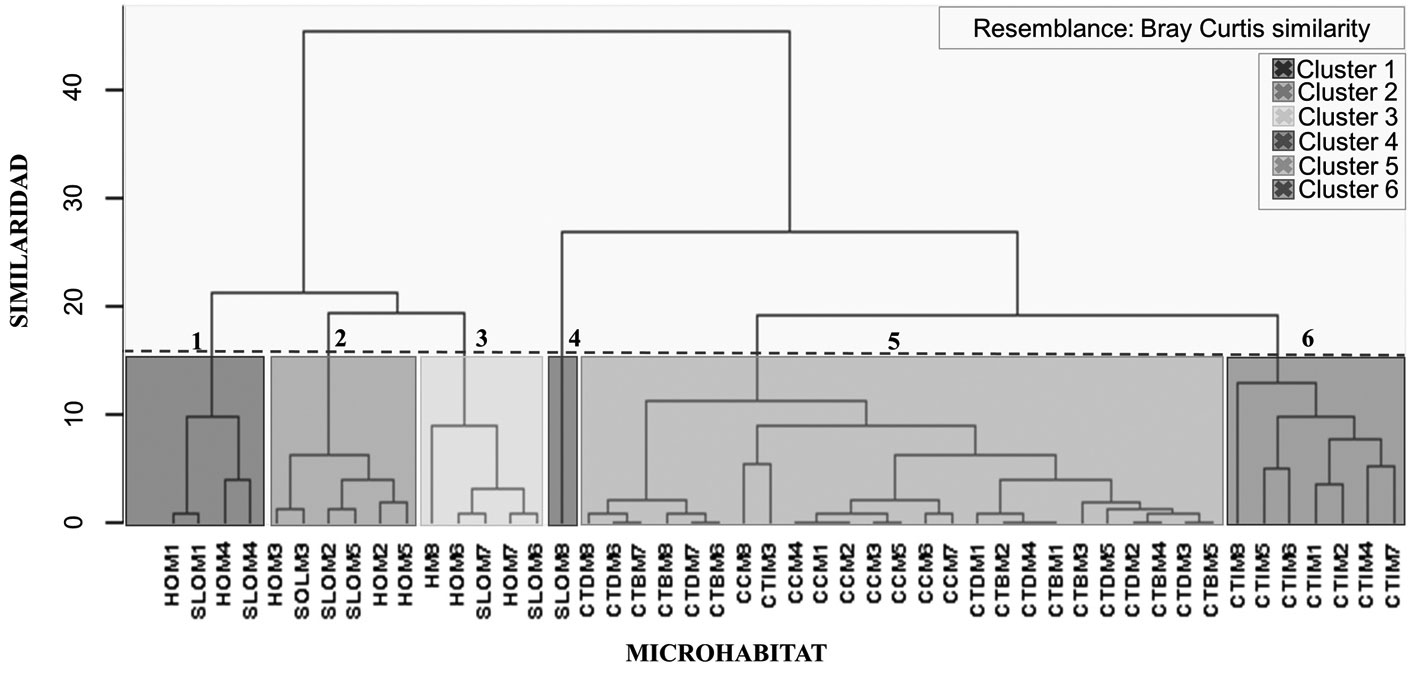
El método de pares no ponderados (UPGMA) creó los grupos con un corte en la escala de similitud de 15% (fig. 5), basado en la matriz de similaridad de Bray y Curtis (1957) y utilizando las épocas climáticas como factores, permitió definir en el muestreo de microhábitat evaluado la formación de 6 grupos distintos (fig. 5). El primer y segundo conglomerado estuvieron conformados por los microhábitats de hojarasca (HO) y suelo (SLO), que corresponden a los meses de época seca, transición y final de transición, e incluyó a las especies L. chthoniiformis, P. isolatum, P. arboreum (fig. 5). De igual forma, el tercer conglomerado estuvo conformado por los microhábitats de hojarasca (HO) y suelo (SLO) que corresponde a los meses de época de lluvia e incluyó a las especies L. chthoniiformis, P. isolatum, P. arboreum (fig. 5). El cuarto conglomerado estuvo conformado solo por el microhábitat de suelo (SLO) y que corresponde a la época de lluvia e incluye a las especies E. insularum y P. quirosi (fig. 5). El quinto conglomerado estuvo conformado por los microhábitats de cascajo de coral (CC), corteza de árbol en barra de arena (CTB), troncos en descomposición (CTD), zonas inundables (CTI) y que corresponden a las 3 épocas climáticas e incluye a las especies A. reductus, P. aff. setosus, E. insularum, P. quirosi, P. arboreum y S. gratus; esta asociación entre los diferentes microhábitats parece indicar que estas especies pueden preferir uno de estos microhábitats como refugio o zona de alimentación (fig. 5). El sexto conglomerado estuvo conformado solo por el microhábitat de zonas inundables (CTI) y que corresponde a todas las épocas climática e incluye a las especies A. reductus y S. gratus, lo cual, puede indicar la exclusividad de estas especies en las zonas inundables del mangle (fig. 5).
Tabla 1
Abundancia promedio (± desviación estándar) para cada microhábitat en cada fragmento de mangle.
| Localidad | |||||
| Microhábitat | Pta. Bolívar | Pta. Bello | Playa Blanca | Pta. Bonita | Pta. Nisperal |
| Restos de coral | 2.1 ± 1.1 | 0 | 4.1 ± 0.3 | 0 | 5.1 ± 3.1 |
| Corteza de árbol | 3.8 ± 2.4 | 2.1 ± 1.1 | 10.2 ± 3.1 | 2.1 ± 1.1 | 3.3 ± 2.3 |
| Hojarasca | 47.3 ± 21.7 | 13.6 ± 11.2 | 12.1 ± 3.2 | 13.1 ± 9.7 | 1.4 ± 0.4 |
| Suelo | 8.2 ± 2.9 | 4.2 ± 1.3 | 5.6 ± 0.6 | 2.25 ± 0.25 | 0 |
Tabla 2
Abundancia relativa para cada una de las técnicas de muestreo.
| Familia/especies | Colecta
manual |
Embudo de Berlese | ||
| N | % | N | % | |
| Chthoniidae | ||||
| Paraliochthonius quirosi | 0 | 0 | 6 | 0.9 |
| Lechytia chthoniiformis | 15 | 4.5 | 170 | 24.3 |
| Chernetidae | ||||
| Americhernes reductus | 25 | 0 | 0 | |
| Epactiochernes insularum | 0 | 0 | 5 | 0.7 |
| Parachernes aff. setosus | 6 | 0 | 0 | 0 |
| Garypinidae | ||||
| Serianus gratus | 66 | 19.6 | 0 | 0 |
| Hesperolpiidae | ||||
| Pachyolpium isolatum | 210 | 62.3 | 508 | 72.6 |
| Planctolpium arboreum | 46 | 13.6 | 11 | 1.6 |
| Total | 337 | – | 700 | – |
| % | 32.5 | – | 67.5 | – |
| N° especies | 4 | – | 5 | – |
El ensamblaje de pseudoescorpiones presentó diferencias entre los 6 conglomerados formados por la especies y los microhábitats en cada una de las épocas climáticas (Anosim; global R = 0.326; p < 0.01), encontrando la principal variación entre los microhábitats para la época seca (Anosim; R = 0.703; p < 0.05) y la época de transición (Anosim; R = 0.147; p < 0.04), sin presentar diferencias relevantes con la época de lluvia (Anosim; R = 0.312; p < 0.02). El análisis de porcentaje de similitud (SIMPER) indicó que, para la época seca, P. isolatum fue la especie que más contribuyó a la similitud y mostró el más alto acumulado (90.5%), es decir, fue la especie más importante en términos de abundancia en casi todos microhábitats evaluados. Para las aguas de transición, fueron las especies L. chthoniiformis y P. isolatum (95.3%), mientras que para la época de lluvia fueron E. insularum, L. chthoniiformis y P. isolatum (92.6%). Estos resultados sugieren que estas especies fueron las más dominantes en sus respectivos microhábitats durante todos los meses de muestreo, en cada época climática (tabla 3).
La humedad de la hojarasca no presentó diferencias (KW = 2.61; p > 0.62) para los 5 sectores de estudio; a pesar de lo anterior, el fragmento de Punta Nisperal registró los valores más altos de humedad, en contraste, Punta Bonita registró los menores valores (tabla 4). La salinidad del suelo no presentó diferencias significativas (KW = 6.51; p > 0.16); Playa Blanca y Punta Nisperal registraron los valores más altos de salinidad (tabla 4). La humedad de la corteza no presentó diferencias significativas (KW = 5.18; p > 0.27), sin embargo, los valores registrados no fueron similares para los 5 fragmentos de bosque de mangle debido a las marcadas fluctuaciones en cada fragmento (tabla 4). La humedad del suelo presentó diferencias significativas (F = 3.32; p < 0.02) debido a las marcadas fluctuaciones en cada fragmento durante los periodos de lluvias; la prueba de múltiple rango de Tukey-HSD estableció diferencias entre Punta Bonita y Punta Nisperal (p < 0.009) para la humedad en el suelo (tabla 4). Para los 5 fragmentos de bosque de manglar evaluados, la RDA sugiere una correlación positiva entre la salinidad y la humedad del suelo (tabla 4). La prueba de permutaciones para la RDA, bajo un modelo reducido, indicó una correlación significativa entre estas variables y la abundancia relativa del ensamblaje de pseudoescorpiones (F = 2; p < 0.002). La RDA sugiere una mayor relación entre la salinidad del suelo y la abundancia relativa de especies de E. insularum, P. isolatum y P. quirosi. De manera similar, se puede observar una correlación positiva entre L. chthoniiformis y la humedad del suelo, mientras que P. arboreum tuvo una correlación negativa con la humedad de la hojarasca. Se registró un comportamiento particular para las especies A. reductus, P. aff. Setosus y S. gratus, que presentaron una correlación negativa con las variables evaluadas en este estudio, así como la humedad de la corteza no ejerció influencia ni se correlacionó con la presencia y/o abundancia relativa de la especie (fig. 6).
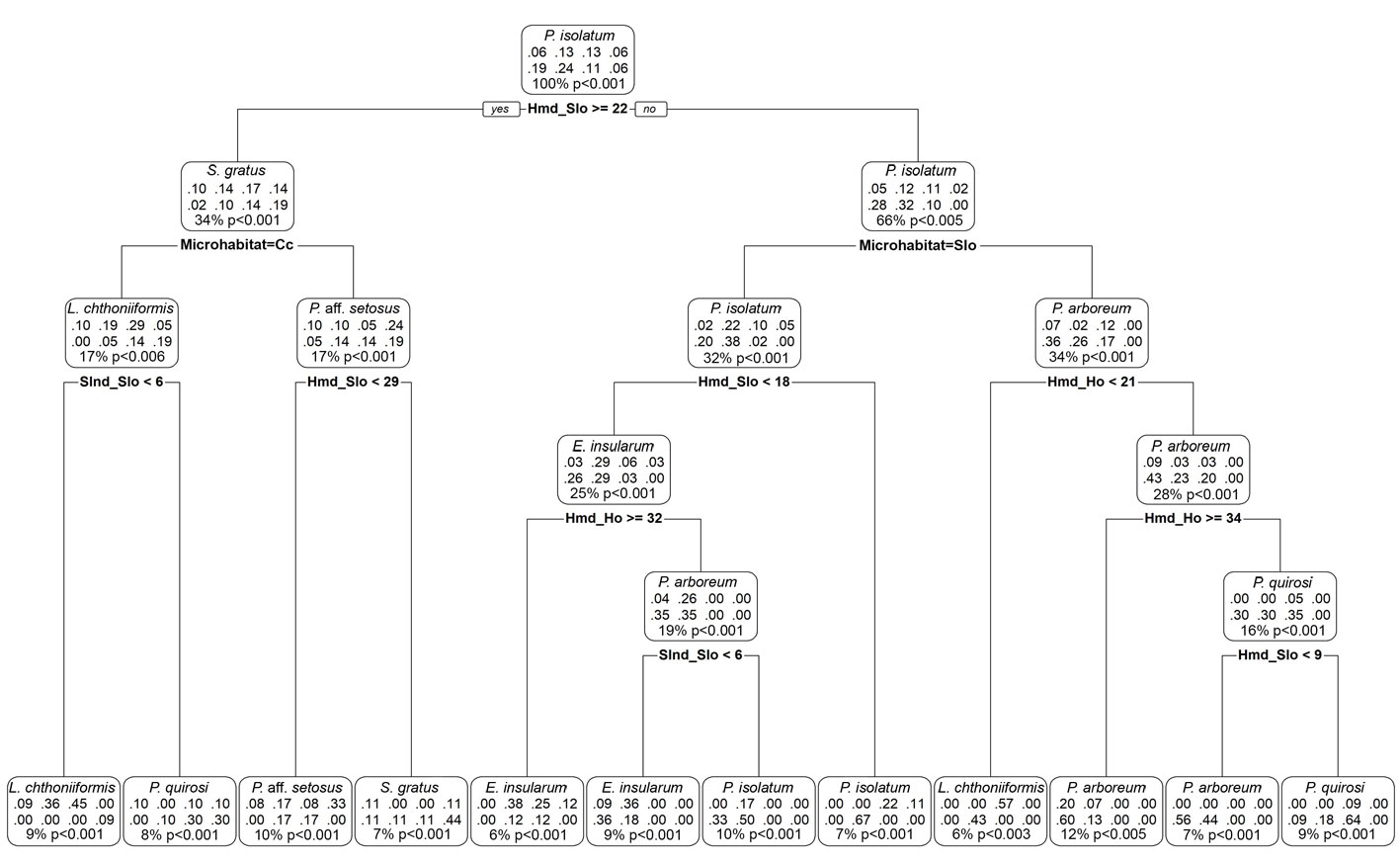
Según el índice de preferencia, las especies de pseudoescorpiones registradas se asociaron con microhábitats particulares en cada uno de los fragmentos de bosque de manglar evaluados, lo cual, fue corroborado por las clasificaciones establecidas en el árbol de decisión (fig. 7), y se logró el 100% de las clasificaciones correctas para cada especie en cada nodo dentro de cada microhábitat, (accuracy = 84.2%; Kappa = 73.2%; ACC > NIR; p < 0,009; McNemar Test, p < 0.006). La medida de selectividad de Manly, en un primer vistazo general a la selección de recursos, indicó el uso de los 6 tipos de microhábitat para cada especie de pseudoescorpión (fig. 8A), asimismo, identificó variabilidad entre cada especie (χ2 = 1,050.4; df = 5; p < 0.001), lo cual, sugiere cierta especificidad de cada especie en cada microhábitat (χ2 = 911.4; df = 35; p < 0.0001). Se presentaron diferencias significativas y cierta heterogeneidad (χ2 = 914.1; df = 40; p < 0.0001) entre los microhábitats y las especies para la selección general de hábitat (fig. 8B), de igual forma, la prueba de hipótesis de que las especies usan en promedio los recursos en proporción a la disponibilidad independientemente de si son iguales o no (fig. 8C), presentó diferencias significativas e independencia entre cada una de las especies (-2 log = 48.8; χ2 = 22.3; df = 6; p < 0.001).
De acuerdo con los resultados obtenidos por la medida de selectividad de Manly (1974), aunque las especies tienen cierta preferencia por un microhábitat (fig. 8A), también hacen uso de otros microhábitats (fig. 8D). Las especies P. quirosi y E. insularum tienen un comportamiento similar, aunque éstas prefieren áreas de restos de coral, hacen uso de la hojarasca respectivamente (fig. 8D); las especies A. reductus, P. aff. setosus y S. gratus pueden considerarse aquí como corticícolas y exclusivos de este microhábitat debido a que prefieren y usan este microhábitat respectivamente (fig. 8D); P. arboreum, aunque prefiere la corteza de los troncos en descomposición, utiliza la corteza de los árboles en la barra de arena (fig. 8D); en contraste, L. chthoniiformis prefiere el suelo y utiliza la hojarasca, sin embargo, P. isolatum presentó preferencia por el suelo (fig. 8D), pero utiliza una amplia variedad de microhábitats como hojarasca, corteza de árbol en descomposición y corteza de árbol en la barra de arena en los fragmentos de bosque de manglar evaluados (fig. 8D).
Discusión
Los resultados exhibidos por las técnicas y el microhábitat, concuerdan con Gabbutt (1970) al establecer el procesamiento por embudo de Berlese como una buena técnica para recolectar pseudoescorpiones en la hojarasca, por ser éste un microhábitat estable, y coincide con el trabajo realizado en los bosques inundables, que reportaron altos valores de abundancia en la hojarasca. La combinación de estos métodos es apropiado para obtener una buena representación de la fauna de pseudoescorpiones (Adis y Junk, 2002; Adis y Mahnert, 1985, 1990, 1993; Adis et al., 1988, 2002; Aguiar y Bührnheim, 2003; Aguiar et al., 2006; Moráis et al., 1997). Los pseudoescorpiones son considerados como un grupo mesodiverso de arácnidos (Harvey, 2013). En este sentido, la curva de acumulación obtenida permitió alcanzar el número de especies establecido por los estimadores y concuerda con los establecidos por otros autores, quienes han reportado mayores valores de abundancia de pseudoescorpiones en ambientes con mayor equilibrio ecológico (Barros et al., 2010; Lencinas et al., 2015; Ranius et al., 2011; Yamamoto et al., 2001), lo cual parece indicar una estrecha relación positiva de la estructura vegetal y la heterogeneidad del hábitat, con la riqueza y diversidad de pseudoescorpiones. Ésto concuerda con lo establecido por otros autores como Tews et al. (2004) y González-Megias et al. (2007), los cuales indican que dependiendo del grupo taxonómico y la escala espacial, la riqueza puede tener una relación con el aumento de la heterogeneidad del hábitat. En contraste, autores como Gerlach et al. (2013), sugieren que los indicadores son útiles para identificar características ecológicas o monitorear los efectos del manejo del hábitat, particularmente para indicar el progreso en la restauración; en este sentido, los pseudoescorpiones han sido usados para indicar la calidad de los suelos (Barros et al., 2010); a pesar de ésto, Gerlach et al. (2013) mencionan que este grupo de arácnidos, generalmente son muy escasos y demasiado difíciles de identificar para ser útiles como indicadores de diversidad; sin embargo, debido a la estrecha relación de la diversidad, riqueza y abundancia relativa con el equilibrio ecológico (Lencinas et al., 2015), se puede decir que las especies registradas en este estudio, ofrecen el potencial para ser usadas como indicadores ecológicos del estados de conservación, no obstante, se requiere un mayor número de estudios enfocados en este punto de vista.

Tabla 3
Análisis (SIMPER), por época climática en cada microhábitat.
| Abundancia | Similaridad | Contribución (%) | Acumulado (%) | |
| Época seca | – | 32.13 | – | – |
| Pachyolpium isolatum | 20.25 | 29.08 | 90.52 | 90.52 |
| Época de transición | – | 28.48 | – | – |
| Pachyolpium isolatum | 16.88 | 24.25 | 85.17 | 85.17 |
| Lechytia chthoniiformis | 3 | 2.88 | 10.12 | 95.3 |
| Época de lluvia | – | 26.67 | – | – |
| Pachyolpium isolatum | 17.75 | 23.53 | 66.01 | 66.01 |
| Lechytia chthoniiformis | 8.92 | 7.15 | 20.05 | 86.05 |
| Epactiochernes insularum | 0.42 | 2.33 | 6.55 | 92.6 |
Los manglares, a pesar de la pobreza de su suelo, albergan una gran riqueza de fauna, brindan galerías, hábitats para alimentación, anidación y refugio (Quirós y Arias, 2013). Los manglares del departamento de Córdoba son los terceros más grandes y de los más conservados de Colombia (INVEMAR, 2012; Quirós y Arias, 2013). El suelo, los restos de coral, el banco de arena, la hojarasca, la corteza de los árboles vivos y los troncos en descomposición, son hábitats diferentes en relación con la distribución del ensamblaje de pseudoescorpiones, la cual, presenta una distribución heterogénea en la abundancia relativa entre los diferentes microhábitats. Los análisis han indicado una variación espacial significativa y una especificidad dentro de cada microhábitat, tanto en su ocupación como en su uso, lo cual, concuerda con lo que se registra para varios géneros representativos, exclusivos de los microhábitat halófilos de Baja California, la verdadera zonación de Carolina del Norte, los reportes de las islas Galápagos y los de bosques de mangles de Colombia y México (Bedoya-Roqueme et al., 2016; Félix-Angulo, 2018; Harvey, 2009; Judson, 2016; Lee, 1979; Mahnert, 2014; Weygoldt, 1969). Del mismo modo se observa el comportamiento para otros grupos de artrópodos en bosques de áreas inundables (Battirola et al., 2007, 2009, 2010, 2017; Castilho et al., 2005; Marques et al., 2011).
Tabla 4
Promedio (± Desviación estándar) de las variables físicas y químicas en cada uno de los fragmentos de bosque de mangle evaluados.
| Variable/Sector | Punta Bolívar | Punta Bello | Playa Blanca | Punta Bonita | Punta Nisperal |
| Humedad del suelo (%) | 18.8 ± 11.7 | 13.7 ± 4.6 | 16.3 ± 4.5 | 10.6 ± 2 | 27.5 ± 13 |
| Humedad hojarasca (%) | 29.8 ± 3.18 | 27.8 ± 0.7 | 31.5 ± 9.7 | 24.5 ± 11.2 | 31.8 ± 3.8 |
| Humedad Corteza (%) | 17.8 ± 9.6 | 12.4 ±3.4 | 18.1 ±3.4 | 9.3 ± 1.9 | 22.4±11.4 |
| Salinidad del suelo (ups) | 26.3 ± 6.8 | 28 ± 7.5 | 30.8 ± 0.8 | 30.6 ± 7.9 | 34.8 ± 0.4 |

Estos arácnidos exploran diversos microhábitats y presentan adaptaciones a la vida en ambientes sujetos a condiciones temporales, así como variaciones en sus condiciones estructurales, tales como áreas de inundación (Adis, 1997; Adis et al., 1988, 2002; Belozerov, 2013; Moráis et al., 1997; Weygoldt, 1969). Las principales adaptaciones de los pseudoescorpiones para sobrevivir en áreas con marcadas fluctuaciones estacionales son conductuales, como el rafting, caminata y la migración vertical del suelo hacia la corteza o el dosel en épocas de alta humedad, así como el comportamiento formativo de algunas especies (Adis, 1997; Adis y Mahnert, 1985, 1990, 1993; Aguiar y Bührnheim, 2003; Aguiar et al., 2006; Lee, 1979; Weygoldt, 1969). Esto se observó en el ensamblaje de pseudoescorpiones en el sur del golfo de Morrosquillo, la corteza y la hojarasca presentaron los valores más altos de abundancia relativa de pseudoescorpiones, sin embargo, en cada microhábitat evaluado se registró una estratificación de acuerdo con la especificidad exhibida por cada una de las especies en cada microhábitat, atribuida al impacto ejercido por las inundaciones estacionales que genera adaptaciones para el uso de recursos como alimentos y refugio, considerando la frecuencia y la fuerza ejercida por el pulso de inundación en los organismos (Adis y Junk, 2002; Battirola et al., 2017; Junk et al., 1989; Moráis et al., 1997).
De acuerdo con los resultados obtenidos en la medida de selectividad, el patrón de distribución de los pseudoescorpiones en cada uno de los microhábitats evaluados y su especificidad, es consistente con lo informado para este grupo de arácnidos en otros ambientes marinos exclusivos de microhábitat halófilo (Félix-Angulo, 2018; Harvey, 2009; Hoff, 1959; Lee, 1979; Judson, 2016; Mahnert, 2014; Mahnert y Schuster, 1981; Weygoldt, 1969). Esta zonificación está determinada por la tolerancia fisiológica a la desecación y una mayor tolerancia a los períodos de inmersión (Harvey, 2009; Hoff, 1959; Kensler, 1967; Lee, 1979; Weygoldt, 1969). Algunas especies pueden encontrarse restringidas en ambientes costeros, estableciéndose en microhábitats intermareales, siendo muy estrictos en los requisitos para establecerse (Bedoya-Roqueme et al., 2016; Kensler, 1967; Schuster, 1962; Weygoldt, 1969). La similitud mostrada por los grupos puede atribuirse a la estructura vegetal de cada uno de los fragmentos de bosque de manglar evaluados, tales diferencias en la estructura, pueden ofrecer de una forma u otra un mayor número de microhábitats que pueden ser ocupados por una gran cantidad de artrópodos, es decir, un mayor suministro de alimentos, refugio y sitios de anidación, posibles lugares para períodos de reproducción; por lo tanto, cada microhábitat ofrece las condiciones y los requisitos de cada especie de pseudoescorpión para ocupar cada microhábitat específico (Aguiar et al., 2006; Battirola et al., 2017; Gabbutt, 1970; Moráis et al., 1997; Weygoldt, 1969).
Se encontró que el ensamblaje de pseudoescorpiones en cada microhábitat está significativamente influenciado por la salinidad y la humedad del suelo, autores como Bedoya-Roqueme et al. (2016) reportaron la influencia de la humedad y la salinidad como variables que pueden influir en la presencia de especies de pseudoescorpiones. En este estudio se encontró que la salinidad del suelo, la humedad y la humedad de la hojarasca, ejercen una influencia significativa en la presencia de pseudoescorpiones, lo cual fue confirmado por la clasificación generada por el árbol de decisiones y puede explicar la especificidad registrada en cada microhábitat. La desecación, puede ser el factor principal que controla la distribución y actividad de los organismos intermareales; asimismo, la humedad es el factor esencial en cada microhábitat y por lo tanto, la mayoría de las especies son susceptibles a la pérdida de humedad (Kensler, 1967; Lee, 1979; Schuster, 1962; Weygoldt, 1969).
Agradecimientos
A Estefanía Padilla Montiel, asistente del Laboratorio de Zoología de la Universidad de Córdoba por su colaboración. Al personal del Laboratorio de Entomología de la Universidad de Córdoba (LEUC) y del Laboratorio de Microscopía de la Universidad de Córdoba por su colaboración, a Maira Alejandra Acosta Berrocal por su ayuda en la recolección del material. Finalmente, a la agencia de Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-CAPES por su respaldo.
Referencias
Adis, J. (1997). Estratégias de sobrevivência de inverte-brados terrestres em florestas inundáveis da Ama-zônia Central: uma resposta à inundação de longo período. Acta Amazonica, 27, 43–54. https://doi.org/10.1590/1809-43921997271054
Adis, J., Bonaldo, A. B., Brescovit, A. D., Bertani, R., Cokendolpher, J. C., Condé, B. et al. (2002). Arachnida at ‘Reserva Ducke’, central Amazonia/Brazil. Amazoniana, 17, 1–14.
Adis, J. y Junk, W. (2002). Terrestrial invertebrates inhabiting lowland river floodplains of Central Amazonia and Central Europe: a review. Freshwater Biology, 47, 711–731. https://doi.org/10.1046/j.1365-2427.2002.00892.x
Adis, J. y Mahnert, V. (1985). On the natural history and ecology of pseudoscorpiones (Arachnida) from an Amazonian backwater inundation forest. Amazoniana, 9, 297–314.
Adis, J. y Mahnert, V. (1990). Vertical distribution and abundance of pseudoscorpions species (Arachnida) in the soil of a neotropical secondary forest during the dry and the rainy season. Acta Zoologica Fennica, 190, 11–16.
Adis, J. y Mahnert, V. (1993). Vertical distribution and Abundance of pseudoscorpions (Arachnida) in the soil of two different neotropical primary forests during the dry and rainy seasons. Memoirs of the Queensland Museum, 33, 431–440.
Adis, J., Mahnert, V., Moráis, J. W. y Rodríguez, J. M. (1988). Adaptation of an Amazoniaian pseudoscorpion (Arachnida) from dryland forests to inundation forests. Ecology, 69, 287–291.
Aguiar, N. O. y Bührnheim, P. F. (2003). Pseudoscorpiones (Arachnida) da vegetaca de sub-bosque da floresta primaria tropical de terra firme (Coari, Amazonas, Brasil). Acta Amazonica, 33, 515–526. https://doi.org/10.1590/S0044-59672003000300016
Aguiar, N. O., Gualberto, T. y Franklin, E. (2006). A medium spatial scale distribution pattern of Pseudoscorpionida (Arachnida) in a gradient of topography (altitude and inclination), soil factors, and litter in a central Amazonia forest reserve, Brazil. Brazilian Journal of Biology, 66, 791–802. https://doi.org/10.1590/S1519-69842006000500004
Andrade, R. y Gnaspini, P. (2002). Feeding in Maxchernes iporangae (Pseudoscorpiones, Chernetidae) in captivity. Journal of Arachnology, 30, 613–617.
Barros, Y. J., Melo, V. F., Sautter, K. D., Buschle, B., de Oliveira, E. B. et al. (2010). Indicadores de qualidade de solos de área de mineração e metalurgia de chumbo: II – Mesofauna e plantas. Revista Brasileira de Ciência do Solo, 34, 1413–1426. https://doi.org/10.1590/S0100-06832010000400037.
Bastienne, S., Gayoso, J. y Guerra, J. (2001). Manual de procedimientos para inventarios de carbono en ecosistemas forestales. Valdivia: Universidad Austral de Chile.
Battirola, L. D., Adis, J., Marques, M. I. y Silva, F. H. O. (2007). Composição da comunidade de artró-podes associada à copa de Attalea phalerata Mart. (Arecaceae), durante o período de cheia no Panta-nal de Poconé, Mato Grosso, Brasil. Neotropical Entomology, 36, 640–651. https://doi.org/10.1590/S1519-566X2007000500002
Battirola, L. D., Marques, M. I., Brescovit, A. D., Rosado-Neto, G. H. y Anjos, K. C. (2010). Comunidade edáfica de Araneae (Arthropoda, Arachnida) em uma floresta sazonalmente inundável na região norte do Pantanal de Mato Grosso, Brasil. Biota Neotropica, 10, 173–183. http://dx.doi.org/10.1590/S1676-06032010000200022
Battirola, L. D., Marques, M. I., Rosado-Neto, G. H., Pinheiro, T. G. y Pinho, N. G. C. (2009). Vertical and time distribution of Diplopoda (Arthropoda: Myriapoda) in a monodominant forest in Pantanal of Mato Grosso, Brazil. Zoologia, 26, 479–487. http://dx.doi.org/10.1590/S1984-46702009005000008
Battirola, L. D., Rosado-Nieto, G. H., Batistella, D. A., Mahnert, V., Brescovit, A. D. y Marques, M. I. (2017). Vertical and time distribution of Pseudoscorpiones (Arthropoda: Arachnida) in a floodplain forest in the Brazilian Pantanal. Revista de biologia tropical, 65, 445–459. http://dx.doi.org/10.15517/rbt.v65i2.24134
Batzli, G. O. y Lesieutre, C. (1991). The influence of high quality food on habitat use by arctic microtine rodents. Oikos, 60, 299–306. https://doi.org/10.2307/3545071
Bedoya-Roqueme, E. (2015). Una nueva especie de Paraliochthonius (Pseudoscorpiones: Chthoniidae: Tyrannochthoniini) de Colombia. Revista Ibérica de Aracnología, 26, 49–54.
Bedoya-Roqueme, E. (2019). Pseudoscorpiones of the tribe Chernetini (Chernetidae) from the Colombian Caribbean. New species and an identification key. Revista Ibérica de Aracnología, 34, 21–40.
Bedoya-Roqueme, E. y Quirós-Rodríguez, J. A. (2018). A new species of Antillochernes (Pseudoscorpiones: Chernetidae: Chernetini) from Colombia. Revista Ibérica de Aracnología, 32, 93–99.
Bedoya-Roqueme, E. y Quirós-Rodríguez, J. A. (2019). Pseudoscorpiones (Arachnida) de Isla Fuerte y Tortuguilla, Caribe colombiano. Acta Biológica Colombiana, 24, 163–173. http://dx.doi.org/10.15446/abc.v24n1.70560
Bedoya-Roqueme, E., Pérez-Agudelo, M., Zaragoza, J.A. y Quirós-Rodríguez, J.A. (2017). Nuevos reportes de Pseudoescorpiones (Arachnida) de bosques de manglar en Córdoba, Caribe colombiano. Revista Ibérica de Aracnología, 30, 25–36.
Bedoya-Roqueme, E., Salleg-Pérez, G. y Quirós-Rodríguez, J. A. (2016). Sobre la ecología de pseudoescorpiones (Arachnida: Pseudoscorpiones) en bosques de manglar del sur del Golfo de Morrosquillo, Caribe colombiano. Revista Ibérica de Aracnología, 28, 65–74.
Belozerov, V. N. (2013). Seasonal Aspects of the Life Cycles of Pseudoscorpions (Arachnida, Pseudoscorpiones). Entomological Review, 93, 634–652. https://doi.org/10.1134/S0013873813050126
Benavides, L. R, Cosgrove, J. G., Harvey, M. S. y Giribet, G. (2019). Phylogenomic interrogation resolves the backbone of the Pseudoscorpiones tree of life. Molecular Phylogenetics and Evolution, 139, 106509. https://doi.org/10.1016/j.ympev.2019.05.023
Bray, R. J. y Curtis, J. T. (1975). An ordination of the upland forest communities of southern of Wisconsin. Ecological monographs, 27, 325–349. https://doi.org/10.2307/1942268
Briano, M., Ortiz, A. y Torres, R. (2010). Introducción al conocimiento de los pseudoscorpiones del estado de Aguas Calientes, México. Investigación y ciencia de la Universidad Autónoma de Aguas Calientes, 50, 5–9.
Broza, M., Poliakov, D., Weber, S. y Izhaki, I. (1993). Soil microarthropods on postfire pine forests on Mount Carmel, Israel. Water Science and Technology, 27, 533–538. https://doi.org/10.2166/wst.1993.0592
Buddle, C. (2010). Photographic key to the Pseudoscorpions of Canada and the adjacent USA. Canadian Journal of Arthropod Identification, 10, 1–77. https://doi.org/10.3752/cjai.2010.10
Calenge, C. (2006). The package adehabitat for the R software: tool for the analysis of space and habitat use by animals. Ecological Modelling, 197, 1035. https://doi.org/10.1016/j.ecolmodel.2006.03.017
Castilho, A. C. C., Marques, M. I., Adis, J. y Brescovit, A. D. (2005). Distribuição sazonal e vertical de Araneae em área com predomínio de Attalea phalerata Mart. (Arecaceae), no Pantanal de Poconé, Mato Grosso, Brasil. Amazoniana, 18, 215–239.
Clarke, K. y Gorley, R. (2005). PRIMER v.6: user manual/tutorial. Plymouth, United Kingdom: PRIMER–E Ltda.
Cole, D. C., Elgar, M. A. y Harvey, M. S. (1995). Associations between Australian pseudoscorpions and ants. Psyche Cambridge, Mass, 101, 221–227. https://doi.org/10.1155/1994/23982
Colwell, R. (2013). EstimateS: Statistical estimation of species richness and shared species from samples Version 9.1.0. User’s Guide and application. Recuperado 19 de febrero de 2019 de: http://www.viceroy.eeb.uconn.edu/estimates
Cortés, D. V. y Rangel, J. O. (2011). Los bosques de mangle en un gradiente de salinidad en la Bahía de Cispatá – Boca Tinajones, departamento de Córdoba-Colombia. Caldasia, 33, 155–176.
CVS-INVEMAR (Corporación Autónoma Regional de los Valles del Sinú y del San Jorge-Instituto de Investigaciones Marinas y Costeras). (2010). Plan integral de manejo del distrito de Manejo Integrado (DMI) bahía de Cispatá – La Balsa – Tinajones y sectores aledaños del delta estuarino del río Sinú, departamento de Córdoba. Santa Marta: Serie de Publicaciones Especiales de INVEMAR
Del-Claro, K. y Tizo-Pedroso, E. (2009). Ecological and evolutionary pathways of social behavior in Pseudoscorpions (Arachnida: Pseudoscorpiones). Acta Ethologica, 12, 13–22. https://doi.org/10.1007/s10211-009-0052-y
Donovan, B. y Paul, F. (2005). Pseudoscorpions: the forgotten beneficials inside beehives and their potential for management for control of varroa and other arthropod pests. Bee World, 86, 83–87. https://doi.org/10.1080/0005772X.2005.11417322
Etchevers, J. (1988). Análisis químico de suelos y plantas. Centro de Edafología. Chapingo, Estado de México: Colegio de Posgraduados.
Félix-Angulo, A.G. (2018). Diversidad de pseudoescorpiones (Arachnida: Pseudoscorpiones) en bosque de mangle en la localidad el conchal, Culiacán, Sinaloa. Boletin de la Sociedad Mexicana de Entomología, 4, 5–8.
Francke, O. F. y Villegas-Guzmán, G. A. (2006). Symbiotic relationships between Pseudoscorpions (Arachnida) and packrats (Rodentia). Journal of Arachnology, 34, 289–298. https://doi.org/10.1636/04-36.1
Gabbutt, P. (1962). Nets of the marie falsescorpion. Nature London, 196, 97–98.
Gabbutt, P. (1970). Sampling problems and the validity of the life history analyses of pseudoscorpions. Journal of Natural History, 4, 1–15. https://doi.org/10.1080/00222937000770011
Garshelis, D. L. (2000). Delusions in habitat evaluation: measuring use, selection, and importance. En L. Boitani y T. K. Fuller (Eds.), Research techniques in animal ecology: controversies and consequences (pp. 111–164). New York: Columbia University.
Gerlach, J., Samways, M. y Pryke, J. (2013). Terrestrial invertebrates as bioindicators: an overview of available taxonomic groups. Journal of Insect Conservation, 17, 831–850. https://doi.org/10.1007/s10841-013-9565-9
González, V. H., Mantilla, B. y Mahnert, V. (2007). A new record for Dasychernes inquilinus (Arachnida, Pseudoscorpiones, Chernetidae), with an overview of pseudoscorpion-bee relationships. Journal of Natural History, 35, 470–474. https://doi.org/10.1636/H06-62.1
González-Megias, A., Gómes, J. G. y Sánchez-Piñero, F. (2007). Diversity-habitat heterogeneity relationship at different spatial and temporal scales. Ecography, 30, 31–41. https://doi.org/10.1111/j.0906-7590.2007.04867.x
Harvey, M. S. (1992). The phylogeny and classification of the Pseudoscorpionida (Chelicerata: Arachnida). Invertebrate Taxonomy, 6, 1373–1435. https://doi.org/10.1071/IT9921373
Harvey, M. S. (2009). The first Australasian species of the genus pseudoscorpion halophilic Paraliochthonius (Pseudoscorpiones: Chthoniidae). Records of the Australian Museum, 25, 329–344. http://dx.doi.org/10.18195/issn.0312-3162.25(3).2009.329-344
Harvey, M. S. (2013). Pseudoscorpions of the World, version 2.0. Western Museum Australian, Perth. Recuperado el 21 de enero de 2020 de: http://www.museum.wa.gov.au/catalogs/pseudoscorpion
Harvey, M. S., Waldock, J., Teale, R. y Webber, J. (2007). New distribution records of the intertidal pseudoscorpion Parahya submersa (Pseudoscorpiones: Parahyidae). Records of the Australian Museum, 23, 393–395. http://dx.doi.org/10.18195/issn.0312-3162.23(4).2007.393-395
Hoff, C. C. (1959). The ecology and distribution of the pseudoscorpions of north–central New Mexico. University New Mexico Publishing Biological, 8, 1–68.
Hoff, C. C. (1964). The pseudoscorpions of Jamaica. Part 3. The suborder Diplosphyronida. Bulletin of the Institute of Jamaica. Science series, 10, 1–47.
INVEMAR (Instituto de Investigaciones Marinas y Costeras). (2012). Informe del estado de los ambientes y recursos marinos y costeros en Colombia: año 2011. Santa Marta: Serie de Publicaciones Periódicas, 8a Ed.
Judson, M. L. I. (1992). A simple, slow-diffusion method for clearing small arthropods. The Newsletter British Arachnological Society, 64, 6–7.
Judson, M. L. I. (2005). Baltic amber fossil of Garypinus electri Beier provides first evidence of phoresy in the pseudoscorpion family Garypinidae (Arachnida: Chelonethi). En D. V. Logunov y D. Penney (Eds.), European Arachnology 2003 (Proceedings of the 21st European Colloquium of Arachnology, St. Petersburg, 4-9 August 2003 (pp. 127–131). Moscú: KMK Scientific Press.
Judson, M. L. I. (2016). Pseudoscorpions (Arachnida, Chelonethi) in Mexican amber, with a list of extant species associated with mangrove and Hymenaea trees in Chiapas. Boletín de la Sociedad Geológica Mexicana, 68, 57–79. https://doi.org/10.5281/zenodo.50595
Junk, W. J., Bayley, P. B. y Sparks, R. E. (1989). The flood pulse concept in river-floodplain systems. En D. P. Dodge (Eds.), Proceedings of the Internatio-nal Large River Symposium (LARS) (pp.110–127). Ontario, Canadá: Department of Fisheries and Oceans.
Kensler, C. (1967). Dessication resistance of intertidal species as a factor of their zonation. Journal of Animal Ecology, 3, 391–406.
Krausman, R. P. (1999). Some basic principles of habitat use, grazing behavior of livestock and wildlife. Idaho Forest. Wildlife and Range Experiment Station Bulletin, 70, 85–90.
Lee, V. F. (1979). The maritime pseudoscorpions of Baja California, México (Arachnida: Pseudoscorpionida). Occasional papers of the California Academy of Sciences, 131, 1–38.
Lencinas, M. V., Kreps, G., Soler, R., Peri, P. L., Porta, A., Ramírez, M. et al. (2015). Neochelanops michaelseni (Pseudoscorpiones: Chernetidae) as a potential bioindicator in managed and unmanaged Nothofagus forests of Tierra del Fuego. Journal of Arachnology, 43, 406–412.
Litvaitis, J. A., Titus, K. y Anderson, E. M. (1994). Measuring vertebrate use of territorial habitats and foods. En T. A. Bookhout (Eds.), Research and management techniques for wildlife and habitats. 5th edition (pp. 254–274), Bethesda, Maryland: The Wildlife Society.
Lubin, Y., Ellner, S. y Kotzman, M. (1993). Web relocation and habitat selection in a desert widow spider. Ecology, 74, 2456–2459.https://doi.org/10.2307/1940835
Mahnert, V. (2014). Pseudoscorpions (Arachnida: Pseudoscorpiones) from the Galapagos Islands (Ecuador). Revue Suisse de Zoologie, 121, 135–210.
Mahnert, V. y Adis, J. (2002). Pseudoscorpiones. En J. Adis (Eds), Amazonian Arachnida and Myriapoda (pp. 367–380). Sofía, Moscú: Pensoft Publisher.
Mahnert, V. y Schuster, R. (1981). Pachyolpium atlanticum sp. nov., ein Pseudoskorpion aus der Gezeitenzone der Bermudas-Morphologie und Ökologie (Pseudoscorpiones: Olpiidae). Revue Suisse de Zoologie, 88, 265–273. https://doi.org/10.5962/bhl.part.82371
Manly, B. F. J. (1974). A model for certain types of selection experiments. Biometrics, 30, 281–94.
Manly, B. F. J., McDonald, L. L, Thomas, D. L., McDonald, T. L. y Erickson, W. P. (2003). Resource selection by animals statistical design and analysis for field studies. Países Bajos: Springer.
Marques, M. I., Adis, J., Battirola, L. D., Santos, G. B. y Castilho, A. C. C. (2011). Arthropods associated with a forest of Attalea phalerata Mart. (Arecaceae) palm trees in the northern Pantanal of the Brazilian state of Mato Grosso. En W. J. Junk, C. J. Da-Silva, C. Nunes-da Cunha y K. M. Wantzen (Eds.), The Pantanal: ecology, biodiversity and sustainable management of a large neotropical seasonal wetland (pp. 431–468). Sofia, Moscú: Pensoft Publishers.
McGeoch, M. A., Sithole, H., Samways, M. J., Simaika, J. P., Pryke, J. S., Picker, M. et al. (2011). Conservation and monitoring of invertebrates in terrestrial protected areas. Koedoe, 53, 1–13.https://doi.org/10.4102/koedoe.v53i2.1000
Moráis, J. W., Adis, J., Mahnert, V. y Berti-Filho, E. (1997). Abundance and phenology of Pseudoscorpiones (Arachnida) from a mixedwater inundation forest in Central Amazonia, Brazil. Revue Suisse de Zoologie, 104, 475–483. http://dx.doi.org/10.5962/bhl.part.80005
Montenegro, J. y Acosta, A. (2008). Programa innovador para evaluar uso y preferencia de hábitat. Universitas Scientiarum, 13, 208–217.
Morris, D. W. (2003). Toward an ecological synthesis: a case for habitat selection. Oecologia, 136, 1–13. https://doi.org/10.1007/s00442-003-1241-4
Morrison, M. L., Block, W. M., Strickland, M. D., Collier, B. A. y Peterson, M. J. (2008). Wildlife study design (2a. ed.). New York: Springer Series on Environmental Management.
Morrison, M. L., Marcot, B. G. y Mannan, R. W. (1998). Wildlife habitat relationships: concepts and applications (2a. ed.). Madison, Wisconsin: The University of Wisconsin.
Muchmore, W. B. (1976). Pseudoscorpions from Florida and the Caribbean Area. 5. Americhernes, a new genus based upon Chelifer elongatus Say (Chernetidae). Florida Entomologist, 59, 151–163.
Muñoz, J., Mendoza, A., López, F., Soler, A. y Hernández, M. (2000). Manual de análisis de suelo. Edafología. México D.F.: Escuela Nacional de Estudios Profesionales Iztacala, UNAM.
Poinar, G. O., Ćurčić, J. R. B. P. M. y Cokendolpher, J. C. (1998). Arthropod phoresy involving pseudoscorpions in the past and present. Acta Arachnologica, 47, 79–96. https://doi.org/10.2476/asjaa.47.79
Quirós-Rodríguez, J. A. y Arias, J. E. (2013). Taxocenosis de moluscos y crustáceos en raíces de Rhizophora mangle (Rhizophoracea) en la bahía de Cispatá, Córdoba, Colombia. Acta Biológica Colombiana, 18, 329–340.
R Core Team. (2020). R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Recuperado el 20 de diciembre, 2019 de: http://www.R–project.org/
Ranius, T., Johansson, V. y Fahrig, L. (2011). Predicting spatial occurrence of beetles and pseudoscorpions in hollow oaks in southeastern Sweden. Biodiversity and Conservation, 20, 2027–2040. https://doi.org/10.1007/s10531-011-0072-6
Read, S., Howlett, B. G., Donovan, B. J., Nelson, W. R. y Van Toor, R. F. (2014). Culturing chelifers (Pseudoscorpions) that consume Varroa mites. Journal of Applied Entomology, 138, 260–266. https://doi.org/10.1111/jen.12096
Sánchez, L. E, Paolini, J. y Rodríguez, J. (2010). Dinámica de las propiedades del suelo en bosques de Rhizophora mangle L. (Rhizophoraceae) en Isla de Margarita, Venezuela. Revista Biología Tropical, 58, 547–564. https://doi.org/10.15517/rbt.v58i2.5228
Schuster, R. (1962). Das marine litoral als lebensraum terrestrischer kleinarthropoden. Internationale Revue der gesamten Hydrobiologie und Hydrographie, 47, 359–412. https://doi.org/10.1002/iroh.19620470304
Tews, J., Brose, U., Grimm, V., Tielborger, K., Wichmann, M. C., Schwager, M. et al. (2004). Animal species diversity driven by habitat heterogeneity/diversity: the importance of keystone structures. Journal of Biogeography, 31, 79–92. https://doi.org/10.1046/j.0305-0270.2003.00994.x
Tizo-Pedroso, E. y Del-Claro, K. (2011). Is there division of labor in cooperative pseudoscorpions? An analysis of the behavioral repertoire of a tropical species. Ethology, 117, 498–507. https://doi.org/10.1111/j.1439-0310.2011.01906.x
Tooren, D. (2011). New records of olpiid pseudoscorpions (Pseudoscorpiones: Olpiidae) from the Caribbean area and Surinam, with descriptions of four new species of the genera Pachyolpium Beier, Tricholpium gen. nov. and Heterohorus gen. nov. Zoologische Mededelingen, 85, 29, 169–194.
Topp, G. (1993). Soil water content. En M. R. Carte (Ed.), Soil sampling and methods of analysis (pp. 541–557). Charlottetown, Prince Edward Island: Lewis Publishers.
Underwood, A. J., Chapman, M. G. y Crowe, T. P. (2004). Identifying and understanding ecological preferences for hábitat or prey. Journal of Experimental Marine Biology and Ecology, 300, 161–187. https://doi.org/10.1016/j.jembe.2003.12.006
Weygoldt, P. (1969). The biology of pseudoscorpions. Cambridge: Harvard University.
Willard, H., Merrit, L. y Dean, A. (1974). Instrumental methods of analysis. 5th edition. New York: Van Nostrand.
Yamamoto, T., Nakagoshi, N. y Touyama, Y. (2001). Ecological study of pseudoscorpion fauna in the soil organic layer in managed and abandoned secondary forests. Ecological Research, 16, 593–601. https://doi.org/10.1046/j.1440-1703.2001.00422.x
Zeh, D. W. y Zeh, J. A. (1992a). Dispersal–generated sexual selection in a beetle–riding pseudoscorpion. Behavioral Ecology and Sociobiology, 30, 135–142. https://doi.org/10.1007/BF00173949
Zeh, D. W. y Zeh, J. A. (1992b). On the function of harlequin beetleriding in the pseudoscorpion, Cordylochernes scorpioides (Pseudoscorpionida: Chernetidae). Journal of Arachnology, 20, 47–51.
Zeh, D. W. y Zeh, J. A. (1997). Sex via the substrate: mating system and sexual selection in pseudoscorpions. En J. C. Choe y B. J. Crespi (Eds.), The evolution of mating systems in insects and arachnids (pp. 329–339). Cambridge: Cambridge University.




