Dieta de la rana de invernadero Eleutherodactylus planirostris (Amphibia: Eleutherodactylidae) en la península de Yucatán, México
Tania Ramírez-Valverde (a), *, David González-Solís (a), José Rogelio Cedeño-Vázquez (a), Ricardo Luría-Manzano (b)
a El Colegio de la Frontera Sur, Unidad Chetumal, Avenida Centenario Km 5.5, 77014 Chetumal, Quintana Roo, México
b Departamento de Ecologia, Instituto de Biociências, Universidade de São Paulo, Rua do Matão, Travessa 14, Cidade Universitária, 05508-090, São Paulo, SP, Brasil
*Autor para correspondencia: trvalverde@gmail.com (T. Ramírez-Valverde)
Resumen
Se analizaron los contenidos estomacales de 209 individuos de la rana de invernadero Eleutherodactylus planirostris provenientes de 3 sitios de la península de Yucatán, México, donde ésta es una especie invasora. La dieta estuvo dominada numéricamente por Oribatida y Formicidae, y esta última junto con Isopoda, tuvieron la mayor importancia relativa. Schizomida se reporta por primera vez como parte de la dieta de esta rana. Se encontró un cambio ontogénico en la composición de la dieta, las presas pequeñas (ácaros y colémbolos) fueron más consumidas por los jóvenes, mientras que las presas más grandes (hormigas), fueron más consumidas por los adultos. La dieta no varió entre sexos. Se encontró un nivel de especialización individual en la dieta, mayor al esperado por azar en los 3 sitios. La presencia de esta especie en la península de Yucatán es preocupante debido al alto número de presas consumidas por individuo y a su amplia distribución en la región. Por lo tanto, este trabajo provee una base para futuros estudios enfocados en los impactos de la especie en los sitios invadidos en esta región.
Palabras clave: Rana de invernadero; Cambio ontogénico; Schizomida; Especialización individual
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Diet of the greenhouse frog Eleutherodactylus planirostris (Amphibia: Eleutherodactylidae) in the Yucatán Peninsula, Mexico
Abstract
We analyzed the stomach contents of 209 individuals of the greenhouse frog Eleutherodactylus planirostris from 3 sites of the Yucatán Peninsula, Mexico, where it is an invasive species. Oribatida and Formicidae were the numerically dominant groups, the latter along with Isopoda, had the highest relative importance. Schizomida is reported for the first time as part of the diet of this frog. We found an ontogenetic change in the diet composition, small preys (mites and springtails) were more consumed by juveniles, whereas larger preys (ants) were more consumed by adults. Diet did not vary between sexes. We found an individual level of specialization in the diet, higher than expected by chance in the 3 sites. The presence of this species in the Yucatán Peninsula is worrisome because of the high number of prey eaten by individual, and its wide distribution in the region. Therefore, this work provides baseline information for future studies focused on the impacts of the species in the invaded sites from this region.
Keywords: Greenhouse frog; Ontogenetic change; Schizomida; Individual specialization
© 2020 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
La rana de invernadero Eleutherodactylus planirostris (Cope, 1862) ocupa el quinto lugar entre los anfibios invasores más exitosos del mundo (Bomford et al., 2009). Su distribución original comprende Cuba, Islas Caimán y Bahamas (Schwartz, 1974). Sin embargo, actualmente se ha establecido en China (Lee et al., 2016), EUA (Goin, 1947), Filipinas (Olson et al., 2014), Guam (Christy et al., 2007), Honduras (McCraine et al., 2008), Jamaica (Stewart y Martin, 1980), México (Cedeño-Vázquez et al., 2014), Nicaragua (Villa, 2015), Nigeria (Ukpong et al., 2012), Panamá (Crawford et al., 2011) y Singapur (Lim y Sind, 2017).
Al igual que otras especies invasoras, la rana de invernadero podría potencialmente trasmitir parásitos y enfermedades, modificar la dinámica del ciclo de nutrientes y actuar como depredador o competidor de las especies nativas en los ecosistemas invadidos (Kraus, 2009). Estos efectos se podrían intensificar debido a que alcanza una madurez sexual temprana, tiene alta fecundidad y poblaciones con alta abundancia (Goin, 1947; Olson et al., 2012). Respecto a su dieta, E. planirostris es especialista en hormigas, aunque existe una variación interpoblacional en el consumo de éstas y otros artrópodos (i.e., ácaros y colémbolos) de los que se alimenta (Ferreira et al., 2015; Goin, 1947; Olson y Beard, 2012). Adicionalmente, durante la época de lluvias consume un alto número de presas y generalmente no tiene el estómago vacío, lo cual incrementa su posible efecto sobre los artrópodos de la hojarasca (Olson y Beard, 2012).
En México, desde 1974 se tiene conocimiento de la presencia de esta especie en Veracruz (Schwartz, 1974). En 2010 se encontraron los primeros individuos en la península de Yucatán (Cedeño-Vázquez et al., 2014) y posteriormente se han hecho registros adicionales (Cedeño-Vázquez y Beutelspacher-García, 2019; García-Balderas et al., 2016); además, se ha confirmado el establecimiento de algunas de sus poblaciones tanto en la península de Yucatán, como en Veracruz (Contreras-Calvario et al., 2018; Ortiz-Medina et al., 2017). Recientemente, Gómez-Salazar y Cedeño-Vázquez (2017) reportaron que E. planirostris se encuentra ampliamente distribuida en la zona urbana de Playa del Carmen y presenta una abundancia aún mayor que en Hawai, isla donde ha sido introducida y donde aún no se han registrado depredadores que puedan regular sus poblaciones (Olson y Beard, 2012).
La dieta de la rana de invernadero ha sido estudiada enfocándose principalmente en su variación intersexual, ontogénica y geográfica en sistemas insulares. Por lo tanto, en este estudio se analiza la dieta de E. planirostris en relación con el sexo y la ontogenia en 3 sitios continentales de la península de Yucatán. Además, se evalúa la existencia del fenómeno de especialización individual en su dieta, lo cual podría dar evidencia adicional sobre las características ecológicas que han facilitado su rápida dispersión y establecimiento en esta región.
Materiales y métodos
Se recolectaron 209 individuos de E. planirostris del 5 al 7 de julio de 2017 (periodo que corresponde a la estación lluviosa) en 3 sitios antropizados: 1) hotel El Rey del Caribe, Cancún, Quintana Roo, totalmente inmerso en la zona urbana (CAN, n = 51) (21°09’51” N, 86°49’23” O); 2) Parque Zoológico Bicentenario Animaya, ubicado en la periferia oeste de la ciudad de Mérida (MER, n = 92) (20°58’59” N, 89°41’26” O), y 3) poblado Emiliano Zapata, municipio de Oxkutzcab, Yucatán (OXK, n = 66) (20°13’32” N, 89°28’02” O). Dos personas realizaron la búsqueda y recolecta de las ranas durante una noche (21:00-00:00 h) en cada sitio. Después de ser capturadas, las ranas fueron sacrificadas en un lapso no mayor a 30 minutos, preservadas en alcohol al 70% e ingresadas a la colección herpetológica de El Colegio de la Frontera Sur, unidad Chetumal (ECO-CH-H 4133-4341).
En el laboratorio, con un calibrador (± 0.01 mm) se tomaron las siguientes medidas corporales de las ranas: longitud hocico-cloaca (LHC), distancia entre ojo-nostrilo (DON), ancho de la boca (AB), longitud de la cabeza (LC) y diámetro del ojo (DO). Se consideraron adultos cuando presentaron una LHC ≥ 15.20 mm y jóvenes con una LHC < 15.20 mm (Iturriaga et al., 2014). Posteriormente, se realizó una incisión longitudinal en el vientre de cada rana y se removió el estómago para obtener las presas ingeridas. El contenido estomacal de cada rana fue vertido en una caja de Petri; las presas se contaron e identificaron hasta la mínima unidad taxonómica identificable (generalmente orden). Además, los insectos holometábolos se separaron en larvas y adultos. Se midió la longitud y ancho de las presas con un objetivo 10× con retícula (± 0.09 mm), para calcular el volumen de cada presa con la fórmula del elipsoide (Parmelee, 1999). Se determinó la importancia de cada categoría de presa con la fórmula propuesta por Biavati et al. (2004).
Debido a que la mayoría de los datos no tuvieron una distribución normal, se utilizaron principalmente pruebas no paramétricas, como la de Mann-Whitney para comparar la LHC del total de machos y hembras y de cada sitio. La diversidad de la dieta se calculó con el exponencial del índice de Shannon, para así obtener la “diversidad verdadera”, la cual tiene como unidad de medida el número de categorías de presa efectivas, lo que permite hacer comparaciones entre sitios (Jost, 2006). Con el fin de evaluar las diferencias en el número de presas y volumen del contenido entre sitios, se utilizaron pruebas de Kruskal-Wallis; cuando resultaron significativas, se utilizaron Mann-Whitney como pruebas “post hoc” (Hammer et al., 2001). Estas últimas también fueron utilizadas para las comparaciones entre sexos y clases de edad.
Para evaluar la existencia de un cambio en la composición de la dieta en relación con la ontogenia se realizó un análisis de componentes principales (ACP) para los datos de cada sitio, utilizando LHC, DON, AB, LC y DO, las cuales se transformaron usando el logaritmo natural. Se utilizó el puntaje del componente principal 1 (LHC) para calcular una matriz de distancias euclidianas de tamaño entre pares de individuos para cada sitio. Después se calculó una matriz de traslape de dieta por pares de individuos, utilizando el índice de similitud proporcional (PS) de Schoener (1968), el cual proporciona valores de 0 (sin traslape) a 1 (traslape total). Se excluyeron las categorías de presa que representaron menos de 1% del total de las presas en cada sitio (Araújo et al., 2007). Si las dietas estuvieran asociadas con el tamaño, se esperaría que las matrices estuvieran negativamente correlacionadas, por lo que dicha correlación se evaluó con una prueba de Mantel con 1,000 simulaciones. Se realizaron análisis multivariados de varianza con permutaciones (Permanova) con el coeficiente de Bray-Curtis para comparar la similitud en la composición de la dieta entre clases de edad y sexos. Cuando hubo diferencias, se realizaron Permanovas como pruebas “post hoc” para cada variable dependiente (i.e., categoría de presa).
Para estimar la especialización individual de la dieta en cada sitio, se consideraron únicamente adultos y se utilizó la adaptación del índice PS (PSi), el cual mide el traslape entre la dieta de los individuos i y la dieta de la población (Bolnick et al., 2002):
Psi = 1 – 0.5 Ʃj |pij–qj| = Ʃj min (pij – qj)
donde pij es la proporción de la categoría j en la dieta del individuo i, y qj es la proporción del recurso j en el nicho de la población. Para los individuos que consumen los recursos en proporción similar a la población en su conjunto, PSi es igual a 1. Para obtener el valor de especialización de toda la población (IS), se promedian los valores de PSi de todos los individuos. El valor de IS varía de cerca de 0 (máxima especialización individual) a 1 (ninguna especialización individual). Se utilizó el método de Monte Carlo con 1,000 simulaciones para calcular la significancia de IS mediante modelos nulos (Bolnick et al., 2002).
La mayoría de los análisis estadísticos se hicieron en el programa PAST versión 3.16 (Hammer et al., 2001). El ACP y la prueba de Mantel se realizaron en el programa XLSTAT (Addinsoft, 2009). El cálculo de PS, IS y las simulaciones de Monte Carlo se realizaron con el paquete RInSp (Zaccarelli et al., 2013). Para todos los análisis se consideró un α = 0.05.
Resultados
De los 209 individuos de E. planirostris recolectados, 52 fueron machos, 65 hembras y 92 jóvenes. Las hembras fueron significativamente más grandes que los machos (tabla 1).
Del total de organismos, 202 (97%) presentaron contenido estomacal, de donde se identificaron 4,796 presas, agrupadas en 27 categorías (tabla 2). Las principales categorías de presas de acuerdo con el índice de importancia relativa y la frecuencia, fueron Isopoda, Formicidae y Oribatida, estas 2 últimas también tuvieron el mayor número de presas (19% cada una), seguidas de Symphypleona (13%) e Isopoda (11%). Por su parte, Isopoda representó el mayor volumen de presas (33%), seguida de Formicidae (14%) y Coleoptera (8%) (tabla 2).
Tabla 1
Valores promedio ± desviación estándar de la longitud hocico-cloaca de 117 adultos de Eleutherodactylus planirostris. En todos los casos p < 0.001.
|
Hembras |
Machos |
|
|
Cancún |
21.22 ± 2.07; n = 17 |
16.47 ± 0.66; n = 20 |
|
Mérida |
20.29 ± 2.65; n = 39 |
17.46 ± 1.32; n = 16 |
|
Oxkutzcab |
21.68 ±2.71; n = 9 |
17.32 ± 1.19; n = 16 |
|
Total |
20.93 ± 2.76; n = 65 |
17.37 ± 1.25; n = 52 |
Tabla 2
Porcentaje numérico (N%), volumétrico (V%), de la frecuencia de presencia (F%) e importancia relativa (I) de las categorías de presas en la dieta de Eleutherodactylus planirostris por sexos y clases de edad.
|
Hembras |
Machos |
Jóvenes |
Total |
|||||||||||||
|
Categoría de presa |
N% |
V% |
F% |
I |
N% |
V% |
F% |
I |
N% |
V% |
F% |
I |
N% |
V% |
F% |
I |
|
Arachnida |
||||||||||||||||
|
Araneae |
3.8 |
1.2 |
52.5 |
19.2 |
1.9 |
2.3 |
32.0 |
12.1 |
2.0 |
2.0 |
30.8 |
11.6 |
2.4 |
1.6 |
37.6 |
13.9 |
|
Pseudoscorpionida |
0.0 |
0.0 |
0.0 |
0.0 |
0.1 |
0.0 |
2.0 |
0.7 |
0.0 |
0.0 |
0.0 |
0.0 |
0.0 |
0.0 |
0.5 |
0.2 |
|
Schizomida |
0.1 |
0.0 |
1.6 |
0.6 |
0.4 |
1.0 |
6.0 |
2.5 |
0.2 |
0.3 |
5.5 |
2.0 |
0.2 |
0.2 |
4.5 |
1.6 |
|
Acari |
||||||||||||||||
|
Mesostigmata |
1.0 |
0.1 |
16.4 |
5.8 |
2.3 |
0.3 |
26.0 |
9.5 |
16.8 |
6.9 |
76.9 |
33.5 |
9.0 |
1.3 |
46.0 |
18.8 |
|
Oribatida |
23.9 |
1.7 |
60.7 |
28.7 |
18.6 |
5.5 |
48.0 |
24.0 |
15.6 |
7.7 |
68.1 |
30.5 |
18.6 |
3.4 |
60.9 |
27.6 |
|
Chilopoda |
||||||||||||||||
|
Lithobiomorpha |
0.5 |
0.3 |
6.6 |
2.5 |
0.3 |
0.7 |
8.0 |
3.0 |
0.5 |
1.3 |
8.8 |
3.5 |
0.5 |
0.6 |
7.9 |
3.0 |
|
Geophilomorpha |
0.1 |
0.1 |
1.6 |
0.6 |
0.1 |
0.0 |
2.0 |
0.7 |
0.1 |
0.3 |
2.2 |
0.9 |
0.1 |
0.1 |
2.0 |
0.7 |
|
Clitellata |
||||||||||||||||
|
Oligocheta |
||||||||||||||||
|
Haplotaxida |
0.3 |
3.2 |
6.6 |
3.3 |
0.0 |
0.0 |
0.0 |
0.0 |
0.0 |
0.5 |
1.1 |
0.5 |
0.1 |
2.2 |
2.5 |
1.6 |
|
Collembola |
||||||||||||||||
|
Entomobryomorpha |
4.8 |
0.2 |
29.5 |
11.5 |
7.5 |
1.0 |
28.0 |
12.2 |
11.1 |
2.4 |
42.9 |
18.8 |
8.5 |
0.7 |
35.1 |
14.8 |
|
Poduromorpha |
0.7 |
0.0 |
3.3 |
1.3 |
0.3 |
0.0 |
6.0 |
2.1 |
1.9 |
0.1 |
16.5 |
6.2 |
1.2 |
0.0 |
9.9 |
3.7 |
|
Symphypleona |
8.0 |
0.1 |
24.6 |
10.9 |
18.6 |
0.7 |
12.0 |
10.4 |
13.1 |
3.8 |
31.9 |
16.3 |
13.0 |
0.9 |
24.8 |
12.9 |
|
Diplopoda |
||||||||||||||||
|
Polydesmida |
0.1 |
0.5 |
1.6 |
0.7 |
0.5 |
1.2 |
10.0 |
3.9 |
0.8 |
1.1 |
11.0 |
4.3 |
0.5 |
0.7 |
7.9 |
3.1 |
|
Gastropoda |
||||||||||||||||
|
Pulmonata |
0.3 |
0.5 |
6.6 |
2.5 |
0.3 |
0.6 |
6.0 |
2.3 |
0.0 |
1.2 |
1.1 |
0.8 |
0.2 |
0.6 |
4.0 |
1.6 |
|
Insecta |
||||||||||||||||
|
Blattodea |
2.4 |
5.7 |
27.9 |
12.0 |
0.4 |
2.9 |
6.0 |
3.1 |
0.1 |
2.6 |
2.2 |
1.6 |
0.8 |
4.7 |
10.9 |
5.5 |
|
Coleoptera |
3.2 |
7.2 |
36.1 |
15.5 |
3.6 |
12.2 |
38.0 |
17.9 |
1.3 |
6.8 |
20.9 |
9.6 |
2.4 |
7.9 |
29.7 |
13.3 |
|
Coleoptera larvas |
0.3 |
0.2 |
6.6 |
2.4 |
0.9 |
1.4 |
4.0 |
2.1 |
0.5 |
0.4 |
11.0 |
4.0 |
0.6 |
0.4 |
7.9 |
3.0 |
|
Dermaptera |
0.9 |
5.3 |
16.4 |
7.5 |
1.1 |
9.8 |
18.0 |
9.7 |
0.3 |
1.1 |
5.5 |
2.3 |
0.7 |
5.2 |
11.9 |
5.9 |
|
Diptera |
3.2 |
7.2 |
32.8 |
14.4 |
5.4 |
1.1 |
40.0 |
15.5 |
5.0 |
3.5 |
49.5 |
19.3 |
4.6 |
5.6 |
42.1 |
17.4 |
|
Hembras |
Machos |
Jóvenes |
Total |
|||||||||||||
|
Categoría de presa |
N% |
V% |
F% |
I |
N% |
V% |
F% |
I |
N% |
V% |
F% |
I |
N% |
V% |
F% |
I |
|
Diptera larvas |
2.1 |
7.5 |
18.0 |
9.2 |
9.7 |
6.6 |
24.0 |
13.4 |
3.1 |
1.4 |
25.3 |
9.9 |
4.5 |
6.2 |
22.8 |
11.1 |
|
Hemiptera |
2.1 |
7.0 |
27.9 |
12.3 |
1.0 |
1.9 |
16.0 |
6.3 |
0.4 |
0.7 |
8.8 |
3.3 |
1.0 |
5.0 |
16.3 |
7.5 |
|
Formicidae |
23.2 |
12.0 |
85.2 |
40.2 |
20.7 |
22.7 |
72.0 |
38.5 |
15.0 |
14.3 |
81.3 |
36.9 |
18.6 |
14.1 |
80.2 |
37.6 |
|
Hymenoptera (no Formicidae) |
0.9 |
0.5 |
9.8 |
3.7 |
0.1 |
0.0 |
2.0 |
0.7 |
1.1 |
0.6 |
22.0 |
7.9 |
0.8 |
0.4 |
13.4 |
4.9 |
|
Lepidopera larvas |
0.2 |
2.7 |
1.6 |
1.5 |
0.0 |
0.0 |
0.0 |
0.0 |
0.1 |
0.1 |
2.2 |
0.8 |
0.1 |
1.8 |
1.5 |
1.1 |
|
Orthoptera |
0.9 |
3.5 |
11.5 |
5.3 |
0.3 |
0.3 |
8.0 |
2.9 |
0.3 |
0.6 |
6.6 |
2.5 |
0.5 |
2.5 |
8.4 |
3.8 |
|
Thysanoptera |
0.1 |
0.0 |
1.6 |
0.6 |
0.1 |
0.0 |
2.0 |
0.7 |
0.2 |
0.0 |
5.5 |
1.9 |
0.1 |
0.0 |
3.5 |
1.2 |
|
Malacostraca |
||||||||||||||||
|
Isopoda |
17.0 |
33.3 |
65.6 |
38.6 |
5.7 |
27.4 |
48.0 |
27.1 |
10.4 |
40.2 |
63.7 |
38.1 |
11.0 |
33.7 |
60.4 |
35.0 |
En promedio, las ranas consumieron 23 presas (1-158) y un volumen de 18.90 mm³ (0.05-298 mm³). La diversidad total de la dieta de E. planirostris fue de 11 categorías de presas efectivas, las cuales variaron por sitio (10 en CAN y 9 en MER y OXK).
Las hembras tuvieron en promedio 41.04 mm³ (1-298 mm³) de volumen del contenido, que fue significativamente mayor al de los machos (x = 12.06 mm³, 0.05-63.21mm³) (z = -5.44, p < 0.001); sin embargo, no se encontraron diferencias en el número de presas consumidas entre sexos (z = -1.12, p = 0.26). Los organismos jóvenes consumieron un mayor número de presas (x = 25, 1-157) que los adultos (x = 22, 1-158) (z = -3.52, p < 0.001), aunque con un menor volumen para los primeros (x = 7.79 mm³, 0.05-15.52 mm³ vs x = 27.98 mm³, 15.25-298.11 mm³) (z = 6.17, p < 0.001). En MER se consumió un mayor número de presas que en CAN (x = 31, 1-158 vs x = 17, 2–60) (z = -5.64, p = < 0.001) y OXK (x = 18, 1-53) (z = -5.60, p < 0.001), pero entre OXK y CAN no hubo diferencias (z = -1.12, p = 0.27). El volumen del contenido fue distinto en todos los sitios, siendo MER en donde se presentó el mayor valor (x = 23.17 mm³, 0.82-196.25 mm³), seguido de OXK (x = 16.04 mm³, 1.14-160.12 mm³) y CAN (x = 14 mm³, 0.05-298.1 mm³) (p < 0.04 en todos los casos).
Existió una correlación negativa entre la matriz de distancias morfológicas y la de traslape de dietas en MER (r = -0.190, p < 0.001) y OXK (r = -0.172, p < 0.001), pero no en CAN (r = -0.020, p = 0.533). Las categorías de presas más consumidas por los jóvenes fueron las larvas de Coleoptera (Pseudo-F = 13.9, p < 0.001) y Entomobryomorpha (Pseudo-F = 4.2, p = 0.02) en CAN; en MER fue Poduromorpha (Pseudo-F = 8.4, p = 0.002), Oribatida en OXK (Pseudo-F = 12.21, p = < 0.001) y en los 3 sitios Mesostigmata (CAN Pseudo-F = 28.7, MER Pseudo-F = 23.11, OXK Pseudo-F = 24.07; p < 0.001). Los adultos consumieron más presas de las categorías Formicidae (Pseudo-F = 6.0, p = 0.002), Blattodea (Pseudo-F = 9.9, p = 0.002) y Araneae (Pseudo-F = 4.9, p = 0.02) que los jóvenes en MER. El sexo no influyó en la composición de la dieta en los 3 sitios (CAN: Pseudo-F = 0.89, p = 0.52; MER: Pseudo- F = 1.97, p = 0.06; OXK: Pseudo-F = 2.23, p = 0.07). Por último, se encontró un nivel de especialización individual en la dieta mayor a la esperada por azar de acuerdo con los modelos nulos (fig. 1), la cual fue ligeramente mayor en CAN (IS = 0.37, p < 0.001) que en MER (IS = 0.47, p < 0.001) y OXK (IS = 0.49, p < 0.001).
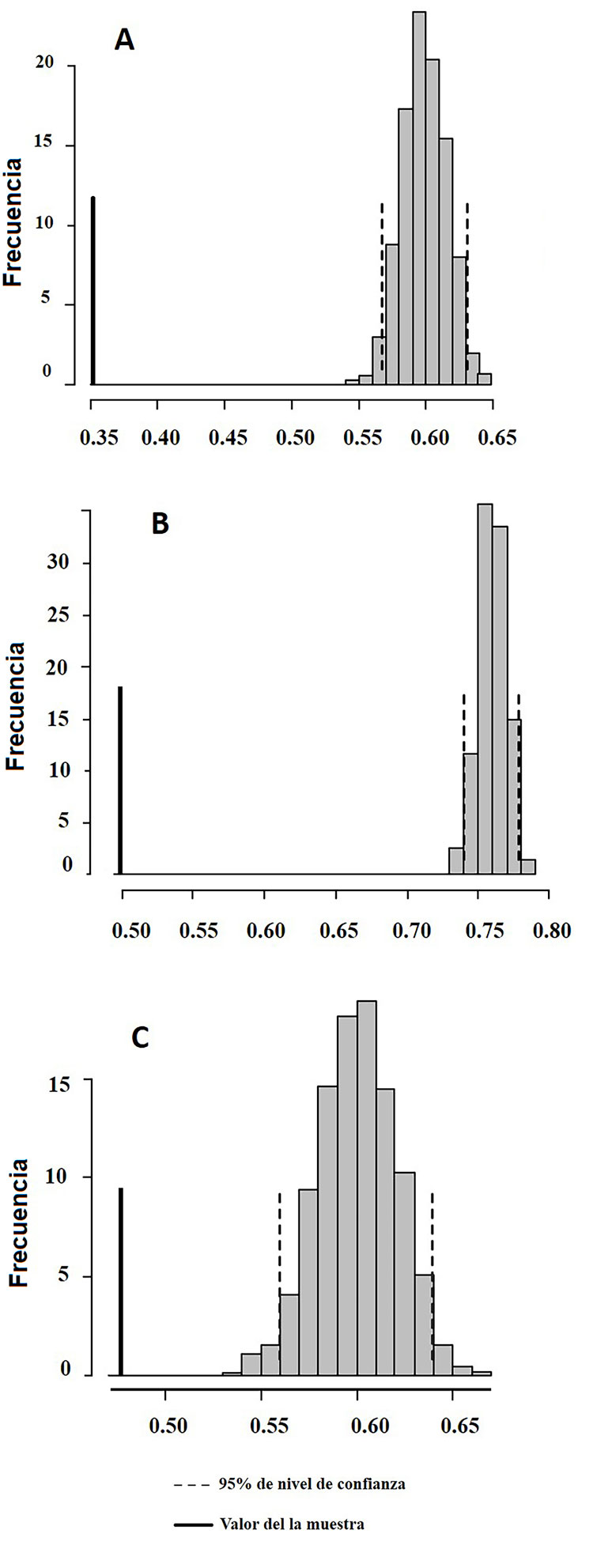
Discusión
El dimorfismo sexual en el tamaño en E. planirostris (machos notablemente más pequeños que las hembras) ya había sido previamente reportado para otras poblaciones introducidas de esta especie (Ferreira et al., 2015; Olson y Beard, 2012) y es común en otras especies del subgénero Euhyas, al cual pertenece esta especie (Hedges et al., 2008). A pesar de ésto, no se encontraron diferencias en la composición de la dieta entre sexos, similar a lo reportado para otras especies de anuros que viven en la hojarasca (Biavati et al., 2004; Lima y Moreira, 1993).
Eleutherodactylus planirostris es una rana que consume hormigas en mayor proporción a otras presas, aun cuando haya una mayor disponibilidad de estas últimas en el ambiente (Ferreira et al., 2015; Olson y Beard, 2012). Sin embargo, en la península de Yucatán se encontró que el consumo de ácaros y colémbolos fue similar al de las hormigas. Esto podría estar relacionado con la distribución desigual de las clases de edad de las ranas en las muestras, ya que los jóvenes representaron 45% del total de las ranas en este estudio y consumieron mayor cantidad de Oribatida, Mesostigmata, Entomobryomorpha y Poduromorpha que los adultos. En Hawai, los jóvenes representaron solo 35% (Olson y Beard, 2012) y en Maui 3% (Ferreira et al., 2015). A pesar de ésto, es importante mencionar que mientras que todas las especies de hormigas en Hawai son exóticas, ~ 89% de las que habitan en la península de Yucatán son nativas de esta región (AntWeb, 2019; Vásquez-Bolaños, 2011). Por lo tanto, E. planirostris podría tener un mayor efecto negativo sobre especies nativas de artrópodos de la hojarasca y sus interacciones en esta última región.
Todas las categorías de presas encontradas en la rana de invernadero en este estudio ya habían sido reportadas anteriormente en otros sitios de invasión (Ferreira et al., 2015; Goin, 1947; Olson y Beard, 2012), excepto Schizomida. Este último orden tuvo una baja frecuencia, pero se consumió en los 3 sitios estudiados. En la península de Yucatán solo se han registrado Schizomus goodnightorum y Stenochrus portoricensis, las cuales pueden ser confundidas al momento de ser consumidas con presas morfológicamente similares, como insectos marchadores terrestres y quitinosos, como hormigas pequeñas (López et al., 2007). Además, pueden encontrarse en microhábitats similares a los de las presas que suelen consumir, como colémbolos y cochinillas (de Armas y Melic, 2015), por lo que no se considera raro el consumo de esquizómidos en dicha península.
En este estudio, se encontró que la composición de la dieta varía con la ontogenia de E. planirostris ya que los artrópodos muy pequeños, como ácaros y colémbolos, fueron más consumidos por los organismos jóvenes; mientras que artrópodos más grandes, como hormigas, fueron más consumidos por los adultos. Este resultado es consistente con lo observado en otras especies de anuros de tamaño pequeño que forrajean en la hojarasca (Blackburn y Moreau, 2006; Lima y Moreira, 1993). Este patrón sugiere que el cambio en la dieta, producto de la ontogenia de estas especies, se lleva a cabo principalmente por un forrajeo pasivo hacia presas de distintos tamaños (sensu Whitfield y Donnelly, 2006). Sin embargo, es posible que también exista un cambio en la actividad de forrajeo en E. planirostris, como lo sugiere la variación ontogénica en el número de presas consumidas y que este cambio tenga un efecto en la composición de la dieta (Lima y Magnusson, 2000).
El volumen del contenido estomacal consumido por las hembras fue mayor al de los machos, pero no así el número de presas. Este patrón también se presentó en las poblaciones de E. planirostris en Maui (Ferreira et al., 2015) y Hawai (Olson y Beard, 2012), y puede estar relacionado con el mayor tamaño de las hembras, que les permite consumir presas más grandes (Biavati et al., 2004) y por lo tanto, contener un mayor volumen de presas. La similitud en el número de presas puede deberse a que los machos, durante las noches del periodo reproductivo, podrían tener la misma oportunidad de capturar presas que las hembras (Wells, 2001).
A pesar de que E. planirostris tiene una dieta especializada en hormigas, se encontró que presentó especialización individual en su dieta. Este resultado concuerda con lo encontrado en varias especies de anfibios generalistas y en menor grado en especialistas (Araújo et al., 2007; Costa et al., 2015). La especialización individual podría disminuir la competencia intraespecífica (Araújo et al., 2011; Svanbäck y Bolnick., 2007) y de esta manera, contribuir a la alta abundancia de E. planirostris (Gómez-Salazar y Cedeño-Vázquez, 2017) y el establecimiento de sus poblaciones en la península de Yucatán.
Finalmente, el porcentaje de individuos con presas se encuentra entre los más altos reportados y el número de presas consumidas por organismo es mayor a los registrados previamente (Ferreira et al., 2015; Olson y Beard, 2012). Ésto, aunado a su especialización en hormigas, el cambio ontogénico, la especialización individual en su dieta, su amplia distribución y alta abundancia en algunos sitios (Gómez-Salazar y Cedeño-Vázquez, 2017), sugiere que la rana de invernadero podría ocasionar algunos impactos, tales como la disminución de las poblaciones de artrópodos nativos (Olson y Beard, 2012) y la alteración del ciclo de nutrientes (Beard et al., 2003; Sin et al., 2008). Esta especie no se encuentra incluida en algún instrumento legal, como lo es la lista de especies exóticas invasoras para México emitida por la Semarnat (2016). Por lo tanto, consideramos que E. planirostris se debe incluir en esta lista, con la finalidad de poder implementar un plan de control o erradicación, como los que se han establecido para otras especies invasoras como parte de la estrategia nacional sobre especies invasoras en México (Comité Asesor Nacional sobre Especie Invasoras, 2010).
Agradecimientos
A Rubén Alonso Carbajal Márquez, Javier Alonso Ortiz Medina y Daniel Isaac Cabrera Cen por su valioso apoyo en el trabajo de campo. A la Sra. Aracely Domínguez por el hospedaje y las facilidades proporcionadas en el hotel El Rey del Caribe. A Manuel Campos Ancona por las facilidades de acceso al parque Animaya. A los habitantes del poblado Emiliano Zapata por permitir el acceso a su comunidad. Al Consejo Nacional de Ciencia y Tecnología por la beca otorgada a la primera autora para sus estudios de maestría, de los cuales se deriva este trabajo y a El Colegio de la Frontera Sur por el apoyo institucional. La colecta de ejemplares se llevó a cabo bajo la autorización de la Dirección General de Vida Silvestre de la Semarnat, mediante los permisos de colecta científica SGPA/DGVS700950/16 y SGPA/DGVS/01205/17, otorgados a Fausto Méndez-de la Cruz con extensión para José Rogelio Cedeño Vázquez.
Referencias
Addinsoft, S. A. R. L. (2009). XLSTAT software, version 2018.1. París, Francia.
AntWeb. (2019). Disponible en: http://www.antweb.org; última consulta: 07-V-2019.
Araújo, M. S., Bolnick, D. I. y Layman, C. A. (2011). The ecological causes of individual specialization. Ecology Letters, 14, 948–958. https://doi.org/10.1111/j.1461-0248.2011.01662.x
Araújo, M. S., dos Reis, S. F., Giaretta, A. A., Machado, G. y Bolnick, D. I. (2007). Intrapopulation diet variation in four frogs (Leptodactylidae) of the Brazilian Savannah. Copeia, 4, 855–865. https://doi.org/10.1643/0045-8511(2007)7[855:idviff]2.0.co;2
Beard, K. H., Eschtruth, A, K., Vogt, K. A., Vogt, D. J. y Scatena, F. N. (2003). The effects of the frog Eleutherodactylus coqui on invertebrates and ecosystem processes at two scales in the Luquillo experimental Forest, Puerto Rico. Journal of Tropical Ecology, 19, 607–617. https://doi.org/10.1017/s0266467403006011
Biavati, G. M., Wiederhecker, H. C. y Colli, G. R. (2004). Diet of Epipedobates flavopictus (Anura: Dendrobatidae) in a Neotropical Savanna. Journal of Herpetology, 38, 510–518. https://doi.org/10.1670/30-04a
Blackburn, D. C. y Moreau, C. S. (2006). Ontogenetic diet change in the arthroleptid frog Schoutedenella xenodactyloides.
Journal of Herpetology, 40, 388–394. https://doi.org/10.1670/0022-1511(2006)40[388:odcita]2.0.co;2
Bolnick, D. I., Yang, L. H., Fordyce, J. A., Davis, J. M. y Svanbäck, R. (2002). Measuring individual-level resource specialization. Ecology, 83, 2936–2941. https://doi.org/10.1890/0012-9658(2002)083[2936:milrs]2.0.co;2
Bomford, M., Kraus, F., Barry, S. C. y Lawrence, E. (2009). Predicting establishment success for alien reptiles and amphibians: a role for climate matching. Biological Invasions, 11, 713–724. https://doi.org/10.1007/s10530-008-9285-3
Cedeño-Vázquez, J. R. y Beutelspacher-García, P. M. (2019). Geographic distribution. Eleutherodactylus planirostris (Greenhouse Frog). Herpetological Review, 50, 96.
Cedeño-Vázquez, J. R., González-Vázquez, J., Martínez-Arce, A. y Canseco-Márquez, L. (2014). First record of the invasive greenhouse frog (Eleutherodactylus planirostris) in the Mexican Caribbean. Revista Mexicana de Biodiversidad, 85, 650–653. https://doi.org/10.7550/rmb.43234
Christy, M. T., Savidge, J. A. y Rodda, G. H. (2007). Multiple pathways for invasion of anurans on a Pacific island. Diversity and Distributions, 13, 598–607. https://doi.org/10.1111/j.1472-4642.2007.00378.x
Comité Asesor Nacional sobre Especies Invasoras. (2010). Estrategia nacional sobre especies invasoras en México, prevención, control y erradicación. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Comisión Nacional de Áreas Protegidas, Secretaría de Medio Ambiente y Recursos Naturales.
Contreras-Calvario, A. I., Mora-Reyes, A., Parra-Olea, G. y Mendoza, A. M. (2018). New record of the introduced species Eleutherodactylus planirostris (Anura: Eleutherodactylidae) in the state of Veracruz, Mexico. Herpetological Journal, 28, 107–110.
Costa, A., Salvidio, S., Posillico, M., Matteucci, G., de Cinti, B. y Romano, A. (2015). Generalization within specialization: inter-individual diet variation in the only specialized salamander in the world. Scientific Reports, 5, 1–10. https://doi.org/10.1038/srep13260
Crawford, A. J., Alonso, R., Jaramillo, C. A., Sucre, S. y Ibáñez, R. (2011). DNA barcoding identifies a third invasive species of Eleutherodactylus (Anura: Eleutherodactylidae) in Panama City, Panama. Zootaxa, 2890, 65–67. https://doi.org/10.11646/zootaxa.2890.1.6
de Armas, L. F. y Melic, A. (2015). Orden Schizomida. Revista Idea-SEA, 21, 1–6.
Ferreira, R. B., Beard, K. H., Choi, R. T. y Pitt, W. C. (2015). Diet of the nonnative frog (Eleutherodactylus planirostris) in Maui, Hawaii. Journal of Herpetology, 49, 586–583. https://doi.org/10.1670/14-103
García-Balderas, C. M., Cedeño-Vázquez, J. R. y Mineros-Ramírez, R. (2016). Eleutherodactylus planirostris. Distribution notes. Mesoamerican Herpetology, 3, 173.
Goin, C. J. (1947). Studies on the life history of Eleutherodactylus ricordii planirostris (Cope, 1862) in Florida: with special reference to the local distribution of an allelomorphic color pattern. Tallahassee: University of Florida Press.
Gómez-Salazar, A. A. y Cedeño-Vázquez, J. R. (2017). Distribución y abundancia de la rana de invernadero, Eleutherodactylus planirostris (Cope, 1862), en Playa del Carmen, Quintana Roo, México. Teoría y Praxis, 21, 55–66. https://doi.org/10.22403/uqroomx/typ21/03
Hammer, O., Harper, D. A. T. y Ryan, P. D. (2001). PAST: paleontological statistics software for education and data analysis. Paleontologia Electronica, 4, 9.
Hedges, S. B., Duellman, W. E. y Heinicke, M. P. (2008). New World direct-developing frogs (Anura: Terrarana): molecular phylogeny, classification, biogeography, and conservation. Zootaxa, 1737, 1–182. https://doi.org/10.11646/zootaxa.1737.1.1
Iturriaga, M., Sanz, A. y Oliva, R. (2014). Seasonal reproduction of the Greenhouse Frog Eleutherodactylus planirostris (Anura: Eleutherodactylidae) in Havana, Cuba. South American Journal of Herpetology, 9, 142–150. https://doi.org/10.2994/sajh-d-13-00039.1
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363–375. https://doi.org/10.1111/j.2006.0030-1299.14714.x
Kraus, F. (2009). Impacts of alien reptiles and amphibians. En F. Kraus. (Ed.), Alien reptiles and amphibians a scientific compendium and analysis (pp. 57–93). Dordrecht: Springer. https://doi.org/10.1007/978-1-4020-8946-6_3
Lee, W. H., Lau, M. W., Lau, A., Rao, D. y Sung, Y. H. (2016). Introduction of Eleutherodactylus planirostris (Amphibia, Anura, Eleutherodactylidae) to Hong-Kong. Acta Herpetologica, 11, 85–89. https://doi.org/10.13128/Acta_Herpetol-16491
Lim, K. K. P. y Sind, L. I. (2017). Greenhouse frogs at Clementi Woods. Singapore Biodiversity Records, 2017, 103–104.
Lima, A. P. y Magnusson, W. E. (2000). Does foraging activity change with ontogeny? An assessment for six sympatric species of postmetamorphic litter anurans in central Amazonia. Journal of Herpetology, 34, 192–200.
Lima, A. P. y Moreira, G. (1993). Effects of prey size and foraging mode on the ontogenetic change in feeding niche of Colostethus stepheni (Anura: Dendrobatidae). Oecologia, 95, 93–102. https://doi.org/10.1007/bf00649512
López, J. A., Ghirardi, R., Scarabotti, P. A. y Medrano, M. C. (2007). Feeding ecology of Elachistocleis bicolor in a riparian locality of the middle Paraná River. Herpetological Journal, 17, 48–53.
McCraine, J. R., Collart, J. R., Castañeda, F. E. y Solís, J. M. (2008). Geographic distribution. Eleutherodactylus (Euhyas) planirostris (greenhouse frog). Herpetological Review, 39, 362–363.
Olson, C. A. y Beard, K. H. (2012). Diet of the introduced Greenhouse Frog in Hawaii. Copeia, 1, 121–129. https://doi.org/10.1643/ce-11-008
Olson, C. A., Beard, K. H., Koons D. N. y Pitt, W. C. (2012). Detection probabilities of two introduced frogs in Hawaii: implications for assessing non-native species distributions. Biological Invasions, 14, 889–900. https://doi.org/10.1007/s10530-011-0125-5
Olson, C. A., Diesmos, A. y Beard, K. H. (2014). Geographical distribution: Eleutherodactylus planirostris (Greenhouse Frog). Herpetological Review, 45, 652–653.
Ortiz-Medina, J. A., Nahuat-Cervera, P. E., Cabrera-Cen, D., Vega-Marcín, A. y Cedeño-Vázquez, J. R. (2017). First records for the invasive Greenhouse Frog, Eleutherodactylus planirostris (Cope, 1862) (Anura: Eleutherodactylidae), in the state of Yucatán, Mexico. Mesoamerican Herpetology, 4, 191–193.
Parmelee, J. R. (1999). Trophic ecology of a tropical anuran assemblage. Scientific Papers Natural History Museum, The University of Kansas, 11, 1–59. https://doi.org/10.5962/bhl.title.16167
Schoener, T. W. (1968). The Anolis lizards of Bimini: resource partitioning in a complex fauna. Ecology, 49, 704–726. https://doi.org/10.2307/1935534
Schwartz, A. (1974). Eleutherodactylus planirostris. Catalogue of American Amphibians and Reptiles, 154, 1–4.
Semarnat (Secretaría del Medio Ambiente y Recursos Naturales). (2016). Acuerdo por el que se determina la lista de Especies Exóticas Invasoras para México. Diario Oficial de la Federación, México, D.F.
Sin, H., Beard, K. H y Pitt, W. C. (2008). An invasive frog, Eleutherodactylus coqui, increases new leaf production and leaf litter decomposition rates through nutrient cycling in Hawaii. Biological Invasions, 10, 335–345. https://doi.org/10.1007/s10530-007-9133-x
Stewart, M. M. y Martin, G. E. (1980). Coconut husk-piles a unique habitat for Jamaican terrestrial frogs. Biotropica, 12, 107–116. https://doi.org/10.2307/2387726
Svanbäck, R. y Bolnick, D. I. (2007). Intraspecific competition drives increased resource use diversity within a natural population. Proceedings of the Royal Society B, 274, 839–844. https://doi.org/10.1098/rspb.2006.0198
Ukpong, E. E., Jacob, D. E., Ufot, I. y Joseph, A. E. (2012). The fauna biodiversity of Ikoy Ondo community forest in Essien Udim L.G.A. of Akwa Ibom State, South Eastern Nigeria. Ethiopian Journal of Environmental Studies and Management, 5, 276–280. https://doi.org/10.4314/ejesm.v5i3.9
Vásquez-Bolaños, M. (2011). Lista de especies de hormigas (Hymenoptera: Formicidae) para México. Dugesiana, 18, 95–133.
Villa, J. (2015). Las ranitas de Cayos Miskitos. Revista de Temas Nicaragüenses, 89, 6–22.
Wells, K. D. (2001). The energetics of calling in frogs. En M. J. Ryan (Ed.), Anuran communication (pp. 45–60). Washington, DC: Smithsonian Institution Press.
Whitfield, S. M. y Donnelly, M. A. (2006). Ontogenetic and seasonal variation in the diets of a Costa Rican leaf-litter herpetofauna. Journal of Tropical Ecology, 22, 409–417. https://doi.org/10.1017/s0266467406003245
Zaccarelli, N., Mancinelli, G. y Bolnick, D. I. (2013). RInSp: an R package for the analysis of individual specialization in resource use. Methods in Ecology and Evolution, 4, 1018–1023. https://doi.org/10.1111/2041-210x.12079



