Recuperación de la diversidad florística en plantaciones de cítricos abandonadas en el sur de Veracruz, México: implicaciones para la conservación
Juan Carlos López-Acosta a, Gregoria Zamora-Pedraza a, Eduardo Mendoza-Ramírez b y M. Cristina MacSwiney a, *
a Centro de Investigaciones Tropicales, Universidad Veracruzana, Calle José María Morelos y Pavón 44 y 46, Centro, 91000 Xalapa, Veracruz, México
b Laboratorio de Análisis para la Conservación de la Biodiversidad, Instituto de Investigaciones sobre los Recursos Naturales, Universidad Michoacana de San Nicolás de Hidalgo, Ave. San Juanito Itzícuaro s/n, Col. Nueva Esperanza, 58330 Morelia, Michoacán, México
*Autor para correspondencia: cmacswiney@uv.mx (M.C. MacSwiney)
Resumen
La región de Uxpanapa, en el sur de Veracruz, es uno de los principales centros de diversidad vegetal de México y en donde las actividades humanas han ocasionado la desaparición de cerca del 80% de la vegetación original. Actualmente, las plantaciones de cítricos son un componente evidente del paisaje de la zona. Sin embargo, debido a su baja rentabilidad, muchas plantaciones han sido abandonadas, convirtiéndose en áreas de vegetación secundaria. Para analizar la dinámica de regeneración en estos sistemas, se caracterizó la composición, diversidad y recambio de especies vegetales en una cronosecuencia de naranjales abandonados. Se consideraron además las estrategias de establecimiento, formas de vida y estrategias de dispersión de las especies vegetales. Se muestrearon 0.1 ha en cada una de 6 plantaciones con diferentes tiempos de abandono (3, 8, 17, 26, 36 y 48 meses). En cada transecto se distinguieron 2 grupos de plantas: adultas y brinzales. En total se registraron 191 especies (57 familias y 122 géneros). La riqueza florística se incrementó con el tiempo de abandono. Los árboles con dispersión zoocora dominaron en todas las parcelas. Las características de los naranjales abandonados son atractivas para dispersores vertebrados y su cercanía a fuentes de propágulos favorece un proceso de regeneración acelerado.
Palabras clave:
Cronosecuencia; Diversidad vegetal; Plantaciones frutícolas; Sucesión secundaria; Uxpanapa
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Recovery of floristic diversity in abandoned citrus plantations in southern Veracruz, Mexico: implications for conservation
Abstract
The Uxpanapa region at south of Veracruz, is one of the centers of plant diversity in Mexico, where the transformation by human activities have caused the disappearance of about 80% of the original vegetation. Currently, citrus plantations are a common component of the landscape, however, due to low profitability, many plantations have been abandoned, turning into areas of secondary vegetation. The composition, diversity and turnover of plant species in a chronosequence of abandoned orange groves was characterized, also considering establishment strategies, life forms and species dispersal strategies. We sampled 0.1 ha in 6 plantations with different time of abandonment (3, 8, 17, 26, 36 and 48 months), for a total of 0.6 ha sampled. In each transect, 2 contingents were considered: adult and regenerating plants. A total of 191 species were recorded (57 families and 122 genera). The floristic diversity increased as the time of abandonment increased. Plants with zoocoric dispersion and trees dominated in all stages of abandonment. The characteristics of the abandoned citrus plantations are attractive for vertebrate dispersers and their proximity to sources of propagules allow an accelerated regeneration process.
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Chronosequence; Plant diversity; Fruit plantations; Secondary succession; Uxpanapa
Introducción
El trópico ha experimentado fuertes alteraciones que han generado paisajes constituidos por un mosaico heterogéneo de hábitats con distintos grados de conservación e impacto humano (Dirzo et al., 2009). En el Neotrópico, las selvas húmedas y subhúmedas cubren actualmente sólo 26% y 43.6% de su extensión original respectivamente, mientras que el resto se ha convertido en asociaciones vegetales con distintos grados de transformación (Sánchez-Colón et al., 2010). En el caso particular de México, la ganadería y la agricultura son las principales causas de cambio de la cobertura forestal. Se ha estimado que el 82.3% de las zonas originalmente cubiertas por vegetación madura se han destinado para usos agrícolas y pecuarios, mientras que el 14% fue modificado a pastizales (Meneses, 2009). Estos cambios son dinámicos ya que las variaciones en los factores socio-económicos y de mercado que determinan la rentabilidad de las actividades productivas pueden hacer que se abandonen las tierras, dando lugar al surgimiento de asociaciones de vegetación secundaria a través de procesos de sucesión ecológica (Martínez-Ramos y García-Orth, 2007; Parrotta, 1992). Por ejemplo, en México, alrededor de 509,000 hectáreas que en 1993 aparecieron como dedicadas a la agricultura o ganadería, en el año 2002 estuvieron cubiertas por vegetación secundaria, que en partes era imposible de distinguir de la vegetación madura al analizarse con imágenes satelitales (Sánchez-Colón et al., 2010).
La región de Uxpanapa, en el estado de Veracruz, es una zona crítica para la conservación de la flora de las selvas húmedas de México ya que alberga un estimado de 3,500 especies de plantas vasculares (Wendt, 1987). No obstante, a partir de los últimos 40 años, esta área ha perdido 80% de su cobertura original debido al establecimiento de pastizales para uso ganadero, parcelas para agricultura de autoabasto, plantaciones de hule (Hevea brasiliensis) y de cítricos (Citrus spp.; Rodríguez-Luna et al., 2011). Estas últimas se localizan en la zona centro y oeste del valle de Uxpanapa y abarcan una superficie superior a las 2,000 hectáreas. Sin embargo, a consecuencia del surgimiento de problemas para la comercialización de este producto, ha ocurrido un abandono considerable de sus plantaciones, las cuales se convierten en focos de regeneración de la cobertura vegetal y refugio potencial de especies. Esto puede amortiguar los impactos antropogénicos negativos. Resulta, por lo tanto, necesario desarrollar estudios enfocados a evaluar en qué medida se recupera la diversidad vegetal en estas parcelas abandonadas, que son parte integral del paisaje en la región de estudio. En términos más generales, estas parcelas constituyen un modelo útil para incrementar nuestro conocimiento sobre la dinámica de los paisajes antropizados en regiones tropicales (Gardner et al., 2007; Melo et al., 2013; Van Breugel et al., 2013).
La transformación de las plantaciones abandonadas a bosques secundarios, es resultado de procesos de sucesión ecológica, la cual es definida como el remplazo de las especies a través del tiempo que puede culminar en un estado similar al existente previo al disturbio o bien en estados alternativos (Chazdon, 2014). Este proceso puede estar mediado por una gran cantidad de factores como el nivel del impacto inicial, las condiciones físico-químicas y biológicas del suelo, el banco de semillas, la apertura del dosel, la atracción a dispersores y las estrategias de establecimiento de las plantas. Por otro lado, también pueden influir las características a nivel del paisaje como su conectividad y distancia a la fuente de propágulos. Así mismo, diferentes intensidades de manejo y tolerancia de las plantas o el manejo selectivo de algunas especies pueden originar distintas variantes de bosque secundario (Finegan, 1992; Gómez-Pompa y Vázquez-Yanes, 1985; López-Acosta et al., 2014; Pietersen et al., 2018; Ruiz-Guerra et al., 2014).
Los cultivos de naranja abandonados, pueden servir como un modelo de estudio de la sucesión secundaria, ya que existen en muchos sistemas tropicales, y pueden por lo tanto ser utilizados para realizar comparaciones entre diferentes regiones. En este caso específico, el estudio del abandono de las tierras de cultivo puede presentarnos una oportunidad para identificar procesos de sucesión que pueden ser tomados en cuenta como parte de las estrategias de restauración, favoreciendo los procesos de conservación y manejo a nivel de paisaje.
Para analizar la dinámica temporal de cambio de la estructura vegetal en naranjales abandonados seleccionamos una cronosecuencia de parcelas con 3 y hasta 48 meses de abandono. Mediante este diseño observacional se abordaron 3 preguntas específicas: i) ¿Cómo cambia la diversidad alfa y beta a lo largo de la cronosecuencia? ii) ¿Cómo cambia la estructura de la comunidad vegetal, evaluada por los valores de importancia de las especies que las componen? iii) ¿En qué medida cambia la representación de distintas estrategias de dispersión, establecimiento y formas de vida de las plantas a través de una cronosecuencia? Nuestra hipótesis de trabajo es que este tipo de plantaciones forestales abandonadas son atractivos para los dispersores que promueven un alto recambio de especies vegetales y la llegada de propágulos típicos de zonas conservadas (Otsamo, 2000; Parrotta, 1995, 1999) constituyéndose como núcleos de regeneración y reservorios de diversidad vegetal, por lo que tienen una alta probabilidad de recuperar parte de la diversidad vegetal original en poco tiempo.
Materiales y métodos
El valle de Uxpanapa tiene una superficie de 11,074.88 km2 y se localiza en el sureste del estado de Veracruz, en el límite con Oaxaca (fig. 1). La región es levemente accidentada con elevaciones de 100 a 250 m snm. En general existen 2 tipos de suelos: Luvisoles y Acrisoles. Predominan los climas cálidos húmedos con abundantes lluvias en verano. La temperatura media anual oscila entre los 24 y 26 °C y la precipitación es mayor a los 3,000 mm anuales en las partes de mayor altitud (Inegi, 2008). Originalmente, Uxpanapa estaba dominada por selva alta perennifolia (Miranda y Hernández, 1963) y fue la región con selva tropical en suelos planos más extensa de México (Gómez-Pompa, 1979). Los árboles más característicos de la selva alta perennifolia son: Ceiba pentandra, Terminalia amazonia, Pouteria sapota, Manilkara zapota, Sterculia mexicana, Dialium guianense, Cojoba arborea, Omphalea oleifera y Aspidosperma megalocarpon. En el dosel medio las especies más abundantes son: Guarea glabra, Guarea bijuga, Quararibea funebris, Quararibea sessiliflora y Dendropanax arboreus. Actualmente, la región está cubierta por una mezcla de fragmentos de vegetación primaria, asociaciones secundarias y algunos agroecosistemas (Rodríguez-Luna et al., 2011).
El área específica de estudio está situada en los ejidos circundantes al poblado 2 del valle de Uxpanapa, entre las localidades Plan de Arroyo y Jorge L. Tamayo (17°13’5.58” N, 94°36’50.38” O) (fig. 1). Las parcelas se ubicaron en las cercanías de la carretera principal del valle de Uxpanapa, en una zona de alta perturbación, donde se encuentran extensas superficies de cultivos de naranja, tanto en manejo activo como en abandono. Esta zona está rodeada de fragmentos de acahuales y selvas en buen estado de conservación, todo ésto dentro de una matriz de pastizales ganaderos.
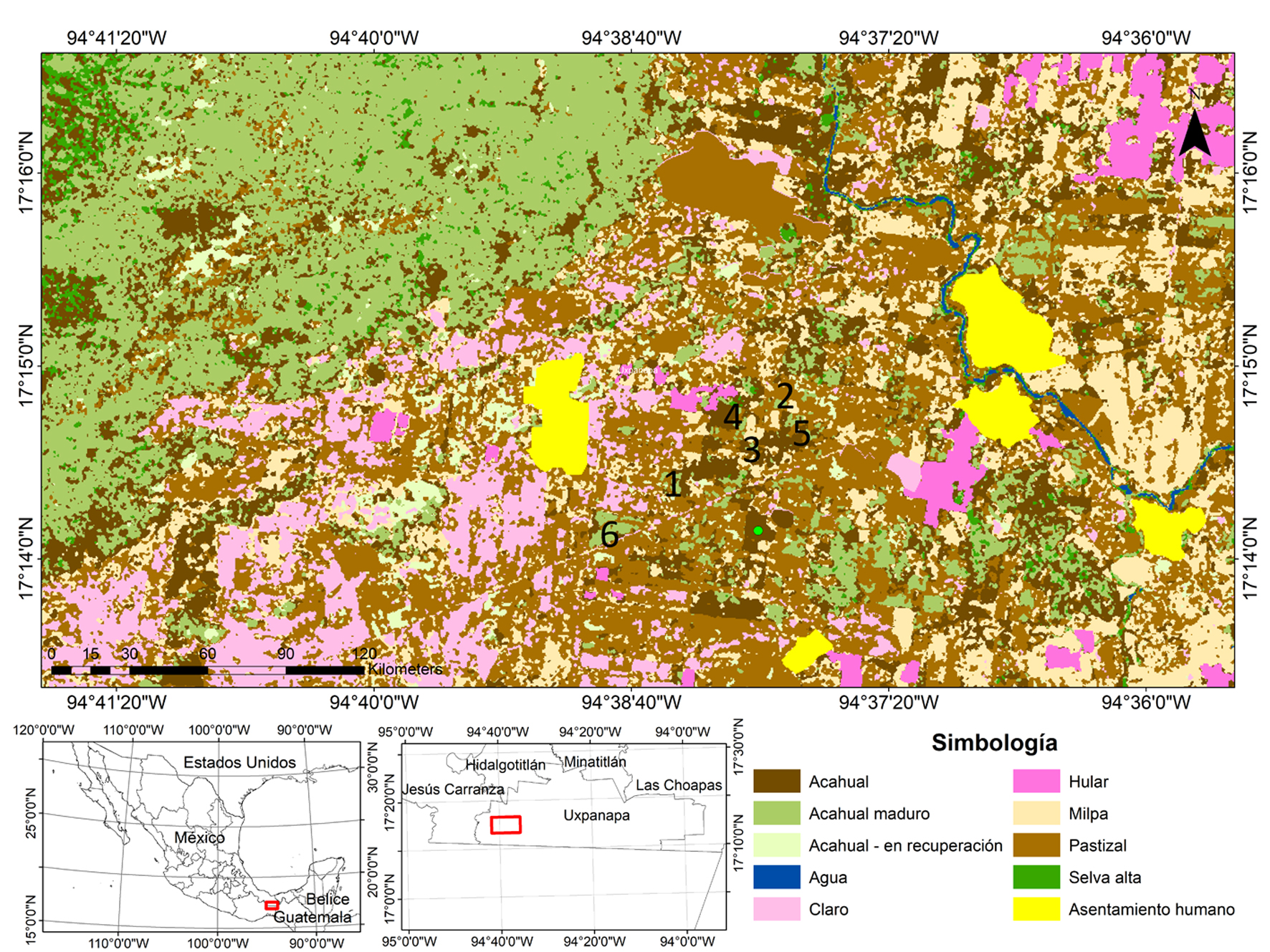
Se seleccionaron 6 plantaciones de naranja, cada una con distinta edad de abandono: 3, 8, 17, 26, 36 y 48 meses, todas ellas con al menos 3 ha de extensión. Los manejos típicos de los naranjales en activo incluyen el chapeo constante, barbecho, limpia manual de árboles y aplicación de herbicidas. El abandono implicó la interrupción de estas prácticas. Los muestreos de vegetación se realizaron entre agosto y septiembre de 2011. Para determinar la edad de las parcelas abandonadas se realizaron entrevistas con sus dueños, agentes municipales y los ejidatarios en la zona. Se realizaron recorridos de campo para corroborar la información de manera independiente y para hacer la selección de aquellas parcelas para las que el tiempo reportado de abandono y los tipos de manejo local fueran coincidentes con lo observado. Otro criterio de selección fue que las parcelas estuvieran rodeadas por paisaje similares, en términos de su relieve, orientación y tipo de suelo, así como su distancia a fragmentos de selva (ca. 2 km). En cada una de las parcelas, se realizaron diez transectos de 50 × 2 m (100 m2; Gentry, 1982, 1988), para un total 0.1 ha por parcela y un total global de 0.6 ha. Los transectos se dispusieron aleatoriamente, evitando que se superpusieran y los potenciales efectos de borde entre parcelas contiguas. La distancia mínima entre transectos fue de 50 m y de 500 m entre parcelas. Dentro de cada transecto se identificaron y registraron todas las plantas leñosas y herbáceas con diámetro a la altura del pecho (DAP) ≥ 1 cm. Además, en los mismos transectos se identificaron y registraron todos los brinzales con un diámetro ≤ 1cm de DAP, pero una altura ≥ 30 cm. Este último conjunto de plantas fue denominado como la vegetación en regeneración porque asumimos que refleja el potencial del establecimiento y crecimiento de especies de plantas en cada uno de las etapas de la cronosecuencia. Para cada planta se determinó su estrategia de establecimiento (pioneras vs. tolerantes), su forma de vida (hierba, árbol, arbusto, liana, hemiepífita, palmas) y su síndrome de dispersión (autocora, anemocora, zoocora). En el caso de que se reportara más de un síndrome de dispersión para una especie, se seleccionó el más comúnmente referido en la literatura. Los ejemplares colectados fueron depositados en el Herbario del Centro de Investigaciones Tropicales de la Universidad Veracruzana (CITRO-UV). La nomenclatura taxonómica fue cotejada con Villaseñor (2016).
Se calculó el índice de valor de importancia (V.I.) de cada especie en cada parcela (Lamprecht, 1990). Este índice se obtuvo de la sumatoria de los valores relativos de su densidad (DeR), frecuencia (FR) y dominancia (DoR). En donde DeR = número de individuos/1000 m2 × 100, FR = número de transectos en los que aparece la especie/ número total de transectos × 100; DoR = Σ área basal de todos los individuos de la especie / Σ área basal de toda la comunidad × 100. Así mismo, se analizó el contingente de regeneración, en donde al no tener área basal, se sumó la densidad y la frecuencia relativa.
Por otra parte, se cuantificó la diversidad alfa (α), la cual fue evaluada con el índice de Shannon-Wiener (H’) y se probó si había diferencias estadísticas en los índices entre pares de edades en la cronosecuencia, mediante el procedimiento propuesto por Solow (1993) utilizando el programa estadístico PAST PAleontological STastiscs 3.20 (Hammer et al., 2001)
Para analizar la similitud en el contingente de las especies entre las diferentes edades de la cronosecuencias (diversidad beta), se calculó el índice de Sorensen (Bloom, 1981). Con los valores de este índice, se construyó una gráfica de conglomerados mediante la técnica de WPGMA (Weighted
Arithmetic Average), la cual es recomendada para estudios de campo que no tienen un muestreo aleatorio o sistemático simple (Legendre y Legendre, 2012) mediante el programa R (R Core Team, 2017).
Para contrastar la composición de especies entre edades de las cronosecuencias (considerando tanto plantas > 1 cm DAP como brinzales), se realizó un análisis de similitud no paramétrico (Anosim) basado en una matriz de Bray-Curtis (Clarke, 1993) a través del programa R (R Core Team, 2017).
Resultados
En total, en las 0.6 ha muestreadas, se registraron 7,688 plantas pertenecientes a 57 familias, 122 géneros y 191 especies (apéndice 1). En el grupo de plantas >1 cm DAP, se registraron 60 especies (498 individuos agrupados en 28 familias y 49 géneros). Se detectó una relación positiva entre el tiempo de abandono y la riqueza de plantas en las parcelas (R2 = 0.87), el tiempo de abandono y el total de plantas por parcela (R2 = 0.82) y el tiempo de abandono y la diversidad (R2 = 0.95), todas con p < 0.001. Para los brinzales (≤ 1 cm DAP; ≥ 30 cm altura) se registraron 191 especies, correspondientes a 7,190 individuos distribuidos en 56 familias y 120 géneros. En este caso también se encontró un incremento en la riqueza de las plantas con la edad de abandono (R2 = 0.83; p < 0.001), la abundancia de individuos (R2 = 0.93; p < 0.001) y la diversidad (R2 = 0.38 p = 0.05). La parcela con un abandono de 48 meses fue la que tuvo el mayor número de especies (n = 123) y la de parcela de 3 meses la que tuvo menos (31) (tabla 1).
Para el grupo de plantas > 1 cm DAP (tabla 2a), el valor más alto de diversidad se presentó a los 48 meses (2.81), mientras que los valores menores fueron registrados en las parcelas de 3 y 8 meses de abandono (0.58 en ambas parcelas; tabla 2a). Al contrastar estadísticamente los valores de diversidad, encontramos diferencias significativas para todos los pares comparados (p < 0.05), excepto entre los pares de parcelas de 3 vs. 8 meses y 26 vs. 36 meses.
En el contingente de brinzales se registraron entre 3 y 7 veces más especies que el grupo de las plantas adultas (tabla 2a, b). En el contraste por pares, la diversidad fue significativamente distinta entre todas las etapas de la cronosecuencia. El valor menor de diversidad lo presentó la parcela de 3 meses (0.2), mientras que el mayor valor se registró a los 17 y 26 meses (H´ = 3.8 y 3.6, respectivamente).
Parcela de 3 meses: se encontraron tan solo 5 especies, siendo Citrus sinensis la especie que presentó el V.I. mayor (80% del total). Otra especie conspicua fue Piper auritum, la cual representó el 10% de V.I. total. Otros elementos encontrados en la parcela, pero con menor representatividad, fueron Tabebuia rosea, Piper umbellatum y Carica papaya, sumando un total del 10% restante del V.I. Para el grupo de plantas en regeneración, se encontraron 30 especies de las cuales Syngonium podophyllum fue la especie más importante con un (29%, del V.I. total), otras especies fueron Momordica charantia y Hamelia patens sumando ambas 19% de V.I., Stigmaphyllon ellipticum, Calyptranthes chytraculea y C. papaya, sumando conjuntamente 15% de V.I. total, debido a su frecuencia relativamente alta en todos los transectos de esta parcela.
Tabla 1
Número de familias, géneros y especies en total registrados para cada etapa de la cronosecuencia.
|
Familias |
Géneros |
Especies |
|
|
3 meses |
17 |
26 |
31 |
|
8 meses |
25 |
35 |
45 |
|
17 meses |
40 |
69 |
98 |
|
26 meses |
39 |
69 |
101 |
|
36 meses |
41 |
80 |
120 |
|
48 meses |
43 |
89 |
123 |
Tabla 2
Índices de diversidad de especies registradas: a) > 1 cm DAP y b) Individuos < 1 cm, > 30 cm de altura de cada edad en la cronosecuencia derivada de cultivos de naranja abandonados en el valle de Uxpanapa, Veracruz. Para el índice de Shannon, letras distintas indican diferencias significativas (p < 0.05).
|
a) Individuos > 1cm DAP |
|||
|
Parcela |
Nº de especies |
Total de individuos |
Índice de Shannon |
|
3 meses |
5 |
91 |
0.58a |
|
8 meses |
9 |
96 |
0.58ab |
|
17 meses |
13 |
113 |
1.16c |
|
26 meses |
20 |
194 |
1.75dc |
|
36 meses |
19 |
255 |
1.78e |
|
48 meses |
42 |
232 |
2.81f |
|
b) Individuos < 1cm, > 30cm de altura |
|||
|
3 meses |
30 |
504 |
2ª |
|
8 meses |
43 |
918 |
2.5b |
|
17 meses |
95 |
992 |
3.8c |
|
26 meses |
99 |
1225 |
3.6d |
|
36 meses |
118 |
1475 |
3.4e |
|
48 meses |
119 |
2076 |
3.3f |
Parcela de 8 meses: se registraron en total 9 especies (> 1cm DAP), C. sinensis es el componente principal representando el 80% de V.I. total. La especie Bursera simaruba fue la segunda más importante con 4.5% de V.I. Hamelia verticillata y Gmelina arborea sumaron el 5% de V.I. Para el contingente de regeneración se registraron 43 especies donde Pithecoctenium crucigerum fue la especie más importante 22% de V.I. seguida de Hamelia verticillata, Stigmaphyllon ellipticum, sumando un V.I. total de 21.5%. Hamelia patens, Cissus microcarpa, Vernonia patens, Syngonium podophyllum, Capsicum annuum, Hamelia longipes, Solanum umbellatum y Randia armata presentaron valores de importancia que oscilaron entre 2 y 4%.
Parcela de 17 meses: se registraron 13 especies (> 1cm DAP), teniendo C. sinensis el mayor V.I. (68%); Senna multijuga, Lonchocarpus purpusii y Senna papillosa, tuvieron un V.I. total de 16%. El contingente de especies restantes tuvo valores de importancia bajos (<3%), pues al sumar sus V.I. contribuyen sólo con el 15.5% total. La vegetación en regeneración se compuso por 95 especies, entre las que destacaron: Piper hispidum, Combretum argenteum, Acacia mayana, Vernonia patens, Conostegia xalapensis, Stemmadenia donnell-smithii y Paullinia costaricensis, acumulando un 30% de V.I. El resto de las especies de este estrato, registraron valores de importancia menores al 3%.
Parcela de 26 meses: se registraron 20 especies (> 1cm DAP). Nuevamente C. sinensis fue la especie más representativa para el sitio con un V.I. de 53%. También se encontraron las especies Senna papillosa, Senna multijuga y Vernonia patens, con valores intermedios de importancia, que oscilaron entre el 8 y 12 % del V.I. total. En regeneración se registraron 99 especies destacando Adelia barbinervis y Piper hispidum (12%V.I. en total). Por otra parte, Senna papillosa, Senna multijuga, Stemmadenia donnell-smithii y Vernonia patens, entre todas, sumaron un V.I total que oscila entre 4% y 5%. Las especies restantes tuvieron un V.I. inferior a 3%.
Parcela de 36 meses: se registraron 19 especies (> 1cm DAP), siendo C. sinensis el árbol con mayor representatividad (V.I. 48%). En segundo lugar, se registró a Senna papillosa con un V.I. de 17%, mientras que Vernonia patens y Senna multijuga, sumaron el 17% del V.I. total para el sitio. Para la vegetación en regeneración se registraron 118 especies donde Piper hispidum tuvo el mayor V.I. (12%), seguida por Senna multijuga, Piper umbellatum, Senna papillosa, Stemmadenia donnell-smithii y Vernonia patens, cuyos valores fluctuaron entre 3 y 5% de V.I. El resto de las especies no sumaron en conjunto más del 2% del V.I.
Parcela de 48 meses: se registraron 42 especies > 1cm DAP. C. sinensis se mantuvo como la especie más importante (V.I. 44%). Otras especies importantes fueron: Platymiscium yucatanum, Tithonia diversifolia, Tectona grandis, Piper hispidum y Acalypha diversifolia, que juntas sumaron el 20% de V.I., principalmente por sus abundancias. Otras especies importantes son Acacia usumacintensis y Gmelina arbórea, con un V.I. del 5%. Las especies restantes contribuyeron con el 20% del V.I. En el contingente de regeneración se encontraron 119 especies; Piper hispidum fue la que mostró el mayor V.I. con 18 %, sobre todo por su alta abundancia (671 ind.). Hamelia patens, Platymiscium yucatanum y Eugenia capuli, juntas, sumaron el 11% del V.I. total. El resto de las especies tuvieron un V.I. no mayor a 1%.
El análisis del recambio de especies mostró la existencia de una baja similitud entre las parcelas. Esto fue más evidente cuando se separaron las plantas maduras de brinzales (> 1 cm DAP vs. regeneración). El análisis de conglomerados WPGMA mostró la existencia de una clara separación entre estos 2 grupos, para el grupo de plantas adultas podemos apreciar una mayor similitud entre parcelas de edad subsecuente después de los 8 meses, es decir, son más similares en función a su cercanía de edad; sin embargo, el grupo de adultos de 48 meses posee una mayor similitud con el estrato de regeneración avanzada (fig . 2).
En la categoría > 1 cm DAP, las parcelas fueron más similares entre sí (valores de similitud de 0.45 hasta 0.845); mientras en la categoría de regeneración hubo mayor contraste entre las parcelas y los valores de similitud se encuentran entre 0.01 hasta un máximo de 0.496 (fig. 2). Dentro del grupo de plantas adultas la mayor similitud la mostraron las parcelas de 3 y 8 meses (0.845) y las parcelas de 8 y 17 meses (0.823), mientras que la parcela de 48 meses resultó la menos similar al resto. Para el grupo de plantas en regeneración la mayor similitud se presentó entre las parcelas de 17 y 26 meses (0.496) y entre las de 26 y 36 meses (0.575). La menor similitud la mostraron las parcelas iniciales de 3 y 8 meses cuyos contrastes con el resto de parcelas son menores a 0.1.
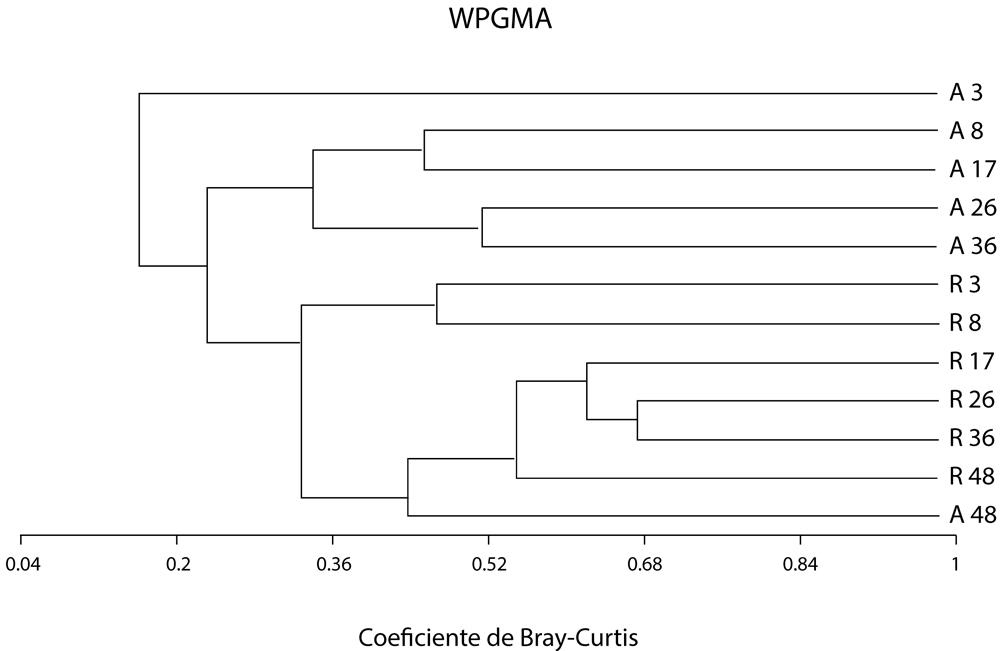
El análisis de similitud no paramétrico (Anosim) mostró diferencias significativas entre todas las parcelas en global (global R = 0.561; p < 0.001). Las únicas combinaciones entre pares de parcelas que no resultaron estadísticamente distinguibles fueron las parcelas de 8 y 17 meses (R = 0.008; p = 0.37) y las de 3 y 36 meses ( R= -0.022; p = 0.635), todas ellas del contingente de plantas adultas (tabla 3).
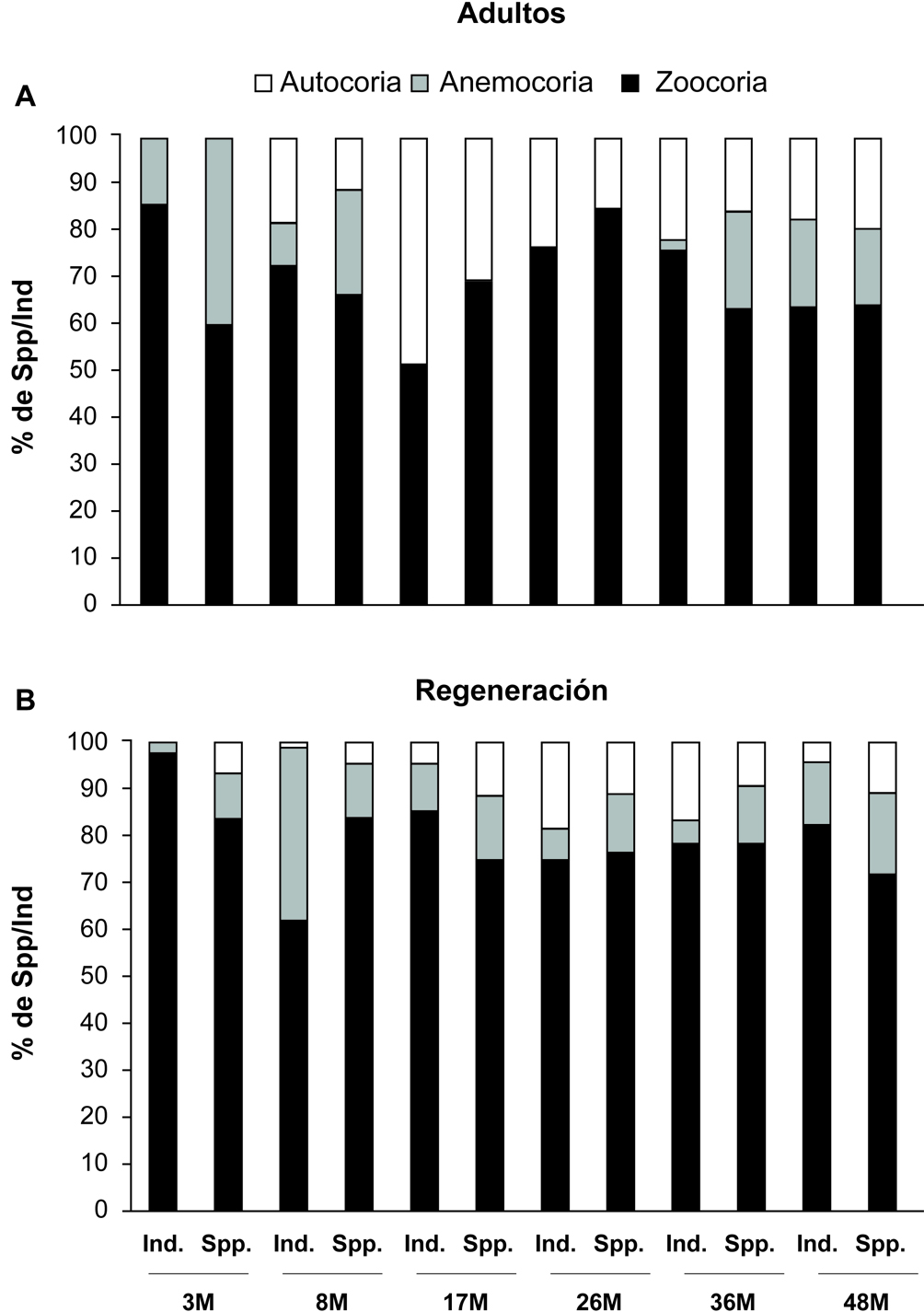
El síndrome de dispersión mejor representado en todas las etapas fue la zoocoria (70% de las especies registradas y el 80% del total de individuos). Para el contingente de plantas > 1 cm DAP, el 69% de las especies (74 spp.) fueron identificadas como zoocoras. En cada etapa este grupo representó al menos el 60% de las especies, alcanzando su valor máximo en la etapa de los 26 meses con el 85% de las especies. En términos de número de individuos, la zoocoria fue la estrategia dominante (75% del total los individuos registrados) que corresponde al 51% de las especies en cada etapa, alcanzando su valor mayor en la etapa inicial (3 meses), en donde representa el 85% de los individuos (fig. 3a). La anemocoria se observó en el 16% (17 especies y 40% de la proporción de todas las especies) que estuvieron presentes en las etapas iniciales; no se registró este síndrome en los 17 y 26 meses. En términos de número de individuos su mayor proporción fue en la etapa los 48 y 3 meses (19% y 14% de los individuos, respectivamente). Finalmente, la autocoria representó el 14% del total de especies, su mayor registro tanto para especies como para individuos fue en la etapa de 17 meses, representando el 30 y 48%, respectivamente (fig. 3a).
Para las especies en regeneración, la zoocoria también se registró como el síndrome más representativo (77% del total de las especies). Para cada etapa más del 74% del total de las especies fueron zoocoras, alcanzando el valor máximo del 83% en las etapas de 3 y 17 meses. En términos de números de individuos, el 80% de total fueron zoocoras, lo que representa más del 62% en cada una de las etapas. El valor más alto se registró en la parcela de 3 meses (97% de los individuos; fig. 3b). La anemocoria se registró en el 13% de las especies totales, con valores entre 10% (3 meses) y 18% (48 meses). El número de individuos anemocoros representa 12% del total, alcanzando valores hasta de 37% en la parcela de 8 meses. Finalmente, las especies autocoras representaron el 9% del total de especies, que son más frecuentes en las etapas 17, 26 y 48 meses, las cuales mostraron el 11% de especies anemocoras. Para el número de individuos solo el 7% fueron autocoras, siendo los 26 y 36 meses donde fueron mejor representados (18 y 16% respectivamente; fig. 3b).
Tabla 3
Análisis de similitudes (Anosim) entre estratos y tiempo de abandono de las parcelas. Por encima de la diagonal se presentan los valores de R y por debajo, los niveles de significancia (A: individuos > 1 cm DAP y R: < 1 cm, > 30 cm de altura).
|
A 3M |
A 8M |
A 17M |
A 26M |
A 28M |
A 48M |
R 3M |
R 8M |
R 17M |
R 26M |
R 36M |
R 48M |
|
|
A 3M |
0.5111 |
0.626 |
0.5508 |
-0.02289 |
0.1778 |
0.5874 |
0.5417 |
0.5417 |
0.5563 |
0.6123 |
0.5783 |
|
|
A 8M |
0.0001 |
0.008333 |
0.6728 |
0.4547 |
0.1732 |
0.8601 |
0.7117 |
0.7489 |
0.808 |
0.7942 |
0.7529 |
|
|
A 17M |
0.0002 |
0.372 |
0.8514 |
0.5769 |
0.301 |
0.9988 |
0.9854 |
0.9926 |
1 |
0.9724 |
0.9963 |
|
|
A 26M |
0.0001 |
0.0002 |
0.0001 |
0.4594 |
0.3621 |
0.8606 |
0.6658 |
0.7006 |
0.5781 |
0.8039 |
0.7498 |
|
|
A 28M |
0.635 |
0.0003 |
0.0001 |
0.0001 |
0.1229 |
0.5659 |
0.5164 |
0.5127 |
0.5313 |
0.5296 |
0.5504 |
|
|
A 48M |
0.0077 |
0.0106 |
0.0002 |
0.0002 |
0.0212 |
0.5751 |
0.3384 |
0.3197 |
0.472 |
0.5091 |
0.3636 |
|
|
R 3M |
0.0002 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0002 |
0.0001 |
0.6231 |
0.9806 |
|
|
R 8M |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.9563 |
0.3271 |
0.7676 |
0.8121 |
0.4454 |
|
|
R 17M |
0.0001 |
0.0001 |
0.0002 |
0.0001 |
0.0001 |
0.0001 |
0.9849 |
0.0002 |
0.7912 |
0.9142 |
0.5608 |
|
|
R 26M |
0.0002 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.9613 |
0.0001 |
0.0001 |
0.897 |
0.8272 |
|
|
R 36M |
0.0002 |
0.0001 |
0.0001 |
0.0002 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.6231 |
|
|
R 48M |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
0.0002 |
0.0001 |
0.0001 |
0.0001 |
0.0001 |
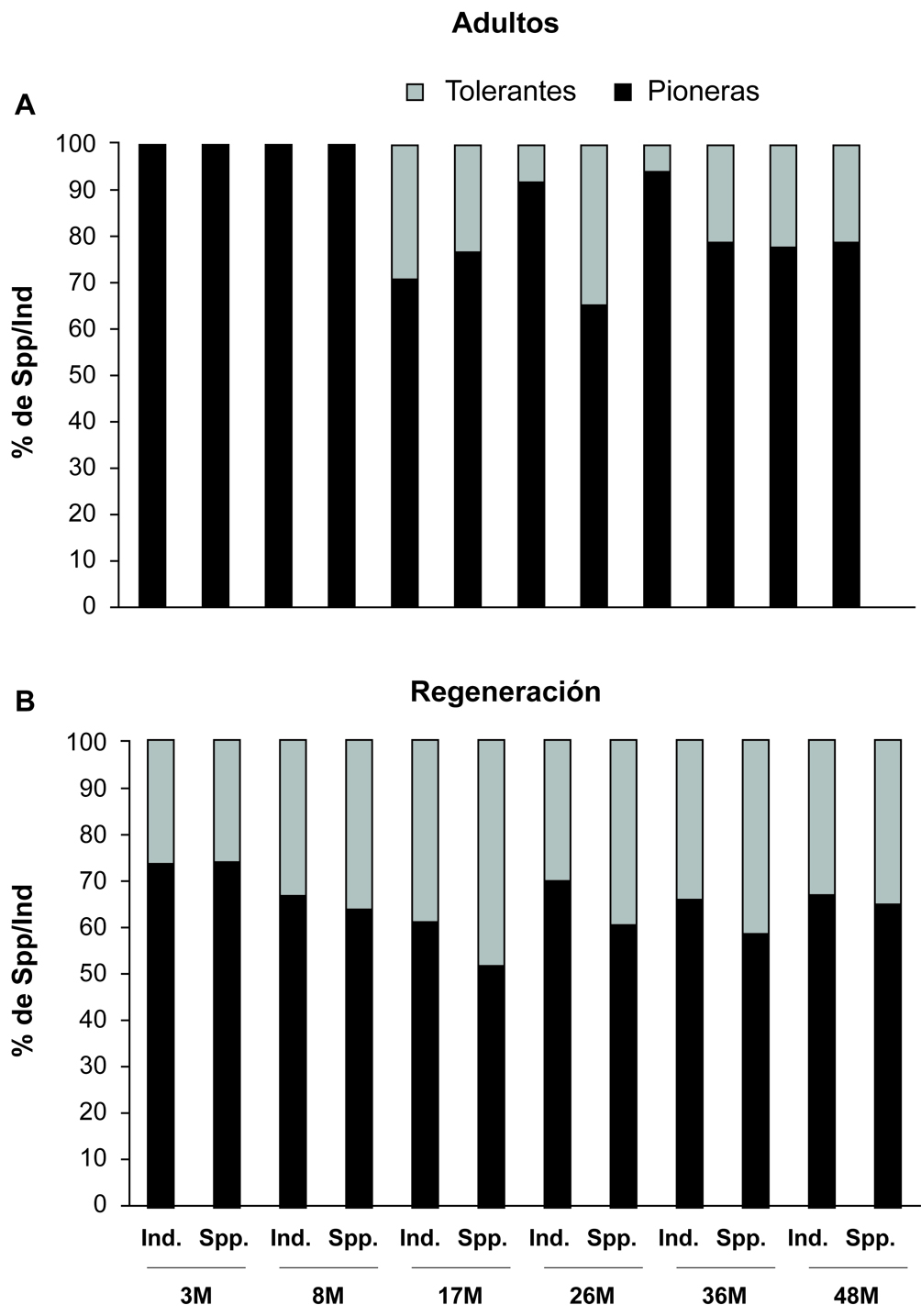
En general, las plantas pioneras fueron el grupo mejor representado en todas las etapas de sucesión (85% de todas las especies y el 78% de todos los individuos). Para los contingentes > 1 cm DAP, el 100% de especies y de individuos para las etapas de 3 y 8 meses fueron pioneras (fig. 4a). Esta dominancia disminuye a los 17 meses donde ⅔ de los individuos/especies son pioneras y el resto tolerantes. A los 48 meses de abandono, las tolerantes ocuparon el 21% de especies y el 22% de los individuos, mientras que el resto fue de plantas pioneras.
Para el grupo de plantas en regeneración (fig. 4b), las plantas pioneras representan más del 61% de las especies y el 67% de los individuos en todas las etapas sucesionales. Sin embargo, se observó que conforme se incrementó la edad de abandono (26, 36 y 48 meses), se presentó una clara disminución de esta estrategia de vida y en contraste, se registró un aumento de las plantas con estrategia tolerante, las cuales representan por arriba del 30% de individuos y de especies.
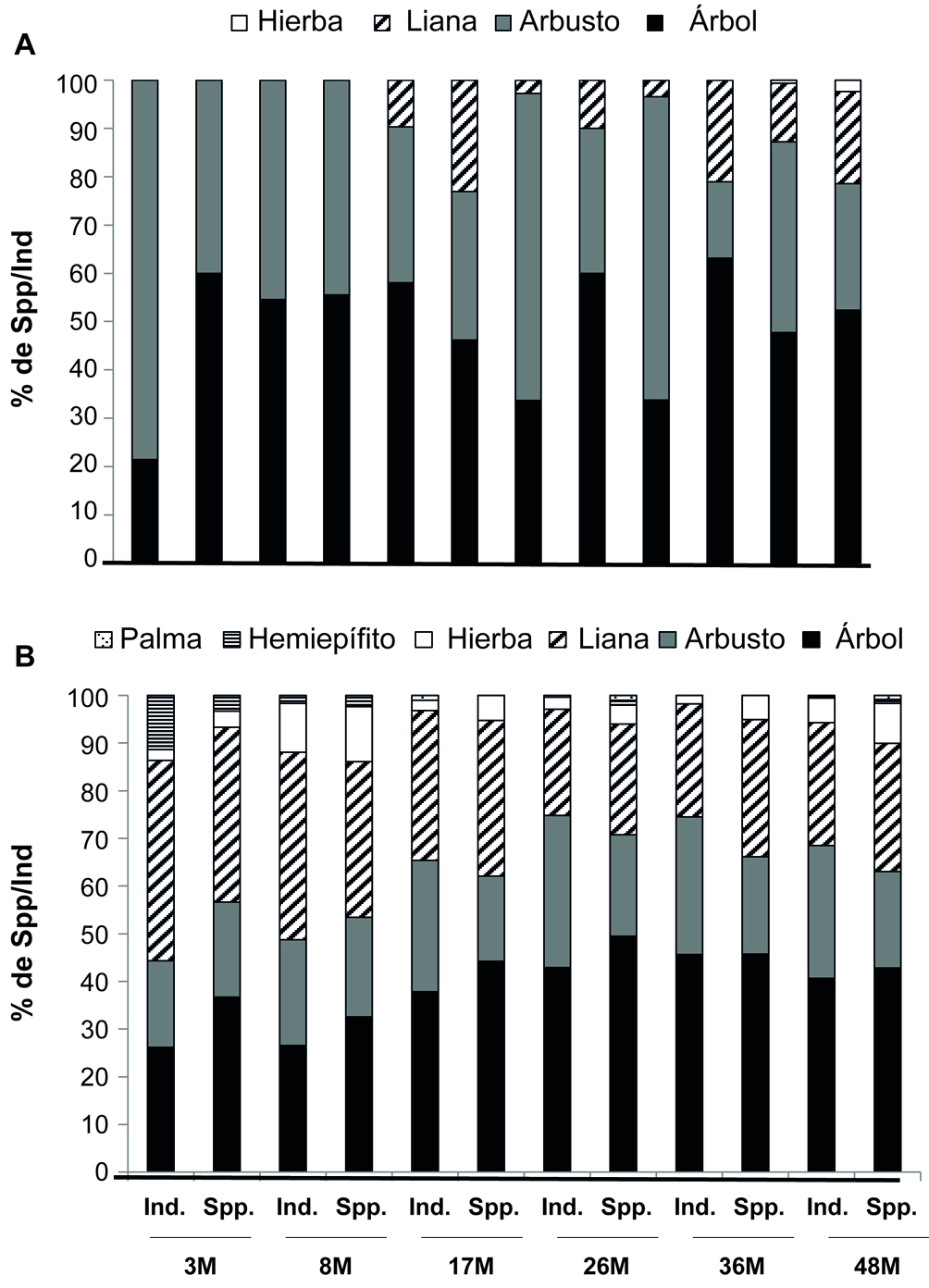
En general, los árboles fueron el grupo más representado en todas las etapas de la cronosecuencia (40% de todas las especies y el 46% de todos los individuos). Para las especies > 1 cm DAP, en la etapa de 3 meses el 78% de los individuos fueron arbustos, sin embargo, estas representaban el 40% de las especies, mientras los árboles el 60% (fig. 5a). En las etapas de 18 y 17 meses los árboles dominaron en términos de número de especies e individuos. A los 17 meses se reportan las primeras lianas. En el resto de las etapas los árboles representan la mayor cantidad de especies/individuos salvo en los 26 y 36 meses donde se observa una alta abundancia de arbustos (fig. 5a).
Para el grupo de plantas en regeneración (fig. 5b), se registraron 2 formas de vida más: hemiepífitas y palmas. En las etapas de 3 y 8 meses, las lianas dominaron en términos de individuos/especies. Para el resto de las etapas los árboles fue el grupo más importante, representando arriba del 35% de los individuos/especies de cada etapa de la cronosecuencia (fig. 5b).
Discusión
El conocimiento y el inventario de la riqueza de plantas de la vegetación secundaria asociada con las plantaciones abandonadas, es esencial para reconocer su contribución en el proceso de sucesión en los paisajes antrópicos. Además, nos permite conocer su capacidad para retener diversidad florística y ser la base de alternativas de manejo y restauración ecológica. Este tipo de información puede permitir generar más alternativas para acelerar el proceso de sucesión secundaria al acortar el tiempo para el establecimiento de las especies de bosque maduro (Dirzo et al., 2009; Montagnini, 2008).
Los resultados de este estudio proporcionan evidencia de que los naranjales pueden mantener una alta riqueza y diversidad vegetal que se incrementa con el tiempo de abandono y la representación de árboles tolerantes, típicos de zonas conservadas. Esto era una situación predecible (Guariguata y Ostertag, 2001), pero no en las magnitudes observadas (191 especies totales). Este registro es mayor que los obtenidos en estudios previos que analizaron la flora en ambientes de origen antrópico en la zona (Del Amo y Ramos, 1993; Márquez, 1976; Ramos-Prado et al., 1982). De esta manera, el presente estudio permite alcanzar un conocimiento más completo de la riqueza de la flora en la región de Uxpanapa. Por otra parte, Ruiz-Guerra et al. (2014) encontraron, al muestrear la vegetación leñosa con un DAP > 1 cm en 0.1 ha, que un fragmento de bosque bien conservado en el valle de Uxpanapa mantenía una riqueza de 106 especies repartidas en 36 familias. Esto indica que los naranjales pueden alcanzar una riqueza de especies equivalente al 56% de la diversidad florística de bosques representativos de la vegetación original del valle.
Por otra parte, en otro estudio realizado en Uxpanapa (en el que se siguió el mismo protocolo de muestreo del presente estudio), Pantoja-Aparicio (2014) registró, en 0.5 ha, 97 especies con un DAP > 1 cm y 112 en regeneración en selvas bien conservadas, así como 92 especies con un DAP > 1cm y 98 en regeneración en acahuales de entre 7 y 15 años de abandono. Estos valores revelan, el fuerte potencial de los naranjales abandonados de retener riqueza de especies sobre todo después de los 17 meses de abandono, en donde el número de especies en reclutamiento es similar o incluso mayor a los reportados en acahuales y selvas de la zona. Adicionalmente, las categorías registradas en este estudio representan una importante proporción de plantas tolerantes a la sombra, típicas de selvas conservadas.
Al analizar los valores de importancia de las especies en cada parcela encontramos al manejo local inicial como un potencial factor que modifica las trayectorias de sucesión de estos ambientes. Resulta interesante observar que en naranjales de 3 meses de abandono, los cuales tienen labor de manejo tales como chapeo, limpieza de árboles y labranza, se pueden observar especies como Tabebuia rosea y Carica papaya, ambas con importancia local (madera y frutos respectivamente), las cuales son toleradas en los naranjales en pleno uso junto con plantas pioneras de uso local como Piper spp. La persistencia de estas especies les confiere una utilidad mixta a los naranjales y por otro lado favorece los procesos de sucesión cuando los naranjales son abandonados, debido a los síndromes de dispersión y modificación rápida de los microambientes del sitio (Montagnini, 2008). Otras especies útiles dominantes en la zona fueron: Gmelina arborea, Bursera simaruba, Tectona grandis, Rollinia mucosa y Eugenia capuli. Estas son especies con potencial de uso forestal maderable que constituyen una alternativa de manejo para los naranjales mediando el conflicto de uso del suelo y sus implicaciones sociales, económicas y ambientales (Parrotta y Turnbull, 1997; Toledo-Aceves y Swaine, 2008).
La composición de especies en sitios con abandono mayor a los 36 meses muestra la presencia, ya como individuos > 1 cm DAP, de especies típicas de selvas maduras. Tal es el caso de Platymiscium yucatanumo y Combretum argenteum que, debido a su poco diámetro, se infiere se establecieron después del abandono del naranjal. Particularmente, en los sitios de mayor tiempo de abandono en el contingente de regeneración, se observó un aumento drástico en el número de individuos y de especies, muchas de ellas componentes típicos de selvas primarias y especies pioneras como heliófilas de vida larga. En regiones tropicales se ha desarrollado mucha investigación, la cual describe los procesos de sucesión y regeneración de selvas (Gómez-Pompa y Wiechers, 1975; Martínez-Ramos, 1985; Yamamoto, 2000). Estos estudios indican que la regeneración en los primeros estadios sucesionales favorece a las especies pioneras, las cuales, al modificar factores ambientales promueven el desarrollo de plantas tolerantes, típicas de selvas maduras. Los resultados mostraron que la dominancia en número de especies e individuos de plantas pioneras fue muy alta en todas las etapas de la cronosecuencia, aunque con la inclusión de plantas tolerantes, predominantemente árboles en estado adulto después del mes 17 de abandono.
El análisis de similitud realizado sobre los 2 contingentes de plantas, mostró una alta heterogeneidad de especies presente en la cronosecuencia. Estas altas tasas de recambio pueden ser explicadas a pesar de la cercanía cronológica de las etapas evaluadas, por una alta varianza en el arribo de especies (Lawrance et al., 2010), que puede ser el producto del flujo de propágulos de fragmentos cercanos de vegetación original, los cuales han sido reportados como altamente diversos (Wendt, 1987). El recambio de especies disminuye con la edad, y está ligado al tiempo de abandono de los sistemas, por lo que mientras las plantaciones estén en manejo o recién abandonados, menor será el establecimiento de nuevas especies, y las que arriben solo serán toleradas por los dueños de las parcelas en función al uso local.
A pesar de tener alta diversidad, incluso la etapa de 36 meses puede ser considerada como de segunda fase de sucesión secundaria (sensu Gómez-Pompa y Vázquez-Yanes, 1985), es decir sitios donde predominan especies pioneras de larga vida formando un estrato arbóreo más cerrado propicio para el establecimiento de especies umbrófilas. Este patrón es consistente en el grupo de plantas en regeneración, en donde las especies tolerantes tienen una presencia importante, llegando a ser hasta más de un tercio de las especies o individuos de las etapas de 17 y 36 m. Este fenómeno es sin duda promovido por el claro síndrome de dispersión zoocórica que tienen las plantas de naranja, las cuales atraen una gran cantidad de aves que dejan una abundante lluvia de semillas y muchas de ellas son especies tolerantes a la sombra (De la Vega-Rivera, 2005). Ésto es muy evidente cuando contrastamos datos para la zona (siguiendo la misma metodología) en una plantación de hule (Hevea brasiliensis) con muy bajo mantenimiento, en la cual se registraron 19 especies de plantas > 1 cm DAP (en 0.5 ha), lo que representa 3 veces menos especies que las registradas en el naranjal. La diferencia en estrategias intrínsecas a la especie Hevea brasiliensis como su dispersión autocórica, su carácter caducifolio, así como fustes rectos y poco ramificados pueden explicar el bajo reclutamiento al compararlo con especies atractivas para los dispersores como los naranjales, que además tienen copas ramificadas las cuales albergan una alta diversidad de epífitas/hemiepífitas (De la Cruz-Osorio, 2009; García-González y Riverón-Giró, 2014).
En general, se cuenta con evidencia empírica de que en el trópico, la mayoría de las semillas que colonizan pastizales son dispersados por el viento, mientras que las semillas que entran en las plantaciones son dispersadas por vertebrados (Orozco-Zamora y Montagnini, 2007a). La cronosecuencia en naranjales abandonados reflejó que la dispersión zoocórica fue la forma de dispersión más importante tanto para los contingentes de plantas adultas y sobre todo para la regeneración. Estos datos concuerdan con estudios realizados en la Estación Biológica La Selva en Costa Rica, en donde plantaciones forestales proveen un hábitat más atractivo para los agentes de dispersión de semillas que zonas abiertas (Bedoya, 2009; Mariscal, 1998; Orozco-Zamora y Montagnini, 2007a, b).
Otro factor que favorece la riqueza en los naranjales es la presencia dentro de la matriz del paisaje de grandes continuos de selva alta y fragmentos en buen estado de conservación (Rodríguez-Luna et al., 2011), estos sitios funcionan como fuentes imprescindibles de propágulos. Se ha demostrado que bajo un uso de la tierra de ligero a moderado y cuando las fuentes de semillas están cerca (ambos escenarios presentes en este sistema de naranjales abandonados), la riqueza vegetal rápidamente aumenta durante los primeros años de la sucesión, y se tarda no más de unas pocas décadas después del abandono de llegar a valores comparables a bosques maduros (Kammesheidt, 1998).
De acuerdo al presente estudio, las plantaciones de Citrus sinensis promueven la regeneración natural, tanto de especies silvestres como asociadas a los agroecosistemas circundantes aún en etapas muy recientes del abandono, atrayendo a una gran cantidad de dispersores, lo cual modifica positivamente el proceso de sucesión secundaria. Esto es compatible con los hallazgos de De la Vega-Rivera (2005), quien reportó un alto reclutamiento de plántulas por debajo de las copas de árboles de naranja aislados en potreros de la región de “Los Tuxtlas”.
Algunos estudios señalan que las plantaciones pueden acelerar o “catalizar” la sucesión del bosque secundario (Lamb et al., 2005; Orozco-Zamora y Montagnini, 2007a, b), aunque en general se infiere poco sobre su papel de promover el establecimiento de especies de las etapas más avanzadas de la sucesión (Montagnini, 2008). En este sentido, el presente estudio muestra claramente como en el contingente de regeneración, incluye tanto plantas tolerantes como intolerantes a la sombra, típicamente presentes en los fragmentos de vegetación adyacente, los cuales actúan como fuentes de propágulos que generan el reclutamiento de una alta diversidad de especies. Asimismo, se encontró una predominancia de árboles y arbustos en el estrato de regeneración y adulto superando en riqueza y abundancia a las lianas (sobre todo en el estrato adulto). Las lianas son a menudo consideradas como plantas adaptadas a la perturbación y se registran frecuente en las primeras fases de la sucesión o en sitios perturbados (Schnitzer y Bongers, 2002), con alto potencial competitivo sobre árboles y arbustos (Madeira et al., 2009; Schnitzer, 2005; Toledo-Aceves y Swaine, 2008). Incluso las lianas aparecen en baja proporción en los estratos > 1 cm DAP y baja la proporción arriba de los 26 meses de abandono (fig. 5a, b), esto confiere una ventaja para la rápida recuperación en términos de riqueza y atribuible a la presencia de los árboles de naranja, los cuales cambian las condiciones ambientales para el establecimiento de lianas, sobre todo aquellas pioneras de semilla pequeña (Letcher y Chazdon, 2012).
Los resultados obtenidos dejan ver la gran importancia que presentan las plantaciones abandonadas de C. sinensis como elemento del paisaje con capacidad de retener riqueza florística, y funcionar como corredores de movimiento de organismos, propágulos y genes (Dirzo et al., 2009; Holl, 2002), así como proporcionar bienes y servicios valiosos a los humanos tales como la provisión de productos de importancia local, la protección de las cuencas hidrográficas, zonas de amortiguamiento para fragmentos de selva (Aide et al., 1996; Brown y Lugo, 1990; Wijdeven y Kuzee, 2000) e incluso la provisión de frutos para vertebrados que habitan en parches cercanos (Laurance y Vasconcelos, 2004; Wright et al., 1999). Por lo tanto el enriquecimiento en las etapas de manejo activo de los naranjales con especies cultural y económicamente importantes, así como el reconocimiento de la capacidad de retención de procesos ecológicos y de biodiversidad en los estadios sucesionales subsecuentes al abandono de los naranjales, son estrategias Inegi que deben de ser reconocidas como importantes a nivel de paisaje, incluyendo a estas zonas en las acciones alineadas a las políticas públicas de conservación y restauración, para evitar su reconversión a monocultivos forestales o ganaderos.
Agradecimientos
A Santiago Sinaca-Colín y a Mauricio Juárez Fragoso por su ayuda en campo, así como a los habitantes de la Congregación Jorge L. Tamayo (poblado 12), por las facilidades otorgadas para la realización de este trabajo. A Beatríz Bolívar por su apoyo en la realización del mapa y dos revisores anónimos por sus importantes contribuciones para el mejoramiento de este trabajo. Este proyecto se realizó con financiamiento del Fondo Mixto Conacyt-Gobierno del Estado de Veracruz (Núm. 108990).
Apéndice 1. Listado de especies de acuerdo con Villaseñor (2016) y Tropicos (2017) registradas en las 6 etapas de la cronosecuencia de naranjales abandonados con cada uno de sus valores de importancia (V.I). La letra A indica el contingente de adultas, R es el contingente de regeneración. La información entre paréntesis en superíndice se refiere a la forma de vida, estrategia de dispersión y estrategia de establecimiento, respectivamente; donde, a: árbol, b: arbusto, c: hierba, d: liana o trepadora, e: hemiepífita, f: palma, 1: autocoria, 2: anemocoria, 3: zoocoria, x: pionera, y: tolerante.
|
Apéndice 1. Continuación. |
|||||||||||||
|
Familia |
3 meses |
8 meses |
17 meses |
26 meses |
36 meses |
48 meses |
|||||||
|
Especies |
A |
R |
A |
R |
A |
R |
A |
R |
A |
R |
A |
R |
|
|
Familia
|
3 meses |
8 meses |
17 meses |
26 meses |
36 meses |
48 meses |
|||||||
|
Especies |
A |
R |
A |
R |
A |
R |
A |
R |
A |
R |
A |
R |
|
|
Amaranthaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Chamissoa altissima (Jacq.) Kunth. (d,3,x) |
|
|
|
|
0.43 |
|
0.20 |
0.82 |
1.22 |
|
|
|
|
Annonaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Rollinia mucosa (Jacq.) Baill. (a,3,y) |
|
|
|
|
0.28 |
0.84 |
0.49 |
|
|
|
0.17 |
|
|
Apocynaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Echites tuxtlensis Standl. (d,3,x) |
|
|
0.54 |
|
0.23 |
|
|
|
|
|
|
|
|
|
Forsteronia viridescens S.F. Blake (d,1,x) |
|
|
|
|
0.46 |
|
|
|
0.19 |
|
|
|
|
|
Prestonia mexicana A. DC. (d,1,x) |
|
|
|
|
0.23 |
|
|
|
0.19 |
|
|
|
|
|
Stemmadenia donnell-smithii (Rose) Woodson (a,1,x) |
|
|
1.24 |
|
3.55 |
0.84 |
4.05 |
2.20 |
3.86 |
|
1.41 |
|
|
|
Tabernaemontana alba Mill. (a,3,y) |
|
|
|
|
0.23 |
0.84 |
1.76 |
2.24 |
2.47 |
|
|
|
|
|
Thevetia ahouai (L.) A. DC. (b,3,x) |
|
|
|
|
|
|
0.49 |
|
0.36 |
|
0.17 |
|
|
Araceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Philodendron sagittifolium Liebm. (d,3,x) |
|
|
|
|
|
|
0.29 |
|
0.22 |
|
1.01 |
|
|
|
Syngonium podophyllum Schott (e,3,x) |
28.90 |
|
2.92 |
|
|
|
0.33 |
|
|
|
0.29 |
|
|
|
Xanthosoma robustum Schott (c,3,x) |
|
|
|
|
|
|
|
|
|
|
0.36 |
|
|
Araliaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Dendropanax arboreus (L.) Decne. et Planch. (a,3,y) |
|
|
|
|
|
|
|
|
|
|
0.53 |
|
|
Arecaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Sabal mexicana Mart. (f,3,x) |
|
|
|
|
|
|
|
|
|
|
0.19 |
|
|
|
Chamaedorea tepejilote Liebm. (f,3,y) |
|
|
|
|
0.69 |
|
|
|
|
|
|
|
|
Asteraceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Baltimora recta L. (b,3,x) |
0.67 |
|
|
|
|
|
|
|
0.19 |
|
0.17 |
|
|
|
Eupatorium galeottii B.L. Rob. (b,3,x) |
|
|
|
|
|
|
|
|
|
|
0.36 |
|
|
|
Eupatorium odoratum L. (b,2,x) |
|
|
|
|
|
|
0.20 |
|
0.25 |
|
0.17 |
|
|
|
Liabum discolor (Hook. et Arn.) Benth. et Hook. f. ex Hemsl. (a,1,x) |
|
|
|
|
|
|
0.20 |
|
|
|
0.26 |
|
|
|
Neurolaena lobata (L.) Cass. (b,1,x) |
|
|
0.48 |
|
|
|
|
|
0.59 |
|
0.33 |
|
|
|
Tithonia diversifolia (Hemsl.) A. Gray (b,3,x) |
|
|
|
|
|
|
|
|
|
3.95 |
1.34 |
|
|
|
Vernonia patens Kunth (b,3,x) |
|
|
3.00 |
2.82 |
4.13 |
7.88 |
4.01 |
8.38 |
3.49 |
0.91 |
0.33 |
|
|
Begoniaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Begonia manicata Brongn. ex F. Cels (e,2,x) |
|
|
|
|
0.28 |
|
0.45 |
|
|
0.46 |
0.48 |
|
|
Bignoniaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Anemopaegma chrysanthum Dugand. (d,2,y) |
|
|
|
|
0.50 |
|
|
|
|
|
|
|
|
|
Amphilophium paniculatum (L.) Kunth (d,2,y) |
1.36 |
|
|
|
|
|
|
|
|
1.65 |
0.62 |
|
|
|
Arrabidaea chica (Bonpl.) B. Verl. (d,2,y) |
|
|
1.07 |
|
|
|
|
|
0.19 |
|
|
|
|
|
Cydista diversifolia (Kunth) Miers (d,3,y) |
|
|
2.05 |
|
1.42 |
|
1.27 |
|
|
|
0.79 |
|
|
|
Cydista heterophylla Seibert (d,3,y) |
|
|
|
|
0.28 |
|
|
|
|
|
|
|
|
|
Macfadyena laurifolia (Kunth) Miers (d,2,x) |
|
|
|
|
|
|
|
|
|
|
0.17 |
|
|
|
Macfadyena uncata (Andrews) Sprague et Sandwith (d,2,x) |
|
|
|
|
|
|
0.20 |
|
0.25 |
|
0.17 |
|
|
|
Paragonia pyramidata (Rich.) Bureau (d,3,x) |
|
|
|
|
1.62 |
|
0.53 |
|
0.19 |
|
|
|
|
|
Parmentiera aculeata (Kunth) Seem. (a,2,y) |
|
|
|
|
0.46 |
|
0.20 |
|
0.76 |
|
0.57 |
|
|
|
Pithecoctenium crucigerum (L.) A.H. Gentry (d,2,x) |
|
|
21.87 |
|
2.13 |
|
2.25 |
|
0.98 |
|
0.86 |
|
|
|
Pithecoctenium echinatum (Jacq.) Baill. (d,2,y) |
|
|
|
|
|
|
|
|
|
|
|
0.91 |
|
Bignoniaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Pithecoctenium laxiflorum DC. (d,2,y) |
|
|
|
|
0.23 |
|
0.25 |
|
|
|
|
|
|
|
Stizophyllum riparium (Kunth) Sandwith (d,2,y) |
|
|
0.59 |
|
0.28 |
|
|
|
0.22 |
|
|
|
|
|
Tabebuia rosea (Bertol.) A. DC. (a,2,x) |
5.58 |
0.67 |
2.12 |
0.48 |
|
1.30 |
|
1.60 |
0.69 |
1.39 |
1.22 |
1.39 |
|
Bombacaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Bernoullia flammea Oliv. (a,2,y) |
|
|
|
|
|
|
|
|
|
|
0.17 |
|
|
|
Ceiba pentandra (L.) Gaertn. (a,2/3,x) |
|
|
|
|
|
|
|
|
0.19 |
|
|
|
|
Boraginaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Rochefortia lundellii Camp (a,3,y) |
|
|
|
|
|
|
0.45 |
|
|
|
|
|
|
|
Cordia alliodora (Ruiz et Pav.) Cham. (a,2,x) |
|
|
|
|
0.23 |
|
0.20 |
|
0.19 |
|
|
|
|
|
Cordia stellifera I.M. Johnst. (a,3,x) |
|
|
|
|
|
|
|
|
|
|
0.65 |
|
|
Bromeliaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Aechmea mexicana Baker. (d,3,y) |
|
|
|
|
0.96 |
|
0.20 |
|
|
|
|
|
|
Burseraceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Bursera simaruba (L.) Sarg. (a,1/3,x) |
|
4.21 |
1.98 |
|
0.46 |
|
0.90 |
|
0.56 |
0.91 |
0.86 |
|
|
Cannaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Canna indica L. (c,3,x) |
|
|
1.29 |
|
0.23 |
|
|
|
|
|
0.58 |
|
|
Caricaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Carica papaya L. (a,3,x) |
2.47 |
3.73 |
2.11 |
2.15 |
|
|
|
0.20 |
|
0.19 |
2.12 |
0.17 |
|
Celastraceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Perrottetia longistylis Rose (a,3,y) |
|
|
|
|
|
|
|
|
|
|
0.96 |
|
|
Combretaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Combretum argenteum Bertol. (d,3,x) |
|
|
|
1.41 |
5.39 |
1.69 |
2.66 |
0.82 |
0.42 |
1.08 |
0.74 |
|
|
|
Combretum laxum Jacq. (d,3,x) |
|
|
|
|
|
|
0.61 |
|
0.37 |
|
|
|
|
|
Terminalia amazonia (J.F. Gmel.) Exell (a,2,y) |
|
|
|
|
|
|
|
|
|
|
0.17 |
|
|
Convolvulaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Itzaea sericea (Standl.) Standl. et Steyerm. (d,3,x) |
|
|
|
|
0.23 |
|
0.20 |
|
|
|
0.53 |
|
|
Costaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Costus dirzoi García-Mend. et G. Ibarra-Manr. (c,3,x) |
|
|
|
|
|
|
|
|
|
|
0.46 |
|
|
|
Costus scaber Ruiz et Pav. (c,3,x) |
|
|
0.54 |
|
0.51 |
|
|
|
0.19 |
|
1.15 |
|
|
Cucurbitaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Momordica charantia L. (d,3,x) |
10.30 |
|
0.54 |
|
|
|
|
|
|
|
0.17 |
|
|
Dioscoreaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Dioscorea bartlettii C.V. Morton (d,1,y) |
|
|
|
|
0.69 |
|
0.20 |
|
0.37 |
|
|
|
|
|
Dioscoria composita Hemsley (d,1,y) |
|
|
|
|
0.61 |
|
|
|
0.56 |
0.46 |
0.22 |
|
|
Euphorbiaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Acalypha diversifolia Jacq. (b,3,y) |
|
|
0.48 |
|
1.27 |
|
0.20 |
|
0.29 |
4.45 |
2.88 |
|
|
|
Adelia barbinervis Schltdl. et Cham. (a,1,x) |
|
|
|
|
0.23 |
|
5.84 |
|
|
|
|
|
|
|
Alchornea latifolia Klotzsch (a,3,y) |
0.67 |
|
|
|
|
|
0.20 |
|
|
|
|
|
|
|
Ochroma pyramidale (Cav. ex Lam.) Urb. (a,2,x) |
|
|
|
|
|
|
|
|
0.19 |
|
|
|
|
|
Sapium lateriflorum Hemsl. (a,3,y) |
|
|
|
|
|
1.09 |
|
0.69 |
0.37 |
|
|
|
|
|
Sapium nitidum (Monach.) Lundell (a,3,y) |
|
|
|
|
0.23 |
1.68 |
0.20 |
1.38 |
0.56 |
|
|
|
|
Fabaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Acacia cornigera (L.) Willd (b,1/3,x) |
|
|
|
|
0.91 |
|
|
|
0.19 |
|
0.43 |
|
|
|
Acacia hayesii Benth. (a,2/3,x) |
|
|
|
|
|
0.84 |
0.20 |
|
0.19 |
|
0.67 |
|
|
|
Acacia mayana Lundell. (a,3,x) |
|
|
|
|
4.69 |
0.84 |
0.78 |
|
0.59 |
|
|
|
|
|
Acacia usumacintensis Lundell. (a,3,x) |
0.67 |
|
|
|
0.23 |
1.68 |
3.07 |
2.77 |
1.35 |
3.09 |
|
|
|
|
Dialium guianense (Aubl.) Sandwith (a,1/3,y) |
|
|
|
0.48 |
|
0.56 |
|
|
|
|
|
|
|
Fabaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Gliricidia sepium Kunth ex Steud. (a,1,x) |
|
|
|
|
0.23 |
|
0.41 |
|
|
|
|
|
|
|
Inga nobilis Willd. (a,3,y) |
|
|
|
|
0.46 |
|
|
|
|
|
|
|
|
|
Lonchocarpus discolor Huber (a,1,y) |
|
|
|
|
0.28 |
|
|
|
|
|
|
|
|
|
Lonchocarpus pallidus Killip (a,1,y) |
|
|
|
|
|
1.76 |
0.78 |
|
0.22 |
0.69 |
0.38 |
|
|
|
Lonchocarpus purpusii Brandegee (a,1,y) |
|
|
|
5.43 |
2.10 |
|
|
2.09 |
2.37 |
0.92 |
0.19 |
|
|
|
Lonchocarpus sericeus (Poir.) Kunth (a,1,y) |
|
|
|
|
|
|
|
|
0.66 |
0.46 |
0.74 |
|
|
|
Machaerium cirrhiferum Pittier (d,2,x) |
|
|
|
|
|
|
|
0.69 |
0.51 |
|
0.17 |
|
|
|
Pithecellobium lanceolatum (Humb. et Bonpl. ex Willd.) Benth. (d,3,y) |
|
|
|
1.41 |
|
|
|
|
|
|
0.41 |
|
|
|
Platymiscium yucatanum Standl. (a,2,x) |
|
|
|
|
|
|
0.37 |
|
|
3.57 |
3.67 |
|
|
|
Pterocarpus hayesii Hemsl. (a,2,y) |
|
|
|
|
|
|
0.20 |
|
|
|
1.39 |
|
|
|
Pterocarpus rohrii Vahl (a,2,y) |
|
|
|
|
|
|
|
|
0.19 |
|
0.33 |
|
|
|
Rhynchosia minima (L.) DC. (d,3,x) |
2.20 |
|
|
|
|
|
|
|
0.19 |
|
0.22 |
|
|
|
Rhynchosia nelsoni (Rose) Grear (d,3,x) |
2.10 |
|
1.02 |
|
|
|
|
|
0.47 |
|
0.50 |
|
|
|
Senna multijuga (Rich.) H.S. Irwin et Barneby (a,1,x) |
|
|
|
5.58 |
0.61 |
8.92 |
4.62 |
8.62 |
5.28 |
0.93 |
|
|
|
|
Senna papillosa (Britton et Rose) H.S. Irwin et Barneby (b,3,x) |
|
2.11 |
1.45 |
5.11 |
2.64 |
11.64 |
4.86 |
16.93 |
4.32 |
2.29 |
0.84 |
|
|
|
Swartzia guatemalensis (Donn. Sm.) Pittier (a,1/3,y) |
|
|
|
|
|
|
|
|
|
|
0.33 |
|
|
Flacourtiaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Casearia tremula Griseb. ex C. Wright (a,3,y) |
|
|
|
|
0.23 |
|
|
|
0.41 |
|
|
|
|
|
Casearia corymbosa Kunth. (a,3,y) |
|
|
|
|
|
|
|
|
0.41 |
|
|
|
|
|
Casearia sylvestris Sw. (a,3,y) |
|
|
|
|
|
|
|
|
0.19 |
|
0.79 |
|
|
Heliconiaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Heliconia uxpanapensis C. Gut. Baez (c,3,x) |
|
|
|
|
|
|
|
|
0.19 |
|
|
|
|
Hippocrateaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Hippocratea celastroides Kunth (d,2,y) |
|
|
|
|
0.51 |
|
|
|
|
|
|
|
|
Lauraceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Ocotea rubiginosa Mez (a,3,y) |
|
|
|
|
0.23 |
0.84 |
0.20 |
|
|
|
0.33 |
|
|
|
Persea americana Mill. (a,3,x) |
|
|
|
|
|
|
|
|
0.19 |
1.36 |
0.81 |
|
|
|
Nectandra loeseneri Mez (a,1/3,y) |
|
|
|
|
|
|
|
|
|
|
0.19 |
|
|
|
Nectandra reticulata (Ruiz et Pav.) Mez (a,1/3,y) |
|
|
0.48 |
|
|
|
|
|
|
|
0.86 |
|
|
Leguminosae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Albizia purpusii Britton et Rose (a,2,x) |
0.77 |
|
|
|
0.71 |
|
0.61 |
1.10 |
0.54 |
1.53 |
1.37 |
|
|
|
Caesalpinea sp. L. (d,1/3,x) |
|
|
|
|
1.67 |
|
|
|
|
0.46 |
0.55 |
|
|
Liliaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Smilax spinosa Mill. (d,3,x) |
1.43 |
|
|
|
|
|
|
|
|
|
|
|
|
Loganiaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Strychnos brachiata Ruiz et Pav. (d,3,y) |
|
|
|
|
1.07 |
|
|
|
0.37 |
|
|
|
|
Malpighiaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Stigmaphyllon ellipticum (Kunth) A. Juss. (d,3,y) |
6.68 |
|
6.31 |
|
0.92 |
|
2.25 |
|
1.64 |
|
0.96 |
|
|
|
Stigmaphyllon lindenianum A. Juss. (d,3,y) |
3.86 |
|
2.21 |
|
|
|
|
|
0.22 |
0.46 |
0.26 |
|
|
Malvaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Hampea nutricia Fryxell (a,3,y) |
|
|
|
|
0.33 |
|
1.02 |
|
1.88 |
1.52 |
0.33 |
|
|
|
Luehea speciosa Willd. (a,3,y) |
|
|
|
|
0.46 |
|
|
|
|
|
|
|
|
Melastomataceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Clidemia petiolaris (Schltdl. et Cham.) Schltdl. ex Triana (b,3,x) |
|
|
|
|
|
|
|
|
0.22 |
|
|
|
|
|
Clidemia setosa (Triana) Gleason (b,3,x) |
|
|
|
|
3.09 |
|
2.66 |
|
2.79 |
|
1.80 |
|
|
|
Conostegia xalapensis (Bonpl.) D. Don (b,3,x) |
|
2.11 |
|
1.42 |
3.70 |
0.85 |
1.02 |
|
2.42 |
0.46 |
0.65 |
|
|
|
Leandra barbinervis (Cham. ex Triana) Cogn. (a,3,y) |
|
|
|
|
|
|
|
|
|
|
|
0.22 |
|
Melastomataceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Miconia argentea (Sw.) DC. (a,3,y) |
|
|
|
|
0.23 |
|
0.20 |
|
|
|
|
|
|
|
Miconia trinervis Griseb. (a,3,y) |
|
|
|
|
1.52 |
|
0.41 |
|
0.19 |
|
|
|
|
|
Miconia triplinervis Ruiz et Pav. (a,3,y) |
|
|
|
|
|
|
|
|
0.19 |
|
|
|
|
Meliaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Trichilia martiana C. DC. (a,1/3,y) |
|
|
|
|
|
|
0.41 |
|
0.29 |
|
0.43 |
|
|
|
Cedrela odorata L. (a,2,x) |
|
|
1.45 |
|
|
|
0.20 |
0.89 |
|
|
0.50 |
|
|
|
Guarea glabra Vahl (a,1/3,y) |
|
|
|
|
|
|
|
|
0.19 |
|
0.17 |
|
|
Moraceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Brosimum guianense Huber ex Ducke (a,3,y) |
|
|
|
|
0.23 |
|
|
|
0.19 |
|
|
|
|
|
Cecropia obtusifolia Bertol. (a,3,x) |
|
|
|
|
|
|
0.20 |
|
0.19 |
|
0.19 |
|
|
Myrtaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Calyptranthes chytraculia (L.) Sw. (a,3,y) |
4.30 |
|
1.45 |
|
0.51 |
|
0.45 |
|
0.36 |
|
1.92 |
|
|
|
Calyptranthes latifolia Poir. (d,3,y) |
|
|
0.54 |
1.41 |
0.23 |
|
|
|
0.25 |
|
0.38 |
|
|
|
Eugenia acapulcensis Steud. (a,3,x) |
0.67 |
|
|
|
0.23 |
|
0.20 |
|
|
|
|
|
|
|
Eugenia capuli (Schltdl. et Cham.) Hook. et Arn. (a,3,x) |
|
|
0.48 |
1.42 |
|
|
0.49 |
|
1.18 |
0.46 |
3.53 |
|
|
|
Psidium guajava L. (a,3,x) |
0.67 |
|
1.66 |
|
0.84 |
|
2.13 |
0.70 |
1.08 |
|
0.43 |
|
|
|
Psidium schenckianum Kiaersk. (a,3,y) |
|
|
|
|
|
|
|
|
0.66 |
|
|
|
|
Nyctaginaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Neea belizensis Lundell (a,3,y) |
|
|
0.48 |
|
0.23 |
|
|
|
|
|
|
|
|
Passifloraceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Passiflora costaricensis Killip (d,3,x) |
|
|
|
|
|
|
0.20 |
|
0.19 |
|
|
|
|
|
Passiflora serratifolia L. (d,3,x) |
|
|
|
|
|
|
0.41 |
|
0.19 |
|
|
|
|
|
Passiflora unipetala P. Jorg., Muchhala et J.M. MacDougal (d,3,x) |
|
|
|
|
|
|
|
|
|
|
0.33 |
|
|
Phytolaccaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Rivina humilis L. (c,3,x) |
|
|
1.02 |
|
|
|
|
|
|
|
0.17 |
|
|
|
Trichostigma octandrum (L.) H. Walter (d,3,x) |
|
|
|
|
0.46 |
|
|
|
0.63 |
|
0.50 |
|
|
Piperaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Piper auritum Kunth (b,3,x) |
9.75 |
1.33 |
|
|
|
0.23 |
|
0.66 |
|
0.25 |
|
0.17 |
|
|
Piper hispidum Kunth (b,3,x) |
|
|
|
|
5.67 |
|
6.66 |
|
12.40 |
4.37 |
17.59 |
|
|
|
Piper lapathifolium (Kunth) Steud. (b,3,x) |
|
|
|
|
|
|
|
|
0.39 |
1.37 |
2.23 |
|
|
|
Piper umbellatum L. (b,3,x) |
3.16 |
|
|
|
|
1.34 |
|
2.98 |
|
4.67 |
0.46 |
1.13 |
|
Polygonaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Coccoloba barbadensis Jacq. (a,3,y) |
|
|
|
|
|
|
0.20 |
|
|
|
0.41 |
|
|
|
Coccoloba hondurensis Lundell. (a,1/3,y) |
|
|
|
|
|
|
|
|
|
|
0.48 |
|
|
|
Coccoloba matudai Lundell. (a,3,y) |
|
|
|
|
0.23 |
|
|
|
0.76 |
|
0.41 |
|
|
|
Polygonum sp. L. (c,3,y) |
|
|
|
|
|
|
0.94 |
|
0.19 |
|
|
|
|
Pteridaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Pteridium aquilinum (L.) Kuhn (c,1,x) |
|
|
1.83 |
|
0.23 |
|
|
|
|
|
0.29 |
|
|
Ranunculaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Clematis sp. L. (d,3,y) |
|
|
|
|
|
|
0.20 |
|
0.19 |
|
|
|
|
Rhamnaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Gouania lupuloides (L.) Urb. (d,2,x) |
|
|
|
|
2.94 |
|
1.47 |
|
1.62 |
|
2.09 |
|
|
Rubiaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Alibertia edulis (Rich.) A. Rich. ex DC. (a,3,y) |
|
|
|
|
0.46 |
|
|
|
0.19 |
|
0.17 |
|
|
|
Amaioua corymbosa Kunth. (b,3,y) |
|
|
|
|
|
|
0.20 |
|
0.19 |
|
|
|
|
|
Hamelia longipes Standl. (b,3,x) |
|
|
2.43 |
|
0.28 |
|
0.78 |
|
|
0.46 |
0.17 |
|
|
|
Hamelia patens Jacq. (b,3,x) |
|
8.87 |
2.10 |
4.11 |
1.41 |
2.84 |
|
2.00 |
0.69 |
1.42 |
0.46 |
3.84 |
|
Rubiaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Hamelia verticillata Moc. et Sessé ex DC. (b,3,x) |
1.73 |
2.47 |
6.44 |
|
1.55 |
1.85 |
2.54 |
|
0.69 |
1.37 |
1.39 |
|
|
|
Psychotria cartagoensis Nepokr. (b,3,y) |
|
|
|
|
|
|
0.20 |
|
0.19 |
|
|
|
|
|
Psychotria chiapensis Standl. (a,3,y) |
|
|
|
|
0.74 |
|
|
|
|
|
0.41 |
|
|
|
Psychotria flava Oerst. ex Standl. (a,3,y) |
|
|
|
|
1.70 |
|
|
|
0.37 |
|
|
|
|
|
Psychotria limonensis K. Krause (b,3,y) |
|
|
0.48 |
|
1.19 |
|
0.45 |
|
2.44 |
|
1.27 |
|
|
|
Psychotria marginata Sw. (a,3,y) |
|
|
|
|
|
|
|
|
0.37 |
|
|
|
|
|
Psychotria padifolia Willd. ex Roem. et Schult. (a,3,y) |
|
|
|
|
|
|
|
|
0.19 |
|
|
|
|
|
Psychotria simiarum Standl. (a,3,y) |
|
|
|
|
|
|
0.20 |
|
0.19 |
|
|
|
|
|
Randia armata (Sw.) DC. (a,3,y) |
0.67 |
|
2.31 |
|
0.74 |
|
0.61 |
|
0.37 |
|
0.53 |
|
|
|
Randia laetevirens Standl. (a,3,y) |
|
|
1.34 |
|
|
|
0.20 |
|
|
|
|
|
|
|
Simira lancifolia (Lundell) E. Martínez et Borhidi (a,3,y) |
|
|
|
|
0.69 |
|
0.65 |
|
0.63 |
|
|
|
|
|
Simira salvadorensis Standl. (a,3,y) |
2.97 |
|
|
|
2.94 |
0.84 |
3.27 |
|
1.35 |
|
|
|
|
Rutaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Citrus reticulata Blanco. (a,3,x) |
|
|
|
|
|
|
0.41 |
|
0.19 |
0.46 |
0.36 |
|
|
|
Citrus sinensis (L.) Osbeck. (a,3,x) |
79.03 |
|
80.31 |
|
68.31 |
0.23 |
53.39 |
0.20 |
47.62 |
0.37 |
43.50 |
0.17 |
|
|
Zanthoxylum regnellianum Engl. (a,3,x) |
|
|
|
|
|
|
0.41 |
|
0.19 |
|
0.17 |
|
|
Sapindaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Allophylus cominia (L.) Sw. (b,1/3,y) |
|
|
|
|
0.28 |
|
0.20 |
|
|
|
|
|
|
|
Cupania glabra Sw. (a,1/3,x) |
|
|
0.96 |
2.87 |
3.19 |
|
1.23 |
|
1.06 |
0.46 |
0.19 |
|
|
|
Paullinia clavigera Schltdl. (d,3,x) |
|
|
|
|
2.64 |
|
1.31 |
|
2.38 |
0.91 |
1.10 |
|
|
|
Paullinia costaricensis Radlk. (d,3,x) |
|
|
|
|
3.27 |
|
0.90 |
|
0.25 |
|
0.55 |
|
|
|
Serjania goniocarpa Radlk. (d,3,y) |
|
|
|
|
|
|
|
|
|
|
1.66 |
|
|
|
Serjania mexicana (L.) Willd. (d,3,y) |
|
|
|
|
0.28 |
|
|
|
|
|
2.59 |
|
|
Sapotaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Chrysophyllum mexicanum Brandegee ex Standl. (a,3,y) |
|
|
|
|
0.28 |
|
0.25 |
|
0.76 |
|
|
|
|
Schizaeaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Lygodium heterodoxum Kunze (d,1,x) |
0.67 |
|
|
|
0.28 |
|
|
|
0.22 |
|
0.41 |
|
|
|
Lygodium venustum Sw. (d,1,x) |
|
|
|
|
1.02 |
|
0.98 |
|
1.25 |
|
1.03 |
|
|
Simaroubaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Picramnia antidesma Sw. (b,3,y) |
|
|
|
|
|
|
0.41 |
|
0.19 |
|
|
|
|
|
Picramnia teapensis Tul. (b,3,y) |
|
|
|
|
0.69 |
|
1.60 |
|
0.78 |
0.46 |
0.81 |
|
|
Solanaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Capsicum annuum L. (c,3,x) |
1.43 |
|
2.47 |
|
|
|
0.29 |
|
0.32 |
|
0.17 |
|
|
|
Cestrum racemosum Ruiz et Pav. (a,3,x) |
|
|
|
|
0.46 |
|
0.20 |
|
0.37 |
|
|
|
|
|
Eutheta hondurensis (Donn. Sm.) Standl. (c,3,y) |
|
|
|
|
|
|
|
|
0.19 |
|
|
|
|
|
Lycianthes purpusii (Brandegee) Bitter (d,3,x) |
|
|
|
|
0.38 |
|
|
|
|
|
|
|
|
|
Physalis pubescens L. (c,3,x) |
|
|
|
|
0.28 |
|
0.25 |
|
|
|
0.17 |
|
|
|
Solanum geminata (G. Don) Walp. (b,3,x) |
1.33 |
|
|
|
0.28 |
0.84 |
2.49 |
|
0.19 |
|
1.51 |
|
|
|
Solanum rudepannum Dunal (b,3,x) |
|
|
|
|
|
|
|
|
0.19 |
|
0.19 |
|
|
|
Solanum schlechtendalianum Walp. (a,3,x) |
|
|
|
|
|
|
0.20 |
|
0.41 |
|
0.17 |
|
|
|
Solanum tampicense Dunal (b,3,x) |
|
|
0.48 |
|
|
0.84 |
|
|
0.63 |
|
0.22 |
|
|
|
Solanum umbellatum Mill. (b,3,x) |
2.00 |
|
2.42 |
|
0.94 |
|
1.76 |
|
1.35 |
|
0.69 |
|
|
Sterculiaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Guazuma ulmifolia Lam. (a,1/3,x) |
|
|
|
|
|
|
|
|
0.37 |
0.61 |
|
|
|
Tiliaceae |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Heliocarpus appendiculatus Turcz. (a,2,x) |
|
|
|
|
|
|
|
|
|
1.07 |
0.33 |
|
|
|
Heliocarpus donnellsmithii Rose (a,2,x) |
|
|
|
|
|
|
|
|
|
|
0.46 |
0.36 |
Referencias
Aide, T. M., Zimmerman, J. K., Rosario, M. y Marcano, H. (1996). Forest recovery in abandoned cattle pastures along an elevational gradient in Northeastern Puerto Rico. Biotropica, 28, 537–548.
Bedoya, A. R. (2009). Plantaciones forestales como mecanismo para la recuperación de zonas degradadas en la Estación Biológica La Selva, Costa Rica (Tesis de maestría). Universidad Estatal a Distancia, Vicerrectoría Académica Escuela de Ciencias Exactas y Naturales, San José, Costa Rica.
Bloom, S. (1981). Similarity indices in community studies: potential pitfalls. Marine Ecology Progress Series, 5, 125–128.
Brown, S. y Lugo, A. E. (1990). Effects of forest clearing and succession on the carbon and nitrogen content of soils in Puerto Rico. Plant and Soil, 124, 53–64.
Chazdon, R. L. (2014). Second growth: the promise of tropical forest regeneration in an age of deforestation. Chicago: University of Chicago Press.
Clarke, K. R. (1993). Non-parametric multivariate analysis of changes in community structure. Australian Journal of Ecology, 18, 117–143.
De la Cruz-Osorio, J. C. (2009). El huerto familiar como sistema agroforestal en Francisco Villa, Tihuatlán, Veracruz (Tesis). División de Ciencias Forestales, Universidad Autónoma de Chapingo, México.
De la Vega-Rivera, A. (2005). El papel de los árboles de cítricos sobre la dispersión de semillas en potreros tropicales: implicaciones para la restauración ecológica de los Tuxtlas, Veracruz, México (Tesis de maestría). Instituto de Ecología UNAM, México D.F.
Del Amo, R. S. y Ramos, P. J. (1993). Use and management of secondary vegetation in a humid-tropical area. Agroforestry Systems, 21, 27–42.
Dirzo, R., Aguirre, A. y López, J. C. (2009). Diversidad florística de las selvas húmedas en paisajes antropizados. Investigación Ambiental, 1, 17–22.
Finegan, B. (1992). The management potential of neotropical secondary lowland rain forest. Forest Ecology and Management, 47, 295–321.
García-González, A. y Riverón-Giró, F. (2014). Organización espacial y estructura de una población de Ionopsis utricularioides (Orchidaceae) en un área suburbana de Pinar del Río, Cuba. Lankesteriana, 13, 419–427.
Gardner, T. A., Barlow, J., Parry, L. W. y Peres, C. A. (2007). Predicting the uncertain future of tropical forest species in a data vacuum. Biotropica, 39, 25–30.
Gentry, A. H. (1982). Patterns of neotropical plant species diversity. En M. K. Hecht, B. Wallace y E. T. Prance (Eds.), Evolutionary biology (pp. 1–84). New York: Plenum Publishing.
Gentry, A. H. (1988). Tree species richness of upper Amazonian forests. Proceedings of the National Academy of Sciences, 85, 156–159.
Gómez-Pompa, A. (1979). Antecedentes de las investigaciones botánico-ecológicas en la región del río Uxpanapa, Veracruz, México. Biótica, 4, 127–133.
Gómez-Pompa, A. y Vázquez-Yanes, C. (1985). Estudio sobre la regeneración de selvas en regiones cálido-húmedas. En A. Gómez-Pompa y S. Del Amo (Eds.), Investigaciones sobre la regeneración de Selvas Altas en Veracruz, México (pp. 1–25). México D.F.: Alhambra Mexicana, S.A. de C.V./ Instituto Nacional de Investigaciones sobre Recursos Bióticos.
Gómez-Pompa, A. y Wiechers, L. (1975). Regeneración de los ecosistemas tropicales y subtropicales. En A. Gómez-Pompa, S. Del Amo, C. Vázquez-Yanes y C. Butanda-Cervera (Eds.), Investigaciones sobre la regeneración de Selvas Altas en Veracruz, México (pp. 11–30). México D.F.: Editorial Continental.
Guariguata, M. R. y Ostertag, R. (2001). Neotropical secondary forest succession: changes in structural and functional characteristics. Forest Ecology and Management, 148, 185–206.
Hammer, O., Harper, D. A. T. y Ryan, P. D. (2001). PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica, 4, 1–9.
Holl, K. D. (2002). Long-term vegetation recovery on reclaimed coal surface mines in the eastern USA. Journal of Applied Ecology, 39, 960–970.
Inegi (Instituto Nacional de Estadística, Geografía e Informática). (2008). México en cifras. Uxpanapa, Veracruz de Ignacio de la Llave (30210). Recuperado en abril 2018, de: http://www.beta.inegi.org.mx/app/areasgeograficas/?ag=30210
Kammesheidt, L. (1998). The role of tree sprouts in the restoration of stand structure and species diversity in tropical moist forest after slash-and-burn agriculture in Eastern Paraguay. Plant Ecology, 139, 155–165.
Lamb, D., Erskine, P. D. y Parrotta, J. A. (2005). Restoration of degraded tropical forest landscapes. Science, 310, 1628–1632.
Lamprecht, H. (1990). Silvicultura en los trópicos: los ecosistemas forestales en los bosques tropicales y sus especies arbóreas; posibilidades y métodos para un aprovechamiento sostenido. Rossdorf, Alemania: Agencia Alemana de Cooperación Técnica (GTZ) GmbH.
Laurance, W. F. y Vasconcelos, H. L. (2004). Ecological effects of habitat fragmentation in the tropics. En G. A. B. da Fonseca, C. A. Harvey, G. Gascon, H. L. Vasconcelos y A. M. Izac (Eds.), Agroforestry and biodiversity conservation in Tropical landscapes (pp. 33–49). Washington D.C.: Island Press.
Lawrence, R. W., Bardgett, W. D. R. y Clarkson, B. D. (2010). The use of chronosequences in studies of ecological succession and soil development. Journal of Ecology, 98, 725–736.
Legendre, P. y Legendre, L. F. (2012). Numerical ecology, Vol. 24, Tercera Edición. Amsterdam: Elsevier.
Letcher, S. G. y Chazdon, R. L. (2012). Life history traits of lianas during tropical forest succession. Biotropica, 44, 720–727.
López-Acosta, J. C., Lascurain, M., López-Binnqüist, C. y Covarrubias, M. (2014). Structure and floristic composition of forest management systems associated with the edible fruit tree Oecopetalum mexicanum in the sierra de Misantla, Veracruz, Mexico. Economic Botany, 68, 44–58.
Madeira, B. G., Espírito-Santo, M. M, D’Ângelo-Neto, S., Nunes, Y. R. F., Sánchez-Azofeifa, A., Fernandes, G. W. et al. (2009). Changes in tree and liana communities along a successional gradient in a tropical dry forest in south-eastern Brazil. Plant Ecology, 201, 291–304.
Mariscal, C. A. (1998). Efecto de las plantaciones forestales sobre la calidad de regeneración leñosa en la estación biológica La Selva, Costa Rica (Tesis de maestría). Centro Agronómico Tropical de Investigación y Enseñanza (CATIE). Turrialba, Costa Rica.
Márquez, W. (1976). Estudio de la vegetación secundaria en la región de Uxpanapa, Veracruz (Tesis). Facultad de Biología, Universidad Veracruzana, Xalapa, México.
Martínez-Ramos, M. (1985). Claros, ciclos vitales de los árboles tropicales y regeneración natural de las selvas altas perennifolias. En A. Gómez-Pompa y S. Del Amo (Eds.), Investigaciones sobre la regeneración de Selvas Altas en Veracruz, México (pp. 191–239). Xalapa: Alhambra Mexicana, S.A. de C.V./ Instituto Nacional de Investigaciones sobre Recursos Bióticos.
Martínez-Ramos, M. y García-Orth, X. (2007). Sucesión ecológica y restauración de las selvas húmedas. Boletín de la Sociedad Botánica de México, 80, 69–84.
Melo, F. P. L., Arroyo-Rodríguez, V., Fahrig, L., Martínez-Ramos, M. y Tabarelli, M. (2013). On the hope for biodiversity-friendly tropical landscapes. Trends in Ecology et Evoution, 28, 462–468.
Meneses, T. (2009). Análisis del índice normalizado de la vegetación (NDVI) para detección de degradación de la cubierta forestal en México 2008-2009. Estudios de caso sobre la evaluación de la degradación de los bosques. Roma: FAO.
Miranda, F. y Hernández, X. (1963). Los tipos de vegetación de México y su clasificación. Boletín de la Sociedad Botánica de México, 28, 29–179.
Montagnini, F. (2008). Management for sustainability and restoration of degraded pastures in the neotropics. En R. W. Myster (Eds.), Post-agricultural succession in the Neotropics (pp. 265–295). New York: Springer.
Orozco-Zamora, C. y Montagnini, F. (2007a). Seed rain and seed dispersal agents in pure and mixed plantations of native trees and abandoned pastures at La Selva Biological Station, Costa Rica. Restoration Ecology, 15, 453–461.
Orozco-Zamora, C. y Montagnini, F. (2007b). Lluvia de semillas y sus agentes dispersores en plantaciones forestales de nueve especies nativas en parcelas puras y mixtas en la Estación Biológica La Selva, Costa Rica. Recursos Naturales y Ambiente, 49, 131–140.
Otsamo, R. (2000). Secondary forest regeneration under fast-growing forest plantations on degraded Imperata cylindrica grasslands. New Forests, 19, 69–93.
Pantoja-Aparicio, E. (2014). Diversidad florística y manejo asociado a las plantaciones de Hevea brasiliensis (Willd. Ex A. Juss.) Müell. Arg., 1865 en el Valle de Uxpanapa, Veracruz (Tesis). Facultad de Biología, Universidad Veracruzana. Xalapa, México.
Parrotta, J. A. (1992). The role of plantation forests in rehabilitating degraded ecosystems. Agriculture Ecosystem Environmental, 41, 115–133.
Parrotta, J. A. (1995). Influence of understory composition on understory colonization by native species in plantations on a degraded tropical site. Journal of Vegetation Science, 6, 627–636.
Parrotta, J. A. (1999). Productivity, nutrient cycling, and succession in single- and mixed-species plantations of Casuarina equisetifolia, Eucalyptus robusta, and Leucaena leucocephala in Puerto Rico. Forest Ecology and Management, 124, 45–77.
Parrotta, J. A. y Turnbull, J. (1997). Catalizing native forest regeneration on degraded tropical lands. Forest Ecology and Management, 99, 1–7.
Pietersen, S., López-Acosta, J. C., Gómez-Díaz, J. A. y Lascurain-Rangel, M. (2018). Floristic diversity and cultural importance in agroforestry systems on small-scale farmer’s livelihoods in Central Veracruz, México. Sustainability, 10, 279.
R Core Team. (2017). R: A Language And Environment For Statistical Computing. Disponible en:
https://www.R-project.org/
Ramos-Prado, J. M., Del Amo, S. y Fernández, E. (1982). Análisis estructural de un área de vegetación secundaria en Uxpanapa, Veracruz. Biótica, 7, 7–28.
Rodríguez-Luna, E., Gómez-Pompa, A., López, J. C., Velázquez-Rosas, N., Aguilar, Y. y Vázquez, M. (2011). Atlas de los espacios naturales protegidos de Veracruz. Xalapa: Secretaría de Educación. Gobierno del estado de Veracruz.
Ruiz-Guerra, B., Velázquez-Rosas, N. y López-Acosta, J. C. (2014). Plant diversity in live fences and pastures, two examples form the mexican humid tropics. Enviromental Management, 54, 656–667.
Sánchez-Colón, S., Flores-Martínez, A., Cruz-Leyva, I. A. y Velázquez, A. (2010). Estado y transformación de los ecosistemas terrestres por causas humanas. En R. Dirzo, R. Gonzalez e I. March (Eds.), Capital natural de México, Vol. II: estado de conservación y tendencias de cambio (pp. 75–129). México: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Schnitzer, S. A. (2005). A mechanistic explanation for global patterns of liana abundance and distribution. American Naturalist, 166, 262–276.
Schnitzer, S. A. y Bongers, F. (2002). The ecology of lianas and their role in forests. Trends in Ecology et Evolution, 17, 223–230.
Solow, A. R. (1993). A simple test for change in community structure. Journal of Animal Ecology, 62, 191–193.
Toledo-Aceves, T. y Swaine, M. (2008). Above-and below-ground competition between the liana Acacia kamerunensis and tree seedlings in contrasting light environments. Plant Ecology, 196, 233–244.
Tropicos. (2017). Missouri Botanical Garden Recuperado 30 Mayo 2018. Fuente: http://www.tropicos.org/Home.aspx
Van-Breugel, M. A., Hall, J. S., Craven, D., Bailon, M., Hernández, A., Abbene, M. et al. (2013). Succession of ephemeral secondary forests and their limited role for the conservation of floristic diversity in a human-modified tropical landscape. Plos One, 8, e82433.
Villaseñor, J. L. (2016). Checklist of the native vascular plants of Mexico. Revista Mexicana de Biodiversidad, 87, 559–902.
Wendt, T. (1987). Las selvas de Uxpanapa, Veracruz-Oaxaca, México: evidencia de refugios florísticos cenozoicos. Anales Instituto de Biología, Universidad Nacional Autónoma de México, Serie Botánica, 58, 29–54.
Wijdeven, S. M. J. y Kuzee, M. E. (2000). Seed availability as a limiting factor in forest recovery processes in Costa Rica. Restoration Ecology, 8, 414–424.
Wright, S. J., Carrasco, C., Calderón, C. y Paton, S. (1999). The El Niño Southern Oscillation, variable fruit production, and famine in a tropical forest. Ecology, 80, 1632–1642.
Yamamoto, S. (2000). Forest gap dynamics and tree regeneration. Journal Forest Restoration, 5, 223–229.