La importancia y diversidad de los recursos pesqueros del río Usumacinta, México
Manuel Mendoza-Carranza a, *, Wendi Arévalo-Frías b, Alejandro Espinoza-Tenorio c, Chrystian C. Hernández-Lazo a, Arturo M. Álvarez-Merino a y Rocío Rodiles-Hernández d
a El Colegio de la Frontera Sur, Unidad Villahermosa, Carretera Villahermosa-Reforma Km 15.5 s/n, Ranchería Guineo 2a. sección, 86280 Villahermosa, Tabasco, México
b División Académica de Ciencias Biológicas, Universidad Juárez Autónoma de Tabasco, Carretera Villahermosa-Cárdenas Km 0.5 s/n, Ranchería Emiliano Zapata, 86150 Villahermosa, Tabasco, México
c El Colegio de la Frontera Sur, Unidad Campeche, Av. Rancho Polígono 2-A, Ciudad Industrial, 24500 Lerma, Campeche, México
d El Colegio de la Frontera Sur, Unidad San Cristóbal de la Casas, Carretera Panamericana y Periférico Sur s/n, Barrio María Auxiliadora, 29290 San Cristóbal de las Casas, Chiapas, México
*Autor para correspondencia: mcarranza@ecosur.mx (M. Mendoza-Carranza)
Resumen
La cuenca del Usumacinta es uno de los principales sistemas hidrológicos de México, posee una alta diversidad de flora y fauna, y constituye el último río vivo en el país, por consiguiente la generación de información que ayude a su aprovechamiento sustentable es urgente. El objetivo de esta investigación es analizar la diversidad de especies asociada a la pesca en la cuenca del Usumacinta, haciendo énfasis en la importancia de las especies introducidas en relación a la diversidad de especies explotadas. La cuenca fue dividida en 3 regiones (selva, lagunas y costa). En toda la cuenca, la pesca de pequeña escala explota 35 especies (30 especies de peces y 5 de crustáceos). La mojarra pinta (Parachromis managuensis), la tilapia (Oreochromis niloticus), el bobo escama (Ctenopharyngodon idella), la carpa común (Cyprinus carpio), la carpa roja (Carassius auratus) y los plecos (Pterygoplichthys spp.) son especies introducidas, representando 20.7% del total. En la zona selva, las especies introducidas alcanzaron altas tasas de captura, siendo las carpas las más capturadas. A pesar de que estas especies son parte fundamental de las pesquerías del Usumacinta, sus efectos sobre el ecosistema deben ser analizados, especialmente especies con altas abundancias y nula importancia comercial como los plecos.
Palabras clave:
Pesca; Especies invasoras; Cyprinidae; Loricariidae; Conectividad
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
The importance and diversity of fisheries resources at the Usumacinta River, Mexico
Abstract
The Usumacinta basin is one of the main hydrological systems in Mexico, it has a high diversity of flora and fauna, and it is the last free flowing river in the country, so that the generation of information that helps its sustainable use is urgent. The aim of this research is to analyze the species diversity associated with fishing in the basin of the Usumacinta, considering the importance of invasive species in relation to the diversity of exploited species. The basin was divided into 3 regions (forest, lagoons and coast). Throughout the basin, small-scale fisheries exploited 35 species (30 species of fish and 5 of crustaceans). The jaguar guapote (Parachromis managuensis), tilapia (Oreochromis niloticus), grass carp (Ctenopharyngodon idella), common carp (Cyprinus carpio), red carp (Carassius auratus) and the suckermouth armoured catfish (Pterygoplichthys spp.) are introduced species, representing 20.7% of the total. In the upper area, introduced species reached high catch rates, having the carps the highest capture rate. Although these species are a fundamental part of fisheries in the Usumacinta, its effects on the ecosystem should be analyzed, especially species with high abundances and no importance as the suckermouth armored catfish.
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Fishery; Invasive species; Cyprinidae; Loricariidae; Connectivity
Introducción
El Río Usumacinta es el más caudaloso de México cuya condición ecológica aún provee importantes servicios ambientales, como la pesca. Dicho sistema lótico sustenta a una alta diversidad de hábitats dulceacuícolas y estuarinos en donde la pesca es aún una de las principales actividades económicas de la cuenca (Mendoza-Carranza et al., 2013). Como en otras regiones de México, la pesca de pequeña escala provee la mayor parte de la producción pesquera (Arreguín-Sánchez y Arcos-Huitrón, 2011) y es una fuente de alimento primordial para las poblaciones locales, pudiéndose afirmar que la pesca tiene una alta importancia económica y social (Inda-Díaz et al., 2009). No obstante, como sucede con la mayoría de las pesquerías en aguas continentales de México, el conocimiento que se tiene de éstas en el Usumacinta es escaso y se restringe a trabajos específicos en tiempo y espacio. Una de las mayores dificultades para el estudio de estas pesquerías es la escasa información, pues por lo general, las estadísticas oficiales agrupan los registros, minimizando la importancia de las pesquerías locales destinadas prioritariamente al autoconsumo (Inda-Díaz et al., 2009). Esta falta de información es especialmente aguda en el caso de pesquerías de autoconsumo.
En los pocos trabajos que se tienen con relación a las pesquerías asociadas a la cuenca del Usumacinta, se tienen registradas 57 especies de importancia comercial (Huerta-Ortíz et al., 2013; Inda-Díaz et al., 2009; Mendoza-Carranza et al., 2013; Perera-García et al., 2013; Rodiles-Hernández y Cruz-Morales, 2004). Algunas de estas especies son de alto valor comercial, como los robalos (género Centropomus) (Perera-García et al., 2011, 2013), y los cíclidos, que cumplen un papel fundamental en la nutrición de muchos de los pobladores que se asientan a lo largo de la cuenca del Usumacinta (Inda-Díaz et al., 2009; Mendoza-Carranza et al., 2013). Es importante notar que a pesar del alto potencial pesquero que tienen las especies nativas, estos trabajos también reportan especies introducidas como parte de la fauna que compone la pesca comercial y de autoconsumo.
Independientemente de los efectos negativos de la introducción de especies, al menos la tilapia (Oreochromis niloticus) presenta la mayor importancia pesquera por volumen de captura en la cuenca del Usumacinta (Benítez y Ponce, 2014). Otras especies introducidas y que al momento presentan una creciente importancia comercial y alimenticia media son la mojarra pinta (Parachromis managuensis), la carpa común (Cyprinus carpio) y la carpa herbívora (Ctenopharyngodon idella) (Amador-del Ángel y Wakida-Kusunoki, 2014). Tan solo en los años 2013 y 2014, la carpa herbívora se explotó en un volumen total de 1,603,258 kg representando un valor económico de $10,755,801 pesos mexicanos. Para el mismo periodo, el volumen total de tilapia capturado en la cuenca Usumacinta fue de 417,731 kg, con un valor de $5,103,982 pesos. Por último, el volumen total de mojarra pinta capturado en el Usumacinta fue de 24,491 kg, representando un total de $669,218 pesos (Sagarpa, 2015).
El efecto de estas introducciones no solo impactó positivamente a las comunidades pesqueras; en otros casos, las especies introducidas han sido vectores de enfermedades, como en el caso de C. carpio en San Cristóbal de Las Casas, la cual transmitió endoparásitos a las poblaciones del pez endémico popoyote Profundulus hildebrandi (Rodiles-Hernández et al., 2013; Velázquez-Velázquez y Schmitter-Soto, 2004).
Especial atención merecen los plecos (Pterygoplichthys spp.), cuya abundancia y amplia distribución es un problema económico para los pescadores (Barba y Cano-Salgado, 2014; Lienart et al., 2013), ya que cuando se enmallan, la mayoría de las veces los filamentos de las redes tienen que cortarse, produciendo pérdidas (Mendoza-Carranza et al., 2008). Estas especies han tenido un incremento muy alto en sus poblaciones en los últimos años, pero al contrario de la tilapia, el pleco no es una especie que sea del agrado del mercado de consumo, por lo que su evolución como producto alimenticio o insumo para otros alimentos ha sido muy lenta (Cano-Salgado et al., 2012).
Debido a la dominancia y amplia distribución de las especies introducidas dentro de la cuenca del Usumacinta, se plantea como hipótesis que estas especies incrementarán su importancia pesquera. Por tanto, los objetivos de este trabajo son actualizar el listado de especies de importancia comercial que se explotan en la cuenca del río Usumacinta y determinar su relevancia pesquera poniendo énfasis en las especies introducidas que ocurren en la cuenca del Usumacinta, así como su variación en un gradiente longitudinal.
Materiales y métodos
La cuenca del Río Usumacinta abarca una superficie de 7,319,522 ha (March y Castro, 2010) que comparten México y Guatemala, iniciando en la parte alta de la sierra de los Cuchumatanes en Guatemala y desembocando en el golfo de México. En la parte mexicana, la cuenca abarca los estados de Chiapas, Tabasco y parte de Campeche (Castillo-Bolaina et al., 2011). El río Usumacinta tiene una longitud total de 560 km; la precipitación media anual es de 2,700 mm en la zona costera y de hasta 4,000 mm en la sierra y el caudal promedio del río es de 1,700 m3 por segundo (Benassini 1972, según March y Castro, 2010).
La cuenca del Usumacinta es una de las regiones con mayor biodiversidad en el mundo (March y Castro, 2010). En esta cuenca ocurren especies amenazadas como el manatí (Trichechus manatus), cocodrilos (Crocodylus acutus y C. moreletii), así como la tortuga blanca (Dermatemys mawii). Además se han registrado más de 30 especies de peces de importancia pesquera, así como crustáceos y reptiles (Cruz-Morales y Rodiles-Hernández, 1999; Inda-Díaz et al., 2009).
El periodo de muestreo comprendió de febrero a agosto de 2015. Debido a su gran extensión, la cuenca del Usumacinta fue dividida en 3 zonas focales para su estudio dentro del territorio mexicano: selva, lagunas y costa. La zona focal selva corresponde a la cuenca del río Lacantún y el río Usumacinta, caracterizada por su selva tropical media y alta (Cayuela, 2006), el principal tributario del Usumacinta en México es el río Lacantún y en esta zona se encuentran importantes áreas protegidas como Yaxchilán, Lacantún y la Reserva de la Biosfera de Montes Azules (Cruz-Morales y Rodiles-Hernández, 1999; Rodiles-Hernández y Cruz-Morales, 2004). Los sitios de muestreo incluyen a los municipios Marqués de Comillas, Benemérito de las Américas y Ocosingo. En esta zona fueron elegidas 3 localidades como puntos de muestreo: Benemérito de las Américas (una cooperativa), Frontera Corozal (informante clave-pesca de autoconsumo) y Zamora Pico de Oro (informante clave-pesca de autoconsumo) (Fig 1).
La zona focal lagunas incluye los municipios de Catazajá, La Libertad y Palenque en Chiapas; Emiliano Zapata, Balancán, Jonuta y Tenosique en Tabasco. Esta zona se caracteriza por el gran número de lagunas asociadas a la planicie de inundación del río Usumacinta y de importantes ríos tributarios como el río San Pedro en Balancán, Tabasco (Cano-Salgado et al., 2012), incluyendo 2 grandes sistemas, la laguna Chaschoc en el municipio de Emiliano Zapata, en Tabasco y el sistema lagunar de playas de Catazajá, en Chiapas (Rodiles-Hernández et al., 2013). En esta zona fueron designados 2 sitios de muestreo, uno en la Cooperativa San Pedro que opera en el río del mismo nombre y en la Cooperativa Tenosique que opera en el río Usumacinta (fig. 1).
La zona focal costa corresponde a la parte baja de la cuenca. Incluye los municipios de Palizada en Campeche y Centla en Tabasco y se caracteriza principalmente por su extensa zona de inundación, pantanos y humedales. La Reserva de la Biosfera Pantanos de Centla se encuentra en esta área (Vega, 2005). Esta región recibe todos los materiales y nutrientes que el río Usumacinta arrastra desde su origen en Guatemala y en su planicie costera, las especies extraídas pueden ser de hábitos dulceacuícolas o marinas, dependiendo de la época del año. En esta zona focal solo se estableció un sitio de muestreo en una cooperativa ubicada en Ribera alta tercera sección, en el municipio de Centla, Tabasco (fig. 1).
Debido a la extensión territorial del área de estudio se tuvo la necesidad de establecer una estrategia de muestreo basada en el conocimiento ecológico tradicional de los pobladores, especialmente de pescadores. Debido precisamente a la amplia experiencia y conocimientos heredados, los pescadores tienen un alto grado de certidumbre al momento de identificar especies, clasificar artes de pesca, embarcaciones y otros factores relacionados con la pesca (Berkes, 2003; García-Quijano, 2007; Haggan et al., 2007). Todas las personas contactadas para las actividades de recolecta de datos pesqueros fueron capacitadas en cada localidad. La capacitación incluyó el entrenamiento para las tareas específicas requeridas, como fueron el cotejo de la identificación de las especies más comunes durante las primeras etapas del muestreo, en este caso el conocimiento de los propios de los pescadores y una guía fotográfica fueron empleados y comparados con los organismos a ser identificados. La identificación de los recursos pesqueros se basó en claves taxonómicas de diferentes grupos. Para crustáceos se emplearon las claves taxonómicas de Contreras (1930), Felder (1973), Williams (1984) y Raz-Guzmán et al. (1992). La identificación de peces se basó en las claves de Weber (1991, 1992), Castro-Aguirre et al. (1999), Skelton (2001), Miller et al. (2005), Carpenter (2002) y Armbruster y Page (2006). Por último, se realizó una actualización de nombres válidos basada en Eschmeyer (2017). Los nombres comunes de las especies de peces se basaron en Page et al. (2013). Se realizó un listado de especies capturadas siendo clasificadas de acuerdo a su origen (nativas, introducidas y especies estuarino-dependientes). La clasificación de especies de peces fue realizada de acuerdo con Froese y Pauly (2017).
Otra parte de la capacitación incluyó demostrar cómo se toma la longitud total de crustáceos y peces en centímetros con cinta métrica. La LT se midió de la siguiente forma: en camarones palemónidos, desde la punta del rostro hasta al punta del telson; en portúnidos se midió el ancho del caparazón, de extremo a extremo de las espinas laterales, y finalmente en peces, desde el extremo anterior hasta el extremo posterior de la aleta caudal (Holden y Raitt, 1975). Finalmente a cada encuestador se le capacitó en el llenado de los formatos pesqueros. Adicionalmente a cada informante se le proporcionó una cámara fotográfica electrónica, para obtener fotos de las especies muestreadas, fotos que fueron útiles al momento de dudas con identificación de especies.
Otros datos registrados por los pescadores capacitados fueron tipo de embarcación y artes de pesca por viaje de pesca. Se recopilaron datos acerca de la composición de especies capturadas (nombre común) por viaje de pesca en peso total por especie en kilos y la longitud total (LT) de los individuos capturados en centímetros. Se solicitó a cada informante que los muestreos fueran lo más frecuente posible durante el periodo de muestreo y cada mes el equipo de investigadores visitó a cada uno de los informantes para recoger los datos colectados y verificar que todos los datos estuvieran siendo tomados correctamente.
Para analizar los datos, se decidió arbitrariamente no considerar dentro de los análisis la estacionalidad, pues durante el período de muestreo las condiciones fueron anómalas, siendo que el período de secas se extendió durante todo el periodo de muestreo. En periodos intensos de “El Niño” en Centroamérica y sur de México las condiciones ambientales tienden a ser secas con lluvias muy escasas (Curtis, 2013; Magaña et al., 1999; NOAA, 2015), factor que fue constatado durante el periodo de nuestra investigación (Servicio Meteorológico Nacional, 2017).
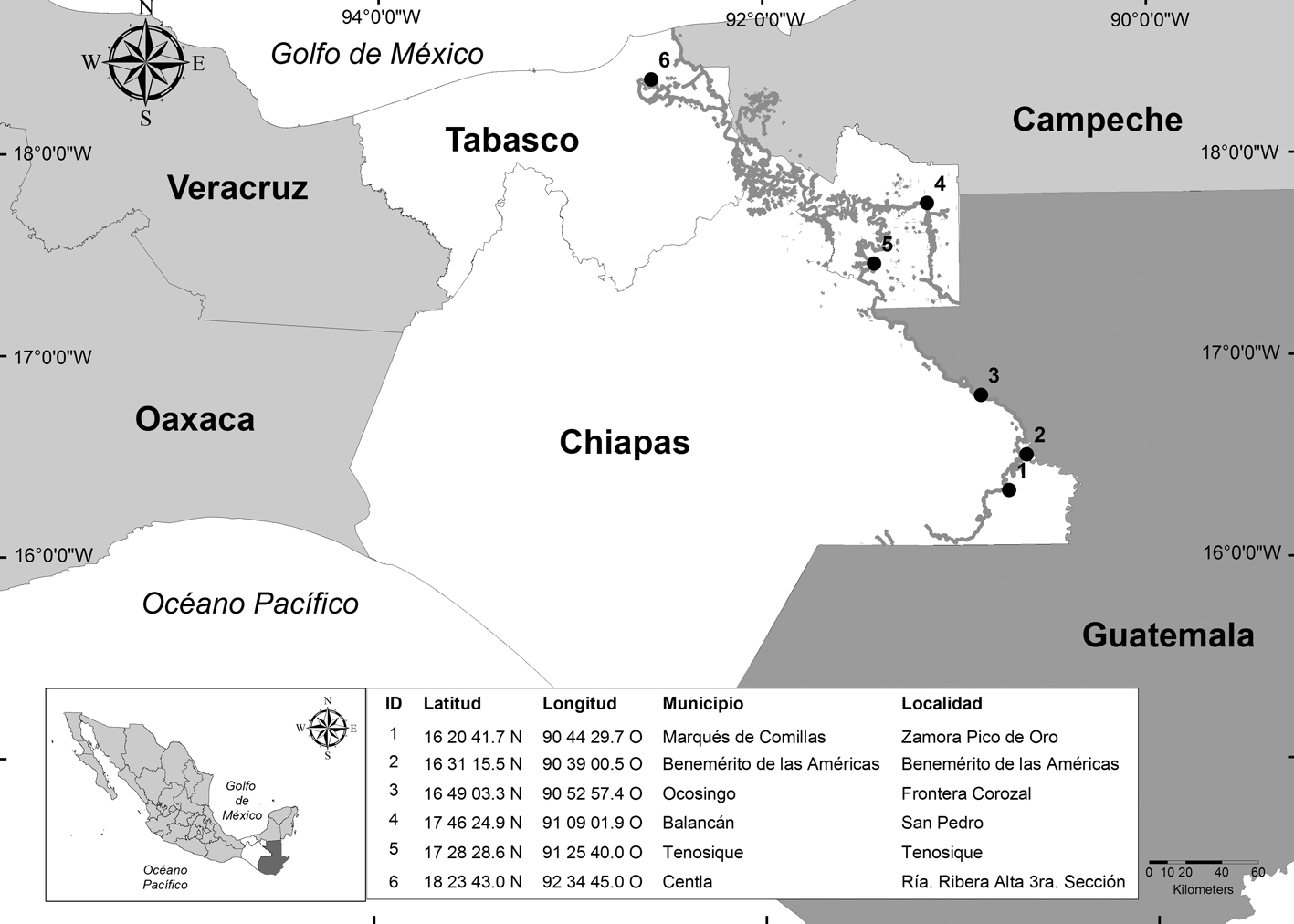
Con el fin de analizar la correlación entre los géneros de especies capturados y los diversos puntos de muestreo se realizó un análisis multidimensional (MDS) (Isaac et al., 2009; Lessa et al., 2009). Las diferencias entre ensambles de organismos acuáticos capturados por los pescadores de las diversas zonas se compararon con el índice de disimilitud de Bray-Curtis (Nijkamp y Rietveld, 1979; Renner y Huntington, 2014). La diversidad de las diferentes zonas focales fue analizada a través los perfiles de diversidad de Rényi, los cuales proveen información de riqueza y equitatividad en forma gráfica (Rényi, 1970; Rogers et al., 1999). La riqueza de especies es calculada elevando la base de logaritmo neperiano exponente al valor α0 (alfa cero). La proporción de especies dominantes se obtiene del inverso del logaritmo neperiano elevado al valor de αinf (alfa infinito) (Ricotta, 2003).
El análisis de la frecuencia y correlación entre las principales especies de peces por arte de pesca y por localidad fue realizado por medio de una gráfica de mosaico (Hornik et al., 2006). En una gráfica de mosaico, los cuadrantes están relacionados con la importancia relativa de los factores cruzados incluidos en el análisis y la longitud de los lados de cada cuadrado, está relacionado con la importancia relativa de cada factor independiente (Friendly, 1994, 2013).
Cabe mencionar que la información acerca del esfuerzo de pesca como: el tiempo efectivo, tamaño, y el número preciso de artes de pesca, no se determinó con exactitud y en la mayoría de los casos, se carecía de dicha información. Por esta situación se decidió que la tasa de captura fuera determinada en kilos por viaje de pesca, expresado en media ± desviación estándar (Mendoza-Carranza et al., 2013). Para el análisis de las tasas de captura, se realizaron análisis en gráficos de caja (boxplot) por cada zona focal.
Resultados
En la pesca de la cuenca del Usumacinta, existen 2 tipos de embarcaciones: a) los cayucos, embarcaciones tradicionalmente hechas de madera, pero ahora hechas de fibra de vidrio, pequeñas, de longitud máxima de 6 m y muy estrechas, b) las lanchas que son las típicas comerciales de fibra de vidrio de 23 (7.0 m) pies de eslora. Existe una mayor proporción de uso de cayucos (88%) que de lanchas (12%). Resaltando la localidad de Zamora Pico de Oro (selva) donde se emplean únicamente cayucos de madera de 6 m de longitud y San Pedro, Balancán (lagunas), donde solamente se usan lanchas de fibra de vidrio de 7 m de longitud. Con respecto al número de viajes de pesca monitoreados y que tiene que ver con la intensidad de pesca, el mayor número se observó en la localidad de San Pedro, Balancán (n = 248) y el menor número de viajes de pesca se observó en la localidad de Frontera Corozal (n = 59).
En la cuenca del río Usumacinta, el 67% de los pescadores emplearon redes agalleras. El anzuelo con línea de mano ocupa el segundo lugar de las artes de pesca más usadas con 15%. En menor porcentaje se emplea una combinación de diferentes artes de pesca como son: lienza (línea de mano), pistola (arpón comercial de ligas), atarraya, fisga (tridente que se coloca al final del remo), arpón (arpón de mano hecho con una vara de madera y 2 puntas metálicas), chinchorro y nasa (14%); red agallera, atarraya, pistola, anzuelo y lienza (3%) y por último, anzuelo, atarraya y arpón (1%).
La longitud promedio de las redes agalleras fue de 91 m, con un máximo de 300 m y un mínimo de 2 m. En la localidad de Benemérito de las Américas se registraron las redes de mayor tamaño, obteniendo un promedio de 140 m de longitud, con un máximo de 300 m y un mínimo de 5 m. En la localidad Frontera Corozal se registraron las redes de menor extensión, con un promedio de 12 m de longitud, un máximo de 40 m y un mínimo de 2 m. En lo que respecta al tamaño de luz de malla (malla extendida), el promedio general para la cuenca es de 10 cm, con un máximo de 20 cm y un mínimo de 5 cm. En Tenosique se registraron las redes con la luz de malla más grande (11.25 y 15cm), con un mínimo de 5 cm; en Ribera Alta se registró un tamaño de luz de malla de 7.5 cm.
En la cuenca Usumacinta se explotan 3 especies de crustáceos en la pesca, la jaiba Callinectes similis en la parte baja de la cuenca y los langostinos Macrobrachium carcinus y Macrobrachium acanthurus, ambos a todo lo largo del río Usumacinta, siendo especialmente abundante durante el periodo de muestreo M. carcinus (2.74 ± 4.70 kg/ viaje de pesca) en las capturas en Tenosique y Balancán de la zona focal lagunas (tabla 1).
En relación a la riqueza de especies de peces explotada en la cuenca, se registró un total de 35 a lo largo del Usumacinta. La familia con mayor riqueza de especies fue Cichlidae contabilizando 10, de las cuales 2 son introducidas (O. niloticus y P. managuensis). La segunda familia con más especies fue Ariidae con 4. De las 3 especies con mayores tasas de capturas, 2 son especies introducidas: el bobo escama (C. idella) con 44.79 ± 91.69 kg/ viaje de pesca), la carpa común (C. carpio) con 23.68 ± 21.35 kg/ viaje de pesca y una nativa, el robalo prieto (Centropomus poeyi) con 17.0 ± 5.5 kg/ viaje de pesca (tabla 1). Las demás especies no sobrepasan la decena de kilos por viaje de pesca (tabla 1).
En total se identificaron 6 especies introducidas, 6 especies de carpas (Cyprinidae), 1 especie de loricárido (Loricariidae) y 2 especies de mojarras (Cichlidae, tabla 1). La mayoría de las especies fueron registradas en todas las comunidades muestreadas.
Tabla 1
Especies de crustáceos y de peces de importancia comercial capturados por pescadores de la cuenca del Usumacinta, México. Localidad de presencia: Z = Zamora Pico de Oro, Marqués de Comillas, Chiapas, zona focal selva; B = Benemérito de las Américas, Chiapas, zona focal selva; F = Frontera Corozal, Ocosingo, Chiapas; T =Tenosique, Tabasco, zona focal lagunas; S = San Pedro, Balancán, Tabasco, zona focal costa; R = Rivera Alta, Centla, Tabasco. Tasa de captura (media ± desviación estándar). ND = no determinado.
|
Tabla 1 Continuación. |
||||||
|
Clase/familia |
Nombre científico |
Nombre común |
Hábitat* |
Origen |
Zona focal de presencia |
Tasa de captura (kg/evento de pesca) |
|
Clase/familia |
Nombre científico |
Nombre común |
Hábitat* |
Origen |
Zona focal de presencia |
Tasa de captura (kg/evento de pesca) |
|
Malacostraca |
||||||
|
Portunidae |
Callinectes similis |
Jaiba |
Agua salobre |
Nativa |
R |
ND |
|
Palaemonidae |
Macrobrachium acanthurus |
Acamaya |
Agua dulce/salobre |
Nativa |
R, T |
0.57 ± 0.38 |
|
Macrobrachium carcinus |
Pigua |
Agua dulce/salobre |
Nativa |
F, T |
2.74 ± 4.70 |
|
|
Osteichthyes |
||||||
|
Lepisosteidae |
Atractosteus tropicus |
Pejelagarto |
Agua dulce |
Nativa |
Z, S, T, R |
4.09 ± 3.11 |
|
Megalopidae |
Megalops atlanticus |
Sábalo |
Agua dulce/salobre/marina |
Nativa |
Z, F, T |
7.31 ± 4.85 |
|
Clupeidae |
Dorosoma anale |
Arenga |
Agua dulce |
Nativa |
Z |
0.85 ± 0.77 |
|
Cyprinidae |
Ctenopharyngodon idella |
Bobo escama |
Agua dulce |
Introducida (Asia) |
Z, B, T, R |
44.79 ± 91.69 |
|
Cyprinus carpio |
Carpa común |
Agua dulce/salobre |
Introducida (Asia) |
Z, B, T |
23.68 ± 21.35 |
|
|
Carassius auratus |
Carpa dorada |
Agua dulce |
Introducida (Asia) |
F, S, T |
6.20 ± 6.57 |
|
|
Catostomidae |
Ictiobus meridionalis |
Chopa, pejepuerco |
Agua dulce |
Nativa |
Z, T |
4.67 ± 3.05 |
|
Characidae |
Brycon guatemalensis |
Macabí |
Agua dulce |
Nativa |
Z, B, F, |
8.51 ± 11.77 |
|
Loricariidae |
Pterygoplichthys spp. |
Plecos |
Agua dulce |
Introducida (Sudamérica) |
Z, F, B, S, T, R |
6.17 ± 6.52 |
|
Ictaluridae |
Ictalurus meridionalis |
Bobo liso |
Agua dulce |
Nativa |
Z, F, S, T |
4.77 ± 6.01 |
|
Ariidae |
Ariopsis felis |
Curuco |
Agua dulce/salobre |
Nativa |
Z, F, T, |
ND |
|
Cathorops aguadulce |
Curuco |
Agua dulce/salobre |
Nativa |
Z, F, T, |
1.98 ± 1.86 |
|
|
Bagre marinus |
Bandera |
Agua marina/salobre/dulce |
Nativa |
R |
ND |
|
|
Potamarius nelsoni |
Cabeza de fierro |
Agua dulce |
Nativa |
Z |
1.81 ± 1.64 |
|
|
Heptapteridae |
Rhamdia guatemalensis |
Juil |
Agua dulce |
Nativa |
Z |
0.50 ± 0.00 |
|
Centropomidae |
Centropomus poeyi |
Robalo prieto/machín |
Agua dulce/salobre/marina |
Nativa |
T, R |
17.00 ± 5.50 |
|
Centropomus parallelus |
Chucumite |
Agua dulce/salobre/marina |
Nativa |
R |
ND |
|
|
Centropomus undecimalis |
Robalo blanco |
Agua dulce/salobre/marina |
Nativa |
Z, B, S, T, R |
5.30 ± 5.53 |
|
|
Gerreidae |
Eugerres mexicanus |
Mojarra blanca |
Agua dulce |
Nativa |
Z, T |
2.29 ± 2.66 |
|
Sciaenidae |
Aplodinotus grunniens |
Roncador, topuche |
Agua dulce |
Nativa |
F, S, T |
6.20 ± 8.99 |
|
Carangidae |
Caranx hippos |
Jurel |
Agua dulce/salobre/marina |
Nativa |
R |
ND |
|
Mugilidae |
Mugil cephalus |
Lisa |
Agua dulce/salobre/marina |
Nativa |
Z |
3.10 ± 1.75 |
|
Mugil curema |
Liseta |
Agua dulce/salobre/marina |
Nativa |
Z |
3.03 ± 2.66 |
|
|
Cichlidae |
Mayaheros urophthalmus |
Mojarra castarrica |
Agua dulce/salobre/marina |
Nativa |
Z, S, R |
4.99 ± 11.29 |
|
Cincelichthys pearsei |
Mojarra zacatera |
Agua dulce/salobre |
Nativa |
Z, F, B, S, T |
1.80 ± 3.43 |
|
|
Parachromis managuensis |
Mojarra pinta |
Agua dulce |
Introducida (Centroamérica) |
Z, F, S, R |
3.16 ± 2.31 |
|
|
Maskaheros argenteus |
Mojarra pozolera |
Agua dulce |
Nativa |
Z, F |
0.48 ± 0.37 |
|
|
Vieja bifasciata |
Mojarra colorada |
Agua dulce |
Nativa |
Z, F, S, T, R |
1.69 ± 3.37 |
|
|
Vieja melanura |
Mojarra paleta |
Agua dulce |
Nativa |
Z, F, S, T, R |
ND |
|
|
Petenia splendida |
Mojarra tenguayaca |
Agua dulce |
Nativa |
Z, F, S, T, R |
4.02 ± 5.18 |
|
|
Oscura heterospila |
Mojarra de montecristo |
Agua dulce |
Nativa |
Z, F, S, T, R |
ND |
|
|
Oreochromis niloticus |
Tilapia, carpa |
Agua dulce |
Introducida (África) |
Z, F, B, S, T, R |
5.52 ± 2.26 |
|
|
Eleotridae |
Gobiomorus dormitor |
Guabina |
Agua dulce/salobre/marina |
Nativa |
Z, B, F, S, T |
1.52 ± 2.06 |
*Clasificación basada en Froese y Pauly (2017).
Es importante resaltar la presencia de especies que dependen de las zonas estuarinas y marinas para completar su ciclo de vida, como son los robalos (Centropomidae) y el sábalo (Megalopidae), las cuales se capturan a todo lo largo del río Usumacinta y alcanzan áreas muy alejadas de la costa en la zona focal selva (tabla 1). Otras especies estuarino-dependientes que fueron reportadas en la zona focal selva fueron las lisas (Mugilidae, tabla 1) y crustáceos estuarino-dependientes del género Macrobrachium (tabla 1).
Los gráficos de Rényi (Fig. 2) indican que la mayor riqueza de especies fue es observada en las comunidades de Zamora Pico de Oro (α0 = 3.13 = 23), Tenosique y en Frontera Corozal (α0 = 2.89 = 18, α0 = 2.83 = 18 respectivamente). La comunidad pesquera con menor diversidad fue Benemérito de las Américas (α0 = 1.94 = 7). Las localidades con la mayor proporción de especies dominantes y menor equitatividad (α inf) fueron Benemérito de las Américas (0.57) y Zamora Pico de Oro (0.32), por el contrario Tenosique obtuvo la mayor equitatividad y menor proporción de especies dominantes (0.10), esto se ve reflejado en las curvas generadas por el análisis, donde la curva de Tenosique es la que mayor asíntota alcanza (fig. 2).
El índice de disimilitud de Bray-Curtis refleja las tendencias del MDS, siendo que la localidad que presentó mayores diferencias con las demás fue Benémerito de la Américas con un mínimo de 0.52 con Tenosique y un máximo de 0.66 con Frontera Corozal. En los demás casos el índice de disimilitud no sobrepasaron el valor de 0.55 (tabla 2).
El análisis multidimensional explicó 77% de la variabilidad de los datos (45% eje 1 y 32% eje 2). En el gráfico se observa una separación clara entre Benemérito de las Américas (BAM) con el resto de los sitios muestreados (fig. 3). Esta localidad está asociada a la captura de 2 especies de carpas C. idella (CTEIDE) y C. carpio (CYPCAR), así como con el macabí Brycon guatemalensis (BRYGUA) y con la guabina Gobiomorus dormitor (GOBDOR). Del lado contrario del gráfico se ubican Zamora Pico de Oro (ZAP), en la parte superior y Frontera Corozal (FCO) en la parte baja (fig. 3). Para Zamora Pico de Oro, las especies de peces que se asocian cercanamente son: Ictiobus meridionalis y las 2 especies de lisas (Mugil curema y M. cephalus). En el caso de la pesca en Frontera Corozal las especies que más la identifican son: el topuche Aplodinotus grunniens (APLGRU), el bagre Potamarius nelsoni (POTNEL) y la mojarra pozolera Maskaheros argenteus (MASARG). En la parte superior de gráfico se encuentra ubicado Ribera alta de la zona focal costa (RAL) y en la cual la pesca se encuentra asociada a diversas especies entre ellas, el pegelagarto Atractosteus tropicus (ATRTRO), la mojarra pinta P. managuensis (PARMAN), el sábalo Megalops atlanticus (MEGATL) (fig. 3). La mojarra tilapia O. niloticus (ORENIL) que se pesca en todos los locales analizados, se relaciona más fuertemente a las zonas focales lagunas y costa (fig. 3).
Para el análisis de la relación de la diversidad de especies con las artes de pesca empleadas en las 3 diferentes zonas focales, se emplearon gráficas de mosaico. Para la zona focal selva, se observa que la especie que alcanzó las mayores capturas totales es la carpa herbívora (C. idella), lo cual se relacionan en forma significativa con la red agallera (fig. 4). Le siguen en importancia el robalo (Centropomus undecimalis) y el macabí (B. guatemalensis) pero con muy bajas proporciones, ambas asociadas principalmente al uso de la red agallera (fig. 4). En la zona focal lagunas, también la red agallera fue el arte de pesca asociada con las mayores capturas de todas las especies (fig. 4). En el caso de la zona focal lagunas las 3 especies más importantes fueron: el robalo C. undecimalis, la mojarra tilapia O. niloticus y la carpa herbívora C. idella (fig. 5). En la zona focal costa, el anzuelo fue el arte de pesca que se asoció con las mayores capturas en casi todas las especies. En este caso las especies guardan una proporción de sus capturas totales muy similar entre ellas. Las 3 más importantes fueron: el pejelagarto A. tropicus, la mojarra tenguayaca Petenia splendida y la mojarra introducida P. managuensis (fig. 6).
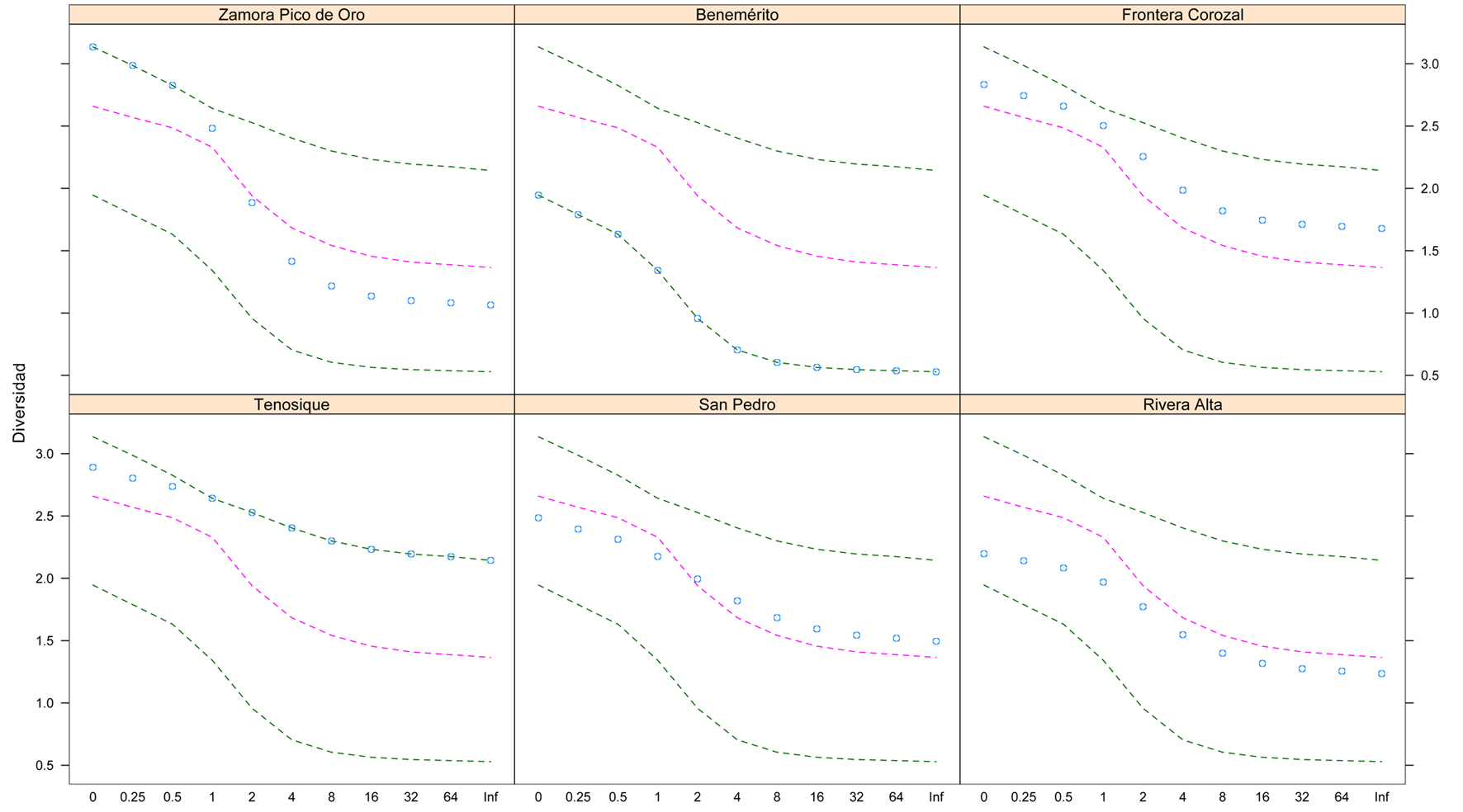
Tabla 2
Índice de disimilitud de Bray-Curtis entre los diferentes puntos de muestreo del río Usumacinta. FCO = Frontera Corozal (selva), BAM = Benemérito de las Américas (selva), SPB = San Pedro Balancán (lagunas), TEN = Tenosique (lagunas) y RAL = Ribera alta (costa).
|
BAM |
FCO |
RAL |
SPB |
TEN |
|
|
FCO |
0.66 |
||||
|
RAL |
0.62 |
0.53 |
|||
|
SPB |
0.57 |
0.37 |
0.23 |
||
|
TEN |
0.52 |
0.37 |
0.55 |
0.33 |
|
|
ZAP |
0.60 |
0.30 |
0.43 |
0.37 |
0.36 |
Respecto a las tallas promedio de peces capturados en la zona focal costa, la especie con la menor LT promedio fue Mayaheros urophthalmus (18.76 ± 4.31 cm LT) y las mayores LT fueron observadas en el sábalo M. atlanticus (91.35 ± 15.15 cm LT) y el robalo C. undecimalis (67.00 ± 1.00 cm LT, tabla 3). Para la zona focal lagunas, las especies con menor LT fueron: la mojarra blanca (Eugerres mexicanus) y las mojarras M. urophthalmus, Vieja bifasciata, Vieja melanura y Oscura heterospila, que tuvieron un promedio entre 21 y 22 cm LT (tabla 3); las especies con mayor LT fueron C. undecimalis (63.94 ± 17.06 cm LT) y C. poeyi (74.72 ± 11.03, Tabla 3). Para la zona focal selva, las especies con menor LT fueron los cíclidos variando de un mínimo de 21.15 ± 3.05 cm LT en O. heterospila a un máximo del LT de 28.17 ± 5.44 cm LT en M. urophthalmus (tabla 3); las mayores LT fueron observadas en I. meridionalis con 82.53 ± 19.41 cm LT (tabla 3).
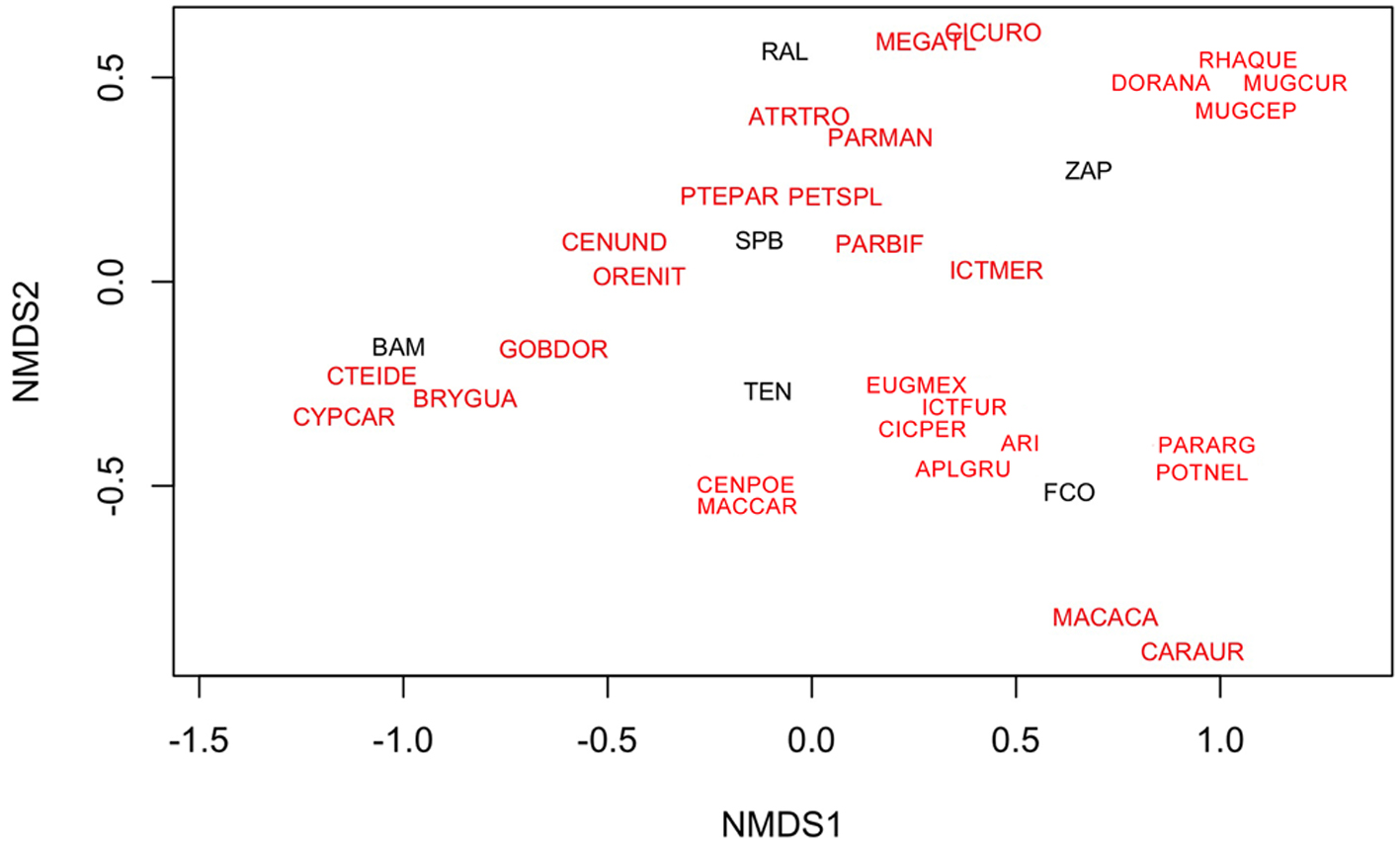
Tabla 3
Longitud total (media ± desviación estándar o mínimo – máximo en centímetros) de las especies capturadas por zona focal en la pesca en la cuenca del río Usumacinta, México.
|
Nombre científico |
Costa |
Lagunas |
Selva |
|
Malascotraca |
|||
|
Callinectes similis |
15.00 – 20.00 |
||
|
Macrobrachium acanthurus |
24.27 ± 4.69 |
||
|
Macrobrachium carcinus |
25.75 ± 3.60 |
||
|
Osteichthyes |
|||
|
Atractosteus tropicus |
56.62 ± 12.10 |
54.89 ± 9.28 |
65.00 ± 12.22 |
|
Megalops atlanticus |
91.35 ± 15.15 |
76.23 ± 21.16 |
|
|
Dorosoma anale |
21.88 ± 12.40 |
||
|
Ctenopharyngodon idella |
68.03 ± 9.77 |
61.40 ± 11.49 |
|
|
Cyprinus carpio |
50.00 ± 5.97 |
42.87 ± 6.13 |
|
|
Carassius auratus |
30.00 – 40.00 |
30.00 – 40.00 |
|
|
Ictiobus meridionalis |
51.00 ± 6.73 |
82.53 ± 19.41 |
|
|
Brycon guatemalensis |
41.55 ± 14.28 |
||
|
Pterygoplichthys spp. |
20.00 – 30.00 |
20.00 – 30.00 |
33.37 ± 5.34 |
|
Ictalurus meridionalis |
45.62 ± 40.38 |
16.31 ± 13.60 |
|
|
Ariopsis felis |
61.2 ± 16.93 |
36.31 ± 7.10 |
|
|
Cathorops aguadulce |
22.80 ± 0.44 |
||
|
Bagre marinus |
30 .00 – 35.00 |
30.00- 35.00 |
|
|
Potamarius nelsoni |
23.66 ± 6.35 |
||
|
Rhamdia guatemalensis |
25.00 ± 11.31 |
||
|
Centropomus poeyi |
74.72 ± 11.03 |
||
|
Centropomus parallelus |
|||
|
Centropomus undecimalis |
67.00 ± 1.00 |
63.94 ± 17.06 |
80.07 ± 22.02 |
|
Eugerres mexicanus |
22.25 ± 1.82 |
24.45 ± 3.27 |
|
|
Aplodinotus grunniens |
31.35 ± 3.18 |
27.37 ± 4.46 |
|
|
Caranx hippos |
30.00 – 40.00 |
||
|
Mugil cephalus |
62.60 ± 8.23 |
||
|
Mugil curema |
46.25 ± 11.14 |
||
|
Mayaheros urophthalmus |
18.76 ± 4.31 |
22.00 ± 1.03 |
28.17 ± 5.44 |
|
Cincelichthys pearsei |
23.84 ± 2.21 |
27.24 ± 3.81 |
|
|
Parachromis managuensis |
23.29 ± 3.87 |
27.82 ± 3.91 |
27.02 ± 5.25 |
|
Maskaheros argenteus |
25.99 ± 4.19 |
||
|
Vieja bifasciata |
27.80 ± 1.97 |
22.87 ± 2.23 |
22.62 ± 4.81 |
|
Vieja melanura |
24.70 ± 1.13 |
23.71 ± 3.19 |
21.53 ± 4.52 |
|
Petenia splendida |
29.29 ± 3.89 |
30.81 ± 7.60 |
|
|
Oscura heterospila |
27.80 ± 1.97 |
21.78 ± 1.10 |
21.15 ± 3.05 |
|
Oreochromis niloticus |
29.27 ± 2.45 |
27.65 ± 4.47 |
26.80 ± 5.04 |
|
Gobiomorus dormitor |
40.41 ± 6.44 |
36.70 ± 10.80 |
Discusión
Los estudios sobre la ictiofauna y otros recursos pesqueros sometidos a explotación en la cuenca del río Usumacinta forman un mosaico de especies que en su totalidad muestran la riqueza de recursos pesqueros de este sistema hidrológico, pero que se han llevado a cabo de manera diferida espacial y temporalmente. La riqueza de especies reportada en este trabajo representa únicamente el 61% de las especies de importancia comercial que se explotan en la cuenca del río Usumacinta. Sin embargo, es el primer trabajo que estudia de manera conjunta las principales zonas de dicha cuenca a lo largo de un amplio gradiente.
Para la zona focal selva, destacan los estudios de Inda-Díaz et al. (2009) y Rodiles-Hernández et al. (1999), quienes reportaron un total de 20 y 22 especies de peces de importancia comercial, respectivamente (incluida una especie de crustáceo). Para la zona focal lagunas, Castillo-Domínguez et al. (2011) y Cruz-Morales y Rodiles-Hernández (1999) reportan un total de 22 y 14 especies de importancia comercial, respectivamente. Por último, para la zona focal costa, destacan los estudios de Barba et al. (2010) y Montalvo-Urgel et al. (2010) quienes reportaron una especie de crustáceo de importancia comercial y Arévalo-Frías y Mendoza-Carranza (2012) y Mendoza-Carranza et al. (2013), que reportaron un total de 37 y 16 especies de peces de importancia comercial, respectivamente.
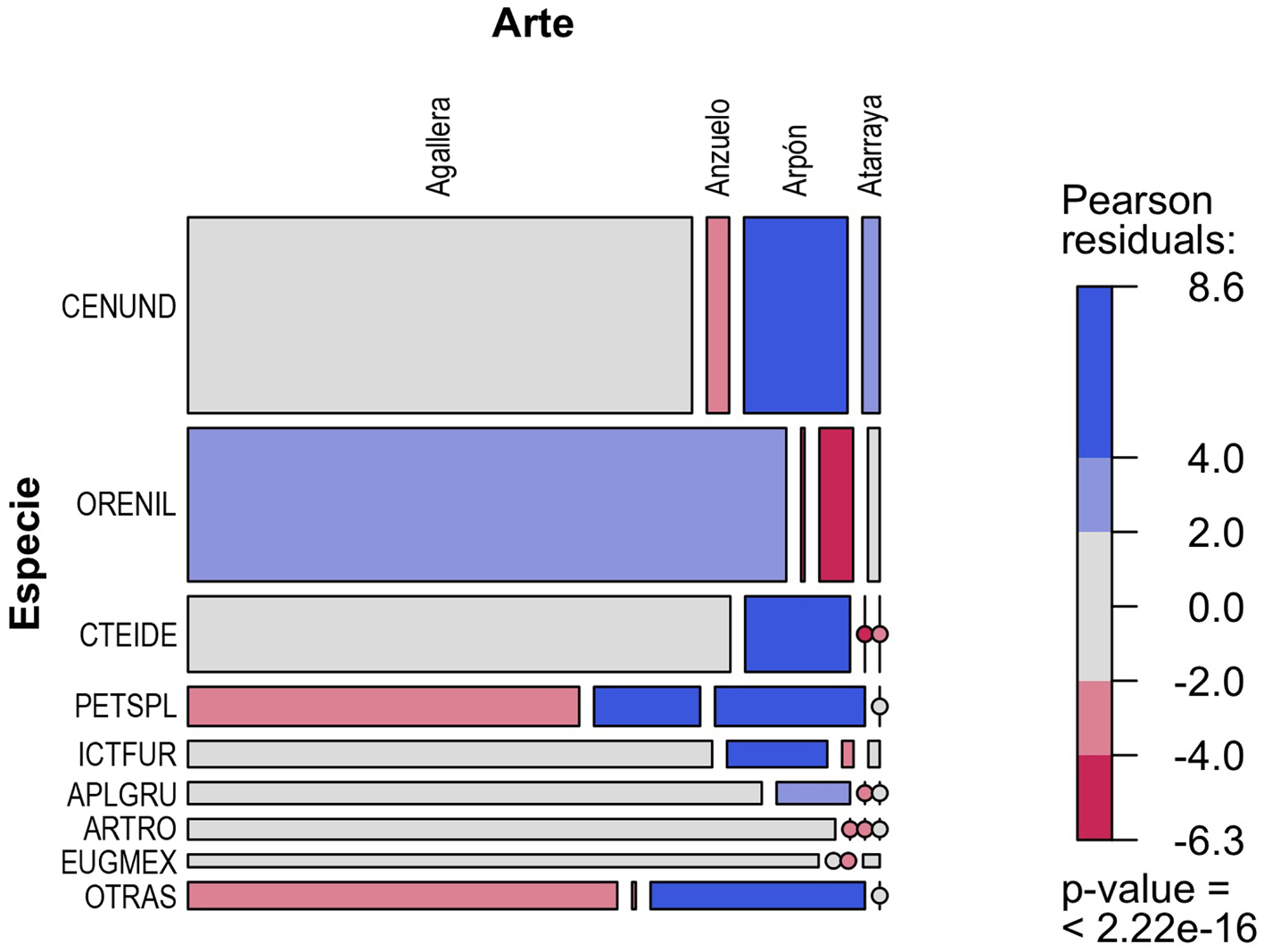
Respecto a los crustáceos, presentaron una baja importancia pesquera en toda la cuenca respecto a los peces, pero cobran relevancia en dirección a la cuenca baja. Para la cuenca alta se ha reportado la captura de camarones del género Macrobrachium y de cangrejos del género Gecarcinus, como ya fue mencionado, éstos con muy baja importancia (Inda-Díaz et al., 2009). En el caso de la cuenca media del Usumacinta la especie de crustáceo más valorada en la cuenca media, especialmente en Tenosique, es el langostino M. carcinus (Benítez-Mandujano y Ponce-Palafox, 2012). Finalmente, en la cuenca baja y especialmente en la Reserva de la Biosfera Pantanos de Centla, las especies de crustáceos de mayor importancia son las jaibas del género Callinectes y el camarón de río M. acanthurus (Mendoza-Carranza et al., 2013).
La disparidad existente entre el número de especies registrado en el presente estudio y el número de especies reportado para toda la cuenca Usumacinta puede atribuirse, principalmente, a los diferentes métodos empleados para la recolecta de datos y al tiempo de muestreo empleado en cada uno de los estudios, este contraste de métodos es mayor entre los trabajos ecológicos (Arévalo-Frías y Mendoza-Carranza, 2012; Castillo-Domínguez et al., 2011; Gaspar-Dillanes, 1996; Rodiles-Hernández et al., 1999) y pesqueros (Inda-Díaz et al., 2009; Mendoza-Carranza et al., 2013). De igual forma, la temporalidad con la que se capturan los diferentes recursos pesqueros de la cuenca influye también en la presencia o ausencia de especies en los distintos periodos muestreados.
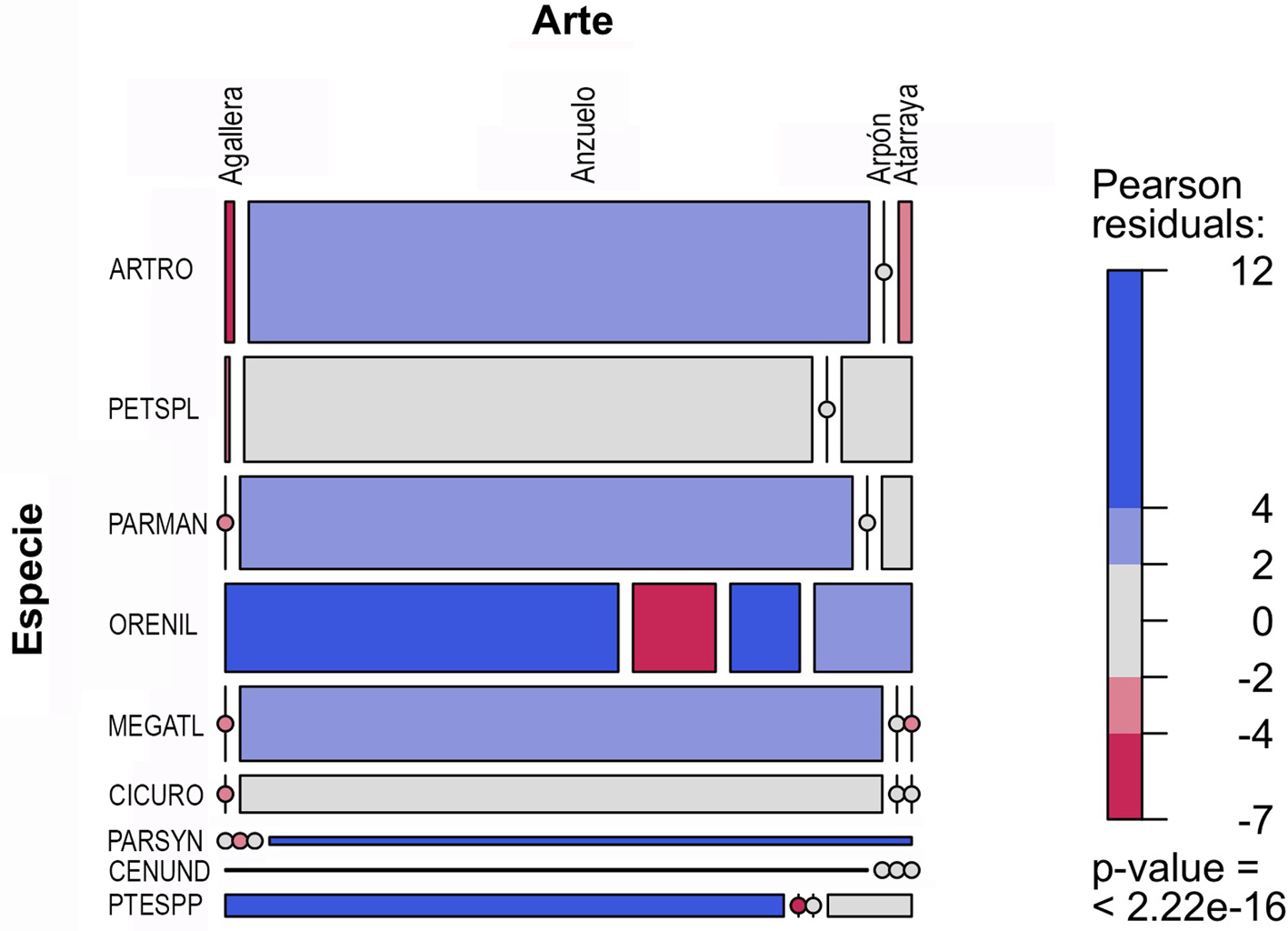
La actividad pesquera a lo largo de la cuenca muestra un gradiente longitudinal en cuanto a su importancia económica y social, presentando su mayor contraste entre la zona foca selva contra la zonas focales lagunas y costa. En la zona focal selva, el objetivo principal de la pesca es el autoconsumo y se lleva a cabo de manera poco tecnificada, siendo esta práctica una fuente fundamental de proteína animal de las poblaciones locales, mientras que en la zonas focales laguna y costa, la actividad se realiza principalmente con fines comerciales, y las embarcaciones, artes y técnicas de pesca presentan un mayor grado de tecnificación. Estos patrones de la actividad pesquera se mantienen en concordancia con lo reportado por Inda-Díaz et al. (2009) y Mendoza-Carranza et al. (2013) para las zonas antes mencionadas. Sin embargo, el reciente establecimiento de la Sociedad Cooperativa de Producción Pesquera Nueva Esperanza de Benemérito de las Américas, Ocosingo (zona focal selva), es un indicador de cambio en las prácticas pesqueras del autoconsumo a la comercialización de los recursos pesqueros de la zona.
La riqueza de recursos pesqueros en la cuenca del Usumacinta se ha visto modificada por la introducción de especies exóticas. De las 35 especies registradas en este trabajo, 6 son especies invasoras, de las cuales, 3 han sido introducidas para acuicultura: la tilapia (O. niloticus), la mojarra pinta (P. managuensis) y la carpa común (C. carpio), 2 para acuariofilia (Carassius auratus y Pterygoplichthys spp.) y la carpa herbívora (C. idella) para control biológico (Amador-del Ángel y Wakida-Kusunoki, 2014; Espinosa-Perez y Ramírez, 2015; Valdez-Moreno et al., 2005). La introducción de estas especies ha modificado la comunidad íctica a nivel regional, así como el aprovechamiento de los recursos pesqueros, como indican nuestros resultados donde se observa la importancia actual que tienen las especies introducidas en la pesca.
Los grandes volúmenes con los que se capturan especies como la tilapia, la mojarra pinta y la carpa herbívora, han impactado positivamente la economía de los pescadores, ya que aunque no tengan un alto valor comercial, representan un buen ingreso para sus familias debido a que se capturan con mayor frecuencia y abundancia que las especies de mayor valor comercial, como el robalo. Así mismo, estas especies han modificado los patrones de alimentación de las comunidades aledañas, el sabor de estas especies no es tan agradable comparado con especies de alto valor comercial, como el robalo o la mojarra tenguayaca, pero constituyen una fuente de proteína animal asequible para el grueso de la población por el valor económico con el que se comercializan.
Al igual que las otras especies introducidas, los plecos (Pterygoplichthys spp.) han tenido una rápida expansión a lo largo de la cuenca del río Usumacinta (Amador-del Ángel y Wakida-Kusunoki, 2014; Wakida- Kusunoki et al., 2007). Sin embargo, estas especies no tienen actualmente importancia comercial en la región, pero sí un impacto ecológico y social en las pesquerías de la cuenca. Entre los principales impactos negativos de los plecos, se pueden mencionar: el daño e interferencia en las artes de pesca, la reducción de las capturas y la contaminación biológica (Amador-del Ángel y Wakida-Kusunoki, 2014).
A pesar de los cambios ecológicos provocados por las actividades antropogénicas e introducción de especies, la función de la cuenca Usumacinta como corredor biológico aún se mantiene, permitiendo la conectividad entre los diferentes ambientes acuáticos que existen y la riqueza de especies que allí se presenta; tal conectividad es relevante para especies acuáticas migratorias. En este trabajo se registraron 8 especies que presentan algún grado de dependencia con zonas marinas y estuarinas (tabla 1). De estas 8 especies, destacan 3 especies del género Centropomus y el sábalo (M. atlanticus), cuyos casos requieren especial atención. El robalo blanco (C. undecimalis), el robalo prieto (C. poeyi) y el chucumite (C. parallelus) constituyen los recursos pesqueros de mayor importancia comercial en la región, capturándose a lo largo de la cuenca del Usumacinta. Estas especies dependen de las zonas costeras para su reproducción, de las zonas estuarinas para su desarrollo y posteriormente, migran río arriba hasta alcanzar la madurez y retornar a las zonas marino-estuarinas para desovar (Perera-García et al., 2011). Por otra parte, el sábalo (M. atlanticus) desova en mar abierto, las larvas inician su metamorfosis en la zona costera, los juveniles habitan en canales, arroyos y manglares, y en su etapa adulta habitan en zonas costeras (Vega-Rodríguez y Ayala-Pérez, 2014); en este estudio es importante haber reportado su presencia en la zona focal selva y lagunas. Esta especie se encuentra clasificada como vulnerable y sus poblaciones en declive de acuerdo con la Lista Roja de Especies Amenazadas de la IUCN (Adams et al., 2012), por lo que mantener la conectividad del río es imprescindible para la sobrevivencia de dichas especies.
La riqueza biológica asociada al corredor biológico sustentado por el río Usumacinta representa un alto valor ecológico toda vez que este continuo provee flujos energéticos que mantienen y potencian la biodiversidad (Álvarez-Icaza y Rosas, 2010) . Este sistema hidrológico ha sido clave para el establecimiento y sustento de diversas civilizaciones y poblaciones asentadas a lo largo de su cauce (Lobato, 1988). Desafortunadamente, el mismo crecimiento poblacional humano y que en últimas décadas ha conllevado un cambio drástico en las condiciones de la cuenca, ha producido una disminución de los servicios ambientales que este río presta, entre ellos la pesca (Álvarez-Icaza y Rosas, 2010). Este recurso representa una fuente relevante de proteínas para los pobladores así como de reservas económicas. La introducción de especies exóticas está alterando severamente la dinámica ecológica y ambiental de la cuenca, afectando también las prácticas y costumbres de las poblaciones humanas que dependen de dichos recursos.
A pesar de esta pérdida en la calidad del hábitat y de acuerdo a nuestros resultados, podemos concluir que la diversidad de peces es importante para la pesca y el sostenimiento de las poblaciones humanas asentadas a los largo del río Usumacinta. Por otra parte, las especies exóticas, a pesar de ser una amenaza para el ecosistema, paradójicamente se han convertido en un recurso pesquero económico de importancia en toda la cuenca, especialmente la tilapia y las diversas especies de carpas. En relación a los cambios tanto en diversidad de especies como en volumen de captura, se observa un incremento de diversidad en sentido cuenca abajo, esto relacionado principalmente con 2 factores , el cambio de especies y su abundancia, debido a la cercanía con la zona marino y estuarina , y también con relación a los modos de pesca. En la cuenca alta, la pesca es casi por completo para sustento y la abundancia de los recursos baja, en contraste con la cuenca baja, donde la pesca es de tipo comercial casi en su totalidad y la abundancia de las especies es alta.
Un aporte adicional de este trabajo es resaltar la presencia de especies con alta capacidad migratoria a lo largo del río como los robalos, el sábalo y las lisas, ya que es un indicativo de la conectividad que posee el río Usumacinta. Estas especies tienen una alta importancia ecológica y comercial, además de servir como puente energético entre los diversos ambientes distribuidos a lo largo del río. Por lo anterior, es urgente y necesario realizar estudios que evalúen la condición ecológica del río Usumacinta a fin de conservar los recursos pesqueros que proveen sustento a gran parte de la población.
Agradecimientos
Al apoyo financiero de la Comisión Federal de Electricidad. Para la colecta de datos y entrevistas, recibimos el apoyo de Antonio Echevarría Canto, Benito Velasco Álvaro, Antonio Nahuat Nahuat, Jesús Antonio García García y Guadalupe Romero Argüelles. Rocío Rodiles agradece al Conacyt por el estímulo otorgado.
Referencias
Adams, A., Guindon, K., Horodysky, A., MacDonald, T., McBride, R., Shenker, J. et al. (2012). Megalops atlanticus. The IUCN Red List of Threatened Species 2012: e.T191823A2006676 . Recuperado 30 September 2016, de http://dx.doi.org/10.2305/IUCN.UK.2012.RLTS.T191823A2006676.en
Álvarez-Icaza, P. L. y Rosas, M. I. H. (2010). Importancia ambiental y social del corredor biológico mesoamericano en México. Mesoamericana, 14, 95–113.
Amador-del Ángel, L. E. y Wakida-Kusunoki, A. T. (2014). Peces invasores en el sureste de México. Especies acuáticas invasoras en México. México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Arévalo-Frías, W. y Mendoza-Carranza, M. (2012). Larvas y juveniles de peces en ambientes estuatinos de la Reserva de la Biosfera Pantanos de Centla y su zona adyacente. En A. J. Sánchez, X. Chiappa-Carrara y B. Pérez (Eds.), Recursos acuáticos costeros del sureste: tendencias actuales en investigación y estado del arte (pp. 242–269). México D.F.: RECORECOS/ CONCYTEY/ UNACAR/ UJAT/ ECOSUR/ UNAM.
Armbruster, J. W. y Page, L. M. (2006). Redescription of Pterygoplichthys punctatus and description of a new species of Pterygoplichthys (Siluriformes: Loricariidae). Neotropical Ichthyology, 4, 401–409.
Arreguín-Sánchez, F. y Arcos-Huitrón, E. (2011). La pesca en México: estado de la explotación y uso de los ecosistemas. Hidrobiologica, 21, 431–462.
Barba, E. y Cano-Salgado, M. P. (2014). Abundancia del plecos (Pterygoplichthys pardalis) en sistemas lagunares y ribereños de la cuenca del Usumacinta, Balancán, Tabasco, México. En A. M. Low Pfeng y E. M. Peters Recagno (Eds.), Especies invasoras acuáticas, casos de estudio en ecosistemas de México (pp. 293–311). México D.F.: Semarnat.
Barba, E., Juárez-Flores, J. y Estrada-Loreto, F. (2010). Distribución y abundancia de crustáceos en humedales de Tabasco, México. Revista Mexicana de Biodiversidad, 81, 153–163.
Benítez-Mandujano, M. A. y Ponce-Palafox, N. C. C. (2014). Aspectos generales de la introducción de especies ícticas exóticas en la Subregión de los Ríos del estado de Tabasco, México. En A. M. Low Pfeng y E. M. Peters Recagno (Eds.), Especies invasoras acuáticas, casos de estudio en ecosistemas de México (pp. 623–636). México: Semarnat.
Berkes, F. (2003). Alternatives to conventional management: lessons from small-scale. Environments, 31, 5–19.
Cano-Salgado, M. P., Baltazar, E. B. y Barba, E. (2012). Innovación social y capacidad de organización de las cooperativas pesqueras en el municipio de Balancán, Tabasco, México. Estudios Sociales, 20, 65–98.
Carpenter, K. E (2002). Cichlidae. En K. E. Carpenter (Eds.), FAO species identification guide for fishery purposes. The living marine resources of the Western Central Atlantic. Vol. 3. Bony fishes part 2 (Opistognathidae to Molidae) (pp. 1375–2127). Rome: FAO.
Castillo-Bolaina, H., Mendoza-Palacios, J. D. D., Rivera-Trejo, J. G. F., Velasco Martinez, L. y Sánchez, H. R. (2011). Estudio de la precipitación pluvial diaria anual en la cuenca del río Usumacinta como base de las estimaciones crecientes de diseño. Memorias del Segundo Congreso Nacional de manejo de cuencas hidrográficas. 18 al 20 de Mayo, Villahermosa, Tabasco, México.
Castillo-Domínguez, A., Barba Macías, E., Navarrete, A. D. J., Rodiles-Hernández, R. y Jiménez Badillo, M. D. L. (2011). Ictiofauna de los humedales del río San Pedro, Balancán, Tabasco, México. Revista de Biología Tropical, 59, 693–708.
Castro-Aguirre, J. L., Pérez, H. E. y Schmitter-Soto, J. J. (1999). Ictiofauna estuarino-lagunar y vicaria de México. México D.F.: Editorial Limusa.
Cayuela, L. (2006). Deforestación y fragmentación de bosques tropicales montanos en los Altos de Chiapas, México. Efectos sobre la diversidad de árboles. Revista Ecosistemas, 15, 192–198.
Contreras, F. (1930). Contribución al conocimiento de las jaibas de México. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, 1, 227–241.
Cruz-Morales, J. y Rodiles-Hernández, R. (1999). Pesca y recursos acuáticos. Playas de Catazajá. Chiapas: El Colegio de la Frontera Sur.
Curtis, S. (2013). Daily precipitation distributions over the intra-Americas sea and their interannual variability. Atmósfera, 26, 243–259.
Eschmeyer, W. N., Fricke, R. y Van-der-Laan, R. (2017). Catalog of fishes: genera, species, references. Disponible en: http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp
Espinosa-Perez, H. y Ramírez, M. (2015). Exotic and invasive fishes in Mexico. Check List, 11, 1627.
Felder, D. L. (1973). Annotated key to crabs and lobsters (Decapoda, Reptantia) from coastal waters of the Northwestern Gulf of Mexico. Baton Rouge, Louisiana: Louisiana State University.
Friendly, M. (1994). Mosaic displays for multi-way contingency tables. Journal of the American Statistical Association, 89, 190–200.
Friendly, M. (2013). Working with categorical data with R and the vcd and vcd Extra packages. Disponible en: https://www.researchgate.net/publication/268276081_Tutorial_Working_with_categorical_data_with_R_and_the_vcd_package
Froese, R. y Pauly, D. (2017). Fishbase. World Wide Web electronic publication, version (10/2017). Disponible en: www.fishbase.org
García-Quijano, C. G. (2007). Fishers’ knowledge of marine species assemblages: bridging between scientific and local ecological knowledge in Southeastern Puerto Rico. American Anthropologist, 109, 529–536.
Gaspar-Dillanes, M. T. (1996). Aportación al conocimiento de la ictiofauna de la Selva Lacandona. Zoologia Informa, 33, 41–54.
Haggan, N., Neis, B. y Baird, I. G. (2007). Fishers’ knowledge in fisheries science and management. Venecia: UNESCO Publishing.
Holden, M. J. y Raitt, D. F. S. (1975). Manual de ciencia pesquera, Parte 2. Métodos para investigar los recursos y su aplicación. Roma: FAO.
Hornik, K., Zeileis, A. y Meyer, D. (2006). The strucplot framework: visualizing multi-way contingency tables with vcd. Journal of Statistical Software, 17, 1–48.
Huerta-Ortíz, M., Perera-García, M. A., Hernández-Gómez, R. E., Mendoza-Carranza, M. y Ortíz-Hernández, M. (2013). Variación interanual de la abundancia pesquera en la cuenca alta del río Usumacinta, Tabasco, México. En S. Cárdenas, J. M. Mancera, M. Rey-Méndez y C. Lodeiros (Eds.), V Foro Iberoamericano de Los Recursos Marinos y de Acuicultura (pp. 717–722). Santiago de Compostela: Sociedad Española de Acuicultura.
Inda-Díaz, E., Rodiles-Hernández, R., Naranjo, E. J. y Mendoza-Carranza, M. (2009). Subsistence fishing in two communities of the Lacandon Forest, Mexico. Fisheries Management and Ecology, 16, 225–234.
Isaac, V. J., Santo, R. V. E., Bentes, B., Frédou, F. L., Mourao, K. R. M. y Frédou, T. (2009). An interdisciplinary evaluation of fishery production systems off the state of Pará in North Brazil. Journal of Applied Ichthyology, 25, 244–255.
Lessa, R. P., Monteiro, A., Duarte-Neto, P. J. y Vieira, A. C. (2009). Multidimensional analysis of fishery production systems in the state of Pernambuco, Brazil. Journal of Applied Ichthyology, 25, 256–268.
Lienart, G. D. H., Rodiles-Hernández, R. y Capps, K. A. (2013). Nesting burrows and behavior of nonnative catfishes (Siluriformes: Loricariidae) in the Usumacinta-Grijalva Watershed, Mexico. The Southwestern Naturalist, 58, 238–243.
Lobato, R. (1988). Terrazas prehispánicas en la región del río Usumacinta y su importancia en la agricultura maya. Estudios de Cultura Maya, 19–58.
Magaña, V., Pérez, J. L., Vázquez, J. L., Carrisoza, E. y Pérez, J. (1999). El niño y el clima. En R. V. O. Magaña (Eds.), Los impactos de El Niño en México (pp. 227). México D.F.: SEP-Conacyt.
March, M. I. y Castro, N. (2010). La cuenca del río Usumacinta: perfíl y perspectivas para su conservación y desarrollo sustentable. En C. A. H. (Eds.), Las cuencas hidrográficas de México. Diagnostico y priorización (pp. 193–197). México D.F.: Universidad de San Luis Potosí.
Mendoza-Carranza, M., Arévalo-Frías, W. y Inda-Díaz, E. (2013). Common pool resources dilemmas in tropical inland small-scale fisheries. Ocean & Coastal Management, 82, 119–126.
Mendoza-Carranza, M., Martínez-Gutiérrez, M. L., Segura-Berttolini, E. C. y Hernández-López, A. (2008). Memorias del taller diagnóstico de la pesca en la Reserva de la Biosfera Pantanos de Centla: la perspectiva social de pesca en los Pantanos de Centla. Villahermosa, Tab. México D.F.: El Colegio de la Frontera Sur.
Miller, R. R., Minckley, W. L. y Norris, S. M. (2005). Freshwater fishes of Mexico. Chicago: The University of Chicago Press.
Montalvo-Urgel, H., Sánchez, A. J., Florido, R. y Macossay-Cortez, A. A. (2010). Lista de crustáceos distribuidos en troncos hundidos en el humedal tropical Pantanos de Centla, al sur del golfo de México. Revista Mexicana de Biodiversidad, 81, 121–131.
Nijkamp, P. y Rietveld, P. (1979). Multidimensional spatial data and decision analysis. Nueva York: John Wiley & Sons.
NOAA (National Oceanic and Atmospheric Administration). (2015). Cold & warm episodes by season. Recuperado 26 de octubre de 2016, de: http://www.cpc.ncep.noaa.gov/products/analysis_monitoring/ensostuff/ensoyears.shtml
Page, L. M., Espinosa-Pérez, H., Findley, L. T., Gilbert, C. R., Lea, R. N., Mandrak, N. E. et al. (2013). Common and scientific names of fishes from the United States, Canada, and Mexico. Bethesda, Maryland: American Fisheries Society.
Perera-García, M. A., Mendoza-Carranza, M., Contreras-Sánchez, W., Ferrara, A., Huerta-Ortiz, M. y Hernández-Gómez, R. E. (2013). Comparative age and growth of common snook Centropomus undecimalis (Pisces: Centropomidae) from coastal and riverine areas in Southern Mexico. Revista de Biologia Tropical, 61, 807–819.
Perera-García, M. A., Mendoza-Carranza, M., Contreras-Sánchez, W. M., Huerta-Ortíz, M. y Pérez-Sánchez, E. (2011). Reproductive biology of common snook Centropomus undecimalis (Perciformes: Centropomidae) in two tropical habitats. Revista de Biología Tropical, 59, 669–681.
Raz-Guzmán, A., Sánchez, A. J. y Soto, L. A. (1992). Catálogo ilustrado de cangrejos braquiuros y anomuros (Crustacea) de laguna de Alvarado, Veracruz, México. Cuadernos del Instituto de Biología, 14. México D.F.: Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México.
Renner, M. y Huntington, H. P. (2014). Connecting subsistence harvest and marine ecology: a cluster analysis of communities by fishing and hunting patterns. Deep Sea Research Part II: Topical Studies in Oceanography, 109, 293–299.
Rényi, A. (1970). Probability theory. New York: Dover Publications, Inc.
Ricotta, C. (2003). On parametric evenness measures. Journal of theoretical biology, 222, 189–197.
Rodiles-Hernández, R. y Cruz-Morales, J. (2004). Capacidades locales para el análisis de las pesquerías en la cuenca del Usumacinta. Etnopaisaje, trabajo comunitario y manejo y conservación de recursos naturales. México D.F.: Universidad Juárez Autónoma de Tabasco/ El Colegio de la Frontera Sur/ Consejo Nacional de Ciencia y Tecnología.
Rodiles-Hernández, M. D. R., Díaz, G. y Acosta, A. Á. G. (2013). Ecosistemas acuáticos. En G. D. E. D. Chiapas (Ed.), La biodiversidad en Chiapas: estudio de estado (pp. 45–57). México D.F.: Comisión Nacional para el Conocimiento y Uso de la Biodiversidad/ Gobierno del Estado de Chiapas.
Rodiles-Hernández, R., Díaz-Pardo, E. y Lyons, J. (1999). Patterns in the species diversity and composition of the fish community of the Lacanja River, Chiapas, Mexico. Journal of Freshwater Ecology, 14, 455–468.
Rogers, S. I., Maxwell, D., Rijnsdorp, A. D., Damm, U. y Vanhee, W. (1999). Fishing effects in northeast Atlantic shelf seas: patterns in fishing effort, diversity and community structure. IV. Can comparisons of species diversity be used to assess human impacts on demersal fish faunas? Fisheries Research, 40, 135–152.
Sagarpa (Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación). (2015). Estadística pequera y acuícola de México Recuperado 30 de Octubre de 2015, de http://www.conapesca.gob.mx/wb/cona/informacion_estadistica_por_especie_y_entidad
Servicio Meteorológico Nacional. (2017). Resumenes mensuales de temperatura y lluvia. Recuperado en noviembre, 2017, de http://smn.cna.gob.mx/es/climatologia/temperaturas-y-lluvias/resumenes-mensuales-de-temperaturas-y-lluvias
Skelton, P. H. (2001). A complete guide to the freshwater fishes of Southern Africa. Cape Town: Struik Publishers.
Valdez-Moreno, M. E., Pool-Canul, J. y Contreras-Balderas, S. (2005). A checklist of the freshwater ichthyofauna from El Petén and Alta Verapaz, Guatemala, with notes for its conservation and management. Zootaxa, 1072, 43–60.
Vega, M. A. (2005). Plan de conservación para la Reserva de la Biosfera Pantanos de Centla y el Área de Protección de Flora y Fauna Laguna de Términos. México D.F.: Pronatura/ The Nature Conservancy/ Conanp.
Vega-Rodríguez, B. y Ayala-Pérez, L. (2014). Age and growth of tarpon Megalops atlanticus in Campeche coast, Mexico. Revista de Biologia Marina y Oceanografia, 49, 351–359.
Velázquez-Velázquez, E. y Schmitter-Soto, J. J. (2004). Conservation status of the San Christóbal pupfish Profundulus hildebrandi Miller (Teleostei: Profundulidae) in the face of urban growth in Chiapas, Mexico. Aquatic Conservation: Marine and Freshwater Ecosystems, 14, 201–209.
Wakida- Kusunoki, A. T., Ruiz-Carus, R. y Amador-del Ángel, E. (2007). Amazon sailfin carfish Pterygoplichthys pardalis (Castelnau, 1955) (Loricaridae), another exotic species established in Southeastern Mexico. The Southwestern Naturalist, 52, 4.
Weber, C. (1991). Nouveaux taxa dans Pterygoplichthys sensu latu (Pisces, Siluriformes, Loricariidae). Revue Suisse de Zoologie, 98, 637–643.
Weber, C. (1992). Revision du genre Pterygoplichthys sensu latu (Pisces, Siluriformes, Loricariidae). Revue Francaise du Aquariologie, 19, 1–36.
Williams, A. B. (1984). Shrimps, lobsters, and crabs of the Atlantic coast of the eastern United States, Maine to Florida. Washington D.C.: Smithsonian Institution Press.
