Juan Maldonado-Carrizales a, Javier Ponce-Saavedra a, * y Alejandro Valdez-Mondragón b
a Universidad Michoacana de San Nicolás de Hidalgo, Facultad de Biología, Laboratorio de Entomología “Biol. Sócrates Cisneros Paz”, Edificio B-4, 2o piso, Ciudad Universitaria, 58060 Morelia, Michoacán, México
b Catedrático Conacyt, Laboratorio de Aracnología (LATLAX), Universidad Nacional Autónoma de México, Instituto de Biología, sede Tlaxcala, Laboratorio Regional de Biodiversidad y Cultivo de Tejidos Vegetales, Ex-Fábrica San Manuel, San Miguel Contla, 90640 Santa Cruz Tlaxcala, Tlaxcala, México
*Autor para correspondencia: ponce.javier0691@gmail.com (J. Ponce-Saavedra)
Recibido: 18 julio 2020; aceptado: 14 diciembre 2020
Resumen
En el poniente de la ciudad de Morelia, Michoacán, México, se muestrearon mensualmente durante un año 3 fraccionamientos similares en tipo de viviendas, pero diferentes en tiempo transcurrido desde su construcción, para estudiar la riqueza y abundancia de arañas. También se hicieron 44 muestreos adicionales en vegetación colindante. Los fraccionamientos se denominaron: localidades “vieja”, “mediana” y “joven”. Mediante recolecta directa, trampas de caída y manta de golpeo, se capturaron 7,065 arañas; 4,281 (721 ♀♀, 369 ♂♂ y 3,191 inmaduros) determinadas y ubicadas en 23 familias, 48 géneros y 54 especies. Hubo diferencia estadística en la proporción de abundancia adultos/inmaduros entre fraccionamientos (χ2 = 38.825; p < 0.0001). Anosim no detectó diferencia significativa entre fraccionamientos por el tiempo de haber sido construidos (R = 0.009; p = 0.167), pero se reconoce una tendencia de cambio debida al tiempo transcurrido desde su construcción. La abundancia por especie entre el fraccionamiento viejo fue diferente con el joven (p = 0.028) y la vegetación colindante (p = 0.049). La familia Salticidae (22 especies) y el género Sassacus (4) presentaron mayor riqueza; mientras que Filistatinella kahloae (663 individuos) fue la especie más abundante. Microlinyphia dana representa registros nuevos de género y especie para México.
Palabras clave: Arañas sinantrópicas; Diversidad; Inventario; Nuevos registros; Especies indicadoras
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Species richness and abundance of spiders (Arachnida: Araneae) in western urban environments and its contiguous vegetation from Morelia City, Michoacán, Mexico
Abstract
In the west of the city of Morelia, Michoacán, Mexico, 3 urban localities with similar type of housing construction, but different in time since their construction were sampled monthly for a year to study the richness and abundance of spiders. Four additional samples were also made in adjacent vegetation. The localities were called: “old”, “medium” and “young”. Through direct hand-picking, pit-fall traps, and beating sheets, 7,065 spiders were captured; 4,281 (721 ♀♀, 369 ♂♂ and 3,191 immature) determined in 23 families, 48 genera and 54 species. There was a statistical difference in the ratio of adult/immature abundance between urban locations (χ2 = 38.825; p < 0.0001). ANOSIM did not detect a significant difference among localities due to the time they were built (R = 0.009; p = 0.167); but a trend of change due to the time elapsed since its construction is recognized. The abundance by species was different between the old housing development with the young (p = 0.028) and the adjoining vegetation (p = 0.049). The family Salticidae (22 species) and the genus Sassacus (4) presented greater richness, while Filistatinella kahloae (663 individuals) was the most abundant species. Microlinyphia dana represents new genus and species records for Mexico.
Keywords: Synanthropic spiders; Diversity; Inventory; New records; Indicator species
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
El ambiente urbano presenta condiciones bióticas y abióticas particulares que afectan, tanto positiva como negativamente a las especies que logran establecerse en él. Algunos factores como la humedad, la temperatura, la disponibilidad de recursos, la protección contra adversidades climáticas y la actividad humana, son importantes para su establecimiento y eventual éxito (Fraser y Frankie, 1986; Melic, 1997; Robinson, 2005). Aquellas especies que son capaces de resistir las modificaciones antrópicas, sobrevivir y mantenerse exitosamente en relación con los humanos y su domicilio, se les conoce como especies sinantrópicas (Cursach et al., 2012; King, 2014). La diversidad de hábitats en los que pueden vivir las arañas, así como sus adaptaciones para alimentarse, las ubica como uno de los grupos dominantes en los ecosistemas terrestres debido a diferentes aspectos de su biología, que pueden proveerles de algunas ventajas para realizar la transición de un ambiente natural o seminatural hacia uno urbanizado, y poder invadir los nuevos hábitats creados por el hombre (Durán-Barrón et al., 2009; Marc et al., 1999). Gracias al éxito que tienen las arañas para adaptarse a diferentes hábitats, son un grupo común en espacios sinantropizados, en los que incluso diversos grupos de arañas son colonizadoras en estos ambientes. Algunas de las especies que mejor se han adaptado a las condiciones modificadas por el humano son conocidas por su importancia médica debido al veneno que inoculan con su mordedura, poniendo en riesgo la salud de las personas e incluso llegan a ser consideradas como de importancia para la salud pública (Cabrera-Espinosa y Valdez-Mondragón, 2019; Desales-Lara et al., 2013; Maldonado-Carrizales et al., 2018; Rodríguez-Rodríguez et al., 2015; Salazar-Olivo y Solís-Rojas, 2015; Taucare-Ríos et al., 2013; Trubl et al., 2012; Valdez-Mondragón et al., 2018, 2019). Además de representar un gremio abundante e importante en la depredación de otros artrópodos, las arañas son excelentes indicadoras de disturbios y modificación de hábitat (Moorhead y Philpott, 2013; Wise, 1993); por lo que caracterizar a las comunidades mediante el estudio de su composición y estructura permite evaluar y monitorear los cambios en los ecosistemas y la biodiversidad (Barnosky et al., 2012). Los listados faunísticos, trabajos taxonómicos y ecológicos representan estudios importantes para conocer la biodiversidad de un grupo megadiverso como las arañas, siendo pieza clave en la detección de sitios de interés para el manejo y conservación, tanto a nivel regional como estatal (Valdez-Mondragón, 2019), así como para evaluar cambios en los ecosistemas debidos a perturbaciones locales o globales.
La ciudad de Morelia, Michoacán, México es la capital del estado y concentra la mayor densidad poblacional de la entidad, y dado el escaso conocimiento de la araneofauna regional y el rápido proceso de urbanización, el presente trabajo tiene como finalidad estudiar la riqueza y abundancia de las comunidades de arañas en los ambientes urbanos y su vegetación aledaña, considerando que la colonización y eventual establecimiento de las arañas en los nuevos ecosistemas, tiene al menos 2 componentes principales: la vegetación adyacente y fuente de especies más cercana, así como la llegada y eventual establecimiento de especies provenientes de otros sistemas urbanos y naturales; además de que esto estará en función del tiempo transcurrido desde la construcción de los conjuntos habitacionales. Adicionalmente, se incrementará el conocimiento sobre la aracnofauna regional, el cual actualmente es escaso.
Materiales y métodos
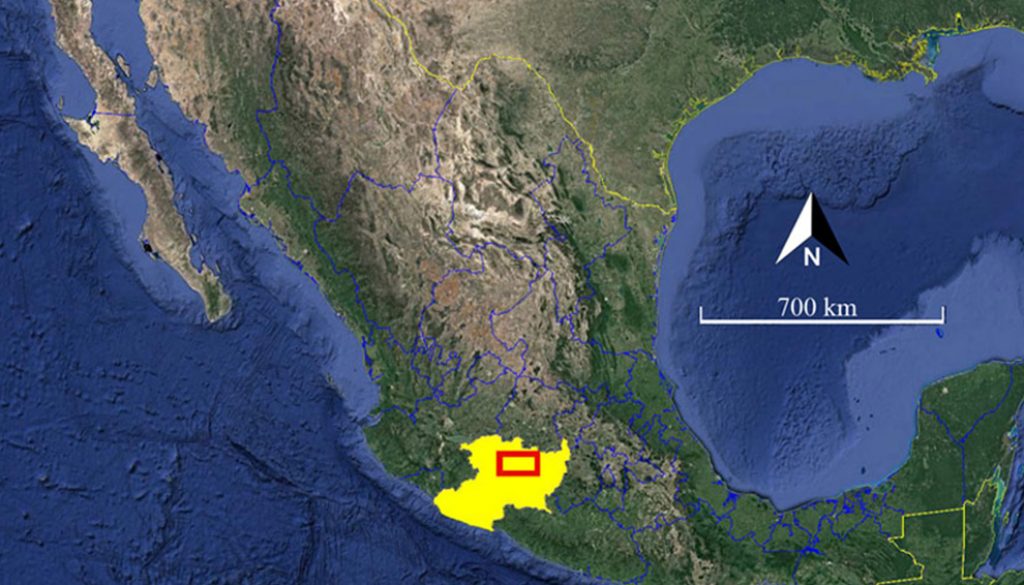
El trabajo se realizó en 3 localidades urbanas, tomando como definición de urbano a la transformación general de la cobertura y uso del suelo que era ocupado por paisajes naturales o bien utilizados con fines agropecuarios, por áreas pobladas provistas con servicios básicos para el humano (inmuebles, suministro de agua, electricidad y drenaje), en las que viven o trabajan más de 10,000 habitantes/km² (> 10 habitantes/ha), y la mayor proporción de la superficie (> 50%) se encuentra cubierta por superficies impermeables como asfalto o concreto (MacGregor-Fors, 2011; Marzluff et al., 2001; Merlotto et al., 2012; Weber y Puissant, 2003). Los fraccionamientos seleccionados colindan con un mismo tipo de vegetación secundaria que reemplaza a un bosque tropical caducifolio (BTC), ubicados al poniente de Morelia, Michoacán, México.
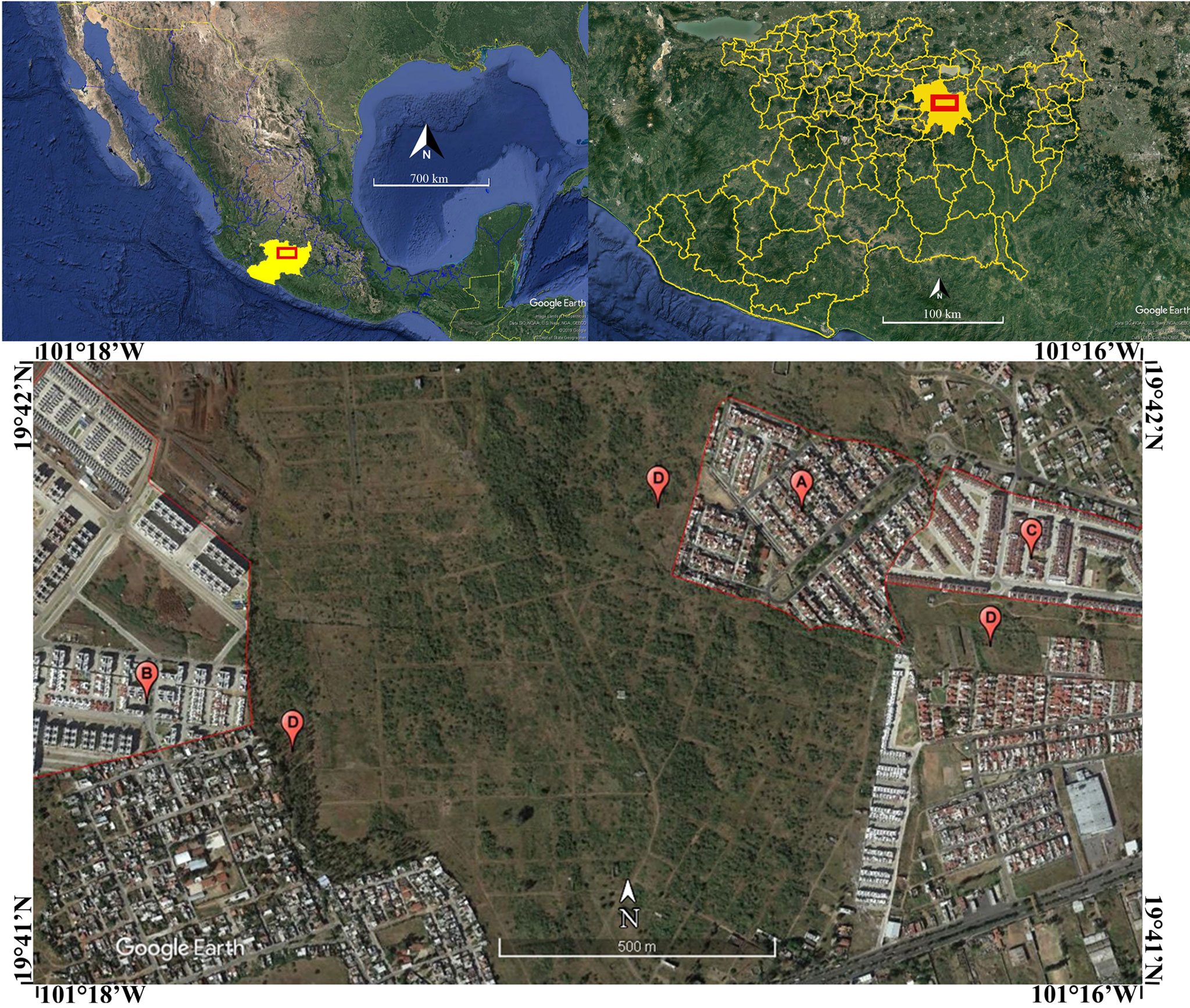
Para estudiar el efecto en la riqueza y abundancia de arañas asociadas a las casas de los fraccionamientos, se visitaron 10 conjuntos habitacionales cuyos tiempos de construcción variaban entre 1 y 17 años, a fin de seleccionar 3 de ellos para llevar a cabo el estudio. Como criterios de selección se consideró, principalmente, el obtener el permiso de los habitantes de los inmuebles y el tiempo transcurrido desde su construcción.
Los fraccionamientos se denominaron: 1) localidad vieja: para el conjunto habitacional cuyo tiempo de construcción fuera de 11 años o más y que correspondió al fraccionamiento “Ario 1815” con 17 años de haber sido construido; 2) localidad mediana: para viviendas cuyo tiempo de construcción se encontrara entre los 6 y 10 años, en donde se ubicó al fraccionamiento “Camponubes” con 7 años transcurridos desde su construcción, y 3) localidad joven: aquella cuyo tiempo de construcción se encuentra entre los 0 y 5 años, que en este caso correspondió al fraccionamiento “Hacienda Ciprés” con 2 años desde su construcción. Una cuarta categoría se denominó localidad original, en referencia a la vegetación nativa, cuyo suelo no se encuentra modificado por acción de la urbanización y donde la actividad antrópica es de muy bajo impacto, en este estudio corresponde a las zonas aledañas a los sitios urbanizadas (fig. 1).
Se realizó un muestreo mensual diurno (entre las 9 y 18 horas) de enero a diciembre del 2018, cubriendo la temporada de lluvias y de estiaje, mientras que en la vegetación colindante, en el mismo horario que en el interior de los sitios urbanizados, se hicieron 4 muestreos diurnos, en agosto y noviembre de 2018 para la temporada de lluvias, y en febrero y mayo 2019 para el estiaje, debido a que las condiciones ambientales son más estables. En cada fraccionamiento, se eligieron al azar 11 viviendas, por lo que en total se muestrearon 33 casas habitación en las se recolectaron las arañas encontradas en la planta baja, tanto en el interior como en el peridomicilio. De acuerdo con Desales-Lara et al. (2013) y Rodríguez-Rodríguez et al. (2015), existe diferencia en la riqueza de especies que se pueden encontrar en la planta baja con respecto a la del primer piso. Se restringió el muestreo a la planta baja, debido a la inseguridad de la zona y la desconfianza por parte de los habitantes de las casas, quienes en general, no permitieron acceso al primer piso.
Para obtener mejor representación de la fauna de arañas se aplicaron 3 métodos de recolecta: 1) directa: consiste en recolectar arañas manualmente en el suelo y posibles microhábitats donde pudieran estar, utilizando pinzas entomológicas y frascos y/o viales con alcohol etílico al 80% para sacrificio y preservación de los ejemplares. Se utilizó el tiempo como unidad de esfuerzo, realizándose la captura durante una hora/persona, tanto en el interior como en el peridomicilio de cada vivienda; 2) golpeteo de la vegetación: consiste en golpear la vegetación con la ayuda de un palo de madera, para que las arañas caigan en un cuadro de manta de 1m × 1m. Se golpearon las ramas de los árboles y arbustos. Dado que se realizaron menos recolectas en la vegetación colindante, el esfuerzo de muestreo para la recolecta directa y golpeteo se multiplicó por 3 veces, 1 por cada mes correspondiente a 1 estación, teniendo así un esfuerzo de muestreo de 3 horas/persona, lo que es igual a 1 hora/persona en 1 mes, y 3) trampas de caída: consisten en colocar recipientes de plástico de un litro, llenándolos a 1/3 de su capacidad con alcohol etílico al 80% y cubriéndolas con material presente en los alrededores, como hojas secas, basura o ramas, evitando obstruir el paso hacia el interior de la trampa.
Se colocaron 10 trampas en cada fraccionamiento, 5 en un área verde al interior del conjunto habitacional y 5 aleatoriamente en jardines de casas habitación. Adicionalmente, en los límites entre la vegetación aledaña compartida y los fraccionamientos, se colocaron 10 trampas en línea recta, con una separación de 5 metros. En total, 60 trampas en el interior de fraccionamientos por fecha de muestreo. Las trampas se dejaron expuestas durante 24 horas.
Las arañas capturadas fueron depositadas, etiquetadas y conservadas en alcohol etílico al 80%, con sus correspondientes datos de recolecta y transportadas al Laboratorio de Entomología “Biól. Sócrates Cisneros Paz”, Facultad de Biología, Universidad Michoacana de San Nicolás de Hidalgo (UMSNH), en la ciudad de Morelia, Michoacán, México.
Para su identificación, los ejemplares fueron observados con ayuda de un microscopio estereoscópico Fisher Scientific Stereomaster modelo 12-562-12. La determinación de las arañas se realizó con apoyo de literatura especializada. Todos los ejemplares fueron ubicados taxonómicamente hasta el nivel de familia; los adultos y la mayoría de los inmaduros se organizaron en morfoespecies y posteriormente identificados a género y especie cuando fue posible. Para la determinación específica, se disectaron los pedipalpos en machos y el epiginio en hembras. Las espermatecas de los epiginios fueron limpiadas con hidróxido de potasio (KOH) al 10%, para poder observar adecuadamente las estructuras y obtener una identificación más precisa. De esta forma, de los 7,065 ejemplares capturados, 4,281 pudieron ser determinados hasta el nivel taxonómico de especie y fueron los que se usaron para los análisis estadísticos.
Para probar posibles diferencias entre los valores de abundancia proporcional de machos y hembras adultos así como inmaduros entre localidades, se consideraron 3 diferentes estados para las arañas: machos adultos, hembras adultas e inmaduros y se aplicó una prueba no paramétrica de Ji-cuadrada (χ2) haciendo comparaciones pareadas para establecer las posibles diferencias en función del tiempo de construcción de las viviendas.
Se aplicó el análisis de similitudes entre comunidades (Anosim) para determinar la posible diferencia estadística en la composición de especies por efecto del tiempo de construcción de los conjuntos habitacionales estudiados y con respecto a la vegetación original.
Para comparar las abundancias por especie, se hicieron comparaciones pareadas con una prueba no paramétrica de Mann y Whitney (Zar, 2010) y posteriormente se hizo una curva de rango-abundancia para determinar las especies dominantes en cada localidad.
Los análisis estadísticos se hicieron en el programa PAST versión 4.03 (Hammer et al., 2001).
Resultados
En el ciclo anual de muestreo, se recolectaron en total 7,065 arañas, de las cuales algunos ejemplares inmaduros eran demasiado jóvenes y no tenían estructuras diagnósticas para su determinación, por lo que no fue posible identificar el género de ejemplares de 8 familias y no se pudo determinar la especie en ejemplares de 60 géneros, razón por la que, para la elaboración del listado taxonómico y el análisis comparativo de riqueza y abundancia entre sitios y épocas, no fueron considerados, quedando 4,281 ejemplares para el análisis, que constituyen 60.59% del total capturado.
La riqueza de arañas recolectadas en un ciclo anual fue de 25 familias y 108 géneros, de las cuales se determinaron 54 especies, pertenecientes a 48 géneros dentro de 23 familias (tabla 1). De los organismos que no pudieron identificarse al nivel de especie, se obtuvo una lista de 60 géneros, pertenecientes a 25 familias, los cuales se incluyen para tener un inventario más completo (tabla 2). Al comparar la riqueza de cada uno de los conjuntos habitacionales, puede apreciarse una disminución gradual en la riqueza de especies conforme el tiempo de construcción aumenta, de joven a mediana, a vieja (tabla 3). La riqueza total de 54 especies obtenida en este trabajo representa el segundo valor más alto de especies de arañas en ambientes urbanos en México, después del realizado por Salazar-Olivo y Solís-Rojas (2015), quienes reportaron 59 especies; y si se consideran únicamente géneros, sería el estudio con mayor diversidad genérica hasta la fecha con 108.
La mayor abundancia relativa se observó en las familias Salticidae (24.1%), Theridiidae (14.8 %) y Araneidae (11.1%) que suman el 50%, seguido de Dictynidae (5.6%) y Gnaphosidae, Linyphiidae, Pholcidae, Tetragnathidae y Thomisidae con el 3.7% cada una. Otras 14 familias comprenden el 25.9% restante, representadas con una sola especie y fueron: Anyphaenidae, Cheirachantiidae, Corinnidae, Diguetidae, Filistatidae, Oecobiidae, Oonopidae, Oxyopidae, Philodromidae, Phrurolithidae, Scytodidae, Trachelidae, Uloboridae y Zoropsidae (fig. 2).
Las familias Salticidae con 10 géneros y 13 especies, Theridiidae con 6 géneros y 7 especies, así como Araneidae con 6 géneros con una especie cada una fueron las más diversas. El género Sassacus (Salticidae) estuvo representado con 4 especies, siendo el género con mayor riqueza, seguido de Mallos (Dictynidae); Latrodectus (Theridiidae) y Synema (Thomisidae), con 2 especies cada uno. El resto de las familias estuvo representada por un género y una especie (tabla 1).
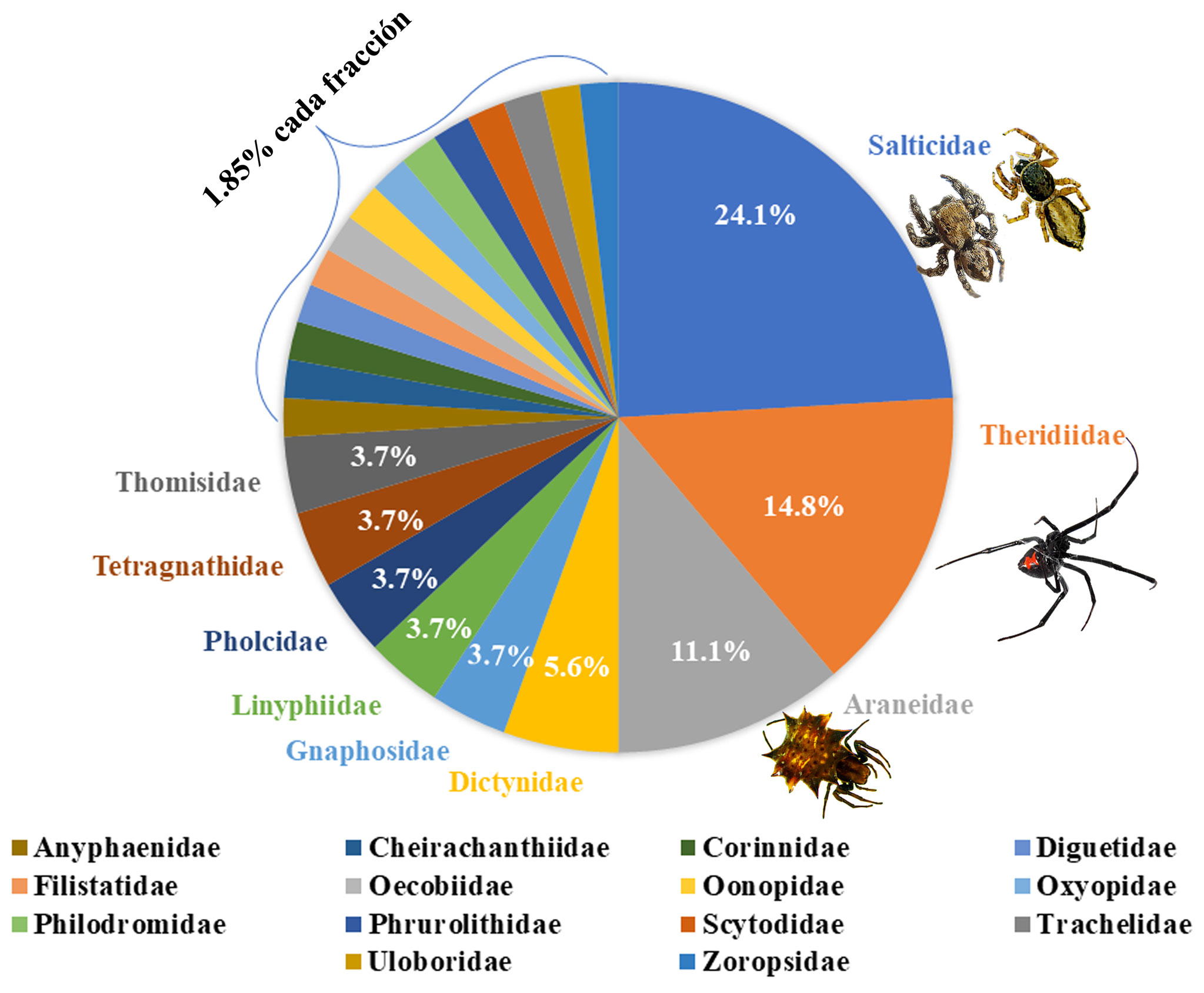
Tabla 1
Abundancia de las especies de arañas encontradas por localidad en el poniente de la ciudad de Morelia, Michoacán, México.
| Familia | Género y especie | Localidad | |||
| vieja | mediana | joven | original | ||
| Anyphaenidae | Anyphaena judicata O. Pickard-Cambridge, 1896 ● | 5 | 19 | 25 | 412 |
| Araneidae | Araneus pegnia (Walckenaer, 1841) ● | 0 | 6 | 3 | 53 |
| Argiope trifasciata (Forsskål, 1775) ● | 38 | 46 | 92 | 103 | |
| Cyclosa walckenaeri (O. Pickard-Cambridge, 1889) ● | 3 | 4 | 1 | 2 | |
| Metepeira spinipes F. O. Pickard-Cambridge, 1903 | 0 | 0 | 0 | 1 | |
| Micrathena gracilis (Walckenaer, 1805) | 0 | 0 | 0 | 1 | |
| Neoscona oaxacencis (Keyserling, 1864) | 7 | 11 | 34 | 28 | |
| Cheirachanthiidae | Cheiracanthium mildei L. Koch, 1864 ● | 3 | 9 | 25 | 43 |
| Corinnidae | Creugas gulosus Thorell, 1878 | 0 | 1 | 3 | 0 |
| Dictynidae | Mallos dugesi (Becker, 1886) ● | 0 | 3 | 0 | 0 |
| Mallos niveus O. Pickard-Cambridge, 1902 ● | 1 | 17 | 4 | 7 | |
| Tivyna spatula (Gertsch y Davis, 1937) ● | 5 | 17 | 33 | 4 | |
| Diguetidae | Diguetia albolineata (O. Pickard-Cambridge, 1895)● | 0 | 1 | 0 | 12 |
| Filistatidae | Filistatinella kahloae Magalhaes y Ramírez, 2017 | 61 | 226 | 374 | 2 |
| Gnaphosidae | Cesonia lugubris (O. Pickard-Cambridge, 1896) ● | 0 | 1 | 4 | 31 |
| Haplodrassus signifer (C. L. Koch, 1839) ● | 0 | 1 | 0 | 1 | |
| Linyphiidae | Frontinella pyramitela (Walckenaer, 1841) ● | 5 | 11 | 14 | 5 |
| Microlinyphia dana (Chamberlin y Ivie, 1943) ▼● | 0 | 0 | 2 | 0 | |
| Oecobiidae | Oecobius annulipes Lucas, 1846 ● | 0 | 0 | 2 | 0 |
| Oonopidae | Triaeris stenaspis Simon, 1892 ● | 0 | 0 | 2 | 1 |
| Oxyopidae | Peucetia viridans (Hentz, 1832) | 4 | 12 | 23 | 47 |
| Philodromidae | Apollophanes punctipes (O. Pickard-Cambridge, 1891) ● | 7 | 11 | 31 | 23 |
| Pholcidae | Physocyclus brevicornus Valdez-Mondragón, 2010● | 309 | 190 | 46 | 2 |
| Psilochorus simoni (Berland, 1911) ● | 30 | 1 | 19 | 2 | |
| Phrurolithidae● | Scotinella sp. nov. *● | 7 | 6 | 13 | 12 |
| Salticidae | Anicius dolius Chamberlin, 1925 | 0 | 0 | 0 | 3 |
| Colonus hesperus (Richman y Vetter, 2004) | 0 | 0 | 0 | 3 | |
| Habronattus fallax (Peckham y Peckham, 1909) | 14 | 11 | 9 | 8 | |
| Menemerus bivitattus (Dufour, 1831) ● | 8 | 33 | 20 | 1 | |
| Messua tridentata (F. O. Pickard-Cambridge, 1901) ● | 0 | 2 | 0 | 0 | |
| Paraphidippus aurantius (Lucas, 1833) | 4 | 15 | 7 | 64 | |
| Pelegrina variegata (F. O. Pickard-Cambridge, 1901) | 1 | 0 | 0 | 24 | |
| Phidippus pompatus Edwards, 2004 ● | 3 | 2 | 12 | 6 | |
| Sassacus barbipes (Peckham y Peckham, 1888) ● | 2 | 2 | 1 | 9 | |
| Sassacus cyaneus (Hentz, 1846) | 0 | 0 | 0 | 2 | |
| Sassacus paiutus (Gertsch, 1934) | 0 | 0 | 0 | 1 | |
| Sassacus vitis (Cockerell, 1894) ● | 4 | 4 | 6 | 17 | |
| Synageles mexicanus Cutler, 1988 | 13 | 12 | 6 | 0 | |
| Tabla 1. Continúa | |||||
| Familia | Género y especie | Localidad | |||
| vieja | mediana | joven | original | ||
| Scytodidae | Scytodes intricata Banks, 1909 ● | 1 | 0 | 8 | 54 |
| Tetragnathidae | Leucauge argyrobapta (White, 1841) | 14 | 8 | 6 | 24 |
| Tetragnatha laboriosa Hentz, 1850 ● | 2 | 1 | 5 | 3 | |
| Theridiidae | Cryptachaea porteri (Banks, 1896) | 4 | 24 | 111 | 3 |
| Emertonella emertoni (Bryant, 1933) ● | 0 | 1 | 0 | 0 | |
| Euryopis lineatipes O. Pickard-Cambridge, 1893 | 1 | 2 | 1 | 2 | |
| Latrodectus geometricus C. L. Koch, 1841 | 17 | 148 | 171 | 1 | |
| Latrodectus mactans (Fabricius, 1775) | 19 | 53 | 69 | 3 | |
| Paratheridula perniciosa (Keyserling, 1886) ● | 0 | 5 | 2 | 0 | |
| Steatoda grossa (C. L. Koch, 1838) | 74 | 42 | 99 | 5 | |
| Tidarren sisyphoides (Walckenaer, 1841) | 5 | 69 | 26 | 0 | |
| Thomisidae | Synema parvulum (Hentz, 1847) ● | 1 | 1 | 2 | 115 |
| Synema viridans (Banks, 1896) ● | 1 | 0 | 1 | 26 | |
| Trachelidae | Meriola decepta Banks, 1895 ● | 0 | 0 | 2 | 0 |
| Uloboridae | Uloborus segregatus Gertsch, 1936 ● | 0 | 6 | 11 | 10 |
| Zoropsidae | Zorocrates fuscus Simon, 1888 | 25 | 5 | 22 | 21 |
| Total | 698 | 1,039 | 1,347 | 1,197 |
* = Nueva especie; = nuevo registro para Michoacán; ▼ = nuevo registro para México; ● = primer registro para México en un ambiente urbano.
De las 54 especies identificadas, 20 representan nuevos registros para el estado de Michoacán; mientras que la especie Microlinyphia dana (Chamberlin e Ivie, 1943) representa un nuevo registro para México a nivel genérico y específico.
Se identificó una familia (Phrurolithidae) y 32 especies que no habían sido previamente registradas en los trabajos de arañas sinantrópicas en México (tabla 1). Con este trabajo, la diversidad de arañas conocida para Michoacán aumentó en 8% con respecto al último inventario publicado con las 20 especies registradas por primera vez en la entidad, sumando hasta ahora 281 especies para el estado (Valdez-Mondragón, 2019).
Con los 4,281 ejemplares que se identificaron hasta especie (721 ♀♀, 369 ♂♂ y 3,191 inmaduros), se aplicó la prueba de concordancia con Ji-cuadrada para probar si la proporción entre hembras, machos e inmaduros era similar en las diferentes localidades. Se encontró diferencia estadísticamente significativa entre las proporciones de abundancia de los 3 estados considerados en los fraccionamientos estudiados (X2 = 38.825; d.f. = 6; p = 7.75E-07). Los resultados desglosados para cada uno de los estados (hembra, macho e inmaduros) se pueden observar en el apéndice 1. La comparación entre los conjuntos habitacionales muestra que hay un gradiente de diferencia entre la vegetación original con la localidad joven y mediana, hasta ser muy diferentes con la localidad con mayor tiempo de haber sido construida (tabla 4). La mayor diferencia en abundancia de los 3 estados (hembras, machos e inmaduros) se encontró entre la localidad joven con la vieja.
Tabla 2
Familias y géneros de arañas de las que no se obtuvo identificación a nivel de especie en fraccionamientos y vegetación aledaña del poniente de la ciudad de Morelia, Michoacán, México.
| Localidad | ||||||
| Familia | Género | Morfoespecie | vieja | mediana | joven | original |
| Agelenidae* | Agelenopsis | Agelenopsis sp. | 0 | 0 | 0 | 1 |
| Anyphaenidae | Wulfila | Wulfila sp. | 0 | 0 | 0 | 10 |
| Araneidae | Araniella | Araniella sp. | 0 | 1 | 1 | 1 |
| Eriophora | Eriophora sp. | 0 | 0 | 0 | 7 | |
| Pozonia | Pozonia sp. | 0 | 0 | 0 | 9 | |
| GenND | ————— | 7 | 6 | 17 | 17 | |
| Clubionidae* | Clubiona | Clubiona sp. | 1 | 0 | 0 | 0 |
| Corinnidae | Castianeira | Castianeira sp. | 3 | 16 | 25 | 10 |
| Falconia | Falconia sp. | 0 | 1 | 0 | 0 | |
| Septentrina | Septentrina sp. | 1 | 1 | 3 | 1 | |
| GenND | —————– | 1 | 3 | 2 | 0 | |
| Cybaeidae* | GenND | —————– | 0 | 0 | 0 | 1 |
| Dictynidae | Emblyna | Emblyna sp. | 0 | 2 | 1 | 0 |
| Lathys | Lathys sp. | 1 | 2 | 0 | 0 | |
| Tricholathys | Tricholathys sp. | 0 | 0 | 0 | 1 | |
| GenND | —————- | 10 | 20 | 5 | 3 | |
| Euagridae* | Euagrus | Euagrus aff. garnicus | 0 | 0 | 0 | 24 |
| Euctenizidae* | Eucteniza | Eucteniza aff. coylei | 0 | 0 | 0 | 1 |
| Gnaphosidae | Gnaphosa | Gnaphosa sp. | 0 | 0 | 1 | 3 |
| Nodocion | Nodocion sp. | 0 | 0 | 2 | 0 | |
| Trachyzelotes | Trachyzelotes sp. | 2 | 0 | 0 | 0 | |
| GenND | —————– | 4 | 4 | 5 | 7 | |
| Linyphiidae | Batyphantes | Batyphantes sp. | 0 | 0 | 1 | 0 |
| Macrargus | Macrargus sp. | 0 | 2 | 0 | 0 | |
| Oaphantes | Oaphantes sp. | 0 | 3 | 0 | 0 | |
| Sisicus | Sisicus sp. | 0 | 0 | 1 | 1 | |
| GenND | —————- | 55 | 91 | 125 | 20 | |
| Liocranidae* | Apostenus | Apostenus sp. | 0 | 1 | 1 | 2 |
| Hesperocranum | Hesperocranum sp. | 0 | 0 | 2 | 0 | |
| Liocranoeca | Liocranoeca sp. | 1 | 4 | 22 | 0 | |
| GenND | —————- | 4 | 14 | 0 | 1 | |
| Lycosidae* | Hesperocosa | Hesperocosa sp. | 0 | 0 | 1 | 0 |
| Pardosa | Pardosa sp. | 39 | 159 | 150 | 70 | |
| Rabidosa | Rabidosa sp. | 12 | 14 | 17 | 16 | |
| Sosippus | Sosippus sp. | 0 | 2 | 0 | 0 | |
| Tigrosa | Tigrosa sp. | 1 | 3 | 2 | 0 | |
| Trochosa | Trochosa sp. | 0 | 0 | 0 | 1 | |
| GenND | ——————- | 1 | 0 | 4 | 11 | |
| Tabla 2. Continúa | ||||||
| Localidad | ||||||
| Familia | Género | Morfoespecie | vieja | mediana | joven | original |
| Mimetidae* | Mimetus | Mimetus sp. | 0 | 1 | 1 | 0 |
| Oonopidae | Escaphiella | Escaphiella aff. pocone | 1 | 0 | 0 | 3 |
| Noonops | Noonops aff. minutus | 1 | 0 | 0 | 2 | |
| Opopaea | Opopaea aff. concolor | 1 | 0 | 1 | 1 | |
| GenND | ——————- | 2 | 0 | 2 | 2 | |
| Oxyopidae | Hamataliwa | Hamataliwa sp. | 0 | 0 | 0 | 20 |
| Oxyopes | Oxyopes sp. | 5 | 15 | 16 | 24 | |
| GenND | —————— | 1 | 3 | 1 | 8 | |
| Philodromidae | Thanatus | Thanatus sp. | 1 | 0 | 1 | 2 |
| Tibelllus | Tibellus aff. chamberlini | 0 | 0 | 1 | 0 | |
| GenND | —————— | 0 | 1 | 0 | 2 | |
| Pholcidae | GenND | —————— | 1 | 1 | 0 | 0 |
| Salticidae | Chinattus | Chinattus sp. | 0 | 2 | 0 | 0 |
| Corythalia | Corythalia aff. barbipes | 61 | 0 | 8 | 0 | |
| Eris | Eris sp. | 0 | 1 | 1 | 0 | |
| Habronattus | Habronattus aff. mexicanus | 35 | 66 | 74 | 5 | |
| Habronattus sp. | 2 | 4 | 7 | 0 | ||
| Lyssomanes | Lyssomanes sp. | 0 | 3 | 2 | 1 | |
| Metaphidippus | Metaphidippus sp. | 0 | 0 | 0 | 1 | |
| Mexigonus | Mexigonus aff. dentichelis | 57 | 6 | 20 | 2 | |
| Neonella | Neonella sp. | 0 | 1 | 1 | 2 | |
| Peckhamis | Peckhamia aff. picata | 3 | 1 | 2 | 3 | |
| Pellenes | Pellenes sp. | 1 | 4 | 4 | 1 | |
| Phanias | Phanias sp. 1 | 1 | 0 | 0 | 2 | |
| Phanias sp. 2 | 0 | 1 | 0 | 0 | ||
| Synemosyna | Synemosyna aff. americana | 0 | 5 | 9 | 0 | |
| Zygoballus | aff. Zygoballus sp. | 0 | 0 | 0 | 4 | |
| GenND | ——————- | 12 | 6 | 13 | 43 | |
| Scytodidae | Scytodes | Scytodes aff. fusca | 189 | 61 | 95 | 11 |
| Tetragnathidae | GenND | ——————- | 0 | 1 | 2 | 1 |
| Theridiidae | Anelosimus | Anelosimus sp. | 1 | 9 | 9 | 3 |
| Latrodectus | Latrodectus sp. | 0 | 3 | 5 | 0 | |
| Romphaea | Romphaea sp. | 0 | 0 | 0 | 1 | |
| Theridion | Theridion sp. | 49 | 99 | 206 | 31 | |
| Thyomoites | Thymoites sp. | 0 | 0 | 1 | 0 | |
| GenND | ——————- | 12 | 35 | 33 | 19 | |
| Thomisidae | Mecaphesa | Mecaphesa sp. | 0 | 0 | 0 | 25 |
| Misumenoides | Misumenoides sp. | 0 | 0 | 0 | 44 | |
| Misumenops | Misumenops sp. | 0 | 0 | 0 | 2 | |
| Tabla 2. Continúa | ||||||
| Localidad | ||||||
| Familia | Género | Morfoespecie | vieja | mediana | joven | original |
| Tmarus | Tmarus sp. | 1 | 0 | 0 | 25 | |
| Xysticus | Xysticus sp. | 0 | 27 | 7 | 4 | |
| GenND | —————— | 1 | 4 | 3 | 36 | |
| Uloboridae | Zosis | Zosis sp. | 0 | 1 | 0 | 0 |
| GenND | —————— | 3 | 0 | 0 | 0 | |
| Zoropsidae | GenND | —————— | 17 | 4 | 4 | 4 |
| Abundancia total | 601 | 714 | 917 | 552 |
* = Familia representada únicamente por morfoespecies; GenND = organismos demasiado inmaduros para su determinación a nivel de género.
Como se observa en la figura 3, poco más de 50% de la abundancia de todas las localidades, se encuentra concentrada en 3 familias: Theridiidae con 957 arañas (22.35%), Filistatidae con 663 arañas (15.49%) y Pholcidae con 599 arañas (13.99%). La abundancia registrada en los fraccionamientos sin considerar los ejemplares recolectados en la vegetación aledaña se obtuvieron 3,084 arañas, lo que representa la segunda abundancia más grande de arañas recolectadas en ambientes urbanos para el país, después de Rodríguez-Rodríguez et al. (2015), quienes recolectaron 3,900 ejemplares (tabla 1).
Tabla 3
Riqueza de arañas en los 4 fraccionamientos (localidad urbana) y la vegetación aledaña (localidad original) en el poniente de la ciudad de Morelia, Michoacán, México.
| Localidad | Familia | Género | especie |
| Original | 19 | 39 | 44 |
| Urbana1 | 23 | 44 | 48 |
| vieja | 13 | 31 | 34 |
| mediana | 18 | 38 | 41 |
| joven | 20 | 39 | 42 |
| Total2 | 23 | 48 | 54 |
1 = Los 3 fraccionamientos juntos; 2 = incluye fraccionamientos y vegetación aledaña.
Con el análisis de similitudes entre comunidades (Anosim) se determinó que no existe diferencia estadística en la composición de especies y su abundancia entre los fraccionamientos por efecto del tiempo que llevan de haber sido construidas (R = 0.003; p = 0.275) (tabla 5). Sin embargo, se puede apreciar la tendencia a ser cada vez más distintos de la vegetación original conforme aumenta el tiempo de construcción de las localidades urbanas, pues se encontraron diferencias estadísticas de abundancia por especie entre la localidad vieja y la joven (p = 0.028) y la original (p = 0.049) utilizando pruebas pareadas no paramétricas (método de Mann-Whitney; tabla 6).
Tabla 4
Valores de probabilidad de Ji-cuadrada (χ2) entre conjuntos habitacionales (vieja, mediana, joven) y vegetación aledaña (original) en el poniente de la ciudad de Morelia, Michoacán, México.
| Localidad | ||||
| vieja | mediana | joven | original | |
| vieja | ||||
| mediana | 0.0037 | |||
| joven | 0.0035 | 0.548 | ||
| original | 7.75E-07 | 1.24E-05 | 1.87E-06 |
Tabla 5
Valores de probabilidad del análisis de similitudes (Anosim) entre conjuntos habitacionales (vieja, mediana, joven) y vegetación aledaña (original) en el poniente de la ciudad de Morelia, Michoacán, México.
| Localidad | ||||
| vieja | mediana | joven | original | |
| vieja | ||||
| mediana | 0.223 | |||
| joven | 0.107 | 0.902 | ||
| original | 0.052 | 0.795 | 0.859 |
Valores de Anosim (R = 0.003; p = 0.275).
Tabla 6
Valores de probabilidad de la prueba no paramétrica de Mann-Withney entre conjuntos habitacionales (vieja, mediana, joven) y vegetación aledaña (original) en el poniente de la ciudad de Morelia, Michoacán, México.
| Localidad | ||||
| vieja | mediana | joven | original | |
| vieja | ||||
| mediana | 0.13 | |||
| joven | 0.028 | 0.424 | ||
| original | 0.049 | 0.586 | 0.8 |
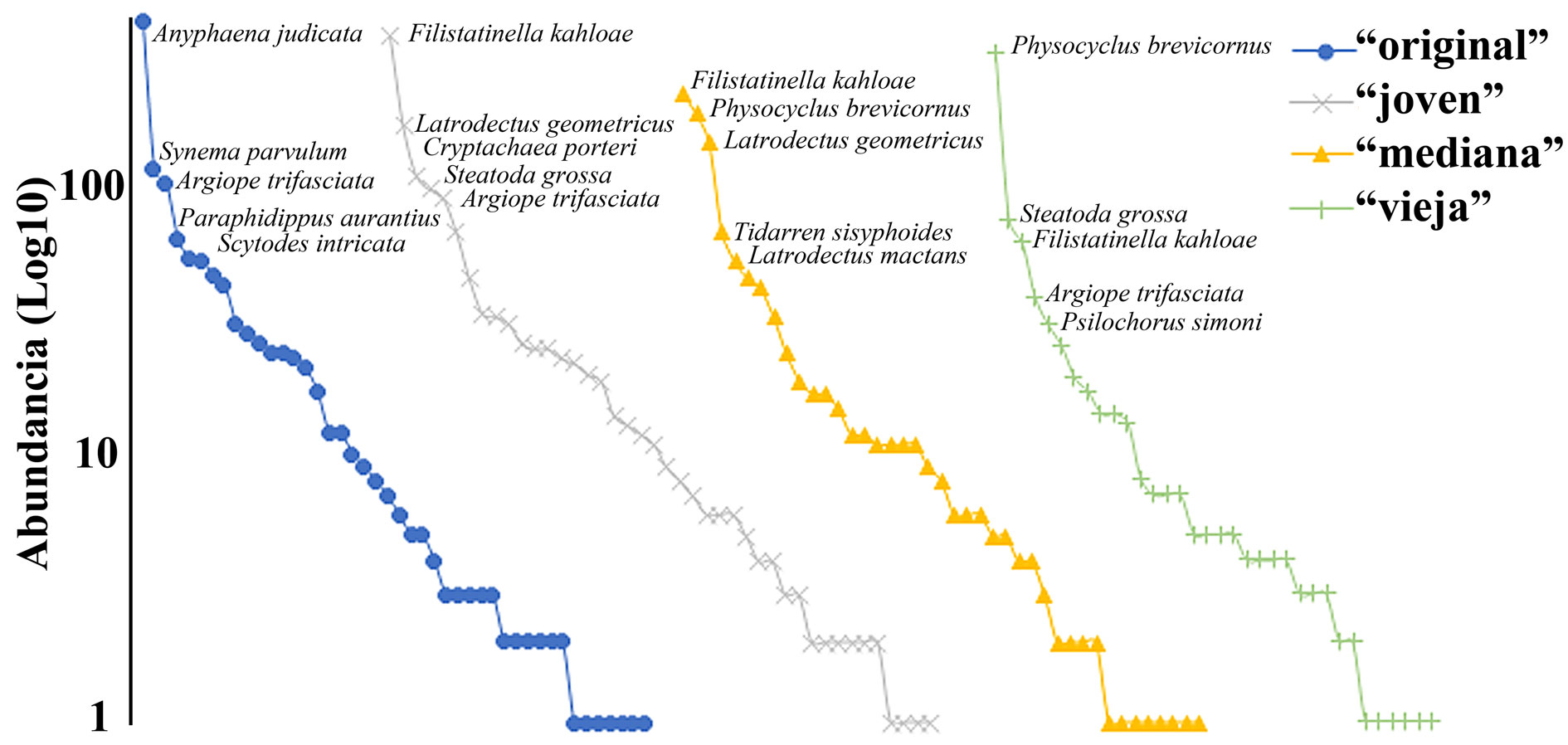
Las especies más abundantes variaron en las diferentes localidades muestreadas, como puede apreciarse en la figura 4. En la localidad original, Anyphaena judicata O. Pickard-Cambridge, 1896 (Anyphaenidae) con 412 arañas (34.42%) fue la especie más abundante; mientras que Filistatinella kahloae Magalhaes y Ramírez, 2017 (Filistatidae) con 374 (27.77%) y 226 (21.75%) arañas, fue la más abundante en las localidades joven y mediana, respectivamente; por último Physocyclus brevicornus Valdez-Mondragón, 2010 (Pholcidae) con 309 arañas (44.27%), fue la de mayor abundancia en la localidad vieja. Los detalles de las abundancias para cada especie en cada localidad muestreada se encuentran en la tabla 1 y la distribución de las dominancias en la curva de rango-especie, se muestra en la figura 4.
Discusión
McIntyre (2000) menciona que no existe un método estándar para los estudios de los artrópodos en los ambientes urbanos, lo que explica la variación de riquezas en los diferentes estudios en México, ya que en algunos se realizaron recolectas esporádicas y no sistematizadas (Durán-Barrón et al., 2009); mientras que en otros fueron sistematizadas (Desales-Lara et al., 2013; Jiménez, 1998; Maldonado-Carrizales et al., 2018; Rodríguez-Rodríguez et al., 2015; Salazar-Olivo y Solís-Rojas, 2015), mismas que variaron en el esfuerzo de la recolecta de las arañas.
La diferencia en la composición de la riqueza de especies en los trabajos de arañas en ambientes urbanos en México también se explica por la ubicación geográfica de las áreas estudiadas, pues en cada una se presentan una combinación de factores ambientales y biológicas únicos, los cuales son importantes para la estructura de las comunidades (Desales-Lara et al., 2013; Jiménez, 1998; Maldonado-Carrizales et al., 2018; Rodríguez-Rodríguez et al., 2015; Salazar-Olivo y Solís-Rojas, 2015). Sin embargo, se pueden identificar algunos patrones como por ejemplo, el que las familias Theridiidae y Salticidae suelen encontrarse entre las más ricas en estos ambientes en México, lo cual también ocurrió en este trabajo (Durán-Barrón et al., 2009; Maldonado-Carrizales et al., 2018; Rodríguez-Rodríguez et al., 2015; Salazar-Olivo y Solís-Rojas, 2015). Ambas familias presentan una gran diversidad en todo el mundo, con gran variedad morfológica, comportamientos complejos, especialización en captura de presas y la capacidad de realizar ballooning para dispersarse, lo que les permite desplazarse grandes distancias usando el aire y un hilo de seda para ello, lo cual les permite llegar a nuevas áreas, incluidas las zonas urbanizadas como los fraccionamientos, los cuales representan ambientes nuevos y por tanto son objeto de colonización (Agnarsson, 2004; Bidegaray-Batista et al., 2017; Richardson et al., 2006). Las diferentes actividades antrópicas como el continuo desplazamiento de los habitantes de las viviendas, el movimiento de productos para alimentación y mantenimiento de las viviendas, y transporte entre otras, son también un factor que pude explicar la presencia de estas familias en los ambientes urbanizados.

De acuerdo con trabajos previos, se ha demostrado que el bosque tropical caducifolio es rico en diversidad de arañas, por lo que al ser ésta la vegetación sobre la que se urbanizó, incluso siendo vegetación secundaria, podría explicar la alta riqueza encontrada tanto de familias como de géneros y especies (Castelo-Calvillo, 2000; Pinkus-Rendón et al., 2006; Valdez-Mondragón, 2006). Además, sería también esperable que la mayor parte de las especies se encuentren compartidas, como sucedió y se aprecia en la tabla 1, donde se resaltan en negritas los cambios importantes en la abundancia de especies entre la vegetación original y las localidades con diferentes edades de construcción.
Éste es el primer trabajo en el que se evalúa el efecto del cambio en uso de suelo para urbanización sobre la riqueza de la araneofauna, tomando como referente la vegetación vecina al área modificada. También es el primero en el que se documentan los pequeños cambios en composición y abundancia de especies acorde con el tiempo que llevan construidas las viviendas de los conjuntos habitacionales. En este trabajo también se reportan los efectos sobre la abundancia de varias especies; por ejemplo, Anyphaena judicata (Anyphaenidae) y los aranéidos Araneus pegnia (Walckenaer, 1841) y Argiope trifasciata (Forsskål, 1775) cuyas poblaciones altamente abundantes en la vegetación original, mantienen su presencia en los diferentes conjuntos habitacionales pero en abundancias claramente menores (tabla 1), debido fundamentalmente a la eliminación de arbustos , lo que disminuye sus posibilidades de construir sus redes orbitales; incluso la especie Araneus pegnia ya no se encontró en la localidad con 17 años de haber sido urbanizada; igual ocurre con Argiope trifasciata, aunque ésta es capaz de usar vegetación al interior de las áreas urbanizadas o incluso algunas estructuras artificiales para construir sus redes.
En el caso de Anyphaena judicata y 2 especies de la familia Thomisidae del género Synema, son arañas cazadoras activas sobre el follaje de la vegetación y evidentemente se ven afectadas con la reducción drástica de su hábitat natural (Campbell et al., 2019; Dondale y Redner, 1982).
Por lo anterior, la cercanía con la vegetación nativa, las áreas verdes internas en los desarrollos habitacionales, así como los parques y/o jardines son importantes para las comunidades de arañas, pues como ya anteriormente se había mencionado por otros autores (Desales-Lara et al., 2013; Rodríguez-Rodríguez et al., 2015), la vegetación puede proveer de alimento y refugio para aquellas arañas que posteriormente logran establecerse en los ambientes urbanos, influyendo en su diversidad y/o abundancia
A otras especies cazadoras, que en el ambiente natural viven bajo hojarasca o bajo troncos y piedras, como Scytodes intricata Banks, 1909 (Scytodidae), les es difícil adecuarse a las nuevas condiciones con mucho menos refugios y áreas de caza; no obstante, en este trabajo se encontró a esta especie en muy baja abundancia en rocas porosas cerca de las casas y en la base de las paredes exteriores de las viviendas, lo que corrobora que cuando se encuentra en áreas urbanas, son las paredes exteriores en donde se encuentran (Valerio, 1981). Paraphidippus aurantius (Lucas, 1833), de la familia Salticidae, es una araña relativamente grande (8-12 mm), cazadora activa que puede comer animales de mayor tamaño que ellas (Kaston, 1973; Robinson y Valerio, 1977), que en la localidad con la vegetación original se encontró abundante, no así en los sitios urbanizados, lo que denota el efecto del ambiente en la disminución de presas disponibles para estos organismos.
Los métodos de recolecta utilizados para la obtención de las arañas en este trabajo, representan otro factor que influyó en la elevada riqueza específica registrada, pues fueron mayores en comparación con otros trabajos de recolectas sistematizadas en ambientes urbanos (Cupul-Magaña y Navarrete-Heredia, 2008; Desales-Lara et al., 2013; Jiménez, 1998; Maldonado-Carrizales et al., 2018; Rodríguez-Rodríguez et al., 2015), a excepción del de Salazar-Olivo y Solís-Rojas (2015), quienes reportaron 59 especies.
En el presente trabajo se siguió la recomendación de Ponce-Saavedra et al. (2019), quienes sugieren que el uso de diferentes técnicas de recolecta en los ambientes urbanizados ayuda a una mejor representación de la riqueza y abundancia al incrementar la posibilidad de captura de especies raras o poco abundantes. Además de la recolecta directa, se colocaron trampas “pit-fall” o de caída para tener oportunidad de capturar arañas de hábitos nocturnos. El uso de la técnica de golpeo en arbustos ayudó también para colectar aquellas arañas con microhábitat específicos en la vegetación. Este esfuerzo de muestreo se reflejó en el presente trabajo, con un incremento de 8% en el conocimiento sobre la biodiversidad de arañas en Michoacán, aumentando de 261 a 283 especies hasta ahora (Valdez-Mondragón, 2019), sin considerar 8 familias y 60 géneros de los cuáles no se tuvieron adultos para la determinación específica.
Respecto a algunas especies de arañas encontradas en los ambientes urbanos y su denominación como sinantrópicas, es necesario realizar otros estudios en diferentes zonas urbanas para determinar sus capacidades de adecuación a los ambientes antrópicos, ya que en este estudio la presencia de las diferentes especies en las áreas antropizadas puede ser influencia de su cercanía con la vegetación aledaña.
Argañaraz y Gleiser (2017) demostraron que existen diferencias entre sitios con las mismas características de hábitat, debido a los factores locales que pueden ser relevantes para la conformación de las comunidades de arañas. En este trabajo, entre los fraccionamientos hay diferencias físicas (material de construcción de las viviendas) y biológicas (estructura de la vegetación y la actividad humana) que genera una estructuración ambiental diferente, lo que pudiera ser la causa de la variación abrupta en las abundancias encontradas para las especies registradas (Varet et al., 2013).
La mayor abundancia de inmaduros en las localidades urbanas se debe a que algunas arañas en este estadio se dispersan hacia un punto alejado de sus progenitores para establecerse en otro sitio de manera terrestre o aérea (Foelix, 2011; Nentwig et al., 2019) y los conjuntos habitacionales recién construidos representan un ambiente nuevo abierto a la colonización (Emlen, 1974). De esta manera, es esperable una gran abundancia de arañas en estados inmaduros que se conocen como buenas colonizadoras de ambientes urbanos como Physocyclus brevicornus y Psilochorus simoni (Berland, 1911), de la familia Pholcidae y Filistatinella kahloae (Filistatidae) que son muy raras en la vegetación original y comunes en los sitios urbanizados (Varet et al., 2013), con importantes abundancias de inmaduros. Una gran proporción de arañas inmaduras no logran llegar a la etapa adulta, debido a que son depredadas o bien no resisten las nuevas condiciones y mueren (Turnbull, 1973), lo que explicaría la presencia de especies encontradas en abundancias muy bajas como adultas y altas poblaciones de inmaduros en los ambientes urbanizados.
Varias especies del género Physocyclus (Pholcidae) están asociadas a los ambientes urbanos, se les encuentra en lugares oscuros, cálidos, con pocas corrientes de aire y con poca perturbación, incluso una de las especies del género es cosmopolita (Physocyclus globosus) (Valdez-Mondragón, 2010). Esta combinación de factores se encuentra en el interior de los domicilios, lo que explica que en este trabajo se encontrara una alta abundancia de P. brevicornus en las partes superiores de las paredes, cerca del techo y a lo largo del año, lo que sugiere que esta especie se establece con facilidad.
La elevada abundancia de Filistatinella kahloae (Filistatidae) en las localidades joven y mediana podría deberse a su tamaño pequeño, entre 2 y 2.6 mm (Magalhaes y Ramírez, 2017), que les permite esconderse fácilmente entre las imperfecciones de las construcciones humanas y cumplir su ciclo de vida con éxito.
La composición de especies en un período de 11-20 años no es muy diferente con respecto a la vegetación original; sin embargo las abundancias sí muestran el efecto del cambio de uso del suelo, pudiendo detectarse usando técnicas como el análisis de similitudes (Anosim), como ocurrió en este trabajo, en el que se puede apreciar una tendencia más o menos clara hacia la disminución en las abundancias de muchas especies registradas en la vegetación (tabla 1).
La urbanización afecta de manera positiva y negativa a las comunidades de arañas, generalmente disminuyendo su riqueza y aumentando la abundancia, por efecto de unas cuantas especies dominantes, generalmente diferentes a las que dominan en los ambientes naturales, lo que en este trabajo se aprecia claramente en el gráfico de especies-rango de la figura 4 (Maldonado-Carrizales y Ponce-Saavedra, 2017; Zolotarev y Belskaya, 2015).
Este trabajo representa el primero para el país donde se considera un mismo tipo de urbanización y se analiza el efecto del tiempo de construcción de las casas habitación, sobre la riqueza y abundancia de las arañas. La tendencia en diferencia estadística sugiere que hay un efecto en la riqueza y abundancia de especies de arañas en un mismo tipo de urbanización por efecto del tiempo de construcción de las viviendas, disminuyendo las abundancias de especies bien representadas en la vegetación original a medida que aumenta la edad de las urbanizaciones. También es apreciable la presencia de especies poco representadas en la vegetación y con abundancias elevadas en las áreas urbanizadas, lo que apunta hacia especies que llegan de otros sistemas vecinos a los fraccionamientos (tabla 5).
Usualmente, los estudios sobre biodiversidad descartan el uso de los estados inmaduros debido a lo complicado o prácticamente imposible que puede llegar a ser la identificación (Coddington et al., 1996; Dobyns, 1997; Sørensen et al., 2002; Toti et al., 2000), lo que genera que sea importante la proporción de capturas que no se incluyen en los análisis y resultados, en nuestro caso, un poco más de 30%; por lo que tener inventarios con faltantes no es raro, además de que el número de especies raras y poco abundantes suele ser alto; también es común, que en trabajos que pretenden inventariar arañas, no se consiga registrar la totalidad de las especies (Jiménez-Valverde y Hortal, 2003; New, 1999).
Jiménez-Valverde y Lobo (2006) mencionan que al realizar un análisis tomando en cuenta a los adultos e inmaduros identificados como morfoespecies, se obtiene un mejor entendimiento en la composición de las comunidades estudiadas; a pesar de ello, un elevado número de morfoespecies puede generar información poco confiable, razón por la que en este trabajo no fueron considerados.
En general, al comparar las capturas en los 3 conjuntos habitacionales como una muestra vs. lo obtenido en la vegetación original, se podría interpretar que la urbanización favorece una mayor riqueza, ocultando el cambio gradual que se observa al comparar con el efecto del tiempo y las diferencias en composición de especies que se presentan a medida que son mayores los tiempos de construcción de las viviendas, tal como se documenta en este trabajo y que permite apoyar la sugerencia de que para futuros trabajos, éste sea un factor a analizar.
Agradecimientos
El primer autor quiere agradecer a Consejo Nacional de Ciencia y Tecnología (Conacyt) por la beca asignada para la realización de estudios en el Programa Institucional de Maestría en Ciencias Biológicas de la Universidad Michoacana de San Nicolás de Hidalgo (UMSNH). Al Programa Institucional de Maestría en Ciencias Biológicas de la Universidad Michoacana de San Nicolás de Hidalgo, por la formación académica durante la investigación, al comité sinodal de la maestría por su valiosa contribución, comentarios y sugerencias para la realización de este trabajo. Se agradece también a las personas y vecinos de los fraccionamientos de la ciudad de Morelia donde se realizó el trabajo, por la confianza que brindaron para la recolecta de las arañas.
Apéndice 1. Abundancia de los estados (hembra, macho e inmaduros) de las especies de arañas encontradas por localidad en el poniente de la ciudad de Morelia, Michoacán, México.
| vieja | mediana | joven | original | ||||||||||
| Familia | Género y especie | ♀♀ | ♂♂ | Juv | ♀♀ | ♂♂ | Juv | ♀♀ | ♂♂ | Juv | ♀♀ | ♂♂ | Juv |
| Anyphaenidae | Anyphaena judicata | 0 | 0 | 5 | 2 | 1 | 16 | 3 | 3 | 19 | 47 | 13 | 352 |
| Araneidae | Araneus pegnia | 0 | 0 | 0 | 3 | 1 | 2 | 1 | 0 | 2 | 3 | 1 | 49 |
| Argiope trifasciata | 10 | 1 | 27 | 9 | 1 | 36 | 11 | 7 | 74 | 9 | 38 | 56 | |
| Cyclosa walckenaeri | 2 | 0 | 1 | 3 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 2 | |
| Metepeira spinipes | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | |
| Micrathena gracilis | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | |
| Neoscona oaxacencis | 4 | 1 | 2 | 3 | 0 | 8 | 3 | 0 | 31 | 12 | 0 | 16 | |
| Apéndice 1. Continúa | |||||||||||||
| vieja | mediana | joven | original | ||||||||||
| Familia | Género y especie | ♀♀ | ♂♂ | Juv | ♀♀ | ♂♂ | Juv | ♀♀ | ♂♂ | Juv | ♀♀ | ♂♂ | Juv |
| Cheirachanthiidae | Cheiracanthium mildei | 0 | 0 | 3 | 3 | 1 | 5 | 7 | 3 | 15 | 3 | 2 | 38 |
| Corinnidae | Creugas gulosus | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 0 | 0 | 0 |
| Dictynidae | Mallos dugesi | 0 | 0 | 0 | 0 | 1 | 2 | 0 | 0 | 0 | 0 | 0 | 0 |
| Mallos niveus | 1 | 0 | 0 | 5 | 1 | 11 | 2 | 0 | 2 | 1 | 1 | 5 | |
| Tivyna spatula | 2 | 1 | 2 | 9 | 1 | 7 | 17 | 7 | 9 | 0 | 1 | 3 | |
| Diguetidae | Diguetia albolineata | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 5 | 0 | 7 |
| Filistatidae | Filistatinella kahloae | 17 | 5 | 39 | 54 | 18 | 154 | 82 | 23 | 269 | 0 | 0 | 2 |
| Gnaphosidae | Cesonia lugubris | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 3 | 4 | 10 | 17 |
| Haplodrassus signifer | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | |
| Linyphiidae | Frontinella pyramitela | 0 | 0 | 5 | 1 | 2 | 8 | 4 | 0 | 10 | 3 | 0 | 2 |
| Microlinyphia dana | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | |
| Oecobiidae | Oecobius annulipes | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 |
| Oonopidae | Triaeris stenaspis | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 1 | 0 | 0 |
| Oxyopidae | Peucetia viridans | 2 | 0 | 2 | 1 | 1 | 10 | 3 | 0 | 20 | 1 | 2 | 44 |
| Philodromidae | Apollophanes punctipes | 0 | 0 | 7 | 0 | 1 | 10 | 1 | 2 | 28 | 3 | 7 | 13 |
| Pholcidae | Physocyclus brevicornus | 22 | 17 | 270 | 33 | 13 | 144 | 11 | 4 | 31 | 0 | 0 | 2 |
| Psilochorus simoni | 11 | 5 | 14 | 0 | 0 | 1 | 0 | 1 | 18 | 1 | 0 | 1 | |
| Phrurolithidae | Scotinella sp. nov. | 0 | 1 | 6 | 2 | 1 | 3 | 3 | 6 | 4 | 2 | 4 | 6 |
| Salticidae | Anicius dolius | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 2 |
| Colonus hesperus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 | |
| Habronattus fallax | 4 | 5 | 5 | 0 | 8 | 3 | 0 | 5 | 4 | 2 | 4 | 2 | |
| Menemerus bivitattus | 0 | 1 | 7 | 4 | 3 | 26 | 0 | 1 | 19 | 0 | 0 | 1 | |
| Messua tridentata | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Paraphidippus aurantius | 2 | 1 | 1 | 1 | 0 | 14 | 0 | 1 | 6 | 5 | 8 | 51 | |
| Pelegrina variegata | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 7 | 2 | 15 | |
| Phidippus pompatus | 0 | 0 | 3 | 0 | 1 | 1 | 4 | 2 | 6 | 0 | 0 | 6 | |
| Sassacus barbipes | 0 | 1 | 1 | 0 | 1 | 1 | 0 | 0 | 1 | 1 | 0 | 8 | |
| Sassacus cyaneus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | |
| Sassacus paiutus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | |
| Sassacus vitis | 1 | 1 | 2 | 0 | 2 | 2 | 1 | 1 | 4 | 1 | 0 | 16 | |
| Synageles mexicanus | 1 | 6 | 6 | 4 | 4 | 4 | 2 | 0 | 4 | 0 | 0 | 0 | |
| Scytodidae | Scytodes intricata | 1 | 0 | 0 | 0 | 0 | 0 | 2 | 4 | 2 | 9 | 6 | 39 |
| Tetragnathidae | Leucauge argyrobapta | 3 | 1 | 10 | 1 | 1 | 6 | 0 | 1 | 5 | 19 | 0 | 5 |
| Tetragnatha laboriosa | 0 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 5 | 0 | 1 | 2 | |
| Theridiidae | Cryptachaea porteri | 0 | 0 | 4 | 6 | 1 | 17 | 39 | 9 | 63 | 0 | 0 | 3 |
| Emertonella emertoni | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Euryopis lineatipes | 1 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 2 | |
| Latrodectus geometricus | 1 | 1 | 15 | 1 | 7 | 140 | 9 | 13 | 149 | 0 | 0 | 1 | |
| Latrodectus mactans | 10 | 1 | 8 | 4 | 5 | 44 | 19 | 8 | 42 | 0 | 0 | 3 | |
| Apéndice 1. Continúa | |||||||||||||
| vieja | mediana | joven | original | ||||||||||
| Familia | Género y especie | ♀♀ | ♂♂ | Juv | ♀♀ | ♂♂ | Juv | ♀♀ | ♂♂ | Juv | ♀♀ | ♂♂ | Juv |
| Paratheridula perniciosa | 0 | 0 | 0 | 5 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | |
| Steatoda grossa | 10 | 0 | 64 | 5 | 0 | 37 | 8 | 5 | 86 | 1 | 1 | 3 | |
| Tidarren sisyphoides | 1 | 1 | 3 | 6 | 8 | 55 | 4 | 5 | 17 | 0 | 0 | 0 | |
| Thomisidae | Synema parvulum | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 2 | 33 | 2 | 80 |
| Synema viridans | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 25 | |
| Trachelidae | Meriola decepta | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 |
| Uloboridae | Uloborus segregatus | 0 | 0 | 0 | 2 | 0 | 4 | 1 | 1 | 9 | 2 | 0 | 8 |
| Zoropsidae | Zorocrates fuscus | 4 | 0 | 21 | 0 | 0 | 5 | 0 | 0 | 22 | 3 | 2 | 16 |
| Abundancia total por estado | 112 | 51 | 535 | 171 | 89 | 779 | 245 | 118 | 984 | 184 | 107 | 906 | |
| Abundancia total | 698 | 1,039 | 1,347 | 1,197 |
♀♀: Hembras; ♂♂: machos; Juv: inmaduros.
Referencias
Agnarsson, I. (2004). Morphological phylogeny of cobweb spiders and their relatives (Araneae, Araneoidea, Theridiidae). Zoological Journal of the Linnean Society, 141, 447–626. https://doi.org/10.1111/j.1096-3642.2004.00120.x
Argañaraz, C. I. y Gleiser, R. M. (2017). Does urbanization have positive or negative effects on Crab spider (Araneae: Thomisidae) diversity? Zoologia, 34, 1–8. https://doi.org/10.3897/zoologia.34.e19987
Barnosky, A. D., Hadly, E. A., Bascompte, J., Berlow, E. L., Brown, J. H., Fortelius, M. et al. (2012). Approaching a state shift in Earth’s biosphere. Nature, 486, 52–58. https://doi.org/10.1038/nature11018
Bidegaray-Batista, L., Arnedo, M., Carlozzi, A., Jorge, C., Pliscoff, P., Postiglioni, R. et al. (2017). Dispersal strategies, genetic diversity, and distribution of two wolf spiders (Araneae, Lycosidae): potential bio-indicators of ecosystem health of coastal dune habitats of South America. En C. Viera y M. O. Gonzaga (Eds.), Behaviour and ecology of spiders. Contributions from the Neotropical Region (pp. 109–135). Cham: Springer International Publishing. https://doi.org/10.1007/978-3-319-65717-2_5
Cabrera-Espinosa, L. A. y Valdez-Mondragón, A. (2019). El género de arañas “viudas negras” Latrodectus (Araneae: Theridiidae) en México, ¿qué se conoce hasta ahora sobre su distribución? Boletín de la Asociación Mexicana de Sistemática de Artrópodos, 3, 15–21.
Campbell, J. W., Milne, M., Dinh, B. T., Daniels, J. C. y Ellis, J. D. (2019). Spider (Araneae) abundance and species richness comparison between native wildflower plantings and fallow controls in intensively managed agricultural areas. Arthropod–Plant Interactions, 14, 263–274. https://doi.org/10.1007/s11829-019-09725-9
Castelo-Calvillo, J. L. (2000). Diversidad de Salticidae (Arachnida: Araneae) en una localidad de la selva baja caducifolia del sur de Jalisco, México (Tesis). Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México. México D.F.
Coddington, J. A., Young, L. H. y Coyle, F. A. (1996). Estimating spider species richness in a southern Appalachian cove hardwood forest. Journal of Arachnology, 24, 111–128.
Cupul-Magaña, F. G. y Navarrete-Heredia, J. L. (2008). Artropodofauna de las viviendas de Puerto Vallarta, Jalisco, México. Ecología Aplicada, 7, 187−190.
Cursach, J. A., Rau, J. R., Ther, F., Vilugrón, J. y Tobar, C. N. (2012). Sinantropía y conservación marina: el caso del chungungo Lontra felina en el sur de Chile. Revista de Biología Marina y Oceanografía, 47, 593–597. http://dx.doi.org/10.4067/S0718-19572012000300022
Desales-Lara, M. A., Francke, O. F. y Sánchez-Nava, P. (2013). Diversidad de arañas (Arachnida: Araneae) en hábitats antropogénicos. Revista Mexicana de Biodiversidad, 84, 291−305. http://dx.doi.org/10.7550/rmb.31708
Dobyns, J. R. (1997). Effects of sampling intensity on the collection of spider (Araneae) species and the estimation of species richness. Environmental Entomology, 26, 150–162. https://doi.org/10.1093/ee/26.2.150
Dondale, C. D. y Redner, J. H. (1982). The sac spiders of Canada and Alaska, Araneae: Clubionidae and Anyphaenidae. The insects and arachnids of Canada. Agriculture Canada Publication, 1724, 1−194.
Durán-Barrón, C. G., Francke, O. F. y Pérez-Ortiz, T. M. (2009). Diversidad de arañas (Arachnida: Araneae) asociadas con viviendas de la ciudad de México (Zona Metropolitana). Revista Mexicana de Biodiversidad, 80, 55−69. http://dx.doi.org/10.22201/ib.20078706e.2009.001.584
Emlen, J. T. (1974). An urban bird community in Tucson, Arizona: derivation, structure, regulation. Condor, 76, 184–197. https://doi.org/10.2307/1366729
Foelix, R. (2011). Biology of spiders. New York: Oxford University Press.
Fraser, J. y Frankie, G. (1986). An ecological comparison of spiders from urban and natural habitats in California. Hilgardia, 54, 1−24. https://doi.org/10.3733/hilg.v54n03p031
Hammer, Ø., Harper, A. D. y Ryan, D. P. (2001). Past: paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 4, 1−9
Jiménez, M. L. (1998). Aracnofauna asociada a las viviendas de la ciudad de La Paz, B. C. S., México. Folia Entomológica Mexicana, 102, 1−10
Jiménez-Valverde, A. y Hortal, J. (2003). Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología, 8, 151−161.
Jiménez-Valverde, A. y Lobo, J. M. (2006). Establishing reliable spider (Araneae, Araneidae and Thomisidae) assemblage sampling protocols: estimation of species richness, seasonal coverage and contribution of juvenile data to species richness and composition. Acta Oecologica, 30, 21−32. https://doi.org/10.1016/j.actao.2006.01.001
Kaston, B. J. (1973). Four new species of Metaphidippus, with notes on related jumping spiders (Araneae: Salticidae) from the eastern and central United States. Transactions of the American Microscopical Society, 92, 106−122
King, G. A. (2014). Exaptation and synanthropic insects: A diachronic interplay between biology and culture. Environmental Archaeology, 19, 12−22. https://doi.org/10.1179/1749631413Y.0000000011
MacGregor-Fors, I. (2011). Misconceptions or Misunderstandings? On the Standardization of Basic Terms and Definitions in Urban Ecology. Landscape and Urban Planning, 100, 313−314. https://doi.org/10.1016/j.landurbplan.2011.01.013
Magalhaes, I. L. F. y Ramírez, M. J. (2017). Relationships and phylogenetic revision of Filistatinella spiders (Araneae: Filistatidae). Invertebrate Systematics, 31, 665−712. https://doi.org/10.1071/IS16083
Maldonado-Carrizales, J. y Ponce-Saavedra, J. (2017). Arañas Saltarinas (Araneae: Salticidae) en dos sitios contrastantes en grado de antropización en Morelia Michoacán, México. Entomología Mexicana, 4, 597−603.
Maldonado-Carrizales, J., Quijano-Ravell, A., Guzmán-García, C. E. y Ponce-Saavedra, J. (2018). Arañas (Araneae: Araneomorphae) antrópicas de Morelia, Michoacán, México. Entomología Mexicana, 5, 22−28.
Marc, P., Canard, A. y Ysnel, F. (1999) Spiders (Araneae) useful for pest limitation and bioindication. Agriculture, Ecosystems & Environment, 74, 229−273.
Marzluff, J., Bowman, R. y Donnelly, R. (2001). Avian ecology and conservation in an urbanizing world. Boston : Kluwer Academic Publishers. https://doi.org/10.1007/978-1-4615-1531-9
McIntyre, N. E. (2000). Ecology of urban arthropods: a review and a call to action. Annals of the Entomological Society of America, 93, 825–835. https://doi.org/10.1603/0013-8746(2000)093[0825:EOUAAR]2.0.CO;2
Melic, A. (1997). Entomología urbana, Los artrópodos y el hombre. Boletín de la Sociedad Entomológica Aragonesa, 20, 293–300
Merlotto, A., Piccolo, M. C. y Bértola, G. R. (2012). Crecimiento urbano y cambios del uso/cobertura del suelo en las ciudades de Necochea y Quequén, Buenos Aires, Argentina. Revista de Geografía Norte Grande, 53, 159−176. http://dx.doi.org/10.4067/S0718-34022012000300010
Moorhead, L. C. y Philpott, S. M. (2013). Richness and composition of spiders in urban green spaces in Toledo, Ohio. Journal of Arachnology, 4, 356−363. http://dx.doi.org/10.1636/P12-44.1
Nentwig, W., Derepas, B. y Gloor, D. (2019). Diversity and origin of the spider fauna of the Indian Ocean islands. Arachnology, 18, 172−188. https://doi.org/10.13156/arac.2018.18.2.172
New, T. R. (1999). Untangling the web: spiders and the challen-ges of invertebrate conservation. Journal of Insect Conservation, 3, 251−256. https://doi.org/10.1023/A:1009697104759
Pinkus-Rendón, M. A., León-Cortés, J. L. y Ibarra-Núñez, G. (2006). Spider diversity in a tropical habitat gradient in Chiapas, Mexico. Diversity and Distributions, 12, 61–69. https://doi.org/10.1111/j.1366-9516.2006.00217.x
Ponce-Saavedra, J., Quijano-Ravell, A. F. y Valdez-Mondragón, A. (2019). Técnicas para la recolección de arañas y otros arácnidos en ambientes antrópicos. En I. Zuria, A. M. Olvera-Ramírez y P. Ramírez Bastida (Eds.). Manual de técnicas para el estudio de fauna nativa en ambientes urbanos (pp. 59−75). Santiago de Querétaro: Red Temática Conacyt: Biología, Manejo y Conservación de Fauna Nativa en Ambientes Antropizados (REFAMA).
Richardson, B. J., Zabka, M., Gray, M. R. y Milledge, G. (2006). Distributional patterns of jumping spiders (Araneae: Salticidae) in Australia. Journal of Biogeography, 33, 707–719. https://doi.org/10.1111/j.1365-2699.2005.01405.x
Robinson, M. H. y Valerio, C. E. (1977). Attacks on large or heavily defended prey by tropical salticid spiders. Psyque, 84, 1−10. https://doi.org/10.1155/1977/48480
Robinson, W. H. (2005). Urban insects and arachnids. Cambridge: Cambridge University Press https://doi.org/10.1017/CBO9780511542718
Rodríguez-Rodríguez, S. E., Solís-Catalán, K. P. y Valdez-Mondragón, A. (2015). Diversity and seasonal abundance of anthropogenic spiders (Arachnida: Araneae) in different urban zones of the city of Chilpancingo, Guerrero, Mexico. Revista Mexicana de Biodiversidad, 86, 962−971. https://doi.org/10.1016/j.rmb.2015.09.002
Salazar-Olivo, C. A. y Solís-Rojas, C. (2015). Araneofauna Urbana (Arachnida: Araneae) de Ciudad Victoria, Tamaulipas, México. Acta Zoológica Mexicana (nueva serie), 31, 55−66. https://doi.org/10.21829/azm.2015.311505
Sørensen, L. L., Coddington, J. A. y Scharff, N. (2002). Inventorying and estimating subcanopy spider diversity using semiquantitative sampling methods in an Afromontane forest. Environmental Entomology, 31, 319–330. https://doi.org/10.1603/0046-225X-31.2.319
Taucare-Ríos, A., Brescovit, A. y Canals, M. (2013). Synanthropic spiders (Arachnida: Araneae) from Chile. Revista Ibérica de Aracnología, 23, 49−56.
Toti, D. S., Coyle, F. A. y Miller, J. A. (2000). A structured inventory of Appalachian grass bald and heath bald spider assemblages and a test of species richness estimator performance. Journal of Arachnology, 28, 329–345. https://doi.org/10.1636/0161-8202(2000)028[0329:ASIOAG]2.0.CO;2
Trubl, P., Gburek, T., Miles, L. y Johnson, J. C. (2012). Black widow spiders in an urban desert: Population variation in an arthropod pest across metropolitan Phoenix, AZ. Urban Ecosystems, 15, 599−609. https://doi.org/10.1007/s11252-011-0223-2
Turnbull, A. L. (1973). Ecology of the true spiders (Araneomorphae). Annual Review of Entomology, 18, 305−348. https://doi.org/10.1146/annurev.en.18.010173.001513
Valdez-Mondragón, A. (2006). Diversidad de arañas (Arachnida: Araneae) relacionadas con Las Grutas de Juxtlahuaca, Guerrero, México (Tesis). Facultad de Ciencias, Universidad Nacional Autónoma de México. México D.F.
Valdez-Mondragón, A. (2010). Revisión taxonómica de Physocyclus Simon, 1893 (Araneae: Pholcidae), con la descripción de especies nuevas de México. Revista Ibérica de Aracnología, 18, 3−80
Valdez-Mondragón, A. (2019). Arañas araneomorfas y migalomorfas (Arachnida: Araneae). En Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Conabio) (Eds.), La biodiversidad de Michoacán. Estudio de estado 2 (pp. 385–389). Ciudad de México: Conabio.
Valdez-Mondragón, A., Cortez-Roldán, M. R., Juárez-Sánchez, A. R. y Solís-Catalán, K. P. (2018). A new species of Loxosceles Heineken & Lowe (Araneae, Sicariidae), with updated distribution records and biogeographical comments for the species from Mexico, including a new record of Loxosceles rufescens (Dufour). Zookeys, 802, 39−66. https://doi.org/10.3897/zookeys.802.28445
Valdez-Mondragón, A., Navarro-Rodríguez, C. I., Solís-Catalán, K. P., Cortez-Roldán, M. R. y Juárez-Sánchez, A. R. (2019). Under an integrative taxonomic approach: the description of a new species of the genus Loxosceles (Araneae, Sicariidae) from Mexico City. Zookeys, 892, 93−133. https://doi.org/10.3897/zookeys.892.39558
Valerio, C. E. (1981). Spitting spiders (Araneae, Scytodidae, Scytodes) from Central America. Bulletin of the American Museum of Natural History, 170, 80–89.
Varet, M., Pétillon, J., Lafage, D. y Burel, F. (2013). Age-dependent colonization of urban habitats: a diachronic approach using carabid beetles and spiders. Animal Biology, 63, 1–13. https://doi.org/10.1163/15707563-00002410
Weber, C. y Puissant, A. (2003). Urbanization pressure and modeling of urban growth: example of the Tunis Metropolitan Area. Remote Sensing of Environment, 86, 341−352. https://doi.org/10.1016/S0034-4257(03)00077-4
Wise, D. H. (1993). Spiders in ecological webs. Cambridge: Cambridge University Press. https://doi.org/10.1017/CBO9780511623431
Zar, J. H. (2010). Biostatiscal analysis. Upper Saddle River, New Jersey: Prentice-Hall/Pearson.
Zolotarev, M. P. y Belskaya, E. A. (2015). Ground-dwelling invertebrates in a large industrial city: differentiation of recreation and urbanization effects. Contemporary Problems of Ecology, 8, 83–90. https://doi.org/10.1134/S1995425515010163