Riqueza y endemismo de las especies de Clavariadelphus (Clavariadelphaceae: Gomphales) en la Faja Volcánica Transmexicana
Astrid González-Ávila a, Margarita Villegas-Ríos b, Juan Andrés Pérez-Trejo b, Raúl Contreras-Medina c e Isolda Luna-Vega a, *
a Laboratorio de Biogeografía y Sistemática, Departamento de Biología Evolutiva, Facultad de Ciencias, Circuito Exterior s/n, Ciudad Universitaria, Universidad Nacional Autónoma de México, 04510 Ciudad de México, México
b Laboratorio de Micología, Departamento de Biología Comparada, Facultad de Ciencias, Circuito Exterior s/n, Ciudad Universitaria, Universidad Nacional Autónoma de México, 04510 Ciudad de México, México
c Escuela de Ciencias, Universidad Autónoma Benito Juárez de Oaxaca, Av. Universidad s/n, 68120 Oaxaca de Juárez, Oaxaca, México
*Autor para correspondencia: luna.isolda@gmail.com; ilv@hp.fciencias.unam.mx (I. Luna-Vega)
Resumen
Se llevó a cabo un estudio de las especies de Clavariadelphus presentes en la Faja Volcánica Transmexicana (FVTM) para conocer sus patrones de riqueza y endemismo. El área de estudio fue dividida en una cuadrícula de 0.5° × 0.5° de latitud/longitud, donde fueron ubicados los 240 registros obtenidos de 14 colecciones nacionales, literatura especializada y bases de datos institucionales. Clavariadelphus truncatus es la especie con más amplia distribución. Los datos obtenidos muestran que la riqueza de especies está distribuida de forma heterogénea, siendo las zonas central y oriental de la FVTM las que concentran el mayor número de registros y de especies. El índice de complementariedad (IC) para cada combinación de cuadros resultó relativamente alto. En la FVTM son necesarios 5 cuadros para tener representada la totalidad de las especies de Clavariadelphus, todos localizados en el centro de México. El cuadro con la mayor riqueza de especies y el valor más alto de endemismo coincide con el Área Natural Protegida conocida como corredor biológico Chichinautzin-Tepozteco, Morelos-Ciudad de México-Estado de México. Se concluye que la FVTM es una zona biodiversa en especies de Clavariadelphus, concentrándose en ella el 68.4% de las especies conocidas para el mundo.
Palabras clave:
Distribución; Clavarioides; Biogeografía; Conservación
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Richness and endemism of the species of Clavariadelphus (Clavariadelphaceae: Gomphales) in the Trans-Mexican Volcanic Belt
Abstract
We present the study of the fish fauna from La Paz Bay (LPB), based on an updated checklist with notes on zoogeography, conservation and commercial value. The checklist includes 533 species, 314 genera, 123 families, 34 orders and 2 classes: Actinopterygii (467 species) and Chondrichthyes (66 species). The order Perciformes represents 56% of the total ichthyofauna, with 10 families comprising 34% of the species richness. The Cortés (82.4%) and Mexican (68.3%) provinces showed the highest fish affinity as result of the existence of a transitional zone for fishes from temperate and tropical derivation. The ichthyofauna of LPB inhabits mostly over sand-mud (38%), rocky bottoms (30%) and mangrove biotopes (29%). Based on the IUCN Red List, 84% are fish species of least concern and not evaluated, 16% corresponds to another category of risk. The NOM-059-Semarnat-2010 includes 6 teleosts under special protection and 2 threatened chondrichthians. In accordance to the IUCN, 188 species are of commercial value, but at least the artisanal fisheries in LPB catch other 82 species. This study could provide a basis for the formulation of management programs, catch rates or aquaculture projects, excluding those species no distributed in LPB, as well as along the Tropical Eastern Pacific (TEP).
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Distribution; Clavarioides; Biogeography; Conservation
Introducción
El género Clavariadelphus (Clavariadelphaceae, Gomphales) tiene una amplia distribución en las regiones templadas del mundo, con sólo algunas especies (e.g., C. truncatus, C. unicolor, C. cokeri y C. fasciculatus) que alcanzan las zonas subtropicales (Methven, 1990). Actualmente se reconocen entre 18 y 21 especies en el mundo (Kirk et al., 2008; Methven, 1990) segregadas en los subgéneros Ligulus (con esporas elipsoides, con ancho promedio menor a 2.5 µm) y Clavariadelphus (con esporas ovadas cuyo ancho promedio es mayor a 2.5 µm). La mayoría de sus especies son ectomicorrizógenas (entre el 86 y 95% de sus especies), con pocos representantes saprobios (Tedersoo y Nara, 2010).
La monofilia de Clavariadelphus no ha sido confirmada; el muestreo taxónomico en análisis filogenéticos morfológicos y moleculares ha sido poco representativo, en los que ha sido ubicado dentro del clado Gomphoide-Phalloide y en particular dentro del orden Gomphales y la familia Clavariadelphaceae (Hibbett et al., 1997, 2007; Hibbett y Thorn, 2001; Kim y Jung, 2000; Villegas et al., 1999). Tedersoo y Nara (2010) sugieren que las especies ectomicorrizógenas son monofiléticas y que las saprobias están más cercanamente relacionadas a especies no micorrizógenas del género Ramaria.
A la fecha, no existen análisis sobre los patrones de distribución geográfica de las especies de Clavariadelphus. Trabajos como los de Methven (1990), Shiryaev (2009), Tedersoo y Nara (2010) y Hanif et al. (2014) incluyen notas breves sobre la distribución de las especies de este género en zonas templadas del hemisferio norte. Para México, la información disponible proviene de listados taxonómicos elaborados para diferentes regiones del país, en los cuales se han encontrado 8 especies distribuidas preferentemente en bosques de coníferas, encinos, abetos y mesófilos de montaña, principalmente en la parte central y norte del país, en altitudes entre los 1,400 y 3,900 m (González-Ávila, Luna-Vega et al., 2013; González-Ávila, Torres-Miranda et al., 2013).
La micogeografía “Mycogeografia sensu Lichtwardt (1995)” también llamada biogeografía de los hongos, estudia y explica los patrones de distribución de los mismos. Es un campo relativamente nuevo con una historia reciente, en comparación a la de otros grupos de organismos (Baroni et al., 1997; Demoulin, 1973; Eckblad, 1981; Hibbett, 2001; Lange, 1974; Lumbsch et al., 2008; Pringle y Vellinga, 2006; Redhead, 1989; Skrede et al., 2011; Watling, 2001; Wu y Mueller, 1997). En las últimas décadas ha sido fuertemente impulsada por la sistemática molecular (Hibbett, 2001; Lumbsch et al., 2008; Pringle y Vellinga, 2006; Skrede et al., 2011; Watling, 2001).
Se deben considerar al menos 2 hechos importantes para entender la biogeografía de hongos: 1) estos organismos se desarrollan en diferentes hábitats y sustratos, por lo que ciertos factores como el tipo de suelo, régimen de lluvias, intervalos de temperatura y composición de las comunidades vegetales, entre otros, influyen en las áreas donde se encuentran, y 2) varios de ellos se asocian de forma obligada a otros organismos como parásitos o mutualistas, por lo que es de esperarse que sus patrones de distribución coincidan con los de sus hospederos u organismos asociados (Halling et al., 2008; Horak, 1983; Lichtwardt, 1995). Los hongos saprobios, que generalmente no tienen una distribución geográficamente restringida, pueden atribuir sus patrones de distribución a otros factores, como lo han sugerido Baker y Meeker (1972).
La areografía es el estudio de las áreas de distribución de taxones (Rapoport, 1975; Rapoport y Monjeau, 2001), por medio del cual se obtienen áreas de riqueza y endemismo para diferentes zonas basados en diferentes organismos. En México se han utilizado los análisis de cuadrícula para detectar riqueza y endemismo de varios grupos de organismos en función de su presencia (Contreras-Medina y Luna-Vega, 2007; González-Ávila, Torres-Miranda et al., 2013; Serrato et al., 2004).
El objetivo de este trabajo es determinar los patrones de riqueza, endemismo y distribución de las especies de Clavariadelphus en la FVTM, mismos que son relevantes en el conocimiento y entendimiento de su historia evolutiva, permitiendo generar información biogeográfica útil en la delimitación de regiones y áreas importantes de México para la conservación. Además es importante ahondar en su conocimiento, ya que se sabe poco acerca del grupo.
Materiales y métodos
La Faja Volcánica Transmexicana (FVTM) es un conjunto de volcanes alineados sobre una franja que cruza el territorio mexicano de oeste a este, desde Cabo Corrientes, Nayarit hasta la sierra de Chinconquiaco, Veracruz (Ferrusquía-Villafranca, 2007). Tiene aproximadamente 1,000 km de longitud y una amplitud irregular entre los 80 y 230 km, y las coordenadas extremas son al norte 21°38’24”, al sur 18°23’24”, al este 96°22’12” y al oeste 105°45’. Esta provincia se extiende desde las costas del Pacífico, en los estados de Nayarit (San Blas) y Jalisco (bahía de Banderas), hasta las costas del golfo de México, en Palma Sola, Veracruz (Gómez-Tuena et al., 2005). Incluye parte de los estados de Nayarit, Colima, Jalisco, Michoacán, Guanajuato, Querétaro, Hidalgo, Puebla, Veracruz y buena parte de Estado de México y Morelos, mientras que Tlaxcala y Ciudad de México quedan totalmente incluidos dentro de la FVTM.
La FVTM es un área muy compleja en origen y medio físico; en ella están presentes los volcanes más altos de México, entre los cuales están el Pico de Orizaba, Popocatépetl, Iztaccíhuatl, Nevado de Toluca, Nevado de Colima y La Malinche. La actividad volcánica que se observa en esta cordillera es producto de la interacción entre las placas tectónicas Norteamericana y de Cocos, donde ésta última se encuentra en un franco proceso de subducción bajo la primera, generando el arco volcánico continental conocido como FVTM (Ortega et al., 2000). La complejidad geológica y climática de la FVTM permite que casi todos los tipos de vegetación que se desarrollan en México estén presentes, aunque predominan los bosques de coníferas (31%) y de encino (28%). El resto está compuesto por pastizales, matorrales submontanos, bosques mesófilos de montaña (en áreas de cañadas), bosques de galería y tierras urbanas y de cultivo (Espinosa et al., 2008). Esta cordillera ha sido reconocida como centro de diversificación, endemismo y transición biogeográfica para una gran variedad de taxones, lo que la hacen una de las provincias más heterogéneas y complejas del país (Flores-Villela y Canseco-Márquez, 2007; Delgadillo et al., 2003; Morrone, 2010; Navarro-Sigüenza et al., 2007). Al igual que en otras provincias, la distribución de especies en la FVTM no es azarosa, siguiendo patrones que responden a diferentes procesos históricos y ecológicos comunes (Morrone, 2009).
Los registros de las especies de Clavariadelphus se obtuvieron de la revisión de ejemplares de los herbarios CIRB, ENCB, EBUM, FCME, FEZA, HEMIM, IBUG, IZTA, MEXU, TLMX, UJAD, CIAD, UTCV y XAL (Index Herbariorum, http:/sweetgum.nybg.org/ih), bases de datos institucionales (REMIB), revisión de literatura especializada (González-Ávila et al. 2016; Nava y Valenzuela 1997) y 8 recolecciones realizadas en campo por los autores. La determinación específica se realizó con base en la revisión de 240 ejemplares y utilizando bibliografía adecuada para este fin (Hanif et al., 2014; Methven, 1990).
Se conjuntó una base de datos del género Clavariadelphus compuesta por diferentes campos, que comprenden entre otros, nombre científico, altitud, coordenadas geográficas, tipos de vegetación, localidad, nombre común, usos, hábitat, colector, determinador y herbario de depósito del ejemplar. Para identificar los patrones de riqueza y endemismo, todos los registros fueron georreferenciados a partir de mapas topográficos de escala 1:250,000 y 1:50,000 elaborados por el Inegi (2012a, b).
El análisis de la distribución de las especies y las representaciones gráficas se realizaron por medio del software ArcView GIS versión 3.2 (ESRI, 1998). Las localidades fueron sobrepuestas en un mapa a escala 1:250,000 generado por la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Conabio, 2011). Para ello, la región de la FVTM fue dividida mediante un sistema de cuadrícula, de 0.5° × 0.5° de latitud/longitud. Para reconocer los patrones de riqueza de especies en cada sitio, las localidades en donde se ubicó a cada especie fueron sobrepuestas en la cuadrícula en la que fue dividida la FVTM.
El endemismo de las especies fue medido con base en el índice propuesto por Crisp et al. (2001) y Linder (2001), empleando el método de endemismo ponderado y el de endemismo ponderado corregido, el cual utiliza los inversos del intervalo en la distribución de las especies, mismo que fue corregido para eliminar de éste la influencia de la riqueza de especies. Es decir, si una especie se ubica en un solo cuadro, su valor máximo será de 1, en cambio, si una especie es ubicada, por ejemplo, en 4 cuadros, su peso será de 0.25 y si una especie se distribuye en 20 cuadros tendrá un peso de 0.05. Posteriormente, para obtener el valor de cada cuadro, se suman los valores de todas las especies que se encuentren en él, denominándose a este índice como “endemismo ponderado”. De esta manera se espera que cuadros con muchas especies de distribución restringida tengan valores mayores que otros con muchas especies de amplia distribución.
La obtención del valor total de cada cuadro se obtuvo sumando la ponderación de las especies presentes en ese cuadro y dividido entre el número total de especies en el cuadro, para generar así un índice conocido como “endemismo ponderado corregido” (Linder, 2001).
Los cuadros con mayor número de especies y más altos niveles de endemismo de Clavariadelphus en la FVTM se superpusieron con las Áreas Naturales Protegidas (Conanp, 2012). Los resultados obtenidos en este estudio se compararon con los de Alcántara-Ayala y Paniagua (2007), Escalante et al. (2007), Navarro-Sigüenza et al. (2007), Gámez et al. (2012) y Suárez-Mota et al. (2013), con la finalidad de evaluar si los datos obtenidos para Clavariadelphus son concordantes con otros taxones de plantas y animales.
Adicionalmente, se realizó un análisis de complementariedad, con base en la composición taxonómica de cada unidad y considerando la riqueza de especies, se determinó el número mínimo de cuadros de 0.5° × 0.5° necesarios para incluir la totalidad de especies de Clavariadelphus en la FVTM. Para ello se empleó el índice de complementariedad (IC) de Colwell y Coddington (1994) para calcular el valor de la diferencia respecto a la composición taxonómica mantenida entre cada par de cuadros mediante la fórmula:
ICAB= (a+b-2c)/(a+b-c)
donde a = número de especies en un cuadro dado A, b = número de especies en una cuadro dado B, y c = número de especies compartidas entre ambos cuadros. El valor de complementariedad varía de 0 a 1, donde 0 indica que los sitios son idénticos respecto a su composición de especies, en tanto que 1 es la complementariedad total, donde ninguna especie es compartida entre las áreas (Álvarez y Morrone, 2004; Aguilar-Aguilar y Salgado-Maldonado, 2006; Colwell y Coddington, 1994). Los cuadros que solamente presentaron una especie no fueron considerados para el análisis de complementariedad, debido a que en su mayoría se trataba de Clavariadelphus truncatus Donk 1933, una especie de amplia distribución.
Resultados
Los 240 registros de Clavariadelphus que se ubicaron en la FVTM corresponden a 11 especies diferentes; 3 de ellas al parecer son especies nuevas para la ciencia, ya que presentan diferencias morfológicas con las especies hasta ahora descritas (tabla 1). Seis de estas especies se habían registrado previamente para México (González-Ávila, Torres-Miranda et al., 2013). Clavariadelphus americanus (Corner) Methven 1989 (que había sido registrada para el este de Estados Unidos y Canadá sensu Methven, 1990) y C. caespitosus Methven 1989 (previamente registrada en el oeste de los Estados Unidos sensu Methven, 1990) son hallazgos nuevos para el país. Todas las especies revisadas provienen de bosques de coníferas, encino y mesófilo de montaña. La especie que presenta mayor cantidad de registros es C. truncatus (174 ejemplares pertenecientes a 3 diferentes variedades) y también la que tiene una distribución más amplia en la FVTM, pues se presenta en 21 cuadros; asimismo C. truncatus es la especie más citada para el país (González-Ávila, Torres-Miranda et al., 2013). Las otras especies se encontraron en 2 a 12 cuadros, mientras que 4 especies solamente se presentaron en 1 cuadro y son registros únicos; tal es el caso de C. americanus y de las 3 especies consideradas como posibles nuevas especies.
La FVTM fue dividida en 95 cuadros de 0.5° × 0.5°. En 25 de estos cuadros se registró al menos 1 especie de Clavariadelphus (fig. 1). Para ello, a cada cuadro se le asignó secuencialmente un código numérico único para su identificación. El 26.31% de los cuadros de la FVTM presentan registros de especies de Clavariadelphus.
En la figura 2 se muestra la riqueza de especies en la FVTM. El sitio con más alta riqueza de especies corresponde al cuadro 21 en donde fueron encontradas 7 especies (63.6%), que son: Clavariadelphus americanus (Corner) Methven, C. caespitosus Methven, C. fasciculatus Methven y Guzmán, C. occidentalis Methven, C. subfastigiatus V.L. Wells y Kempton, C. truncatus Donk y C. unicolor (Berk. y Ravenel) Corner principalmente en bosques de encino y bosques de coníferas en altitudes entre 2,000-3,800 m snm. Este cuadro se encuentra localizado en parte de la Ciudad de México, Estado de México y Morelos. Los siguientes cuadros con mayor riqueza de especies son el 11 y el 13 (con 6 especies) que concentran cada uno el 54.5% de las especies. Los 2 últimos cuadros únicamente difieren entre sí en que en el primero, además de C. caespitosus, C. fasciculatus, C. occidentalis, C. truncatus y C. unicolor, está presente C. cokeri V.L. Wells y Kempton, mientras que en el segundo está C. subfastigiatus. El cuadro 11 se encuentra ubicado en el estado de Michoacán, en sitios con bosques de encino y de coníferas, en altitudes entre 2,000 y 2,800 m, mientras que el cuadro 13 está ubicado en el Estado de México, en sitios con bosques de coníferas, en altitudes de 1,800 a 3,000 m. Otro cuadro importante es el 23 que concentra el 45.4% de las especies, donde se registraron C. caespitosus, C. fasciculatus, C. occidentalis, C. truncatus y C. unicolor; este cuadro abarca los estados de Tlaxcala y Puebla, en sitios con bosques de encino y de coníferas en altitudes de 2,500 a 2,900 m (tabla 2).
Tabla 1
Número de registros de las especies de Clavariadelphus en la Faja Volcánica Transmexicana
|
Especie |
Número de ejemplares registrados en la FVTM |
Altitud en m snm en la FVTM |
Tipos de vegetación en la FVTM |
Registros en otros estados |
Registros en otras partes del mundo |
|
Clavariadelphus americanus |
1 |
2,600 |
BE |
Durango y Nuevo León |
Este de EUA, Canadá |
|
C. caespitosus |
13 |
2,400-3,500 |
BE, BP, BPE, BPAE, BMM |
Ninguno |
Oeste de EUA |
|
C. cokeri |
2 |
2,000-2,700 |
BE, BPE |
Guanajuato |
EUA, Canadá |
|
C. fasciculatus |
13 |
2,500-3,400 |
BA, BP, BEP, BAP, BPE y BE |
Durango |
Ninguno |
|
C. occidentalis |
17 |
1,900-3,300 |
BP, BPE, BEP, BA y BE |
Durango |
EUA, Canadá |
|
Clavariadelphus sp. 1 |
1 |
3,900 |
BP |
Ninguno |
Ninguno |
|
Clavariadelphus sp. 2 |
1 |
2,500 |
BPE |
Ninguno |
Ninguno |
|
Clavariadelphus sp. 3 |
1 |
2,900 |
BAP |
Ninguno |
Ninguno |
|
C. subfastigiatus |
7 |
1,700-3,800 |
BAE, BPA y BE |
Guanajuato |
EUA |
|
C. truncatus |
174 |
1,700-3,900 |
BAP, BPE, |
Zacatecas, |
EUA |
|
C. truncatus var. lovejoyae C. truncatus var. truncatus C. truncatus var. umbonatus |
BEP, BA, BAEn, BAE, BPAE y BE |
Nuevo León, Guerrero Chihuahua, Chiapas, Coahuila |
EUA, Austria, Canadá, China, Checoslovaquia, Finlandia, Francia, Alemania, India, Italia, Noruega, Suecia, Suiza, norte de África, Japón |
||
|
C. unicolor |
10 |
2,400-3,100 |
BPA, BPE, BA, BE y BMM |
Tamaulipas |
EUA |
Los valores de endemismo ponderado muestran que el cuadro con mayor valor (1.732) se ubica también en el sector central de la FVTM (cuadro 21), coincidiendo con el cuadro de mayor riqueza. En este cuadro, las especies de Clavariadelphus se encuentran en bosques de coníferas y encinos en altitudes de entre 2,000 a 3,800 m, situación que permite catalogarlas como especies montanas. A diferencia de lo observado en el análisis de riqueza, el siguiente cuadro de mayor valor es el 19 con un valor de 1.316, mismo que se ubica en el centro de la FVTM (fig. 3), comprendiendo buena parte de los estados de México y Michoacán, en bosques de encino, pino-encino, abeto-pino y encino-pino, en altitudes de 1,800 a 3,500 m. El cuadro 20 tiene un valor de 1.248 y se localiza en el Estado de México, en bosques de encino, pino-encino, abeto, abeto-pino y abeto-encino, en altitudes de 1,800 a los 3,800 m.
Cuando se ponderan los valores de endemismo para eliminar la influencia de la riqueza de especies (fig. 4; tabla 2) se obtienen los valores del endemismo ponderado corregido, con lo que los resultados cambian, ya que el cuadro con el valor más alto es el 20 (0.416). Otros cuadros con valores altos son el 22 con un valor de 0.391 y el cuadro con un valor de 0.329.
El índice de complementariedad (IC) para cada combinación de cuadros resultó relativamente alto (IC > 0.5) para el 75.24% de las combinaciones (tabla 3). En la FVTM se detecta que prácticamente 13 de los 15 cuadros analizados tienen un alto índice de complementariedad con al menos otro cuadro. Los cuadros 15 y 20 tuvieron altos IC con más del 50% de los otros cuadros. Los cuadros 13 y el 21 no tuvieron índices mayores a 0.75%. En la FVTM son necesarios 5 cuadros para tener representada la totalidad de las especies de Clavariadelphus; dichos cuadros son 19, 20, 21, 22 y 11, todos localizados en el centro de México.
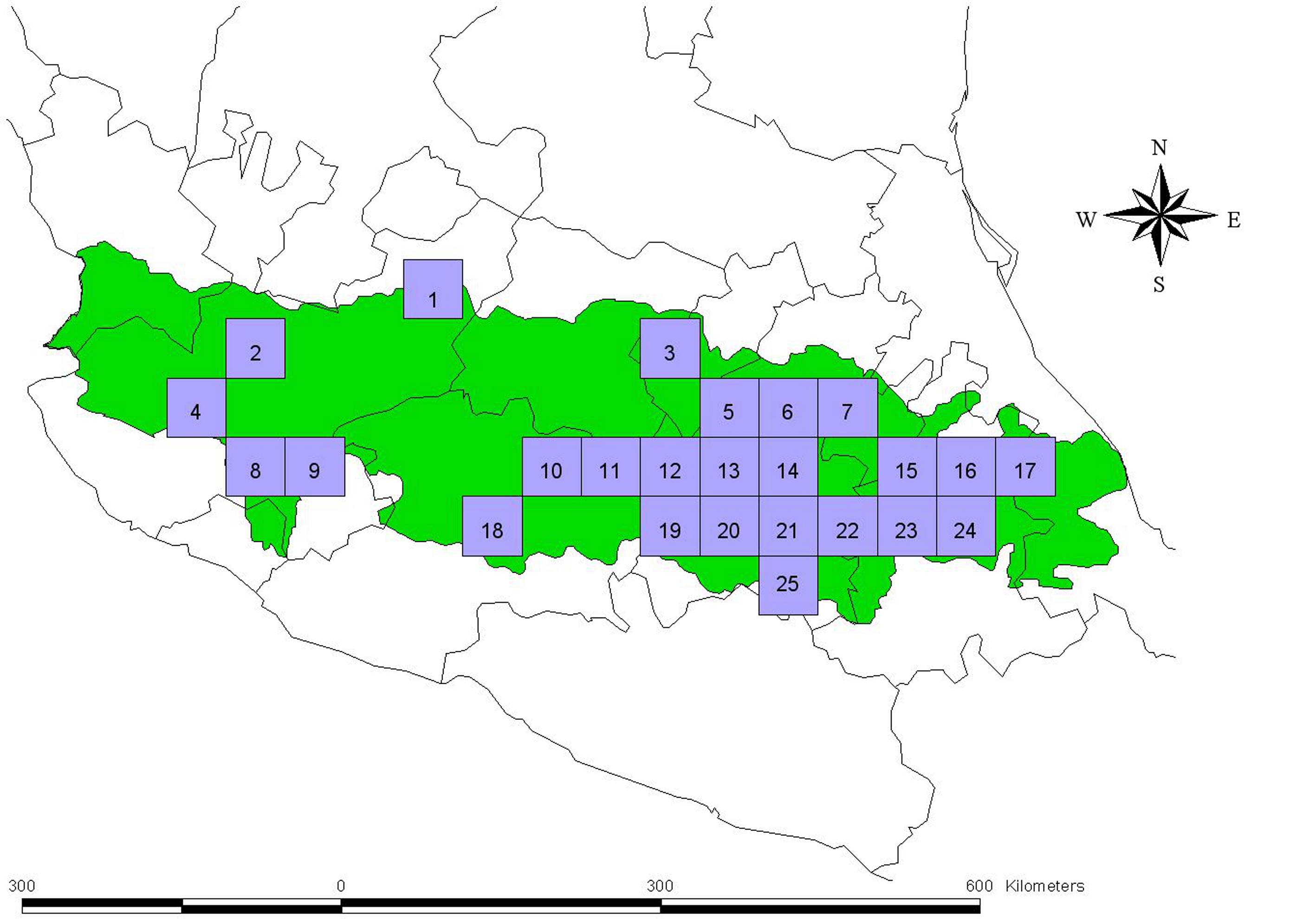
Tabla 2
Valores de riqueza, endemismo, altitud y tipos de vegetación de los cuadros con al menos un registro de Clavariadelphus en la Faja Volcánica Transmexicana.
|
Número de cuadro |
Número de especies (riqueza) |
Valor de endemismo ponderado |
Valor de endemismo ponderado corregido |
Tipo de vegetación predominante |
Altitud predominante (m snm) |
|
1 |
1 |
0.048 |
0.048 |
BMM |
2,240 |
|
2 |
1 |
0.048 |
0.048 |
BE |
2,700 |
|
3 |
1 |
0.048 |
0.048 |
BE |
2,800 |
|
4 |
2 |
0.216 |
0.108 |
BPE |
2,000-2,250 |
|
5 |
4 |
0.559 |
0.140 |
BA, BE, BPE |
2,600 |
|
6 |
1 |
0.048 |
0.048 |
BA |
2,900 |
|
7 |
3 |
0.264 |
0.088 |
BA, BE, BPE |
2,700-2,900 |
|
8 |
2 |
0.173 |
0.087 |
BPE |
1,800 |
|
9 |
1 |
0.091 |
0.091 |
BPE |
2,000 |
|
10 |
1 |
0.048 |
0.048 |
BAEn |
2,800 |
|
11 |
6 |
1.032 |
0.172 |
BPE, BPAE |
2,000-2,400 |
|
12 |
2 |
0.173 |
0.087 |
BE, BPE |
2,400-2,600 |
|
13 |
6 |
0.732 |
0.122 |
BAE, BP BE |
2,700-3,500 |
|
14 |
3 |
0.264 |
0.088 |
BE, BEP BEP, BA |
2,500-3,200 |
|
15 |
4 |
0.891 |
0.223 |
BA, BAP, BPE |
2,500-2,900 |
|
16 |
1 |
0.091 |
0.091 |
BPE |
2,400 |
|
17 |
1 |
0.048 |
0.048 |
BP |
2,400 |
|
18 |
1 |
0.048 |
0.048 |
BMM |
2,300 |
|
19 |
3 |
1.316 |
0.329 |
BPE, BMM |
2,400 |
|
20 |
3 |
1.248 |
0.416 |
BAP, BA, BPA |
2,600-3,500 |
|
21 |
7 |
1.732 |
0.247 |
BPE, BAE, BA, BMM |
2,300-3,500 |
|
22 |
3 |
1.173 |
0.391 |
BEP, BA, BP, BPE |
1,800-3,400 |
|
23 |
5 |
0.532 |
0.106 |
BAP, BEP, BPE, BE |
2,500-3,200 |
|
24 |
1 |
0.048 |
0.048 |
BAP |
2,800 |
|
25 |
2 |
0.139 |
0.070 |
BPE, BMM |
2,000-2,300 |
BE, bosque de encino, BP, bosque de pino, BPE, bosque de pino-encino, BPAE, bosque de pino-abeto-encino, BMM, bosque mesófilo de montaña, BA, bosque de abeto, BEP, bosque de encino-pino, BAP, bosque de abeto-pino, BAE, bosque de abeto-encino, BPA, bosque de pino-abeto, BAEn, bosque de abeto-enebro.
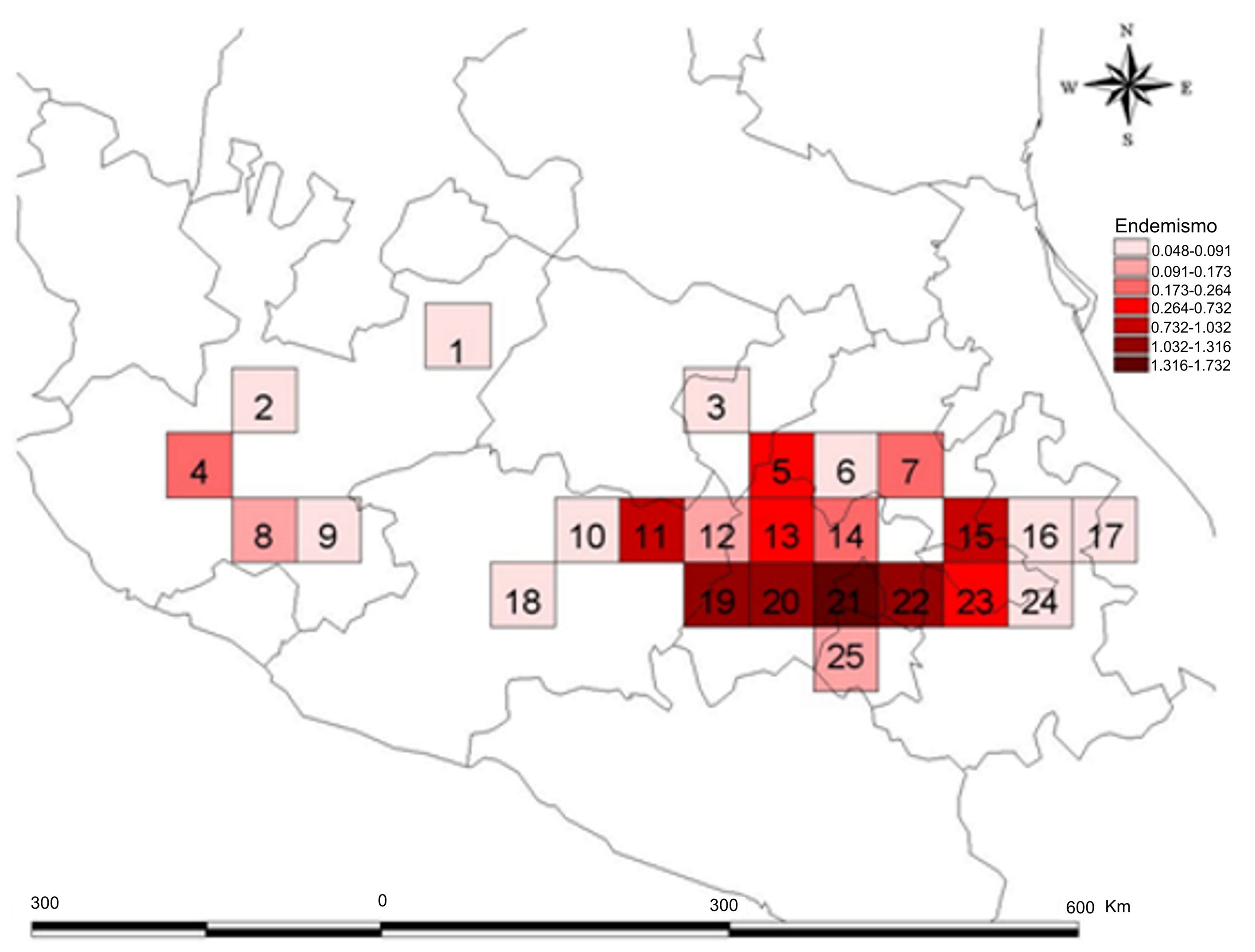
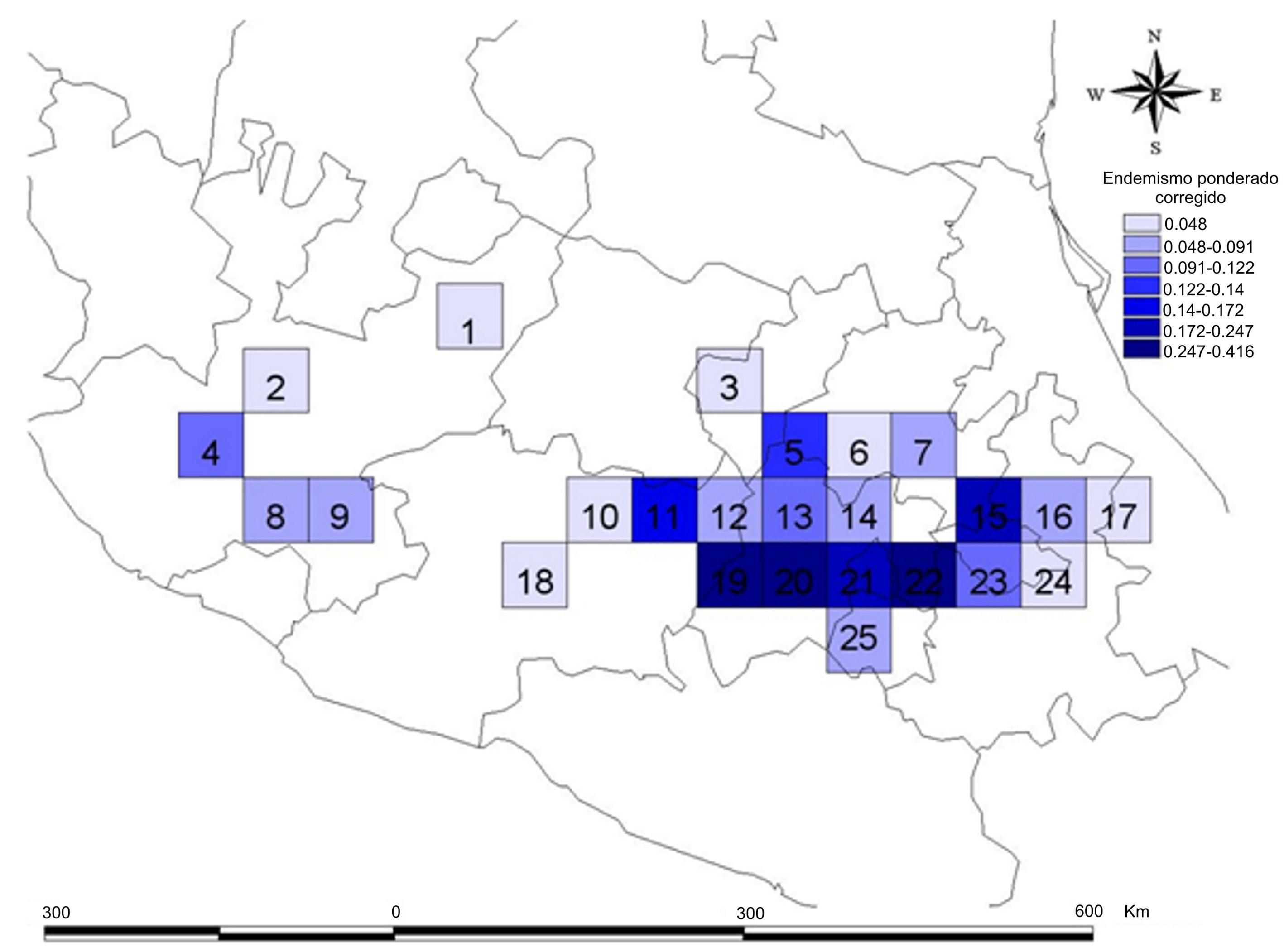
Tabla 3
Valores obtenidos mediante el índice de complementariedad para los cuadros donde se han encontrado las especies de Clavariadelphus en la FVTM.
|
C-4 |
C-5 |
C-7 |
C-8 |
C-11 |
C-12 |
C-13 |
C-14 |
C-15 |
C-19 |
C-20 |
C-21 |
C-22 |
C-23 |
C-25 |
|
|
C-4 |
* * |
||||||||||||||
|
C-5 |
0.8 |
* * |
|||||||||||||
|
C-7 |
0.75 |
0.6 |
* * |
||||||||||||
|
C-8 |
1 |
0.8 |
0.333 |
* * |
|||||||||||
|
C-11 |
0.666 |
0.571 |
0.5 |
0.666 |
* * |
||||||||||
|
C-12 |
0.666 |
1 |
0.75 |
0.666 |
0.666 |
* * |
|||||||||
|
C-13 |
0.666 |
0.333 |
0.5 |
0.666 |
0.285 |
0.666 |
* * |
||||||||
|
C-14 |
0.333 |
0.833 |
0.5 |
0.75 |
0.5 |
0.333 |
0.5 |
* * |
|||||||
|
C-15 |
1 |
0.833 |
0.8 |
0.75 |
0.5 |
0.75 |
0.714 |
0.8 |
* * |
||||||
|
C-19 |
0.8 |
0.857 |
0.833 |
0.8 |
0.571 |
0.5 |
0.571 |
0.6 |
0.6 |
* * |
|||||
|
C-20 |
1 |
0.833 |
0.8 |
0.75 |
0.875 |
0.75 |
0.714 |
0.8 |
0.8 |
0.833 |
* * |
||||
|
C-21 |
0.714 |
0.428 |
0.571 |
0.714 |
0.375 |
0.571 |
0.142 |
0.571 |
0.75 |
0.625 |
0.75 |
* * |
|||
|
C-22 |
1 |
0.833 |
0.5 |
0.333 |
0.714 |
0.75 |
0.714 |
0.8 |
0.8 |
0.833 |
0.8 |
0.75 |
* * |
||
|
C-23 |
0.6 |
0.5 |
0.4 |
0.6 |
0.166 |
0.6 |
0.166 |
0.4 |
0.666 |
0.5 |
0.857 |
0.285 |
0.666 |
* * |
|
|
C-25 |
0.666 |
0.8 |
0.333 |
0.666 |
0.666 |
0.666 |
0.666 |
0.333 |
0.75 |
0.8 |
0.75 |
0.714 |
0.75 |
0.6 |
* * |
Discusión
La FVTM se puede considerar como una zona biodiversa en especies de Clavariadelphus, ya que en ella se concentran el 68.4% de las especies registradas para el mundo (Kirk et al., 2008; Methven, 1990). En la FVTM están representadas todas las especies actualmente conocidas para México. Estos resultados son congruentes con los obtenidos con otros grupos de organismos, por ejemplo plantas (Delgadillo et al., 2003; Suárez-Mota et al. 2013; Torres-Miranda y Luna-Vega, 2006) y animales (Espinosa et al., 2008; Gámez et al., 2012; Morrone, 2010; Torres-Miranda y Luna-Vega, 2006). Estos hechos apoyan la hipótesis de que la complejidad geológica, climática y de vegetación presentes en esta cordillera generan una alta riqueza de especies, además de ser parte de la zona de transición entre las regiones biogeográficas Neártica y Neotropical (Morrone, 2010).
Los datos hasta ahora obtenidos muestran que la riqueza de especies está distribuida en forma heterogénea, siendo la porción central y oriental de la FVTM, las que concentran el mayor número de registros. Esto puede deberse, en parte, a que son las áreas más recolectadas del área de estudio y a que son fácilmente accesibles para estudios de campo (Delgadillo et al., 2003), además de que en esta área existe una mayor representación de bosques de coníferas y en general de bosques montanos. El cuadro 21 contiene la riqueza de especies más alta de Clavariadelphus en la FVTM, mismo que incluye al Área Natural Protegida conocida como corredor biológico Chichinautzin-Tepozteco, que se localiza en parte de los estados de Morelos, Ciudad de México y Estado de México. Este cuadro también es el que presenta un valor más alto para el índice de endemismo ponderado. El cuadro 11 con 6 especies de Clavariadelphus abarca 2 áreas naturales protegidas: el Parque Nacional José María Morelos y el Parque Nacional Cerro de Garnica, ambos situados en el estado de Michoacán. El cuadro 20, el cual presenta el valor más alto de endemismo ponderado corregido coincide con el Área de Protección de Flora y Fauna Nevado de Toluca y con el Área de Protección de Recursos Naturales Cuencas de los Ríos Valle de Bravo y Temascaltepec. En la zona occidental de la FVTM sólo se registraron una o 2 especies, lo cual puede deberse a lo poco exploradas que se encuentran las áreas del noroeste de Michoacán, centro de Jalisco, sur de Nayarit y sur de Guanajuato. En esta zona occidental existen extensas zonas agrícolas, pastizales, selvas bajas caducifolias o zonas urbanas, aspectos que limitan el desarrollo de especies de Clavariadelphus.
Estos datos conducen a considerar que la riqueza de especies de Clavariadelphus se encuentra asociada a factores como cambio de uso de suelo, clima y la vegetación, así como a la existencia de especies de plantas con las que tienen una asociación micorrizógena, principalmente coníferas y ciertas latifoliadas (Rinaldi et al., 2008). De acuerdo con Hernández-Cerda y Carrasco-Anaya (2007), las zonas de la FVTM más húmedas (con precipitaciones superiores a 1,500 mm) y con temperatura máxima promedio de 20 a 26 °C se localizan en las regiones montañosas que miran hacia el golfo de México.
Las especies de Clavariadelphus se desarrollan predominantemente en estas áreas, donde son frecuentes los bosques montanos. Lo encontrado en este estudio está apoyado por Rinaldi et al. (2008), quienes han sustentado que una alta proporción de especies de Clavariadelphus establecen una asociación ectomicorrizógena con coníferas. Por otra parte, el estudio de Contreras-Medina y Luna-Vega (2007) muestra que las gimnospermas se distribuyen principalmente en el intervalo altitudinal que va de los 1,200 a 3,200 m snm, en los que los tipos de vegetación de pino-encino son los mejor representados, situación relevante al ser las coníferas el grupo de plantas con los cuales guardan una estrecha relación simbiótica las especies de Clavariadelphus (Rinaldi et al., 2008).
El cuadro 13 con 6 especies y que se ubica en el Estado de México, no coincide con ningún área natural protegida que resguarde a las especies de Clavariadelphus, por lo que las especies que habitan en estos sitios están en riesgo alto de desaparecer. Si a lo anterior se suma que las especies de Clavariadelphus presentes en la FVTM se pueden considerar como raras (1-3 registros) y poco comunes (menos de 30 registros sensu Shiryaev, 2009), el problema se agudiza. Solamente C. truncatus se puede considerar como una especie común (más de 30 registros de acuerdo con Shiryaev, 2009).
Los resultados obtenidos por Morales-Torres et al. (1999) para el género Amanita, un taxón ectomicorrizógeno, coinciden con el presente estudio en el sentido de que la mayor riqueza de especies se encuentra en bosques mixtos de pino-encino, siendo la región central de la FVTM la que concentra el mayor número de registros. Los bosques templados del Estado de México son diversos no sólo en especies de Clavariadelphus, sino que también albergan una riqueza extraordinaria de otros hongos bien estudiados como los pertenecientes al orden Gomphales (González-Ávila et al., 2016).
Las localidades con registros de Clavariadelphus en la FVTM se concentran en 25 cuadros de 0.5° × 0.5°; sin embargo, todos mostraron una riqueza baja (menor a 10 especies). El género es poco diverso a escala mundial, con un alto número de especies conocidas restringidas a América del Norte. Methven (1990) registró para esta área 15 especies, de las cuales 8 se encuentran en la FVTM (más del 50%). Al menos 4 de los 25 cuadros contienen entre el 33.3 y el 46.7% de las especies norteamericanas. No obstante lo anterior, en algunos casos el muestreo ha sido insuficiente y el esfuerzo de recolecta de Clavariadelphus se nota más hacia los estados que rodean a la Ciudad de México, que es en donde se concentran importantes centros de investigación de los hongos mexicanos y son de fácil acceso (Delgadillo et al., 2003; González-Ávila et al., 2016). En otros casos el bajo número de especies no es un artefacto del muestreo, sino un reflejo de la reducción en la cubierta vegetal, que se ha visto mermada por actividades antrópicas. A lo anterior es necesario sumar que los tipos de vegetación templada en donde se desarrollan estos hongos son de los más vulnerables, al ser los más utilizados para cultivos y ganadería (Challenger, 1998; Luna-Vega et al., 2006).
El análisis de complementariedad tomando cuadros como unidades de estudio, ha sido utilizado previamente para proponer áreas de conservación en México, basándose en la distribución de diferentes grupos biológicos, como mamíferos (Rodríguez et al., 2003), helmintos (Aguilar-Aguilar y Salgado-Maldonado, 2006), herpetofauna (Ochoa-Ochoa y Flores-Villela, 2006) y cactáceas (Godínez-Álvarez y Ortega-Baes, 2007), por mencionar algunos. En estos trabajos se pone de manifiesto la importancia de la riqueza y del alto recambio de especies entre cuadros en un país megadiverso y betadiverso como lo es México. Los datos obtenidos en el presente estudio coinciden con estas ideas, pues resulta evidente que en la FVTM existen cuadros habitados por un conjunto de especies que no se replica totalmente en otro, y que para tener representada la totalidad de las especies de Clavariadelphus, son necesarios 5 cuadros (19, 20, 21 22 y 11), los cuales son relevantes en términos de su conservación. Dichos cuadros coinciden con ciertas Áreas Naturales Protegidas que principalmente albergan bosques templados, lo cual podría tomarse en cuenta dentro de una estrategia de conservación para las especies de Clavariadelphus. La selección de los cuadros complementarios considera la presencia-ausencia de las especies, no la viabilidad de las poblaciones que se pretenden conservar (Ochoa-Ochoa y Flores-Villela, 2006; Rodrigues et al. 2000). En México se cuenta con información de presencia-ausencia proveniente principalmente de registros de colecciones científicas y se puede comenzar por tomar en cuenta los 5 cuadros complementarios, a reserva de hacer análisis posteriores para la propuesta de nuevas áreas de conservación (Ochoa-Ochoa y Flores-Villela, 2006).
Las especies de Clavariadelphus son habitantes de las zonas templadas del hemisferio norte; no obstante, en este estudio fue evidente que algunas de ellas también se encuentran en montañas ubicadas en el Neotrópico, principalmente en los estados de Chiapas y Oaxaca, y de manera importante en la FVTM, donde el dosel arbóreo está dominado principalmente por especies de afinidad boreal. La mayoría de ellas son ectomicorrizógenas y crecen en bosques de coníferas, encino, pinos, mesófilos de montaña y otros bosques mixtos. La información actualmente disponible indica que sólo C. fasciculatus es endémica de México, debido a que no se ha registrado en otro país.
La distribución de las especies de Clavariadelphus alcanza la Zona de Transición Mexicana sensu Morrone (2010) y llega a rebasar este límite, donde habitan en bosque de pino-encino y bosque de encino-pino, en altitudes de 2,200 a 2,300 m, por lo que en este estudio se demuestra que el género no es exclusivo de las zonas templadas del hemisferio norte, sino que alcanza los montañas tropicales de México. Hasta la fecha no han sido registradas especies para América Central.
Los resultados de este estudio permiten concluir que la riqueza de especies de algunos grupos de hongos, plantas y animales que habitan en la FVTM son congruentes y muestran una mayor concentración de especies en la parte central de la FVTM, donde son comunes los bosques de coníferas, de encino y pino-encino húmedos y otros tipos de vegetación menos frecuentes en la zona occidental (Contreras-Medina y Luna-Vega, 2007; García-Trejo y Navarro-Sigüenza, 2004; Navarro-Sigüenza et al., 2007).
Ninguna de las especies de Clavariadelphus está incluida en alguna categoría de riesgo dentro la Norma Oficial Mexicana vigente NOM-059-SEMARNAT-2010 (Semarnat, 2010). Las especies de Clavariadelphus, al igual que otras muchas de las especies de hongos que se desarrollan en nuestro país, enfrentan el problema de la destrucción acelerada de los bosques, debido principalmente a la expansión de las fronteras ganaderas, agrícolas y urbanas que aunados a la contaminación atmosférica y de los acuíferos representan una grave amenaza (Challenger, 1998; Luna-Vega et al., 2006).
Los cuadros que tienen relevancia en términos de conservación de las especies de Clavariadelphus son 11, 19, 20, 21 y 22, ya que son los cuadros que albergan la totalidad de las especies del género, además de que los cuadros 19, 20 y 22 presentaron los valores más altos en cuanto al índice del endemismo ponderado corregido. En el mismo sentido, los cuadros 21, 11 y 13 son los que presentan la mayor riqueza de especies dentro de la FVTM.
Las especies de Clavariadelphus que se han registrado como comestibles en México son: C. cokeri, C. truncatus, C. truncatus var. lovejoyae y C. unicolor (González-Ávila, Luna-Vega et al., 2013), en los estados de Tlaxcala, Estado de México, Oaxaca y Michoacán; además se ha registrado que C. truncatus es un importante indicador biológico de contaminación (González-Ávila, Luna-Vega et al., 2013).
Se sugieren estudios de tipo demográfico de las especies para conocer el estado actual de las poblaciones y asociaciones particulares con plantas vasculares, así como el estudio de las especies crípticas sobre todo del complejo truncatus, donde pueden estar involucrados varios linajes.
En este estudio se incluyen 3 especies nuevas para la ciencia, las cuales serán descritas posteriormente, por lo que sería interesante llevar a cabo análisis de ADN ribosomal y un estudio más profundo a nivel micromorfológico, incluyendo otros caracteres como características del apéndice hilar, composición de los cristales presentes en las hifas, metabolitos secundarios en los esporomas, desarrollo de los basidiomas y características de las micorrizas, entre otros.
Durante la época de lluvias existe formación de esporomas, por lo que es necesaria la recolección de estas especies en esas épocas para garantizar su identificación taxonómica y registro de distribución. Las diferentes especies forman esporomas en distintas épocas del año, evidenciándose la mayoría de ellas entre los meses de agosto a octubre.
Agradecimientos
Los autores agradecen a los curadores por las facilidades otorgadas para la consulta de ejemplares en las siguientes colecciones: Cristina Burrola Aguilar (CIRB), Mario Ishiki (ECOSUR, San Cristóbal), Elvira Aguirre (MEXU), Víctor Manuel Gómez Reyes (EBUM), Marco Antonio Hernández (FEZA), Lilia Ramírez (FCME), Lourdes Acosta Urdapilleta (HEMIM), Irene Frutis (IZTA), Laura Guzmán (IBUG), Ricardo Valenzuela (ENCB), Raúl Díaz (UJAD), Jesús García (UTCV), Silvia Capello (UJAT), Martín Ezqueda (CIAD), Gastón Guzmán (XAL) y Alejandro Kong (TLMX). Al proyecto DGAPA PAPIIT IV201015, IN215914, CONACYT 2015-01-207 y SIP-20180243 por el financiamiento: para la revisión de colecciones
Referencias
Aguilar-Aguilar, R. y Salgado-Maldonado, G. (2006). Diversidad de helmintos parásitos de peces dulceacuícolas en dos cuencas hidrológicas de México: los helmintos y la hipótesis del México betadiverso. Interciencia, 31, 484–490.
Alcántara-Ayala, O. y Paniagua, M. (2007). Patrones de distribución y conservación de plantas endémicas. En I. Luna-Vega, J. J. Morrone y D. Espinosa (Eds.). Biodiversidad de la Faja Volcánica Transmexicana (pp. 421–438). Ciudad de México: Conabio/ Universidad Nacional Autónoma de México.
Álvarez, E. y Morrone, J. J. (2004). Propuesta de áreas para la conservación de aves de México, empleando herramientas panbiogeográficas e índices de complementariedad. Interciencia, 29, 112–120.
Baker, G. E. y Meeker, J. (1972). Ecosystems, mycologists and the geographical distribution of fungi in the Central Pacific. Pacific Science, 26, 418–43.
Baroni, J. T., Lodge, D. J. y Cantrell, S. A. (1997). Tropical connections: sister species and species in common between the Caribbean and the eastern United States McIlvainea, 13, 4–18.
Challenger, A. (1998). Utilización y conservación de los ecosistemas terrestres de México Ciudad de México: Conabio/ Universidad Nacional Autónoma de México/ Sierra Madre A.C.
Conanp (Comisión Nacional de Áreas Naturales Protegidas). (2012). Áreas Naturales Protegidas Federales de México. Diario Oficial de la Federación. Agosto 2012 Ciudad de México.
Colwell, R. y Coddington, J. (1994). Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society B: Biological Sciences, 345, 101–118.
Conabio (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad) (2011). División política estatal 1:250000. 2010′, escala: 1:250000. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Versión 4. Modificado de Conjunto de datos vectoriales y toponimia de la carta topográfica. Serie III. Instituto Nacional de Estadística, Geografía e Informática (2003-2004). Áreas geoestadísticas estatales, del Marco Geoestadístico 2010 versión 5.0. Instituto Nacional de Estadística y Geografía. Escala 1:250000. México.
Contreras-Medina, R. y Luna-Vega, I. (2007). Species richness, endemism and conservation of Mexican gymnosperms. Biodiversity and Conservation, 16, 1803–1821.
Crisp, M. D., Laffan, S., Linder, H. y Monro, A. (2001). Endemism in the Australian flora. Journal of Biogeography, 28, 183–198.
Delgadillo, C., Villaseñor, J. y Dávila, P. (2003). Endemism in the Mexican flora: a comparative study in three plant groups. Annals of the Missouri Botanical Garden, 90, 25–34.
Demoulin, V. (1973). Phytogeography of the fungal genus Lycoperdon in relation to the opening of the Atlantic. Nature, 242, 123–125.
Eckblad, F. (1981). Soppgeografi. Oslo: Universitetsforlaget.
Escalante, T., Rodríguez, G., Gámez, N., León, L., Barrera, O. y Sánchez-Cordero, V. (2007). Biogeografía y conservación de los mamíferos. En I. Luna-Vega, J. Morrone y D. Espinosa (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 485–502). Ciudad de México: Conabio/ Universidad Nacional Autónoma de México.
Espinosa, D., Ocegueda, S., Aguilar, C., Flores-Villela, O. y Llorente, J. (2008). El conocimiento biogeográfico de las especies y su regionalización natural. En Capital natural de México, Vol. I. Conocimiento actual de la biodiversidad. (pp. 33–65). Ciudad de México: Conabio.
ESRI. (1998). ArcView Gis ver. 3.2. Redlands, California: Environmental Systems Research Institute Inc.
Ferrusquía-Villafranca, I. (2007). Ensayo sobre la caracterización y significación biológica En I. Luna-Vega, J. J. Morrone y D. Espinosa (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 7–24). Ciudad de México: Conabio/ Universidad Nacional Autónoma de México.
Flores-Villela, O. y Canseco-Márquez, L. (2007). Riqueza de la herpetofauna. En I. Luna Vega, J. J. Morrone y D. Espinosa (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 407–420). Ciudad de México: Conabio/ Universidad Nacional Autónoma de México.
Gámez, N., Escalante, T., Rodríguez, G., Linaje, M. y Morrone, J. J. (2012). Caracterización biogeográfica de la Faja Volcánica Transmexicana y análisis de los patrones de distribución de su mastofauna. Revista Mexicana de Biodiversidad, 83, 258–272.
García-Trejo, E. A. y Navarro- Sigüenza, A. (2004). Patrones biogeográficos de la riqueza de especies y el endemismo de la avifauna en el oeste de México. Acta Zoológica Mexicana, 20, 167–185.
Godínez-Álvarez, H. y Ortega-Baes, P. (2007). Mexican cactus diversity: environmental correlates and conservation priorities. Boletín de la Sociedad Botánica de México, 81, 81–87.
Gómez-Tuena, A., Orozco-Esquivel, M. T. y Ferrari, L. (2005). Petrogénesis ígnea de la Faja Volcánica Transmexicana. Boletín de la Sociedad Geológica Mexicana, 57, 227–283.
González-Ávila, P. A., Luna-Vega, I., García-Sandoval, R. y Contreras-Medina, R. (2016). Distributional patterns of the order Gomphales (Fungi: Basidiomycota) in Mexico. Tropical Conservation Science, 9, 1–17.
González-Ávila, P. A., Luna-Vega, I., Villegas-Ríos, M., Saade, R. y Blanco, J. (2013). Current knowledge and importance of the order Gomphales (Fungi Basidiomycota) in Mexico. Nova Hedwigia, 97, 1–2.
González-Ávila, P. A., Torres-Miranda, A., Luna-Vega, I. y Villegas-Ríos, M. (2013). Richness patterns and ecological differentiation of genus Phaeoclavulina in Mexico and their implications for conservation. North American Fungi, 8, 1–32.
Halling, R., Osmundson, T. y Neves, M. (2008). Pacific boletes: implications for biogeographic relationships. Mycological Research, 112, 437–447.
Hanif, M., Nasir, A. y Exeter, R. (2014) Clavariadelphus pakistanicus sp. nov., a new club fungus (Basiodiomycota: Gomphales) from Himalayan moist temperate forests of Pakistan. Botany, 92, 471–476.
Hernández-Cerda, M. E. y Carrasco-Anaya, G. (2007). Rasgos climáticos más importantes En I. Luna-Vega, J. J. Morrone y D. Espinosa (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 57–72). Ciudad de México: Conabio/ Universidad Nacional Autónoma de México.
Hibbett, D. S. (2001). Shiitake mushrooms and molecular clocks: historical biogeography of Lentinula. Journal of Biogeography, 28, 231–241.
Hibbett, D. S., Binder, M., Bischoff, J. F., Blackwell, M., Cannon, P. F. y Eriksson, O. E., et al. (2007). A higher-level phylogenetic classification of the Fungi. Mycological Research, 111, 509–547.
Hibbett, D. S., Pine, E., Langer, E., Langer, G. y Donoghue, M. (1997). Evolution of gilled mushrooms and puffballs inferred from ribosomal DNA sequences. Proceedings of the National Academy of Sciences, 94, 12002–12006.
Hibbett, D. S. y Thorn, R. (2001). Basidiomycota: Homobasidiomycetes. En D. McLaughlin, E. McLaughlin y P. Lemke (Eds.), The Mycota VII Part B. Systematics and Evolution (pp. 121–168). Berlín: Springer-Verlag.
Horak, E. (1983). Mycogeography in the south Pacific region: Agaricales, Boletales Australian Journal of Botany, Supplement, 10, 1–41.
Inegi (Instituto Nacional de Estadística, Geografía e Informática). (2012a). Carta topográfica. Escala 1:250,000. Instituto Nacional de Estadística, Geografía e Informática, Aguascalientes. Disponible en: http://www.inegi.org.mx/geo/contenidos/topografia/default.aspx
Inegi (Instituto Nacional de Estadística, Geografía e Informática). (2012b). Carta topográfica. Escala 1:50,000. Instituto Nacional de Estadística, Geografía Informática Aguascalientes. Disponible en: http://www.inegi.org.mx/geo/contenidos/topografia/default.aspx
Kim, S. y Jung, H. (2000). Phylogenetic relationships of the Aphyllophorales inferred from sequence analysis of nuclear small subunit ribosomal DNA. Journal of Microbiology, 38, 122–131.
Kirk, P., Cannon, P., Minter, D. y Stalpers, J. (2008). Ainsworth and Bisby’s Dictionary of the Fungi. Wallingford: International Mycological Institute, CAB International.
Lange, L. (1974). The distribution of Macromycetes in Europe. Dansk Botanisk Arkiv, 30, 7–15.
Lichtwardt, R. (1995). Biogeography and fungal systematics. Canadian Journal of Botany, 73, 731–737.
Linder, H. (2001). Plant diversity and endemism in sub-Saharan tropical Africa. Journal of Biogeography, 28, 169–182.
Lumbsch, T., Buchanan, P., May, T. y Mueller, G. (2008). Phylogeography and biogeography of fungi. Mycological Research, 112, 423–424.
Luna-Vega, I., Alcántara-Ayala, O., Contreras-Medina, R. y Vargas, A. (2006). Biogeography, current knowledge and conservation of threatened vascular plants characteristic of Mexican temperate forests. Biodiversity and Conservation, 15, 3773–3799.
Methven, A. (1990). Genus Clavariadelphus in North America. Bibliotheca Mycologica, 138, 1–192.
Morales-Torres, E., Villegas-Ríos, M., Cifuentes, J. y Tulloss, R. (1999). Revision of Amanita alexandri and its similarity to Amanita polypyramis. Mycotaxon, 73, 477–491.
Morrone, J. J. (2009). Evolutionary biogeography: an integrative approach with case studies. Nueva York: Columbia University Press.
Morrone, J. J. (2010). Fundamental biogeographic patterns across the Mexican Transition Zone: an evolutionary approach. Ecography, 33, 355–361.
Nava, R. y Valenzuela, R. (1997). Los macromicetos de la sierra de Nanchititla, Estado de México. Polibotánica, 5, 21–36.
Navarro-Sigüenza, A., Lira-Noriega, A., Peterson, A. T., Oliveras de Ita, A. y Gordillo-Martínez, A. (2007). Diversidad, endemismo y conservación de las aves. En I. Luna-Vega, J. J. Morrone y D. Espinosa (Eds.), Biodiversidad de la Faja Volcánica Transmexicana (pp. 461–484). Ciudad de México: Universidad Nacional Autónoma de México/ Conabio.
Ochoa-Ochoa, L. y Flores-Villela, O. (2006). Áreas de diversidad y endemismo de la herpetofauna mexicana. Ciudad de México: Universidad Nacional Autónoma de México/ Conabio.
Ortega, F., Sedlock, R. y Speed, R. (2000). Evolución tectónica de México durante el Fanerozoico. En J. Llorente, E. González y N. Papavero (Eds.), Biodiversidad, taxonomía y biogeografía de artrópodos de México: hacia una síntesis de su conocimiento (pp. 3–59). Ciudad de México: Universidad Nacional Autónoma de México/ Conabio.
Pringle, A. y Vellinga, E. (2006). Last chance to know? Using literature to explore the biogeography and invasion biology of the death cap mushroom Amanita phalloides (Vaill. ex Fr.: Fr.) Link. Biological Invasions, 8, 1131–1144.
Rapoport, E. (1975). Areografía: estrategias geográficas de las especies. Ciudad de México: Fondo de Cultura Económica.
Rapoport, E. y Monjeau, J. (2001). Areografía. En J. Llorente y J. J. Morrone (Eds.), Introducción a la biogeografía en Latinoamérica: teorías, conceptos, métodos y aplicaciones (pp. 23–30). Ciudad de México: Facultad de Ciencias, Universidad Nacional Autónoma de México.
Redhead, S. (1989). A biogeographical overview of the Canadian mushroom flora. Canadian Journal of Botany, 67, 3003–3062.
Rinaldi, A., Comandini, O. y Kuyper, T. (2008). Ectomycorrhizal fungal diversity: separating the wheat from the chaff. Fungal Diversity, 33, 1–45.
Rodrigues, A. S., Orestes, J. y Gaston, K. J. (2000). Flexibility, efficiency, and accountability: adapting reserve selection algorithms to more complex conservation problems. Ecography, 23, 565–574.
Rodríguez, P., Soberón, J. y Arita, H. (2003). El componente beta de la diversidad de mamíferos de México. Acta Zoológica Mexicana, 89, 241–259.
Semarnat (Secretaría de Medio Ambiente y Recursos Naturales). (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-especies nativas de México de flora y fauna silvestres Categorías de riesgo y especificaciones para su inclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Federación. 30 de diciembre de 2010, Segunda Sección, México.
Serrato, A., Ibarra-Manríquez, G. y Oyama, K. (2004). Biogeography and conservation of the genus Ficus (Moraceae) in Mexico. Journal of Biogeography, 31, 475–485.
Shiryaev, A. (2009). Diversity and distribution of clavarioid fungi in Estonia. Folia Cryptogamica Estonica, 45, 65–80.
Skrede, I., Engh, I., Binder, M., Carlsen, T., Kauserud, M. y Bendiksby, M. (2011). Evolutionary history of Serpulaceae (Basidiomycota): molecular phylogeny, historical biogeography and evidence for a single transition of nutritional mode. BMC Evolutionary Biology, 11, 230–243.
Suárez-Mota, M., Téllez-Valdés, O., Lira-Saade, R. y Villaseñor, J. L. (2013). Una regionalización de la Faja Volcánica Transmexicana con base en su riqueza florística. Botanical Sciences, 91, 93–105.
Tedersoo, L. y Nara, K. (2010). General latitudinal gradient of biodiversity is reversed in ectomycorrhizal fungi. New Phytologist, 185, 351–354.
Torres-Miranda, A. y Luna-Vega, I. (2006). Análisis de trazos para establecer áreas de conservación en la Faja Volcánica Transmexicana. Interciencia, 31, 849–855.
Villegas, M., De Luna, E., Cifuentes, J. y Estrada-Torres, A. (1999). Phylogenetic studies in Gomphaceae sensu lato (Basidiomycetes). Mycotaxon, 70, 127–147.
Watling, R. (2001). The relationships and possible distributional patterns of boletes in south-east Asia. Mycological Research, 105, 1440–1448.
Wu, Q. X. y Mueller, G. M. (1997). Biogeographic relationships between the macrofungi of temperate eastern Asia and eastern North America. Canadian Journal of Botany, 75, 2108–2116.