Análisis morfométrico del grupo Selenicereus vagans (Cactaceae: Hylocereeae) con base en la anatomía del tallo
Daniel Martín Martínez-Quezada a, Estela Sandoval-Zapotitla b y Salvador Arias b, *
a Departamento de Botánica, Instituto de Biología, Universidad Nacional Autónoma de México Apartado postal 70-233, 04510 Ciudad de México, México
b Jardín Botánico, Instituto de Biología, Universidad Nacional Autónoma de México, Apartado postal 70-614, 04510 Ciudad de México, México
*Autor para correspondencia: sarias@ib.unam.mx (S. Arias)
Resumen
Se realizó un estudio anatómico del tallo para las especies del grupo Selenicereus vagans sensu Bauer (S. atropilosus, S. dorschianus, S. murrillii, S. vagans), con el objetivo de estimar su valor en la delimitación de las especies y conocer si S. dorschianus se circunscribe a este grupo con base en evidencia anatómica. Se analizaron 25 caracteres anatómicos a través de métodos multivariados (análisis discriminante canónico, análisis clasificatorio y de agrupamiento). Se demostró que los caracteres anatómicos cuantitativos del tallo son tan importantes como los caracteres anatómicos cualitativos. Para este grupo de especies, los caracteres numéricos tuvieron una mayor representatividad y permitieron delimitar especies, interpretándolos como taxonómicamente informativos. El espesor de la cutícula, la longitud de las células oclusivas, el área de células epidérmicas, el grosor de la pared de las células hipodérmicas, así como el grosor de la pared de las fibras asociadas al floema secundario apoyan a S. murrillii como un taxón distinto de S. vagans. S. dorschianus mostró similitud anatómica con miembros del grupo S. vagans, pero se reconoce por tener vasos agrupados y madera dimorfa. Los resultados permiten confirmar la utilidad de los caracteres anatómicos en la taxonomía del género Selenicereus.
Palabras clave: Epidermis; Hipodermis; Xilema secundario; Métodos multivariados
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Morphometric analysis of the Selenicereus vagans group (Cactaceae: Hylocereeae), based on stem anatomy
Abstract
A stem anatomical study for species of Selenicereus vagans group sensu Bauer (S. atropilosus, S. dorschianus, S. murrillii, S. vagans) was carried out, with the aim of estimating their value in the species delimitation and know if S. dorschianus is circumscribed to this group based on anatomical evidence. Twenty five anatomical characters were analyzed through multivariate methods (canonical discriminant analysis, classificatory and cluster analysis). It was shown that the quantitative anatomical characters of the stem are as important as the qualitative ones. For this group, the numerical characters had a greater representation and allowed to recognize species, interpreting them as taxonomically informative. The cuticle thickness, the length of the occlusive cells, the epidermal cells area, the thickness of the hypodermal cells wall, as well as the thickness of the wall of the fibers associated to the secondary phloem supports S. murrillii as a taxon distinct from S. vagans. S. dorschianus showed anatomical similarity with members of the S. vagans group, but it is recognized by having grouped vessels and dimorphic wood. The results confirm the usefulness of the anatomical characters in the taxonomy of the genus Selenicereus.
Keywords: Epidermis; Hypodermis; Secondary xylem; Multivariate methods
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
El género Selenicereus (A. Berger) Britton et Rose (Hylocereeae, Cactaceae), es nativo de las regiones tropicales de México y Centroamérica, se caracteriza por incluir plantas trepadoras con tallos cilíndricos o planos, flores nocturnas, generalmente blancas y grandes, así como frutos carnosos (Bauer, 2003; Bravo-Hollis, 1978; Korotkova et al., 2017). Un análisis filogenético reciente para Hylocereeae revela que Selenicereus es monofilético (tipo S. grandiflorus (L.) Britton et Rose), solo si además incluye a Cryptocereus, Hylocereus, Mediocactus, Werckleocereus y Wilmatea, que en conjunto incluyen aproximadamente 31 especies (Korotkova et al., 2017). Sin embargo, son escasos los estudios que permiten entender la diversidad taxonómica del género. Por ejemplo, Bauer (2003), con base en una revisión de herbario propuso que S. purpusii (Weing.) S. Arias et N. Korotkova y S. ocamponis (Salm-Dyxk) D.R. Hunt representan la misma especie al no encontrar cambios discretos en los caracteres observados; sin embargo, García-Aguilar et al. (2013) mostraron evidencias moleculares que permiten reconocer de forma independiente ambos taxones.
Bauer (2003) propuso algunos grupos taxonómicos informales en Selenicereus a partir de caracteres morfológicos, entre los que se encuentra el grupo S. vagans, caracterizado por tener costillas con margen obtuso y distribución hacia el oeste (Sinaloa a Michoacán) del territorio mexicano. Este grupo está compuesto por 3 especies: S. atropilosus Kimnach, S. murrillii Britton et Rose y S. vagans K. Brandegee. Más recientemente, Bauer (2009) describió a S. dorschianus de la costa de Jalisco, resaltando la similitud morfológica del tallo con S. vagans. Los taxones mencionados presentan dificultades en cuanto a su reconocimiento; por ejemplo, S. murrillii ha sido considerado en sinonimia con S. vagans (Guzmán et al., 2007; Terrazas et al., 2013), mientras que para S. dorschianus no existe una base morfológica sólida, que demuestre su pertenencia al grupo S. vagans.
Algunos estudios sobre la anatomía de los tallos en Cactaceae enfatizan la relevancia taxonómica y filogenética de los caracteres de la epidermis a nivel de género y especie, principalmente dentro de la subfamilia Cactoideae (Bravo-Hollis, 1978; García Aguilar et al., 2009; Gibson y Nobel, 1986; Loza-Cornejo y Terrazas, 2003; Terrazas y Arias, 2002; Terrazas y Loza-Cornejo, 2002; Terrazas y Mauseth, 2002). El córtex y el xilema secundario parecen no tener valor taxonómico debido a la plasticidad reportada (Terrazas y Arias, 2002). Además, los caracteres de la hipodermis, así como el tipo de matriz en el que se encuentren embebidos los vasos y la variación en el desarrollo de la madera, fueron reportados como informativos a nivel de género en la tribu Cacteae (Vázquez-Sánchez et al., 2017).
Por otro lado, los análisis morfométricos aplicados a la sistemática vegetal han permitido reconocer especies con amplia variación morfológica o pertenecientes a complejos de especies en diversas familias de plantas (Arroyo-Cosultchi et al., 2010; Cope et al., 2012). A pesar de que este tipo de trabajos son escasos en Cactaceae, en ellos se ha demostrado que los caracteres morfológicos del tallo tienen valor taxonómico en la delimitación de taxones pertenecientes a complejos de especies en Cephalocereus (Arroyo-Cosultchi et al., 2010), Coryphantha (Baker y Butterworth, 2013), Echinocereus (Baker, 2006a, b; Sánchez et al., 2013), Escobaria (Baker y Johnson, 2000) y Melocactus (Mota-Lambert et al., 2006).
Teniendo en cuenta las evidencias que señalan la relevancia de los caracteres anatómicos en Cactaceae para reconocer especies, este artículo tiene como objetivos: a) describir la anatomía del tallo en el grupo Selenicereus vagans (S. atropilosus, S. murrillii, S. vagans) y S. dorschianus, b) reconocer y evaluar los atributos anatómicos que permitan definir grupos discretos reconocibles como especies mediante el uso de métodos multivariados y c) mediante un análisis de similitud, poner a prueba la pertenencia de Selenicereus dorschianus a este grupo taxonómico.
Materiales y métodos
Se analizaron individuos de todos los taxones del grupo Selenicereus vagans, recolectados en campo y depositados en la colección de cactáceas del Jardín Botánico, Instituto de Biología UNAM. Se obtuvieron muestras de 3 localidades por cada taxón sobre las cuales se realizaron todos los análisis, excepto para S. murrillii, de quien sólo se contó con muestras de 1 localidad (tabla 1). Todos los ejemplares tienen un respaldo depositado en MEXU.
Por cada individuo incluido, se cortaron segmentos de aproximadamente 1 cm de longitud de la región media de tallos maduros y se fijaron con FAA (formaldehido-ácido acético-alcohol-agua) por 48 h, posteriormente se ablandaron con GAA 1:1:1 (glicerina-alcohol-agua) por varios meses. Las muestras se procesaron a través de la microtecnia convencional de inclusión en parafina (Sandoval-Zapotitla et al., 2005). Se realizaron secciones transversales de 30 μm de espesor con un micrótomo de deslizamiento, se tiñeron con safranina-verde rápido y se montaron como preparaciones permanentes. Se obtuvieron segmentos epidérmicos mediante la técnica de aislamiento mecánico de epidermis (Sandoval-Zapotitla et al., 2005) y se montaron con gelatina glicerinada como preparaciones semipermanentes. Para el estudio de la composición celular del xilema secundario, se recurrió a la técnica de maceración con solución Jeffrey (Sandoval-Zapotitla et al., 2005), los elementos celulares disociados se tiñeron con safranina y se montaron en resina sintética.
Las observaciones fueron realizadas en un fotomicroscopio Axioskop (Carl Zeiss). Se capturaron fotomicrografías con una cámara de video ExwaveHAD (Sony) y las mediciones para los caracteres cuantitativos se realizaron con el analizador de imágenes ImageJ v.1.48. Se evaluó un total de 25 caracteres, entre cuantitativos y cualitativos (tabla 2). En la descripción anatómica, se utilizó la terminología propuesta por Koch et al. (2009) para la superficie epidérmica; por Terrazas y Mauseth (2002) y por Terrazas y Arias (2002) para el sistema fundamental; mientras que para el xilema secundario, se siguieron las recomendaciones de la Asociación Internacional de Anatomistas de la Madera (IAWA, Angyalossy-Alfonso et al., 1989).
Se registraron 60 datos correspondientes a 3 individuos por especie (con excepción de S. murrillii donde se registraron 20 datos), para 19 caracteres anatómicos cuantitativos. Los datos de los caracteres cuantitativos continuos fueron transformados a logaritmo natural, mientras que los datos de los caracteres cuantitativos discretos fueron transformados mediante raíz cuadrada (Arroyo-Cosultchi et al., 2010). Se aplicó un análisis discriminante canónico (ADC) evaluando los caracteres anatómicos cuantitativos por especie, se calcularon las distancias cuadradas de Mahalanobis (D2) y se probó su significancia estadística mediante la prueba de distancias de Fisher (Tapia et al., 2016). Se llevó a cabo un análisis discriminante clasificatorio (AC) y a los caracteres con mayor carga seleccionados por el ADC, se les aplicó un análisis de varianza (Anova) y se compararon las medias entre grupos mediante una prueba HSD de Tukey; finalmente, se calculó el promedio (caracteres cuantitativos continuos) o moda (caracteres cuantitativos discretos) y la desviación estándar.
Se realizó un análisis fenético con NTSYS-PC v.2.1, para lo cual, se generó una matriz de datos mixta, en donde se incluyen los 6 caracteres cualitativos codificados como binarios sin orden específico, así como los promedios de los parámetros cuantitativos más relevantes generados a partir del análisis discriminante canónico. Se obtuvo una matriz de similitud mediante el coeficiente de distancia taxonómica y se utilizó ligamiento promedio (UPGMA) como algoritmo de agrupamiento. Todos los estadísticos fueron realizados con el programa JMP v.7, con excepción de la estandarización de las matrices de datos, el cálculo de las distancias de Mahalanobis y la prueba de distancias de Fisher, que fueron realizados con el programa XLStat.
Resultados
Las células epidérmicas en vista superficial son poligonales en todas las especies y sus paredes anticlinales son onduladas “tipo S” (fig. 1A). En todos los casos las células epidérmicas presentan cristales prismáticos variables en tamaño y forma (fig. 1B). Los estomas son paralelocíticos (fig. 1C) y el poro estomático se encuentra orientado al azar en las 4 especies. En sección transversal la cutícula es lisa y puede desarrollar intrusiones (fig. 1D). La epidermis es uniestratificada, conformada por células de paredes delgadas, oblongas con paredes periclinales externas convexas bajas (S. atropilosus y S. dorschianus, fig. 1E), a elevadas (S. murrillii y S. vagans, fig. 1F). Las células oclusivas respecto al resto de las células epidérmicas, pueden encontrarse al mismo nivel del resto de las células epidérmicas como en S. dorschianus (fig. 1G), o estar semihundidas como en S. atropilosus, S. murrillii y S. vagans (fig. 1H).
Tabla 1
Especies y muestras utilizadas en el presente estudio.
|
Especie |
Localidad, colector y número de colecta |
|
S. atropilosus Kimnach |
Jalisco, H. Arreola 1473, S. Arias 2216, S. Arias 2217 |
|
S. dorschianus Bauer |
Jalisco, S. Arias 2219, S. Arias 2220, S. Arias 2221 |
|
S. murrillii Britton et Rose |
Michoacán, H. Sánchez-Mejorada 4206 |
|
S. vagans (K. Brandegee) Britton et Rose |
Jalisco, N.P. Taylor 296; Nayarit, J.J. Blancas 111; Sinaloa S. Arias 1832 |
Debajo de la epidermis se encuentra la hipodermis, conformada por células colenquimatosas, con un engrosamiento uniforme de sus paredes primarias y difieren en grosor en los 4 taxones evaluados. En todos los taxones el córtex es heterogéneo, conformado por parénquima en empalizada inmediatamente debajo de la hipodermis y por parénquima de reserva hacia el cilindro vascular (fig. 1I); sin embargo la proporción de parénquima en empalizada en S. atropilosus es mucho mayor y más evidente que en S. dorschianus, S. murrillii y S. vagans, las cuales presentan una mayor proporción de parénquima de reserva. En todos los casos el córtex presenta células de mucílago y abundantes cristales estiloideos y rafidios, así como haces vasculares con fibras sobre el floema como en S. murrillii y S. vagans, o sin ellas (S. atropilosus y S. dorschianus).
El floema secundario tiene asociado en la región más externa, esclerénquima conformado por estratos variables de fibras. El xilema secundario no presenta anillos de crecimiento, los vasos se encuentran embebidos en fibras y pueden ser solitarios como en S. atropilosus, S. murrillii y S. vagans (fig. 1J), o en grupos como en S. dorschianus (fig. 1K). El contorno de los vasos es redondeado, tienen placas de perforación simples, así como punteaduras intervasculares escalariformes grandes (fig. 1L). El diámetro promedio de los vasos es de 36.19 ± 5.42 μm en S. murrillii y S. vagans, mientras que en S. atropilosus y S. dorschianus es de 48.33 ± 9.49 μm. El número de vasos/mm2, en todos los casos es mayor a 100. La longitud de los elementos de vaso varía de 194 a 200 μm en todas las especies; mientras que la longitud de las fibras libriformes presentes tanto en el xilema secundario como en el esclerénquima asociado al floema secundario, varía de 400 a 500 μm en todas las especies.
El parénquima axial es paratraqueal escaso. Los radios son homogéneos, multiseriados (4 a 5 series), la altura de los mismos excede los 1,000 μm (fig. 1M), conformados por células erectas (fig. 1N), lignificadas y con punteaduras simples, en forma de ranura de célula radial a célula radial y con punteaduras laterales simples evidentes cuando se encuentran asociadas a los elementos de vaso (fig. 1O). En todos los casos la médula es parenquimatosa, carece de haces vasculares y presenta células de mucílago así como gran cantidad de almidón de reserva.
El resultado del ADC mostró que las 3 primeras funciones canónicas poseen una representatividad de 100%. Los valores propios y lo valores de correlación canónica de estas funciones son altos (valores muy próximos a 1), lo cual indica que los parámetros evaluados tienen un gran peso en la discriminación de grupos (tabla 3). El valor de Lambda de Wilks es bajo (λ = 0.01) y posee un valor crítico de F, estadísticamente significativo (p <0.05), lo que revela que los grupos tienen centroides distintos en las variables discriminantes.
Tabla 2
Caracteres cuantitativos y cualitativos analizados.
|
Núm. de carácter |
Caracteres cuantitativos |
|
1 |
Espesor de la cutícula (µm) |
|
2 |
Ancho de células epidérmicas en sección transversal (µm) |
|
3 |
Alto de células epidérmicas en sección transversal (µm) |
|
4 |
Longitud células oclusivas en vista superficial (µm) |
|
5 |
Ancho de células oclusivas en vista superficial (µm) |
|
6 |
Área de células epidérmicas en vista superficial (µm2) |
|
7 |
Grosor de la pared anticlinal de células epidérmicas en vista superficial (µm) |
|
8 |
Índice estomático |
|
9 |
Número de estratos hipodérmicos en sección transversal |
|
10 |
Ancho de células hipodérmicas en sección transversal (µm) |
|
11 |
Alto de células hipodérmicas en sección transversal (µm) |
|
12 |
Grosor de la pared de células hipodérmicas en sección transversal (µm) |
|
13 |
Diámetro tangencial de los vasos del xilema secundario (µm) |
|
14 |
Longitud de los elementos de vaso del xilema secundario (µm) |
|
15 |
Grosor de la pared de fibras del xilema secundario (µm) |
|
16 |
Grosor de la pared de fibras del esclerénquima asociado al floema secundario (µm) |
|
17 |
Longitud de fibras (µm) |
|
18 |
Ancho de fibras en la región media (µm) |
|
19 |
Longitud de células erectas de los radios del xilema secundario (µm) |
|
Caracteres cualitativos |
|
|
20 |
Intrusiones cuticulares en la epidermis. (0) ausentes, (1) presentes |
|
21 |
Posición de las células oclusivas respecto a las células subsidiarias en sección transversal. (0) semihundidas, (1) a nivel |
|
22 |
Forma de la pared periclinal externa de las células epidérmicas en sección transversal. (0) convexas altas, (1) convexas bajas |
|
23 |
Proporción de parénquima cortical en empalizada. (0) abundante, (1) escaso |
|
24 |
Arreglo de los vasos en el xilema secundario. (0) solitarios, (1) agrupados |
|
25 |
Haces vasculares corticales con fibras sobre el floema. (0) ausentes, (1) presentes |
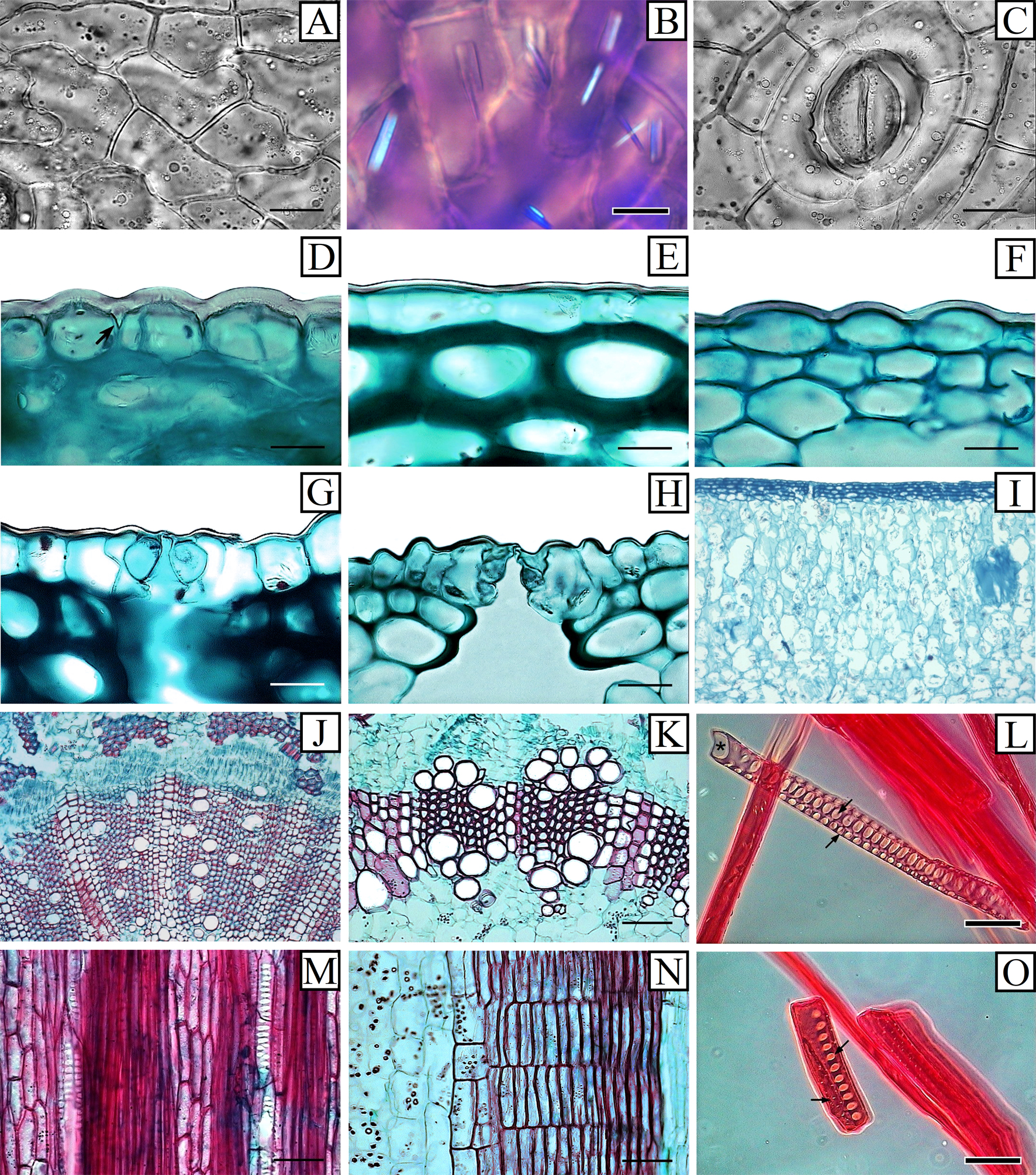
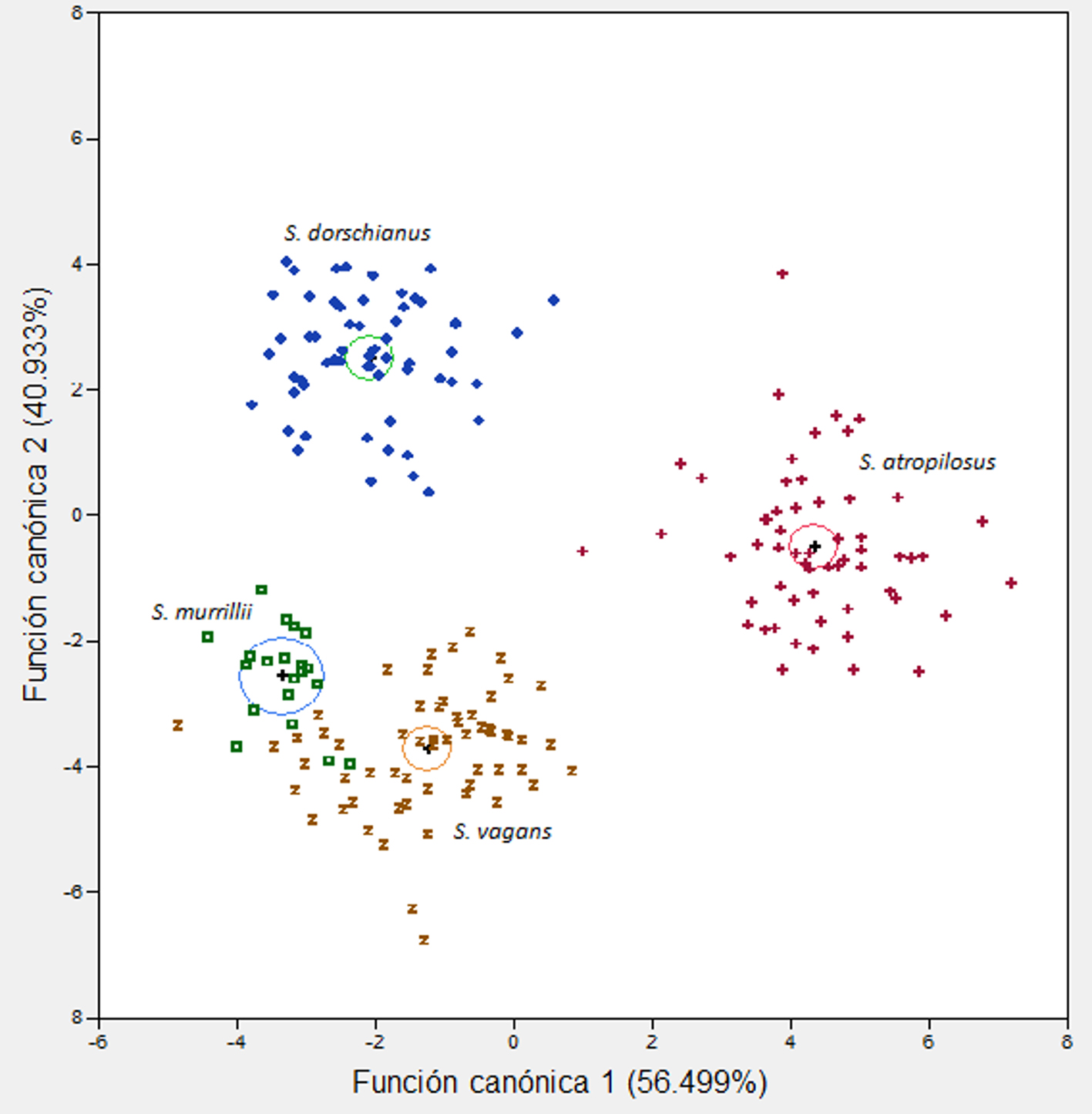
Tabla 3
Resumen del análisis discriminante canónico de los 19 caracteres anatómicos cuantitativos evaluados por especie.
|
Función canónica |
Valores propios |
Porcentaje |
Porcentaje acumulado |
Correlación canónica |
|
1 |
8.716 |
56.499 |
56.499 |
0.947 |
|
2 |
6.315 |
40.933 |
97.432 |
0.929 |
|
3 |
0.396 |
2.567 |
100 |
0.532 |
En la representación gráfica (fig. 2), a la derecha del eje canónico 1 se ubica la especie que tiene la cutícula más gruesa, las células oclusivas más largas, así como las paredes anticlinales de las células epidérmicas más gruesas (S. atropilosus); hacia el lado izquierdo sobre este mismo eje se encuentran las especies con las cutículas más delgadas, las células oclusivas más cortas, así como las paredes anticlinales de las células epidérmicas más delgadas (S. dorschianus, S. murrillii y S. vagans). Sobre el eje canónico 2, hacia la parte superior se ubica la especie con las células hipodérmicas más anchas y con paredes más engrosadas (S. dorschianus), mientras que hacia la parte inferior se localizan las especies que poseen células hipodérmicas más angostas y con paredes más delgadas (S. atropilosus, S. murrillii y S. vagans). Al analizar el eje canónico 3 (no incluido gráficamente), resulta que hacia el extremo positivo del mismo se ubican las especies que poseen las fibras de esclerénquima asociadas al floema secundario con paredes más gruesas (S. atropilosus, S. dorschianus y S. vagans), mientras que hacia el extremo negativo se ubica S. murrillii cuyas fibras de esclerénquima asociadas al floema secundario, tienen paredes más delgadas (tabla 4).
Tabla 4
Representatividad de los 19 caracteres anatómicos cuantitativos evaluados por especie, en cada una de las 3 primeras funciones canónicas del análisis discriminante canónico. En negritas los caracteres con mayor peso.
|
Carácter |
Función canónica 1 |
Función canónica 2 |
Función canónica 3 |
|
Espesor de la cutícula (µm) |
1.020 |
0.622 |
0.561 |
|
Ancho de células epidérmicas en sección transversal (µm) |
-0.127 |
0.099 |
-0.097 |
|
Alto de células epidérmicas en sección transversal (µm) |
0.036 |
-0.104 |
0.226 |
|
Longitud de células oclusivas (µm) |
0.790 |
-0.086 |
0.332 |
|
Ancho de células oclusivas (µm) |
0.763 |
-0.407 |
-0.513 |
|
Área de células epidérmicas (µm2) |
0.098 |
0.739 |
-0.218 |
|
Grosor de la pared anticlinal de células epidérmicas en vista superficial (µm) |
0.880 |
0.128 |
-0.225 |
|
Índice estomático |
-0.194 |
0.044 |
-0.370 |
|
Número de estratos hipodérmicos |
0.249 |
-0.402 |
0.268 |
|
Ancho de células hipodérmicas en sección transversal (µm) |
-0.067 |
0.688 |
-0.005 |
|
Alto de células hipodérmicas en sección transversal (µm) |
-0.139 |
0.092 |
0.445 |
|
Grosor de la pared de células hipodérmicas (µm) |
-0.585 |
1.315 |
-1.135 |
|
Diámetro tangencial de los vasos del xilema secundario (µm) |
0.074 |
0.294 |
-0.285 |
|
Longitud de los elementos de vaso del xilema secundario (µm) |
0.090 |
0.126 |
-0.047 |
|
Grosor de la pared de fibras del xilema secundario (µm) |
0.003 |
-0.225 |
-0.303 |
|
Grosor de la pared de fibras asociadas al floema secundario (µm) |
-0.278 |
0.181 |
0.839 |
|
Longitud de fibras (µm) |
0.146 |
-0.229 |
-0.147 |
|
Grosor de fibras en la región media (µm) |
-0.049 |
0.070 |
0.127 |
|
Longitud de células erectas de los radios (µm) |
0.099 |
-0.429 |
-0.007 |
El análisis clasificatorio arrojó que 98% de los registros se clasificaron correctamente a los grupos establecidos a priori, 4 registros de S. vagans se clasificaron en S. murrillii. Los valores de las distancias cuadradas de Mahalanobis muestran que la distancia entre las nubes de puntos es grande (tabla 5); el valor de la prueba de distancias de Fisher es estadísticamente significativo (p <0.05). Los 7 caracteres con mayor carga en el ADC presentaron diferencias significativas (p <0.05) en el análisis de varianza para al menos 2 especies (tabla 6).
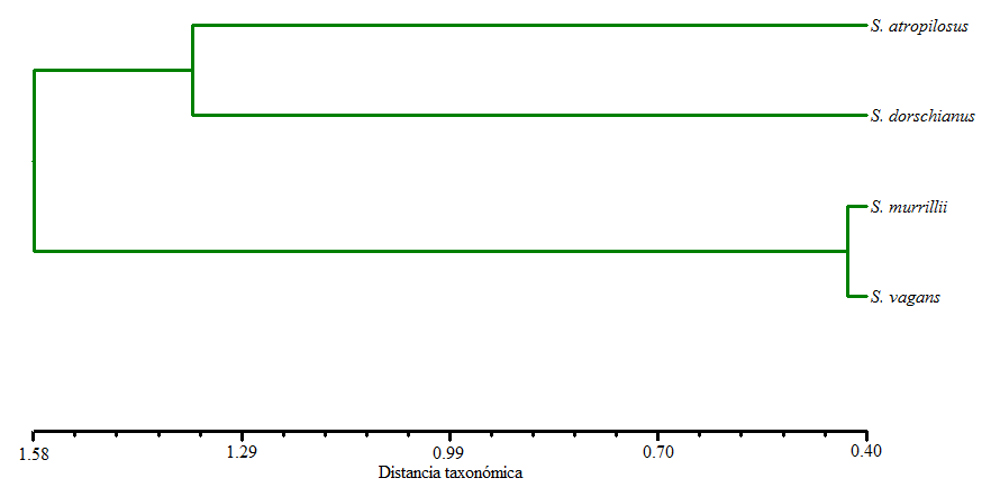
El análisis de agrupamiento mostró 2 grupos de especies (fig. 3). El primero y de mayor similitud está conformado por S. murrillii y S. vagans, quienes comparten una menor área de células epidérmicas, paredes anticlinales delgadas en las células epidérmicas, presencia de paredes periclinales convexas altas en las células epidérmicas, células hipodérmicas más angostas, así como haces vasculares corticales con fibras de paredes muy engrosadas. El segundo grupo y con menor similitud está integrado por S. atropilosus y S. dorschianus, que tienen cutículas más gruesas, células epidérmicas más grandes, paredes anticlinales más gruesas en las células epidérmicas y células epidérmicas con paredes periclinales externas convexas bajas. También comparten las células hipodérmicas más anchas, mayor grosor de la pared de las células hipodérmicas y mayor grosor de la pared de fibras asociadas al floema secundario.
Tabla 5
Distancias cuadradas de Mahalanobis (D2) de los 19 caracteres anatómicos cuantitativos evaluados por especie. Todos los centroides tienen diferencias estadísticamente significativas bajo la prueba de distancias de Fisher.
|
|
S. atropilosus |
S. dorschianus |
S. murrillii |
S. vagans |
|
S. atropilosus |
0 |
– |
– |
– |
|
S. dorschianus |
50.4931 |
0 |
– |
– |
|
S. murrillii |
65.6613 |
30.8549 |
0 |
– |
|
S. vagans |
42.0870 |
39.6858 |
10.6779 |
0 |
Tabla 6
Caracteres anatómicos cuantitativos más relevantes del tallo, evaluados por especie. Se presenta el promedio y desviación estándar (P ± D.E.). Letras distintas indican grupos distintos en la prueba de Tukey (p <0.05).
|
Carácter |
S. atropilosus |
S. dorschianus |
S. murrillii |
S. vagans |
|
Espesor de la cutícula (µm) |
3.607 ± 0.801a |
2.663 ± 0.480b |
1.727 ± 0.166d |
2.241 ± 0.504c |
|
Longitud de células oclusivas (µm) |
39.746 ± 2.364a |
33.213 ± 1.898b |
28.579 ± 1.664c |
32.667 ± 3.530b |
|
Área de células epidérmicas (µm2) |
743.002 ± 162.150b |
822.987 ± 179.510a |
562.618 ± 79.551c |
481.515 ± 125.139c |
|
Grosor de la pared anticlinal de células epidérmicas en vista superficial (µm) |
3.549 ± 0.809a |
2.500 ± 0.469b |
1.852 ± 0.258c |
1.885 ± 0.349c |
|
Ancho de células hipodérmicas en sección transversal (µm) |
41.87 ± 9.457b |
47.422 ± 8.624a |
34.094 ± 4.083c |
34.716 ± 6.461c |
|
Grosor de la pared de células hipodérmicas (µm) |
5.259 ± 1.107b |
6.162 ± 0.959a |
4.306 ± 0.380c |
3.116 ± 0.770d |
|
Grosor de la pared de fibras asociadas al floema secundario (µm) |
5.858 ± 1.217b |
7.248 ± 1.790a |
4.44 ± 0.738c |
4.759 ± 1.117c |
Discusión
En el ADC, los caracteres con valores de carga más altos corresponden a atributos de la epidermis y la hipodermis, lo que es congruente con lo reportado por Terrazas y Arias (2002), quienes enfatizan la importancia de estos tejidos como fuente de caracteres con relevancia taxonómica. Las 4 especies aquí estudiadas comparten la forma convexa de la pared periclinal externa de las células epidérmicas con variación en el grado de elevación (fig. 1D-F), así como el córtex heterogéneo con diferente proporción de parénquima en empalizada. Este cambio gradual no había sido reportado para miembros de la tribu Hylocereeae y puede ser taxonómicamente informativo en la nueva propuesta filogenética de la tribu, particularmente en Selenicereus y los clados internos recuperados por Korotkova et al. (2017), como ocurre en otras especies de Cactaceae (Bravo-Hollis, 1978; Gibson y Nobel, 1986; Terrazas y Arias, 2002; Terrazas y Mauseth, 2002).
Tradicionalmente se considera que el índice estomático es útil para el reconocimiento de taxones a diferentes niveles (Meidner y Mansfield, 1968; Salisbury, 1928; Sharma y Dunn, 1968). Sin embargo, Conde (1975) refiere que en Cactaceae, el índice estomático cambia con la adición de nuevas células epidérmicas, mientras que Herrera-Martínez et al. (2015) demostraron que en Selenicereus undatus las condiciones de cultivo y la región del tallo donde se calcule este parámetro, influyen en su variación, por lo que no representa un carácter diagnóstico. Nuestros resultados son congruentes con lo señalado por Conde (1975), al encontrar que el índice estomático no mostró tener una representatividad alta en el análisis. Por otra parte, los estomas de S. dorschianus son superficiales, congruente con lo reportado por Eggli (1984) para S. anthonyanus (Alexander) D.R. Hunt y S setaceus (Salm-Dyck ex DC.) Werderm., en el complemento de las especies analizadas, los estomas se encuentran semihundidos. Por tanto, consideramos que la posición de los estomas respecto a las células epidérmicas es de importancia taxonómica y podría tener un mayor peso en el reconocimiento de especies de Selenicereus poco conocidas (p.ej., S. ocamponis / S. purpusii, S. costaricensis (F.A.C. Weber) S. Arias et N. Korotkova / S. monacanthus (Lem.) D.R. Hunt, como en el caso de Ferocactus (Grego-Valencia et al., 2014).
En estudios previos se reportan cristales múltiples en las células de la epidermis sólo en algunos miembros de Cactoideae (Loza-Cornejo y Terrazas, 2003; Terrazas y Arias, 2002). En este trabajo se reportan cristales múltiples por célula en las 4 especies analizadas, la presencia de cristales en las células epidérmicas es una condición compartida con S. ocamponis, S. purpusii y S. undatus (García-Aguilar et al., 2009). De acuerdo con Terrazas y Arias (2002), las condiciones ambientales influyen sobre el grosor de la cutícula y la hipodermis, por lo que recomiendan evitar su uso como caracteres taxonómicos. Sin embargo, en este caso, el espesor de la cutícula, el grosor de la pared de células hipodérmicas, así como el ancho de las mismas en sección transversal tienen valores de carga altos en el ADC y permiten distinguir a las especies. Aunque no hay otros estudios que respalden la eficacia de estos atributos en el reconocimiento de especies, el espesor de la cutícula, es importante para diferenciar a Cylindropuntia y Opuntia (Conde, 1975). Terrazas y Mauseth (2002), señalan que el córtex en Cactaceae no es informativo; sin embargo, en el grupo de Selenicereus analizado, el córtex puede tener una proporción diferencial de células de parénquima en empalizada y de reserva, siendo una mayor proporción de parénquima en empalizada un atributo que permitió diferenciar a S. atropilosus del resto de las especies.
Las células epidérmicas con menor área, las paredes anticlinales adelgazadas en las células epidérmicas, las paredes periclinales externas convexas más altas, las células hipodérmicas más angostas, así como los haces vasculares corticales con fibras de paredes muy gruesas, son caracteres comunes en S. vagans y S. murrillii. Es relevante interpretar esos atributos en un análisis de evolución de caracteres que permitan evaluar si representan apomorfias de estas especies. Por otra parte, reconocemos que caracteres como la cutícula más delgada, las células oclusivas más cortas y las células hipodérmicas con paredes más gruesas están presentes en S. murrillii pero no en S. vagans.
En este estudio, la longitud de los elementos celulares del xilema secundario no tuvo un valor de carga alto en el ADC; sin embargo, el grosor de la pared de las fibras de esclerénquima asociado al floema secundario, sí tuvo un valor de carga alto en dicho análisis. Conde (1975) reporta en el género Opuntia un comportamiento similar en los elementos del xilema secundario y señala que la amplia variación en la longitud de estos tipos celulares, se debe a que en el origen, las células iniciales cambiales tienen un diámetro bien definido que se conserva hasta su madurez, lo contrario ocurre con la longitud de estas células, en donde la fase de elongación es variable y se ve afectada por el ambiente (Bailey y Srivastava, 1962). En el presente estudio, S. dorschianus, a diferencia del resto de las especies estudiadas, tiene madera dimorfa, en donde se presenta una fase de desarrollo de la madera que tiene los vasos embebidos en una matriz parenquimatosa, alternándose con una fase de madera con vasos embebidos en una matriz fibrosa. La condición de dimorfismo en la madera ya había sido reportada para S. monacanthus (Lem.) D.R. Hunt por Mauseth y Plemons (1995); de acuerdo a Reyes-Rivera et al. (2015), las maderas fibrosas proveen soporte mecánico significativo, mientras que las maderas parenquimatosas son propias de plantas con tallos procumbentes, lo que podría favorecer el hábito trepador en Selenicereus.
Korotkova et al. (2017) comprobaron que el grupo S. vagans es monofilético y fuertemente soportado y está integrado por S. atropilosus, S. dorschianus, S. murrillii y S. vagans. Los 4 grupos establecidos a priori en el ADC, se mantienen independientes con centroides estadísticamente distintos entre sí; sin embargo, las similitudes anatómicas, morfológicas, así como su distribución geográfica corroboran que las especies analizadas están estrechamente relacionadas. El presente estudio anatómico, comparado con un enfoque numérico, demostró que los caracteres anatómicos cuantitativos del tallo (particularmente los de la epidermis y la hipodermis) son tan importantes como los caracteres cualitativos y dado que permiten delimitar especies dentro del grupo S. vagans, podemos decir que son taxonómicamente informativos. Estos resultados aportan más información que permite considerar a S. murrillii como una entidad taxonómica distinta de S. vagans, con lo que se complementan los estudios morfológicos y moleculares que se han llevado a cabo hasta el momento (Korotkova et al., 2017). Más de 60% de los caracteres cuantitativos, además de algunos cualitativos como la ausencia de intrusiones cuticulares y una menor proporción de parénquima en empalizada en el córtex, avalan la afinidad filogenética de Selenicereus dorschianus con el grupo S. vagans.
Referencias
Angyalossy-Alfonso, V., Baas, P., Carlquist, S., Peres-Chimelo, J., Rauber-Coradin, V. T., Détienne, P. et al. (1989). List of microscopic features for hardwood identification. International Association of Wood Anatomists Bulletin, New Series, 10, 219–332.
Arroyo-Cosultchi, G., Terrazas, T., Arias, S. y López-Mata, L. (2010). Delimitación de Neobuxbaumia mezcalaensis y N. multiareolata (Cactaceae) con base en análisis multivariados. Boletín de la Sociedad Botánica de México, 86, 53–64. http://dx.doi.org/10.17129/botsci.2320
Bailey, I. W. y Srivastava, L. M. (1962). Comparative anatomy of the leaf-bearing Cactaceae, IV. The fusiform initials of the cambium and the form and structure of their derivates. Journal of the Arnold Arboretum, 43, 187–202. https://www.jstor.org/stable/43781430
Baker, M. (2006a). A new florally dimorphic hexaploid, Echinocereus yavapaiensis sp. Nov. (section Triglochidiatus, Cactaceae) from central Arizona. Plant Systematics and Evolution, 258, 63–83. https://doi.org/10.1007/s00606-005-0390-9
Baker, M. (2006b). Circumscription of Echinocereus arizonicus subsp. arizonicus: phenetic analysis of the morphological characters in section Triglochidiatus (Cactaceae), Part II. Madroño, 53, 388–399. https://doi.org/10.3120/0024-9637(2006)53[388:coeasa]2.0.co;2
Baker, M. y Butterworth, C. A. (2013). Geographic distribution and taxonomic circumscription of populations within Coryphantha section Robustispina (Cactaceae). American Journal of Botany, 100, 984–997. https://doi.org/10.3732/ajb.1200619
Baker, M. A. y Johnson, R. A. (2000). Morphometric analysis of Escobaria sneedii var. sneedii, E. sneedii var. leei and E. guadalupensis (Cactaceae). Systematic Botany, 25, 577–587. https://doi.org/10.2307/2666722
Bauer, R. (2003). A synopsis of the tribe Hylocereeae F. Buxb. Cactaceae Systematics Initiatives, 17, 43–50.
Bauer, R. (2009). Selenicereus dorschianus Ralf Bauer spec. nov., eine neue Art aus dem westlichen México (Jalisco) mit grünen Früchten-Beschreibung inter Berücksichtigung neuer Erkenntnisse über Selenicereus vagans (K. Brandegee) Britton et Rose und Selenicereus murrillii Britton et Rose. EPIG, 69, 5–19.
Bravo-Hollis, H. (1978). Las cactáceas de México. Vol. 1 (2da. edición). Ciudad de México, México: Universidad Nacional Autónoma de México.
Conde, L. (1975). Comparisons of five species of Opuntia (Cactaceae). Annals of the Missouri Botanical Garden, 62, 425–473. https://doi.org/10.2307/2395206
Cope, J. S., Corney, D., Clark, J. Y., Remagnino, P. y Wilkin, P. (2012). Plant species identification using digital morphometrics: A review. Expert Systems with Applications, 39, 7562–7573. https://doi.org/10.1016/j.eswa.2012.01.073
Eggli, U. (1984). Stomatal types of Cactaceae. Plant Systematics and Evolution, 146, 197–214. https://doi.org/10.1007/bf00989546
García-Aguilar, M. A., Terrazas, T. y Arias, S. (2009). Anatomía caulinar de tres especies del género Hylocereus (Berger) Britton et Rose (Cactaceae) en México. Revista Fitotecnia Mexicana, 32, 201–208.
García-Aguilar, M. A., Terrazas, T., Segura-León, O., Arias, S., Vibrans, H. y López-Mata, L. (2013). Caracterización molecular de tres especies de Hylocereus (Cactaceae) presentes en México. Revista Fitotecnia Mexicana, 36, 13–22.
Gibson, A. C. y Nobel, P. S. (1986). The cactus primer. Cambridge, Massachusetts: Harvard University Press.
Grego-Valencia, D., Terrazas, T., Vázquez-Sánchez, M. y Arias, S. (2014). Ferocactus (Cactaceae) epidermis: its systematic value. Journal of the Torrey Botanical Society, 141, 313–325. https://doi.org/10.3159/torrey-d-1-00023.1
Guzmán, U., Arias, S. y Dávila, P. (2007). Catálogo de cactáceas Mexicanas. Ciudad de México, México: Universidad Nacional Autónoma de México/ Comisión Nacional para el Conocimiento y Uso de la Biodiversidad.
Herrera-Martínez, V., Ríos-Hernández, L., Gracidueñas-Piña, C., Lara-Ibarra, A., Adabache-Ortiz, A., Soria-Guerra, R. E. et al. (2015). Effect of culture conditions on stomatal density and stomatal index in four cactus pecies. Haseltonia, 20, 43–50. https://doi.org/10.2985/026.020.0108
Koch, K., Bhushan, B. y Barthlott, W. (2009). Multifunctional surface structures of plants: an inspiration for biomimetics. Progress in Materials Science, 54, 137–178. https://doi.org/10.1016/j.pmatsci.2008.07.003
Korotkova, N., Borsch, T. y Arias, S. (2017). A phylogenetic framework for the Hylocereeae (Cactaceae) and implications for the circumscription of the genera. Phytotaxa, 327, 001–046. https://doi.org/10.11646/phytotaxa.327.1.1
Loza-Cornejo, S. y Terrazas, T. (2003). Epidermal and hypodermal characteristics in North American Cactoideae (Cactaceae). Journal of Plant Research, 116, 27–35. https://doi.org/10.1007/s10265-002-0066-2
Mauseth, J. D. y Plemons, B. J. (1995). Developmentally variable, polymorphic woods in Cacti. American Journal of Botany, 82, 1199–1205. https://doi.org/10.2307/2446241
Meidner, H. y Mansfield, T. A. (1968). Physiology of Stomata. New York: McGraw-Hill.
Mota-Lambert, S., Leite-Borba, E., Camara-Machado, M. y Da Silva-Andrade, S. (2006). Allozyme Diversity and norphometrics of Melocactus paucispinus (Cactaceae) and evidence for hybridization with M. concinnus in the Chapada Diamantina, Northeastern Brazil. Annals of Botany, 97, 389–403. https://doi.org/10.1093/aob/mcj052
Reyes-Rivera, J., Canché-Escamilla, G., Soto-Hernández, M. y Terrazas, T. (2015). Wood chemical composition in species of Cactaceae: the relationship between lignification and stem morphology. Plos One, 10, 1–17. https://doi.org/10.1371/journal.pone.0123919
Salisbury, E. J. (1928). On the causes and ecological significance of stomatal frequency with special reference to the woodland flora. Philosophical Transactions of the Royal Society B., 216, 1–65.
Sánchez, D., Arias, S. y Terrazas, T. (2013). Análisis morfométrico de las especies de Echinocereus sección Triglochidiati (Cactaceae) en México. Brittonia, 65, 368–385. https://doi.org/10.1007/s12228-012-9285-6
Sandoval-Zapotitla, E., Rojas-Leal, A., Guzmán-Ramos, C., Carmona-Jiménez, L., Ponce-Salazar, R. M., León-Gómez, C. et al. (2005). Cuadernos 38. Técnicas aplicadas al estudio de la anatomía vegetal. Ciudad de México: Universidad Nacional Autónoma de México.
Sharma, G. K. y Dunn, D. B. (1968). Effect of environment of the cuticular features in Kalanchoe fedschenkoi. Bulletin of the Torrey Botanical Club, 95, 464–473. https://doi.org/10.2307/2483478
Tapia, H. J., Arias, S., Yánez-Espinosa, L. y Terrazas, T. (2016). El uso de espinas del tallo en la identificación de las especies de Neobuxbaumia (Cactaceae). Revista Mexicana de Biodiversidad, 87, 288–300. https://doi.org/10.1016/j.rmb.2016.04.006
Terrazas, T. y Arias, S. (2002). Comparative stem anatomy in the subfamily Cactoideae. The Botanical Review, 68, 444–473. https://doi.org/10.1663/0006-8101(2002)068[0444:csaits]2.0.co;2
Terrazas, T., Cházaro, M. y Arreola, H. (2013). Selenicereus murrillii. IUCN Red List of Threatened Species, Version 2013.2. Recuperado el 10 diciembre, 2017 de: www.iucnredlist.org
Terrazas, T. y Loza-Cornejo, S. (2002). Phylogenetic relationships of Pachycereeae: a cladistic analysis based on anatomical-morphological data. En T. H. Flemming y A. Valiente-Banuet (Eds.), Evolution, ecology, conservation of the columnar cacti, their mutualists (pp. 66–86). Tucson: Arizona University Press.
Terrazas, T. y Mauseth, J. D. (2002). Shoot anatomy and morphology. En P. S. Nobel (Ed.), Cacti: biology and uses (pp. 23–40). Los Angeles: University of California Press.
Vázquez-Sánchez, M., Terrazas, T., Grego-Valencia, D. y Arias, S. (2017). Growth form and wood evolution in the tribe Cacteae (Cactaceae). Willdenowia, 47, 49–67. https://doi.org/10.3372/wi.47.47106