Límites de distribución actual de Sturnira hondurensis
Laura Torres-Morales
División de Posgrado, Instituto de Ecología, A.C., carretera Antigua a Coatepec 351, El Haya, 91070 Xalapa, Veracruz, México
*Autor para correspondencia: arualtm@hotmail.com (L. Torres-Morales)
Resumen
Sturnira hondurensis es una de las 2 especies de murciélagos del género que se distribuyen desde Centroamérica hasta el norte de México; recientemente fue reconocida a nivel de especie, pero sus límites de distribución geográfica son inciertos. Con la finalidad de conocer estos límites, se modeló su nicho ecológico para determinar su distribución geográfica actual. Se encontró que para S. hondurensis, el límite sur se localiza en la Cordillera Central de Panamá, con una disyunción en la depresión de Nicaragua, mientras que hacia el norte, los límites se encuentran desde las sierras Madre Occidental y Madre Oriental en México, con excepción de la península de Yucatán.
Palabras clave:
Centroamérica; Depresión Nicaragua; Murciélagos neotropicales; Nicho ecológico
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Current distribution limits of Sturnira hondurensis
Abstract
Sturnira hondurensis is one of the 2 bat species in this genus whit geographical distribution from Central America to northern Mexico. It was recently recognized as species level, and its geographic distribution boundaries are uncertain. In order to know the limits of this species, its ecological niche was modeled to determine its geographical distribution in the present. The results shown that S. hondurensis has a southern distribution limit lies in the Central Cordillera of Panama, with a disjunction in the Depression of Nicaragua. Meanwhile to the north, the distribution limits are found from the Sierra Madre Occidental and Sierra Madre Oriental in Mexico, with the exception of the Yucatán Peninsula.
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Keywords:
Central America; Nicaragua Depression; Neotropical bats; Ecological niche
Introducción
Dentro de los murciélagos de la subfamilia Stenodermatinae (Chiroptera: Phyllostomidae) el género Sturnira Gray, 1842 es el más diverso con al menos 21 especies reconocidas de murciélagos frugívoros de origen neotropical (Hernández-Canchola y León-Paniagua, 2017; Molinari et al., 2017; Velazco y Patterson, 2013). Son conocidos como murciélagos de hombros amarillos, se caracterizan por presentar, generalmente, manchas de color ocre sobre los hombros (charreteras), un uropatagio peludo reducido y carecen de cola (Velazco y Patterson, 2013). El área de distribución del género se extiende desde el norte de Argentina hasta México y las Antillas Menores. La mayor diversidad del género se presenta en las laderas boscosas al norte de los Andes y la región del Chocó (Velazco y Patterson, 2013). Actualmente, 5 especies del género Sturnira se distribuyen en Centroamérica (S. hondurensis, S. burtonlimi, S. mordax, S. parvidens y S. luisi). Todas con origen posterior al surgimiento definitivo del puente terrestre de Panamá (hace 3 Ma., Velazco y Patterson, 2013). Sturnira parvidens (Goldman, 1917) y Sturnira hondurensis (Goodwin, 1940) son las únicas especies que han expandido su rango de distribución hasta México (Hernández-Canchola y León-Paniagua, 2017; Téllez-Girón, 2005). Antes del análisis filogenético del género Sturnira de Velazco y Patterson (2013), S. hondurensis era considerada sinónimo de S. ludovici mientras que S. parvidens era considerada S. lilium parvidens subespecie de S. lilium, de modo que los límites de distribución de ambas especies eran inciertos (Gardner, 2008; Iudica, 2000; Velazco y Patterson, 2013). Recientemente, Hernández-Canchola y León-Paniagua (2017) esclarecieron los límites geográficos de S. parvidens. Sin embargo, para S. hondurensis las discrepancias sobre los límites de distribución continúan existiendo.
Sturnira hondurensis habita en los bosques a mediana altitud (500-2,000 m snm, Téllez-Girón, 2005; Reid, 2009). La información disponible sobre los límites en el sur de su distribución es confusa. Goodwin (1940, 1942) describió S. hondurensis a partir de especímenes hondureños y lo diferenció de S. ludovici ecuatoriano por la presencia de 2 lóbulos en los incisivos inferiores. Mientras que en los ejemplares de Ecuador de Anthony (1924) y Albuja (1999), el borde de los incisivos es entero, sin lóbulos. Goodwin (1946) señala que los organismos costarricenses de S. hondurensis son de menor tamaño que los de Honduras, pero no hay otras características que los diferencien. Hershkovitz (1949), consideró a S. lilium bogotensis y S. hondurensis sinónimos de S. ludovici, sin ninguna explicación. Jones y Phillips (1964) no encontraron diferencias significativas en el tamaño corporal de especímenes costarricenses. Pacheco y Patterson (1991) indican que S. ludovici de Ecuador, Colombia y Venezuela tienen los incisivos inferiores bilobulados. Sánchez-Hernández et al. (2005) estudiaron las características morfológicas de una muestra de 8 individuos identificados como S. hondurensis y 16 individuos de S. ludovici de Venezuela, determinándolos según los criterios de Goodwin (1940), y reportaron la presencia de S. hondurensis en el extremo sur de Panamá en Sudamérica. Sin embargo, todos los ejemplares que analizaron tienen los incisivos inferiores bilobulados, lo cual no correspondió con la descripción de S. ludovici de Anthony (1924); además, no encontraron diferencias morfométricas entre los 2 taxones distribuidos en Venezuela. Molinari et al. (2017) describieron una nueva especie S. adrianae para Venezuela y Colombia y asignaron los organismos estudiados por Sánchez-Hernández et al. (2005) a esta nueva especie. Varios autores han señalado que la variación morfológica de las especies del género Sturnira es sutil, en algunos casos los caracteres utilizados para diagnosticar diferentes especies han demostrado ser inconsistentes y las relaciones entre especies no pueden ser clarificadas con una perspectiva morfológica (Iudica, 2000; Jarrín y Clare, 2013; Pacheco y Patterson, 1991). Mientras tanto, los estudios moleculares apoyan la presencia de S. hondurensis desde México hasta la región montañosa central de Honduras (Iudica, 2000; Velazco y Patterson, 2013), la ausencia de muestras genéticas de Nicaragua, Costa Rica y Panamá imposibilita establecer la identidad taxonómica de estas poblaciones y por lo tanto, los límites de la distribución de S. hondurensis en Sudamérica.
El modelado de nicho ecológico (MNE) ha sido ampliamente utilizado como una herramienta que permite determinar, representar y estudiar los rangos actuales de distribución potencial de las especies con base en información de su presencia, previamente registrada, y asociándola con variables climáticas (Soberón y Peterson, 2005). En particular con murciélagos, el MNE se ha utilizado para evaluar la distribución potencial y determinar las principales variables ambientales y geográficas que afectan su distribución (Giménez et al., 2015; Weber et al., 2010). Así como también, para predecir la distribución actual y futura, ya sea para identificar las áreas en las que existe mayor riesgo de enfermedades debido a la presencia del vampiro común (Lee et al., 2012), o para evaluar el impacto de cambio climático sobre la distribución altitudinal de murciélagos frugívoros y nectarívoros (Echeverría, 2013).
En esta investigación, se utilizaron modelos de nicho ecológico para inferir la distribución potencial de Sturnira hondurensis en el presente, para contestar la siguiente pregunta: ¿existen condiciones ambientales idóneas actuales para la presencia de S. hondurensis en el norte de Sudamérica?
Materiales y métodos
Debido a la ambigüedad taxonómica en Sturnira hondurensis y las repercusiones en MNE cuando los límites taxonómicos no son claros (Mota-Vargas y Rojas-Soto, 2016), primero se realizó una revisión bibliográfica exhaustiva para recabar registros de S. hondurensis, en donde se consideraron estudios de filogeografía y variación genética, así como estudios morfológicos para tener certeza de la identidad taxonómica. Los estudios consultados para México fueron de Miranda (2012), Torres-Morales et al. (en prensa) y Verde-Arregoitia et al. (2018); para El Salvador y Guatemala, de Clare et al. (2011) y de México a Honduras, de Jones y Phillips (1964), Iudica (2000) y Velazco y Patterson (2013).
Adicionalmente, se consideraron las 19 variables climáticas del proyecto WorldClim (Hijmans et al., 2005). Las capas climáticas tienen resolución de 30 segundos de arco (1pixel ~1 km2). El área a modelar la distribución potencial de S. hondurensis (M) se delimitó con base en la distribución de las especies del género Sturnira sugerida por Velazco y Patterson (2013). El recorte geográfico incluye desde México hasta el norte de Sudamérica (Ecuador, Colombia y Venezuela).
Para desarrollar el modelo de nicho ecológico se usó el algoritmo de máxima entropía de MaxEnt v.3.4.1 (Phillips et al., 2006), que estima la probabilidad de distribución basada en la máxima entropía, realizando un cierto número de iteraciones hasta alcanzar un límite de convergencia, produciendo un mapa que contiene valores para la idoneidad de hábitat desde 0 (inadecuado) a 1 (adecuado) (Phillips et al., 2006). Para un primer modelo exploratorio, se utilizaron las 19 variables climáticas y se evaluó qué variables fueron relevantes de acuerdo con la prueba de jackknife calculada por MaxEnt (Royle et al., 2012). En un segundo ejercicio de modelado, se generó la distribución de S. hondurensis utilizando las variables ambientales no correlacionadas (r < 0.8) en combinación con las variables ambientales más relevantes identificadas en el primer análisis. Estos pasos nos permitieron reducir el exceso de ajuste de los modelos de distribución generados para esta especie (Ortega-Andrade et al., 2015; Rojas-Soto et al., 2008).
El modelo de nicho para Sturnira hondurensis se generó con 80% de los registros (datos de entrenamiento) y otro 20% se empleó para la validación (puntos de prueba). Se especificaron 5,000 iteraciones y se especificó que el programa no debía extrapolar con el fin de evitar proyecciones artificiales a partir de valores extremos de las variables ecológicas (Elith et al., 2011). Todos los demás parámetros de MaxEnt se mantuvieron en la configuración predeterminada. El formato cloglog (Phillips et al., 2017) se utilizó para obtener los valores de adecuación de hábitat (probabilidad continua de 0 a 1), que posteriormente se convirtieron en valores binarios de presencia-ausencia sobre la base del umbral establecido (ver más abajo). Frente a las limitaciones que presenta la evaluación del área bajo la curva (Lobo et al., 2008), se optó por trabajar con la ROC parcial, la cual se utiliza para resolver problemas asociados con las AUC, evitando una ponderación inadecuada de la omisión y los componentes de comisión en el análisis (Lobo et al., 2008; Peterson et al., 2008). Se calculó el AUC parcial utilizando el programa Tool for Partial-ROC versión 1.0. (Narayani, 2008) con 25% de los datos originales para la evaluación del modelo. Presentamos los resultados ROC parciales como la proporción del modelo AUC con la expectativa nula (“relación AUC”; Peterson et al., 2008), se usó una proporción de puntos para bootstrap de 50%, el número de muestras con reemplazo fue de 1,000 y el umbral de omisión usado fue del 95%.
Para ayudar a la validación e interpretación del modelo, las áreas adecuadas se distinguieron de las áreas inadecuadas al establecer un umbral de decisión que representaba una predicción positiva para la presencia de la especie (Pearson et al., 2006). Para este estudio, el umbral establecido fue el valor acumulado fijo 10 (VAF10), este umbral puede interpretarse ecológicamente al identificar que los pixeles predichos con este valor son al menos tan adecuados como aquellos pixeles donde la especie ha sido registrada previamente, lo que permite rechazar 10% más bajo de posibles valores predichos en el modelo. Para visualizar e interpretar todas las salidas en formato raster, se utilizó el sistema de información geográfica ArcView 3.2 (marca registrada de Environment Systems Research Institute).
Resultados
Se obtuvo un total de 92 registros desde México hasta El Salvador y Honduras, estos registros fueron utilizados para generar el modelo de nicho ecológico (fig. 1).
El área de distribución potencial estimada se muestra en la figura1. El modelo mostró valores de AUC-test (0.96) y AUC-ratio (1.93 ± 0.026; p < 0.05) y un valor VAF10 (valor umbral) de 0.132. Obtuvimos un área total de distribución de ~537,317 km2. Las variables ambientales usadas y su contribución porcentual al modelo se muestran en la tabla 1. El hábitat idóneo disponible se extiende desde las sierras Madre Oriental y Occidental en México con excepción de la península de Yucatán, hacia el sur siguiendo por la sierra Madre y la sierra Cuchamatanes en Guatemala, la región montañosa de Honduras y El Salvador, hasta la cordillera Isabelia en Nicaragua. Las tierras bajas de la depresión de Nicaragua separan estas áreas de las de la región montañosa entre Costa Rica y Panamá (desde la sierra Tilarán hasta la cordillera Talamanca) (fig. 1). Para el norte de Sudamérica, los fragmentos de hábitat idóneo se distribuyen de la siguiente forma, en Ecuador una franja en la región occidental de la cordillera de los Andes, en Colombia la región norte de la sierra Nevada de Santa Marta, la sierra de Perijá y la cordillera Oriental, y en Venezuela la cordillera de Mérida (fig. 1).
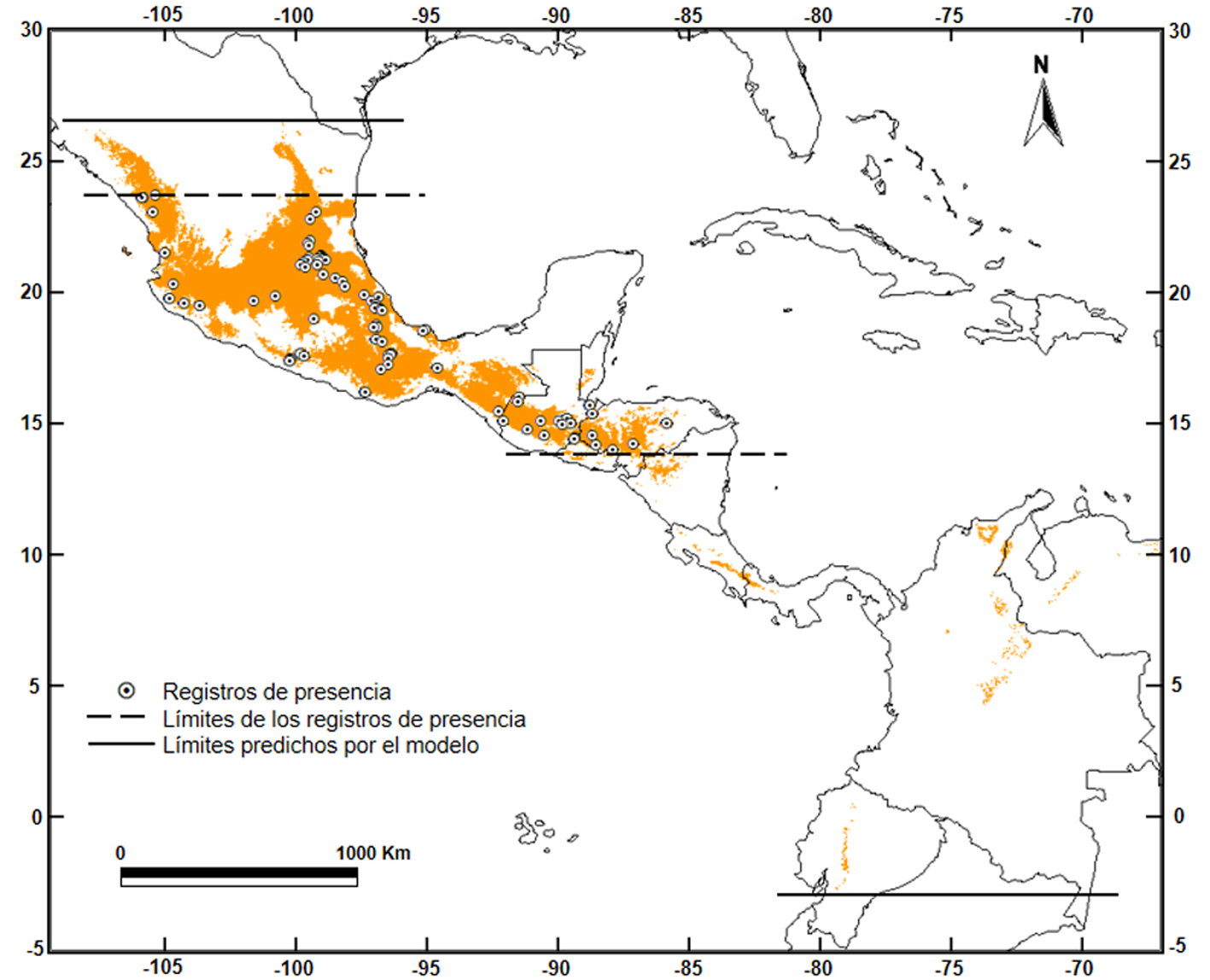
Tabla 1
Resumen de las variables ambientales seleccionadas, no correlacionadas, con contribuciones relativas (%) al modelo de Sturnira hondurensis.
|
Abreviatura |
Variable Ambiental |
Porcentaje de contribución |
|
Bio 4 |
Estacionalidad de la temperatura (desviación estándar X 100) |
29.9 |
|
Bio 6 |
Temperatura mínima del mes más frío |
23.1 |
|
Bio 9 |
Temperatura promedio del trimestre más seco |
21.9 |
|
Bio 13 |
Precipitación del mes más lluvioso (mm) |
16.2 |
|
Bio 7 |
Rango anual de temperatura (BIO5-BIO6) |
4.4 |
|
Bio 3 |
Isotermalidad (BIO2/BIO7)(*100) |
2.1 |
|
Bio 15 |
Estacionalidad de la precipitación (coeficiente de variación) |
1.4 |
|
Bio 19 |
Precipitación del trimestre más frío |
0.6 |
|
Bio 17 |
Precipitación del trimestre más seco (mm) |
0.3 |
Discusión
La distribución de una especie está limitada, en primer lugar, por sus restricciones fisiológicas ante múltiples factores ambientales (Mac Arthur, 1972). Los murciélagos de la familia Phyllostomidae no son la excepción, su distribución está determinada por la obtención de alimento y por características fisiológicas (Kalko, 1998; Kunz, 1982; Mello et al., 2009; Speakman y Thomas, 2003). Las restricciones fisiológicas dependen directamente de las condiciones ambientales, siendo las principales la temperatura y la humedad (Maciel-Mata et al., 2015). En comparación con las especies de murciélagos de la familia Vespertilionidae, los filostómidos son incapaces de entrar en torpor prolongado, esto sugiere que su distribución puede estar más estrechamente relacionada con la temperatura ambiental (McNab, 1988; Stevens, 2004, 2011). En este estudio, las variables relacionadas con la temperatura (ej., estacionalidad de la temperatura (desviación estándar × 100), temperatura mínima del mes más frío y temperatura promedio del trimestre más seco) se encuentran entre los indicadores más importantes en la idoneidad de hábitat. Esto también concuerda con lo encontrado para otras especies de murciélagos como Desmodus rotundus (Lee et al., 2012) y para las especies de murciélagos filostómidos (Echeverría, 2013), en las que las variables relacionadas con la temperatura influyen de manera importante en su presencia y distribución geográfica. Conocer las variables ambientales que influyen en la presencia de las especies en el espacio geográfico favorece la predicción certera sobre la distribución de dichas especies (Peterson y Soberón, 2012).
Echeverría (2013) analizó la riqueza y abundancia de especies de murciélagos nectarívoros y frugívoros (entre ellos S. ludovici) en un gradiente altitudinal en Costa Rica utilizando variables climáticas, así como de hábitat y espaciales. Como resultado, obtuvo que la riqueza de especies de murciélagos nectarívoros y frugívoros está relacionada positiva y significativamente con variables climáticas de temperatura y precipitación (ej., temperatura máxima del mes más cálido, temperatura media del trimestre más lluvioso, precipitación anual, precipitación del mes más seco), mientras que las variables de hábitat y las espaciales no fueron significativas. También encontró que la abundancia de murciélagos se relacionó positivamente con las variables de temperatura (ej., la temperatura media anual y temperatura del mes más cálido), mientras que las variables relacionadas con la precipitación no presentaron significancia. En su estudio, la especie más abundante en el gradiente 880 a 3,000 m de elevación fue S. ludovici. Mello et al. (2008) señalan que la abundancia de algunos murciélagos frugívoros puede verse afectada más por la temperatura que por la disponibilidad de alimento. En su estudio, las poblaciones de tierras altas de S. lilium migran a las zonas bajas durante los meses más fríos, probablemente debido a restricciones fisiológicas.
Hernández-Canchola y León-Paniagua (2017) analizaron los procesos genéticos y ecológicos que promovieron la diversificación y actual distribución de Sturnira parvidens, especie que alcanza distribución hasta los ecosistemas de tierras bajas de México. Como resultado, encontraron que la estacionalidad tanto de la temperatura como de la precipitación influyeron en la diferenciación de los nichos climáticos de S. parvidens. Además, los 2 haplogrupos encontrados mostraron expansión climática con respecto a las variables de temperatura (media anual, máxima del mes más cálido, mínima del mes más frío) y ninguno de los haplogrupos mostró expansión climática con respecto a la isotermalidad y las otras variables de precipitación (total anual, del mes más lluvioso, del mes más seco).
Las especies de Sturnira que actualmente se localizan en Centroamérica se originaron a partir de ancestros originarios del norte de Sudamérica que migraron hacia el norte por el istmo de Panamá durante el gran intercambio biótico americano (Velazco y Patterson, 2013). El istmo de Tehuantepec (IT) en México, la depresión de Nicaragua (DN) en Nicaragua y el Darién en Panamá, han sido reconocidas como corredores y barreras geográficas para la dispersión de especies de origen neotropical (Gutiérrez-García y Vázquez-Domínguez, 2013; Marshall, 2007; Marshall y Liebherr, 2000), estas regiones ya estaban bien desarrolladas cuando S. hondurensis llegó a Centroamérica, sin embargo la presencia de estas rupturas geográficas pudo influir en su distribución hacia el norte.
En el modelo de S. hondurensis (especie que habita en altitudes intermedias y altas) no se encontró apoyo para el papel del IT como barrera geográfica en la distribución actual de esta especie. El IT es un valle que se encuentra ~220 m snm, tiene unos 250 km de ancho en su punto más estrecho y menos de 40 km de distancia entre las montañas a cada lado; se formó entre finales del Mioceno y el Plioceno tardío con la caída del bloque este a lo largo de la falla de Tehuantepec, dando lugar a una incursión marítima (Barrier et al., 1998). Ornelas et al. (2013) sugieren que dicha incursión marítima no pudo haber sumergido completamente el valle del istmo, por lo tanto, no pudo haber dado lugar a una separación completa de las tierras a cada lado del IT. Si S. hondurensis divergió de su grupo hermano durante el Plioceno tardío (c. 2.5 Ma.), como lo sugiere la filogenia de Velazco y Patterson (2013), entonces la llegada de esta especie al norte de México debió ocurrir por las tierras que no fueron afectadas por la incursión marítima.
Sturnira hondurensis parece ser una especie que tolera elevaciones intermedias y que en alguna circunstancia puede descender a las tierras bajas; ésta ha sido registrada en tierras bajas del IT (Barragán et al., 2010; Briones-Salas et al., 2015), en regiones costeras de Oaxaca (Buenrostro-Silva et al., 2012; Briones-Salas et al., 2015) y en las tierras bajas de la cuenca del río Usumacinta, Tabasco (Gordillo-Chávez et al., 2015). Actualmente, estas regiones están cubiertas de bosques tropicales secos (Olson et al., 2001; Rzedowski, 2006).
A diferencia del IT, el modelo sugiere que la depresión de Nicaragua ha jugado un papel más importante en la distribución de Sturnira hondurensis separando el área continua México-Nicaragua, de otra con hábitat idóneo en las regiones montañosas de Costa Rica y Panamá. La DN es un graben tectónico ~50 km de ancho que se extiende por más de 600 km a lo largo del frente volcánico en El Salvador y se extiende a través de Nicaragua hasta el norte de Costa Rica (McBirney y Williams, 1965; Weinberg, 1992). Las tierras bajas de la DN se inundaron a principios del Pleistoceno (Harmon, 2005); por ello, la región montañosa entre Costa Rica y Panamá debió ser inaccesible para S. hondurensis. Cabe recordar que tanto los datos genéticos como los datos morfológicos disponibles en la literatura, respaldan la presencia de S. hondurensis desde México hasta la región montañosa central de Honduras (Clare et al., 2011; Iudica, 2000; Jones y Phillips, 1964; Miranda, 2012; Velazco y Patterson, 2013; Verde-Arregoitia et al., 2018; Torres-Morales et al., en prensa), mientras que los datos genéticos entre Costa Rica y Panamá que se pensaba correspondían a S. ludovici (de la que S. hondurensis se consideraba sinónima), actualmente corresponden a S. burtonlimi especie hermana de S. hondurensis (Velazco y Patterson, 2013, 2014). La depresión de Nicaragua también ha actuado como barrera en otros taxones que se distribuyen en los bosques montanos húmedos de Centroamérica como aves, salamandras, serpientes y roedores (Arbeláez-Cortés et al., 2010; Bonaccorso et al., 2008; Castoe et al., 2009; Daza et al., 2010; Gutiérrez-García y Vázquez-Domínguez, 2012; Mota-Vargas y Rojas-Soto, 2016; Navarro-Sigüenza et al., 2008; Parra-Olea et al., 2004; Sánchez-González et al., 2008).
El Darién en Panamá (sur de Centroamérica) y el Chocó en Colombia (en el norte de Sudamérica) separan otras áreas disyuntas que el modelo identificó como hábitat idóneo en las regiones montañosas de Ecuador, Colombia y Venezuela. Esta distribución disyunta de hábitat potencial en las regiones montañosas del norte de Sudamérica es similar a la que Gardner (2008) describió para Sturnira oporaphilum ludovici y que se corresponde con el S. ludovici de Anthony (1924), reconocida como especies cercanamente relacionada a S. hondurensis (Velazco y Patterson, 2013). Recientemente, Molinari et al. (2017) describieron a Sturnira adrianae de las regiones montañosas al norte de Venezuela y Colombia, al igual que S. hondurensis, la especie nueva había sido confundida con S. ludovici, sin embargo, está más relacionada con S. oporaphilum. De acuerdo con Molinari et al. (2017), la especie que estaría ocupando los fragmentos de hábitat idóneo identificados en el modelo para el presente en la región montañosa entre Colombia y Venezuela, sería S. adrianae y no S. hondurensis, como lo sugirieron Sánchez-Hernández et al. (2005) al estudiar las características morfológicas de individuos identificados como Sturnira hondurensis y Sturnira ludovici de Venezuela.
En ocasiones, la predicción que se obtiene resulta mayor o menor a la distribución verdadera, algunos algoritmos tienden a sobrepredecir los modelos, mientras que otros tienden a sobreajustarlos (Soberón y Peterson, 2005). En el modelo de nicho ecológico de S. hondurensis se observa hábitat idóneo en algunas regiones de la planicie costera del golfo de México, ésto no se esperaba para esta especie que está asociada principalmente con bosques montanos, sin embargo, estas regiones coinciden con las serranías aisladas que interrumpen la planicie costera como la sierra de Tamaulipas en el estado del mismo nombre, las sierras de Chiconquiaco y de los Tuxtlas al centro y sur de Veracruz, respectivamente, así como la sierra Maya en Belice. Lo recomendable en esta situación, es hacer la corroboración en campo, de esta forma los resultados obtenidos se interpretarían mejor que si solo se generaliza el modelo de manera automática (Maciel-Mata et al., 2015).
Agradecimientos
Agradezco a Alejandro Espinosa, Eduardo Ruiz y Antonio Guillén, miembros del comité doctoral de LTM. El Consejo Nacional de Ciencia y Tecnología proporcionó una beca de doctorado para LTM y el Instituto de Ecología, A.C. (INECOL, Red de Biología y Conservación de Vertebrados) proporcionó apoyo logístico y financiero. Francisca Vidal García, Claudio Mota-Vargas, Eduardo Ruiz y Alejandro Espinosa, proporcionaron importantes comentarios a versiones anteriores del manuscrito.
Referencias
Albuja, L. (1999). Murciélagos del Ecuador, 2da. Edición. Cicetrónic, Quito, Ecuador.
Anthony, H. E. (1924). Preliminary report on Ecuadorean mammals, number 6. American Museum Novitates, 139, 1–8.
Arbeláez-Cortés, E., Nyári, A. S. y Navarro-Sigüenza, A. G. (2010). The differential effect of lowlands on the phylogeographic pattern of a Mesoamerica montane species (Lepidocolaptes affinis, Aves: Furnariidae). Molecular Phylogenetics and Evolution, 57, 658–668.
Barragán, F., Lorenzo, C., Morón, A., Briones-Salas, M. A. y López, S. (2010). Bat and rodent diversity in a fragmented landscape on the Isthmus of Tehuantepec, Oaxaca, Mexico. Tropical Conservation Science, 3, 1–16.
Barrier, E., Velasquillo, L., Chávez, M. y Gualon, R. (1998). Neotectonic evolution of the Isthmus of Tehuantepec (southeastern Mexico). Tectonophysics, 287, 77–96.
Bonaccorso, E., Navarro-Sigüenza, A. G., Sánchez-González, L. A., Peterson, A. T. y García-Moreno, J. (2008). Genetic differentiation of the Chlorospingus ophthalmicus complex in Mexico and Central America. Journal of Avian Biology, 39, 311–321.
Briones-Salas, M., Cortés-Marcial, M. y Lavariega, M. C. (2015). Diversidad y distribución geográfica de los mamíferos terrestres del estado de Oaxaca, México. Revista Mexicana de Biodiversidad, 86, 685–710.
Buenrostro-Silva, A., Antonio-Gutiérrez, M. y García-Grajales, J. (2012). Mamíferos del Parque Nacional Laguna de Chacahua y La Tuza de Monroy, Oaxaca, México. Acta Zoológica Mexicana (n.s.), 28, 56–72.
Castoe, T. A., Daza, J. M., Smith, E. N., Sasa, M. M., Kuch, U., Campbell, J. A. et al. (2009). Comparative phylogeography of pitvipers suggests a consensus of ancient Middle American highland biogeography. Journal of Biogeography, 36, 88–103.
Clare, E. L., Lim, B. K., Fenton, M. B. y Hebert, P. D. N. (2011). Neotropical bats: estimating species diversity with DNA barcodes. Plos One, 6, e22648.
Daza, J. M., Castoe, T. A. y Parkinson, C. L. (2010). Using regional comparative phylogeographic data from snake lineages to infer historical processes in Middle America. Ecography, 33, 343–354.
Echeverría, J. L. T. (2013). Ensambles de murciélagos frugívoros y nectarívoros en un gradiente altitudinal de Costa Rica y su potencial distribución bajo escenarios de cambio climático (Tesis de maestría). Centro Agronómico Tropical de Investigación y Enseñanza. Turrialba, Costa Rica.
Elith, J., Phillips, S. J., Hastie, T., Dudík, M., Chee, Y. E. y Yates, C. J. (2011). A statistical explanation of Maxent for ecologist. Diversity and Distribution, 17, 43–57.
Gardner, A. L. (2008). Mammals of South America, Volume 1. Chicago: The University of Chicago Press.
Giménez, A. L., Giannini, N. P., Schiaffini, M. I. y Martin, G. M. (2015). Geographic and potential distribution of a poorly known South American bat, Histiotus macrotus (Chiroptera: Vespertilionidae). Acta Chiropterologica, 17, 143–158.
Goldman, E. A. (1917). New mammals from North and Middle America. Proceedings of the Biological Society of Washington, 30, 107–116.
Goodwin, G. G. (1940). Three new bats from Honduras and the first record of Enchisthenes harti (Thomas) for North America. American Museum Novitates, 1075, 1–3.
Goodwin, G. G. (1942). Mammals of Honduras. Bulletin of the American Museum of Natural History, 79, 107–195.
Goodwin, G. G. (1946). Mammals of Costa Rica. Bulletin of the American Museum of Natural History, 87, 271–474.
Gordillo-Chávez, E. J., Zayas, E. E. M., García-Morales, R., Garduza, M. A. M., García, C. V. y Valdez-Leal, J. D. (2015). Mastofauna del humedal Chaschoc-Sejá en Tabasco, México. Therya, 6, 535–544.
Gray, J. E. (1842). Description of some new genera and fifty unrecorded species of Mammalia. Annals and Magazine of Natural History, 10, 255–257.
Gutiérrez-García, T. A. y Vázquez-Domínguez, E. (2012). Biogeographically dynamic genetic structure bridging two continents in the monotypic Central American rodent, Ototylomys phyllostis. Biological Journal of the Linnean Society, 107, 593–610.
Gutiérrez-García, T. A. y Vázquez-Domínguez, E. (2013). Consensus between genes and stones in the biogeographic and evolutionary history of Central America. Quaternary Research, 79, 311–324.
Harmon, R. S. (2005). Geological development of Panama. En R. S. Harmon (Ed.), The Río Chagres, Panama (pp. 45-62). Dordrecht: Water Science and Technology Library, Vol. 52. Springer.
Hernández-Canchola, G. y León-Paniagua, L. (2017). Genetic and ecological processes promoting early diversification in the lowland Mesoamerican bat Sturnira parvidens (Chiroptera: Phyllostomidae). Molecular Phylogenetics and Evolution, 114, 334–345.
Hershkovitz, P. (1949). Mammals of Northern Colombia, preliminary Report No. 5: Bats (Chiroptera). Proceedings of the United States National Museum, 99, 429–454.
Hijmans, R. J., Cameron, S. E., Parra, J. L., Jones, P. y Jarvis, A. (2005). Very high resolution interpolated climate surfaces for global land areas. International Journal of Climatology, 25, 1965–1978.
Iudica, C. A. (2000). Systematic revision of the neotropical fruit bats of the genus Sturnira: a molecular and morphological approach (Tesis doctoral). University of Florida, Gainesville, Florida, EUA.
Jarrín, V, P. y Clare, E. L. (2013). Systematics of Sturnira (Chiroptera: Phyllostomidae) in Ecuador, with comments on species boundaries. Zootaxa, 3630, 165–183.
Jones, J. K. Jr. y Phillips, G. L. (1964). A new subspecies of the fruit-eating bat, Sturnira ludovici, from Western México. Lawrence, Kansas: University of Kansas.
Kalko, E. (1998). Organization and diversity of tropical bat communities through space and time. Zoology, 101, 281–297.
Kunz, T. (1982). Ecology of bats. New York: Plenum Press.
Lee, D, N., Papes, M. y Van Den Bussche, R. A. (2012). Present and potential future distribution of common vampire bats in the Americas and the associated risk to cattle. Plos One, 7, e42466.
Lobo, J. M., Jiménez-Valverde, A. y Real, R. (2008). AUC: a misleading measure of the performance of predictive distribution models. Global Ecology and Biogeography, 17, 145–151.
Mac Arthur, R. H. (1972). Geographical ecology. Patterns in the distribution of species. New York: Harper and Row.
Maciel-Mata, C. A., Manríquez-Morán, N., Octavio-Aguilar, P. y G. Sánchez-Rojas. (2015). El área de distribución de las especies: revisión del concepto. Acta Universitaria, 25, 3–19.
Marshall, C. J. (2007). The geomorphology and physiographic provinces of CA. En J. Bundschuh y G. E. Alvarado (Eds.), Central America, geology, resources And hazards (pp. 1–51). Londres: Taylor y Francis.
Marshall, C. J. y Liebherr, J. K. (2000). Cladistic biogeography of the Mexican transition zone. Journal of Biogeography, 27, 203–216.
McBirney, A. R. y Williams, H. (1965). Volcanic history of Nicaragua. University of California Publications Geological Sciences, 55, 1–73.
McNab, B. K. (1988). Complications inherent in scaling basal rate of metabolism in mammals. The Quarterly Review of Biology, 63, 25–53.
Mello, M. A. R., Kalko, E. K. V. y Silva, W. R. (2008). Diet and abundance of the bat Sturnira lilium (Chiroptera) in a Brazilian montane Atlantic forest. Journal of Mammalogy, 89, 485–492.
Mello, M. A. R., Kalko, E. K. V. y Silva, W. R. (2009). Ambient temperature is more important than food availability in explaining reproductive timing of the bat Sturnira lilium (Mammalia: Chiroptera) in a montane Atlantic forest. Canadian Journal of Zoology, 87, 239–245.
Miranda, S. A. (2012). Filogeografía de murciélagos frugívoros Sturnira ludovici (Chiroptera: Phyllostomidae) (Tesis). Facultad de Ciencias Biológicas, Universidad Autónoma del Estado de Morelos, Cuernavaca, México.
Molinari, J., Bustos, X. E., Burneo, S. F., Camacho, M. A., Moreno, S. A. y Fermín, G. (2017). A new polytypic species of yellow-shouldered bats, genus Sturnira (Mammalia: Chiroptera: Phyllostomidae), from the Andean and coastal mountain systems of Venezuela and Colombia. Zootaxa, 4243, 075–096.
Mota-Vargas, C. y Rojas-Soto, O. R. (2016). Taxonomy and ecological niche modeling: implications for the conservation of wood partridges (genus Dendrortyx). Journal for Nature Conservation, 29, 1–13.
Narayani, B. (2008). Tool for Partial-ROC. Version 1. Lawrence, KS: Biodiversity Institute.
Navarro-Sigüenza, A. G., Peterson, A. T., Nyari, A., García-Deras, G. M. y García-Moreno, J. (2008). Phylogeography of the Buarremon brush-finch complex (Aves, Emberizidae) in Mesoamerica. Molecular Phylogenetics and Evolution, 47, 21–35.
Olson, D. M., Dinerstein, E., Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C. et al. (2001). Terrestrial ecoregions of the world: A new map of life on Earth. Bioscience, 51, 933–938.
Ornelas, J. F., Sosa, V., Soltis, D. E., Daza, J. M., González, C., Soltis, P. S. et al. (2013). Comparative phylogeographic analyses illustrate the complex evolutionary history of threatened cloud forest of northern Mesoamerica. Plos One, 8, e56283.
Ortega-Andrade, H. M., Prieto-Torres, D. A., Gómez-Lora, I. y Lizcano, D. J. (2015). Ecological and geographical analysis of the distribution of the mountain tapir (Tapirus pinchaque) in Ecuador: importance of protected areas in future scenarios of global warming. Plos One, 10, e0121137.
Pacheco, V. y Patterson, B. D. (1991). Phylogenetic relationships of the New World bat genus Sturnira (Chiroptera: Phyllostomidae). Bulletin of the American Museum of Natural History, 206, 101–121.
Parra-Olea, G., García-París, M. y Wake, D. B. (2004). Molecular diversification of salamanders of the tropical American genus Bolitoglossa (Caudata: Plethodontidae) and its evolutionary and biogeographical implications. Biological Journal of the Linnean Society, 81, 325–346.
Pearson, R. G., Thuiller, W., Araújo, M. B., Martínez-Meyer, E., Brotons, L. McClean, C. et al. (2006). Model-based uncertainty in species range prediction. Journal of Biogeography, 33, 1704–1711.
Peterson, A. T., Papeş, M. y Soberón, J. (2008). Rethinking receiver operating characteristic analysis applications in ecological niche modeling. Ecological Modelling, 213, 63–72.
Peterson, A. T. y J. Soberón. (2012). Species distribution modeling and ecological niche modeling: getting the concepts right. Natureza & Conservação, 10, 102–107.
Phillips, S. J., Anderson, R. P., Dudík, M., Schapire, R. E. y Blair, M. E. (2017). Opening the black box: an open-source release of Maxent. Ecography, 40, 887–893.
Phillips, S. J., Anderson, R. P. y Schapire, R. E. (2006). Maximum entropy modeling of species geographic distributions. Ecological Modelling, 1990, 231–259.
Reid, F. A. (2009). A field guide to the mammals of Central America and Southeast Mexico. New York: Oxford University Press.
Rojas-Soto, O., Martínez-Meyer, E., Navarro-Sigüenza, A., Oliveras-de Ita, A., Gómez-de Silva, H. y Peterson, A. T. (2008). Modeling distributions of disjunct populations of the Sierra Madre sparrow. Journal of Field Omithology, 79, 245–253.
Royle, J. A., Chandler, R. B., Yackulic, C. y Nichols, J. D. (2012). Likelihood analysis of species occurrence probability from presence-only data for modelling species distributions. Methods in Ecology and Evolution, 3, 545–554.
Rzedowski, J. (2006). Vegetación de México. Edición digital. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Disponible en: https://www.academia.edu/9142430/VEGETACION_DE_MEXICO_Jerzy_Rzedowski
Sánchez-González, L. A., Morrone, J. J. y Navarro-Sigüenza, A. G. (2008). Distributional patterns of the Neotropical humid montane forest avifaunas. Biological Journal of the Linnean Society, 94, 175–194.
Sánchez-Hernández, C., Romero-Almaraz, M. L. y Schnell, G. D. (2005). New species of Sturnira (Chiroptera: Phyllostomidae) from northern South America. Journal of Mammalogy, 86, 866–872.
Soberón, J. y Peterson, A. T. (2005). Interpretation of models of fundamental ecological niches and species’ distributional areas. Biodiversity Informatics, 2, 1–10.
Speakman, J. y Thomas, D. (2003). Physiological ecology and energetics of bats. En T. H. Kunz y M. B. Fenton (Eds.), Bat ecology (pp. 430–492). Chicago: The University of Chicago Press.
Stevens, R. D. (2004). Untangling latitudinal richness gradients at higher taxonomic level: familia perspectives on the diversity of new world bat communities. Journal of Biogeography, 31, 665–674.
Stevens, R. D. (2011). Relative effects of time for speciation and tropical niche conservatism on the latitudinal diversity gradient of phyllostomid bats. Proceedings of the Royal Society B, 278, 2528–2536.
Téllez-Girón, G. (2005). Sturnira ludovici. En G. Ceballos y G. Oliva (Coords.), Los mamíferos silvestres de México (pp. 248–249). México D.F.: Conabio/ Fondo de Cultura Económica.
Torres-Morales, L., Guillén-Servent, A. y Ruiz-Sánchez, E. (En prensa). Distinct patterns of genetic connectivity found for two frugivorous bat species in Mesoamerica. Acta Chiropterologica
Velazco, P. M. y Patterson, B. D. (2013). Diversification of the yellow-shouldered bats, Genus Sturnira (Chiroptera, Phyllostomidae), in the New World tropics. Molecular Phylogenetics and Evolution, 68, 683–698.
Velazco, P. M. y Patterson, B. D. (2014). Two new species of yellow-shouldered bats, genus Sturnira Gray, 1842 (Chiroptera, Phyllostomidae) from Costa Rica, Panama and western Ecuador. Zookeys, 402, 43–66.
Verde-Arregoitia, L. D., Hernández-Canchola, G., Santini, L., Schweizer, M., Cabrera-Garrido, M. Y. y León-Paniagua, L. S. 2018. Co-occurrence and character convergence in two Neotropical bats. Journal of Mammalogy, 99, 1055–1064.
Weber, M. M., Terribile, L. C. y Caceres, N. C. (2010). Potential geographic distribution of Myotis ruber (Chiroptera, Vespertilionidae), a threatened Neotropical bat species. Mammalia, 74, 333–338.
Weinberg, R. F. (1992). Neotectonic development of western Nicaragua. Tectonics, 11, 1010–1017.