Uso de hemoglobinómetro como alternativa para la medición de hemoglobina y hematocrito en muestras de aves
Sandra Rocío Hernández-Soto a, b, *, Diego Santiago-Alarcón a y Nubia E. Matta b
a Red de Biología y Conservación de Vertebrados, Instituto de Ecología A.C., Carretera antigua a Coatepec 351, El Haya, 91070 Xalapa, Veracruz, México
b Grupo de Investigación Caracterización genética e inmunología, Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, Carrera 30 Núm. 45-03, Bogotá 111321, Colombia
*Autor para correspondencia: srhernandezs@unal.edu.co (S.R. Hernández-Soto)
Resumen
A pesar de recientes innovaciones en ingeniería y diseño de equipos clínicos portátiles, éstos no están diseñados para grupos taxonómicos como aves o herpetos que poseen eritrocitos nucleados; por tanto, sería importante conocer la confiabilidad de las mediciones de los equipos portátiles. Lo anterior, sumado a la escasa cantidad de sangre que habitualmente se obtiene de animales pequeños como aves, anfibios y lagartos, hace necesario pensar en una alternativa para obtener datos hematológicos. En este estudio comparamos valores de hemoglobina y hematocrito de 39 aves silvestres, obtenidos por metodologías clásicas (espectrofotometría y microhematocrito) y por hemoglobinómetro portátil Mission® Hb (ELA), diseñado para determinar dichos valores en humanos. Encontramos una correlación altamente significativa entre las metodologías para medir hemoglobina (rS = 0.73, p < 0.001), pero no para las mediciones del hematocrito. El uso del hemoglobinómetro portátil para obtener datos de Hb en campo, ayudará a construir una base de datos de referencia para evaluar la salud de animales silvestres. Las metodologías clásicas son las de elección; sin embargo, el uso de ELA resulta conveniente para mediciones en el campo y de pequeños organismos; recomendamos el uso específicamente de aquellos equipos que hagan la corrección de la turbidez generada por el núcleo eritrocitario.
Palabras clave: Hematología aviar; Ecoinmunología; Dispositivos ELA; Vida silvestre; Hematocrito aviar; Hemoglobina aviar
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Use of hemoglobinometer as an alternative for the measurement of hemoglobin and hematocrit in samples of birds
Abstract
Despite recent innovations in engineering and design of portable clinical equipment, these are not designed for taxonomic groups such as birds or herptiles that have nucleated erythrocytes, therefore it would be important to know how reliable measurements are produced by such portable equipment. Another limiting factor is the small amount of blood that is usually obtained from small animals such as birds, amphibians, and lizards, it is necessary to think of an alternative to obtain hematological data. In this study, we compared hemoglobin and hematocrit values of 39 wild birds, obtained by classical methodologies (spectrophotometry and microhematocrit) and by a portable hemoglobinometer Mission® Hb (ELA), designed to determine these values in humans. We found a highly significant correlation between the methodologies for measuring hemoglobin (rs = 0.73, p <0.001), but not for hematocrit measurements. The use of the portable hemoglobinometer to obtain Hb data in the field will help to build a reference database to assess the health of wild animals. The classic methodologies are the ones of choice; however, the use of ELA is very convenient for measurements in the field and of small organisms; we recomend the use of specifically that equipment that makes the correction of the turbidity generated by the erythrocyte nucleus.
Keywords: Avian hematology; Ecoimmunology; POC devices; Wildlife; Avian hematocrit; Avian hemoglobin
© 2019 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
La hematología es la disciplina que estudia las características de la sangre y sus posibles variaciones en los animales vertebrados, se apoya en la medición cuantitativa y cualitativa de parámetros relacionados con los componentes del tejido sanguíneo (Campbell, 2015; Clark et al., 2009). Por ejemplo, el hematocrito (Hct) es un parámetro utilizado en exámenes clínicos que ayuda a diagnosticar una potencial enfermedad, ya que mide indirectamente la cantidad de eritrocitos para transportar oxígeno a los diferentes órganos del cuerpo (Samour, 2006). Cuando el Hct se analiza junto con la cantidad de hemoglobina (Hb), se obtiene información acerca del tamaño de los eritrocitos y el volumen de oxígeno transportado, lo cual normalmente se utiliza para diagnosticar si existe anemia. Por lo tanto, la hematología brinda herramientas útiles para conocer el estado de salud de organismos vertebrados.
La información que se puede obtener de medir la Hb y el Hct es muy valiosa, sin embargo, los métodos clásicos implican el uso de una centrífuga para la medición del Hct, un espectrofotómetro y curvas de calibración para mediciones de Hb, limitando su uso en estudios de vida silvestre. En las últimas décadas, se ha incrementado de manera considerable el uso de los equipos portátiles de medición de diferentes parámetros fisiológicos en la práctica clínica, llamados “exámenes en el lugar de atención” (ELA), debido a que el valor del parámetro que se quiere medir se puede obtener de manera casi inmediata después de depositar una pequeña muestra, haciéndolos perfectos para las unidades móviles de atención médica y salas de emergencias en donde un diagnóstico rápido es de suma importancia. A pesar de que estos instrumentos están calibrados para su uso con sangre humana, ya se han publicado estudios con otros taxones como peces (Meléndez-Flores, 2018), anfibios (Hopkins et al., 2016) y aves (Velguth et al., 2010). Actualmente, ante la inminente pérdida de biodiversidad se ha hecho cada vez más urgente empezar a entender la respuesta fisiológica de los animales a diversos factores de perturbación (p. ej., urbanización; Martin y Boruta, 2014). El utilizar equipos ELA para la medición del estado de salud de animales en vida libre representa un avance importante que ayudará a implementar medidas de conservación y manejo, así como un avance en la ecología funcional de animales silvestres. Actualmente, existen muy pocos estudios que comparen la relación entre las metodologías clásicas y las mediciones por instrumentos ELA, teniendo en cuenta que aves, reptiles, anfibios y peces tienen glóbulos rojos nucleados. En este estudio, evaluamos y comparamos los valores de Hb y Hct en aves silvestres usando metodologías clásicas de la cianometahemoglobina y centrifugación, y por otra parte, haciendo uso del equipo ELA Mission® Hb (hemoglobinómetro portátil Mission Hb; ACON Labs Inc.- Mission Plus Hb Hemoglobin Testing System), el cual está diseñado para la medición de Hb y Hct en sangre humana (Ali, 2014; Oladele et al., 2016).
Materiales y métodos
El sitio de muestreo fue el campus de la Universidad Nacional de Colombia en Bogotá (UNAL), ubicado a 2,560 m snm (04°38’ N, 74°5’ O). El sitio se caracteriza por parches de vegetación en el interior de una matriz urbana que alberga alrededor de 200 especies de aves (ABO, 2000; Botero et al.,1997; Mantilla et al., 2013).
Se tomaron muestras sanguíneas de 39 aves pertenecientes a 9 especies (tabla 1). Las aves fueron capturadas mediante redes de niebla, entre los meses de septiembre y noviembre de 2015 y durante abril de 2016. Las aves capturadas fueron llevadas al laboratorio, donde se procedió a la toma de muestra sanguínea por punción de la vena braquial dentro de los primeros 15 minutos posteriores a la captura, la sangre fue colectada en tubos de microhematocrito heparinizados, obteniendo así entre 90-150 μl (2 tubos de microhematocrito con capacidad para 80 μl cada uno). Las muestras fueron procesadas dentro de las 2 primeras horas después de la captura.
Tabla 1
Comparación de las medidas de hemoglobina (Hb) y hematocríto (Hct) usando métodos clásicos y hemoglobinómetro portátil, a partir de muestras de aves silvestres capturadas en el campus de la Universidad Nacional de Colombia-Bogotá (2,560 m snm). Se utilizan las ecuaciones lineales propuestas por Velguth et al. (2010) para calcular el valor de Hb en Passeriformes y Columbiformes, y comparar dichos valores con los obtenidos en este estudio. La Hb fue medida por método de cianometahemoglobina y el Hct por método de centrifugación. Esos valores son comparados con las medidas de esos 2 parámetros obtenidos por el hemoglobinómetro portátil (ACON Labs Inc. – Mission Plus Hb Hemoglobin Testing System). Las especies Coccyzus americanus, Piranga rubra, Catharus ustulatus y Empidonax traillii tienen estatus migratorio.
|
Tabla 1 Continuación. |
|||||||
|
Hematocrito |
Hemoglobina |
||||||
|
Peso |
Centrífuga |
Hemoglobinómetro |
Cianometahe-moglobina |
Hemoglobinó-metro |
Velguth et al. (2010) metodología |
||
|
Hematocrito |
Hemoglobina |
||||||
|
Peso |
Centrífuga |
Hemoglobinómetro |
Cianometahe-moglobina |
Hemoglobinó-metro |
Velguth et al. (2010) metodología |
||
|
Orden Cuculiformes |
|||||||
|
Familia |
Especie |
g |
% |
% |
g/dL |
g/dL |
g/dL |
|
Cuculidae |
Coccyzus americanus |
50 |
60 |
39 |
18.04 |
13.4 |
NA |
|
C. americanus |
48 |
41 |
34 |
16.78 |
11.7 |
NA |
|
|
C. americanus |
41.5 |
50 |
44 |
12.02 |
15 |
NA |
|
|
Orden Passeriformes |
|||||||
|
Familia |
|||||||
|
Cardinalidae |
Piranga rubra |
31.5 |
52 |
44 |
24.47 |
14.9 |
17.27 |
|
P. rubra |
24.5 |
60 |
56 |
30 |
19 |
19.91 |
|
|
Emberizidae |
Zonotrichia capensis |
20.5 |
52 |
46 |
42.28 |
15.5 |
17.27 |
|
Troglodytidae |
Troglodytes aedon |
14.5 |
52 |
43 |
20.1 |
14.5 |
17.27 |
|
T. aedon |
13.5 |
34 |
33 |
10.94 |
11.2 |
11.33 |
|
|
T. aedon |
13.5 |
50 |
36 |
13.6 |
11.9 |
16.61 |
|
|
Turdidae |
Catharus ustulatus |
28 |
52 |
38 |
25.2 |
12.9 |
17.27 |
|
C. ustulatus |
29.5 |
38 |
44 |
16.4 |
15.1 |
12.65 |
|
|
C. ustulatus |
32 |
46 |
38 |
25.5 |
12.9 |
15.29 |
|
|
C. ustulatus |
27 |
50 |
60 |
26.16 |
19.94 |
16.61 |
|
|
Turdus fuscater |
146 |
46 |
43 |
23.06 |
14.6 |
NA |
|
|
T. fuscater |
138 |
40 |
41 |
21.4 |
13.9 |
13.31 |
|
|
T. fuscater |
135 |
40 |
34 |
16.9 |
11.6 |
13.31 |
|
|
T. fuscater |
130 |
44 |
36 |
27.1 |
12.1 |
14.63 |
|
|
T. fuscater |
155 |
50 |
45 |
27.98 |
15.4 |
16.61 |
|
|
T. fuscater |
155 |
48 |
48 |
24.42 |
16.2 |
15.95 |
|
|
T. fuscater |
143 |
56 |
53 |
29.61 |
17.9 |
18.59 |
|
|
T. fuscater |
148 |
46 |
44 |
27.67 |
15 |
15.29 |
|
|
T. fuscater |
135 |
44 |
70 |
30.94 |
23.57 |
14.63 |
|
|
T. fuscater |
142 |
30 |
57 |
24.72 |
18.83 |
10.01 |
|
|
T. fuscater |
142 |
44 |
60 |
26.25 |
20 |
14.63 |
|
|
T. fuscater |
146 |
46 |
80 |
34.94 |
26.62 |
15.29 |
|
|
T. fuscater |
142 |
43 |
69 |
30 |
22.86 |
14.3 |
|
|
T. fuscater |
148 |
44 |
68 |
29.74 |
22.66 |
14.63 |
|
|
T. fuscater |
136 |
43 |
67 |
29.48 |
22.47 |
14.3 |
|
|
T. fuscater |
139 |
43 |
68 |
29.57 |
22.53 |
14.3 |
|
|
T. fuscater |
140 |
40 |
64 |
27.87 |
21.23 |
13.31 |
|
|
T. fuscater |
152 |
46 |
68 |
29.57 |
22.53 |
15.29 |
|
|
T. fuscater |
134 |
40 |
66 |
28.98 |
22.01 |
13.31 |
|
|
T. fuscater |
132 |
48 |
81 |
35.63 |
27.14 |
15.95 |
|
|
T. fuscater |
143 |
46 |
70 |
30.68 |
23.38 |
15.29 |
|
|
T. fuscater |
134 |
40 |
73 |
31.79 |
24.22 |
13.31 |
|
|
T. fuscater |
148 |
40 |
57 |
25.06 |
19.09 |
13.31 |
|
|
Tyrannidae |
Empidonax traillii |
13.5 |
56 |
50 |
22.68 |
17.1 |
18.59 |
|
Machetornis rixosa |
48 |
58 |
53 |
32.13 |
18 |
19.25 |
|
|
M. rixosa |
42.5 |
54 |
51 |
23.95 |
17.2 |
17.93 |
Para la medición de la Hb por el método clásico de cianometahemoglobina, las muestras fueron procesadas el mismo día del muestreo. Se diluyeron 20 μl de sangre en 5 ml de solución de Drabkin (Drabkin y Austin, 1935). La absorbancia de la muestra se midió a 540 nm en el espectrofotómetro (marca Thermo Spectronic, modelo GENESYS 10 UV-Vis). Se hizo uso de un patrón comercial de Hb de concetración conocida (Spinreact, concentración: 15 g/dL) y se calculó un factor para la construcción de una curva de calibración, el cual al ser multiplicado por la absorbancia de la muestra, proporcionó la cantidad de Hb:
a) Factor = 15 (g / dL) / Absorbancia de patrón comercial estándar de cianometahemoglobina (nm) y
b) Hb ( g / dL) = Factor [(g / dL)/nm] × Absorbancia de la muestra (nm).
Para la medición de la Hb por el método portátil o ELA, el cual trabaja por fotometría de reflectancia, 10 μl de sangre fresca heparinizada fueron depositados en una tira reactiva del equipo Mission® Hb (hemoglobinómetro portátil Mission Hb; ACON Labs Inc.- Mission Plus Hb Hemoglobin Testing System). La Hb reacciona con desoxicolato de sodio, que la libera y el nitrito de sodio convierte la Hb en metahemoglobina (donde Fe2+ es convertido en Fe3+). El equipo lee la absorbancia a 525 nm y reporta el valor de la hemoglobina en g/dL. En otras palabras, la sangre es hemolizada y la Hb convertida en metahemoglobina, la cual causa un cambio a color café en la tira reactiva.
Para la medición del Hct por el método de centrifugación, las muestras de sangre recolectadas en los tubos de microhematocrito heparinizados (entre 60-80 μl de sangre) se centrifugaron a 10,000 rpm durante 4 minutos en una centrífuga para capilares o microcentrífuga (Scientific, Modelo HC-12A-Zenith Lab INC USA). Este procedimiento separa la sangre en 3 fases: eritrocitos, leucocitos y plasma. A continuación, el porcentaje de volumen de los eritrocitos (paquete rojo) se midió usando un lector de tarjetas de microhematocrito (Harrison y Lightfoot, 2006), siendo reportado como el porcentaje de eritrocitos en la sangre del ave muestreada.
El dato de Hct es proporcionado por el hemoglobinómetro equipo Mission® Hb mediante un cálculo equivalente a 3 veces el valor de la Hb, siguiendo la proporción de 3:1, utilizada como metodología alternativa cuando no se cuenta con la metodología clásica disponible (Velguth et al., 2010) y en algunos estudios donde se ha demostrado dicha relación en mamíferos (Duncan y Prasse, 1986).
Para los análisis estadísticos, se llevaron a cabo correlaciones semiparciales de Spearman controlando la variable peso del ave usando el paquete “ppcor de R” y la función pcor.test() (Kim, 2015). Para el modelo lineal, las mediciones obtenidas por el equipo Mission® Hb (Hb y Hct) representan la variable independiente y la variable dependiente estuvo representada por las mediciones de Hb y Hct obtenidas por las metodologías clásicas. Se utilizó la función lm() para determinar el modelo de regresión lineal que mejor se ajusta a los datos de mediciones clásicas y por hemoglobinómetro. Se usó la función glm() para determinar si las variables de peso y año de muestreo tuvieron algún efecto significativo en la medición de la hemoglobina y el hematocrito. Finalmente, se usó lmer() de la librería lme4 (Bates et al., 2015) para integrar el peso como variable aleatoria en el modelo lineal y determinar su contribución a la varianza total del modelo usando la función rsquared() de la librería piecewiseSEM. Todos los análisis fueron realizados en el paquete estadístico R v. 3.5.2 (http://www.R-project.org/).
Resultados
Los valores de Hb obtenidos a partir del equipo Mission® Hb fueron siempre más bajos en comparación con aquellos obtenidos por el método clásico (2-26 g/dL más bajo); los valores de Hct obtenidos igualmente por el equipo Mission® Hb mostraron diferencias con el método clásico, cuando fue más bajo de Hct fueron cercanos al valor obtenido por el método clásico (± 2%), mientras que en aquellos casos en que el valor de Hct fue más alto con el equipo Mission® Hb, la diferencia fue de aproximadamente de 20-30% (tabla 1). La tabla 1 muestra los valores obtenidos de ambos métodos en 39 aves pertenecientes a 9 especies.
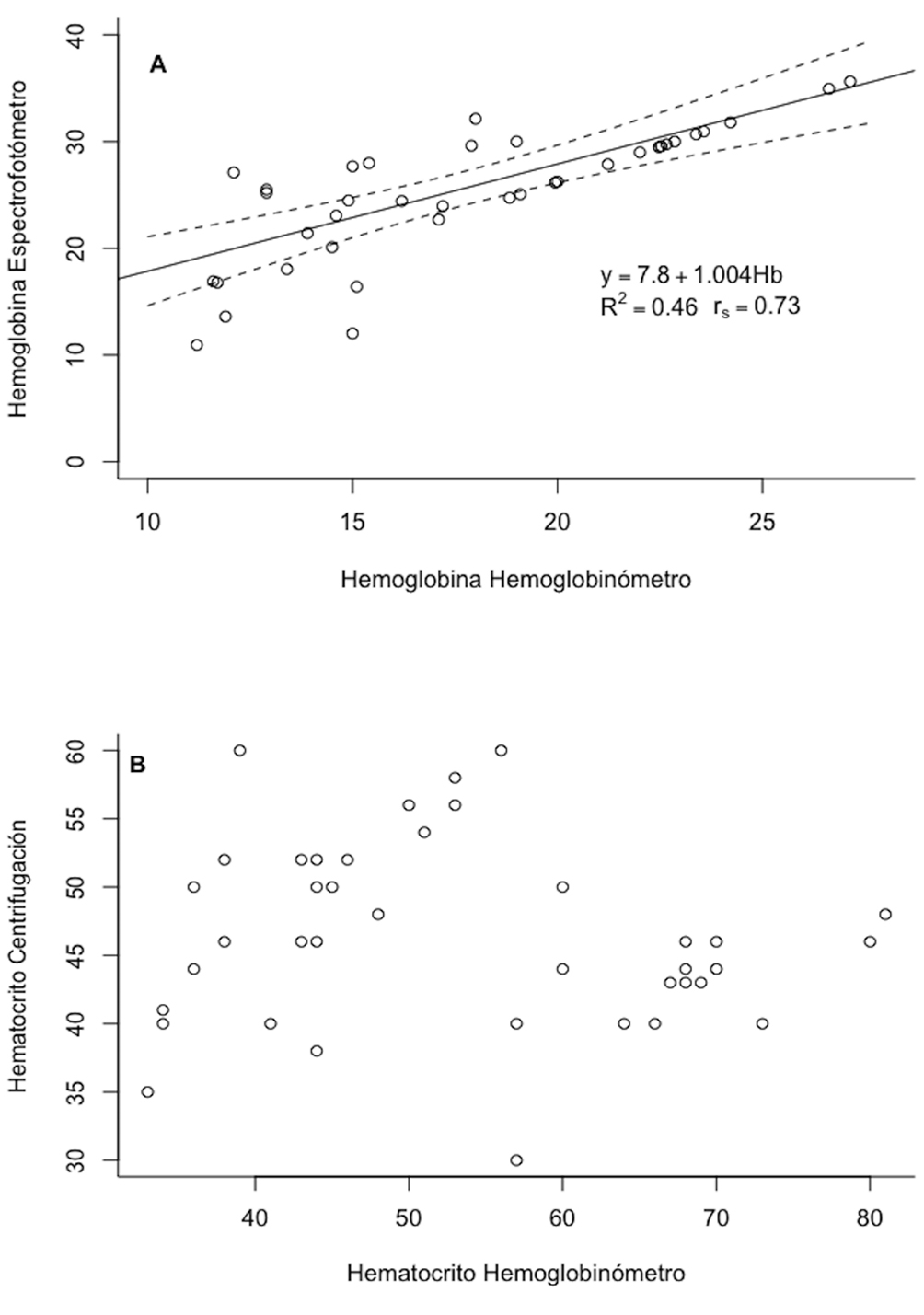
Existe una correlación positiva significativa entre los métodos para la medición de la (Hb) (rS = 0.73, ρ = 6.54, p < 0.001, n = 39; fig. 1A). El modelo de regresión del método clásico de Hb como variable dependiente de los valores obtenidos por el equipo Mission® Hb fue significativo (R2 = 0.46, F137 = 32.34, p < 0.001; fig. 1A); cuando se toma en cuenta el peso como variable aleatoria, el modelo completo (variables fijas y aleatorias) explica 76.7% de la varianza, mientras que el peso explica 32.6% de la varianza. El año de muestreo y el peso no tuvieron efectos significativos sobre los valores medidos de Hb (tabla 2).
No se encontró correlación entre los métodos para medir Hct (rS = 0.022, ρ = 0.134, p = 0.89, n = 39; fig. 1B) y el modelo de regresión explica menos del 2 % de la variación (R2 = 0.017, F137 = 0.66, p = 0.42). El año de muestreo no tuvo efectos significativos sobre los valores medidos de Hct, pero el peso sí (tabla 2), razón por la cual fue adecuado controlar por el peso durante el análisis de correlación.
Existió una correlación positiva significativa entre los valores de Hb y Hct medidos por medio del equipo Mission® Hb (rS = 0.99, ρ = 107.3, p << 0.001, n = 39). El modelo de regresión del Hct como variable dependiente de la Hb, ambos medidos por el equipo Mission® Hb fue significativo (R2 =0.99, F137 = 3.4×104, p < 0.001), y mostró una proporción de 1:3 Hb a Hct (y = -1.64 + 3.06 × hemoglobina).
Tabla 2. Resultados de GLM para: hemoglobina por metodología clásica (A) y hematocrito (B). Los valores en negritas indican valores significativos de p.
|
A. Hemoglobina (Hb) |
||||
|
glm(fórmula = Hb_clásico ~ Hb_hemoglobinómetro + año × peso) |
||||
|
Estimate |
SE |
t value |
p |
|
|
(Intercept) |
921.799 |
713.725 |
1.292 |
0.205 |
|
Hb_hemoglobinómetro |
109.932 |
0.23703 |
4.638 |
5.04e-05 *** |
|
año (2016) |
-205.709 |
363.822 |
-0.565 |
0.576 |
|
peso |
-0.05234 |
0.05849 |
-0.895 |
0.377 |
|
año (2016) × peso |
0.03915 |
0.03439 |
1.138 |
0.263 |
|
B. Hematocrito (Hct) |
||||
|
glm(fórmula = Htc_clásico ~ Htc_hemoglobinómetro + año × peso) |
||||
|
Estimate |
SE |
t value |
p |
|
|
(Intercept) |
3.492.785 |
719.382 |
4.855 |
2.64e-05 *** |
|
Htc_hemoglobinómetro |
0.22744 |
0.07929 |
2.868 |
0.00704 ** |
|
año (2016) |
355.959 |
368.914 |
0.965 |
0.34142 |
|
peso |
-0.13006 |
0.05960 |
-2.182 |
0.03611 * |
|
año (2016) × peso |
0.05506 |
0.03501 |
1.573 |
0.12506 |
Discusión
Aunque ha incrementado el interés en caracterizar la hematología en vida silvestre durante la última década (Campbell, 2015; Davis, 2009), algunos parámetros hematológicos como la Hb y el Hct no son fácilmente medibles durante muestreos en campo debido, en parte, a la necesidad de equipos pesados que requieren electricidad, reactivos que precisan refrigeración permanente y un lugar apropiado para el procesamiento de la muestra como lo sería un laboratorio o una cabina de extracción. Por ejemplo, el método de la cianometahemoglobina requiere de un espectrofotómetro, patrón de Hb y curva de calibración; además, uno de los compuestos del reactivo de Drabkin es el cianuro, haciendo obligatorio un protocolo de seguridad para su uso. Este tipo de dificultades logísticas hacen casi imposible utilizar las metodologías clásicas para estudios de vida silvestre. Desde una perspectiva clínica, es muy importante medir estas 2 variables ya que proveen información valiosa para investigar el impacto de algunos factores bióticos y abióticos en la salud de animales silvestres. En el caso particular de Colombia con más de 1,900 especies de aves (Verhelst-Montenegro y Salaman, 2019), resulta muy importante generar información no solo para las especies residentes, sino además para las más de 180 especies migratorias (Hilty y Brown, 1986); en ambos casos hay muy poca información acerca del efecto de factores causantes de estrés como la urbanización, así como la causada por el desgaste energético requerido por los grandes desplazamientos hacia los cuarteles de invernada. De igual manera, se tiene evidencia de algunos patógenos introducidos por aves migratorias y las alteraciones en la interacción parásito-hospedero generadas en parte gracias a una ampliación en el rango de los vectores a causa del cambio climático (Fuller et al., 2012), de aquí la importancia de motivar a los investigadores a generar información de referencia. De esta manera, el uso de un hemoglobinómetro portátil confiable representa una alternativa a las metodologías clásicas para estudios en campo, particularmente en sitios remotos. Otras ventajas son que las muestras no necesitan preservarse ni transportarse, además de obtener datos en un corto periodo después de la toma de muestra. Es importante considerar, sin embargo, que las tiras reactivas de algunos dispositivos ELA presentan un corto tiempo de vigencia para su uso (6-12 meses), después del cual pueden dar lugar a lecturas erróneas por el equipo; adicionalmente, la humedad y la temperatura pueden afectar la veracidad de las lecturas, por lo que es de suma importancia calibrar el equipo en cada sitio de estudio (Stoot et al., 2014).
Nuestros resultados demuestran que existe una alta correlación en la medición de la Hb entre la metodología clásica y el equipo Mission® Hb. La correlación 1:3 entre Hb y Hct observada en los valores medidos por el equipo Mission® Hb coincide con lo reportado para mamíferos (Duncan y Prasse, 1986). Dicha proporción ya ha sido utilizada en algunos estudios con aves que no obtuvieron el valor de Hb ni con la metodología clásica, ni con algún hemoglobinómetro (Minka y Ayo, 2008; Oladele et al., 2001); por el contrario, calcularon dicho parámetro a partir de la estimación del valor del Hct por el método clásico. Velguth et al. (2010) encontraron una correlación entre los valores de Hct medidos mediante centrifugación y la Hb medida en un hemoglobinómetro portátil para 9 órdenes de aves, dicha correlación fue expresada mediante una ecuación donde la pendiente cambia de acuerdo al orden al que pertenece el ave, dicha ecuación confirma la posibilidad de aplicar la proporción 1:3 del Hct obtenido por centrifugación (método clásico) para estimar la Hb en sangre de aves silvestres. Aplicamos la ecuación propuesta por Velguth et al. (2010) para Passeriformes (Hb = 0.33 * Hct + 0.11) y para Columbiformes (Hb = 0.28 * Hct + 1.94) a nuestros resultados de Hct obtenidos mediante centrífugación para calcular la Hb, y encontramos que se acercan más a los valores obtenidos con el equipo Mission® Hb que a los valores obtenidos por el método clásico (tabla 1). Por lo tanto, nuestros resultados indican que los dispositivos ELA son confiables en la medición de la Hb y se sugiere su uso estándar en investigaciones de ecoinmunología de vida silvestre.
Con respecto al Hct, los datos más confiables son aquellos obtenidos mediante centrifugación debido a que la proporción 1:3 de Hb:Hct no se mantiene usando los métodos clásicos. Además, algunas patologías, estaciones del año y gradientes ambientales (p. ej., altitud) pueden producir variaciones en las características hematológicas de varias aves paserinas (Booth y Elliot, 2002; Ishtiaq y Barve, 2018), razón por la cual es importante calibrar el dispositivo ELA en cada sitio de estudio. Adicionalmente, Stoot et al. (2014) mencionan la necesidad de desarrollar y calibrar dispositivos ELA de manera específica para, al menos, cada grupo de vertebrados (idealmente para cada especie), ya que los rangos normales pueden variar entre los taxones, incluso afuera de un rango de medición del dispositivo. Debido a que nuestros resultados derivados del ELA hemoglobinómetro portátil Mission® Hb muestran una fuerte relación de 1:3 con los valores de Htc (medidos por ambas metodologías), y ya que en algunos casos no es posible obtener un volumen de sangre adecuado para la metodología clásica, proponemos el uso de dicha proporción a partir de la Hb medida con los sistemas ELA.
Hemos detectado variaciones en los valores de Hb obtenidos en ambos métodos, donde el mínimo fue siempre registrado con el equipo Mission® Hb. Rostorfer (1949) comparó varios métodos para medir Hb en aves y también encontró el menor valor con el hemoglobinómetro. Las discrepancias en la medición de la Hb podrían explicarse por imprecisión en la calibración del método por espectrofotometría (p. ej., cianometahemoglobina) debido a manipulación, procedimientos de laboratorio (p. ej., alta dilución 1:251 de la muestra de sangre en la solución de Drabkin, turbidez debido a proteínas), y calidad de reactivos (Tentori y Salvati, 1981; von Schenck et al., 1986). El núcleo de los eritrocitos representa un problema en la medición de la Hb debido a la turbidez generada por membranas que permanecen suspendidas, este problema puede ser resuelto centrifugando las muestras. Además, la calibración y precisión puede variar con diferentes espectrofotómetros (Samour, 2006). Algunos hemoglobinómetros portátiles evitan este problema haciendo una corrección de la turbidez mediante una medición a 880 nm, haciendo el dispositivo ELA más consistente que el método de espectrofotometría. En el caso del Hct, el uso de la medición tradicional del Hct por centrifugación plantea un desafío con pequeños volúmenes de sangre debido a que pueden presentar errores significativamente altos (Kaushansky et al., 2016); por lo tanto, la metodología clásica para obtener valores de Hct se recomienda solo en casos donde sea posible obtener suficiente sangre en un microhematocrito (~ 60 µl).
El “International Committee for Standardization in Hematology” (ICSH) recomendó en 1965 la determinación de hemoglobinocianida (HiCN) como el método de referencia para sangre humana, y cualquier otro método debería ajustarse para obtener comparabilidad con el método de la hemoglobinocianida (ICSH, 1978). El hemoglobinómetro portátil o ELA que mide la Hb total en sangre humana está diseñado para el mismo principio fotométrico sugerido por la ICSH. Dependiendo del laboratorio fabricante, el equipo podría reportar medidas entre 500 y 620 nm, haciendo correcciones para turbidez a 880 nm. Algunos estudios han demostrado que los dispositivos ELA son bastante exactos con sangre venosa humana (Hiscock et al., 2015; Rosenblit et al., 1999; von Schenck et al., 1986) y su uso, por ejemplo en el caso de HemoCue 201+1 analyzer (HemoCue Inc.), se ha ido incrementando en medicina veterinaria y estudios en vida silvestre de diferentes grupos de vertebrados (aves: Ishtiaq y Barve, 2018; Milenkaya et al., 2013; Minias, 2016; anfibios: Hopkins et al., 2106; peces y reptiles: Andrewartha et al., 2016). Sin embargo, se recomienda que al usar un hemoglobinómetro portátil para estudios de vida silvestre en campo, éste ofrezca la corrección de la turbidez a 880 nm (p. ej., Velguth et al., 2010 “HemoCue Hb 201”). Exhortamos a los biólogos de campo y veterinarios a desarrollar la rutina de usar equipos portátiles ELA con el fin de incrementar la información de parámetros hematológicos en vida silvestre. Dicha información es invaluable dado que representa datos de referencia junto con las medidas hematológicas tradicionales obtenidas a partir de frotis sanguíneos (p. ej., conteo diferencial de glóbulos blancos, índice policrómatico), lo cual ayudará a los programas de evaluación de la salud animal y la investigación en ecoinmunología.
Agradecimientos
Al grupo de investigación Relación parásito hospedero GERPH perteneciente al Departamento de Biología de la Universidad Nacional de Colombia – Sede Bogotá. Así como al Programa de Gestión de Proyectos del Departamento de Bienestar de la Universidad Nacional de Colombia – Sede Bogotá, el cual financió esta investigación durante el proyecto de tesis de pregrado. DSA fue financiado por el CONACYT, A.C. programa de Ciencia Básica (2011-01-168524) y programa de Problemas Nacionales (2015-01-1628).
Referencias
ABO. (2000). Aves de la sabana de Bogotá: guía de campo. Bogotá: Asociación Bogotana de Ornitología/ Corporación Autónoma Regional de Cundinamarca CAR.
Ali, M. S. (2014). Comparison between digital hematocrit reader and standard centrifugation based hematocrit measuring instrument. Journal of Kerbala University, 12, 12–14.
Andrewartha, S. J., Munns, S. L. y Edwards, A. (2016). Calibration of the HemoCue point-of-care analyser for determining haemoglobin concentration in a lizard and a fish. Conservation Physiology, 4, 1–6. https://doi.org/10.1093/conphys/cow006
Bates, D., Maechler, M., Bolker, B. y Walker, S. (2015). Fitting linear mixed-effects models using lme4. Journal of Statistical Software, 67, 1–48.
Booth, C. E. y Elliott, P. F. (2002). Hematological responses to hematozoa in North American and neotropical songbirds. Comparative Biochemistry and Physiology, 133, 451–467. https://doi.org/10.1016/s1095-6433(02)00149-6
Botero, E. U., Prieto, L. F. M. y Olarte, J. O. (1997). Cerros, humedales y áreas rurales: Santa Fe de Bogotá: Departamento Técnico Administrativo del Medio Ambiente.
Campbell, T. W. (2015). Exotic animal hematology and cytology. Cuarta edición. Ames: Wiley Blackwell. https://doi.org/10.1002/9781118993705
Clark, P., Boardman, W. y Raidal, S. (2009). Atlas of clinical avian hematology. Chichester: John Wiley and Sons.
Davis, A. K. (2009). The wildlife leukocytes webpage. The ecologist’s source for information about leukocytes of wildlife species. Recuperado el 08 enero de 2018, de http://wildlifehematology.uga.edu
Drabkin, D. L. y Austin, J. H. (1935). Spectrophotometric studies II. Preparations from washed blood cells; nitric oxide hemoglobin and sulfhemoglobin. Journal of Biological Chemistry, 112, 51–65.
Duncan, J. R. y Prasse, K. W. (1986). Veterinary laboratory medicine. Segunda edición. Ames: Iowa State University Press.
Fuller, T., Bensch, S., Müller, I., Novembre, J., Pérez-Tris, J., Ricklefs, R. E. et al. (2012). The ecology of emerging infectious diseases in migratory birds: an assessment of the role of climate change and priorities for future research. EcoHealth, 9, 80–88. https://doi.org/10.1007/s10393-012-0750-1
Harrison, G. J. y Lightfoot, T. L. (2006). Clinical avian medicine, Vol. 2. Florida: Spix Publishing Inc.
Hilty, S. L. y Brown, W. L. (1986). A guide to the birds of Colombia. Princeton: Princeton University Press.
Hiscock, R., Kumar, D. y Simmons, S. W. (2015). Systematic review and meta-analysis of method comparison studies of Masimo pulse co-oximeters (Radical-7™ or Pronto-7™) and HemoCue® absorption spectrometers (B-Hemoglobin or 201+) with laboratory haemoglobin estimation. Anaesth Intensive Care, 43, 341–350. https://doi.org/10.1177/0310057×1504300310
Hopkins, W. A., Fallon, J. A., Beck, M. L., Coe, B. H. y Jachowski, C. M. B. (2016). Haematological and immunological characteristics of eastern hellbenders (Cryptobranchus alleganiensis alleganiensis) infected and co-infected with endo- and ectoparasites. Conservation Physiology, 4, 1–16. https://doi.org/10.1093/conphys/cow002
ICSH (International Committee for Standardization in Haematology). (1978). Recommendations for reference method for haemoglobinometry in human blood (ICSH standard EP 6/2: 1977) and specifications for international haemiglobincyanide reference preparation (ICSH standard EP 6/3: 1977). Journal of Clinical Pathology, 31, 139–143. https://doi.org/10.1136/jcp.31.2.139
Ishtiaq, F. y Barve, S. (2018). Do avian blood parasites influence hypoxia physiology in a high elevation environment? BMC Ecology, 18, 15. https://doi.org/10.1186/s12898-018-0171-2
Kaushansky, K., Lichtman, M. A., Caligiuri, M. A., Prchal, J. T., Levi, M. M., Press, O. W. et al. (2016). Williams hematology. New York: McGraw Hill Education.
Kim, S. (2015). ppcor: An R Package for a fast calculation to semi-partial correlation coefficients. Communications for Statistical Applications and Methods, 22, 665–674. https://doi.org/10.5351/csam.2015.22.6.665
Mantilla, J. S., González, A. D., Valkiūnas, G., Moncada, L. I. y Matta, N. E. (2013). Description and molecular characterization of Plasmodium (Novyella) unalis sp. nov. from the Great Thrush (Turdus fuscater) in highland of Colombia. Parasitology Research, 112, 4193–4204. https://doi.org/10.1007/s00436-013-3611-0
Martin, L. B. y Boruta, M. (2014). The impact of urbanization on avian disease transmission and emergence. En D. Gil y H. Brumm (Eds.), Avian urban ecology: behavioural and physiological adaptations (pp. 116–128). New York: Oxford University Press. https://doi.org/10.1093/acprof:osobl/9780199661572.003.0009
Meléndez-Flores, K. A. (2018). Evaluación del estado de salud y actividad bactericida y aglutinante de la trucha arcoíris (Oncorhynchus mykiss) como bioindicador de la contaminación humana en la cuenca del río Chalhuanca, Apurímac (Tesis de maestría). Universidad Peruana Cayetano Heredia. Lima, Perú.
Milenkaya, O., Weinstein, N., Legge, S. y Walters, J. R. (2013). Variation in body condition indices of crimson finches by sex, breeding stage, age, time of day, and year. Conservation Physiology, 1, 1–14. https://doi.org/10.1093/conphys/cot020
Minias, P. (2016). Seasonal trends in brood sex ratio reflect changes in early-life physiological condition of chicks in the whiskered tern. Ethology Ecology and Evolution, 28, 385–393. https://doi.org/10.1080/03949370.2015.1062804
Minka, N. S. y Ayo, J. O. (2008). Haematology and behaviour of pullets transported by road and administered with ascorbic acid during the hot-dry season. Research in Veterinary Science, 85, 389–393. https://doi.org/10.1016/j.rvsc.2007.11.009
Oladele, S. B., Ogundipc, S., Ayo, J. O. y Esievo, K. A. N. (2001). Effects of season and sex on packed cell volume, haemoglobin and total proteins of indigenous pigeons in Zaria, Northern Nigeria. Veterinarski Arhiv, 71, 277–286.
Oladele, O., Olatunde, O., Abiola, O., Oyinkansola, A., Evelyn, O., Babajide, A. et al. (2016). Point-of-Care testing for anaemia in children using portable haematocrit meter: a pilot study from Southwest Nigeria and implications for developing countries. Ethiopian Journal of Health Sciences, 26, 251–258. https://doi.org/10.4314/ejhs.v26i3.8
Rosenblit, J., Abreu, C. R., Szterling, L. N., Kutner, J. M., Hamerschlak, N., Frutuoso, P. et al. (1999). Evaluation of three methods for hemoglobin measurement in a blood donor setting. Sao Paulo Medical Journal, 117, 108–112. https://doi.org/10.1590/s1516-31801999000300003
Rostorfer, H.H. (1949). Comparison of methods for measurement of avian hemoglobin. Journal of Biological Chemistry, 180, 901–911.
Samour, J. (2006). Diagnostic value of hematology. En G. J. Harrison y T. L. Lightfoot (Eds.), Avian medicine (pp. 587–609). Palm Beach, FL: Spix Publishing.
Stoot, L. J., Cairns, N. A., Cull, F., Taylor, J. J., Jeffrey, J. D., Morin, F. et al. (2014). Use of portable blood physiology point-of-care devices for basic and applied research on vertebrates: a review. Conservation Physiology, 2, cou011. https://doi.org/10.1093/conphys/cou011
Tentori, L. y Salvati, A. M. (1981). Hemoglobinometry in human blood. En E. Antonini, L. Rossi-Bernardi y E. Chiancone (Eds.), Methods in enzymology, Vol. 76 (pp. 707–715). New York, NY: Academic Press, Inc. https://doi.org/10.1016/0076-6879(81)76152-4
Velguth, K. E., Payton, M. E. y Hoover, J. P. (2010). Relationship of hemoglobin concentration to packed cell volume in avian blood samples. Journal of Avian Medicine and Surgery, 24, 115–121. https://doi.org/10.1647/2008-042.1
Verhelst-Montenegro, J. C. y Salaman, P. (2019). Checklist of the birds of Colombia. Electronic list, version ’15 February 2019′. Atlas of the Birds of Colombia. Recuperado el 20 de marzo de 2014 de: https://sites.google.com/site/haariehbamidbar/atlas-of-the-birds-of-colombia
Von Schenck, H., Falkensson, M. y Lundberg, B. (1986). Evaluation of “HemoCue,” a new device for determining hemoglobin. Clinical Chemistry, 32, 526–529.