Uso de microhabitat por un ensamble de pequeños mamíferos no voladores en un bosque de roble sobre la Cordillera Oriental de los Andes colombianos
Laura C. Vargas-Ramírez a, *, Javier E. Colmenares-Pinzón a, b y Víctor H. Serrano-Cardozo a, b
a Laboratorio de Ecología, Escuela de Biología, Facultad de Ciencias, Universidad Industrial de Santander, Calle 9, Carrera 27, Ciudad Universitaria, 680002 Bucaramanga, Santander, Colombia
b Grupo de Estudios en Biodiversidad, Escuela de Biología, Facultad de Ciencias, Universidad Industrial de Santander, Calle 9, Carrera 27, Ciudad Universitaria 27, 680002 Bucaramanga, Santander, Colombia
* Autor para correspondencia: laura91.biologia@gmail.com (L.C. Vargas-Ramírez)
Resumen
Entre octubre de 2014 y septiembre de 2015, durante 5 días consecutivos de cada mes, se evaluó la asociación entre la composición de pequeños mamíferos no voladores y las características de sus hábitats, en un fragmento de bosque de roble, sobre la Cordillera Oriental de los Andes colombianos, en el departamento de Santander. Se establecieron 5 estaciones de muestreo con 20 trampas Sherman en cada una. En cada estación se delimitaron 10 parcelas y se cuantificaron 17 variables estructurales de la vegetación. En un área aproximada de 1.8 hectáreas se capturaron 358 individuos, correspondientes a 5 especies de roedores, 1 de musaraña y 1 de marsupial. Se implementaron acercamientos estadísticos para evaluar la relación entre la abundancia de individuos y las características de sus hábitats encontrándose una correlación positiva y significativa entre la profundidad de la hojarasca y las abundancias de Rhipidomys fulviventer, Thomasomys laniger, Neomicroxus bogotensis, Marmosops caucae y Cryptotis cf. tamensis. Las abundancias de las diferentes especies variaron a través del tiempo siendo enero y mayo los meses con mayor número de capturas. También se pudo constatar una relación significativa entre el número de individuos de R. fulviventer capturados por mes y el promedio mensual de precipitación.
Palabras clave:
Bosque de roble; Colombia; Diversidad; Microhábitat; Rodentia
© 2018 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Microhabitat use by an assamblage of small non volant mammals in an oak forest in the Cordillera Oriental of Colombian Andes
Abstract
Between October 2014 and September 2015, during 5 consecutive days of each month, the associations between small non-volant mammals and the characteristics of their habitats were evaluated in an oak forest fragment in the Cordillera Oriental of Colombian Andes, in the department of Santander. Five sampling stations with 20 Sherman traps each one were established. In each station 10 plots were demarcated, in which 17 structural vegetation variables were quantified. Three hundred and fifty-eight individuals corresponding to 5 rodent species, 1 shrew species and 1 marsupial species were caught in an area of approximately 1.8 hectares. Different statistical approaches were implemented to quantitatively assess the relationship between the abundance of individuals and the characteristics of their habitats. Finding a significant positive correlation between the depth of the fallen leaves and the abundances of Rhipidomys fulviventer, Thomasomys laniger, Neomicroxus bogotensis, Marmosops cacucae y Cryptotis cf. tamensis. Abundances changed overtime, with January and May being the months where more individuals were caught. Nevertheless, we only found a significant statistical relationship between R. fulviventer monthly abundances and the monthly average precipitation.
Keywords:
Oak forest; Colombia; Diversity; Microhabitat; Rodentia
Introducción
Los pequeños mamíferos son organismos fundamentales en las dinámicas de los ecosistemas ya que cumplen papeles funcionales como la depredación, la dispersión de semillas y la polinización de diferentes especies vegetales, además de que son parte de la cadena trófica al ser presa de otros mamíferos, reptiles y aves (Silva, 2001). En este grupo, la riqueza y abundancia de las especies están reguladas tanto por factores bióticos como abióticos (Montañez-Quiroga, 2009), parámetros que suelen verse afectados por cambios temporales en las variables ambientales, los cuales a su vez afectan la disponibilidad de recursos, y por lo tanto la supervivencia y reproducción de los individuos (Andreazzi et al., 2011; Mendel et al., 2008). (Stenseth et al., 2003). Este impacto puede presentarse en forma directa, a través de la fisiología, por lo que en poblaciones de pequeños mamíferos que habitan entornos altamente estacionales, es posible observar picos de crecimiento poblacional durante el verano debido a tasas reproductivas altas y una disminución durante el invierno (Stenseth et al., 2003; Singleton et al., 2001) , y en forma indirecta a través del clima el cual actúa sobre el ecosistema, afectando presas, depredadores y competidores (Garsd y Howard, 1982; Stenseth et al., 2003). A su vez, la estructura de la vegetación y la complejidad del hábitat están involucrados en el comportamiento que muestran las poblaciones de pequeños mamíferos, ya que las plantas proporcionan alimento, oportunidades de anidación y protección contra los depredadores y a condiciones ambientales extremas (Coetzee y Jackson, 1999).
Colombia se caracteriza por su diversidad geográfica, ubicación latitudinal en la zona ecuatorial y por poseer un sistema montañoso particular, lo cual deriva en la existencia de diferentes pisos térmicos con gran diversidad de suelos, flora, fauna y riqueza paisajística (Morales et al., 2007). Por estas razones, el país es considerado como uno de los más diversos a nivel mundial y para el caso concreto de los mamíferos, se ubica en la cuarta posición en cuanto a número de especies (Romero et al., 2008; IAvH, 2012). De las 500 especies que componen la mastofauna del país, las especies pequeñas de hábitos terrestres constituyen el 34% y están representad as por los órdenes Rodentia (roedores), Didelphimorphia (marsupiales), Eulipotyphla (musarañas) y Paucituberculata (runchos) (Ramírez-Chaves y Suárez-Castro, 2014; Solari et al., 2013).
La mayoría de estudios con pequeños mamíferos en Colombia se han enfocado en la elaboración de listados de especies en diferentes zonas y en hábitats particulares, existiendo notables vacíos de conocimiento en casi todos los aspectos de historia de vida. En este contexto, son escasos los trabajos en los que se ha evaluado la asociación entre las especies y sus abundancias con las características de sus hábitats (Castaño y Corrales, 2010; Otálora, 2003; Ramírez y Pérez, 2007; Sánchez-Giraldo y Díaz-Nieto, 2015; Sánchez et al., 2004). Por tales razones, en el presente trabajo se exploró la diversidad de pequeños mamíferos no voladores en un fragmento de bosque de roble sobre el flanco occidental de la Cordillera Oriental de los Andes colombianos y se analizó cuantitativamente la relación entre las diferentes especies y las características bióticas y abióticas de su entorno.
Materiales y métodos
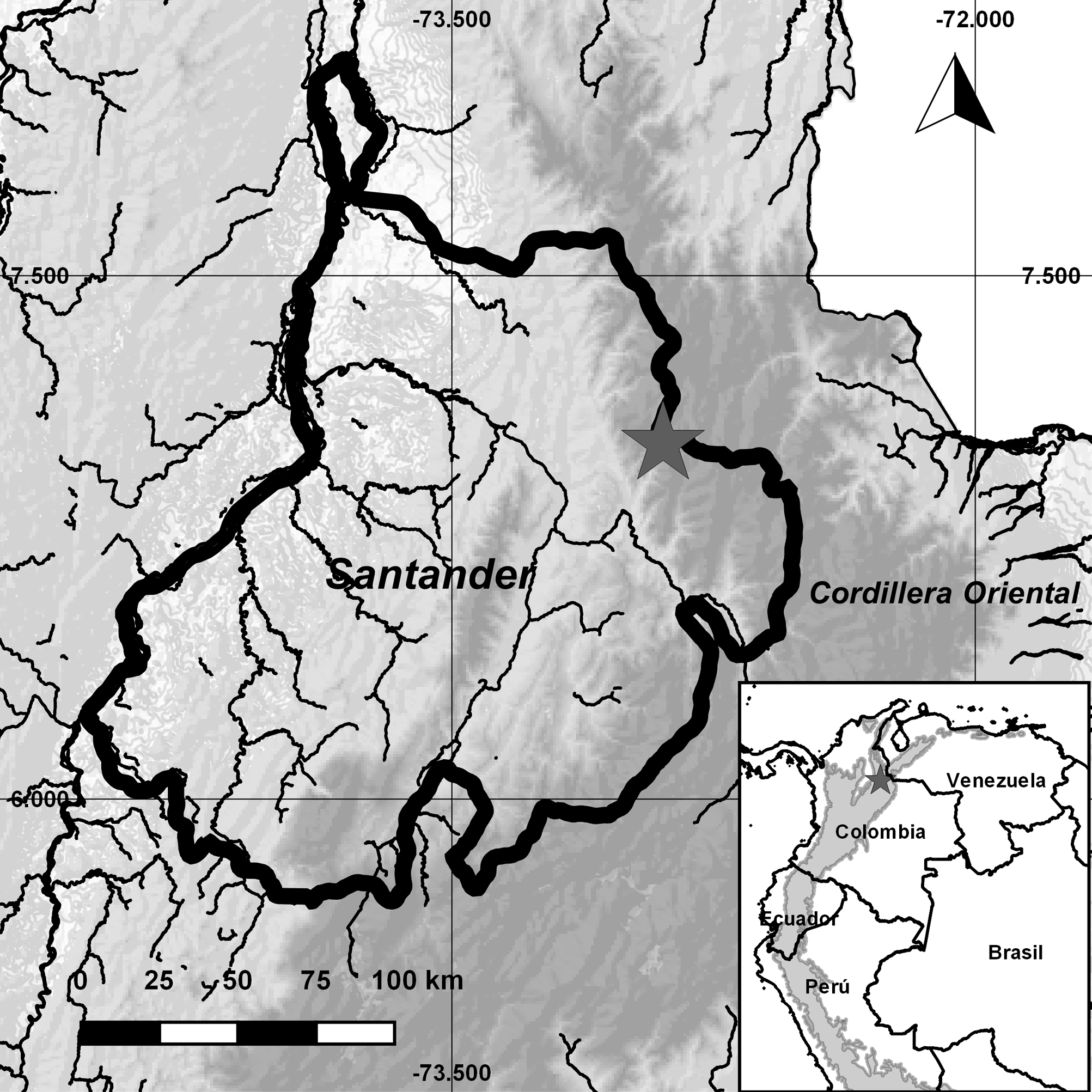
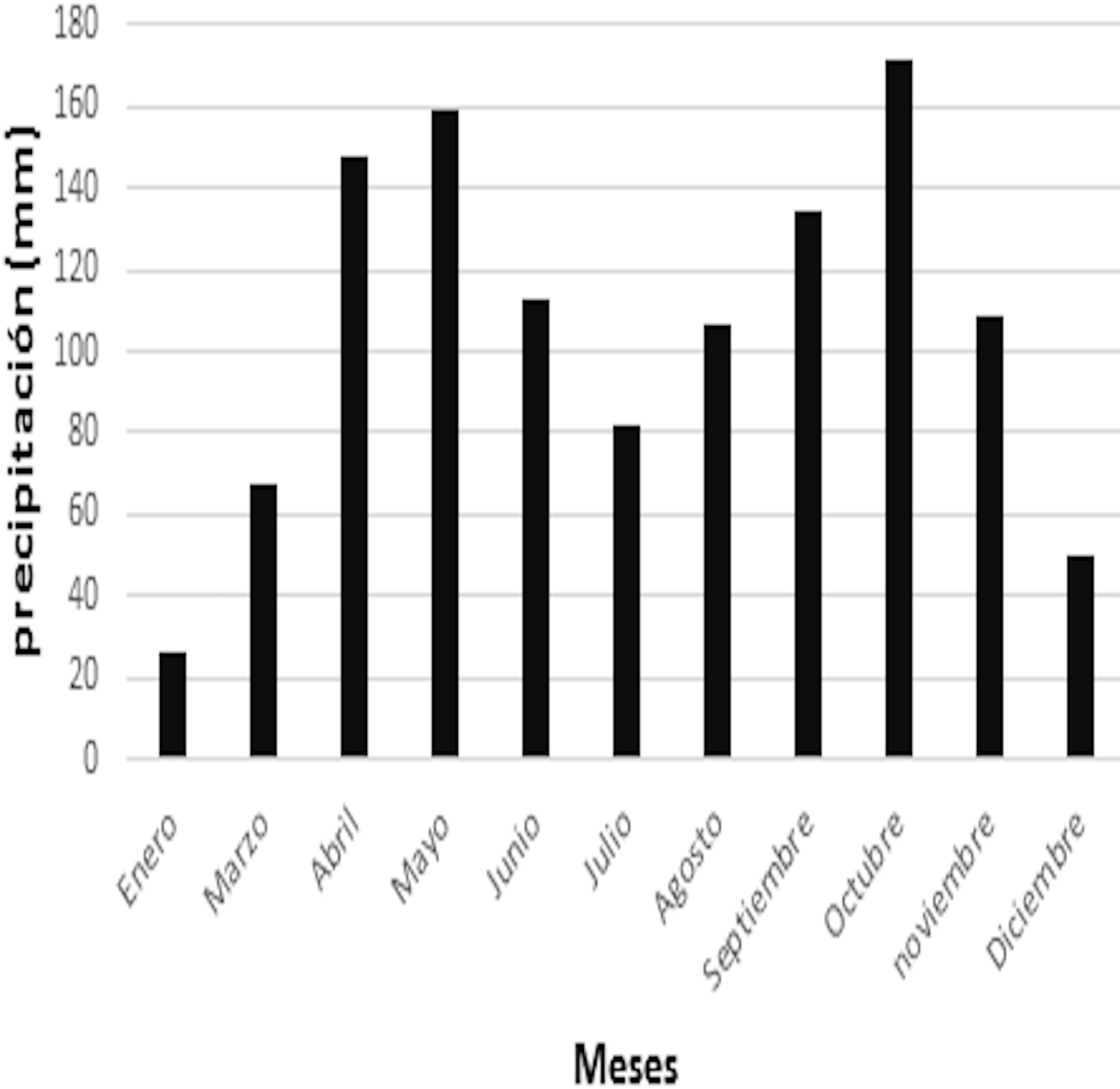
El área de estudio se ubica geográficamente en 7°00’57.4” N, 72°53’51.4” O sobre el flanco occidental de la Cordillera Oriental en el municipio de Santa Bárbara, Santander, Colombia (fig. 1). Esta zona presenta una precipitación anual aproximada de 1,230 mm (fig. 2), con un régimen de lluvias bimodal con 2 periodos altos (de abril a mayo y de septiembre a noviembre) y 2 periodos bajos (de junio a agosto y de diciembre a marzo) (Alcaldía de Santa Bárbara, 2015). La vegetación corresponde a un bosque Andino, constituido por árboles de gran porte donde se destaca la abundancia del roble (Quercus humboldtii).
Se realizaron 11 salidas entre octubre del 2014 y septiembre del 2015 (exceptuando el mes de febrero) con una duración de 8 días. De acuerdo a la facilidad de acceso al terreno se establecieron 5 estaciones de muestreo designadas como A, B, C, D y E las cuales fueron separadas entre sí cada 100 m. En cada estación se colocaron 2 subestaciones de muestreo, cada una de ellas con 10 trampas tipo Sherman (7.6 × 8.9 × 22.9 cm) ubicadas en forma aleatoria. En total se colocaron 20 trampas por estación y 100 trampas en un área total de muestreo de aproximadamente 1.8 hectáreas. Las trampas permanecieron activas durante 5 noches consecutivas y fueron cebadas diariamente con una mezcla de maní molido, masa de maíz, avena en hojuelas, grasa vegetal y esencia de vainilla. Es importante mencionar que como parte de un trabajo paralelo se instalaron trampas de caída dentro de las estaciones de muestreo anteriormente mencionadas, con el fin de cuantificar la biomasa de insectos.
Se consideraron arbitrariamente como pequeños mamíferos aquellas especies que registraron un peso menor a 200 g (Korn, 1987). Los individuos capturados fueron mantenidos en bolsas de tela y una vez revisada la totalidad de las trampas se inició el procesamiento y la identificación taxonómica siguiendo a Gardner (2007) y Patton et al. (2015). Se tomaron las siguientes medidas: longitud total (Lt), longitud cabeza-cuerpo (Lcc), longitud de la cola (Lc), longitud de la oreja (Lo) y longitud de la pata posterior (Lp). Se usaron características cráneo dentales para realizar la identificación taxonómica. De las especies de roedores se recolectaron 25 individuos de Rhipidomys fulviventer, 13 de Nephelomys meridensis, 4 de Neomicroxus bogotensis, 8 de Microryzomys minutus y 5 de Thomasomys laniger. Del marsupial Marmosops caucae se recolectaron 6 individuos y de la musaraña Cryptotis cf. tamensis, 21 individuos. Todos los individuos fueron recolectados bajo el permiso “Marco de Recolección de Especímenes de Especies Silvestres de la Diversidad Biológica con Fines de Investigación Científica No Comercial” otorgado por la ANLA a la Universidad Industrial de Santander. Los especímenes preparados en seco o líquido fueron depositados en la Colección Mastozoológica del Museo de Historia Natural de la Universidad Industrial de Santander.
Con el fin de caracterizar las condiciones bióticas en cada una de las estaciones de muestreo, se establecieron 10 parcelas de 5 × 5 metros adyacentes al lugar donde fueron ubicadas las trampas Sherman. Partiendo de las metodologías usadas por Cerqueira y Freitas (1999) y Lima et al. (2010), dentro de cada parcela se tomaron datos de las siguientes variables: porcentaje de cobertura vegetal (% CV), número de árboles (NA), número de árboles con un perímetro mayor o igual a 10 cm (NA >10), promedio de los perímetros mayores o iguales a 10 cm (PA), altura de árboles (AA), altura promedio del dosel (AD), número de arbustos (NB), altura de los arbustos (AB), número de hierbas (NH), número de troncos caídos (NT), número de troncos caídos con un perímetro mayor o igual a 10 cm (NT >10), promedio de los perímetros de los troncos caídos mayores o iguales a 10 cm (PT), promedio de las longitudes de troncos caídos con un perímetro igual o mayor a 10 cm (LT) y número de hoyos en el suelo (NY). Finalmente, con una cuadrilla de 1 × 1 m se midió el porcentaje de suelo desnudo (% SD), porcentaje de rocas (% Rc), porcentaje de hojarasca (% Hj) y la profundidad de la hojarasca (PrH). Las variables altura de los árboles, altura promedio del dosel y altura de los arbustos fueron medidas en metros, mientras que la profundidad de la hojarasca fue medida en centímetros. Posteriormente todas las unidades métricas fueron convertidas a centímetros para realizar los análisis estadísticos.
La determinación taxonómica de los individuos recolectados se realizó en el laboratorio de ecología de la Universidad Industrial de Santander. Se revisaron caracteres craneodentales y de morfología externa siguiendo los trabajos de Alvarado-Serrano y D’Elía (2013); Carleton y Musser (1989); Díaz-Nieto y Voss (2016); García y Sánchez-González (2013); Gardner (2007); Patton et al. (2015); Quiroga-Carmona y DoNascimiento (2016);
Quiroga-Carmona y Woodman (2015); Voss et al. (2004).
El esfuerzo de captura se calculó multiplicando el número de trampas instaladas en el área de estudio por el número de noches de muestreo y por los meses de muestreo completados. El éxito de captura se calculó mediante la fórmula Ex. C. = (C.T/E.C) × 100, donde: Ex. C = éxito de captura, C.T. = total de individuos capturados y E.C = esfuerzo de captura.
Para relacionar las condiciones físicas de los microhábitats con la abundancia de las diferentes especies, se realizó primero un análisis de componentes principales (PCA) con las variables estructurales de la vegetación. Los primeros 5 factores que reunieron 68.5% de la varianza de los datos fueron utilizados como nuevas variables en un análisis de regresión lineal múltiple paso a paso hacia atrás, en conjunto con las abundancias de las diferentes especies en las estaciones de muestreo. Los análisis estadísticos se realizaron en los programas Past3 (Hammer et al., 2001) y Statistica7 (Stat Soft, 2004).
Debido a que T. laniger fue la única especie que no se capturó en todas las estaciones de muestreo, usamos una regresión logística múltiple para predecir la presencia o ausencia de la especie en función de las variables del microhábitat. Para este análisis la variable dependiente fue la presencia o ausencia de T. laniger en las estaciones de muestreo y 2 modelos fueron analizados (variables predictoras): 1) las variables de microhábitat originales, 2) los factores de microhábitat obtenidos del análisis de componentes principales. La efectividad de cada uno de estos modelos fue evaluada utilizando el criterio de información de akaike (AIC) en la plataforma R studio, utilizando el paquete R commander (Rcmdr).
Para evaluar la fluctuación temporal de las abundancias de cada una de las especies entre los meses, se realizó una prueba de x2. Posteriormente, debido a que los datos no cumplen con los requisitos de normalidad y equidistribución de los residuos se realizó una correlación de Spearman entre los valores promedio de precipitación de cada mes y el número de individuos capturados de cada especie. Los análisis estadísticos se realizaron en los programas Past3 (Hammer et al., 2001) y Statistica7 (Stat Soft, 2004).
Resultados
El esfuerzo de muestreo fue de 4,312 trampas/noche y el éxito de captura del 7.6 %. En total se capturaron 358 individuos correspondientes a 7 especies: 5 roedores, 1 musaraña y 1 marsupial. De los ratones, R. fulviventer fue la especie más abundante con 160 (45%) individuos, seguida de N. meridensis con 91 (26%), N. bogotensis con 10 (3%), M. minutus con 8 (2%) y finalmente T. laniger con tan solo 5 (1%) individuos. Del marsupial M. caucae, se capturaron 55 (15%) individuos y de la musaraña C. cf. tamensis, 29 (8%) individuos. La mayoría de los individuos de C. cf. tamensis se capturaron en las trampas de caída que fueron dispuestas en las estaciones de muestreo con el fin de cuantificar la biomasa de insectos en un trabajo paralelo.
Las estaciones A y B presentaron mayor número de capturas durante toda la fase de campo, con 105 y 103 respectivamente, seguidas de la estación E con 83 y finalmente las estaciones D y C con 69 capturas cada una.
De las 17 variables estructurales de la vegetación que fueron medidas, 7 fueron las más importantes en el análisis de componentes principales (PCA) las cuales se representaron en 5 factores con una varianza acumulada del 68.5% (tabla 1).
Tabla 1
Las 7 variables más importantes del análisis de componentes principales y los valores propios de cada factor. En negritas, las variables que más aportan en cada factor.
|
Variables |
Factor1 |
Factor 2 |
Factor3 |
Factor4 |
Factor5 |
|
Núm. de árboles |
0.789148 |
0.108643 |
-0.410341 |
0.031694 |
0.112346 |
|
Núm. de árboles con perímetro >10cm |
0.728547 |
0.107664 |
-0.489651 |
0.016034 |
0.125725 |
|
Altura promedio del dosel |
0.212184 |
-0.031188 |
0.184330 |
-0.740367 |
-0.278033 |
|
Suma de longitudes de troncos caídos con perímetro > 10 |
-0.461662 |
0.203458 |
-0.543707 |
-0.503326 |
-0.064879 |
|
% suelo desnudo |
-0.276047 |
0.71619 |
-0.113454 |
0.449977 |
-0.311292 |
|
% hojarasca |
0.274431 |
-0.726526 |
0.129108 |
-0.434227 |
0.327363 |
|
Profundidad de la hojarasca |
0.144068 |
0.220838 |
-0.316004 |
0.026689 |
0.724936 |
Las regresiones paso a paso evidenciaron que las abundancias de las especies R. fulviventer (r2 = 0.48; p < 0.0001), M. caucae (r2 = 0.32; p < 0.02), C.cf. tamensis (r2 = 0.15; p < 0.02), N. bogotensis (r2 = 0.33; p < 0.01) y T. laniger (r2 = 0.27; p < 0.001) tienen una relación significativa con la profundidad de la hojarasca. Así mismo, las abundancias de las especies C. cf. tamensis (r2 = 0.15; p < 0.02) y T. laniger (r2 = 0.27; p < 0.001) también se encuentran relacionadas significativamente con el número de árboles con perímetro mayor o igual a 10 cm y altura promedio del dosel, respectivamente. Por último, para los casos de N. meridensis (r2 = 0.01369; p < 0.2) y M. minutus (r2 = 0.26; p < 0.06) no se pudo constatar una relación significativa entre sus abundancias y los valores de las variables estructurales de la vegetación medidas en la fase de campo.
A excepción de T. laniger, que no fue capturado en las estaciones C y D, las demás especies fueron registradas en todas las estaciones de muestreo. El análisis de regresión logística evidenció que las variables de microhábitat originales (AIC = 64.19) y los factores de microhábitat obtenidos del análisis de componentes principales (AIC = 63.62) son buenos predictores de la presencia o ausencia de T. laniger en las diferentes estaciones. El valor del delta de Akaike inferior a 2 (0.529) evidenció que los 2 modelos son similares. Para el primer modelo (variables hábitats originales) se encontró que la profundidad de la hojarasca (p < 0.02) y altura promedio del dosel (p < 0.03) están significativamente relacionadas con la presencia de T. laniger. En el segundo modelo (factores del PCA), el factor 4 (p < 0.01) y el factor 5 (p < 0.02) fueron los más importantes. Se encontró que las segundas variables del primer modelo son las que más peso tienen sobre estos factores.
En general, la abundancia de individuos cambió significativamente a través del tiempo (x2= 59.92; p < 0.0001), siendo enero y mayo los meses con mayor número de capturas, mientras que julio, octubre y diciembre fueron los meses en los que se capturaron un menor número de individuos (tabla 2). Sin embargo, al hacer el análisis para cada una de las especies, se encontró que las abundancias de C. cf. tamensis (x2 = 13.86; p < 0.19) y N. bogotensis (x2 = 4.35; p < 0.96) no variaron significativamente lo largo del tiempo de muestreo. Solo para la especie más abundante, es decir, R. fulviventer, se constató una relación significativa positiva con la precipitación (r2 = 0.89; p < 0.04).
Tabla 2
Número de individuos de cada especie en cada mes de muestreo y precipitación promedio mensual en el área de estudio.
|
Cryptotis cf. tamensis |
Marmosops caucae |
Microryzomys minutus |
Neomicroxus bogotensis |
Nephelomys meridensis |
Rhipidomys fulviventer |
Thomasomys laniger |
Precipitación |
|
|
Enero |
3 |
23 |
0 |
2 |
20 |
31 |
1 |
27 |
|
Marzo |
0 |
11 |
0 |
2 |
11 |
37 |
1 |
68 |
|
Abril |
4 |
10 |
2 |
2 |
8 |
31 |
0 |
148 |
|
Mayo |
4 |
9 |
4 |
3 |
10 |
55 |
0 |
159 |
|
Junio |
1 |
4 |
2 |
2 |
2 |
25 |
0 |
113 |
|
Julio |
1 |
3 |
0 |
1 |
10 |
20 |
0 |
82 |
|
Agosto |
2 |
7 |
1 |
1 |
12 |
31 |
0 |
107 |
|
Septiembre |
2 |
7 |
0 |
1 |
9 |
35 |
0 |
134 |
|
Octubre |
7 |
3 |
0 |
2 |
18 |
4 |
0 |
171 |
|
noviembre |
3 |
9 |
0 |
1 |
24 |
18 |
1 |
109 |
|
Diciembre |
2 |
5 |
0 |
0 |
12 |
12 |
2 |
50 |
|
Total de capturas |
29 |
91 |
9 |
17 |
136 |
299 |
5 |
Discusión
Un total de 7 especies, representando 3 órdenes taxonómicos, se encontraron en el área de estudio. La riqueza de especies en cada orden fue similar a la encontrada en otros trabajos con pequeños mamíferos no voladores en Colombia (Otálora, 2003; Sánchez-Giraldo y Díaz-Nieto, 2015; Sánchez et al., 2004; Zúñiga et al., 1988), siendo Rodentia el orden con mayor número de especies, seguido de Didelphimorphia y finalmente Eulipotyphla, con un menor número de especies. Así mismo, los géneros registrados corresponden a lo que se esperaría encontrar según la literatura y los trabajos de otros autores en este tipo de ecosistemas andinos (Zúñiga et al., 1988; Sánchez et al., 2004 Sánchez-Giraldo y Díaz-Nieto, 2015). Por ejemplo, en un estudio realizado por Otálora (2003) en 2 bosques de roble de los municipios de Charalá y Encino, Santander, Colombia, se registraron un total de 16 especies de pequeños mamíferos, de las cuales 4 podrían corresponder a especies registradas en el presente trabajo: Akodon sp. y Oligorizomys albigularis que según propuestas taxonómicas actuales podrían ser N. bogotensis y N. meridensis, respectivamente (Alvarado-Serrano y D’Elía, 2013; Weksler et al., 2006) y Rhipidomys sp. junto con Thomasomys sp., corresponderían a R. fulviventer y T. laniger (Patton et al., 2015 ).
La información obtenida por Montenegro-Díaz et al. (1991) en un trabajo realizado en el oriente del departamento de Cundinamarca, Colombia, señala que R. latimanus es una especie de hábitos arbóreos que, aunque pasa la mayor parte del tiempo en el dosel, también utiliza el suelo, donde encuentra refugio y parte de su dieta, la cual consiste principalmente de frutos y semillas, aunque puede incluir hojas tiernas e insectos. El hecho de que R. fulviventer use todos los niveles del bosque, así como su capacidad de explotar una amplia gama de recursos alimenticios, le otorga una ventaja sobre las demás especies de roedores que se registraron, las cuales son de hábitos terrestres. Esto podría explicar una mayor abundancia de esta especie en todas las estaciones a lo largo del tiempo de muestreo (Montenegro-Díaz et al., 1991).
El número de capturas fue similar entre las 5 estaciones, probablemente porque la separación entre los sitios fue de 100 m y las características del microhábitat fueron homogéneas.
Siete fueron las variables estructurales de la vegetación más importantes; sin embargo, la profundidad de la hojarasca, seguida del promedio del perímetro de los árboles y la altura promedio de dosel fueron las variables correlacionadas significativamente con las abundancias de la mayoría de especies. Estas variables probablemente están relacionadas con la oferta de recursos alimenticios y refugio, los cuales son factores determinantes en la selección de hábitat por parte de las diferentes especies de micromamíferos (Cerqueira y Freitas, 1999; Cerqueira et al., 1993; López -Arévalo et al., 1993).
Se encontró una correlación positiva entre la profundidad de la hojarasca y la abundancia de 5 de las especies registradas. El hecho de que 3 de estas especies sean de hábitos principalmente terrestres (N. bogotensis T. laniger y C. cf. tamensis), puede ser un indicio de que, en ecosistemas andinos, las capas de vegetación acumulada del bosque de roble son fundamentales para el forrajeo y la protección ante los depredadores a nivel del suelo. Por otra parte, las especies R. fulviventer y M. caucae, aunque tienen hábitos principalmente arbóreos, eventualmente pueden descender y forrajear a nivel del sotobosque (Montenegro-Díaz et al., 1991), por lo que una mayor profundidad de la hojarasca ofrecería los mismos beneficios que a las especies terrestres. Aunque no existen estudios similares en los Andes que confirmen esta idea, diferentes autores han reportado, en otro tipo de ecosistemas y para otras especies, la importancia de variables que también podrían estar relacionadas con el forrajeo y la protección ante los depredadores a nivel del suelo, tales como el porcentaje de cobertura vegetal, el número de hierbas y el número y altura de arbustos (Dalmagro y Vieira, 2005; Gentile y Fernández, 1999; Lima et al., 2010). Todo esto en conjunto sugiere que evitar la depredación es un aspecto importante de la selección de microhábitat por parte de pequeños mamíferos, en particular aquellos con hábitos terrestres (Lima et al., 2010). El hecho de que no se haya reportado una relación entre las variables medidas y la abundancia de M. minutus y N. meridensis, podría indicar que sus abundancias están siendo moduladas por otros factores que no fueron cuantificados en el área de
estudio.
Montañez-Quiroga (2009), en un estudio realizado en el departamento de Santander, Colombia, además de medir variables estructurales de la vegetación para caracterizar el microhábitat, incluyó en su trabajo variables abióticas como la temperatura ambiental, la humedad relativa del suelo y la humedad relativa ambiental, encontrando que estas 2 últimas, en conjunto con el porcentaje de cobertura de plantas y el porcentaje de obstrucciones, están relacionadas con presencias y ausencias de algunas especies como Orizomys cf. alfaroi y Akodon cf. affinis.
Las abundancias de las 7 especies registradas fueron significativamente variables a lo largo del tiempo de muestreo, sin embargo, no se encontró una relación estadística entre estas y la precipitación, excepto en el caso de R. fulviventer que mostró un aumento hacia los meses con mayor lluvia. El aumento en la abundancia relacionado con la precipitación se ha reportado para otros roedores neotropicales, tales como Peromyscus mexicanus (Rojas-Rojas y Barboza-Rodríguez, 2007), Heteromys catopterius, Neacomys tenuipes, Nephelomys caracolus, Oligorizomys trinitatis, O. fulvescens, Rhipidomys venezuelae, R. venustus, Sigmodon hirsutus (García et al., 2013), entre otros. Estos aumentos en la abundancia pueden deberse a que el período lluvioso propicia la producción y caída de frutos y semillas (Rojas-Rojas y Barboza-Rodríguez, 2007), así mismo, la permanente nubosidad que caracteriza el bosque altoandino en este período reduce el riesgo de heladas, lo que favorece una mayor actividad de las poblaciones y posiblemente un mayor éxito reproductivo (Montenegro-Díaz et al., 1991).
Para el caso de la segunda especie más abundante N. meridensis, no se evidenció una relación estadística entre la precipitación y la abundancia de individuos durante todo el período de muestreo, como era de esperarse. Cerqueira et al. (1993) reportan un patrón similar en Akodon cursor y Proechymis iheringi, 2 especies de roedores al sudeste de Brasil cuyas poblaciones aparentemente no fluctúan con relación a la precipitación. Aunque ellos tampoco esperaban este resultado, sugieren que tal vez las diferencias estacionales en la precipitación u otros factores climáticos no son lo suficientemente fuertes como para inducir patrones marcados de fluctuaciones poblacionales. Según lo anterior, es posible que la abundancia de N. meridensis en la zona de estudio esté siendo modulada por otros factores abióticos diferentes a la precipitación, así como por la disponibilidad de recursos y las características del microhábitat. Como soporte de lo anterior, Villamizar-Ramírez et al. (2017) reporta en un trabajo paralelo al presente, una variación significativa de la abundancia de artrópodos y frutos y semillas de roble en el suelo durante todo el año en la zona de estudio. Estos ítems alimenticios, especialmente los derivados del roble, aparentemente son parte importante de la dieta de la especie (Villamizar- Ramírez, 2017). Así mismo, los resultados del presente trabajo demuestran la influencia de algunas variables estructurales de la vegetación en la abundancia de la especie.
Aunque los análisis estadísticos sugieren que no existe una relación entre la precipitación y las abundancias de M. minutus y T. laniger, posiblemente exista un sesgo como consecuencia de las pocas capturas logradas para estas especies. Si bien esto podría reflejar densidades poblacionales bajas en la zona de estudio, se requiere de la continuidad del estudio para evaluar robustamente el patrón de fluctuación con relación al tiempo y otros factores.
Para el caso de la especie de musaraña C. cf. tamensis, de manera general se pudo evidenciar una mayor cantidad de capturas en los meses de abril y mayo, los cuales coinciden con el primer pico lluvioso del año. Sin embargo, la relación estadística entre la precipitación y la abundancia no pudo ser evaluada en este caso con robustez debido a que el método de captura de la especie no se implementó de forma estandarizada durante todo el periodo de estudio.
Con respecto al marsupial M. caucae, la mayor abundancia de individuos se registró en enero, el mes más seco del año. Este patrón se ha reportado también para otras especies de marsupiales neotropicales, sin embargo, ninguna de ellas con distribución andina. Gentile et al. (2000) destacan una mayor abundancia de las especies Didelphis aurita y Philander frenata al final y después de los períodos lluviosos, lo cual podría deberse a un incremento en la actividad reproductiva al inicio de los periodos secos (Cequeira et al., 1993; D’Andrea et al., 1994; O’ Connell, 1982).
En conclusión, para este estudio se capturaron 7 especies que representan 3 órdenes taxonómicos. La especie más abundante fue Rhipidomys fulviventer con 160 individuos, así mismo, esta especie fue la única en la cual se constató una relación significativa positiva con la precipitación. Finalmente, en cuanto a las variables estructurales de la vegetación, la profundidad de la hojarasca seguida del promedio del perímetro de los árboles y la altura promedio de dosel fueron las variables correlacionadas significativamente con las abundancias de la mayoría de las especies.
Agradecimientos
A Ángela M. Villamizar, Christian F. Cacua, Andrés Quiñones, Omar Reyes, Julián Villamizar; Sebastián Solís, Mauricio Salazar, Laura Silva y Wilson Pinzón, quienes tuvieron la disposición de colaborar en alguna de las fases de campo. A Julián Lozano-Flórez quien aporto sus conocimientos en taxonomía y métodos de captura. Al Grupo de Estudios en Biodiversidad y al Laboratorio de Ecología por financiar este trabajo, y a la Universidad Industrial de Santander.
Referencias
Alcaldía de Santa Bárbara. (2015). Nuestro Municipio, información general, ecología. Página web municipal. Recuperado el 13 abril de: http://www.santabarbara-Santander.gov.co/informacion_general.shtml.
Alvarado-Serrano, D. y D’Elía, G. (2013). A new genus for the Andean mice Akodon latebricola and A. bogotensis (Rodentia: Sigmodontinae). Journal of Mammalogy, 94, 995–1015.
Andreazzi, C., Rademaker, V., Gentile, R., Herrera, H., Jansen, A. y D’andrea, P. (2011). Population ecology of small rodents and marsupials in a semi-deciduous tropical forest of the southeast Pantanal, Brazil. Zoologia (Curitiba), 28, 762–770.
Carleton, M. y Musser, G. (1989). Systematic studies of Oryzomyine rodents (Muridae, Sigmodontinae): a synopsis of Microryzomys. Bulletin of the american museum of natural history, 191, 1–83.
Castaño, J. y Corrales, D. (2010). Mamíferos de la cuenca del río La Miel (Caldas): diversidad y uso cultural. Boletín Científico Museo de História Natural, 14, 56–75.
Cerqueira, R. y Freitas, S. (1999). A new study method of microhabitat structure of small mammals. Revista Brasileira de Biologia, 59, 219–223.
Cerqueira, R., Gentile, R., Fernández, F. y D’Andrea, P. (1993). A five-year population study of an assemblage of small mammals in Southeastern Brazil. Mammalia, 57, 507–517.
Coetzee, C. G. y Jackson, T. P. (1999). The comparative behaviour and ecology of Parotomys brantsii and P. littledalei (Mammalia, Rodentia, Otomyinae). Journal-Namibia Scientific Society, 47, 87–106.
Dalmagro, A. D. y Vieira, E. M. (2005). Patterns of habitat utilization of small rodents in an area of Araucaria forest in Southern Brazil. Austral Ecology, 30, 353–362.
D’Andrea, P. S., Cerqueira, R. y Hingst, E. D. (1994). Age estimation of the gray four eyed opossum, Philander opossum (Didelphimorphia: Didelphidae). Mammalia, 58, 283–292.
Díaz-Nieto, J. F. y Voss, R. S. (2016). A revision of the didelphid marsupial genus Marmosops, Part 1. Species of the subgenus Sciophanes. Bulletin of the American Museum of Natural History, 402, 1–70.
García, F. J., Delgado-Jaramillo, M. I., Machado, M., Aular, L. y Mújica, Y. (2013). Pequeños mamíferos no voladores de un bosque nublado del Parque Nacional Yurubí, Venezuela: abundancias relativas y estructura poblacional. Interciencia, 38, 719–725.
García, F. J. y Sánchez-González, E. (2013). Morfometría geométrica craneal en tres especies de roedores arborícolas neotropicales (Rodentia: Cricetidae: Rhipidomys) en Venezuela. Therya, 4, 157–178.
Gardner, A. L. (2007). Mammals of South America. Marsupials, xenarthrans, shrews and bats. Chicago: The University of Chicago Press.
Garsd, A. y Howard, W. E. (1982). Microtine population fluctuations: an ecosystem approach based on time-series analysis. The Journal of Animal Ecology, 51, 225–234.
Gentile, R., D’Andrea, P. S., Cerqueira, R. y Santoro Maroja, L. (2000). Population dynamics and reproduction of marsupials and rodents in a Brazilian rural area: a five-year study. Studies on Neotropical Fauna and Environment, 35, 1–9.
Gentile, R. y Fernández, F. A. S. (1999). Influence of habitat structure on a streamside small mammal community in a Brazilian rural area. Mammalia, 63, 29–40.
Hammer, Ø., Harper, D. A. T. y Ryan, P. D. (2001). Paleontological statistics software: package for education and data analysis. Palaeontologia Electronica, 4, 1–9.
IAvH (Instituto de Investigación de Recursos Biológicos Alexander Von Humboldt). (2012). Informe sobre el estado de los recursos naturales renovables y del ambiente, componente de biodiversidad, 2010-2011. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Korn, H. (1987). Densities and biomasses of non-fossorial southern African savanna rodents during the dry season. Oecologia, 72, 410–413.
Lima, D. O. D., Azambuja, B. O., Camilotti, V. L. y Cáceres, N. C. (2010). Small mammal community structure and microhabitat use in the austral boundary of the Atlantic Forest, Brazil. Zoología (Curitiba), 27, 99–105.
López-Arévalo, H., Montenegro-Díaz, O. y Cadena, A. (1993). Ecología de los pequeños mamíferos de la Reserva Biológica Carpanta, en la Cordillera Oriental colombiana. Studies on Neotropical Fauna and Environment, 28, 193–210.
Mendel, S. M., Vieira, M. V. y Cerqueira, R. (2008). Precipitation, litterfall, and the dynamics of density and biomass in the black-eared opossum, Didelphis aurita. Journal of Mammalogy, 89, 159–167.
Montañez-Quiroga, D. (2009). Preferencia y selección de habitat y microhabitat de mamíferos pequeños terrestres en la finca “El Prado” del municipio de Jesús María, Santander, Colombia (Tesis). Facultad de ciencias, Pontificia Universidad Javeriana. Bogotá D.C.
Montenegro-Díaz, O., López-Arévalo, H. y Cadena, A. (1991). Aspectos ecológicos del roedor arborícola Rhipidomys latimanus TOMES, 1860 (Rodentia: Cricetidae) en el Oriente de Cundinamarca, Colombia. Caldasia, 16, 565–572.
Morales, M., Otero, J., Van, T. y Cárdenas, L. (2007). Atlas de páramos de Colombia. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
O’Connell, M. A. (1982). Population biology of North and South American grassland rodents: a comparative review. Mammalian Biology in South America, 6, 167–86.
Otálora, A. (2003). Mamíferos de los bosques de roble. Acta Biológica Colombiana, 8, 57.
Patton. J., Pardiñas, U. y D’Elía, G. (Eds.). (2015). Mammals of South America, Volume 2: Rodents. Chicago and London: The University of Chicago Press.
Quiroga-Carmona, M. y DoNascimiento, C. (2016). A new species of small-eared shrew of the genus Cryptotis pomel, 1848 (Mammalia, Eulipotyphla, Soricidae) from the easternmost mountains of the Venezuelan Andes. Mammalian Biology-Zeitschrift für Säugetierkunde, 81, 494–505.
Quiroga-Carmona, M. y Woodman, N. (2015). A new species of Cryptotis (Mammalia, Eulipotyphla, Soricidae) from the Sierra de Perijá, Venezuelan-Colombian Andes. Journal of Mammalogy, 96, 800–809.
Ramírez, H. E. y Pérez, W. A. (2007). Mamíferos de un fragmento de bosque de roble en el departamento del Cauca-Colombia. Boletín Científico Centro de Museos Museo de Historia Natural Universidad de Caldas, 11, 65–79.
Ramírez-Chaves, H. E. y Suárez-Castro, A. F. (2014). Adiciones y cambios a la lista de mamíferos de Colombia: 500 especies registradas para el territorio nacional. Mammalogy Notes/Notas Mastozoológicas, 1, 31–34.
Rojas-Rojas, L. y Barboza-Rodríguez, M. (2007). Ecología poblacional del ratón Peromyscus mexicanus (Rodentia: Muridae) en el Parque Nacional Volcán Poás, Costa Rica. Revista de Biología Tropical, 55, 1037–1050.
Romero, M., Cabrera, E. y Ortiz, N. (2008). Informe sobre el estado de la biodiversidad en Colombia 2006-2007. Bogotá: Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt.
Sánchez, F., Sánchez-Palomino, P. y Cadena, A. (2004). Inventario de mamíferos en un bosque de los Andes Centrales de Colombia/Mammal survey in a Central Andes forest in Colombia. Caldasia, 26, 291–309.
Sánchez-Giraldo, C. y Díaz-Nieto, J. F. (2015). Dynamics of species composition of small non-volant mammals from the northern Cordillera Central of Colombia. Mammalia, 79, 385–397.
Silva, M. (2001). Abundance, diversity, and community structure of small mammals in forest fragments in Prince Edward Island National Park, Canada. Canadian Journal of Zoology, 79, 2063–2071.
Singleton, G., Krebs, C. J., Davis, S., Chambers, L. y Brown, P. (2001). Reproductive changes in fluctuating house mouse populations in southeastern Australia. Proceedings of the Royal Society of London B: Biological Sciences, 268, 1741–1748.
Solari, S., Muñoz-Saba, Y., Rodríguez-Mahecha, J. V., Defler, T. R., Ramírez-Chaves, H. E. y Trujillo, F. (2013). Riqueza, endemismo y conservación de los mamíferos de Colombia. Mastozoología Neotropical, 20, 301–365.
Stat Soft. (2004). Statistica (data analysis software system), version 7. Online at: www.statsoft.com
Stenseth, N. C., Ottersen, G., Hurrell, J. y Adlandsvik, B. (2003). Review article. Studying climate effects on ecology through the use of climate indices: the North Atlantic oscillation, El Niño Southern oscillation and beyond. Proceedings Biological Sciences, The Royal Society, 270, 2087–2096.
Villamizar-Ramírez, Á. M., Serrano-Cardozo, V. H., y Ramírez-Pinilla, M. P. (2017). Reproductive activity of a population of Nephelomys meridensis (Rodentia: Cricetidae) in Colombia. Mastozoología Neotropical, 24, 177-189.
Voss, R. S., Tarifa, T. y Yensen, E. (2004). An introduction to Marmosops (Marsupialia: Didelphidae), with the description of a new species from Bolivia and notes on the taxonomy and distribution of other Bolivian forms. American Museum Novitates, 3466, 1–40.
Weksler, M., Percequillo, A. R. y Voss, R. S. (2006). Ten new genera of Oryzomyine rodents (Cricetidae: Sigmodontinae). American Museum Novitates, 3537, 1–29.
Zúñiga, H., Rodríguez, J. R. y Cadena, A. (1988). Densidad de población de pequeños mamíferos en dos comunidades del bosque Andino. Acta Biológica Colombiana, 1,
85–93.



