Manuel Castillo-Rivera * y Guadalupe Morgado-Dueñas
Universidad Autónoma Metropolitana, Unidad Iztapalapa, Departamento de Biología, Laboratorio de Peces, Av. San Rafael Atlixco 186, Colonia Vicentina, 09340 Ciudad de México, México
*Autor para correspondencia: crma@xanum.uam.mx (M. Castillo-Rivera)
Recibido: 19 mayo 2021; aceptado: 14 diciembre 2021
Resumen
El objetivo del estudio es analizar los patrones temporales en la distribución de Beloniformes en un estuario intermitente tropical. Durante 19 meses se realizaron muestreos en ciclos de 24 h cada mes, tomando muestras cada 2 horas (442 muestreos en total). Simultáneamente, se registraron in situ variables abióticas y bióticas, así como variables con registros histórico-regionales. Se capturaron 6 especies, de las cuales Strongylura notata notata mostró un pulso significativo en mayo-agosto, mientras que S. timucu, Hyporhamphus unifasciatus e H. meeki mostraron pulsos significativos en febrero-abril y diciembre (Permanova, p < 0.04). De acuerdo con las correlaciones inter-set de un análisis de correspondencia canónica, la presencia estacional de S. notata notata estuvo principalmente determinada por días largos, altas temperaturas atmosféricas y precipitaciones, mientras que S. timucu e H. unifasciatus se relacionaron con el fitoplancton y zooplancton. Solo S. notata notata presentó diferencias significativas a nivel nictémero (Permanova, p < 0.0005). Las variables histórico-regionales mostraron mayor influencia sobre los patrones de distribución de las especies, que las variables in situ. Un muestreo intensivo permitió conocer de forma más completa las condiciones que determinan los patrones de migración, lo cual contribuye a la conservación y manejo de estas especies.
Palabras clave: Golfo de México; Sitio Ramsar; ANOVA semiparamétrica; Fotoperiodo; Agujón; Pez pajarito
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Seasonal and diel variation in the distribution of Beloniformes at the inlet of a tropical coastal lagoon
Abstract
The objective of the study was to analyze the temporal patterns in the distribution of Beloniformes in an intermittent tropical estuary. During 19 months, a 24-hour sampling cycle was performed each month, taking samples every 2 hours (442 samples in total). Simultaneously, abiotic and biotic variables were recorded in situ, as well as variables with historical-regional records. Six species were caught, of which Strongylura notata notata showed a significant peak from May to August, while S. timucu, Hyporhamphus unifasciatus and H. meeki showed significant pulses during February-April and December (PERMANOVA, p < 0.04). According to the inter-set correlations of a canonical correspondence analysis, the seasonal occurrence of S. notata notata was mainly determined by longer days, and high values of atmospheric temperature and rainfall, while S. timucu and H. unifasciatus were mainly related to phytoplankton and zooplankton densities. Only S. notata notata showed significant diel differences (PERMANOVA, p < 0.0005). The historical-regional variables showed a greater influence on the distribution patterns of the species than the in situ variables. An intensive fieldwork allowed to know in a more complete way, the conditions that determine the migration patterns, which contributes to the conservation and management of these species.
Keywords: Gulf of Mexico; Ramsar site; Semi-parametric ANOVA; Photoperiod; Needlefishes; Halfbeaks
© 2022 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
El orden Beloniformes es un grupo de peces que dominan la región epipelágica de los trópicos y subtrópicos (Collette et al., 2019; Moyle y Cech, 2004; Nelson et al., 2016). En el golfo de México, este orden está representado por 3 familias, 2 de las cuales, Belonidae (peces aguja) y Hemiramphidae (peces pajarito) están representadas por especies marinas que habitan aguas costeras someras, las cuales penetran con cierta regularidad a sistemas estuarinos y dulceacuícolas (Collette, 2002; McEachran, 2009). Así, juveniles y adultos de las especies de los géneros Strongylura, Tylosurus (Belonidae) e Hyporamphus (Hemiramphidae) habitan con frecuencia en sistemas estuarinos, tanto del norte (De Angelo et al., 2014; La Peyre y Birdsong, 2008; Tolan y Nelson, 2009), como del sur del golfo de México (Arévalo-Frías y Mendoza-Carranza, 2015; Castillo-Rivera et al., 2002, 2017; Díaz-Ruiz et al., 2018; Raz-Guzmán et al., 2018; Vega-Cendejas y Hernández, 2004), donde pueden llegar a ser especies moderadamente abundantes (Collette, 2002). No obstante, existen pocos estudios publicados sobre la ecología de estas especies, lo cual en parte se puede deber a su poca importancia dentro de las grandes pesquerías (Arceo-Carranza y Chiappa-Carrara, 2015; Arceo-Carranza et al., 2004; Collette et al., 2019; Egbert y Rulifson, 2017; Porter y Motta, 2004).
Las poblaciones de peces estuarinos llegan a presentar fuertes variaciones estacionales y nictémeras, las cuales están determinadas por factores abióticos y bióticos, por separado o actuando en sinergia. Así, las variaciones de estas poblaciones pueden estar moduladas, a nivel estacional, por factores físicos como la salinidad, temperatura, cobertura vegetal y régimen de precipitación (Castillo-Rivera, 2013; De Angelo et al., 2014; La Peyre y Birdsong, 2008; Tolan y Nelson, 2009), así como por factores biológicos como alimentación, patrones de desove y reclutamiento (Castillo-Rivera et al., 2010; Jaureguizar et al., 2016; Lavergne et al., 2016). A nivel nictémero, las variaciones en salinidad, temperatura, ciclos luz/oscuridad y régimen de mareas, se han asociado con tolerancias fisiológicas y con estrategias biológicas de alimentación, protección, evasión de competencia y de depredación (Castillo-Rivera et al., 2017; Garcia y Pessanha, 2018; Gurdek y Acuña-Plavan, 2017; Pessanha et al., 2003; Teodósio et al., 2016).
Bajo la hipótesis que las variaciones estacionales de las poblaciones se encuentran principalmente moduladas por temperatura, salinidad y régimen de precipitación, mientras que las variaciones nictémeras por el ciclo luz/oscuridad, el objetivo del presente estudio fue analizar los patrones temporales en la distribución de Beloniformes en la boca de una laguna costera tropical.
Materiales y métodos
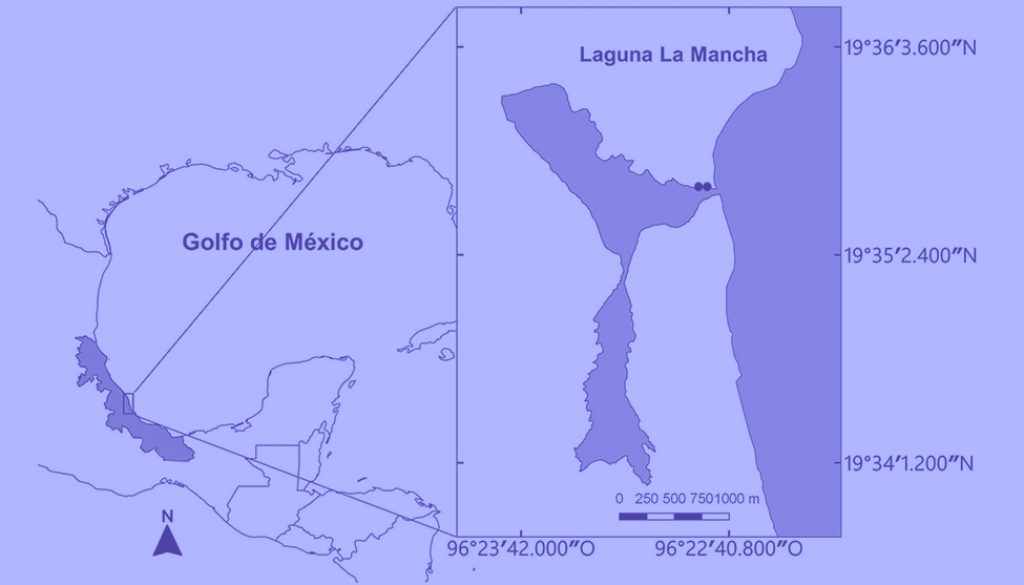
La laguna La Mancha es un sitio Ramsar que se localiza en la parte central del estado de Veracruz (19°33’55”-19°35’44” N, 96°22’41”-96°23’39” O). La extensión lagunar es de 1.742 km2 (Google, 2018; QGIS, 2018), con una longitud aproximada de 3 km. Es un sistema somero micro-mareal rodeado por bosque de manglar, mostrando un patrón estacional de apertura/cierre de la barrera, el cual es regulado por mareas, lluvias y acción humana. El clima es cálido subhúmedo (Aw2), definiéndose 2 épocas climáticas, la de secas, extendiéndose de noviembre a mayo (con promedios de precipitación mensual menores a 60 mm) y la de lluvias de junio a octubre (con promedios de precipitación mensual mayores a 100 mm) (Servicio Meteorológico Nacional, 2020).
Sobre un hábitat arenoso dentro de la laguna, en 2 sitios (a 325 m y 225 m de la boca del sistema (fig. 1), durante 19 meses, se realizaron muestreos en ciclos nictémeros de 24 h cada mes, tomando muestras (con su respectiva réplica simultánea) cada 2 horas, en el período de luna nueva, con el fin de maximizar el efecto luz/oscuridad y de marea (Castillo-Rivera et al., 2010; 2017). Los peces fueron capturados con un chinchorro playero (37.1 m largo, 1.2 m profundidad y 1 cm luz de malla), comprendiendo aproximadamente un área de muestreo de 1,500 m2. Simultáneamente, in situ se registraron clorofila a (técnica de espectrofotometría, SCOR-UNESCO, 1980), número de células fitoplanctónicas (método de Utermölh), biomasa zooplanctónica (arrastres circulares utilizando una red estándar de luz de malla de 150 µm), salinidad (refractómetro ATAGO), temperatura y oxígeno disuelto (oxímetro YSI 550A), hora de muestreo, horas de salida y puesta del sol, y duración del día. Además, se consideraron variables con registros históricos y/o de cobertura regional, como los promedios mensuales de máxima temperatura atmosférica, precipitación máxima mensual (1951-2010; Sistema Meteorológico Nacional, estación 00030353, La Mancha) y mareas (Instituto de Geofísica-UNAM). Inmediatamente después de su captura, los individuos fueron anestesiados con solución de aceite de clavo/alcohol, fijados en formaldehido al 10%, lavados y conservados en alcohol etílico al 70%. Los individuos fueron identificados (Collette, 2002), contados y medida su longitud patrón. El nombre, autor y año de las especies capturadas siguió los criterios de Froese y Pauly (2021).
Se utilizaron análisis de varianza permutacional univariados (Permanova) de 2 vías para evaluar las diferencias en la abundancia de las especies más importantes, con los meses y períodos del día (día: 08:00-16:00 h; penumbra: 06:00 y 18:00 h; noche: 20:00-04:00 h) como factores fijos, así como la significancia de las interacciones entre estos factores. El Permanova es una prueba estadística que permite comparar la respuesta simultánea de 1 o más variables a 1 o más factores, con base en medidas de disimilitud, usando permutaciones múltiples de los datos analizados para generar una distribución propia (pseudo-F), lo que le permite liberarse del cumplimiento de los supuestos de normalidad y homoscedasticidad, además de ser un análisis lo suficientemente robusto incluso con una gran cantidad de 0 (Anderson, 2001, 2014). Se aplicó un análisis de correspondencia canónica (ACC) a la matriz de datos de las abundancias de las especies (conjunto dependiente) y a la matriz de variables ambientales (conjunto independiente), con el fin de dilucidar las relaciones entre estos 2 grupos de datos. Las correlaciones inter-set derivadas de este análisis fueron usadas para determinar las variables ambientales que ejercen más efecto sobre la abundancia de las especies (McGarigal et al., 2000; ter Braak y Šmilauer, 2002). Los Permanova fueron generados con el programa Primer-E 6 + Permanova, utilizando transformación con raíz cuadrada y distancia euclidiana para generar la matriz de similitud, de acuerdo a la rutina para análisis univariados según Anderson et al. (2008), mientras que el ACC fue generado con el programa CANOCO, Ver 4.5 (ter Braak y Šmilauer, 2002).
Resultados
En un total de 442 muestreos se capturaron ejemplares de las especies Strongylura marina (Walbaum 1792), Strongylura notata notata (Poey 1860), Strongylura timucu (Walbaum 1792), Tylosurus crocodilus (Péron y Lesueur 1821), Hyporhamphus meeki Banford y Collette 1993 e Hyporhamphus unifasciatus (Ranzani 1841). El número de individuos recolectados por especie, así como su intervalo de variación en talla y las principales condiciones ambientales bajo las cuales fueron capturados se muestran en la tabla 1.

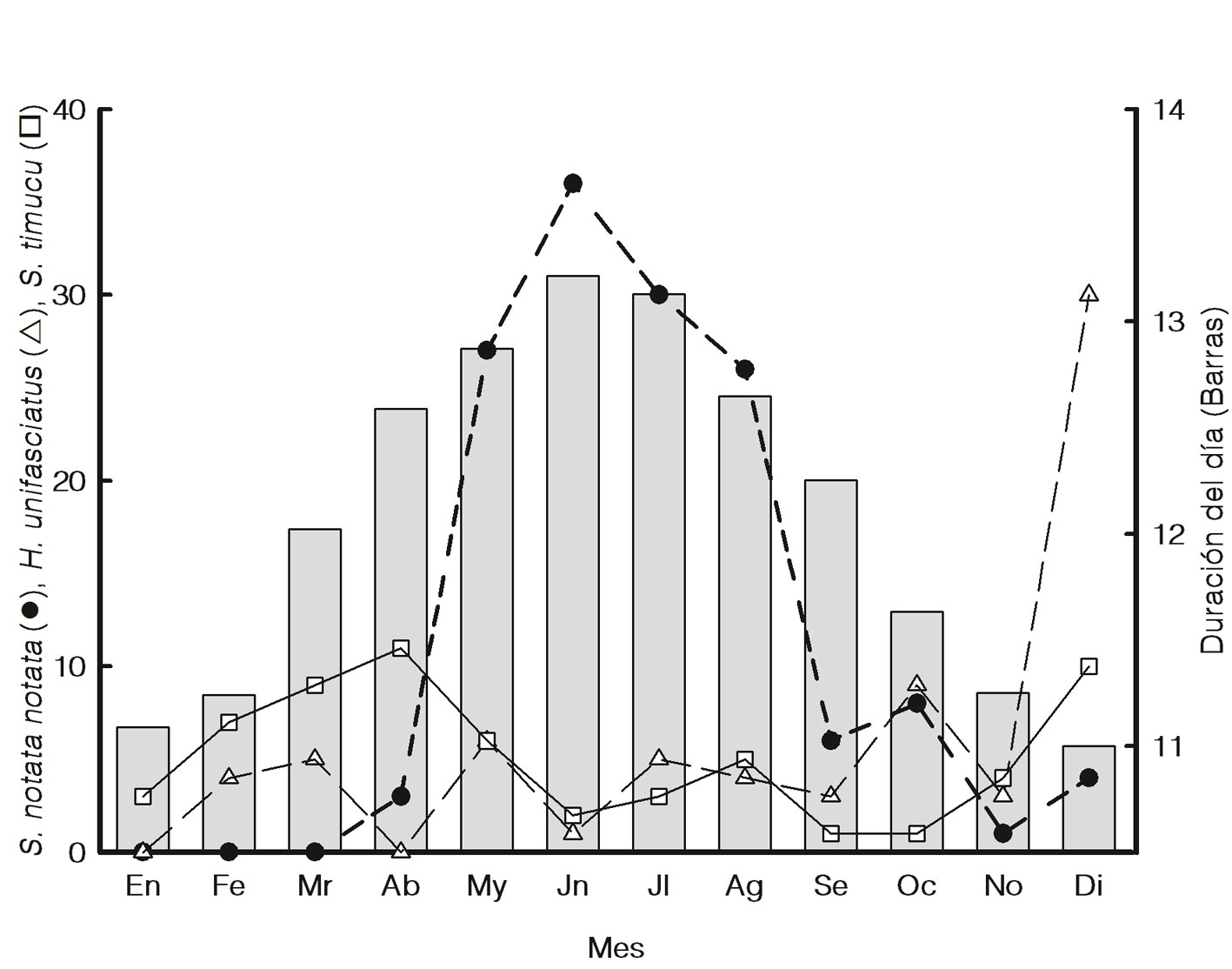
En relación con la variación estacional, S. notata notata fue más abundante de mayo a agosto (con un pulso máximo en junio; fig. 2), existiendo diferencias significativas entre los promedios mensuales. Hyporhamphus unifasciatus mostró un pulso de mayor abundancia en diciembre, S. timucu 2 máximos, 1 en diciembre y otro en febrero-abril (fig. 2) e H. meeki presentó un pulso en marzo. Estas 3 últimas especies también mostraron diferencias significativas entre los promedios mensuales (tabla 2). Diferencias entre meses no fueron evaluadas para las 2 especies menos abundantes, pues S. marina, con abundancias muy bajas, fue registrada solo en el 50% de los 19 meses muestreados, mientras que T. crocodilus fue capturada solo en diciembre.
A nivel nictémero, S. notata notata fue más abundante durante el día (08:00 a 16:00 h), con un pulso máximo a las 14:00 h, presentado diferencias altamente significativas entre los promedios por período del día, mientras que H. unifasciatus mostró pulsos durante la tarde y anochecer (16:00 y 18:00 h) y durante el amanecer (06:00 h) pero sin mostrar diferencias significativas entre estos períodos (tabla 2). Strongylura timucu presentó bajas abundancias durante el día (10:00-16:00 h), con pulsos en horas crepusculares (06:00 y 18:00 h) y en la noche (20:00-24:00 h), mientras que H. meeki mostró pulsos en la tarde (16:00 h) y amanecer (06:00 h), pero para ambas especies tampoco existieron diferencias significativas entre los períodos del día (tabla 2). Las especies S. marina y T. crocodilus mostraron abundancias similares entre los 3 períodos del día. De las interacciones entre los factores estacional y nictémero, solo la correspondiente a H. unifasciatus fue significativa (tabla 2), debido a que durante algunos meses la abundancia fue mayor en la noche y en otros durante el día.
En relación con la influencia de las variables ambientales, los 2 primeros ejes del ACC mostraron 72.9% de variación acumulada y valores de correlaciones especies-variables ambientales relativamente altos para el eje 1. De acuerdo con los valores de las correlaciones inter-set (tabla 3), las variables ambientales más importantes en la determinación de la distribución de las especies fueron aquellas con carácter histórico-regional, como la duración del día (horas), temperatura atmosférica y precipitación máxima mensual (fig. 3). Asimismo, los factores de inflación de la varianza para todas las variables consideradas fueron menores a 7, por lo que no existe evidencia de multicolinealidad en este análisis.
Con respecto a las variables tomadas in situ, las variables bióticas (densidad de fitoplancton y zooplancton) también mostraron cierta importancia, siendo incluso más relevantes que las variables abióticas como la temperatura del agua, estado de la boca, el oxígeno o el período del día (día/penumbra/noche) (fig. 3). Así, la abundancia de S. notata notata estuvo principalmente determinada por días largos, valores altos de temperatura atmosférica y precipitación (lo que implicó un descenso en la salinidad), condiciones que predominaron de junio a agosto, siendo principalmente capturada durante el día, cuando la marea fue baja. Por el contrario, en la abundancia de H. unifasciatus, S. timucu, H. meeki, S. marina y T. crocodilus influyeron principalmente la corta duración del día, valores bajos de temperatura atmosférica y precipitación (con un ascenso de la salinidad) durante los meses de diciembre a marzo, y mareas altas. Asimismo, S. timucu, H. unifasciatus y T. crocodilus fueron más abundantes cuando la concentración de zooplancton y fitoplancton fueron mayores, durante los meses de febrero-marzo y noviembre-diciembre.
Tabla 1
Número de individuos (N), intervalo de tallas, y promedio (x), mínimo (Mín) y máximo (Máx) de las condiciones ambientales en las que se capturaron los individuos, así como para todos los muestreos.
| N | Intervalo de tallas (cm) | Temperatura °C | Salinidad | Oxígeno mgL-1 | |||||||
| x | Mín | Máx | x | Mín | Máx | x | Mín | Máx | |||
| S. marina | 20 | 10.3-52.3 | 28.12 | 24.1 | 32.7 | 24.26 | 6.0 | 39.0 | 5.27 | 3.8 | 7.14 |
| S. notata notata | 141 | 9.7-47.7 | 29.68 | 23.8 | 34.7 | 20.70 | 6.0 | 40.0 | 5.62 | 2.40 | 8.42 |
| S. timucu | 62 | 22.1-52.8 | 26.08 | 20.9 | 31.9 | 24.27 | 6.0 | 38.0 | 5.52 | 2.70 | 7.76 |
| T. crocodilus | 4 | 24.7-31.5 | 24.76 | 23.9 | 26.1 | 34.30 | 30.0 | 38.0 | 5.00 | 4.4 | 5.90 |
| H. meeki | 57 | 10.5-27.3 | 27.76 | 21.4 | 34.7 | 21.59 | 8.0 | 39.0 | 5.88 | 3.60 | 7.4 |
| H. unifasciatus | 70 | 10.3-34.3 | 26.54 | 20.9 | 33.3 | 29.92 | 7.0 | 40.0 | 5.03 | 3.20 | 7.4 |
| Registros en la laguna | 442 | 28.01 | 20.9 | 34.7 | 22.53 | 5.0 | 40.0 | 5.37 | 2.10 | 8.8 |
Tabla 2
Resultados de los Permanova factoriales aplicados para evaluar el efecto estacional (mes) y nictémero (día/penumbra/noche) sobre las especies más abundantes.
| Origen de variabilidad | Grados de libertad | Cuadrados medios | Pseudo-F | p | |
| S. notata notata | Estacional (mes) | 18 | 0.901 | 3.957 | < 0.0005 |
| Nictémero (día/penumbra/noche) | 2 | 3.257 | 14.309 | < 0.0005 | |
| Interacción | 36 | 0.310 | 1.362 | 0.0965 | |
| Error | 385 | 0.228 | |||
| H. unifasciatus | Estacional (mes) | 18 | 0.771 | 6.980 | < 0.0005 |
| Nictémero (día/penumbra/noche) | 2 | 0.270 | 2.443 | 0.083 | |
| Interacción | 36 | 0.268 | 2.425 | 0.0005 | |
| Error | 385 | 0.111 | |||
| S. timucu | Estacional (mes) | 18 | 0.355 | 3.003 | 0.0007 |
| Nictémero (día/penumbra/noche) | 2 | 0.066 | 0.557 | 0.578 | |
| Interacción | 36 | 0.121 | 1.028 | 0.421 | |
| Error | 385 | 0.118 | |||
| H. meeki | Estacional (mes) | 18 | 0.241 | 2.023 | 0.037 |
| Nictémero (día/penumbra/noche) | 2 | 0.040 | 0.338 | 0.713 | |
| Interacción | 36 | 0.098 | 0.824 | 0.672 | |
| Error | 385 | 0.119 |
Se consideran diferencias significativas a un nivel de α< 0.05.
Discusión
Los Beloniformes de la laguna La Mancha estuvieron representados por 6 especies, principalmente juveniles estuarino dependientes, como ha sido comúnmente observado en otros estuarios del golfo, donde pueden llegar a ser dominantes en número o biomasa (Arévalo-Frías y Mendoza-Carranza, 2015; Díaz-Ruiz et al., 2018; Vega-Cendejas y Hernández, 2004). La especie más abundante en el presente estudio fue S. notata notata, siendo también relativamente común que, en estuarios del golfo de México, donde coexisten 4 o más especies de este orden, exista una tendencia a que esta especie sea la más abundante (Arceo-Carranza y Vega-Cendejas, 2009; Castillo-Rivera et al., 2002; De Angelo et al., 2014; Díaz-Ruiz et al., 2018; Vega-Cendejas y Hernández, 2004).
De acuerdo con la variabilidad de los principales factores ambientales en la laguna, las 4 especies más abundantes mostraron una amplia tolerancia a los intervalos de variación en la temperatura, salinidad y oxígeno disuelto.
En relación con la variación estacional de la abundancia, las especies mostraron un uso diferencial del sistema (con diferencias significativas entre los promedios mensuales), en el cual S. notata notata fue más abundante de mayo a agosto, mientras que H. unifasciatus, S. timucu y H. meeki fueron más abundantes en diciembre y/o febrero-abril. Se ha observado que los juveniles de S. notata notata tienden a ser más abundantes durante mayo-julio en otros sistemas estuarinos del sur del golfo de México (Díaz-Ruiz et al., 2018; Vega-Cendejas y Hernández, 2004).
A nivel nictémero, S. notata notata fue significativamente más abundante durante el día (08:00 a 16:00 h). Aunque H. unifasciatus, S. timucu y H. meeki no mostraron diferencias significativas entre los períodos del día, existió una tendencia a que fueran más abundantes en la noche, tarde y horas crepusculares. También han sido observadas mayores abundancias durante el día de S. notata notata, en la tarde para H. unifasciatus y H. meeki, y durante la noche y crepúsculo para S. timucu, en laguna de Celestún, Yucatán (Arceo-Carranza et al., 2010).
Tabla 3
Resultados del análisis de correspondencia canónica (ACC) aplicado a la abundancia de las especies y a los datos ambientales.
| Eje 1 | Eje 2 | |
| Porcentaje acumulado | 48.4 | 72.9 |
| Correlación especies-variables ambientales | 0.55 | 0.352 |
| Correlación inter-set variables ambientales-especies | ||
| Variables in situ | ||
| Clorofila a | 0.051 | 0.130 |
| Fitoplancton | 0.256 | -0.084 |
| Zooplancton | 0.205 | -0.105 |
| Temperatura | -0.149 | 0.0004 |
| Salinidad | 0.196 | -0.062 |
| Oxígeno disuelto | -0.072 | -0.033 |
| Día/penumbra/noche | -0.077 | -0.050 |
| Estado de la boca | -0.001 | 0.109 |
| Variables histórico y/o regionales | ||
| Duración del día | -0.497 | -0.055 |
| Temperatura atmosférica máxima | -0.403 | -0.055 |
| Precipitación máxima | -0.395 | 0.014 |
| Marea | 0.138 | 0.108 |
Los períodos del día fueron considerados de acuerdo con un gradiente luz-oscuridad, con valores de 2 (día), 1 (penumbra) y 0 (noche).
Los resultados del ACC sobre la influencia de las variables ambientales en la determinación de las abundancias explican en gran medida la variación estacional de las especies. Así, las variables histórico-regionales tuvieron mayor incidencia en la determinación de la variación estacional de la abundancia, existiendo una segregación total entre S. notata notata y las otras especies de Beloniformes. Días largos, temperaturas atmosféricas y precipitaciones altas (bajas salinidades), influyeron principalmente en S. notata notata, mientras que días cortos, bajas temperaturas atmosféricas y precipitaciones (salinidades mayores) influyeron sobre H. unifasciatus, S. timucu, H. meeki, S. marina y T. crocodilus. A pesar que el sistema presenta un cierre de la boca durante el período seco-frío (enero-marzo), esta variable tuvo poca influencia en la distribución de las especies.
La variación estacional en la duración del día (fotoperiodo) y temperatura actúa como señal fisiológica importante para muchos organismos (Begon et al., 2006), activando o desactivando patrones de migración, alimentación y reproducción en especies de peces (Comeau et al., 2002; Varpe y Fiksen, 2010; Wang et al., 2010). Aunque el fotoperiodo es una variable regularmente no tomada en cuenta en el análisis de las variaciones estacionales en la migración de peces, en el presente caso fue la variable ambiental de mayor relevancia. Así, el inicio de los días largos y temperaturas altas podrían actuar como señal para S. notata notata para su ingreso al sistema con el fin de alimentarse, como se ha observado en otros estudios (Arceo-Carranza y Vega-Cendejas, 2009; Díaz-Ruiz et al., 2018), lo cual puede estar relacionado con que el período de días largos y temperaturas altas también coincide con el régimen de precipitaciones altas de junio a septiembre.
En la laguna La Mancha, las lluvias incrementan la descarga de ríos y el escurrimiento, aportando grandes cantidades de nutrientes disueltos (Agraz-Hernández et al., 2011; Contreras-Espinosa et al., 2006; López-Portillo et al., 2017) y materia orgánica alóctona hacía el sistema. En el sistema, los nutrientes adicionales durante la época de lluvias estimulan un pulso de producción fitoplanctónica y de pastos acuáticos (Contreras-Espinosa et al., 2006; Rivera-Guzmán et al., 2014), fortaleciendo la ruta de pastoreo, mientras que la materia orgánica derivada principalmente de manglares (i.e., Avicennia germinans) (Agraz-Hernández et al., 2011), promueve la ruta detritívora. Ambas rutas fortalecen la disponibilidad de alimento durante la época lluviosa (Castillo-Rivera, 2013; Castillo-Rivera et al., 2010, 2017; García y Pessanha, 2018), lo cual también favorece un incremento en la abundancia de S. notata notata durante este período.
Los pulsos de abundancia de H. unifasciatus (diciembre), H. meeki (marzo) y S. timucu (diciembre y febrero-abril) coinciden con los pulsos del fitoplancton y zooplancton durante febrero-marzo y noviembre-diciembre en el sistema. Aunque solo para las 2 primeras especies se ha reportado el consumo de algas y pequeños invertebrados (Froese y Pauly, 2021); en general, un aumento en la producción primaria fitoplanctónica, permite un incremento en la disponibilidad de otros recursos tróficos de los que se alimentan estas especies, lo que favorece el aumento de su abundancia.
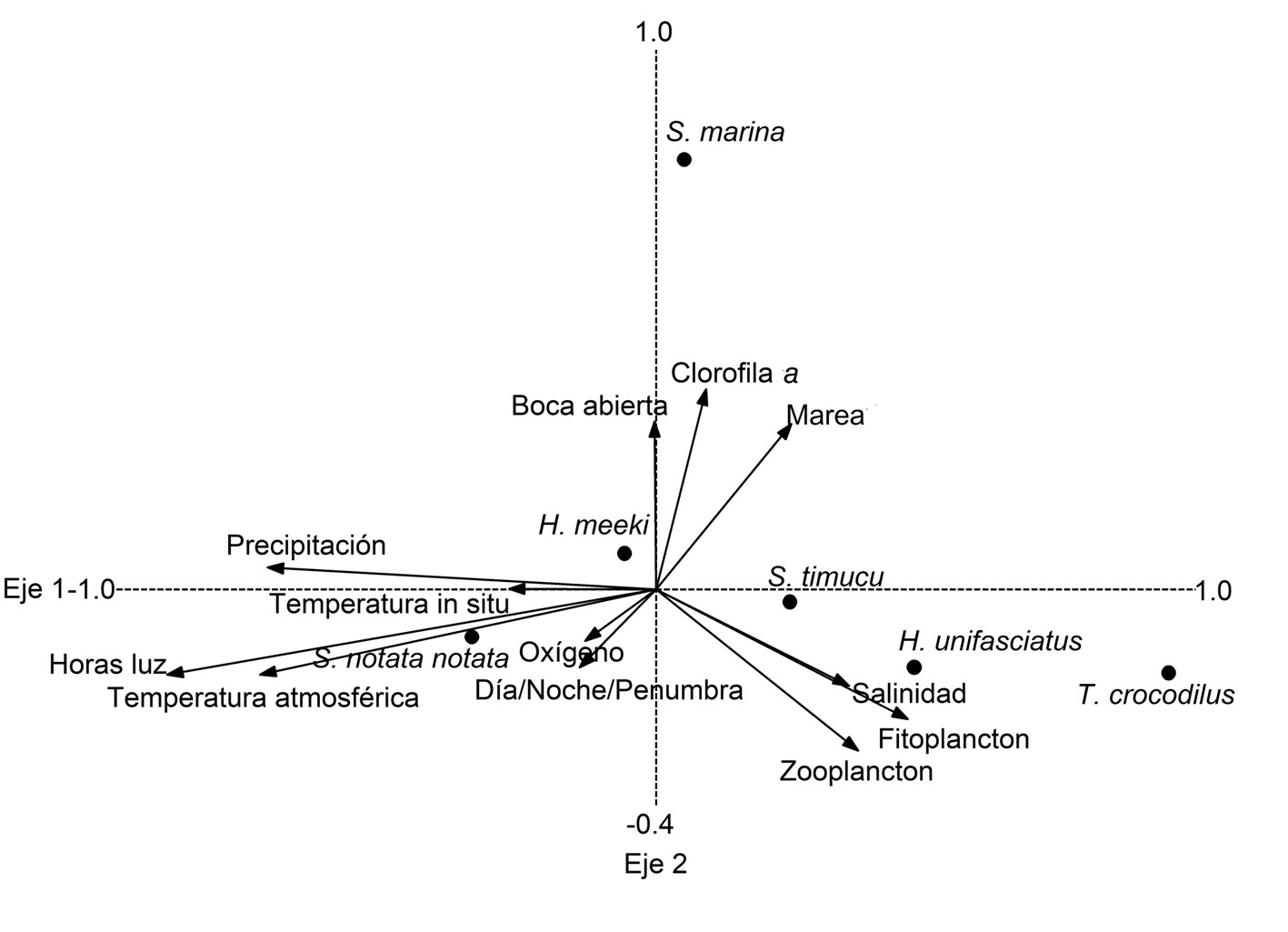
El ACC también mostró que a nivel nictémero, los períodos del día tuvieron menor influencia sobre la abundancia de las especies que el efecto de la marea. La importancia de la marea también ha sido observada en otros estudios (Castillo-Rivera et al., 2010; Gurdek y Acuña-Plavan, 2017; Teodósio et al., 2016). Así, S. notata notata tuvo un patrón diurno y fue capturada en niveles bajos de la marea, mientras que H. unifasciatus, S. timucu, H. meeki, S. marina y T. crocodilus fueron principalmente capturadas en niveles relativamente altos de marea y durante la tarde, noche y/o horas de penumbra. Estos patrones pueden estar relacionados con las estrategias de migración, alimentación y evasión de la competencia, lo que les permitiría a las especies un patrón de reparto de recursos a lo largo de un ciclo de 24 h, siendo cada una más abundante en un particular período del día (día, noche u horas de penumbra) como ha sido observado en otros sistemas estuarinos (Castillo-Rivera et al., 2017; García y Pessanha, 2018; Ley y Halliday, 2007).
Las variables histórico/regionales tuvieron una mayor incidencia en la determinación de los patrones de abundancia de las especies, debido a que los registros históricos con una cobertura más regional que local, podrían explicar de mejor manera los procesos adaptativos de las especies asociados con los patrones de distribución y abundancia. Por el contrario, las variables ambientales tomadas in situ, como la temperatura del agua, salinidad y oxígeno disuelto presentaron una baja incidencia en la determinación de las abundancias, muy probablemente porque éstas solo reflejan condiciones puntuales y efímeras dentro del sistema.
Se ha observado que las variables ambientales a gran escala parecen predecir los procesos ecológicos de mejor manera que las condiciones locales, tanto en peces como en otros organismos (Alonso-Aller et al., 2014; Hallett et al., 2004; Hoeinghaus et al., 2007; Valesini et al., 2014). Particularmente para lagunas salobres del Atlántico mexicano, Sanvicente et al. (2011) evaluaron la contribución relativa de los procesos regionales y locales sobre la estructura de comunidades de larvas de peces, observando que los procesos regionales tuvieron una influencia significativa sobre la composición de especies, mientras que las características ambientales locales no se asociaron significativamente. Asimismo, la consideración de temperatura atmosférica y precipitación máximas, permitió una mayor explicación de la variabilidad de la abundancia, debido a que son regularmente las condiciones extremas (máximos y mínimos de las variables ambientales) las que tienden a regular la abundancia de las especies, más que las condiciones medias del ambiente (Begon et al., 2006).
Agradecimientos
Se agradece a la Universidad Autónoma Metropolitana por el apoyo financiero para realizar el presente estudio y a la Cooperativa Pesquera La Mancha por su autorización para realizar los muestreos. También se agradecen los comentarios de los revisores anónimos que permitieron enriquecer el trabajo.
Referencias
Agraz-Hernández, C. M., García-Zaragoza, C., Iriarte-Vivar, S., Flores-Verdugo, F. J. y Moreno-Casasola, P. (2011). Forest structure, productivity and species phenology of mangroves in the La Mancha lagoon in the Atlantic coast of Mexico. Wetlands Ecology and Management, 19, 273–293. https://doi.org/10.1007/s11273-011-9216-4
Alonso-Aller, E., Gullström, M., Eveleens-Maarse, F. K. J., Gren, M., Nordlund, L. M., Jiddawi, N. y Eklöf, J. S. (2014). Single and joint effects of regional‑ and local‑scale variables on tropical seagrass fish assemblages. Marine Biology, 161, 2395–2405. https://doi.org/10.1007/s00227-014-2514-7
Anderson, M. J. (2001). A new method for non-parametric multivariate analysis of variance. Austral Ecology, 26, 32–46. https://doi.org/10.1111/j.1442-9993.2001.01070.pp.x
Anderson, M. J. (2014). Permutational Multivariate Analysis of Variance (PERMANOVA). Wiley StatsRef: Statistics Reference Online. New Zealand: Massey University. https://doi.org/10.1002/9781118445112.stat07841
Anderson, M. J., Gorley, R. N. y Clarke, K. R. (2008). Permanova + for PRIMER: Guide to software and statistical methods. New Zealand: Massey University.
Arceo-Carranza, D. y Chiappa-Carrara, X. (2015). Feeding ecology of juvenile marine fish in a shallow coastal lagoon of southeastern Mexico. Latin American Journal of Aquatic Research, 43, 621–631. https://doi.org/10.3856/vol43-issue4-fulltext-1
Arceo-Carranza, D., Franco-López, J., Gretchen, L. W. y Chavez-López, R. (2004). Trophic comparison of two species of needlefish (Belonidae) in the Alvarado lagoonal system, Veracruz, Mexico. Gulf and Caribbean Research, 16, 81–88. https://doi.org/10.18785/gcr.1601.14
Arceo-Carranza, D. y Vega-Cendejas, M. E. (2009). Spatial and temporal characterization of fish assemblages in a tropical coastal system influenced by freshwater inputs: northwestern Yucatan peninsula. Revista de Biología Tropical, 57, 89–103. https://doi.org/10.15517/rbt.v57i1-2.11293
Arceo-Carranza, D., Vega-Cendejas, M. E., Montero-Muñoz, J. L. y Hernández, M. J. (2010). Influencia del hábitat en las asociaciones nictimerales de peces en una laguna costera tropical. Revista Mexicana de Biodiversidad, 81, 823–837. https://doi.org/10.22201/ib.20078706e.2010.003.652
Arévalo-Frías, W. y Mendoza-Carranza, M. (2015). Influence of temporal and spatial factors on abundance and richness of fish early stages in shallow tropical estuaries. Environmental Biology of Fishes, 98, 891–904. https://doi.org/10.1007/s10641-014-0324-x
Begon, M., Townsend, C. R. y Harper, J. L. (2006). Ecology. from individuals to ecosystems, 4th Ed. Oxford: Blackwell Publishing.
Castillo-Rivera, M. (2013). Influence of rainfall pattern in the seasonal variation of fish abundance in a tropical estuary with restricted marine communication. Journal of Water Resource and Protection, 5, 311–319. https://doi.org/10.4236/jwarp.2013.53A032
Castillo-Rivera, M., Ortiz-Burgos, S. y Zárate-Hernández, H. (2017). Temporal changes in species richness and fish composition in a submerged vegetation habitat in Veracruz, Mexico. Acta Ichthyologica et Piscatoria, 47, 23–32. https://doi.org/10.3750/AIEP/01997
Castillo-Rivera, M., Zárate-Hernández, R., Ortiz-Burgos, S. y Zavala-Hurtado, A. (2010). Diel and seasonal variability in the fish community structure of a mud-bottom estuarine habitat in the Gulf of Mexico. Marine Ecology, 31, 633–642. https://doi.org/10.1111/j.1439-0485.2010.00394.x
Castillo-Rivera, M., Zavala-Hurtado, J. A. y Zárate-Hernández, R. (2002). Exploration of spatial and temporal patterns of fish diversity and composition in a tropical estuarine system of Mexico. Review in Fish Biology and Fisheries, 12, 167–177. https://doi.org/10.1023/A:1025051027676
Collette, B. B. (2002). Beloniformes. En K. E. Carpenter (Ed.), The living marine resources of the Western Central Atlantic, Vol.2. (pp. 1479–1504). Rome: FAO. FAO species identification guide for fishery purposes/ American Society of Ichthyologists/ Herpetologists special publication
No. 5.
Collette, B. B., Bemis, K. E., Parin, N. V. y Shakhovskoy, I. L. (2019). Fishes of Western North Atlantic. Order Beloniformes: Needlefishes, Sauries, Halfbeaks, and Flyingfishes: Part 10. New Haven, Connecticut: Peabody Museum of Natural History, Yale University Press.
Comeau, L. A., Campana, S. E. y Chouinard, G. A. (2002). Timing of Atlantic cod (Gadus morhua L.) seasonal migrations in the southern Gulf of St Lawrence: interannual variability and proximate control. ICES Journal of Marine Science, 59, 333–351. https://doi.org/10.1006/jmsc.2001.1153
Contreras-Espinosa, F., Castañeda, O. y Rivera-Guzmán, N. (2006). La Laguna. En P. Moreno-Casasola (Ed.), Entornos veracruzanos: la costa de La Mancha (pp. 151–167) Xalapa: INECOL.
De Angelo, J. A., Stevens, P. W., Blewett, D. A. y Switzer, T. S. (2014). Fish Assemblages of shoal- and shoreline-associated seagrass beds in Eastern Gulf of Mexico estuaries. Transactions of the American Fisheries Society, 143, 1037–1048. https://doi.org/10.1080/00028487.2014.911209
Díaz-Ruiz, S., Aguirre-León, A., Mendoza-Sánchez, E. y Lara-Domínguez, A. L. (2018). Factores ambientales que influyen en la ictiofauna de la laguna La Mancha, sitio Ramsar, golfo de México. Revista de Biología Tropical, 66, 246–265. https://doi.org/10.15517/rbt.v66i1.28495
Egbert, M. E. y Rulifson, R. A. (2017). Age and growth, reproductive biology, and histology in Atlantic needlefish (Strongylura marina) in a coastal freshwater lake. Marine and Freshwater Research, 68, 1325–1335. https://doi.org/10.1071/MF16211
Froese, R. y Pauly, D. (Eds). (2021). FishBase. World Wide Web electronic publication. Recuperado el 21 de abril de 2021 de: http://www.fishbase.org
Garcia, A. F. S. y Pessanha, A. L. M. (2018). Temporal dynamics of tidal mudflat fish assemblages in north-eastern Brazil: short and medium-term variations. Journal of the Marine Biological Association of the United Kingdom, 98, 1745–1755. https://doi.org/10.1017/S0025315417001199
Google. (2018). [Mapa de Veracruz, México en Google maps]. Recuperado el 3 de Mayo, 2018, de: https://www.google.com.mx/maps/@19.5828282,-96.3820716,13.86z
Gurdek, R. y Acuña-Plavan, A. (2017). Temporal dynamics
of a fish community in the lower portion of a tidal creek,
Pando sub-estuarine system, Uruguay. Iheringia, Série
Zoologia, 107, e2017003. https://doi.org/10.1590/1678-47
66e2017003
Hallett, T. B., Coulson, T., Pilkington, J. G., Clutton-Brock, T. H., Pemberton, J. M. y Grenfell, B. T. (2004). Why large-scale climate indices seem to predict ecological processes better than local weather. Nature, 30, 7:1–5. https://doi.org/10.1038/nature02708
Hoeinghaus, D. J., Winemiller, K. O. y Birnbaum, J. S. (2007). Local and regional determinants of stream fish assemblage structure: inferences based on taxonomic vs. functional groups. Journal of Biogeography, 34, 324–338. https://doi.org/10.1111/j.1365-2699.2006.01587.x
Jaureguizar, A. J., Solari, A., Cortés, F., Milessi, A. C., Militelli, M. I., Camiolo, M. D. et al. (2016). Fish diversity in the Río de la Plata and adjacent waters: an overview of environmental influences on its spatial and temporal structure. Journal of Fish Biology, 89, 569–600. https://doi.org/10.1111/jfb.12975
La Peyre, M. K. y Birdsong, T. (2008). Physical variation of non-vegetated marsh edge habitats, and use patterns by nekton in Barataria Bay, Louisiana, USA. Marine Ecology Progress Series, 356, 51–61. https://doi.org/10.3354/meps07256
Lavergne, E., Zajonz, U., Krupp, F., Naseeb, F. y Aideed, M. S. (2016). Diversity and composition of estuarine and lagoonal fish assemblages of Socotra Island, Yemen. Journal of Fish Biology, 88, 2004–2026. https://doi.org/10.1111/jfb.12964
Ley, J. A. y Halliday, I. A. (2007). Diel variation in mangrove fish abundances and trophic guilds of northeastern Australian estuaries with a proposed trophodynamic model. Bulletin of Marine Science, 80, 681–720.
López-Portillo, J., Lara-Domínguez, A. L., Vázquez, G. y Aké-Castillo, J. A. (2017). Water quality and mangrove-derived tannins in four coastal lagoons from the Gulf of Mexico with variable hydrologic dynamics. Journal of Coastal Research, 77, 28–38. https://doi.org/10.2112/SI77-004.1
McEachran, J. D. (2009). Fishes (Vertebrata: Pisces) of the Gulf of Mexico. En D. L. Felder y D. K. Camp (Eds.), Gulf of Mexico-origins, waters, and biota. Biodiversity (pp. 1223–1316). Texas: A&M University Press.
McGarigal, K., Cushman, S. y Stafford, S. (2000). Multivariate statistics for wildlife and ecology research. New York: Springer-Verlag.
Moyle, P. y Cech, J. (2004). Fishes: an introduction to Ichthyology, 5th Ed. Upper Saddle River, New Jersey: Prentice Hall.
Nelson, J. F., Grande, T. C. y Wilson, M. V. H. (2016). Fishes of the world, 5th Ed. Hoboken, New Jersey: John Wiley & Sons.
Pessanha, A. L. M., Araújo, F. G., De Azevedo, M. C. C. y Dias-Gomes, I. (2003). Diel and seasonal changes in the distribution of fish on southeast Brazil sandy beach. Marine Biology, 143, 1047–1055. https://doi.org/10.1007/s00227-003-1138-0
Porter, H. T. y Motta, P. J. (2004). A comparison of strike and prey capture kinematics of three species of piscivorous fishes: Florida gar (Lepisosteus platyrhincus), redfin needlefish (Strongylura notata), and great barracuda (Sphyraena barracuda). Marine Biology, 145, 989–1000. https://doi.org/10.1007/s00227-004-1380-0
QGIS.org. (2018). QGIS Geographic Information System. Open Source Geospatial Foundation Project. https://qgis.org
Raz-Guzmán, A., Huidobro, L. y Padilla, V. (2018). An updated checklist and characterisation of the ichthyofauna (Elasmobranchii and Actinopterygii) of the Laguna de Tamiahua, Veracruz, Mexico. Acta Ichthyologica et Piscatoria, 48, 341–362. https://doi.org/10.3750/AIEP/02451
Rivera-Guzmán, N., Moreno-Casasola, P., Ibarra-Obando, S. E., Sosa, V. J. y Herrera-Silveira, J. (2014). Long term state of coastal lagoons in Veracruz, Mexico: Effects of land use changes in watersheds on seagrasses habitats. Ocean & Coastal Management, 87, 30–39. https://doi.org/10.1016/j.ocecoaman.2013.10.007
Sanvicente-Añorve, L., Sánchez-Ramírez, M., Ocaña-Luna, A., Flores-Coto, C. y Ordóñez-López, U. (2011). Metacommunity structure of estuarine fish larvae: the role of regional and local processes. Journal of Plankton Research, 33, 179–194. https://doi.org/10.1093/plankt/fbq098
SCOR-UNESCO. (1980). Determination of photosynthetic pigments in sea water. Paris: UNESCO Monographs on Oceanographic Methodology.
Servicio Meteorológico Nacional. (2020). Normales climatológicas por estado [Internet]. Disponible en: https://smn.conagua.gob.mx/es/informacion-climatologica-por-estado?estado=ver
Teodósio, M. A., Paris, C. B, Wolanski, E. y Morais, P. (2016). Biophysical processes leading to the ingress of temperate fish larvae into estuarine nursery areas: a review. Estuarine, Coastal and Shelf Science, 183, 187–202. https://doi.org/10.1016/j.ecss.2016.10.022
ter Braak, C. J. F. y Šmilauer, P. (2002). CANOCO reference manual and CanoDraw for Windows. User’s guide: software for canonical community ordination (version 4.5). Ithaca, New York: Microcomputer Power.
Tolan, J. M. y Nelson, J. M. (2009). Relationships among nekton assemblage structure and abiotic conditions in three Texas tidal streams. Environmental Monitoring and Assessment, 159, 15–34. https://doi.org/10.1007/s10661-008-0609-7
Valesini, F. J., Tweedley, J. R., Clarke, K. R. y Potter, I. C. (2014). The importance of regional, system-wide and local spatial scales in structuring temperate estuarine fish communities. Estuaries and Coasts, 37, 525–547. https://doi.org/10.1007/s12237-013-9720-2
Varpe, Ø. y Fiksen, Ø. (2010). Seasonal plankton–fish interactions: light regime, prey phenology, and herring foraging. Ecology, 91, 311–318. https://doi.org/10.1890/08-1817.1
Vega-Cendejas, M. E. y Hernández, M. (2004). Fish community structure and dynamics in a coastal hypersaline lagoon: Rio Lagartos, Yucatan, Mexico. Estuarine, Coastal and Shelf
Science, 60, 285–299. https://doi.org/10.1016/j.ecss.2004.01.005
Wang, N., Teletchea, F., Kestemont, P., Milla, S. y Fontaine, P. (2010). Photothermal control of the reproductive cycle in temperate fishes. Reviews in Aquaculture, 2, 209–222. https://doi.org/10.1111/j.1753-5131.2010.01037.x