Israel Cañizales *
Universidad Central de Venezuela, Facultad de Ciencias, Instituto de Zoología y Ecología Tropical, Apartado postal 47058, Caracas 1041-A, Venezuela
*Autor para correspondencia: israel.canizales@ciens.ucv.ve (I. Cañizales)
Recibido: 9 junio 2020; aceptado: 11 noviembre 2020
Resumen
El delfín manchado del Atlántico, Stenella frontalis (Cuvier, 1829), es una especie común en Venezuela. El presente estudio pretende determinar el grado de variación de las características craneanas de individuos de S. frontalis y mostrar la existencia de diferenciación geográfica o separación taxonómica de los grupos. Para distinguir los grupos morfológicos y la variación de estos se usaron pruebas univariadas y multivariadas de 14 medidas craneanas de 20 especímenes previamente caracterizados morfométricamente. El 78.57% de las variables de S. frontalis (occidente) presentan valores medios inferiores a los de S. frontalis (oriente). La variable con mayor porcentaje de variación entre grupos fue el ancho del cráneo a nivel del parietal (ACP) = 28%. Los coeficientes de variación revelaron diferencias significativas (p < 0.05) entre S. frontalis (occidente) y S. frontalis (oriente). El análisis de componentes principales y el análisis de conglomerados (UPGMA) mostraron división entre grupos. Estos resultados apoyan el reconocimiento de 2 grupos morfológicos distintos. Sin embargo, los índices facial y cefálico utilizados para diferenciar las unidades taxonómicas no mostraron diferencias significativas (Kruskal-Wallis, H = 2.316; p = 0.128, H = 1.576; p = 0.209). Además, los diagramas de cajas y bigotes preparados con los índices facial, cefálico y craneal útiles para ilustrar la “regla del 75%” tampoco muestran diferenciación entre el occidente y oriente para S. frontalis.
Palabras clave: Análisis Multivariado; Diferenciación; Morfometría; Stenella frontalis; Venezuela
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Morphometric variation in skulls of the Atlantic spotted dolphin (Stenella frontalis) from Venezuela
Abstract
The Atlantic spotted dolphin, Stenella frontalis (Cuvier, 1829), is a common species in Venezuela. The present study aims to determine the degree of variation in the cranial characteristics of individuals of S. frontalis and to show the existence of geographical differentiation or taxonomic separation of the groups. Univariate and multivariate tests of 14 skull measurements from 20 previously morphometrically characterized specimens were used to distinguish morphological groups and their variation. Roughly 78% of the variables of S. frontalis (west) showed mean values lower than those of S. frontalis (east). The variable with the highest percentage of variation between groups was the parietal width ACP = 28%. Coefficients of variation revealed significant differences (p < 0.05) between S. frontalis (west) and S. frontalis (east). Principal component analysis and cluster analysis (UPGMA) showed division between groups. These results support the recognition of two distinct morphological groups. However, the facial and cephalic indices used to differentiate the taxonomic units did not show significant differences (Kruskal-Wallis, H = 2.316; p = 0.128, H = 1.576; p = 0.209); furthermore, box and whiskers diagrams on the facial, cephalic and cranial indexes commonly useful to illustrate the “75% rule” showed no differentiation between the West and East groups of S. frontalis.
Keywords: Multivariate Analysis; Differentiation; Morphometry; Stenella frontalis; Venezuela
© 2021 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
Introducción
Las variaciones craneales de tipo morfológicas en cetáceos odontocetos se han reportado en varias especies de delfínidos de los géneros Cephalorhynchus, Delphinus, Lagenodelphis, Stenella y Tursiops (Baker et al., 2002; Loy et al., 2010; Perrin, 1975, 1984, 2009; Perrin et al., 2003, 2011; Pinela et al., 2011; Schnell et al., 1985, 1986; Westgate, 2007). Sobre todo, en los caracteres que se asocian con la alimentación, como son el número y el tamaño de los dientes, la longitud y anchura del rostro, y en el tamaño de la fosa temporal, lo que indica que la variación estaría relacionada con la disponibilidad de presas, a las estrategias de alimentación y a las vocalizaciones (Conry et al., 2016; Perrin, 2009).
El género Stenella, con 5 especies de delfines S. frontalis, S. attenuata, S. clymene, S. coeruleoalba y S. longirostris (Wilson y Reeder, 2005) y 6 subespecies (S. a. attenuata, S. a. grafmanni, S. l. centroamericana, S. l. longirostris, S. l. orientalis, S. l. roseiventris), es quizá uno de los que presentan tal número de semejanzas y variaciones intra e interespecíficas respecto de su morfología craneana, que pueden ser fácilmente confundidos entre sí, dificultando su correcta identificación. Todos tienen un rostro aplanado dorsoventralmente relativamente largo y estrecho, un gran número de dientes pequeños y delgados que se diferencian del cráneo de Delphinus en que carecen de surcos palatinos fuertemente definidos (Perrin et al., 1987). En Venezuela una de las especies de cetáceos más comunes es el delfín manchado o moteado del Atlántico Stenella frontalis Cuvier, 1829 (Agudo, 1991, 1992; Agudo et al., 1994; Alvarado et al., 1995; Bolaños y Boher, 1996; Romero et al., 1991, 2001; van Bree, 1975). El cráneo de esta especie puede confundirse con el de Stenella coeruleoalba Meyen, 1833 (Amaral et al., 2009; Barrios y León, 2000), Stenella clymene Gray, 1846 (Perrin et al., 1981; Schmidly et al., 1972), Stenella attenuata Gray, 1846 (Perrin et al., 1987) y Tursiops truncatus Montagu,1821 (Amaral et al., 2009; Perrin et al., 1994). Los cráneos grandes de S. frontalis tienen una forma similar a los cráneos más pequeños de T. truncatus pero pueden diferenciarse con base en el recuento de dientes (más de 30 en S. frontalis). En comparación con S. attenuata, debido a la superposición de todas las medidas del cráneo y del recuento de dientes, los cráneos de las dos especies, especialmente de zonas donde convergen morfológicamente sin información adicional pueden ser muy difíciles de identificar. No existe actualmente un carácter que separe a las 2 especies (Perrin et al., 1994); sin embargo, como análisis discriminante para identificar las especies, se ha utilizado el conteo de alvéolos dentarios, el ancho del rostro a la ½ y a ¾ de su longitud y el ancho del triángulo prenarial a 60 mm (Cañizales y Alvarado, 2013; Perrin et al., 1987). Adicionalmente, como criterios morfológicos craneales para identificar a S. frontalis se señalan la presencia de una marcada línea de fusión supraoccipital, una fosa temporal de gran tamaño con presencia en el borde posterior de pequeñas pestañas óseas de 1 a 5 milímetros proyectadas hacia atrás y hacia adentro, un diámetro alveolar de 6 a 7 mm, la estrecha proximidad de los huesos pterigoideos en su cara medial, la forma ligeramente piriforme a oval del agujero magno (foramen magnum), y la presencia 2 depresiones digitiformes cada una adyacente sobre los cóndilos del occipital (Cañizales y Alvarado, 2013). No obstante, algunos individuos de esta especie pueden presentar variaciones geográficas que en ocasiones generan dudas en la asignación o identificación de la especie basadas de forma exclusiva en las características craneanas. El objetivo de este estudio fue determinar si existe variación geográfica significativa en la morfometría craneal del delfín manchado del Atlántico presente en aguas territoriales de Venezuela.
Materiales y métodos
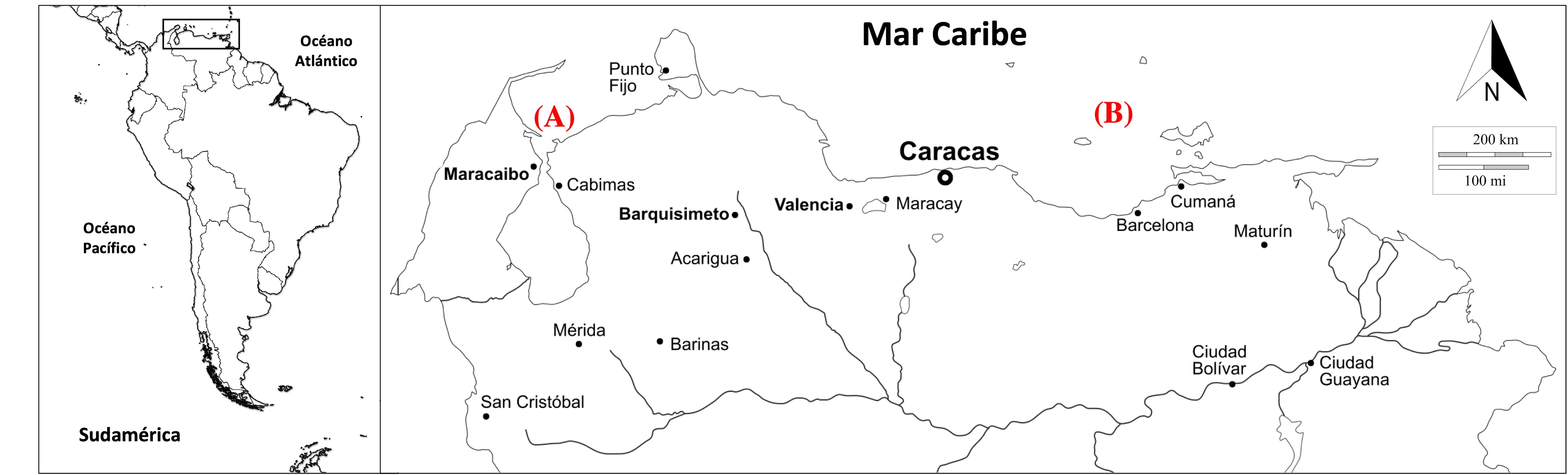
El análisis y comparación craneométrica se hizo a partir de los datos publicados por Acevedo y Briceño (2004) y Cañizales y Alvarado (2013) de cráneos adultos obtenidos en la región occidental y oriental de Venezuela e identificados como S. frontalis (fig. 1). El criterio utilizado para establecer el carácter adulto de los cráneos fue el grado de fusión de los huesos premaxilares a los maxilares, en todos los casos, superior a 50% de su longitud, siguiendo a van Bree (1971) y Perrin et al. (1987); para más información, ver Acevedo y Briceño (2004) y Cañizales y Alvarado (2013). Los cráneos provenientes de la región occidental se encuentran depositados en la colección didáctica de la Asociación Estudiantil Veterinaria por la Fauna Silvestre de la Facultad de Ciencias Veterinarias de la Universidad del Zulia (CAEVFS: 001, 006, 007, 008, 009, 010, 012, 013) y 2 colecciones privadas (CPRI: 001, 002; CPCD: 001). Los cráneos provenientes de la región oriental se encuentran depositados en el Museo de la Estación Biológica de Rancho Grande (EBRG: 22220, 22394, 22396, 22463, 22464, 22465, 22466, 22539, 22540).
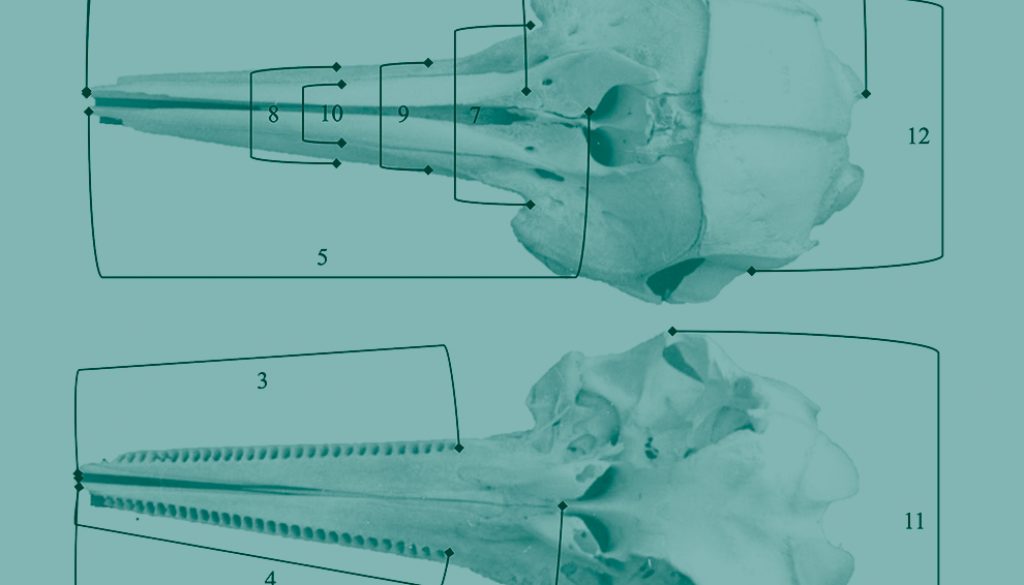
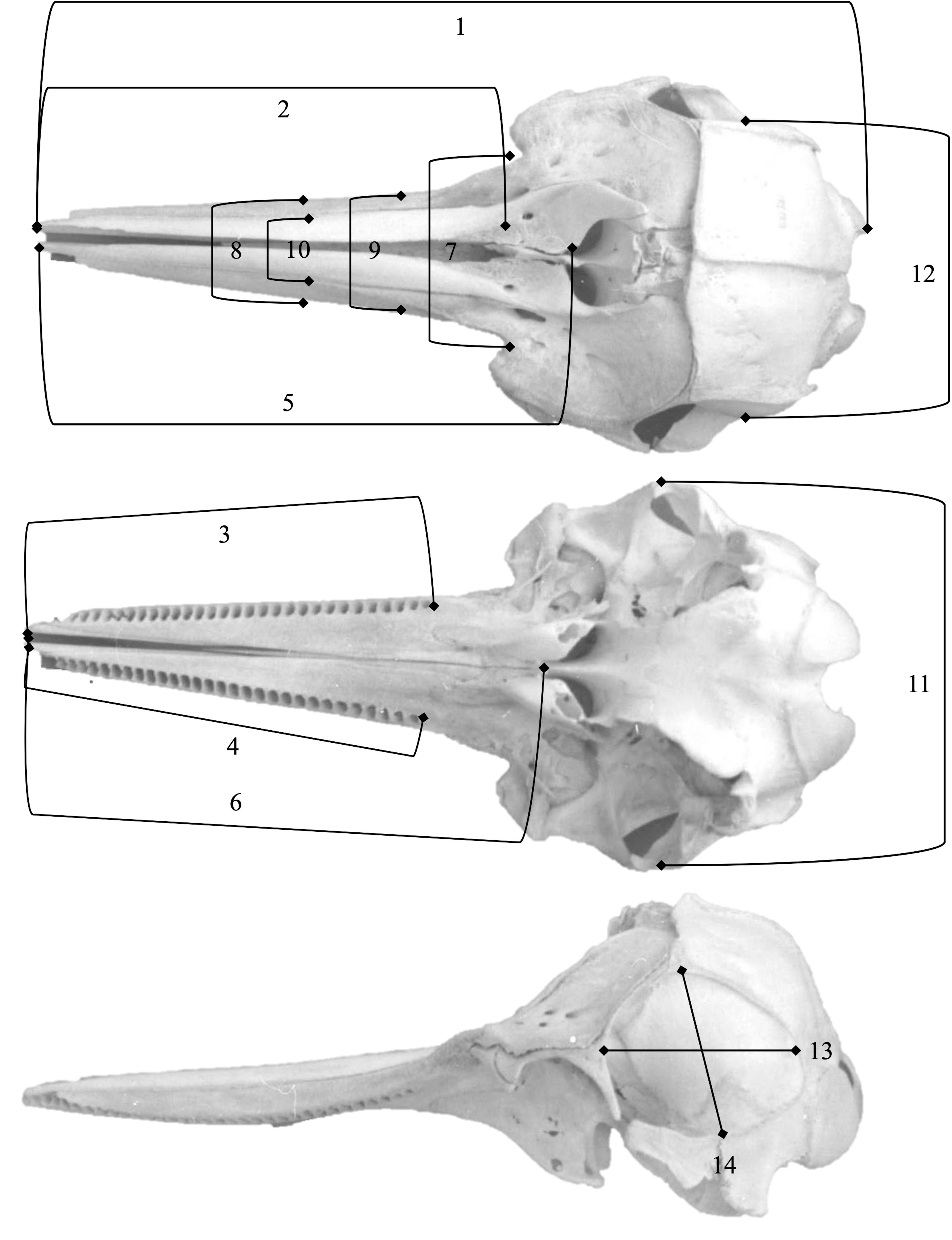
Este estudio se realizó en un total de 20 cráneos, empleando 14 medidas craneanas en milímetros (mm), más el conteo de alvéolos dentarios. La caracterización craneométrica sigue los criterios de medición lineal publicados por Perrin (1975) y Perrin et al. (1987) (fig. 2).
Para confirmar la correcta identificación de la especie y cuantificar la variabilidad entre individuos, se utilizaron como evaluadores taxonómicos: 1) los índices morfológicos [facial (LR/ARB), cefálico (LR/ACAZ) y craneal (LCB/ACAZ)] más el recuento del número de alveolos dentarios en los hemimaxilares superiores derecho e izquierdo, siguiendo a Jefferson y van Waerebeek (2002). El uso de índices o coeficientes se emplea desde hace mucho tiempo en la identificación de diferentes especies de cetáceos odontocetos y permiten medir la variación entre especies de un mismo género (Perrin, 1975; Murphy et al., 2006; Westgate, 2007). Además, son un instrumento útil cuando se trata de muestras pequeñas y como referencia para personas con poca experiencia en la medición craneométrica (Wang et al., 2000). En particular, los índices que incluyen la longitud del rostro y la longitud condilobasal proporcionan una clara separación entre las poblaciones y las especies afines (Banks y Brownell, 1969). Como referencia diagnóstica, los valores calculados fueron comparados con los promedios obtenidos a partir de los datos publicados para las poblaciones de delfín manchado en el Caribe (Perrin et al., 1987) y 2) la “regla del 75%”, a fin de probar de manera concluyente si las diferencias en la media de algunas variables por sí solas son suficientes para apoyar la asignación de una población a un taxón diferente. La separación entre la población A y B ocurre, si, y solo si, ≥ 75% de la población A se distancia de todos los miembros (99+%) de la población B superpuesta para la característica o conjunto de características consideradas (Amadon, 1949; Patten y Unitt, 2002). Los diagramas de cajas y bigotes son especialmente útiles para ilustrar la “regla del 75%”.
Todos los datos se utilizaron para el cálculo de estadística básica (promedio, desviación estándar, mínimo y máximo, coeficiente de variación) independientemente del sexo (solo 2 cráneos eran de sexo conocido y no existen evidencias que demuestren que la muestra estaba sesgada en este sentido). Para determinar si existen diferencias estadísticamente significativas entre los índices morfológicos, se empleó la prueba de Kruskal-Wallis con un nivel de significancia de (p ≤ 0.05). Cada una de las medidas craneanas fue examinada individualmente mediante la prueba U de Wilcoxon-Mann-Whitney con un nivel de significancia de (p ≤ 0.05) debido a que los datos no seguían una distribución normal. Las asociaciones entre las medidas craneanas dentro de cada una de las localidades examinadas se compararon utilizando el coeficiente de correlación (van Belle et al., 2004). Se consideró que los coeficientes > 0.7 tenían una fuerte correlación positiva y que los coeficientes < -0.7 tenían un fuerte coeficiente negativo. Para modelar las posibles diferencias entre las muestras, se analizaron mediante regresión lineal las medidas de longitud frente a (vs.) las medidas de anchura a partir de los pares craneanos combinados que presentaron una correlación > 0.7. Como herramienta descriptiva exploratoria se realizó un análisis de componentes principales (ACP) para determinar los patrones de variación morfométrica entre localidades, así como para identificar la combinación de variables que mejor separan las muestras de cráneo. El primer componente principal del ACP suele considerarse como un eje de tamaño general, mientras que los restantes componentes principales representan el espacio de forma (Palacio et al., 2020). Con el fin de reconocer las relaciones o grado de similitud entre todos los cráneos analizados se generó un análisis de agrupamiento utilizando la distancia euclidiana ajustada con su respectivo dendrograma a través del grupo de pares no ponderados con media aritmética (UPGMA). Para medir el grado en que el dendrograma representa los valores de similitud se emplea el coeficiente de correlación cofenética. Empíricamente se acepta que valores ≥ 0.8 representan mayor robustez en la disimilitud entre las observaciones (Palacio et al., 2020). En este estudio se consideró que valores ≥ 0.6 indican una buena representación por parte del dendrograma. Los gráficos se obtuvieron empleando el programa PAST 4.0 (Hammer et al., 2001).
Resultados
En la tabla 1 se resume la estadística descriptiva de las variables craneales analizadas en este estudio y calculada a partir de los datos publicados por Acevedo y Briceño (2004) y Cañizales y Alvarado (2013). Un 78.57% de las variables de S. frontalis (occidente) presenta valores medios inferiores a los de S. frontalis (oriente). El 50.00% (7) directamente asociadas a la función de alimentación. Por el contrario, 21.43% de las variables presenta valores medios mayores. La variable con mayor porcentaje de variación entre grupos fue ACP = 28.00%.
Los valores obtenidos de los índices facial, cefálico y craneal de S. frontalis (occidente) fueron de 2.44 a 3.18 (2.77 ± 0.24), 1.19 a 1.48 (1.32 ± 0.09) y 2.08 a 2.33 (2.21 ± 0.09). Mientras que para S. frontalis (oriente) estuvieron entre 2.47 a 2.98 (2.63 ± 0.13), 1.29 a 1.54 (1.37 ± 0.08), y 2.23 a 2.51 (2.35 ± 0.08). Estos cocientes muestran una variación entre localidades de 5.12%, 3.46% y 6.07%. En cuanto al número de alvéolos dentarios por cada hemimaxila estos varían entre 21 y 33 con un promedio de 29 en la hilera superior derecha y 31 en la izquierda en S. frontalis (occidente) y entre 29 y 40 con un promedio de 37 por cada hemimaxila en S. frontalis (oriente). Con una diferencia relativa entre localidades en sus valores promedios para esta característica de entre 16.22% y 21.62%. Los individuos de occidente muestran un número de alvéolos promedio menor a la media de las poblaciones en el Caribe de 36.6. Los diagramas correspondientes con los índices facial, cefálico y craneal no muestran diferenciación entre S. frontalis (occidente) y S. frontalis (oriente) (fig. 3). Los “bordes de caja” representan los cuartiles y por lo tanto 75% de la muestra está a la derecha del borde de caja más a la izquierda, y viceversa. Los “bigotes” representan el máximo y el mínimo de la muestra. En todos los casos, las cajas se superponen en mayor o menor grado con el borde más cercano de la caja más cercana, que es ≤ 75%. Adicionalmente, entre localidades, los índices facial y cefálico no mostraron diferencia significativa (Kruskal-Wallis, H = 2.316, p = 0.128; H = 1.576, p = 0.209), en contraste el índice craneal muestra diferencia estadísticamente significativa (Kruskal-Wallis, H = 8.575, p = 0.003).
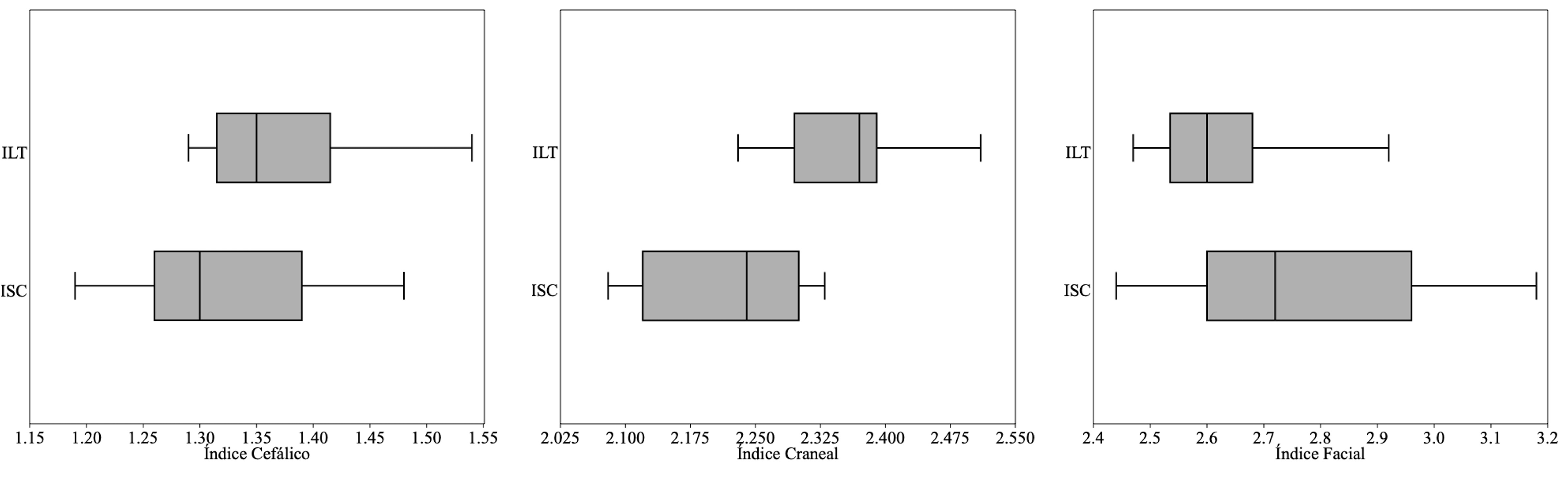
Tabla 1
Estadística descriptiva de S. frontalis. Mann-Whitney (p ≤ 0.05**). Para las siglas, ver Materiales y métodos. DE = Desviación estándar, CV = coeficiente de variación, U = Mann-Whitney. p = Nivel de significancia. Negritas = baja variación.
| Variable | Stenella frontalis
Cañizales y Alvarado (2013) |
Stenella frontalis
Acevedo y Briceño (2004) |
U | p | ||||
| Promedio ± DE | mínimo – máximo
(tamaño muestra) |
CV | Promedio ± DE | mínimo – máximo
(tamaño muestra) |
CV | |||
| LCB | 370.73±15.47 | 344-390 (11) | 0.042 | 395.33±29.05 | 360-439 (9) | 0.073 | 22 | 0.04** |
| LR | 221.91±14.59 | 200-244 (11) | 0.066 | 230.67±24.36 | 200-269 (9) | 0.106 | 37 | 0.34 |
| LSDSD | 179.55±16.80 | 139-190 (11) | 0.094 | 196.22±20.30 | 170-230 (9) | 0.104 | 27 | 0.09 |
| LSDSI | 183.70±8.30 | 167-191 (10) | 0.045 | 195.67±19.87 | 170-229 (9) | 0.102 | 26 | 0.13 |
| DERBAON | 247.64±16.57 | 212-264 (11) | 0.067 | 267.67±26.68 | 233-310 (9) | 0.100 | 25 | 0.07 |
| DERBP | 240.67±33.31 | 180-273 (9) | 0.138 | 273.33±27.85 | 233-316 (9) | 0.102 | 19 | 0.06 |
| ARB | 80.27±3.44 | 72-84 (11) | 0.043 | 87.40±6.83 | 76-97 (10) | 0.078 | 25 | 0.06 |
| ARML | 48.18±3.37 | 40-53 (11) | 0.070 | 51.90±4.23 | 47-58 (10) | 0.082 | 23 | 0.04** |
| AR¾L | 40.71±2.69 | 37-45 (7) | 0.066 | 40.10±3.98 | 35-47 (10) | 0.099 | 29 | 0.83 |
| AMPM | 61.36±1.86 | 58-64 (11) | 0.030 | 72.50±3.98 | 68-78 (10) | 0.055 | 0 | 0.00** |
| ACAZ | 167.64±3.07 | 165-173 (11) | 0.018 | 166.80±10.83 | 152-179 (10) | 0.065 | 35 | 0.27 |
| ACP | 129.45±3.53 | 121-135 (11) | 0.027 | 179.80±12.88 | 162-193 (10) | 0.072 | 0 | 0.00** |
| LFT | 85.64±5.14 | 78-98 (11) | 0.060 | 70.30±5.19 | 62-79 (10) | 0.074 | 1 | 0.00** |
| AFT | 65.82±2.86 | 61-69 (11) | 0.043 | 54.20±7.50 | 42-70 (10) | 0.138 | 11 | 0.00** |
| ADSD | 29 | 21-33 (11) | 37 | 32-40 (9) | ||||
| ADSI | 31 | 24-33 (10) | 37 | 29-41 (9) |
La variación individual, expresada por los coeficientes de variación, fueron relativamente bajos en la mayoría de las variables en ambas localidades. Las variables que mostraron valores relativamente altos (≥ 10%) fueron DERBP en S. frontalis (occidente), y LR, LSDSD, LSDSI, DERBAON, DERBP y AFT en S. frontalis (oriente) (tabla 1). La prueba U de Mann-Whitney determinó que 6 de las 14 las variables craneanas (42.86%) son significativamente diferentes. Las variables fueron LCB, ARML, AMPM, ACP, LFT y AFT (tabla 1). A partir de las 14 variables morfométricas utilizadas en este estudio, se generaron 91 pares de medidas craneanas correlacionadas de forma positiva o negativa. En S. frontalis (occidente), 13 de los 91 pares (14.29%) de medidas craneanas están fuertemente correlacionados (tabla 2). En S. frontalis (oriente), el número de pares de medidas craneanas fuertemente correlacionados es mayor, 63 de los 91 (69.23%) (tabla 3). Al combinar los valores de S. frontalis (occidente y oriente), se obtienen 24 de los 91 pares (26.37%) de medidas craneanas fuertemente correlacionados (tabla 4).
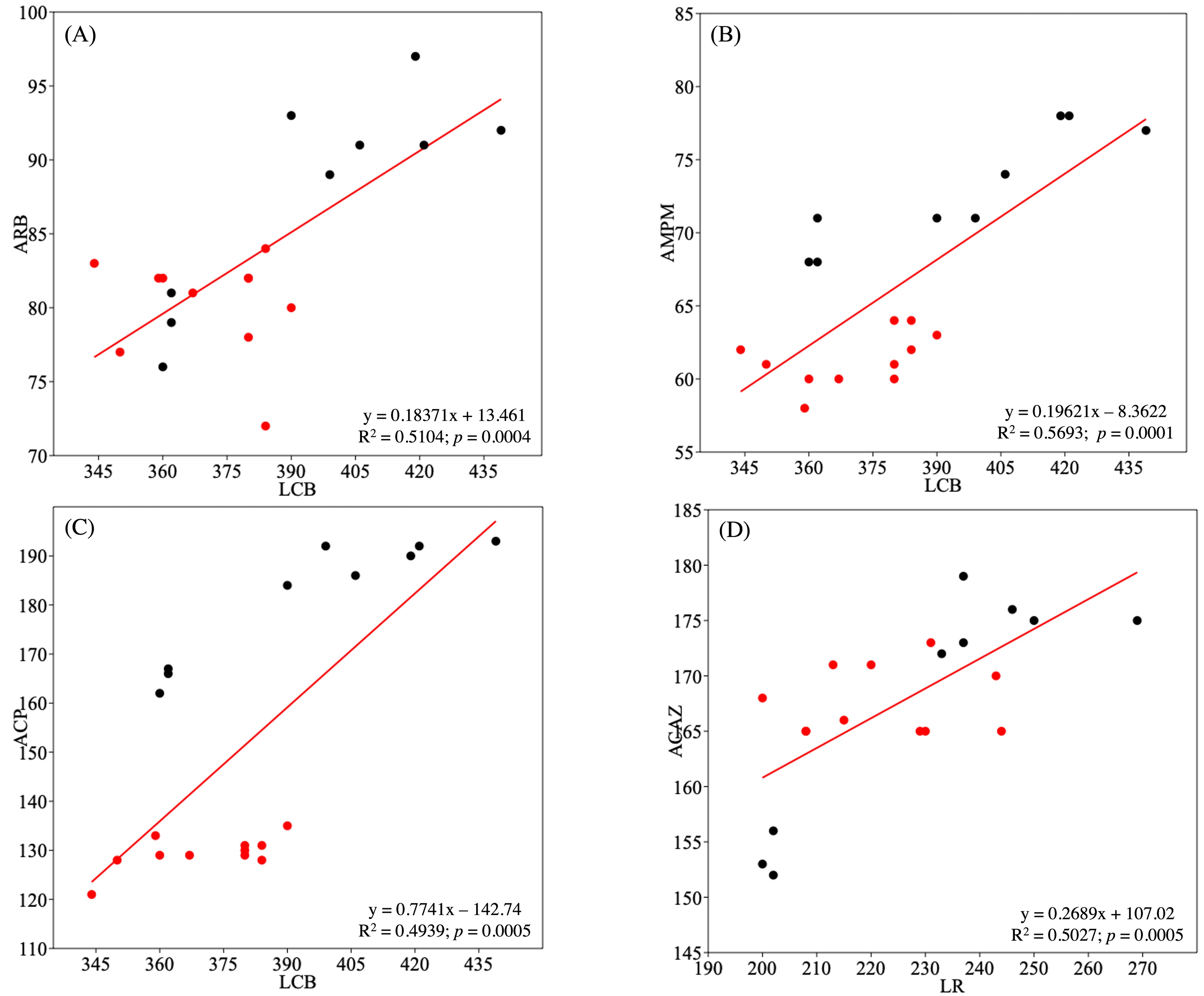
Los gráficos de dispersión presentan una distribución heterogénea de los puntos de diferente intensidad, mostrando cierta relación positiva entre las variables. Cuando se dibujan las líneas de tendencia de LCB vs. ARB, LCB vs. AMPM y LR vs. ACAZ, muestran una pendiente, aunque ascendente positiva, débil. Los coeficientes de determinación (R2), varían de 0.4939 (C) a 0.5693 (B). Es decir, que el modelo lineal explica entre el 49 y el 56% de la variación de los pares de datos. Aunque en todos los casos la relación entre variables se considera moderada, las medidas de longitud se correlacionan significativamente con las medidas de anchura (p < 0.05) (fig. 4).
El ACP dio como resultado el cálculo de 14 variables de S. frontalis (occidente y oriente) (fig. 5). El porcentaje de la variación total que mejor explica los resultados se concentra en los tres primeros componentes (95.14%). El CP1 (componente de tamaño), aunque explica 78.37% de la variación total, presenta coeficientes positivos ≤ 0.5 en 12 de las 14 variables, el valor más alto (0.527) es DERBP. Las 2 medidas relacionadas con la fosa temporal tienen una asociación negativa con este componente. En general los especímenes del grupo oriente tienden a tener cráneos más grandes, mientras que los de la localidad occidente exhiben dimensiones más pequeñas. El CP2 explica 12.13% y suele interpretarse como un componente de forma, sugerido por los coeficientes positivos y negativos. Este componente fue influenciado por LFT, AFT y DERP. El PC3 también un componente de forma explica 4.64% y fue influenciado por LR, LSDSI y ACAZ.
Tabla 2
Correlación de medidas craneanas de S. frontalis (occidente n = 11). Negritas = fuerte correlación positiva. Para las siglas, ver Materiales y métodos.
| Variable | LCB | LR | LSDSD | LSDSI | DERBAON | DERBP | ARB | ARML | AR¾L | AMPM | ACAZ | ACP | LFT | AFT |
| LCB | 1 | |||||||||||||
| LR | 0.63 | 1 | ||||||||||||
| LSDSD | 0.63 | 0.49 | 1 | |||||||||||
| LSDSI | 0.48 | 0.71 | 0.82 | 1 | ||||||||||
| DERBAON | 0.90 | 0.63 | 0.82 | 0.75 | 1 | |||||||||
| DERBP | 0.80 | 0.77 | 0.93 | 0.93 | 0.92 | 1 | ||||||||
| ARB | -0.19 | -0.21 | -0.30 | -0.31 | -0.19 | -0.33 | 1 | |||||||
| ARML | -0.14 | -0.25 | -0.34 | -0.41 | -0.41 | -0.24 | -0.14 | 1 | ||||||
| AR¾L | 0.54 | 0.49 | -0.11 | -0.04 | 0.31 | 0.46 | 0.38 | 0.58 | 1 | |||||
| AMPM | 0.46 | -0.07 | 0.44 | 0.30 | 0.32 | 0.46 | -0.30 | 0.29 | 0.21 | 1 | ||||
| ACAZ | 0.26 | 0.09 | -0.16 | -0.15 | 0.10 | 0.15 | 0.27 | 0.14 | 0.71 | -0.18 | 1 | |||
| ACP | 0.63 | 0.26 | 0.17 | -0.27 | 0.61 | 0.45 | 0.03 | -0.07 | 0.79 | -0.09 | 0.60 | 1 | ||
| LFT | 0.22 | 0.08 | 0.21 | 0.27 | 0.22 | 0.53 | -0.08 | 0.32 | 0.72 | 0.23 | 0.54 | 0.36 | 1 | |
| AFT | -0.01 | 0.40 | 0.22 | 0.61 | 0.01 | 0.35 | -0.52 | -0.03 | -0.06 | -0.06 | 0.26 | -0.18 | 0.42 | 1 |
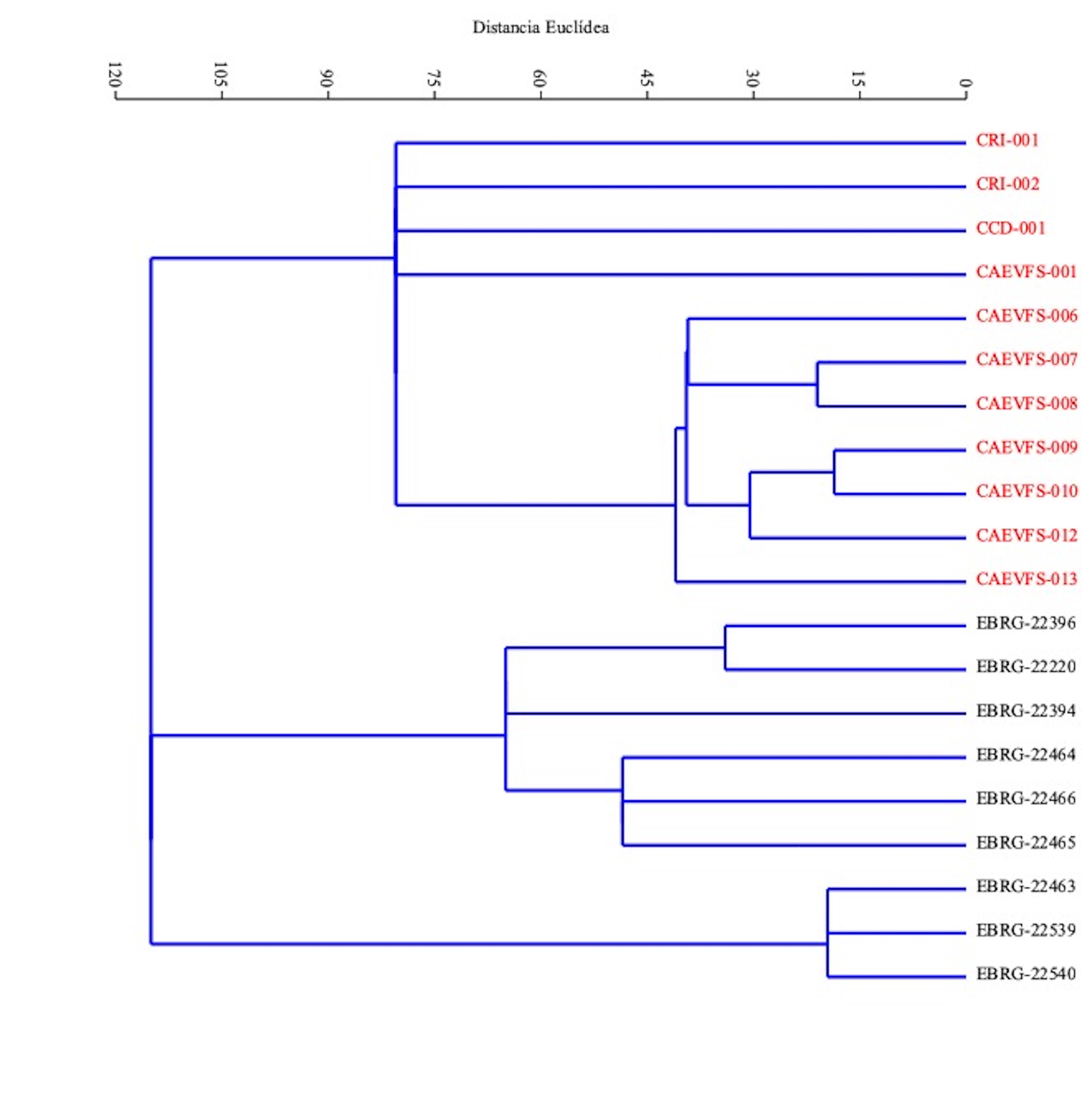
En el análisis de conglomerados se consideraron todas las variables craneanas de 20 individuos identificados como S. frontalis. En primer lugar, se reconocen 3 grupos con un coeficiente de correlación cofenética de 0.58. Seguido de un primer subgrupo (correlación cofenética 0.48) compuesto por 2 subconjuntos formados por especímenes de la región occidental y un segundo y tercer subgrupo (correlación cofenética 0.79) compuestos por individuos de la región oriental. En el primer grupo se muestran 4 individuos como los más divergentes del grupo occidente (fig. 6).
Tabla 2
Correlación de medidas craneanas de S. frontalis (occidente n = 11). Negritas = fuerte correlación positiva. Para las siglas, ver Materiales y métodos.
| Variable | LCB | LR | LSDSD | LSDSI | DERBAON | DERBP | ARB | ARML | AR¾L | AMPM | ACAZ | ACP | LFT | AFT |
| LCB | 1 | |||||||||||||
| LR | 0.63 | 1 | ||||||||||||
| LSDSD | 0.63 | 0.49 | 1 | |||||||||||
| LSDSI | 0.48 | 0.71 | 0.82 | 1 | ||||||||||
| DERBAON | 0.90 | 0.63 | 0.82 | 0.75 | 1 | |||||||||
| DERBP | 0.80 | 0.77 | 0.93 | 0.93 | 0.92 | 1 | ||||||||
| ARB | -0.19 | -0.21 | -0.30 | -0.31 | -0.19 | -0.33 | 1 | |||||||
| ARML | -0.14 | -0.25 | -0.34 | -0.41 | -0.41 | -0.24 | -0.14 | 1 | ||||||
| AR¾L | 0.54 | 0.49 | -0.11 | -0.04 | 0.31 | 0.46 | 0.38 | 0.58 | 1 | |||||
| AMPM | 0.46 | -0.07 | 0.44 | 0.30 | 0.32 | 0.46 | -0.30 | 0.29 | 0.21 | 1 | ||||
| ACAZ | 0.26 | 0.09 | -0.16 | -0.15 | 0.10 | 0.15 | 0.27 | 0.14 | 0.71 | -0.18 | 1 | |||
| ACP | 0.63 | 0.26 | 0.17 | -0.27 | 0.61 | 0.45 | 0.03 | -0.07 | 0.79 | -0.09 | 0.60 | 1 | ||
| LFT | 0.22 | 0.08 | 0.21 | 0.27 | 0.22 | 0.53 | -0.08 | 0.32 | 0.72 | 0.23 | 0.54 | 0.36 | 1 | |
| AFT | -0.01 | 0.40 | 0.22 | 0.61 | 0.01 | 0.35 | -0.52 | -0.03 | -0.06 | -0.06 | 0.26 | -0.18 | 0.42 | 1 |
Tabla 3
Correlación de medidas craneanas de S. frontalis (oriente n = 10). Negritas = fuerte correlación positiva. Para las siglas, ver Materiales y métodos.
| Variable | LCB | LR | LSDSD | LSDSI | DERBAON | DERBP | ARB | ARML | AR¾L | AMPM | ACAZ | ACP | LFT | AFT |
| LCB | 1 | |||||||||||||
| LR | 0.99 | 1 | ||||||||||||
| LSDSD | 0.99 | 0.99 | 1 | |||||||||||
| LSDSI | 0.99 | 0.99 | 1.00 | 1 | ||||||||||
| DERBAON | 0.99 | 0.99 | 0.99 | 0.98 | 1 | |||||||||
| DERBP | 0.98 | 0.98 | 0.99 | 0.99 | 0.97 | 1 | ||||||||
| ARB | 0.86 | 0.88 | 0.83 | 0.82 | 0.85 | 0.86 | 1 | |||||||
| ARML | 0.93 | 0.91 | 0.90 | 0.90 | 0.93 | 0.89 | 0.80 | 1 | ||||||
| AR¾L | 0.71 | 0.69 | 0.68 | 0.65 | 0.74 | 0.65 | 0.72 | 0.89 | 1 | |||||
| AMPM | 0.91 | 0.86 | 0.87 | 0.85 | 0.92 | 0.86 | 0.78 | 0.85 | 0.74 | 1 | ||||
| ACAZ | 0.87 | 0.89 | 0.85 | 0.85 | 0.85 | 0.85 | 0.90 | 0.81 | 0.68 | 0.73 | 1 | |||
| ACP | 0.93 | 0.94 | 0.90 | 0.90 | 0.90 | 0.90 | 0.91 | 0.85 | 0.67 | 0.79 | 0.99 | 1 | ||
| LFT | 0.62 | 0.67 | 0.61 | 0.60 | 0.63 | 0.64 | 0.82 | 0.55 | 0.59 | 0.59 | 0.81 | 0.75 | 1 | |
| AFT | 0.63 | 0.60 | 0.63 | 0.65 | 0.55 | 0.62 | 0.49 | 0.42 | 0.08 | 0.48 | 0.64 | 0.69 | 0.28 | 1 |
Tabla 4. Correlación de medidas craneanas de S. frontalis (n = 21). Negritas = fuerte correlación positiva. Para las siglas, ver Materiales y métodos.
| Variable | LCB | LR | LSDSD | LSDSI | DERBAON | DERBP | ARB | ARML | AR¾L | AMPM | ACAZ | ACP | LFT | AFT |
| LCB | 1 | |||||||||||||
| LR | 0.86 | 1 | ||||||||||||
| LSDSD | 0.87 | 0.79 | 1 | |||||||||||
| LSDSI | 0.91 | 0.90 | 0.93 | 1 | ||||||||||
| DERBAON | 0.97 | 0.86 | 0.93 | 0.95 | 1 | |||||||||
| DERBP | 0.89 | 0.82 | 0.96 | 0.93 | 0.93 | 1 | ||||||||
| ARB | 0.71 | 0.60 | 0.57 | 0.68 | 0.67 | 0.55 | 1 | |||||||
| ARML | 0.66 | 0.50 | 0.48 | 0.60 | 0.53 | 0.47 | 0.63 | 1 | ||||||
| AR¾L | 0.59 | 0.64 | 0.54 | 0.51 | 0.61 | 0.55 | 0.51 | 0.64 | 1 | |||||
| AMPM | 0.75 | 0.47 | 0.67 | 0.66 | 0.69 | 0.69 | 0.72 | 0.71 | 0.27 | 1 | ||||
| ACAZ | 0.67 | 0.71 | 0.52 | 0.67 | 0.62 | 0.48 | 0.66 | 0.52 | 0.66 | 0.28 | 1 | |||
| ACP | 0.70 | 0.45 | 0.59 | 0.60 | 0.64 | 0.65 | 0.75 | 0.65 | 0.18 | 0.94 | 0.31 | 1 | ||
| LFT | -0.20 | 0.03 | -0.16 | -0.10 | -0.15 | -0.18 | -0.28 | -0.23 | 0.33 | -0.64 | 0.34 | -0.70 | 1 | |
| AFT | -0.06 | 0.20 | -0.01 | 0.14 | -0.05 | -0.08 | -0.25 | -0.21 | 0.07 | -0.53 | 0.40 | -0.56 | 0.71 | 1 |

Discusión
En este estudio, el grupo de datos analizados proceden de cráneos de animales varados o capturados de manera incidental y que fueron identificados y confirmados por el análisis craneométrico como S. frontalis por Acevedo y Briceño (2004) y Cañizales y Alvarado (2013), siguiendo los criterios de Perrin et al. (1987). Con una media de 1.32 y 2.77 para los individuos del grupo occidente y de 1.37 y 2.63 para el grupo oriente, los índices cefálico y craneal de los individuos en este estudio son similares a la media de las poblaciones en el Caribe de 1.30 y 2.21 respectivamente. Sin embargo, el índice facial fue notoriamente inferior al promedio caribeño de 4.64.
Los resultados de este estudio constituyen el primer reporte, empleando datos morfométricos, que muestran evidencias de la presencia de 2 grupos de S. frontalis frente a la costa de Venezuela. En esta especie, Méndez-Fernández et al. (2020), empleando como marcadores ecológicos isótopos estables 13C y 15N y contaminantes orgánicos persistentes, proponen al menos 2 morfotipos al este y oeste del Oceáno Atlántico, y sugieren evaluar las poblaciones de la costa atlántica de Centro y Sudamérica para determinar la existencia o no de 1 o 2 grupos. Adicionalmente, Barragán-Barrera et al. (2019) sugieren que las condiciones ambientales asociadas a los hábitats costeros, como la temperatura y la profundidad del agua, así como a los desplazamientos restringidos de la especie en este tipo de hábitat, tanto en el norte como en el sur del océano Atlántico, podrían impulsar la diferenciación de esta especie.
Los resultados de la tabla 1 muestran que la longitud condilobasal de S. frontalis fluctúa entre 344 y 439 mm, con una variación en el número de dientes por hilera entre grupos de 6 a 8, y 11 como máximo. Perrin (1975) y Perrin et al. (1987) señalan para la variable LCB 356 mm como mínima y 461 mm como talla máxima para la especie; al comparar los valores promedio de los demás parámetros, aunque con variaciones, se encuentran dentro del rango descrito para la especie. Sin embargo, y a pesar de un tamaño de muestra relativamente bajo, los resultados entre grupos presentan diferencias significativas. Las variables LCB, ARML, AMPM y ACP del grupo occidente son 6.22%, 7.16%, 15.36% y 28.00% de menor talla que en el grupo oriente, pero presentan una fosa temporal de mayor tamaño incluso comparado con los especímenes descritos para el Caribe (Cañizales y Alvarado, 2013; Perrin et al., 1987). Los cráneos de ambas localidades mostraron una variación relativamente alta, expresada por los coeficientes de variación (CV) en algunas mediciones craneales. Esto sugiere que los cambios en las dimensiones de una parte del cráneo se reflejan uniformemente en otras partes del cráneo. Conocer esto podría ser útil en la determinación de los parámetros craneales si solo están disponibles cráneos rotos o incompletos. En estudios morfométricos anteriores también se ha informado de altos CV (Perrin, 1975; Perrin et al., 1987).
Aunque las variables estudiadas forman parte de un todo integral, la evidencia no nos permite afirmar que esta es la forma auténtica de relación, pero sí nos permite entender esta relación. Las diferencias encontradas pueden deberse a factores biológicos y ambientales, incluidos los errores de medición. Por lo tanto, es razonable tener un incremento de los valores en las variables de cráneos más grandes; esto es más evidente en los puntos que representan S. frontalis (oriente). Aunque algunos puntos se encuentran ligeramente fuera de la línea, los valores medios en todos los especímenes de S. frontalis (occidente) son inferiores a los de S. frontalis (oriente).
Se observaron diferencias significativas tanto en el tamaño como en la forma del cráneo entre los grupos. Los cráneos del grupo oriente fueron más grandes, con un cráneo más amplio, y un rostro más amplio y proporcionalmente más largo en comparación a los cráneos del grupo occidente. Sin embargo, se debe mencionar que en ausencia de información adicional que confirme, niegue o complemente nuestros resultados, como la que proporcionaría la morfometría geométrica, los datos genéticos, conocer el sexo de los ejemplares estudiados o disponer de un tamaño de muestra mayor, estos se consideran como característicos. Por otra parte, el cráneo de los mamíferos son estructuras muy informativas, alberga tanto estructuras altamente conservadoras, como la caja craneana o cerebral, y caracteres adaptables, como la mandíbula, el paladar o los dientes y, por lo tanto, representan una poderosa herramienta para las investigaciones biogeográficas, filogenéticas y sistemáticas, especialmente en ausencia de investigaciones moleculares (Loy, 2007).
En el ACP los cráneos de oriente aparecen relativamente más robustos. La fosa temporal no muestra esta tendencia; las medidas de longitud y anchura de esta estructura son considerablemente menores en los cráneos de oriente. Esto ocurre de forma similar en poblaciones de S. attenuata de distintas regiones geográficas (Perrin et al., 1979). Por otro lado, se ha señalado que los machos de S. frontalis poseen una bóveda craneana más grande, un rostro más corto y ancho, una fosa temporal de mayores dimensiones y un diámetro alveolar de mayor talla (Perrin, 1975).
Ahora bien, la morfología craneal en cetáceos odontocetos refleja las diferencias entre localidades y cómo estas se ven afectadas por diferentes factores ambientales como la temperatura, la disponibilidad de presas o las estrategias de alimentación (Bell et al., 2002, Đuras et al., 2014). Las variaciones craneales se han encontrado sobre todo en los caracteres que se asocian con la alimentación, como el número y el tamaño de los dientes, la longitud y la anchura del rostro y el tamaño de la fosa temporal (Perrin, 2009). Perrin (1975) señala, por ejemplo, que la existencia de diferencias significativas en las dimensiones del rostro entre poblaciones costeras y pelágicas para S. longirostris sugiere que un aparato de alimentación más corto y robusto sería ventajoso cuando se persiguen grandes presas en aguas poco profundas, que viven cerca del fondo o demersales, mientras que un aparato de alimentación más amplio y largo podría ser ventajoso para atrapar presas pelágicas de movimiento rápido. En este sentido, y como fue reportado por Cañizales y Alvarado (2013) el grupo occidente se alimenta con presas más grandes que la forma pelágica, como la lisa blanca o lisa criolla (Mugil curema Valenciennes, 1836) que alcanza un tamaño máximo normal de unos 30 cm y que viven en el mar a poca profundidad en fondos arenosos o asociados a arrecifes (Harrison, 1995).
Según Klinowska (1991), los delfines manchados caribeños en promedio tienen un rostro más delgado, fosa temporal pequeña y dientes más pequeños que los animales costeros. Estas variaciones en las dimensiones del rostro y de la fosa temporal también se han registrado en la forma costera del delfín mular o nariz de botella T. truncatus en aguas de California (Perrin et al., 2011). De forma similar, Cañizales y Alvarado (2013) reportan que el grupo occidente corresponde a la forma costera con un rostro ancho, un triángulo prenarial corto, dientes grandes y menos numerosos y una fosa temporal de mayor dimensión.
Perrin et al. (1987) indican que los cráneos de S. frontalis provenientes de diversas regiones del Caribe, incluyendo individuos de Venezuela, son más pequeños que los del Atlántico norte; dentro de los especímenes caribeños existe variación entre los animales costeros y los pelágicos. A su vez, Acevedo y Briceño (2004) señalan que los cráneos analizados por ellos (oriente), son más cortos, de rostros más anchos en comparación con lo publicado por Perrin et al. (1987). Sin embargo, las diferencias porcentuales calculadas en las variables LCB, LR, ARB y AFT son de apenas 0.74%, 1.34%, 1.75% y 0.55% respectivamente, lo que permite sugerir que con base en el conjunto de estos resultados este grupo puede pertenecer a la forma caribeña.
Finalmente, nuestro análisis de la morfología craneal reveló diferencias entre los animales de occidente y oriente; este hallazgo, sumado a las características morfométricas craneales resumidas en publicaciones anteriores, proporciona un apoyo adicional para el reconocimiento e identificación de delfines manchados de una u otra área.
Agradecimientos
Los comentarios de los revisores anónimos y el soporte editorial ayudaron a mejorar la versión final del manuscrito. Este trabajo no recibió apoyo financiero ni subsidios de ningún organismo o agencia pública o privada.
Referencias
Acevedo, R. y Briceño, J. M. (2004). Morfología craneal de un grupo de delfines moteados del Atlántico (Stenella frontalis) varados en la isla La Tortuga, Venezuela. Acta Biologica Venezuelica, 24, 49–61.
Agudo, A. I. (1991). Criterios de clasificación vernácula en cetáceos. Parte I. Caza y Pesca Náutica Internacional, 338, 42–45.
Agudo, A. I. (1992). Clave ilustrada para identificar delfines típicos de Venezuela y el Caribe. Caza y Pesca Internacional, 341, 64–65.
Agudo, A. I., Viloria, A. L., Coty, J. R. y Acosta, R. J. (1994). Cetofauna (Mammalia: Cetacea) del Estado Zulia, Venezuela. Nor-occidental. Anartia, 5, 1–23.
Alvarado, M., Kaffoussias, A., Rangel, A., Ostos, L., Vidal O., A. y Villasmil Y. (1995). Stenella (sic) frontalis, Tursiops truncatus y Sotalia fluviatilis en el golfo de Venezuela y el estrecho del lago de Maracaibo. En Libro de Resúmenes III Congreso Latinoamericano de Ecología (pp. 22–28; octubre 1995). Facultad de Ciencias, Universidad de Los Andes, Mérida, Venezuela.
Amadon, D. (1949). The seventy-five per-cent rule for subspecies. The Condor, 51, 250–258. https://doi.org/10.2307/1364805
Amaral, A. R., Coelho, M. M., Marugán-Lobón, J. y Rohlf, F. J. (2009). Cranial shape differentiation in three closely related delphinid cetacean species: Insights into evolutionary history. Zoology, 112, 38–47. https://doi.org/10.1016/j.zool.2008.03.001
Baker, A. N., Smith, A. N. H. y Pichler, F. B. (2002). Geographical variation in Hector’s dolphin: Recognition of new subspecies of Cephalorhynchus hectori. Journal of the Royal Society of New Zealand, 32, 713–727. https://doi.org/10.1080/03014223.2002.9517717
Banks, R. C. y Brownell, R. L. (1969). Taxonomy of the Common Dolphins of the Eastern Pacific Ocean. Journal of Mammalogy, 50, 262–271. https://doi.org/10.2307/1378342
Barragán-Barrera, D. C., do Amaral, K. B., Chávez-Carreño, P. A., Farías-Curtidor, N., Lancheros-Neva R., Botero-Acosta N. et al. (2019). Ecological niche modeling of three species of Stenella Dolphins in the Caribbean Basin, with application to the Seaflower Biosphere Reserve. Frontiers in Marine Science, 6. https://doi.org/10.3389/fmars.2019.00010
Barrios, H. A. y León, T. C. (2000). Primer registro del delfín listado, Stenella coeruleoalba (Meyen, 1833) (Cetacea: Delphinidae) en el golfo de Venezuela. Anartia, 9, 1–7.
Bell, C. H., Kemper, C. M. y Conran, J. G. (2002). Common dolphins Delphinus delphis in Southern Australia: a morphometric study. Australian Mammalogy, 24, 1–10. https://doi.org/10.1071/AM02001
Bolaños, J. y Boher, S. (1996). Cetáceos de Venezuela. Lista actualizada. Natura, 104, 51–53.
Cañizales, I. y Alvarado, M. (2013). Morfometría craneana del delfín manchado del Atlántico, (Stenella frontalis Cuvier, 1829) en el noroeste del estado Zulia, Venezuela. Boletín de la Academia de Ciencias Físicas, Matemáticas y Naturales, 73, 35–50.
Conry, D. S., Pistorius, P. A., Plön, S. y Hofmeyr, G. J. G. (2016). Sexual dimorphism in striped dolphin (Stenella coeruleoalba) crania from South Africa. Marine Mammal Science, 32, 1254–1271. https://doi.org/10.1111/mms.12331
Duras, M., Brnic, D. D., Gomercic, T. y Galov, A. (2014). Craniometry of bottlenose dolphins (Tursiops truncatus) from the Adriatic Sea. Veterinarski Arhiv, 84, 649–666.
Hammer, O., Harper, D. A. T. y Ryan, P. D. (2001). PAST: Paleontological Statistic software package for education and data analysis. Paleontologia Electronica, 4, 1–9. http://palaeo-electronica.org/2001_1/past/issue1_01.htm
Harrison, I. J. (1995). “Mugilidae. Lisas”. En W. Fischer, F. Krupp, W. Schneider, C. Sommer, K. E. Carpenter y V. Niem (Eds.), Guía FAO para identificación de especies para los fines de la pesca. Pacifico Centro-Oriental (pp. 1293–1298). FAO. Roma.
Jefferson, T. A. y van Waerebeek, K. (2002). The taxonomic status of the nominal dolphin species, Delphinus tropicalis van Bree, 1971. Marine Mammal Science, 18, 787–818. https://doi.org/10.1111/j.1748-7692.2002.tb01074.x
Klinowska, M. (1991). Dolphins, porpoises, and whales of the World. The UICN Red Data Book. IUCN. Gland. Switzerland.
Loy, A. (2007). Morphometrics and theriology: homage to Marco Corti. Hystrix. Italian Journal of Mammalogy, 18, 115–136. https://doi.org/10.4404/hystrix-18.2-4398
Loy, A., Tamburelli, A., Carlini, R. y Slice, D. E. (2010). Craniometric variation of some Mediterranean and Atlantic populations of Stenella coeruleoalba (Mammalia, Delphinidae): a 3D geometric morphometrics analysis. Marine Mammal Science, 27, 65–78. https://doi.org/10.1111/j.1748-7692.2010.00431.x
Méndez-Fernández, P., Taniguchi, S., Santos, M. C., Cascão, I., Quérouil, S., Vidal, M. et al. (2020). Population structure of the Atlantic spotted dolphin (Stenella frontalis) inferred through ecological markers. Aquatic Ecology, 54, 21–34. https://doi.org/10.1007/s10452-019-09722-3
Murphy, S., Herman, J. S., Pierce, G. J., Rogan, E. y Kitchener, A. C. (2006). Taxonomic status and geographical cranial variation of common dolphins (Delphinus) in the eastern North Atlantic. Marine Mammal Science, 22, 573–599. https://doi.org/10.1111/j.1748-7692.2006.00037.x
Palacio, F. X., Apodaca, M. J. y Crisci, J. V. (2020). Análisis multivariado para datos biológicos: teoría y su aplicación utilizando el lenguaje R. Ciudad Autónoma de Buenos Aires: Fundación de Historia Natural Félix de Azara/ Vazques Mazzini Editores/ Universidad Maimónides, Argentina.
Patten, M. A y Unitt, P. (2002). Diagnosability versus mean differences of Sage sparrow subspecies. The Auk, 119, 26–35. https://doi.org/10.1093/auk/119.1.26
Perrin, W. F. (1975). Variation of Spotted and Spinner Porpoise (Genus: Stenella) in the Eastern Tropical Pacific and Hawaii. Bulletin of Institute of Oceanography, 21, 1–206.
Perrin, W. F. (1984). Patterns of geographical variation in small cetaceans. Acta Zoológica, 172, 137–140.
Perrin, W. F. (2009). Geographic variation. En W. F. Perrin, B. Würsig y J. G. M. Thewissen (Eds.), Encyclopaedia of marine mammals, 2nd edition (pp. 492–498). Burlington, MA: Academic Press.
Perrin, W. F., Caldwell, D. K. y Caldwell, M.C. (1994). Atlantic spotted dolphin Stenella frontalis (G. Cuvier, 1829). Handbook of Marine Mammals, 5, 173–190.
Perrin, W. F., Mitchell, E. D., Mead, J. G., Caldwell, D. K. y van Bree, P. J. H. (1981). Stenella clymene, a rediscovered tropical dolphin of the Atlantic. Journal of Mammalogy, 62, 583–598. https://doi.org/10.2307/1380405
Perrin, W. F., Mitchell, E. D., Mead, J. G., Caldwell, D. K., Caldwell, M. C., van Bree, P. J. H. et al. (1987). Revision of the spotted dolphins, Stenella spp. Marine Mammal Science, 3, 99–170. https://doi.org/10.1111/j.1748-7692.1987.tb001
58.x
Perrin, W. F., Thieleking, J. L., Walker, W. A., Archer, F. I. y Robertson, K. M. (2011). Common bottlenose dolphins (Tursiops truncatus) in California waters: Cranial differentiation of coastal and offshore ecotypes. Marine Mammal Science, 27, 769–792. https://doi.org/10.1111/j.1748-7692.2010.00442.x
Perrin, W. F., Dolar, M. L. L., Amano, M. y Hayano, A. (2003). Cranial sexual dimorphism and geographic variation in Fraser’s dolphin, Lagenodelphis hosei. Marine Mammal Science, 19, 484–501. https://doi.org/10.1111/j.1748-7692.2003.tb01316.x
Perrin, W. F., Sloan, P. A. y Henderson, J. R. (1979). Taxonomic status of the ‘southwestern stocks’ of spinner dolphins, Stenella longirostris, and spotted dolphin, S. attenuata. Report of the International Whaling Commission, 29, 175–184.
Pinela, A. M., Borrell, A. y Aguilar, A. (2011). Common dolphin morphotypes: Niche segregation or taxonomy? Journal of Zoology, 284, 239–247. https://doi.org/10.1111/j.1469-7998.2011.00798.x
Romero, A., Mayayo, A. y Agudo, I. (1991). Los cetáceos recientes de Venezuela. Memoria de la Sociedad de Ciencias Naturales La Salle, 51, 169–180.
Romero, A., Agudo, I., Green, S. M. y Notarbartolo di Sciara, G. (2001). Cetaceans of Venezuela: their distribution and conservation status. NOAA Technical Report, 151.
Schmidly, D. J., Beleau, M. H. y Hildebran, H. (1972). First record of Cuvier’s dolphin from the Gulf of Mexico with comments on the taxonomic status of Stenella frontalis. Journal of Mammalogy, 53, 625–628. https://doi.org/10.2307/1379060
Schnell, G. D., Douglas, M. E. y Hough, D. J. (1985). Sexual dimorphism in spotted dolphins (Stenella attenuata) in the eastern tropical Pacific Ocean. Marine Mammal Science, 1, 1–14. https://doi.org/10.1111/j.1748-7692.1985.tb00529.x
Schnell, G. D., Douglas, M. E. y Hough, D. J. (1986). Geographic patterns of variation in Offshore spotted dolphins (Stenella attenuata) of the eastern tropical Pacific Ocean. Marine Mammal Science, 2, 186–213. https://doi.org/10.1111/j.1748-7692.1986.tb00040.x
Van Belle, G., Fisher, L. D., Heagerty, P. J. y Lumley, T. (2004). Biostatistics. A methodology for the health sciences. Second edition. Hoboken, New Jersey: John Wiley & Sons.
van Bree, P. J. H. (1971). On skull of Stenella longirostris (Gray, 1828) from Eastern Atlantic. Beaufortia, 19, 99–106.
van Bree, P. J. H. (1975). Preliminary list of the Southern Caribbean. Studies of the Fauna of Curaçao and other Caribbean Islands, 48, 79–87.
Wang, J. Y., Chou, L. S. y White, B. N. (2000). Osteological differences between two sympatric forms of bottlenose dolphins (genus Tursiops) in Chinese waters. Journal of Zoology, 252, 147–162. https://doi.org/10.1111/j.1469-7998.2000.tb00611.x
Westgate, A. J. (2007). Geographic variation in cranial morphology of short-beaked common dolphins (Delphinus delphis) from the North Atlantic. Journal of Mammalogy, 88, 678–688. https://doi.org/10.1644/06-MAMM-A-177R.1
Wilson, D. E. y Reeder, D. M. (Eds.) (2005). Mammal species of the World, 3rd edition. Baltimore, Maryland: Johns Hopkins University Press.