Diana Alejandra Vela-Espinosa a, b, Silvia Díaz-Ruiz c, Andrés López-Pérez c y Omar Valencia-Méndez a, *
a Centro de Investigación Científica y de Educación Superior de Ensenada, Carretera Ensenada-Tijuana #3918, Zona Playitas, 22860 Ensenada, Baja California, México
b Ecosistemas Costeros y Marinos A.C., Ocotillo #206, Sector H, 70989 La Crucecita, Oaxaca, México
c Universidad Autónoma Metropolitana, Departamento de Hidrobiología, Iztapalapa, San Rafael Atlixco #186, Col. Vicentina, 09340 Ciudad de México, México
*Autor para correspondencia: ovalencia@cicese.mx (O. Valencia-Méndez)
Recibido: 11 febrero 2022; aceptado: 5 septiembre 2022
Resumen
El Parque Nacional Huatulco (PNH) protege el último arrecife al sur del Pacífico mexicano, considerado como una piedra angular y reservorio genético de diversas especies marinas. La composición íctica del PNH se determinó mediante una revisión bibliográfica y censos visuales entre 2015 y 2019. Se registraron 196 especies, lo que representa un incremento de 46 especies respecto a estudios previamente conducidos en el parque. La curva de acumulación de especies construida a partir de estimadores no paramétricos sugiere que esto representa 75% de la fauna esperada. En un contexto regional, el PNH posee una riqueza moderadamente alta y una alta diversidad taxonómica. La partición de la diversidad-β entre áreas naturales protegidas (ANP) mostró que el reemplazo de especies es mayor al anidamiento, lo que sugiere que hay un importante recambio íctico entre ANP. El PNH posee un ensamblaje íctico diferente en términos de riqueza y diversidad taxonómica comparada otras ANP, por lo cual se deben de procurar estrategias de mitigación de impactos antrópicos, conservación de áreas núcleo y de amortiguamiento en el ANP, vigilar las áreas de aprovechamiento y generar estrategias de difusión científica con la finalidad de preservar el pool genético.
Palabras clave: Área Natural Protegida; Conanp; Biodiversidad; Pacífico sur mexicano; Conservación
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Composition, taxonomic distinctiveness,
and beta diversity of the marine ichthyofauna
of Huatulco National Park
Abstract
The Huatulco National Park (HNP) protects the last reef in the southern Mexican Pacific, considered a cornerstone and genetic reservoir of diverse marine species. The fish composition of the HNP was determined through a literature review and visual censuses between 2015 and 2019. A total of 196 species were recorded, representing an increase of 46 species over previously conducted studies in the park. The species accumulation curve constructed from non-parametric estimators suggests that this represents 75% of the expected fauna. In a regional context, the HNP has high taxonomic richness and diversity. The partitioning of diversity-β between Natural Protected Areas (NPA) showed that species replacement is higher than nesting, suggesting an important ichthyic turnover between NPA. The PNH has a different ichthyic assemblage in terms of taxonomic richness and diversity compared to other NPA, for which strategies should be pursued to mitigate anthropogenic impacts and conserve core and buffer areas in the NPA, monitor harvesting areas and generate scientific dissemination strategies to preserve the genetic pool.
Keywords: Natural Protected Area; Conanp; Biodiversity; Mexican South Pacific; Conservation
© 2023 Universidad Nacional Autónoma de México, Instituto de Biología. This is an open access article under the CC BY-NC-ND license
Introducción
Las áreas marinas protegidas son el instrumento más eficiente para manejar los recursos y mitigar las perturbaciones antropogénicas en los ecosistemas marinos, principalmente aquellas asociadas a la presión por pesca (Bates et al., 2014; Ramírez-Ortiz et al., 2020). Desde mediados de la década de los ochenta, el gobierno mexicano ha establecido varias áreas naturales protegidas (ANP) para conservar la biodiversidad y controlar la extracción de recursos (Conanp, 2007). Actualmente existen 185 ANP repartidas en 6 categorías de manejo (Áreas de Protección de Flora y Fauna, Áreas de Protección de Recursos Naturales, Monumentos Naturales, Parques Nacionales, Reservas de la Biosfera y Santuarios), que en conjunto protegen un total de 908,395 km2 (Conanp, 2022). Sin embargo, la mayoría de las ANP (~67%) no cuentan con programas de manejo adecuados o carecen de uno, debido a la falta de información sobre la diversidad que albergan y el estado de conservación de los recursos dentro del polígono designado (Galván-Villa, 2010).
El Parque Nacional Huatulco (PNH) fue decretado el 24 de julio de 1998, protege un área terrestre y marina de 118.90 km2 dentro de las que se encuentran ecosistemas complejos que albergan especies amenazadas, endémicas y con alto valor ecológico para su conservación (Conanp, 2003). La porción marina protege un número importante de algas, invertebrados, peces, mamíferos marinos, así como ecosistemas coralinos (Conanp, 2003). Entre los ecosistemas incluidos en el polígono del parque, los arrecifes coralinos se consideran los mejor conservados del Pacífico mexicano (López-Pérez y Hernández-Ballesteros, 2004) debido a que albergan una alta riqueza de especies de corales pétreos (López-Pérez et al., 2008), equinodermos y peces asociados (Juárez-Hernández y Tapia-García, 2018a, b; López-Pérez et al., 2014).
Los inventarios biológicos permiten conocer la composición de especies en un área en particular, pero cuando éstos son realizados dentro de una ANP, generalmente se utilizan métodos no extractivos para minimizar el efecto de muestreo (i.e., censos visuales, CV). Desde la aparición del buceo con fines científicos, el uso de censos visuales en el Pacífico mexicano fue adoptado como un método eficaz para el monitoreo de la biodiversidad bajo las premisas de que es económico, fácil de emplear y no destructivo (Álvarez-Filip et al., 2006; Villarreal-Cavazos et al., 2000). No obstante, se ha documentado que el empleo de CV conlleva problemas en la identificación de especies y, por consiguiente, sesgos en la estimación de la biodiversidad real y en la composición de especies. Para generar datos más precisos y exactos se requiere del uso de técnicas complementarias, especialmente las extractivas, que permitan mejorar la calidad de los inventarios biológicos (Ackerman y Bellwood, 2000; Alzate et al., 2014; Brandl et al., 2018; Brock, 1982; Wolfe et al., 2021).
Los estudios ícticos del PNH se iniciaron con la publicación del Programa de Manejo del área (Conanp, 2003), en donde se señaló la existencia de 116 especies pertenecientes a 42 familias. Posteriormente, los estudios de Barrientos-Villalobos (2000), López-Pérez et al. (2008, 2010, 2014), Juárez-Hernández et al. (2013), Zepeta-Vilchis et al. (2013) y Juárez-Hernández y Tapia-García (2018a, b), incrementaron el inventario íctico hasta registrar 150 especies. Además de estos inventarios, se llevaron a cabo estudios que exploraron la relación entre la fauna íctica y los componentes del sustrato (López-Pérez et al., 2013, Juárez-Hernández et al., 2013; Juárez-Hernández y Tapia-García, 2018a, b), así como la respuesta de la comunidad íctica ante perturbaciones naturales (López-Pérez et al., 2016). Aunque los listados taxonómicos alcanzaron a registrar 150 especies, la totalidad del inventario biológico parece estar lejos de alcanzarse debido a que constantemente se siguen añadiendo especies (López-Pérez et al., 2019; Zepeta-Vilchis et al., 2013), particularmente de naturaleza críptica y especies raras (i.e., singulares, dobles, únicas y duplicadas) (López-Pérez et al., 2019; Violle et al., 2017).
A partir de los índices de distintividad taxonómica promedio (AvTD) y su variación taxonómica (VarTD) descritos por Warwick y Clarke (1995), se estima la importancia de las diferencias taxonómicas entre especies utilizando información derivada de un árbol taxonómico jerárquico, como una clasificación de Linneo o una matriz de distancias filogenéticas. Estos índices son utilizados con datos de presencia/ausencia; además, no son susceptibles a la variación en el tamaño de la muestra (Warwick y Clarke, 1995, 1998).
La diversidad-β, se define como la disimilitud entre la diversidad gamma (regional) y alfa (local), por lo tanto, es posible evaluar si las comunidades comparten especies similares (Villéger et al., 2012; Whittaker, 1972). La diversidad-β cambia con el tiempo y el espacio, puede ser influenciada por cambios en el rango de especies y extinciones locales (Magurran et al., 2015). Las medidas ecológicas de disimilitud más utilizadas incluyen las descritas por Jaccard (1900) y Sørensen (1948). Baselga (2010) propone separar el índice de Sørensen en 2 componentes: el recambio de especies, que se mide por el índice de disimilitud de Simpson (βsim) y el componente de anidamiento (βnes).
Por lo anterior expuesto, los objetivos del presente trabajo son: actualizar el listado íctico del PNH a partir del análisis crítico de los listados de especies previamente publicados (1998-2021) y trabajo de campo, y evaluar la diversidad taxonómica y el recambio faunístico del PNH respecto a otras ANP del Pacífico central mexicano. Hipotetizamos que debido a que la composición de especies/riqueza íctica del PNH ha sido estimada únicamente mediante CV, habrá una menor riqueza de especies respecto a ANP de la parte central del Pacífico mexicano, donde diversas técnicas de muestreo han sido empleadas. Asimismo, hipotetizamos que la distintividad taxonómica y la diversidad beta serán mayores en el PNH respecto a otras ANP del Pacífico central mexicano como resultado de un gradiente latitudinal.
Materiales y métodos
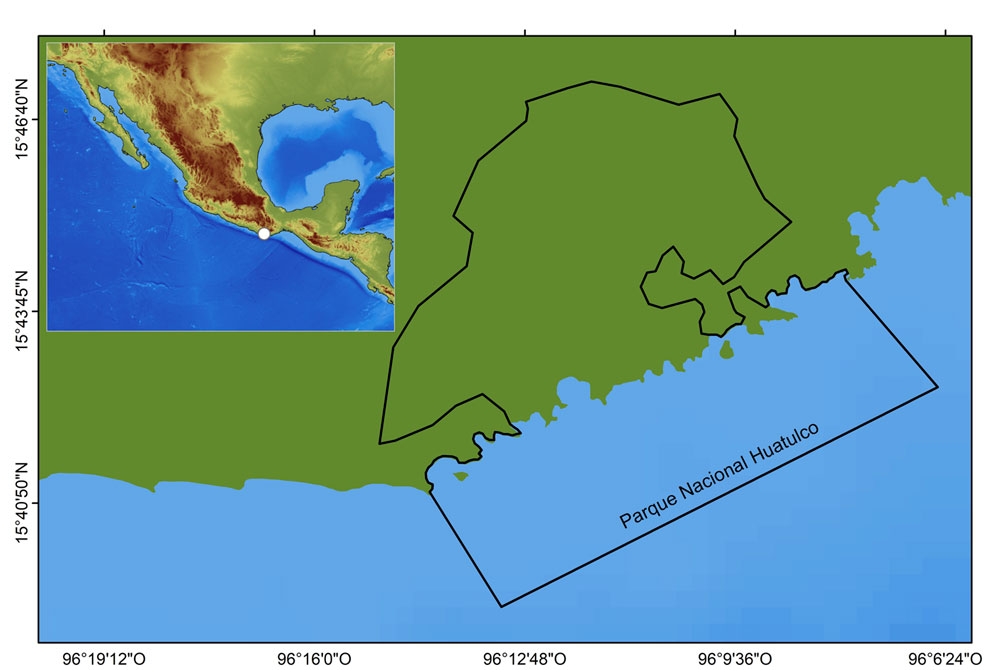
El PNH se localiza en la parte central de la costa de Oaxaca y cuenta con una superficie de 118.90 km2, de las cuales 63.74 km2 son terrestres y 55.16 km2 marinas (Conanp, 2003) (fig. 1). La parte marina se caracteriza por presentar una temperatura superficial típica de mares tropicales (SST > 28 °C), con pequeñas oscilaciones tér-
micas anuales (< 2 °C), una termoclina estable somera (20-40 m) y una salinidad promedio de 34 ups (Fiedler y Talley, 2006). El área se encuentra localizada cerca del golfo de Tehuantepec, lo que provee de aguas productivas durante la temporada de octubre-abril y un máximo desarrollo entre los meses de noviembre-enero, que tiene efectos importantes en el medio marino mediante el incremento de la productividad primaria (Lluch-Cota, 1997).
Se generó una matriz de datos de presencia/ausencia de peces arrecifales a partir de 2 fuentes de información: (i) revisión exhaustiva de literatura generada durante 1998-2021 (artículos científicos y capítulos de libro) que incluye total o parcialmente registros ictiológicos del PNH; (ii) información generada mediante censos visuales realizados de 2015 a 2019 dentro del PNH, obtenidos mediante transectos en banda (20*4 m) y buceo errante (López-Pérez et al., 2014). La validez de los nombres fue corroborada en Fricke, Eschmeyer y Fong (2021), mientras que el listado taxonómico se realizó considerando la clasificación de Fricke, Eschmeyer y Van der Laan (2021).
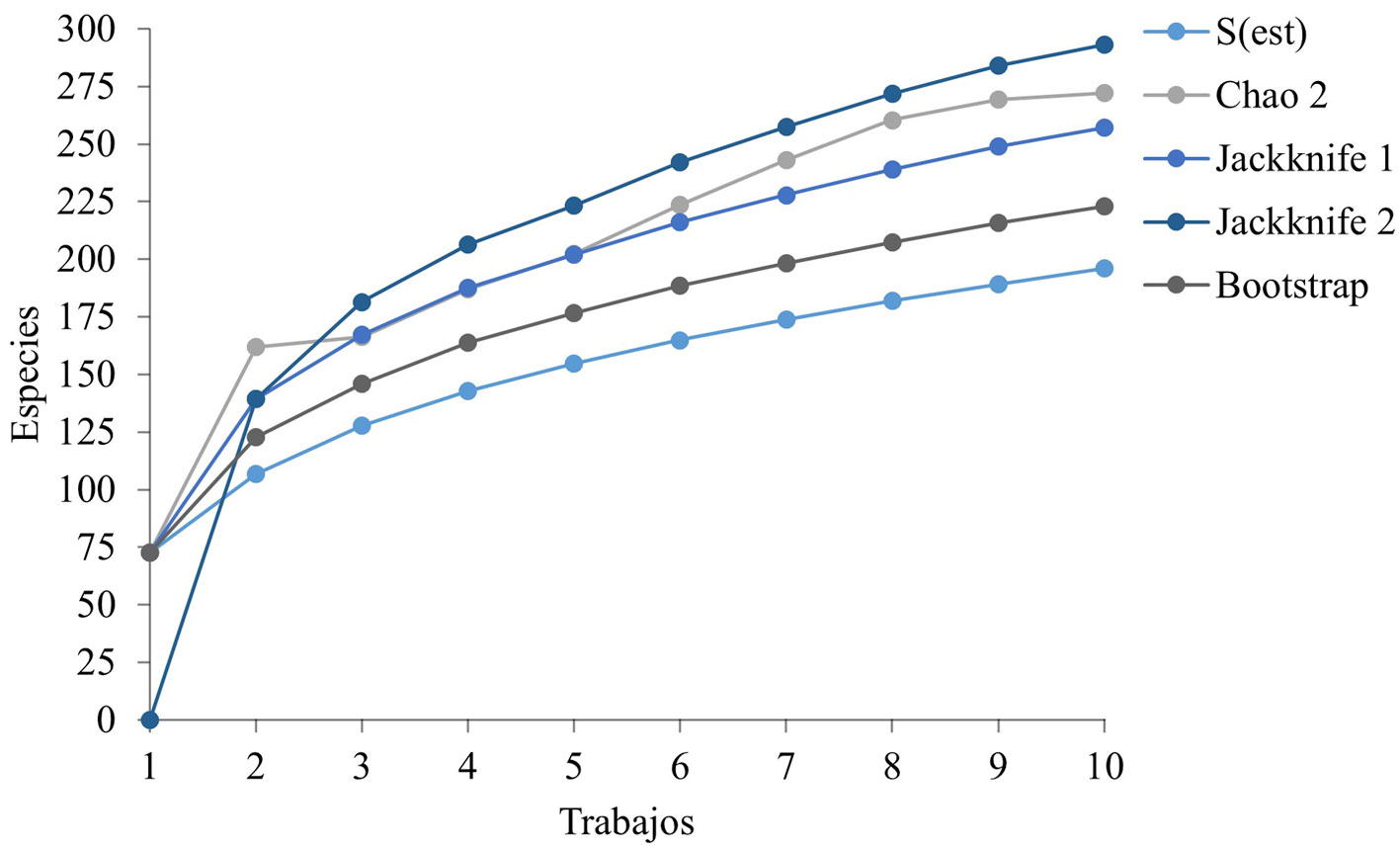
A partir de la matriz de incidencia, se construyó una curva de acumulación de especies (CAE), mientras que el número esperado de especies se estimó mediante métodos no paramétricos de Chao 2, jackknife 1, jackknife 2 y boostrap (Chao y Yang, 1993), lo que permitió calcular el esfuerzo de muestreo empleado y la totalidad del inventario biológico obtenido durante un intervalo de tiempo/esfuerzo (Jiménez-Valverde y Hortal, 2003; Magurran et al., 2004). Se determinó el número de especies raras por su frecuencia de ocurrencia, considerando especies únicas (especies registradas una vez durante todo el estudio) y especies duplicadas (especies registradas 2 veces) (Chao, 1984). Las curvas fueron calculadas mediante 10,000 permutaciones sin reemplazo, usando el programa EstimateS (Colwell, 2013).
Para comparar el ensamblaje del PNH con otras ANP de la región, se analizó la información íctica de las áreas naturales protegidas Santuario de Bahía Chamela (SBCH), Parque Nacional de Islas Marietas (PNIM), Reserva de la Biosfera Islas Marías (RBIM) y Parque Nacional Isla Isabel (PNIIS), todas ellas ubicadas al norte del PNH. Se estimó la distintividad taxonómica promedio (AvTD) y su variación taxonómica (VarTD) mediante una escala lineal simple, en donde el árbol taxonómico estuvo conformado por 5 niveles taxonómicos (especie, género, familia, orden y clase) basados en pasos de igual longitud y peso (Grenié et al., 2017) con intervalos de confianza de 95% (Clarke y Warwick, 1998, 2001a). Para evaluar la similitud ictiofaunística, se realizó un análisis de conglomerados empleando el método del promedio aritmético no ponderado (UPGMA) y un escalamiento multidimensional no métrico (NMDS) a partir de una matriz de similitud de Bray-Curtis. La magnitud del reemplazo de las especies de peces de arrecife entre las 5 ANP se evaluó mediante la partición de la diversidad-β, basados en la disimilitud del índice de Sørensen (βSOR global y βsor para los análisis por pares); este coeficiente de semejanza se descompuso en sus componentes: recambio espacial de especies (βSIM global y βsim para los análisis pareados) y en la diferencia resultante de la anidación de especies (βSNE global y βsne para los análisis pareados) en donde βSOR = βSIM + βSNE y βsor = βsim + βsne (Baselga y Orme, 2012).
Los análisis de distintividad, variación taxonómica, clúster y NMDS se calcularon en Primer + Permanova V6.0 (Clarke y Warwick, 2001b). La partición de la diversidad-β se realizó utilizando el paquete “betapart” en R Studio (Baselga y Orme, 2012).
Resultados
La lista actualizada de peces del Parque Nacional Huatulco está constituida por 196 especies pertenecientes a 141 géneros, 63 familias y 2 clases (Actinopterygii 181 especies y Elasmobranchii 15 especies) (tabla 1). La clase Actinopterygii está compuesta por 54 familias y 16 órdenes, las familias mejor representadas fueron: Carangidae (19 especies), Serranidae (15), Haemulidae (10), Labridae (9), Lutjanidae (9) y Pomacentridae (8). La clase Elasmobranchii está constituida por 9 familias, de las cuales, Urotrygonidae (4 especies), Dasyatidae (2), Narcinidae (2) y Rhinobatidae (2) fueron las mejor representadas.
Los modelos no paramétricos sugieren que, en promedio, la riqueza esperada en el PNH podría alcanzar 261 especies. El menor número de especies fue estimado por Boostrap (223 especies), mientras que el mayor número de especies fue estimado por jackknife 2 (293 especies) (fig. 2), por lo que faltarían añadir entre 26 y 97 especies al inventario biológico actual (196 especies). La completitud del inventario aquí reportado oscila entre 67% y 88% dependiendo del estimador considerado.
En el listado ictiofaunístico incluido dentro del Programa de Manejo del Parque Nacional Huatulco, se detectaron 17 especies de peces identificadas erróneamente. De éstas, 9 nombres de especies son inválidas, 3 especies se distribuyen en el Atlántico (Caranx hipos, Eucinostomus melanopterus e Hyporhamphus unifasciatus), 1 en América Central (Achirus zebrinus), 1 especie en el Pacífico norte (Citharichthys stigmaeus) y 3 especies pertenecen al orden Anura o ranas. En los trabajos publicados posteriormente al Programa de Manejo del PNH, se han incluido 9 especies cuyas distribuciones están restringidas al golfo de California, América Central o América del Sur, pero que no fueron registradas en los censos visuales del 2015-2019 (tabla 2). Por otra parte, se incluyeron 7 especies (Anchovia macrolepidota, Antennatus sanguineus, Citharichthys gilberti, Chloroscombrus orqueta, Oligoplites saurus, Kuhlia mugil, Ctenochaetus marginatus) que fueron consideradas como dudosas y aceptadas temporalmente dentro del listado (tabla 1).
Tabla 1
Tabla 2.
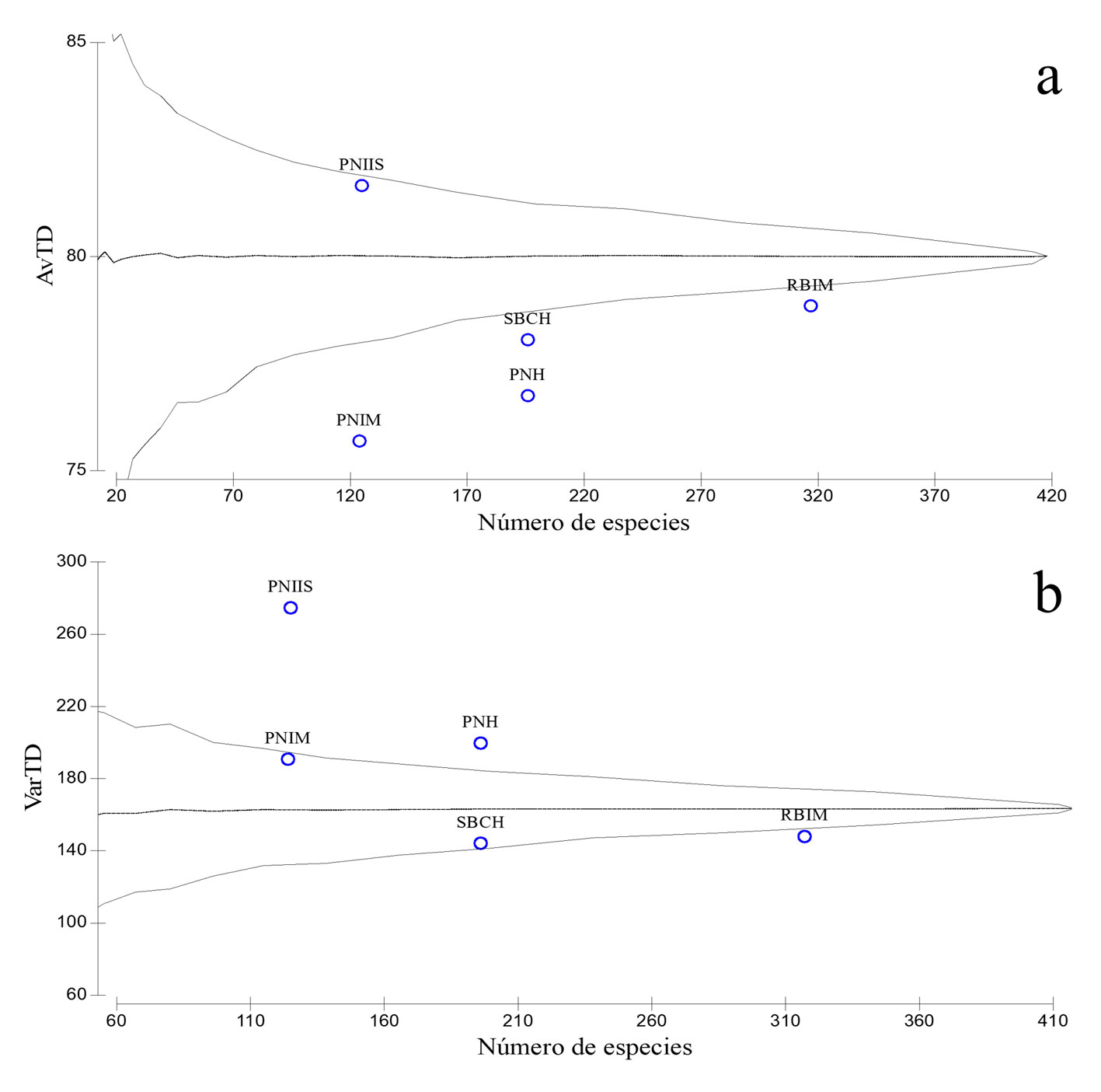
La riqueza de especies en el PNH (196 especies) es igual a la registrada en el SBCH (196 especies), mayor que en el PNIM (124 especies), el PNIIS (125) y menor que en la RBIM (317 especies). El análisis de distintividad taxonómica muestra que la mayor parte de las localidades se ubican por afuera del intervalo de confianza (95%) esperado para la región (fig. 3a). La distintividad taxonómica promedio del PNH (AvTD = 77) es baja y parecida a la estimada para la RBIM (AvTD = 79), el SBCH (AvTD = 78) y el PNIM (AvTD = 76); mientras que el valor más alto correspondió al PNIIS (AvTD = 82). En contraste, la variación de la diversidad taxonómica en el PNH es la segunda más alta (VarTD = 198) únicamente superada por la estimada en el PNIIS (VarTD = 276). La VarTD más pobre, fue obtenida para la RBIM, a pesar de su elevada riqueza de especies (fig. 3b).
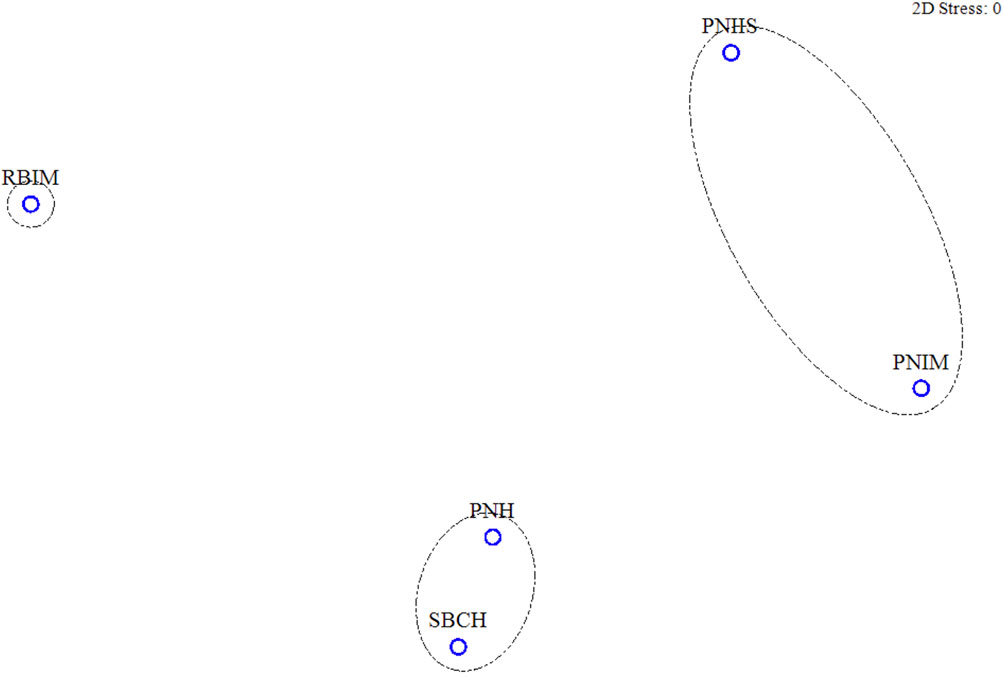
El NMDS muestra la formación de 2 conglomerados con un nivel de stress de < 0.001 y revela un gradiente de riqueza en donde la RBIM presenta la mayor riqueza, seguida del conglomerado formado por PNH y SBCH con una similitud de 70.64, y un tercer conglomerado conformado por el PNIM y el PNIIS con una similitud de 68.99 (fig. 4).
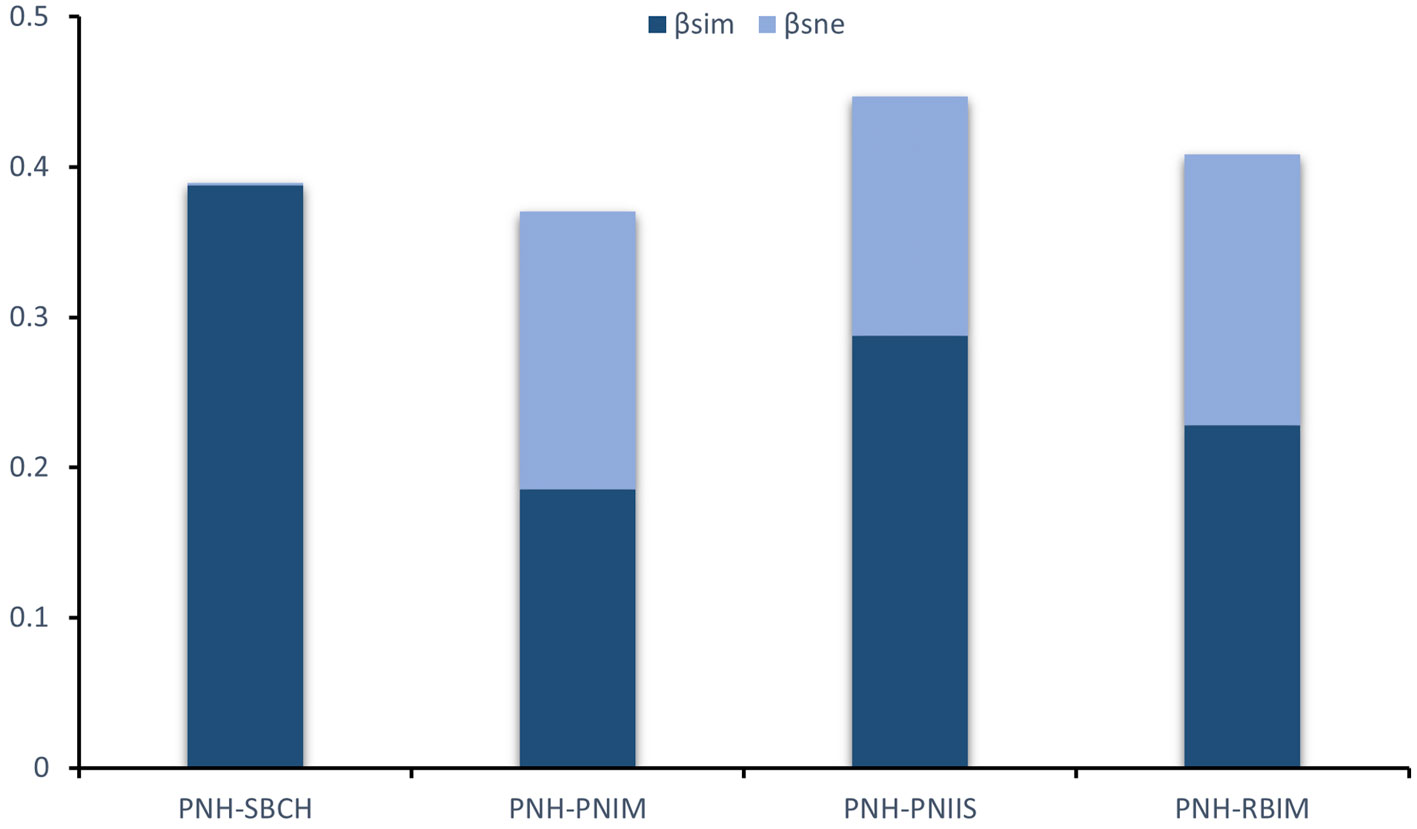
La partición global de la diversidad-β entre las ANP, mostró que el reemplazo de especies es mayor (βSIM = 0.41) al anidamiento de especies (βSNE = 0.20). Las comparaciones pareadas de la partición muestran que existe un alto reemplazo de especies entre PNH-SBCH (βsim = 0.39) y PNH-PNIIS (βsim = 0.29), y en menor grado entre PNH-RBIM (βsim = 0.23), así como entre PNH-PNIM (βsim = 0.19) (fig. 5).
Discusión
El elenco ictiofaunístico del Parque Nacional Huatulco está constituido por 196 especies, las cuales aumentan en 46 especies de acuerdo con el último trabajo publicado y realizado por López-Pérez et al. (2014). Las adiciones de especies ocurrieron principalmente en las familias Carangidae (9 spp.), Serranidae (5 spp.), Haemulidae (4 spp.) y Lutjanidae (3 spp.), lo que representa un aumento de 31% respecto a resultados previos. No obstante, la CAE sugiere que solo se ha recopilado entre 67 y 88% de la riqueza de especies del PNH, por lo que faltan alrededor de 65 especies por añadir al inventario. De acuerdo con el análisis, las especies por incluir deben ser de naturaleza criptica (López-Pérez et al., 2014), las cuales se caracterizan por poseer < 5cm de longitud en la etapa adulta, vivir en cripsis entre grietas o galerías, o poseer una coloración similar al sustrato, y que usualmente se obtienen mediante métodos extractivos (Brandl et al., 2018), los cuales no han sido empleados en el PNH.
Si bien los peces criptobénticos carecen de valor comercial, su importancia radica en que constituyen hasta 50% de la biomasa y al menos 40% de la riqueza de peces de arrecife (Ackerman y Bellwood, 2000), pero han sido subestimados o no contabilizados. Durante la revisión, en el PNH se identificaron y contabilizaron 14 especies crípticas siguiendo el criterio de Brandl et al. (2018), los cuales pertenecen a 11 géneros y 6 familias representando solamente 7% del inventario total (196 especies; tabla 1). En comparación con otras ANP de la región, los porcentajes de especies crípticas son sensiblemente menores respecto a la RBIM (≈22%), el SBCH (≈15%), el PNIM (≈14%), aunque por arriba del PNIIS (≈6%). Alzate et al. (2014) mencionan que los censos visuales realizados en el Pacífico oriental tropical (POT) han subestimado entre 28 y 36% la riqueza de peces, principalmente de grupos crípticos tales como góbidos, blénidos, tripterígidos, entre otros. La reducción o miniaturización de las estructuras claves para la identificación de especies cripticas, no permiten realizar una identificación correcta mediante censos visuales, sumando la variedad en los patrones de coloración, comportamiento y ubicación en el hábitat, e incluso la falta de entrenamiento adecuado para identificar a las especies más comunes.
La revisión del listado íctico del Programa de Manejo del PNH evidenció errores tipográficos (9 especies). Respecto a los listados de especies previamente publicados, se detectaron 9 especies que no han sido registradas durante el último lustro mediante censos visuales. Dos elementos podrían explicar lo anterior, las especies no registradas recientemente forman parte de los taxones reconocidos como “especie turista” o especies que cambian su distribución geográfica ante eventos como “El Niño” o “La Niña”, o quizá se trata de identificaciones erróneas derivadas de la similitud en coloración con otras especies (material suplementario).
Los sesgos de los censos visuales y su impacto en la calidad de los inventarios biológicos han sido bien identificados y documentados (i.e., Bernard et al., 2013); algunos están relacionados intrínsecamente con el buzo monitor, con el tiempo de muestreo, con el área muestreada, o con variabilidad natural (Bernard et al., 2013; Figueroa-Pico et al., 2020; Ward-Paige et al., 2010). En conjunto, subestiman o sobreestiman la riqueza de especies y abundancia, así como la composición de especies (Alzate et al., 2014; Ward-Paige et al., 2010). El uso de técnicas integrativas en otras ANP del Pacífico mexicano, ha mejorado notablemente la calidad de los inventarios biológicos (i.e., Erisman et al., 2011; Galván-Villa et al., 2016; Palacios-Salgado et al., 2014), por lo que es recomendable su aplicación en futuros estudios ícticos del PNH para mejorar la calidad de los inventarios biológicos.
Los índices de distinción taxonómica promedio y su variación taxonómica promedio permiten entender gradientes de biodiversidad asociado a factores evolutivos y ecológicos (Pérez-Hernández, 2019), así como la diversidad funcional de los ecosistemas, lo que permite registrar cambios relevantes en las comunidades de peces (Ramos-Miranda et al., 2005). La fauna íctica del PNH posee una pobre distintividad taxonómica promedio (AvTD) respecto a la diversidad regional, lo que significa que, aunque el PNH tenga una riqueza moderadamente alta de especies (196 especies), la distribución de sus especies en las categorías taxonómicas superiores (divergencia filogenética) es similar al SBCH, e incluso muy cercano a la RBIM, a pesar de que esta última ANP tiene la riqueza de especies más alta. Lo contrario se observa en el PNIIS, en donde su riqueza específica es baja (125), mientras que su divergencia filogenética es elevada (fig. 3a). Por otra parte, la varianza de la distintividad taxonómica (VarTD) promedio del PNH es mayor comparado con el PNIM, el SBCH y la RBIM, lo que implica que la varianza en el reparto de sus especies en las categorías taxonómicas superiores es muy alta, por lo tanto, la distribución supraespecífica es más equitativa en los ensamblajes PNIIS y PNH (Clarke y Warwick, 2001a; Pérez-Hernández, 2019) (fig. 3b). En resumen, el PNH posee una riqueza de especies moderadas, respecto a otras ANP; sin embargo, posee una alta VarTD, lo que implica que posee un pool taxonómico y filogenético diverso, que ante los escenarios de cambio climático, masificación del turismo, pérdida de biodiversidad y degradación del hábitat, el PNH deberá implementar estrategias de conservación, áreas de aprovechamiento y áreas núcleo, consistentes con lo mostrado por la VarTD.
La partición de la diversidad beta muestra que el valor de reemplazo entre las ANP PNH-SBCH es mayor que el anidamiento, lo que sugiere que el ensamblaje del PNH es distinto al del SBCH en términos de composición de especies. De manera contraria, el PNH y las ANP: PNIM, PNIIS y RBIM, si bien mantienen un alto porcentaje de reemplazo de especies, existe también un considerable porcentaje de especies anidadas (fig. 5), lo que sugiere una importante conectividad genética entre las ANP: PNH y PNIM, PNIIS y RBIM. Por otra parte, si bien se mantienen valores considerablemente altos de anidamiento de especies, es importante notar el recambio faunístico (reemplazo) hacia las ANP ubicadas al norte del PNH. Este patrón refleja la dilución del pool regional de especies de las provincias (sensu Spalging et al., 2007) Pacífico Oriental Tropical (POT) hacia el norte, asociado con la aparición de especies de las ecorregiones marinas Corteziana, Trasición de Magdalena, incluyendo especies de islas oceánicas como Revillagidedo. Los patrones de partición de la biodiversidad entre ANP observados coinciden con los observados en otros grupos taxonómicos (Barrientos-Lujan et al., 2021; Valencia-Méndez et al., 2018), lo que podría estar relacionados con el patrón de corrientes en la región (Lequeux et al., 2018) y los procesos históricos que han moldeado la configuración de la fauna en el Pacífico mexicano, desde el cierre de la conexión entre el Pacífico y el Atlántico hace cerca de 3.2 millones de años durante el Plioceno (Coates y Obando, 1996).
En conclusión, los puntos más importantes que se resaltan en este trabajo son: 1) la revisión exhaustiva de literatura y monitoreo biológico mejoró la calidad del inventario ictiológico, y permitió eliminar errores nomenclaturales y clarificar registros, 2) la riqueza de especies del PNH es moderadamente alta si se compara con las ANP: SBCH, PNIM, PNIIS y RBIM, en donde además de CV se han empleado técnicas extractivas, 3) la VarTD de PNH es elevada, lo que indica que posee una mayor diversidad filogenética supraespecífica comparada con las ANP: SBCH, PNIM, PNIIS y RBIM, 4) el recambio faunístico de especies entre el PNH y las ANP al norte es alto, resultado natural de los endemismos y distribuciones restringidas de las especies de las distintas ecorregiones marinas del Pacífico mexicano, 5) se mantiene un considerable anidamiento de especies, resultado de la conectividad genética que mantiene el Pacífico mexicano. La información recopilada y analizada es de gran relevancia para guiar futuras líneas de investigación sobre la fauna íctica del PNH y que permitan robustecer los objetivos de conservación y manejo del Área Natural Protegida Parque Nacional Huatulco ante escenarios y efectos antrópicos, cada vez más persistentes y con profundos impactos negativos en la biodiversidad marina de las ANP de México.
Agradecimientos
A Buceo Huatulco por el apoyo en la logística y toma de datos. A la Conabio (HJ026), al Conacyt (236654) y al Departamento de Hidrobiología-UAM Iztapalapa, por el financiamiento otorgado a ALP. OVM recibió una beca de doctorado del Conacyt (401738) durante la realización del trabajo. Esta es una contribución del Programa de Maestría en Ecología Marina del CICESE, Laboratorio de Arrecifes y Biodiversidad (ARBIOLAB) y Laboratorio Marino virtual (Conacyt #1573). Agradecemos los comentarios de los revisores anónimos que ayudaron a mejorar el manuscrito.
Referencias
Ackerman, J. L. y Bellwood, D. R. (2000). Reef fish assemblages: a re-evaluation using enclosed rotenone stations. Marine Ecology Progress Series, 206, 227–237. https://doi.org/10.3354/meps206227
Alvarez-Filip, L., Reyes-Bonilla, H. y Calderon-Aguilera, L. E. (2006). Community structure of fishes in Cabo Pulmo reef, Gulf of California. Marine Ecology, 27, 253–262. https://doi.org/10.1111/j.1439-0485.2006.00108.x
Alzate, A., Zapata, F. A. y Giraldo, A. (2014). A comparison of visual and collection-based methods for assessing community structure of coral reef fishes in the Tropical Eastern Pacific. Revista de Biología Tropical, 62, 359–371. https://doi.org/10.15517/rbt.v62i0.16361
Barrientos-Luján, N. A., López-Pérez, A., Ríos-Jara, E., Ahumada-Sempoal, M. Á., Ortiz, M. y Rodríguez-Zaragoza, F. A. (2019). Ecological and functional diversity of gastropods associated with hermatypic corals of the Mexican tropical Pacific. Marine Biodiversity, 49, 193–205. https://doi.org/10.1007/s12526-017-0780-6
Barrientos-Luján, N. A., Rodríguez-Zaragoza, F. A. y López-Pérez, A. (2021). Richness, abundance and spatial heterogeneity of gastropods and bivalves in coral ecosystems across the Mexican Tropical Pacific. Journal of Molluscan Studies, 87, eyab004. https://doi.org/10.1093/mollus/eyab004
Barrientos-Villalobos, J. (2000). Diversidad y abundancia de la ictiofauna de los arrecifes coralinos del Parque Nacional Huatulco (Tesis). Universidad Autónoma de Puebla, Puebla, México.
Baselga, A. (2010). Partitioning the turnover and nestedness components of beta diversity. Global Ecology and Biogeography, 19, 134–143. https://doi.org/10.1111/j.1466-8238.2009.00490.x
Baselga, A. y Orme, C. D. L. (2012). Betapart: an R package for the study of beta diversity. Methods in Ecology and Evolution, 3, 808–812. https://doi.org/10.1111/j.2041-210x.2012.00224.x
Bates, A. E., Barrett, N. S., Stuart-Smith, R. D., Holbrook, N. J., Thompson, P. A. y Edgar, G. J. (2014). Resilience and signatures of tropicalization in protected reef fish communities. Nature Climate Change 4, 62–67. https://doi.org/10.1038/nclimate2062
Bernard, A. T. F., Götz, A., Kerwath, S. E. y Wilke, C. G. (2013). Observer bias and detection probability in underwater visual census of fish assemblages measured with independent double-observers. Journal of Experimental Marine Biology and Ecology, 443, 75–84. https://doi.org/10.1016/j.jembe.
2013.02.039
Brandl, S. J., Goatley, C. H. R., Bellwood, D. R. y Tornabene, L. (2018). The hidden half: ecology and evolution of cryptobenthic fishes on coral reefs. Biological Reviews, 93, 1846–1873. https://doi.org/10.1111/brv.12423
Brock, R. E. (1982). A critique of the visual census method for assessing coral reef fish populations. Bulletin of Marine Science, 32, 269–276.
Chao, A. (1984). Nonparametric estimation of the number of classes in a population. Scandinavian Journal of Statistics, 11, 265–270.
Chao, A. y Yang, M. C. K. (1993). Stopping rules and estimation for recapture debugging with unequal failure rates. Biometrika, 80, 193–201. https://doi.org/10.1093/biomet/80.1.193
Clarke, K. R. y Warwick, R. M. (1998). A taxonomic distinctness index and its statistical properties. Journal of Applied Ecology, 35, 523–531.
Clarke, K. R. y Warwick, R. M. (2001a). A further biodiversity index applicable to species lists: Variation in taxonomic distinctness. Marine Ecology Progress Series, 216, 265–278. https://doi.org/10.3354/meps216265
Clarke, K. R. y Warwick, R. M. (2001b). Change in marine communities: an approach to statistical analysis and interpretation, 2a edición. Plymouth, UK: Plymouth Marine Laboratory.
Coates, A. G. y Obando, J. A. (1996). The geologic evolution of the Central American isthmus. En J. B. C. Jackson, A. F. Budd y A. G. Coates (Eds.), Evolution and environment in tropical America (pp. 21–56). Chicago: The University of Chicago Press.
Colwell, R. K. (2013). Estimates: statistical estimation of species richness and shared species from samples. Version 9. User’s guide and application.
Conanp (Comisión Nacional de Áreas Naturales Protegidas) (2003). Programa de Manejo Parque Nacional Huatulco 53(9). México D.F.: Comisión Nacional de Áreas Naturales Protegidas.
Conanp (Comisión Nacional de Áreas Naturales Protegidas) (2007). Estrategia nacional para el desarrollo sustentable del turismo y la recreación en las Áreas Naturales Protegidas de México. México D.F.: Comisión Nacional de Áreas Naturales Protegidas.
Conanp (Comisión Nacional de Áreas Naturales Protegidas) (2021). Áreas Naturales Protegidas Decretadas. Gobierno de México. Recuperado el 26 de octubre, 2021 de: http://sig.conanp.gob.mx/website/pagsig/datos_anp.html
Erisman, B. E., Galland, G. R., Mascareñas, I., Moxley, J., Walker, H. J., Aburto-Oropeza, O. et al. (2011). List of coastal fishes of Islas Marías archipelago, Mexico, with comments on taxonomic composition, biogeography, and abundance. Zootaxa, 2985, 26. https://doi.org/10.11646/zootaxa.2985.1.2
Fiedler, P. C. y Talley, L. D. (2006). Hydrography of the eastern tropical Pacific: a review. Progress in Oceanography, 69, 143–180. https://doi.org/10.1016/j.pocean.2006.03.008
Figueroa-Pico, J., Carpio, A. J. y Tortosa, F. S. (2020). Turbidity: A key factor in the estimation of fish species richness and abundance in the rocky reefs of Ecuador. Ecological Indicators, 111, 106021. https://doi.org/10.1016/j.ecolind.
2019.106021
Fricke, R., Eschmeyer, W. N. y Fong, J. D. (2021). Eschmeyer’s catalog of fishes: Genera/Species by Family/Subfamily. Recuperado el 11 de noviembre, 2021 de: http://researcharchive.calacademy.org/research/ichthyology/catalog/SpeciesByFamily.asp [Recalculated with each new version; based on current literature, this provides counts of available genus and species names, valid genera and species, and genera and species described in the last ten years by family/subfamily].
Fricke, R., Eschmeyer, W. N. y Van der Laan, R. (Eds.). (2021). Eschmeyer’s catalog of fishes: Genera, Species, References. Recuperado el 11 de noviembre, 2021 de: http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp
Galván-Villa, C. M. (2010). Variación espacial de ensamblajes de peces y su importancia en la conservación de áreas marinas protegidas del Pacífico central mexicano (Tesis de maestría). Universidad de Guadalajara. Jalisco, México.
Galván-Villa, C., Ríos-Jara, E., Bastida-Izaguirre, D., Hastings, P. A. y Balart, E. F. (2016). Annotated checklist of marine fishes from the Sanctuary of Bahía Chamela, Mexico, with the occurrence and biogeographic data. Zookeys, 554, 139–157. https://doi.org/10.3897/zookeys.554.6106
Grenié, M., Denelle, P., Tucker, C. M., Munoz, F. y Violle, C. (2017). funrar: An R package to characterize functional rarity. Diversity and Distributions, 23, 1365–1371. https://doi.org/10.1111/ddi.12629
Jaccard, P. (1900). Contribution au problème de l’immigration post-glaciare de la flore alpine. Bulletin de la Société Vaudoise des Sciences Naturelles, 36, 87–130.
Jiménez-Valverde, A. y Hortal, J. (2003). Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología, 8, 151–161.
Juárez-Hernández, L. G. y Tapia-García, M. (2018a). Cambios en la comunidad de peces por efecto del desarrollo costero en el Parque Nacional Huatulco (México). Revista de Biología Tropical, 66, 1569–1579. https://doi.org/10.15517/rbt.v66i4.31908
Juárez-Hernández, L. G. y Tapia-García, M. (2018b). Listado ictiofaunístico de las bahías del Parque Nacional Huatulco, Oaxaca, México. Arxius de Miscel· lània Zoològica, 1, 96–111. https://doi.org/10.32800/amz.2018.16.0096
Juárez-Hernández, L. G., Tapia-García, M. y Luna-Monsivais, B. (2013). Estructura de las comunidades de peces de las bahías Maguey y Cacaluta, Huatulco, Oaxaca. Revista Mexicana de Biodiversidad, 84, 1243–1257. https://doi.org/10.7550/rmb.28910
Lequeux, B. D., Ahumada-Sempoal, M. A., López-Pérez, A. y Reyes-Hernández, C. (2018). Coral connectivity between equatorial eastern Pacific marine protected areas: A biophysical modeling approach. Plos One, 13, e0202995. https://doi.org/10.1371/journal.pone.0202995
López-Pérez, R. A., Benítez-Villalobos, F., López-Ortiz, A. M., López Pérez-Maldonado, I., Granja-Fernández, M. R. y Domínguez y Gómez, M. T. (2008). La comunidad arrecifal en isla Cacaluta, Oaxaca. En J. M. Domínguez-Licona (Ed.), Diagnóstico de los recursos naturales de la bahía y micro-cuenca de Cacaluta (pp. 243–256). Santa María Huatulco, Oaxaca: Universidad del Mar.
López-Pérez, A., Granja-Fernández, R., Aparicio-Cid, C., Zepeta-Vilchis, R. C., Torres-Huerta, A. M., Benítez-Villalobos, F. et al. (2014). Corales pétreos, equinodermos y peces asociados a comunidades y arrecifes coralinos del Parque Nacional Huatulco, Pacífico sur mexicano. Revista Mexicana de Biodiversidad, 85, 1145–1159. https://doi.org/10.7550/rmb.43848
López-Pérez, A., Granja-Fernández, R., Valencia-Méndez, O., Aparicio-Cid, C., Torres-Huerta, A. M., Barrientos-Luján, N. A. et al. (2019). Biodiversity associated with Southern Mexican Pacific Coral Systems. En A. L. Ibáñez (Ed.), Mexican aquatic environments (pp. 119–144). Ciudad de México: Springer. https://doi.org/10.1007/978-3-030-11126-7_5
López-Pérez, R. A. y Hernández-Ballesteros, L. M. (2004). Coral community structure and dynamics in the Huatulco area, western Mexico. Bulletin of Marine Science, 75, 453–472.
López-Pérez, R. A., López-Pérez Maldonado, I., López-Ortiz, A. M., Barranco-Servín, L. M., Barrientos-Villalobos, J. y Leyte-Morales, G. E. (2010). Reef fishes of the Mazunte-Bahías de Huatulco reef track, Oaxaca, Mexican Pacific. Zootaxa, 2422, 53–62. https://doi.org/10.11646/zootaxa.2422.1.5
Lluch-Cota, S. E., Álvarez-Borrego, S., Ángel, S. D., Eduardo, M., Müller-Karger, F. E. y Hernández-Vázquez, S. (1997). The Gulf of Tehuantepec and adjacent areas: spatial and temporal variation of satellite-derived photosynthetic pigments.Ciencias Marinas, 23, 329–340. https://doi.org/10.7773/cm.v23i3.809
Magurran, A. E. (2004). Measuring biological diversity. Oxford: Blackwell Publishing.
Magurran, A. E., Dornelas, M., Moyes, F., Gotelli, N. J. y McGill, B. (2015). Rapid biotic homogenization of marine fish assemblages. Nature Communications, 6, 8405. https://doi.org/10.1038/ncomms9405
Palacios-Salgado, D. S., Ramírez-Valdez, A., Rojas-Herrera, A. A., Amores, J. G. y Melo-García, M. A. (2014). Marine fishes of Acapulco, Mexico (Eastern Pacific Ocean). Marine Biodiversity, 44, 471–490. https://doi.org/10.1007/s12526-014-0209-4
Pérez-Hernández, C. X. (2019). Distintividad taxonómica: evaluación de la diversidad en la estructura taxonómica en los ensambles. En C. E. Moreno (Ed.), La biodiversidad en un mundo cambiante: fundamentos teóricos y metodológicos para su estudio (pp. 285–306). Universidad Autónoma del Estado de Hidalgo, Ciudad de México: Libermex.
Ramírez-Gutiérrez, M., Tapia-García, M., Ramos-Santiago, E. y Ulloa, R. (2007). Fish community structure in San Agustín Bay, Huatulco, México. Revista Chilena de Historia Natural, 80, 419–430. https://doi.org/10.4067/s0716-078×2007000400003
Ramírez-Ortiz, G., Reyes-Bonilla, H., Balart, E. F, Olivier, D., Huato-Soberanis, L., Micheli, F. et al. (2020). Reduced fish diversity despite increased fish biomass in a Gulf of California Marine Protected Area. PeerJ, 8, e8885. https://doi.org/10.7717/peerj.8885
Ramos-Miranda, J., Mouillot, D., Hernández, D., López, A., Chi, T. y Pérez, L. (2005). Changes in four complementary facets of fish diversity in a tropical coastal lagoon after 18 years: a functional interpretation. Marine Ecology Progress Series, 304, 1–13. https://doi.org/10.3354/meps304001
Robertson, D. R. y Allen, G. R. (2015). Peces costeros del Pacífico Oriental Tropical: sistema de información en línea. Peces: Pacifico Oriental, una guía para peces costeros del Pacifico Oriental Tropical. Instituto Smithsonian de Investigaciones Tropicales, Balboa, República de Panamá. Recuperado el 26 de noviembre, 2021 de: http://biogeodb.stri.si.edu/sftep/es/pages
RStudio Team (2020). RStudio: integrated development for R. RStudio, PBC, Boston, MA. Recuperado el 13 de octubre, 2021 de: URL http://www.rstudio.com/
Sørensen, T. (1948). A method of establishing groups of equal amplitude in plant sociology based on similarity of species content and its application in analysis of the vegetation on Danish commons. Kongelige Danske Videnskabernes Selskab, Biologiske Skrifter, 5, 1–34.
Spalding, M. D., Fox, H. E., Allen, G. R., Davidson, N., Ferdaña, Z. A., Finlayson, M. A. X. et al. (2007). Marine ecoregions of the world: a bioregionalization of coastal and shelf areas. Bioscience, 57, 573–583. https://doi.org/10.1641/B570707
Valencia-Méndez, O., Rodríguez-Zaragoza, F. A., Calderón-Aguilera, L. E., Domínguez-Domínguez, O. y López-Pérez, A. (2018). Gamma-diversity partitioning of gobiid fishes (Teleostei: Gobiidae) ensemble along of Eastern Tropical Pacific: biological inventory, latitudinal variation and species turnover. Plos One, 13, e0202863. https://doi.org/10.1371/journal.pone.0202863
Villarreal-Cavazos, A., Reyes-Bonilla, H., Bermúdez-Almada, B. y Arizpe-Covarrubias, O. (2000). Fishes of the Cabo Pulmo Reef, Gulf of California, Mexico: systematic list and aspects of abundance and biogeography. Revista de Biología Tropical, 48, 413–424. https://doi.org/10.15517/RBT.V48I2-3.18757
Villéger, S., Miranda, J. R., Hernández, D. F. y Mouillot, D. (2012). Low functional β-diversity despite high taxonomic β-diversity among tropical estuarine fish communities. Plos One, 7, e40679. https://doi.org/doi:10.1371/journal.pone.0040679
Violle, C., Thuiller, W., Mouquet, N., Munoz, F., Kraft, N. J. B., Cadotte, M. W. et al. (2017). Functional rarity: the ecology of outliers. Trends in Ecology & Evolution, 32, 356–367. https://doi.org/10.1016/j.tree.2017.02.002
Ward-Paige, C., Flemming, J. M. y Lotze, H. K. (2010). Overestimating fish counts by non-instantaneous visual censuses: consequences for population and community descriptions. Plos One, 5, e11722. https://doi.org/10.1371/journal.pone.0011722
Warwick, R. M. y Clarke, K. R. (1995). New biodiversity measures reveal a decrease in taxonomic distinctness with increasing stress. Marine Ecology Progress Series, 129, 301–305. https://doi.org/10.3354/meps129301
Whittaker, R. H. (1972). Evolution and measurement of species diversity. Taxon, 25, 213–251. https://doi.org/10.2307/1218190
Wolfe, K., Kenyon, T. M. y Mumby, P. J. (2021). The biology and ecology of coral rubble and implications for the future of coral reefs. Coral Reefs, 40, 1769–1806. https://doi.org/10.1007/s00338-021-02185-9
Zepeta-Vilchis, R. C., Ayala-Bocos, A., Valencia-Méndez, O. y López-Pérez, A. (2013). First record and range extension of the jawfish, Opistognathus panamaensis (Perciformes: Opistognathidae) from western Mexico. Marine Biodiversity Records, 6, E132. https://doi.org/10.1017/s1755267213001139